摘要
背景
水杨酸(SA)是诱导水稻抵抗病原菌侵袭的重要信号分子。蛋白质磷酸化在植物防御反应中起着重要的调节作用,而水稻对sa介导的防御反应的整体磷蛋白组变化尚未见报道。在本研究中,利用二维凝胶电泳(2-DE)和质谱(MS)分析对SA处理后的两个近等基因水稻品种进行了比较蛋白质组分析。
结果
SA处理后差异表达37个磷蛋白斑点,其中29个经MALDI-TOF/TOF MS鉴定,属于9个功能类。参与光合作用的磷蛋白、抗氧化酶、分子伴侣蛋白在两个品种中表达相似,说明SA可能缓解植物光合作用下降,调节抗氧化防御活性,从而改善两个品种的基础抗性反应。同时,与防御、碳水化合物代谢、蛋白质合成和降解相关的磷酸化蛋白表达存在差异,提示SA介导的磷酸化调节可能协调了两个品种复杂的细胞活动。此外,通过NanoLC-MS/MS验证了4个磷酸化蛋白的磷酸化位点,并通过活性测定验证了3种酶(肉桂酰辅酶a还原酶、磷酸甘油酸mutase和抗坏血酸过氧化物酶)的磷酸化调节作用。
结论
我们的研究表明SA介导的磷酸化调节可能是两个品种抗性反应不同的原因之一。据我们所知,这是第一个测量水稻对SA响应的磷蛋白组学变化的报道,为SA诱导水稻防御的分子机制提供了新的认识。
背景
大米(栽培稻L.)是全球一种重要的经济谷物作物,为全球50%以上的人口提供食物[1].子囊菌真菌Magnaporthe oryzae引起稻瘟病,这是水稻生产中最具破坏性的真菌疾病之一,从而对世界粮食安全构成巨大威胁[2].迄今为止,该病的防治主要依靠杀菌剂的使用和抗病品种的选育。然而,杀菌剂可能不能满足环境和人类健康法规的要求,抗性品种可以通过快速产生/进化的新品系来克服m . oryzae[3.,4].作为一种重要的信号分子,水杨酸(SA)可以诱导植物对多种真菌、病毒和细菌病原的抗性[5].sa介导的植物防御反应积极参与PTI (pamp触发免疫)和ETI(效应者触发免疫)[6].在之前的研究中,我们证实SA可以通过m . oryzae种族佐13在CO39(易感品种)和携带抗性基因的近等基因系C101LAC中Pi-1反对m . oryzae种族佐13因此代表了一个抗性品种[7].蛋白质组学分析进一步表明,SA协调多种细胞活动,促进两个水稻品种的防御反应和恢复。然而,sa诱导的水稻防御反应的分子机制还有待进一步阐明m . oryzae.
磷酸化是最重要的翻译后蛋白修饰(PTMs)之一,调节多种生物的细胞功能,包括细胞信号、代谢、应激反应和防御反应[8].磷蛋白质组学可以捕捉到蛋白质磷酸化的动态和特异性,从而增强我们对基本原理和复杂生物过程的理解[9].近年来,大量新出现的证据表明,蛋白质磷酸化可以调节外源激素和生物胁迫引发的植物应激反应[10,11,12,13].利用传统的生物化学方法也表明,蛋白质磷酸化参与了sa诱导的植物抗性的激活[14,15].据我们所知,蛋白质磷酸化事件和sa诱导的水稻抗性之间的这种联系的一般范围还没有研究过。
本研究采用二维凝胶电泳(2DE)、Pro-Q金刚石磷蛋白染色和MALDI-TOF/TOF质谱联用技术对水稻的sa诱导机制进行了比较分析。共发现37个sa响应的磷蛋白点,其中29个被鉴定。对抗性和易感水稻品种中功能相似或不同的磷蛋白及其表达模式进行了讨论。研究结果为水稻在SA处理后不同时间点的动态磷蛋白组提供了新的认识,拓宽了对SA介导的水稻抗性的认识m . oryzae通过调节蛋白质磷酸化来感染。
结果
水稻叶片中moac富集的推定磷蛋白的特异性分析
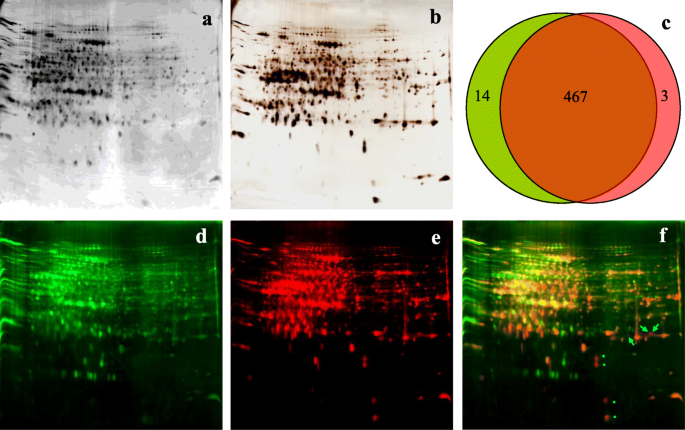
从8 mg总蛋白中富集了490±15 μg推定的磷蛋白。为了测试MOAC对磷蛋白的特异性,我们用2DE分离MOAC富集的假设的磷蛋白,用Pro-Q Diamond对磷蛋白进行序列染色,用银染色对总蛋白进行染色(图5)。1a, b).在Pro-Q金刚石染色凝胶上检测到481±9个蛋白点,在顺序银染色凝胶上检测到469±12个蛋白点;在这些斑点中,有466个是两种染色方法所共有的。1c).为了确定moac富集的磷蛋白的特异性,使用PDQuest软件将序列染色图像重叠,并用不同颜色可视化蛋白斑点(图1)。1d, e, f)。叠加图像显示,大部分蛋白质斑点(超过99%)呈黄色,说明这些蛋白质为磷蛋白;只有3个蛋白点出现在红色区域,表明它们是非磷蛋白(图。1f).结果表明MOAC对检测水稻叶片磷蛋白具有足够的选择性。
SA处理对水稻叶片磷蛋白质组的影响
为了研究SA诱导的磷蛋白谱的变化,我们在SA处理C101LAC和CO39后12 h和24 h进行了基于2de的磷蛋白组学分析。在我们之前的工作中,我们进行了sa诱导的水稻抗性m . oryzae在0.01 mM至1 mM的不同浓度SA中[7].结果表明,SA诱导水稻稻瘟病抗性的最佳浓度为0.1 mM。因此,本研究采用0.1 mM SA。每个处理至少进行三次独立的2DE分析,具有较高的可重复性。8个有代表性的凝胶和其他复制凝胶在附加文件中显示1:分别为图S1和图S21).在所有三个重复中,以1.5以上的倍数变化作为阈值来确定sa响应的磷蛋白。此外,差异表达模式在所有三个重复中都表现出相似,我们手动检查了所有斑点,以确保对差异调节的磷蛋白的信心。从两个品种中共获得了37个sa响应型磷蛋白1:图S1)。每个品种在CO39和C101LAC中分别检测到30和28个sa响应蛋白斑点;其中21个在这两个品种中常见。2DE凝胶上sa响应的磷蛋白的特写视图显示在(附加文件1:图S3)。sa响应的磷蛋白的相对强度显示在(附加文件1:图S4)。我们得出结论,SA处理导致这些蛋白斑点发生了可重复的和显著的变化,我们可以进一步研究。
sa反应磷酸化蛋白的MALDI-TOF/TOF鉴定
从2DE凝胶中分离出37个sa响应的磷蛋白斑点,并进一步用MALDI-TOF/TOF ms进行鉴定1),其余8个磷蛋白点(2、10、19、22、23、26、32和35)在数据库中没有很好的匹配。蛋白斑点11的光谱作为分析的一个例子1:图S5)。一般来说,2DE凝胶中的一个蛋白点代表一个独特的蛋白质。然而,我们注意到在同一凝胶的多个位置发现了三个磷蛋白(见表1,附加文件1:图S1)。例如,3个磷酸蛋白点(11、12和13)被鉴定为可能的谷氨酰内肽酶,2个(17和18)为甘油醛-3-磷酸脱氢酶,2个(24和25)为1,4-葡聚糖磷酸化酶。与我们的结果一致的是,有报道称,蛋白质异构体以斑点链的形式迁移,很可能是由于翻译后修饰[16].具有多重磷酸化状态的蛋白质也可能导致多个点分子量相近但p值不同的电泳模式我[17].
基于UniProtKB数据库中的生物注释(www.uniprot.org),在功能上将29个sa响应磷酸化蛋白分为9组:光合作用、防御、抗氧化酶、蛋白质合成和降解、分子伴侣、氨基酸代谢、碳水化合物代谢、能量代谢和其他代谢(附加文件)1:图S6)。其中,参与碳水化合物代谢、蛋白质合成和降解的磷蛋白最为丰富,分别占鉴定磷蛋白的24.14%(7/29)。
磷酸化位点鉴定
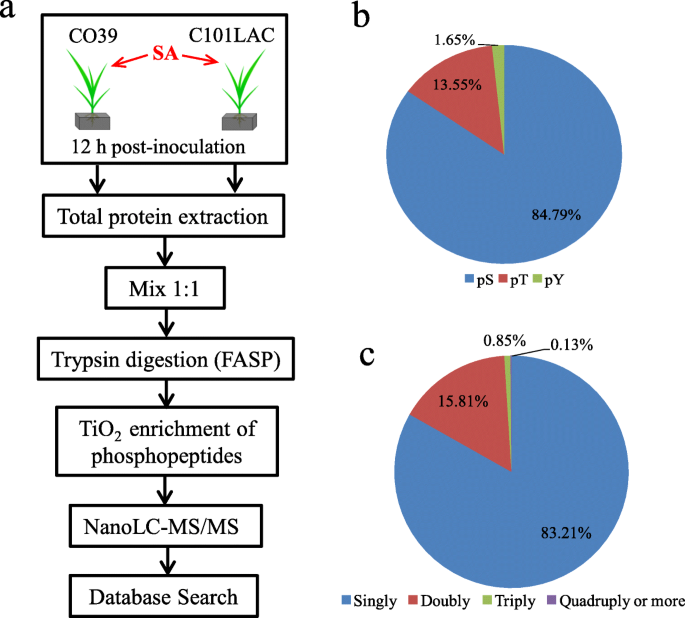
接下来,我们尝试通过NanoLC-MS/MS分析来确定总蛋白的磷酸化模式,流程如图所示。2a.总共鉴定出1815个磷酸位点,来自1537个磷酸肽2:表S1)对839个磷蛋白(附加文件3.:表S2)。在这1815个磷酸化残基中,有1539个磷酸丝氨酸(pS)、246个磷酸苏氨酸(pT)和30个磷酸酪氨酸(pY),分别占所有磷酸化残基的84.79、13.55和1.65%(图1)。2b).我们注意到257个磷酸肽被多重磷酸化,1279个磷酸肽被单磷酸化(图5)。2c).然后在NanoLC-MS/MS分析数据中扫描29个识别出的sa响应磷酸化蛋白。4个确定的sa响应磷酸化蛋白的磷酸化位点得到了验证4表S3)。具有代表性的磷酸化肽(ELLS*YEYDGDEVPIVAGSALK),延伸因子Tu(斑点30)的MS/MS谱见(附加文件1:图S7),作为示例。
SA处理对水稻叶片酶活性的影响
为了进一步验证蛋白质磷酸化可能调节酶活性,我们从鉴定的磷蛋白中选择了三种重要的酶,并评估了它们的活性。SA处理24小时后,C101LAC中肉桂酰辅酶A还原酶(CCR)活性显著增加(图。3.a). SA处理24 h后,CCR在C101LAC中的磷酸化水平升高,说明CCR的酶活性受磷酸化调节。与磷蛋白组学结果一致,SA处理24 h后,两个品种的APX活性均显著下降。SA处理12小时后,仅在C101LAC中检测到pcam活性显著下降,但在CO39中几乎没有变化(图1)。3.b, c).磷蛋白组学分析还显示,SA处理12 h后,磷酸化的pga和APX仅在C101LAC中下调,但在CO39中几乎没有变化(表2)1).以上结果强烈提示pga和APX的酶活性受磷酸化的调控。
SA处理诱导水稻叶片ROS积累
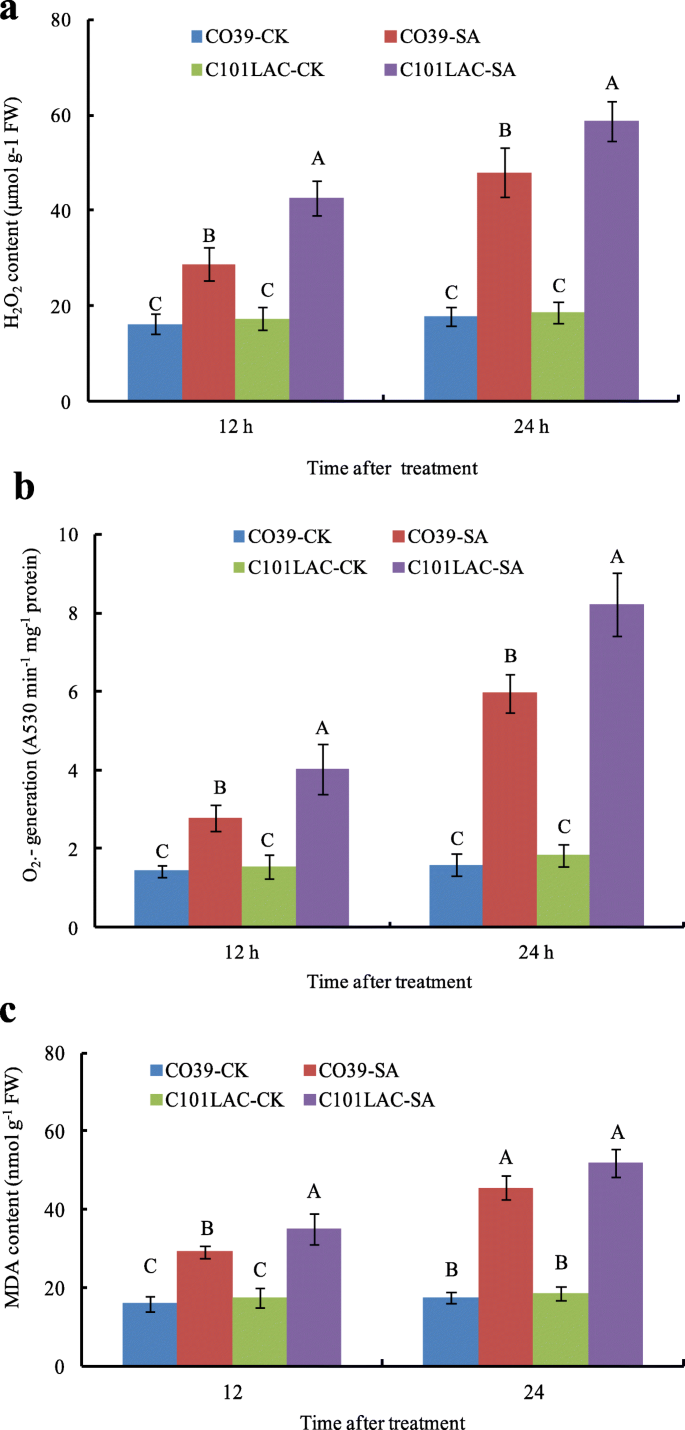
水稻对生物和非生物胁迫防御反应中SA和ROS的产生已有充分的文献记录[18,19].在本研究中,磷蛋白组学分析发现了几个参与ROS生物发生的磷蛋白。与磷蛋白组学结果一致,O2。H2O2与相应对照相比,SA处理后两种水稻品种的MDA含量均显著增加(图1)。4).与对照相比,SA使H增加2O2CO39和CO101LAC在12 h和24 h时含量分别增加1.77和2.72倍,2.47和3.15倍(图1)。4a). O的增加2。SA处理12 h和24 h时,CO39和CO101LAC的含量分别增加了1.94倍和3.75倍,CO101LAC的含量分别增加了2.59倍和4.46倍(图1)。4b).与对照相比,SA处理12 h和24 h后CO39、CO101LAC中MDA含量分别显著增加了1.83和2.61倍,CO101LAC中MDA含量分别增加了2.61和2.79倍(图1)。4c).综上所述,SA处理显著提高了O2。H2O2抗(C101LAC)和感(CO39)品种的丙二醛含量均显著升高,但C101LAC品种的倍数变化显著高于CO39品种。
sa反应性磷蛋白的转录表达分析
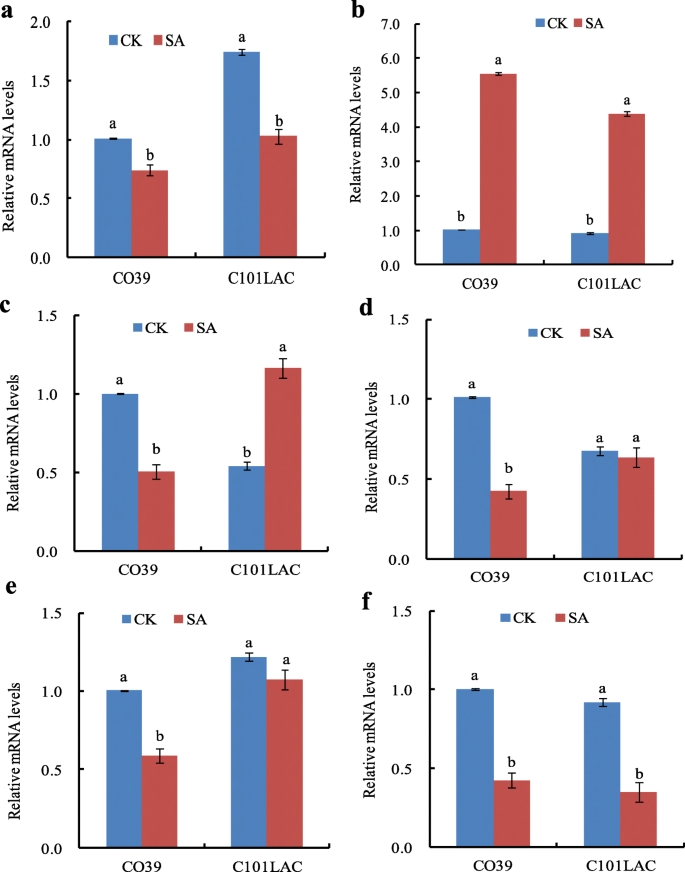
六个基因编码已识别的磷蛋白(附加文件4:表S4)进行qRT-PCR表达分析。SA处理后CO39中编码伴侣蛋白60 β的基因显著下调,而C101LAC中则上调(图1)。5a). CO39中延伸因子Tu在mRNA水平上显著降低,而在C101LAC中无显著变化(图1)。5b).上述两种磷酸化蛋白在mRNA水平上的表达变化与CO39和C101LAC的2DE结果一致。在C101LAC中,两种磷酸化蛋白(真核起始因子4A-1和磷酸oribulokinase)的mRNA水平显著降低,但磷酸化水平显著升高;然而,它们在CO39的mRNA水平和磷酸化水平上都有所下降(图1)。5c, d).有趣的是,甘油醛-3-磷酸脱氢酶在CO39中mRNA水平显著降低,但磷酸化水平升高;然而,在C101LAC中,mRNA水平和磷酸化水平的表达都降低了(图1)。5e). l -抗坏血酸过氧化物酶1在CO39和C101LAC中mRNA水平均显著升高;而其磷酸化水平在C101LAC中表现出典型的下降,而在CO39中无显著变化(图1)。5f).总的来说,这些数据表明SA处理过的水稻植株的转录调控和翻译后调控(通过蛋白质磷酸化)之间缺乏相关性。与此结果一致的是,一些报道的磷蛋白质组学研究也揭示了mRNA水平及其对应的蛋白质水平的不同变化[20.,21].结果表明,sa诱导的水稻抗性机制在多分子水平上具有重要意义。
讨论
SA是一种重要的信号分子,在植物抵御病原体的调控中起着关键作用。在我们之前的工作中,我们探索了sa介导的水稻抗m . oryzaeSA处理后抗稻瘟病和易感水稻品种感染的蛋白质组学分析[7].蛋白质磷酸化是最常见和最具特征的翻译后修饰之一,是调节植物中大量生物加工的关键过程,包括细胞信号转导、代谢、激素和应激反应[22].然而,由于磷蛋白丰度低,用“蛋白质组学”方法检测磷蛋白非常困难[23].为了进一步了解分子机制,我们对SA处理后的两个水稻近等基因系进行了比较蛋白组学分析。我们总共鉴定出29个对SA处理有反应的磷蛋白,属于9个功能类别。在29个磷蛋白中,有17个蛋白点在抗性品种(C101LAC)和感感品种(CO39)中普遍存在,提示SA可能共同影响某些生理过程。而其他12个磷蛋白在CO39和C101LAC之间的变化不同。这些磷蛋白的表达模式有助于了解sa诱导的不同抗性分子机制m . oryzae在两个水稻品种中。
众所周知,光合作用对各种外源刺激高度敏感,包括SA、JA和一些植物激素[24,25].在本研究中,SA处理后共有5个与光合作用相关的磷酸化蛋白被差异调节,其中叶绿体23 kDa的光合系统II多肽(PSII, spots 34)首次被磷酸化,并通过NanoLC-MS/MS进行了验证。以前已经证明光合作用可以通过光合作用相关蛋白的磷酸化来调节。例如,rubisco激活酶(RCA)被称为rubisco活性必不可少的辅助光合蛋白,其磷酸化在非生物胁迫下降低,导致光合作用失灵[26].转酮酶(TKL)是连接非氧化戊糖磷酸途径和卡尔文循环的关键酶,被认为通过磷酸化参与众多代谢途径的功能调节[27].先前的研究表明,去磷酸化会导致TKL活性的急剧下降,从而降低光合作用的速率[28].在本研究中,在SA处理后12 h和24 h,两个水稻品种的大部分磷蛋白,包括RCA (spot5)、Rubisco大亚基(spot20)和TKL (spot27)上调。与我们的结果一致的是,此前有报道SA可以缓解植物对抗病原体感染的光合作用下降,产生各种代谢产物和能量,从而提高植物的防御反应[7].然而,我们也注意到,SA处理12小时后,C101LAC中的had超家族水解酶(亚家族IA,变体3,位点1,含蛋白)下调。提示SA通过磷酸化与光合作用相关的蛋白质来调节植物的光合作用,在水稻植株中SA对光合机制的影响是复杂的。
我们确定了一个假定的肉桂酰辅酶a还原酶(CCR,斑点37)是sa响应的磷蛋白。CCR催化木质素生物合成的单木酚途径的第一步,因此在水稻的防御相关过程中发挥重要作用[29].在我们之前的研究中,首次报道了CCR在水稻易感植株中被脱磷m . oryzae感染,导致酶活性下降[30.].在本研究中,仅在SA处理后24小时,C101LAC中的CCR显著上调(表1).相应的,SA处理24 h后,抗性品种的CCR活性显著增加,而敏感品种的CCR活性则没有增加(图1)。3.a). CCR作为水稻防御信号中的小GTPase Rac的效应子,被认为是由OsRac1激活,进一步导致单烯烃的高效生产,木质素的沉积,ROS积累的增加[31].综上所述,我们推测CCR磷酸化可能会增加酶活性,加速木质素合成和ROS积累,从而进一步激活水稻对病原菌感染的防御反应。
据报道,抗氧化酶的磷酸化参与了抗氧化防御[32].在本研究中,发现了两种磷酸蛋白,分别为gdp -甘露糖3,5-外甲基化酶1 (OsGME 1, spot 15)和l -抗坏血酸过氧化物酶1 (OsAPx01, spot 33),这两种蛋白被称为抗氧化酶。磷酸化的OsGME 1在SA处理12 h后仅在敏感品种中下调,而磷酸化的OsAPx01在两个品种中均下调。先前的研究表明,去磷酸化降低了几种植物中APX和OsGME 1在生物或非生物胁迫下的活性[26,33].为了验证磷酸化对酶活性的调节作用,我们进行了APX活性的测定(图。3.b).结果表明,SA处理24 h后,两个品种的APX活性均显著降低,这与磷蛋白组学分析结果一致。有人认为,清除/抗氧化系统和/或活性的下调可能有助于增加ROS积累[34].早期的研究报告称,植物细胞可能通过协调活性氧生成酶(如SOD)和活性氧降解酶(如APX、POX和CAT)的活性来调节活性氧水平[35].详细比较了SA对H2O2SOD活性和H2O2结果表明,烟叶经SA处理后,H2O2主要是通过激活能够产生H2O2通过使能够降解H2O2[36].在本研究中,水稻APX和OsGME 1的磷酸化被下调,表明清除ros的抗氧化酶活性显著降低,进一步加速了两个品种的氧化爆发。与这一观点一致的是,SA处理后,两个水稻品种中都观察到显著的ROS积累(图1)。4),表明SA可以通过磷酸化调节抗氧化酶活性,进而增强水稻植株ROS积累,作为一种防御反应。然而,SA和ROS的相互作用是复杂的,需要进一步的研究才能完全阐明。
其中一个磷蛋白被鉴定为60 kDa的伴侣蛋白β (Cpn60β, spot 23),它是一种参与蛋白质目的地和组装的分子伴侣蛋白。分子伴侣在植物抗胁迫损伤、免疫应答和细胞死亡等方面发挥调控作用,可能有助于植物增强抵御病原体感染的防御系统[37].磷酸化是不同类型分子伴侣功能的常见调节模式,可显著提高其增强与未折叠蛋白结合的能力,促进某些异常蛋白的快速降解,并防止氧化应激损伤[38,39].在本研究中,磷酸化的Cpn60β在SA处理后24小时上调(表1).此前的一项蛋白质组学研究表明,细菌感染后,抗性番茄品种中60 kDa的伴侣素较易感番茄品种显著上调,可能提供了增强的防御系统假单胞菌solanacearum[40].综上所述,我们推测sa诱导的Cpn60β磷酸化可能提高了Cpn60β的活性,进一步有助于水稻抵御病原菌的攻击。
7个磷酸蛋白参与碳水化合物代谢,包括磷酸甘油酸变酶(PGAM,斑点9),甘油醛-3-磷酸脱氢酶(GAPDH,斑点17和18),1,4-葡聚糖磷酸化酶L同工酶(α-GP,斑点24和25),磷酸蛋白激酶(PRK,斑点31和32)。PGAM催化3-磷酸甘油酸转化为2-磷酸甘油酸,这是糖酵解过程中至关重要的一步。先前的磷蛋白组学研究表明,PGAM可在多个酪氨酸位点磷酸化,从而增强pga活性并上调糖酵解[41,42].在本研究中,SA处理12小时后,磷酸化的pcam仅在C101LAC中下调。为了验证sa诱导的蛋白磷酸化对酶活性的调节作用,评估了pcam的活性(图。3.b).与磷蛋白组学分析一致,SA处理12 h后,C101LAC的pcam活性显著降低,而CO39的pcam活性变化不大。α-GP催化葡聚糖链的可逆磷酸化,释放葡萄糖-1-磷酸用于淀粉的再合成。磷酸化的α-GP是活性的,去磷酸化的α-GP是不活性的[43].GAPDH催化糖酵解的一个关键步骤;如果磷酸化,GAPDH活性显著降低[44].在本研究中,SA处理12 h后,CO39和C101LAC中磷酸化的α-GP均上调,表明SA可能提高α-GP的活性。然而,SA处理12小时后,磷酸化的GAPDH在C101LAC中下调,而在CO39中上调。以上结果表明,SA诱导对两种不同水稻品种碳水化合物积累的调控不同,提示碳水化合物代谢途径可能通过重要酶的反磷酸化进行调控。然而,我们对这些碳水化合物代谢酶的磷酸化调控的潜在作用知之甚少,需要进一步的研究来揭示它们在水稻中的作用。
结论
本研究通过比较磷蛋白组学分析,探讨了不同水稻品种sa诱导防御反应的分子机制。通过MAIDL-TOF/TOF分析,共鉴定出29个sa响应蛋白。参与光合作用的磷蛋白、抗氧化酶、分子伴侣蛋白在两个品种中变化相似,而与蛋白质合成降解、防御、氨基酸代谢和碳水化合物代谢相关的磷蛋白表达差异。此外,通过NanoLC-MS/MS分析验证了4个鉴定的磷酸化蛋白的磷酸化,并通过活性测定验证了3个重要酶(CCR、pcam和APX)的磷酸化调节。据我们所知,这是第一个测量SA诱导的水稻磷蛋白组学变化的报道,这可能拓宽我们对水稻SA响应机制的认识。
方法
化学物质
本研究中使用了以下化学试剂:SA (Sigma-Aldrich, St. Louis, MO, USA);Immobiline™干燥带pH值4-7 NL, 18 cm和IPG缓冲pH值4-7 (GE Healthcare, Uppsala,瑞典);Pro-Q金刚石磷蛋白凝胶染色(分子探针,尤金,OR,美国);甘氨酸,1.5 mol/L Tris-HCl缓冲液pH 8.8, 30%丙烯酰胺/双溶液(37.5:1),覆盖琼脂糖(Bio-Rad, Hercules, CA, USA)。
植物材料
两个水稻近等基因系(水稻)从国际水稻研究所获得,包括携带抗性基因的C101LACPi-1反对m . oryzae,背景系CO39未携带已知抗性基因。在四叶期向水稻幼苗喷洒0.1 mM SA溶液(含0.02% v/v Tween 20) [7].第4片叶分别在SA处理后12和24 h收获。用含0.02% v/v吐温20的灭菌水喷洒作为空白对照。叶片在液氮中冷冻取样,并在- 80°C保存后进行评估。
磷蛋白组富集,2DE和凝胶分析
使用聚乙二醇介导的预分馏方法从5克水稻叶片样品中提取总蛋白[45].磷酸化蛋白的富集跟随已确定的Al (OH)3.-MOAC方法[30.].以牛血清白蛋白为标准,用考马斯蓝染色结合法测定蛋白质含量[46].用不同的叶片样本池进行了三次重复,所有过程均在4℃下进行。
2DE遵循既定协议[47].按照前面描述的方法,用Pro-Q Diamond荧光凝胶染色法可视化磷酸化蛋白[48],然后使用台风三人变模式成像仪(GE医疗保健公司,瑞典乌普萨拉)进行成像。使用PDQuest软件(Version 8.0, Bio-Rad, Hercules, CA, USA)对凝胶斑点进行定量分析,包括斑点检测、测量、匹配和计算。每个磷蛋白样品至少用2DE分析3次。3个生物重复序列均增加或减少≥1.5倍的蛋白点被选为推测的差异调节磷蛋白。
MALDI-TOF/TOF质谱法鉴定磷蛋白
在凝胶内消化之前,手动从凝胶中切除差异表达的磷蛋白斑点[7].随后使用ABI 4800蛋白质组学分析仪MALDI-TOF/TOF(应用生物系统公司,福斯特市,CA)对多肽进行分析。数据库搜索栽培稻数据库(Uniprot, v.2016.08.24)使用MASCOT搜索引擎2.2 (Matrix Science, Ltd.)和GPS-Explorer软件3.6 (Applied Biosystems)。参数设置如下:肽质量公差:100ppm;碎片公差:±0.3 Da;蛋白质评分C.I.%:≥95%;总离子评分C.I.%:≥95%,显著性阈值:p< 0.05。此外,为了消除数据库中出现的不同名称和登录号的蛋白质的冗余,该单蛋白成员属于o .漂白亚麻纤维卷或者从多蛋白质家族中挑选出蛋白质得分最高的其他蛋白质。
用NanoLC-MS/MS鉴定磷酸化位点
使用peg介导的预分馏方法从水稻叶片中提取总蛋白[30.],蛋白质按FASP方法用胰蛋白酶消化[49].然后将胰蛋白酶消化的肽混合物装入二氧化钛(TiO2) (5 μm Titansphere, GL Sciences, Japan),用30 mg/mL DHB(2,5-二羟基苯甲酸)缓冲液洗涤2次后离心收集。珠分别用60% ACN/0.1% TFA和0.1% TFA洗涤两次,然后用60% ACN/4%铵溶液洗脱。采用配备Easy nLC1000 (ThermoFisher,圣何塞,加州)的Q Exactive MS (Thermo Finnigan)进行NanoLC-MS/MS。肽混合物在c18 -反相色谱柱上分离,流速为250 nL/min,超过240 min。在正离子模式下用MS/MS分析多肽,并对Uniprot_进行MS/MS谱搜索选用数据库(v.2018.02.27),使用吉祥物2.2引擎。蛋白质组Discoverer 1.3 (Thermo Electron, San Jose, CA)用于识别磷酸化肽段,阈值设置为pRS评分高于50表示良好的PSM(肽谱匹配),pRS概率高于75%表示真正的磷酸化位点。
酶活性和活性氧的测定
第4片叶子在SA处理后12和24小时取样。APX(抗坏血酸过氧化物酶)、CCR(肉桂酰辅酶a还原酶)和磷酸甘油酸mutase (pga)的酶活性分别按照既定的方案进行测定[50,51,52].过氧化氢(H2O2)遵循Brennan和Frenkel的方法[53].超氧化物(O2.−)的产量测定基于硝基蓝四唑(NBT)还原[54].丙二醛(MDA)含量的测定采用上述方法[55],用下式计算MDA含量(C):C(μmol/L) = 6.45 (一个532-一个600) -0.56一个450.
实时荧光定量PCR (qRT-PCR)分析
用Eastep从水稻叶片中分离总RNA@超级总RNA提取试剂盒(Promega,上海,中国)。第一链cDNA由2 μg归一化总RNA制备,使用FastKing RT Kit(含gDNase)(天根生物技术,北京,中国)。用于选定基因转录评估的基因特异性引物使用Primer 5.0软件设计,并列于(附加文件4:表S4)。微管蛋白基因(Uniprot Accession No。以Q58G87)为参考。qRT-PCR采用CFX Coxnnect™实时系统(Bio-Rad, Hercules, CA, USA)和iTaq™SYBR®Green Supermix (Bio-Rad, Hercules, CA, USA),根据制造商协议进行。对每个基因进行三个独立的生物重复。每个基因的相对转录水平用2−△△Ct方法(56].
统计分析
平均值±标准误差(SE)来自三次生物重复。采用单因素方差分析(ANOVA)对数据进行分析,确定显著差异为p使用SPSS软件(19.0版本,SPSS Inc.,芝加哥,伊利诺斯州,美国)的邓肯检验结果≤0.05。
数据和材料的可用性
在这项研究中产生或分析的数据包括在这篇发表的文章及其补充信息文件中。
缩写
- 2 de:
-
二维凝胶电泳
- APX型:
-
抗坏血酸盐过氧化物酶
- CCR:
-
Cinnamoyl-CoA还原酶
- IEF:
-
等电点聚焦
- IPG:
-
固定pH梯度
- LC:
-
液相色谱法
- MOAC:
-
金属氧化物亲和层析
- 女士:
-
质谱计
- 女士/小姐:
-
串联质谱法
- 挂钩:
-
聚乙二醇
- PGAM:
-
磷酸甘油酸酯变位酶
- Pro-Q DPS:
-
Pro-Q金刚石磷蛋白染色
- 铝:
-
转录后修饰
- 存在:
-
实时定量PCR
- ROS:
-
活性氧种类
- 山:
-
水杨酸
参考文献
- 1.
Sasaya T,中佐野-长冈E, Saika H,青木H, Hiraguri A, Netsu O, Uehara-Ichiki T, Onuki M, Toki S, Saito K, Yatou O.水稻植株抗病毒转基因策略研究。微生物学前缘,2014;4:409。
- 2.
李晓燕,李晓燕,张晓燕,等。水稻稻瘟病菌侵染过程中植物细胞死亡动态的荧光成像研究Magnaporthe oryzae.BMC Plant Biol. 2016;16:69。
- 3.
Ribot C, Hirsch J, Balzergue S, Tharreau D, notteghhem JL, Lebrun MH, Morel JB。水稻对稻瘟病菌的敏感性稻瘟病菌.植物生理学报,2008;29(1):447 - 447。
- 4.
abad - ashtiani F, Kadir JB, Selamat AB, Hanif BM, Nasehi A.叶片和根部施硅对MR219水稻稻瘟病菌的防治效果。植物病理学杂志,2012;28(2):164-71。
- 5.
水杨酸在植物生长发育中的作用。中国科学(d辑:自然科学版)2011;
- 6.
Dempsey DA, Klessig DF。多方面的植物激素水杨酸是如何在植物中对抗疾病的?类似的机制是否在人类中被利用?BMC Biol. 2017;15:23。
- 7.
李艳芳,张志华,聂艳芳,张丽华,王忠忠。水杨酸诱导的抗性蛋白质组学分析Magnaporthe oryzae在易感和抗性水稻中。蛋白质组学。2012;12(14):2340 - 54。
- 8.
Lozano-Duran R, Robatzek S.植物-病原体相互作用中的14-3-3蛋白。植物学报。2015;28(5):511-8。
- 9.
李海燕,陈绍兴。植物磷蛋白质组学研究进展与挑战。蛋白质组学,2015;15(5 - 6):1127 - 41。
- 10.
吴丽君,胡晓丽。王思祥,田亮,庞玉军,韩志平,吴丽丽。植物激素水杨酸诱导玉米磷蛋白组变化的定量分析。科学通报,2015;5:18155。
- 11.
古普塔R, Min CW,孟Q, Agrawal GK, Rakwal R, Kim ST.乙烯和脱落酸处理的比较磷蛋白质组学分析甘氨酸马克斯树叶。植物生理与生物化学,2018;130:173-80。
- 12.
侯亚贤,邱建华,童晓华,魏晓军,Nallamilli BR,吴文华,黄文思,张佳。水稻对白叶枯病抗性的综合定量磷蛋白组分析。BMC Plant Biol. 2015;15:163。
- 13.
邱建华,侯益贤,王艳芳,李志英,赵杰,童晓华。林海辉,魏新军,敖华,张佳。aba诱导水稻蛋白质磷酸化的综合蛋白质组学研究(栽培稻l .)。分子科学学报,2017;18(1):60。
- 14.
顾永强,杨超,Thara VK,周杰,Martin GB。Pti4由乙烯和水杨酸诱导,其产物被Pto激酶磷酸化。植物学报,2000;12(5):771-86。
- 15.
Ueno Y, Yoshida R, Kishikaboshi M, Matsushita, Jiang CJ, Goto S, Takahashi A, Hirochika H, Takatsuji H. MAP激酶磷酸化水稻WRKY45。植物信号行为学报,2013;8(6):e24510。
- 16.
张铮,陈杰,林松,李铮,程锐,方超,陈宏,林伟。ABA对小麦籽粒灌浆作用的蛋白质组学和磷蛋白质组学测定栽培稻L.低劣的小穗。植物科学,2012:185-186-259-73。
- 17.
纳里日尼SN,兹戈达VG,梅恩斯科娃MA,诺维科娃SE,隆日娜NL,瓦赫鲁晓夫四世,赫里亚波娃EV,丽莎莎AV,吉科诺娃OV,波诺arenko EA, Archakov AI。虚拟和实验2DE结合ESI LC-MS/MS可以更清晰地了解人类细胞和血浆的蛋白质组。电泳。2016;37(2):302 - 9。
- 18.
Kim Y, Mun BG, Khan AL, Waqas M, Kim HH, Shahzad R, Imran M, Yun BW, Lee IJ。盐胁迫条件下水杨酸对水稻植物活性氧和氮的调节作用。科学通报,2018;13(3):e0192650。
- 19.
施泰维美,安杰,尹明,贾旭,关艳,何峰,胡娟。冷等离子体处理和外源水杨酸启动增强了水杨酸对盐的耐受性栽培稻幼苗。原生质。2019;256(1):79 - 99。
- 20.
彭πZ,赵ML, XJ,沈SH Phosphoproteomic分析纸桑揭示了磷酸化在耐寒性中的作用。《蛋白质组学报》2017;16(5):1944-61。
- 21.
潘德忠,王丽霞,谭福来,吕松,吕新军,Zaynab M,程立林,Abubakar YS,陈斯普,陈伟。磷蛋白质组学揭示稳定的能量供应是植物耐水能力的关键Kandelia candel.蛋白质组学杂志,2018;176:1-12。
- 22.
Kline-Jonakin KG, Barrett-Wilt GA, Sussman先生。植物学报,2011;14:507-11。
- 23.
Wolschin F, Wienkoop S, Weckwerth W.利用金属氧化物/氢氧亲和层析法(MOAC)从复杂混合物中富集磷酸化蛋白质和多肽。蛋白质组学。2005;5:4389 - 97。
- 24.
杨晓燕,王晓燕,王晓燕。重金属-激素在水稻植株中的相互作用:对生长、净光合作用和碳水化合物分布的影响。植物生长学报,1995;14(2):61-7。
- 25.
纳扎尔R,奥马尔S,汗NA。外源水杨酸通过增加盐胁迫下芥菜抗坏血酸-谷胱甘肽代谢和S同化来改善光合作用和生长。植物信号行为学报,2015;10(3):e1003751。
- 26.
Margaria P, Abbà S, Palmano S.用蛋白质组学和磷蛋白质组学方法研究葡萄对植物原体感染反应的新方面,并将数据集成到功能网络。BMC基因组学,2013;14:38。
- 27.
Rocha AG, Mehlmer N, Staez S, Mair A, Parvin N, Chigri F, Teige M, Vothknecht UC。的磷酸化拟南芥转酮酶Ser428位点为叶绿体碳代谢的代谢控制提供了一个潜在的范式。生物化学杂志,2014;458(2):313-22。
- 28.
杨丽娟,张丽娟。Rubisco和转酮酶基因共过表达对水稻光合作用的影响。Photosynth res2017;131(3): 281-9。
- 29.
公园霍奇金淋巴瘤,Bhoo SH, Kwon M,李西南,秋MH。生化和表达分析水稻cinnamoyl-CoA还原酶基因家族。植物科学进展2017;8:2099。
- 30.
引用本文李艳芳,叶志军,聂艳芳,张军,王桂良,王忠忠Magnaporthe oryzae-反应蛋白在易感和抗性水稻品种。蛋白质组学杂志2015;115:66-80。
- 31.
Kawasaki T, Koita H, Nakatsubo T, Hasegawa K, Wakabayashi K, Takahashi H, Umemura K, Umezawa T, Shimamoto K.桂皮酰辅酶a还原酶是木木素生物合成的关键酶,是水稻小GTPase Rac防御信号传递的效应酶。中国生物医学工程学报,2006;32(1):447 - 447。
- 32.
Gou jiy, Li K, Wu KT, Wang XD, Lin HQ, Cantu D, Uauy C, Dobon-Alonso A, Midorikawa T, Inoue K, Sanchez J, Fu D, Blechl A, Wallington E, Fahima T, Meeta M, Epstein L, Dubcovsky J小麦抗条锈病蛋白WKS1降低了类囊体相关抗坏血酸过氧化物酶对活性氧的解毒能力。植物学报,2015;27(6):1755-70。
- 33.
韩超,王凯,杨鹏飞。水稻胚萌发过程凝胶比较磷蛋白质组学分析。植物与细胞生理学报,2014;55(8):1376-94。
- 34.
夏新军,周永华,石凯,周杰,傅永昌,于建强。活性氧与激素在植物发育和抗逆性调控中的相互作用。中国科学(d辑:自然科学版)2015;
- 35.
Herrera-Vásquez A, Salinas P, Holuigue L.水杨酸和活性氧在防御基因表达的转录控制中的相互作用。植物科学进展2015;6:171。
- 36.
陈志,Silva H, Klessig DF。水杨酸诱导植物系统获得性抗性中的活性氧种类。科学。1993;262(5141):1883 - 6。
- 37.
石川一,田中恒,中井一,旭旭。伴侣蛋白60β基因的缺失导致细胞死亡拟南芥病变起始1突变体。植物细胞学报,2003;44(3):255-61。
- 38.
谢尔曼,戈德堡,热休克大肠杆菌通过诱导其磷酸化改变伴侣蛋白groEL的蛋白质结合特性。大自然。1992;357(6374):167 - 9。
- 39.
结核分枝杆菌GroEL1伴侣蛋白是丝氨酸/苏氨酸蛋白激酶的底物。中华微生物学杂志,2009;31(4):369 - 369。
- 40.
Afroz A, Khan MR, Ahsan N, Komatsu S.番茄青萎病易感和抗病品种的蛋白质组学比较分析。肽。2009;30(9):1600 - 7。
- 41.
Hitosugi T, Zhou L, Fan J, Elf S, Zhang L, Xie JX, Wang Y, Gu TL, Aleckovic M, LeRoy G, Kang YB, Kang HB, Seo JH, Shan CL, Jin P, Gong WM, Lonial S, Arellano ML, Khoury HJ, Chen GZ, Shin DM, Khuri FR, Boggon TJ, Kang S, He C, Chen J. Tyr26 PGAM1磷酸化通过稳定活性构像为肿瘤提供代谢优势。2013;4:1790。
- 42.
王燕,蔡文伟,陈琳,王光勇。分子动力学模拟揭示了磷酸甘油酸变化酶1酪氨酸26磷酸化如何上调糖酵解并促进肿瘤生长。Oncotarget。2017;8(7):12093 - 107。
- 43.
Tan AW, Nuttall FQ。从大鼠肝脏中纯化的磷酸化酶脱磷形式的特性及其在粗肝制剂中的活性测定。生物化学学报1975;410(1):45-60。
- 44.
皮亚托尼CV,费列罗DML,德拉费列拉I,贝吉蒂A,伊格莱西亚斯AÁ。胞质甘油醛-3-磷酸脱氢酶在种子发育过程中被磷酸化。植物科学进展2017;8:522。
- 45.
金ST、赵克思、余S、金SG、洪JC、韩CD、裴德威、南MH、康KY。稻瘟病菌和激发子诱导的悬浮培养水稻细胞差异表达蛋白的蛋白质组学分析。蛋白质组学。2003;3(12):2368 - 78。
- 46.
利用蛋白质与染料结合的原理,对蛋白质的微克量进行定量的一种快速而灵敏的方法。分析生物化学,1976;72:248-54。
- 47.
引用本文:李艳芳,聂艳芳,张志华,叶志军,邹晓涛,张丽华,王忠忠。茉莉酸甲酯诱导不同水稻品种防御反应的蛋白质组学比较分析。蛋白质组学。2014;14(9):1088 - 101。
- 48.
Agrawal GK, Thelen JJ。磷酸蛋白的一种简化、经济的聚丙烯酰胺凝胶染色方法的开发。蛋白质组学。2005;5(18):4684 - 8。
- 49.
维涅夫斯基JR, Zougman A, Nagaraj N, Mann M.蛋白质组分析的通用样品制备方法。Nat方法。2009;6(5):359-62。
- 50.
干旱和盐胁迫下植物抗坏血酸过氧化物酶和过氧化氢酶活性及其遗传调控国际分子科学杂志2015;16(6):13561-78。
- 51.
Lüderitz T, Grisebach H.木质素前体的酶法合成。肉桂酰辅酶a还原酶与肉桂醇的比较:NADP+云杉脱氢酶(挪威云杉L.)和大豆(大豆l .)。中国生物医学工程学报。1981;29(1):61 - 62。
- 52.
Bourgis F, Botha FC, Mani S, Hiten FN, Rigden DJ, Verbruggen n拟南芥编码d-PGMase超家族的同源物的cDNA。中国生物医学工程学报2005;56(414):1129-42。
- 53.
黄晓明,张晓明。过氧化氢在梨衰老调控中的作用。植物物理学报,1977;59(3):411-6。
- 54.
Shah J, Kachroo PK, Nandi A, Klessig DF。拟南芥SSI2基因的隐性突变使PR基因的SA-和npr1独立表达和对细菌和卵菌病原体的耐药性。植物学报。2001;25(5):563 - 571。
- 55.
李红。植物生理生化实验原理与技术。北京:高等教育出版社;2000.196 - 7页。
- 56.
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR分析和2——ΔΔCT方法。方法。2001;25(4):402 - 8。
致谢
感谢陈建驰教授(美国农业部农业研究服务中心,圣华金谷农业科学中心)和邓宜珍教授(华南农业大学广东省微生物信号与疾病控制重点实验室)对稿件的严格审阅。
资金
国家自然科学基金项目(31671968)、广东省自然科学基金项目(2015A030313406)、广东省科技计划项目(2016A020210099、2016A020210098)、广州市科技计划项目(201804010119)资助。资助机构在设计研究、收集、分析和解释数据以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
RS、SQ、TZ、ZW、HL、YL、YN构思研究,参与研究设计,并对研究结果进行批判性讨论。TZ和HL进行qRT-PCR分析。RS、SQ、TZ分别进行磷蛋白组学分析和生化分析。ZW, HL, YL和YN负责NanoLC-MS/MS分析。RS, YL和YN撰写并修改了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
MQ水(作为对照)和SA处理过的水稻叶片中磷蛋白的代表性2DE模式。图S2所有额外的水稻磷蛋白2DE凝胶显示为复制凝胶。图S3。2DE凝胶区域的特写图显示了两个水稻品种中所有sa响应的磷蛋白斑点。图S4。水稻叶片sa响应性磷蛋白的定量分析。图S5。MALDI-TOF/TOF MS对11号斑的识别图S6。29个sa反应蛋白的功能种类分布。图S7。延伸因子Tu (Q6ZI53)对应的ELLS*YEYDGDEVPIVAGSALK的代表性磷酸化肽的MS/MS谱。
附加文件2:表S1。
通过NanoLC-MS/MS分析确定磷酸多肽及其磷酸化位点(用氨基酸残基的小写字母标记)。
附加文件3:表S2。
水稻磷蛋白的NanoLC-MS/MS鉴定。
附加文件4:表S3。
利用NanoLC-MS/MS数据绘制sa响应磷酸化蛋白。表S4。设计用于qRT-PCR的基因特异性引物。
权利与权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于本文
引用本文
孙锐,秦珊珊,张涛。et al。稻瘟病抗性和易感水稻品种对水杨酸反应的磷蛋白质组学比较分析。植物生物学19日,454(2019)。https://doi.org/10.1186/s12870-019-2075-5
收到了:
接受:
发表:
关键字
- 水杨酸
- 大米
- Phosphoproteome
- 二维凝胶电泳
- 蛋白质磷酸化