摘要
背景
花青素是花朵颜色的主要来源,也积累在营养组织中,在营养组织中,它们具有多种保护作用,传统上归因于代谢途径的早期化合物(黄酮醇,黄酮等)。花瓣中花青素的特异性损失可以使植物逃避类黄酮和花青素在营养器官中损失的负面多效效应,在这些器官中,它们执行过多的基本功能。在此,我们在生物化学尺度上研究了shore campion粉红色-白色花色多态性的多效性程度。硅宾littorea.我们报告了21个种群中粉红色和白色个体的频率,以及三种花色变体的潜在生化特征:所有组织中都存在花青素(粉红色花瓣),花瓣特异性花青素损失(白色花瓣),所有组织中花青素损失(白色花瓣)。
结果
只在花瓣中缺乏花青素的个体在物种范围北部边缘的两个群体中表现出稳定的多态性(平均频率为8-21%)。然而,在整个植物中,在整个物种范围内都发现了缺乏花青素的个体,但频率非常低(< 1%)。生物化学上,黄酮类化合物为花青素和黄酮类;在色素个体中,各组织中黄酮的浓度比花青素高14 - 56倍,在叶片中检测到的差异为> - 100倍。花青素色素沉着的丧失,无论是在花瓣中还是在整个植物中,都不会影响这些表型合成黄酮的能力,而且这种模式在所有样本群体中都是一致的。
结论
我们发现,无论是在花瓣中还是在整个植株中,所有颜色变体都表现出相似的黄酮分布,只有在光合组织中含有花青素的花色变体是稳定的花色多态性。这些结果表明,光合组织中的花青素是非传粉者介导选择的目标,而不是类黄酮中间体。
背景
突变是所有生物遗传变异的主要来源,对表型多样性有重要贡献[1,2],但并不是所有的突变都与进化相关。一些表型变化是通过自发突变产生的,其有害影响可通过净化选择始终消除[3.].相比之下,持久的表型变化来自于通过频率依赖或异质选择或通过促进多个自适应峰值来平衡选择所维持的突变[4,5,6,7,8],导致该性状的群体多态性[9,10,11].这些因素可能决定了为什么一些新的表型是短暂的,而一些则是持续的,因为多态性仍然是开放的[12,13],但对花卉颜色的研究有助于阐明这个问题[14,15,16,17].
花卉的颜色变化在历史上引起了许多博物学家的注意[18,19,20.],至今仍是进化生物学家研究的重要焦点[14,21].花朵的颜色被认为是吸引传粉者的适应性特征[22],但基础色素也有其他功能,尤其是在营养组织中。花青素是最常见的植物色素,可以使花朵呈现橙色、红色、粉色和蓝色。23]以吸引不同功能的传粉者[22,24].例如,猕猴花中花青素含量的变化(Mimulus)会产生花为红色和粉红色的品种,而蜂鸟和蜜蜂则会分别到访这些品种[25,26].在营养组织中,花青素可发挥防晒、抗氧化剂或抗病原体等保护作用[27,28].因此,花青素的损失可能会影响传粉者的活动,但也可能产生生理影响,这取决于花青素是否在营养组织中积累。如果花青素的损失仅限于花(通常在花瓣中),植物的其余部分可以产生花青素,并减少其他组织中的任何负面多效性影响[29,30.],而整个植物中缺乏花青素的个体有可能生长和繁殖,但经常表现出适应性劣势,这似乎解释了它们在野生环境中的稀缺[31,32,33](见附加文件1:表S1)。
花瓣特异性花青素的丢失通常是由调控突变(即基因表达调控的改变)引起的,并且Myb转录因子是控制植物花青素生物合成的关键调控因子[30.,34].Myb蛋白的不同拷贝调控花和营养花青素,因此这种调控的特异性被预测具有低的多效性后果[35].例如,在番薯紫竹调控突变IpMyb1色素花中花青素损失的基因[36].然而,这些突变并不影响白花植物的适应性,并显示出与有色个体相同甚至更高的繁殖成功率[15,29].
另一方面,缺乏花青素的个体是由于花青素生物合成途径(以下简称ABP)的任何结构位点或全植物调节基因的功能丧失[30.,34].功能缺失突变可能针对高谱基因,因为有更多可能的位点,可以授予非色素表型。因此,该途径的任何结构基因失活通常会限制ABP的通量并阻断花青素的产生,但也可能影响该途径侧分支中未着色/淡黄色非花青素类黄酮的合成[23].这些类黄酮,如黄酮或黄酮醇,也具有重要的生态功能,因为它们对环境应激的保护功能与花青素本身相似,甚至更强[37].因此,与花青素和/或中间非花青素类黄酮缺乏相关的负性多效效应应限制功能丧失突变的持久性[14,17,38].针对这些变异的选择可能取决于突变发生的位置和类黄酮损失的相关负面后果。
色素沉着丧失,特别是由于花青素的缺乏,是植物中花色多态性最常见的情况[39,40].白花变种代表了有价值的天然基因型,可以了解整个植物缺乏花青素可能带来的选择劣势[33,39,41,42,43],但这些植物的非花青素类黄酮成分尚不清楚。此外,至少在某些组织中,花青素的含量通常与非花青素类黄酮的含量相关,后者的浓度甚至高于花青素[44,45].因此,很难区分哪一组类黄酮是导致缺乏花青素的植物的选择性劣势的原因[31,32,33],明确区分类黄酮组的研究也很有限。
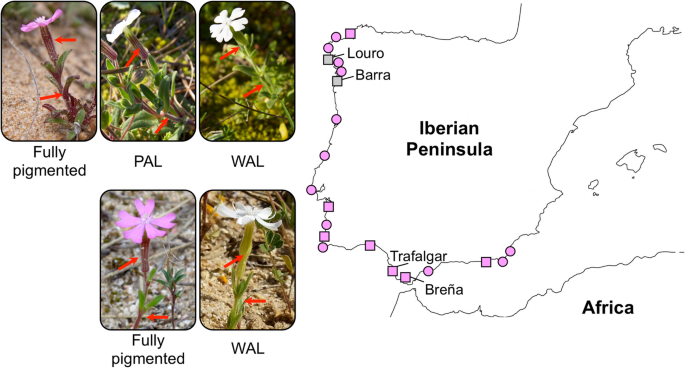
海岸剪枝硅宾littoreaBrot。(石竹科)是一种一年生粉红色花的植物,在花瓣、花萼、叶和茎中积累花青素和非花青素类黄酮[44,46].这两种类黄酮在营养组织中的积累变化很大,似乎对轻应激有反应[46].硅宾littorea沿伊比利亚海岸生长,在西北分布范围的两个居群中表现出基于花青素的粉红色-白色花色多态性,但在一些居群中偶见花青素缺乏个体[47].在美国littorea,花瓣特异性多态性可能是由于黄酮-3-羟化酶下调(F3 h)基因通过下调SlMyb1a转录因子[47],但缺乏花青素植物的遗传原因仍然未知。本种花主要由双翅目、膜翅目和鳞翅目的通才传粉者访问;然而,它们似乎对粉色或白色花朵都没有表现出强烈的传粉者偏好(M.L.B. 2019,未发表数据)。由此可见,花瓣花青素损失的发生与全株花青素损失个体有关美国littorea(以下分别为PAL和WAL表型)提供了一个很好的机会来理解由于缺乏花青素和/或非花青素类黄酮而导致的非传粉者选择的重要性。
在这项研究中,我们试图了解决定不同形式花青素变异命运的因素美国littorea.因此,我们在5年的时间里研究了21个种群在物种分布范围内的三种花青素表型(PAL、WAL和完全色素化)的种群频率。然后,我们使用高效液相色谱-二极管阵列检测和电喷雾电离串联质谱(HPLC-DAD-MS)n)在全色素表型上研究全株水平的类黄酮谱,并与白花变种(即PAL和WAL表型)进行比较;在此之后,本研究扩展到更多的个体和人群使用黄酮分光光度法定量。由于缺少类黄酮的负面影响30.,38],我们预计PAL表型在人群中比WAL更常见。因此,花青素和非花青素类黄酮的损失预计仅限于PAL植物的花瓣,而在WAL个体中扩展到整株植物。
结果
PAL、WAL和全色素表型的频率
我们的种群调查证实,PAL表型仅限于物种范围北部的两个种群(图2)。1).在这两个种群中,PAL植物多年来一直保持着8%至21%的多态性(附加文件)2:表S2)。相反,在调查的21个群体中,有9个群体(包括两个多态群体)中发现了WAL个体,但频率非常低(< 1%;无花果。1和附加文件2:表S2),并没有明确的地理分布格局。
硅宾littorea花青素积累的取样和表型。这幅地图显示了21个种群,涵盖了美国littorea其中估计花瓣花青素损失(PAL)和全植物花青素损失(WAL)表型的频率(见附加文件2:表S2)。粉红色圆圈表示只发现完全色素个体(粉红色花瓣和花青素光合组织)的种群,粉红色方块表示在研究期间至少一年也发现WAL个体的种群,白色方块表示发现WAL和PAL个体的种群。对其中的黄酮类化合物进行生物化学分析的两个多态种群(Louro和Barra)和两个非多态种群(Trafalgar和Breña)被命名。在多态种群(上图)和非多态种群(下图)中呈现的三种表型的照片。注意完全着色和PAL植物与WAL个体花青素积累在花萼和茎中的差异(由红色箭头指示)(更多照片可在附加文件中获得)3.:图S1)
各植物组织中类黄酮的鉴定及组成
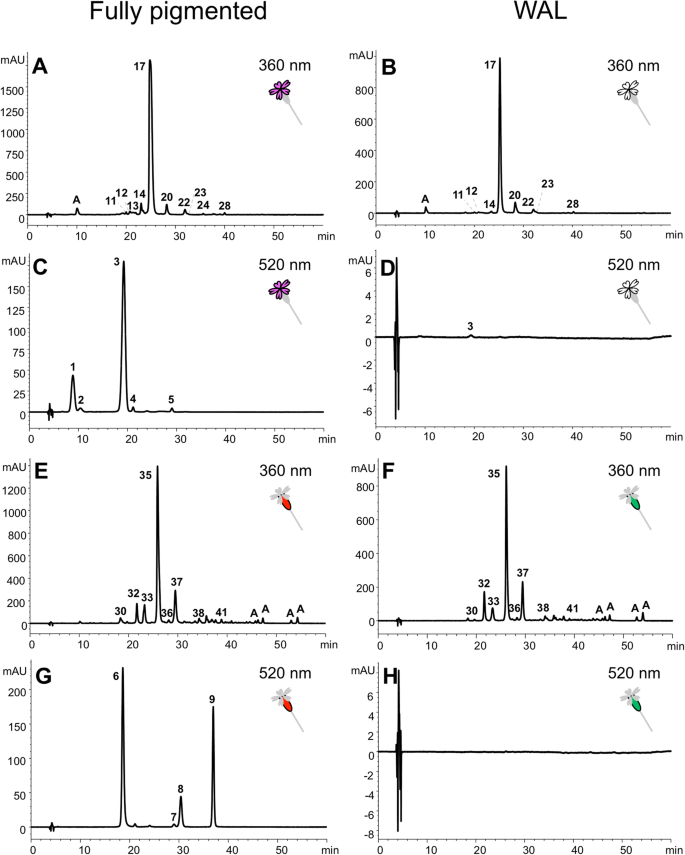
在花瓣中鉴定出5种花青素和21种黄酮,在光合组织中鉴定出4种花青素和19种黄酮(附加文件)4:表S3)。在所有情况下,检测到的花青素都是花青素衍生物,但在花瓣和光合组织中具有不同的取代基(图。2和附加文件4:表S3)。色素花瓣中的主要花青素是由两种糖(一个鼠李糖葡萄糖和一个葡萄糖)糖基化的花青素,并与乙酸酰化(占总花青素浓度的71.0-74.1%;图中3号峰2c).在光合作用组织中,优势花青素结构较简单,苷元上仅附着1个糖(78.0 ~ 99.4%;图中峰6-9。2g)。
与光合组织相比,花瓣中黄酮类化合物的组成也有所不同:异牡荆素衍生物主要积累在花瓣中,而异荭草素衍生物是光合组织中主要的黄酮类化合物(表2)1和附加文件4:表S3)。主花瓣黄酮为异牡荆素与2个戊糖糖基化(占3个表型总黄酮浓度的69.5 ~ 88.3%;图17峰2在花萼(58.8-63.2%)、叶(42.9-58.1%)和茎(50.6-57.8%)中主要存在一种含有额外己糖和咖啡基残基的异向丁衍生物;图中峰35。2e和f)。在所有组织中也检测到异莨菪碱衍生物,但水平相对较低(< 11%;表格1和附加文件4:表S3)。
黄酮是在组织中检测到的最丰富的类黄酮。在完全色素化的个体中,花瓣、花萼和茎中的黄酮类含量比花青素高14 - 56倍;叶组织表现出极大的偏向,产生黄酮的速度是花青素的100倍(表1)1).这些差异在PAL植物的白色花瓣和缺乏花青素的WAL个体中更为明显。
用HPLC-DAD-MS分析各表型类黄酮含量的变化n
3个表型的花青素浓度均有显著差异。在花瓣中,PAL和WAL表型只积累了完全着色表型中1%的花青素(图2)。2d;表1而且2).在花萼和茎中,WAL表型产生了无法检测到的花青素浓度(图。2h),而完全着色型和PAL表型显示出相似的花青素水平。在叶片中,花青素浓度很低,3种表型的花青素浓度在统计学上相似。
与花青素浓度的差异相比,三种表型在黄酮含量上的差异最小(图2)。2a, b, e和f),只有3种花瓣黄酮(占总黄酮的1.5%)不存在于所有表型中(见附加文件)4:表S3)。我们发现多态种群和非多态种群的黄酮组成存在差异,其中有5种化合物是Breña特有的(附加文件中的化合物16,18,21,33a和37a)4:表S3)。前3个化合物为花瓣中罕见的非酰基o -糖基- c -单糖苷类黄酮(占总黄酮的比例< 1%),其他2个化合物在光合组织中含量中等(占总黄酮的4.17-21.2%)。因此,基于黄酮组成和浓度的主成分分析显示,居群之间的分离比各居群表型之间的分离更高(附加文件)7:图S4)。当我们比较每个特定组的黄酮(即异牡荆素、异荭草素和异莨菪素的衍生物,以及二- c -糖苷)的黄酮浓度时,我们发现无论是在多态性群体中还是在非多态性群体中,表型之间都没有显著差异(表2)2).当使用MANOVAs中黄酮的相对比例时,也得到了类似的结果(附加文件8:表S4)。
用分光光度法测定表型间类黄酮含量的变化
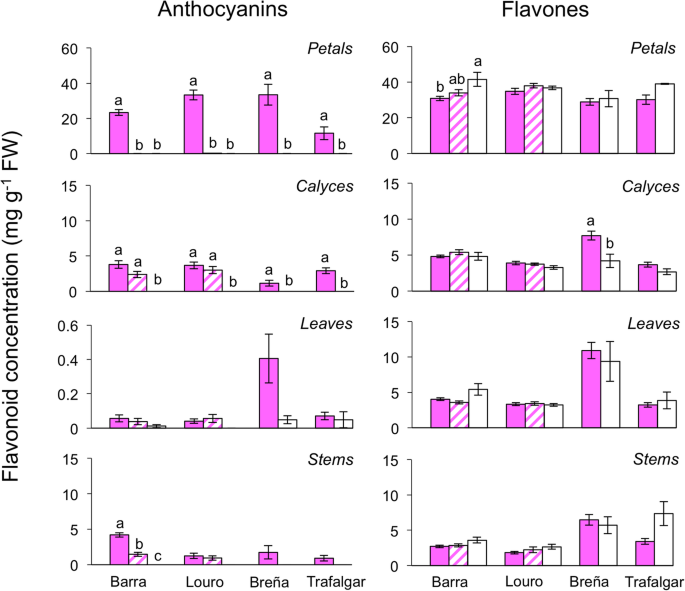
当取样扩大到更多的个体和群体时,分光光度法定量显示出与HPLC分析中发现的花青素和黄酮生产相似的模式。在两个多态群体中,三种表型的花青素积累在除叶片外的所有组织中表现出显著差异,在所有表型中表现出非常低的值(图2)。3.;表格3.).在花瓣中,PAL和WAL表型的花青素含量接近于零,而在光合组织中只有WAL表型缺乏花青素。三种表型在光合组织中的黄酮浓度具有统计学上的相似性。在花瓣中,由于黄酮含量较高,花瓣中存在显著差异(图2)。3.).在不同种群间,花瓣和茎中花青素的产量以及所有组织中黄酮的产量存在显著差异。花青素和黄酮类化合物的浓度总体上Barra高于Louro。
在非多态群体中,花瓣和花萼中花青素的产生在全色素和WAL表型之间有显著差异,在茎中也接近显著(图2)。3.;表格3.).两种表型的黄酮浓度在除花盏外的所有组织中相似,其中来自Breña的WAL植物与完全着色的植物相比,黄酮浓度接近一半(图2)。3.).不同居群之间,除茎外各组织中花青素含量均有显著差异,各光合组织中黄酮类含量均有显著差异,Breña居群中花青素含量较高。
讨论
在这项研究中,我们发现肖尔芒同时积累花青素和黄酮,但这些化合物的特定类别在花瓣中与光合花盏、叶片和茎中产生的不同。全色素型植株和PAL型植株的花青素含量相似,但花瓣中明显缺乏花青素,而WAL型植株全株缺乏花青素。相反,白色花瓣的植物(PAL和WAL表型)与粉红色花的植物相比,具有相似的黄酮组成和浓度。因此,在PAL和WAL表型的每个组织中,黄酮的合成似乎不受花青素损失的影响。这种花青素和黄酮在所有表型中的产生模式在遥远的多态和非多态群体中是一致的。这些结果表明,光合组织中花青素的积累直接或间接地参与了花瓣颜色多态性的持久性。下面,我们讨论这些发现,鉴于PAL和WAL表型在自然群体中发现的频率。
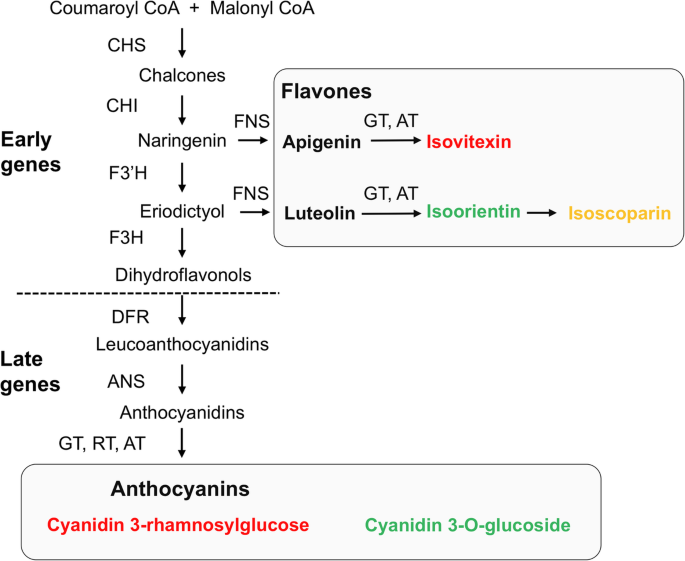
本文报道的最重要的发现之一是PAL和WAL植物与完全着色的植物具有相似的黄酮含量,尽管它们的花瓣或花瓣和营养组织中缺乏花青素。在前人的研究中,分析了植物花瓣中ABP基因的序列和基因表达美国littorea, Casimiro-Soriguer等人。[47]提示PAL个体花青素花瓣损失是由黄酮-3-羟化酶(F3h)由一种花瓣特异性调控基因控制,SlMyb1a.PAL花瓣中黄酮的检测与ABP的阻塞一致F3 h因为黄酮是由柚皮素或碘二醇合成的,它们是在F3H之前的步骤中产生的。4).我们建议对F3 h防止黄酮产生受阻[48],并将花青素中的通量重定向到白色花瓣中的黄酮美国littorea,如其他花色多态种所述[49,50].类似地,导致WAL个体完全缺乏花青素的突变可能发生在保存黄酮产生的途径的后期。在Mimulus lewisii而且Iochroma calycinum,二氢黄酮醇4还原酶(ABP)的晚期基因编码区突变(Dfr),导致稀有白花个体的花青素完全丧失[51,52].类似的下游ABP阻塞,但不一定是由DFR失活引起的,可以解释WAL个体中花青素的缺失。
简化了类黄酮生物合成途径硅宾littorea.酶活性(箭头旁边的大写字母)和代谢产物。HPLC-DAD-MS检测主要花青素和黄酮n用红色、绿色和黄色字母分别表示在花瓣、光合组织或两者中发现的化合物。根据生物合成途径上游(黄酮)和下游(花青素)产物合成所涉及的基因,用虚线将生物合成路线分为早期和晚期两部分。CHS:查尔酮合成酶;CHI,查尔酮异构酶;F3'H,类黄酮3 '羟化酶;FNS,黄酮合成酶;F3H flavanone-3-hydroxylase;DFR,二氢黄酮醇4-还原酶;ANS,花青素合成酶;GT,葡萄糖转移酶; RT, rhamnosyl transferase; AT, acyltransferase
虽然一些研究已经检查了PAL和WAL表型的遗传和分子基础[11,29,48,51,52,53],这是第一个比较这两种白花个体中完整的类黄酮谱的研究。然而,一些研究已经在野生物种中接近这一目标。例如,罕见的白花表型Iochroma calycinum积累与薄层色谱法测定的色素表型相同的黄酮醇(槲皮素)[52].虽然自然植物和园艺植物之间的比较应该仔细处理,因为它们在栽培时选择不同,但对于观赏植物有一些生化知识。几项研究报告了白花和色素系的类似黄酮醇谱,如莲花(Eustoma羊藿)及龙胆(龙胆triflora) [54,55];但部分白花株系黄酮类化合物分布不一致,可能是由于ABP基因存在明显的遗传阻塞。WAL表型中类黄酮多样性的缺乏加强了这样一种假设,即功能丧失突变可能针对特定的晚期基因,而不是ABP的早期基因,这将损害黄酮的产生。除了黄酮和花青素外,肖尔芒不产生其他种类的类黄酮[47].因此,之前影响ABP基因的任何突变F3 h应排除任何黄酮的产生(图。4),由于这些化合物对植物的发育和生存起着决定性的作用,使这种突变具有选择性的不利作用[28,37,56].
花青素类色素的损失在自然界中较为普遍[39,40,57],但它对植物适应性的影响将决定白花个体的命运。在一些物种中,PAL表型通常表现出与全色素植物相似甚至更高的适应度([40,58,59];但是,例如,[11]),在种群中形成稳定的花色多态性。在海岸剪皮草中,粉白多态多年来一直保持,白花在两个多态种群中占总数的8-21%。myb介导的花青素损失美国littorea,通常是细胞或组织特有的[60,61并允许花瓣花青素的下调,而不妨碍花青素在其他组织中的积累。我们的生化结果证实,PAL和完全着色的植物除了具有相似的黄酮含量外,在光合组织中具有相似的花青素含量,预计其很少或没有改变PAL表型适应度的多效性作用[17,34].事实上,蜗牛和毛毛虫在完全着色和PAL植物的叶子上产生了相似的食草性水平,但PAL植物的白色花瓣比完全着色植物的花瓣显示出更高的半花瓣性(M.L.B. 2019,未发表的数据)。
从我们的发现中产生的一个关键问题是,“为什么WAL表型如此罕见,即使它们具有与完全着色的植物相似数量的保护性黄酮?”黄酮具有花青素所具有的许多保护生物功能[27,56,62],并且在其他物种中普遍存在的shore campion组织中的花青素含量至少是花青素的14倍[63].在美国littorea,花瓣黄酮(异葡萄素)可能参与表皮细胞液泡稳态的调节和/或作为花青素的共色素[64,65],而积累在光合组织中的黄酮类化合物(异荭草素)是有效的抗氧化剂,可能在抗胁迫中发挥重要作用[28,62].由于这些保护性黄酮积累在WAL植物的生殖和营养组织中,花青素的损失似乎可能与WAL表型在种群中仍然稀缺的生态劣势有关。事实上,最近有人提出花青素可能在负责细胞生长和分化的信号级联调控中起决定性作用;因此,控制重要的发育过程[27,28,66,67].此外,ABP基因与其他影响适应度的位点之间的遗传连锁关系[16],以及类黄酮与其他代谢途径之间的代谢串通[68],是其他可能的解释,为什么花青素(而不是类黄酮中间物)的损失似乎限制了WAL表型的传播。综上所述,我们的研究结果表明,在肖兰的光合组织中产生花青素色素的能力与产生稳定的花瓣颜色多态性的能力有关。
结论
综上所述,我们的研究结果表明,在完全着色和白色花瓣变种之间,花青素的合成能力存在显著差异美国littorea而黄酮的产生不受花青素损失的影响。PAL和WAL个体之间类黄酮谱的差异分别是基于花瓣或整株花青素的缺乏。WAL植物在自然群体中的低频率导致我们考虑在光合组织中花青素损失或其他假定的多花相关性状的负面生态后果,并提示这些化合物在产生稳定的花色多态性方面的关键作用。分析花瓣或全株花青素损失个体的其他物种的类黄酮谱,并将这一信息与它们的种群频率联系起来,将是很有趣的。这些数据将为花朵颜色的进化提供新的见解,也可能为微进化过程提供新的知识。
方法
研究花青素缺乏表型的种类和频率
硅宾littorea是一种一年生野生植物,生长在伊比利亚半岛西北部至东南部的海岸沙丘生态系统中[47].根据人类对其栖息地的干扰程度,种群的大小从大约。100个(如Algezur, Odiel)到10,000多个个体(如Sines, Barra)。本自亲和种是昆虫性的,但可通过自发自交配产生高达20%的果实和种子[69].花萼、叶片和茎产生叶绿素,显示光合作用活性[70].
为了解释PAL和WAL表型的种群频率,我们对21个种群进行了抽样,覆盖了PAL和WAL表型的全部分布范围美国littorea(无花果。1).在估计个体超过1000个的人群中,频率估计是在随机抽样后进行的;在个体数量较少的种群中,对整个种群进行了仔细的抽样。根据花瓣和光合组织中花青素的有无,将植物视觉上分类为每种表型。PAL和WAL个体的形态(株高、开花数、花大小)与全色素表型相似。
类黄酮分析取样
在西北部的两个花瓣色多态种群(Barra和Louro)和南部的两个非多态种群(Breña和Trafalgar;无花果。1).为了进行完全类黄酮的鉴定,我们在Barra中随机选择了4株全色素、PAL和WAL表型的植物,在Breña中随机选择了4株全色素和WAL表型的植物。为了对这四个群体中的黄酮类化合物进行分光光度定量,除了罕见的WAL个体外,我们将样本扩展到每种表型的11-20株植物,其中6株、5株、6株和3株进行了分析(分别为Barra、Louro、Breña和Trafalgar)。采样时间为2016年3月至4月,在该物种花期的早期至中期(采集这些样本无需许可)。对于每一株植物,我们收集了四个样本:一朵花的花瓣和花萼,从茎中部区域的一片叶子和茎段(1厘米长)。黄酮类化合物在1.5 ml含1% HCl的MeOH中提取,并按照Del Valle等人所述的程序在−20°C的黑暗中存储。[44].来自这些种群的代金券标本存放在Pablo de Olavide大学植物标本馆(UPOS-3954, UPOS-8982, UPOS-8983和UPOS-8984)。
黄酮类化合物的HPLC-DAD-MS鉴定与定量n
在SpeedVac浓缩器(Savant ISS110, Thermo Fisher Scientific, NC, USA)中,加入100 μL超纯水(automatic, Wasserlab, Barbatáin, Spain),对每个植物组织(即花瓣、花萼、叶子和茎)进行500 μL的甲醇提取物浓缩。然后用pH = 1.4, HCl的酸化水将水浸提液的体积调至250 μL。在HPLC-DAD-MS前对水提取物进行过滤(clar惰性™Syring Filters, 0.45 μm, Agela Technologies, DE, USA)n分析。我们遵循Alcalde-Eon等人描述的程序。[71,72],该方法在其他植物材料中花青素的分析中提供了令人满意的结果,也允许在单次运行中同时检测花青素和黄酮(见结果)。HPLC分析在惠普1100系列液相色谱仪(安捷伦科技,Waldbronn,德国)中进行。在360 nm和520 nm分别进行黄酮和花青素的检测。光谱记录在220 ~ 600 nm。
质谱分析在API 3200 Qtrap中进行,配有ESI源和由Analyst v.5.1软件控制的三重四极离子阱质量分析仪(应用生物系统公司,达姆施塔特,德国)。HPLC系统通过UV单元出口与质谱仪连接。正模式(ESI)+)和特定的条件下选择允许同时检测花青素和黄酮(见附加文件9:详见补充方法)。
化合物的鉴定是根据它们的保留时间,紫外-可见光谱,m / z分子离子(M+)的花青素或m / z质子离子[M + H]+对于黄酮,化合物的碎片离子和碎片模式。这些数据提供了有关苷元和取代基性质的有价值的信息,并进一步与文献中报道的标准物的特征进行了比较[73],并按照这些标准(3- o -葡萄糖苷、异牡荆素(芹菜素6- c -葡萄糖苷)和异荭草素(木犀草素6- c -葡萄糖苷))和大麦上已知成分的样品(大麦芽l . (74])在相同条件下进行分析。此外,在所有类型的样品提取物(花瓣和营养部分)中进行碱性和酸性水解,以验证分子中酸的存在,并确定它们的身份(见附加文件)9:详见补充方法)。从花瓣和光合组织中分离出一些主要化合物,并对其进行碱性水解。
用Cyanidin 3-从520 nm记录的色谱图中检测到的峰区进行花青素定量O-葡萄糖苷(Polyphenols Labs, Sandnes, Norway)校准曲线。同样,从360 nm记录的色谱图中检测到的峰的区域进行黄酮定量。采用异牡荆素(Extrasynthese, Genay, France)和异荭草素(isovitexin, Genay, France)的校准曲线分别定量了花瓣和光合组织中的黄酮。
分别对黄酮类和花青素进行HPLC分析。在每个组织中,通过主成分分析(PCA)对不同表型的黄酮含量进行探索性分析,使用所有确定的化合物的浓度。我们保留了那些主成分含量最高的化合物。此外,消除了高度相关的化合物以克服共线性。主成分分析基于协方差矩阵,提取的分量不旋转[75].当检测到人群之间的差异时,进行验证性manova(多变量方差分析)[75].根据c -苷类黄酮核心(即异牡荆素、异荭草素和异莨菪素的衍生物和二- c -苷类化合物),将植物总黄酮组成分为四个功能基团;见表1).由于来自Barra和Breña地区的植物在黄酮含量上存在差异(见结果),而PAL表型仅存在于Barra,因此对这两个群体进行了独立分析。由于样品中只发现了少量花青素化合物,一些表型不产生花青素(见结果),因此无法进行探索性pca;相反,用anova和事后Tukey检验分析各表型间总花青素浓度的差异。在SPSS v.22.0 (Armonk, NY, IBM Corp.)中进行anova, pca和manova。
黄酮分光光度法定量
我们使用Multiskan GO微孔板分光光度计(赛默飞世尔科学公司,MA,美国)来量化全球花青素和黄酮的浓度,以便将研究扩大到更多的个体和人群。对所有个体的每个组织分别测定3个200 μL的重复量。分别在350和520 nm处读取吸光度,以确定黄酮和花青素的浓度[46],采用主要化合物(即3- o -葡萄糖苷、异牡荆苷和异荭草苷)标准物的校准曲线计算其浓度,分别表示为花青素-3-葡萄糖苷、异牡荆苷和异荭草苷等量物(鲜重)。
在R v3.4.0中进行了具有高斯或伽马误差分布的广义线性模型[76]测试每种植物组织中花青素和黄酮积累的差异;表型和种群被认为是固定因素。在此之前,我们使用赤池信息准则(Akaike’s Information Criterion)测试了在模型中产生较小偏差的误差分布。F-偏差分析测试用于校正过分散[77].使用" multicomp " R-package进行多次事后比较[78].分别对多态和非多态群体进行GLMs,使用事后比较和Bonferroni调整来测试每个群体内表型之间的差异。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。
缩写
- ABP:
-
花青素生物合成途径
- 全球语言监测机构:
-
广义线性模型
- HPLC-DAD-MSn:
-
高效液相色谱结合二极管阵列检测和电喷雾电离串联质谱
- 朋友:
-
花瓣花青素损失
- 细胞膜:
-
全植物花青素
参考文献
- 1.
孟德尔种群的进化。遗传学。1931;16:97 - 159。
- 2.
赫伦JC,弗里曼S.进化分析。纽约:皮尔逊;2013.
- 3.
形态论与进化。遗传(Edinb)。1955; 9:1-51。
- 4.
李志刚,李志刚,李志刚。负频率依赖选择在无回报兰花中保持了显著的花色多态性Dactylorhiza sambucina(l)秀。自然科学进展,2001;https://doi.org/10.1073/pnas.111162598.
- 5.
张志刚,张志刚,张志刚,等。单基因介导的授粉昆虫吸引的转变佩妮.《植物科学》2007;19(3):779 - 90。https://doi.org/10.1105/tpc.106.048694.
- 6.
Mitchell-Olds T, Willis JH, Goldstein DB。哪些进化过程影响表型性状的自然遗传变异?Nat Rev Genet. 2007; 8:845-56。
- 7.
兰恩AL, Tellier A.异质选择促进宿主-寄生虫相互作用的多态性维持。Oikos。2008;117:1281-8。
- 8.
Chouteau M, Arias M, Joron M.自然界中警告信号处于正频率依赖选择下。中国科学(自然科学版)2016;https://doi.org/10.1073/pnas.1519216113.
- 9.
福特EB。生态遗传学。伦敦:查普曼和霍尔;1975.
- 10.
种群的进化和遗传学。羊皮纸书卷4。自然种群之间的变异。芝加哥:芝加哥大学出版社;1978.
- 11.
Kellenberger RT, Byers KJRP, De Brito Francisco RM, Staedler YM, LaFountain AM, Schönenberger J,等。通过传粉媒介介导的显性性出现花卉颜色多态性。Nat Commun. 2019;10:63。https://doi.org/10.1038/s41467-018-07936-x.
- 12.
Do R, Balick D, Li H, Adzhubei I, Sunyaev S, Reich D.没有证据表明选择在消除欧洲人的有害突变方面不如非洲人有效。Nat Genet. 2015; 47:26 6 - 31。
- 13.
Sharp NP, Agrawal AF.适应度分量中遗传方差维持的突变-选择平衡模型的实验检验。生物工程学报(自然科学版)2018;
- 14.
花卉颜色的进化转变。植物科学学报,2008;49(2):344 - 344。
- 15.
斯特恩DL, Orgogozo V.进化的位点:基因进化如何可预测?进化。2008;62:2155 - 77。
- 16.
麦金农JS, Pierotti MER。颜色多态性及其相关特征:遗传机制和进化。分子生物学,2010;19:551 - 25。
- 17.
群体遗传学、多效性和适应进化过程中突变的优先固定。进化。2010;65:629-42。
- 18.
植物群落失范。John Smith & Son:伦敦;1817.
- 19.
Mendel G. Versuche über Plflanzenhybriden。Verh natf ver Brunn abh。1866; 3: S3。https://doi.org/10.2307/2528198.
- 20.
Coonen LP。亚里士多德的生物学。生物科学。1977;27:733-8。https://doi.org/10.2307/1297678.
- 21.
杜斌。花卉颜色变异:进化实验研究的一个模型。自然科学进展,2000;https://doi.org/10.1073/pnas.97.13.7016.
- 22.
Fenster CB, Armbruster WS, Wilson P, Dudash MR, Thomson JD。授粉综合征和花的专门化。科学通报。2004;35:375-403。https://doi.org/10.1146/annurev.ecolsys.34.011802.132347.
- 23.
花色素的遗传学和生物化学。植物学报。2006;57:761-80。https://doi.org/10.1146/annurev.arplant.57.032905.105248.
- 24.
哈本JB,格雷尔RJ。类黄酮和昆虫。进:哈伯恩·JB,编辑。类黄酮。1986年以来的研究进展。伦敦:Chapman & Hall;1994.p . 589 - 618。
- 25.
威尔伯特SM, Schemske DW, Bradshaw HD。两种不同传粉者的猴花花青素。生物化学学报,1997;25:437-43。
- 26.
Schemske DW, Bradshaw HD。猴花传粉者偏好与花型性状演化(Mimulus).自然科学进展,1999;26(3):344 - 344。https://doi.org/10.1073/pnas.96.21.11910.
- 27.
兰迪,塔蒂尼M,高德k。花青素在植物-环境相互作用中的多重功能作用。环境科学学报。2015;19(4):344 - 344。https://doi.org/10.1016/j.envexpbot.2015.05.012.
- 28.
周勇,李志强,李志强。类黄酮和甜菜素在植物抗非生物胁迫中的作用。植物年鉴2018;1:1-41。
- 29.
一种等位基因产生白花的多效性效应番薯紫竹.进化。2008;62:1076 - 85。
- 30.
Sobel JM, Streisfeld MA。花色作为植物进化演化研究的模型系统。植物科学进展(英文版);
- 31.
植物的花青素色素。剑桥:剑桥大学出版社;1916.
- 32.
Burdon JJ, Marshall DR, Brown AHD。种群的人口学和遗传变化Echium Plantagineum.生态学杂志,1983;71:667-79。https://doi.org/10.2307/2259584.
- 33.
李文达,布拉克等。自然选择反对白花瓣夹竹桃.进化。1995;49:1017-22。https://doi.org/10.1111/j.1558-5646.1995.tb02336.x.
- 34.
Wessinger CA, Rausher MD.花色进化对选择目标的启示。中国科学(d辑),2012;https://doi.org/10.1093/jxb/err267.
- 35.
刘东,刘海燕,刘海燕,等。植物花青素调控转录因子调控的研究进展番薯.新植物,2011;191:264-74。
- 36.
常思敏,陆勇,Rausher MD.花青素调控基因非结合区中性进化Ipmyb1番薯。遗传学。2005;170:1967 - 78。
- 37.
黄酮醇:老用途的老化合物。Ann Bot, 2011; 108:1225-33。
- 38.
Strauss SY, Whittall JB。非传粉媒介对花性状选择的影响。进:Harder LD, Barret HSC,编辑。花卉的生态与进化。牛津大学出版社:牛津;2006.120 - 38页。https://doi.org/10.1111/j.1439-0418.1973.tb01782.x.
- 39.
Warren J, Mackenzie S.为什么不是所有的颜色组合都平等地代表花朵颜色的多态性?新植物,2001;151:237-41。
- 40.
王海红,王志刚,王志刚,王志刚。地中海盆地花的颜色多态性:发生、维持及物种形成的意义。植物生物学,2018;20:8-20。
- 41.
恩斯特。田间群体花色多态性的稀缺性紫花洋地黄)植物学报。1987;179:231-9。
- 42.
王晓燕,王晓燕,王晓燕,王晓燕,等。猕猴花种群中色素缺失现象的研究进展。Am Nat 2018; 191:135-45。https://doi.org/10.1086/694853.
- 43.
李文杰,李志强,李志强,等。自花授粉植物花色多态性的生态成因与后果(Boechera一成不变).新植物,2018;218:380-92。
- 44.
陈志刚,陈志刚,陈志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚。硅宾littorea).植物科学进展(英文版);https://doi.org/10.3389/fpls.2015.00939.
- 45.
Berardi AE, Hildreth SB, Helm RF, Winkel BSJ, Smith SD。黄酮在花和叶中产生的进化相关性(茄科)。植物化学。2016;130:119-27。
- 46.
陈志强,李志强,李志强,等。光致黄酮在石竹科植物中的表型可塑性研究。环境实验机器人。2018;153:100-7。https://doi.org/10.1016/j.envexpbot.2018.05.014.
- 47.
Casimiro-Soriguer I, Narbona E, Buide ML, Del Valle JC, Whittall JB。植物花色多态性的转录组和生化分析硅宾littorea(石竹科)。前沿植物科学,2016;7:204。https://doi.org/10.3389/fpls.2016.00204.
- 48.
Dick CA, Buenrostro J, Butler T, Carlson ML, Kliebenstein DJ, Whittall JB。北极芥菜花色多态性受花青素生物合成通路阈值花瓣特异性下调控制。科学通报。2011;6:e18230。
- 49.
Van Houwelingen A, Souer E, Spelt K, Kloos D, Mol J, Koes R.花色素沉着随机转座子突变体分析佩妮矮牵牛.植物学报1998;13:39-50。
- 50.
西原M,山田E,齐藤M,藤田K,高桥H,中冢t。白花托雷乃属植物突变的分子特征。BMC植物生物学。2014;14:86。https://doi.org/10.1186/1471-2229-14-86.
- 51.
CA Wu, MA Streisfeld, LI Nutter, KA Cross。一种罕见花卉花色多态性的遗传基础Mimulus lewisii提供进化的可重复性的见解。科学通报。2013;8:e81173。
- 52.
科本RA,格里芬RH,史密斯SD。安第斯山脉茄科一种罕见花突变体的遗传基础。中国科学(d辑),2015;
- 53.
查尔酮合成酶突变株的分析番薯紫竹揭示了黄酮类化合物的新功能:改善热应激。分子生物学,2003;12:1113-24。
- 54.
Davies KM, Bradley JM, Schwinn KE, Markham KR, Podivinsky E.五种莲花花瓣黄酮类化合物的生物合成(Eustoma羊藿操纵者。)。植物科学进展(英文版);1993;
- 55.
Nakatsuka T, Nishihara M, Mishiba K, Yamamura S.两种不同的突变参与了白花龙胆植物的形成。植物科学进展(英文版);2005;
- 56.
黄酮:从生物合成到健康益处的研究。植物。2016;27。https://doi.org/10.3390/plants5020027.
- 57.
Carlson JE, Holsinger KE。从当地生态过程推断南非Protea颜色多态性的属内模式。生物工程学报(自然科学版)2015;
- 58.
戈麦斯JM。表型选择和对选择的反应Lobularia maritima:自然选择的直接和相关成分的重要性。中国生物医学杂志,2000;13:689-99。
- 59.
Carlson JE, Holsinger KE。南非灌木中传粉者和种子捕食者对花色素沉着的直接和间接选择。环境科学。2013;171:905-19。
- 60.
Albert NW, Davies KM, Lewis DH, Zhang HB, Montefiori M, Brendolise C,等。转录激活因子和抑制因子的保守网络调节花青素的色素沉着。植物学报。2014;26:962-80。
- 61.
马丁斯TR,蒋P, Rausher MD.花瓣如何改变它们的斑点:顺式调节重新布线山字草(柳叶菜科)。新植物,2017;216:510-8。
- 62.
黄酮在植物抗氧化剂中的地位及其功能意义。植物科学进展(英文版);2012;https://doi.org/10.1016/j.plantsci.2012.07.014.
- 63.
为什么有些叶子是花青素的,为什么大多数花青素叶子是红色的?植物。2006;201:163 - 77。
- 64.
黄酮类异牡荆素对非糖基化基因型黄酮类异牡荆素的形态效应硅宾pratensis(石竹科)。Experientia。1982;38:929-31。
- 65.
叶亚谷,齐藤M,岩谷T,山口M.日本花园鸢尾花色稳定性的研究,虹膜ensata研究。Euphytica。2000;115:1-5。
- 66.
Taylor LP, Grotewold E.黄酮类化合物作为发育调节剂。植物学报,2005;8:317-23。
- 67.
姚鹏,邓睿,黄勇,史佳,史刚,等。苦荞糖基转移酶基因的多样性生物学效应。BMC植物生物学2019;19:339。
- 68.
Mouradov A, Spangenberg G.类黄酮:介导植物适应其不动产的代谢网络。前沿植物学报2014;620。https://doi.org/10.3389/fpls.2014.00620.
- 69.
Casimiro-Soriguer, I., Buide, M. L, and Narbona, E.(2013)。雌花和雌雄同体花在雌雄同体花中的作用硅宾littorea,对性表达的物候学的见解。植物学报15,941-947。https://doi.org/10.1111/j.1438-8677.2012.00697.x
- 70.
纳博纳,E,雅卡,J.,德尔·瓦勒,J. C,瓦拉达雷斯,F.和布德,M.。l .(2018)。全株发红硅宾germana是由于花青素的积累对可见光的响应。植物学报,20,968-977。https://doi.org/10.1111/plb.12875.
- 71.
Alcalde-Eon C, rias - gonzalo JC, Muñoz O, Escribano-Bailón MT。Schizanthus grahamii而且Schizanthus hookeri.它们的花青素组成与不同的授粉综合征是否有关系?植物化学,2013;85:62 - 71。https://doi.org/10.1016/j.phytochem.2012.09.013.
- 72.
阿尔卡尔德- eon C, García-Estévez I,里瓦斯-贡萨洛JC。Rodríguez De La Cruz D, Escribano-Bailón MT.该属花药的花青素化学分类学标记杨树l区分杨树黑质,杨树阿尔巴而且杨树tremula.植物化学。2016;128:35-49。
- 73.
王晓燕,王晓燕,王晓燕,等。黄酮类化合物的系统鉴定。纽约:Springer-Verlag出版社;1970.
- 74.
费瑞思,裴建伟,Valentão P,杨建伟。大麦研究进展(大麦芽l .)离开O糖基-C-糖基黄酮采用液相色谱-紫外二极管阵列检测-电喷雾电离质谱。中国生物医学工程学报(英文版);2008;
- 75.
Valcárcel V, Vargas P.一般谱系概念下的数量形态和物种划分:优化常春藤(五茄科)。中国科学(d辑),2010;
- 76.
R核心团队。R:用于统计计算的语言和环境。2017.http://www.r-project.org.
- 77.
克劳利乔丹。R书。奇切斯特:威利;2007.
- 78.
霍thorn T, Bretz F, Westfall P.一般参数模型的同时推断。生物学报。2008;50:346-63。
确认
作者感谢Ágata Cardoso, Rebeca Ferreras和Antonio Gallardo的现场和实验室协助。我们也感谢审稿人提出的有用的意见和建议。
资金
资金支持由西班牙政府MINECO项目(CGL2012-37646和CGL2015-63827-P)提供,也通过博士预科培训计划授予JCV (BES-2013-062610)。
作者信息
从属关系
贡献
EN、MLB和JBW构想并设计实验;JCD、CAE和MTEB采集植物材料并进行生化分析;JCD, EN, JBW和CAE共同撰写了这篇文章。JCD在田间进行了种属鉴定。所有作者都参与了手稿的准备工作,并最终批准出版。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
花瓣花青素丢失(PAL)和全株花青素丢失(WAL)个体在花瓣花青素丢失多态性和自发白色突变体自然居群中的频率
附加文件2:表S2。
花花青素损失(PAL)和全株花青素损失(WAL)表型的位点、地理位置、估计种群规模和百分比美国littorea.
附加文件3:图S1。
白花植物的图片美国littorea其中花瓣花青素损失表型(PAL)与全株花青素损失表型(WAL)在光合组织中花青素积累方面存在差异。
附加文件4:表S3。
高效液相色谱- dad - ms鉴定花青素和黄酮n从花瓣和光合组织(花盏,叶和茎)的甲醇提取物美国littorea植物。
附加文件5:图S2。
在360 nm处记录的Breña居群WAL标本花瓣提取物色谱图。
附加文件6:图S3。
在360 nm处记录的来自Barra群体的完全着色标本的叶子提取物的色谱图。
附加文件7:图S4。
用花瓣、花盏、叶和茎中黄酮类成分提取pca主成分的散点图美国littorea通过HPLC-DAD-MS分析表型n.
附加文件8:表S4。
MANOVAs结果比较了Barra(完全色素化,PAL和WAL)和Breña(完全色素化,WAL)表型中黄酮的相对比例。
附加文件9。
补充方法。质谱条件的细节,黄酮的分离,以及碱性和酸水解。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
德尔·瓦勒,j.c.,阿尔卡尔德- eon, C., Escribano-Bailón, M.T.et al。花瓣颜色多态性的稳定性:光合组织中花青素积累的意义。BMC植物生物学19日,496(2019)。https://doi.org/10.1186/s12870-019-2082-6
收到了:
接受:
发表:
关键字
- 花青素
- 类黄酮
- 花色多态性
- 色素沉着丧失
- 非传粉媒介介导的选择
- 植物次生代谢产物
- 基因多效性