摘要
背景
大豆(大豆油菜是最重要的产油经济作物之一。然而,盐渍化严重制约了大豆的生产。因此,鉴定大豆耐盐相关基因并揭示其耐盐分子机制至关重要。更好地了解植物如何抵抗盐胁迫,为改进现有大豆品种以及培育新的耐盐品种提供了思路。在本研究中,研究了GmNHX1一种nhx样基因,以及其分子基础GmNHX1-介导的盐胁迫抗性已经被揭示。
结果
我们发现GmNHX1大豆在盐胁迫条件下表达上调,在盐处理后24 h达到峰值。利用病毒诱导的基因沉默技术(VIGS),我们还发现沉默后的大豆植株对盐胁迫更加敏感GmNHX1与野生型相比,在盐处理下,更多沉默的植物比野生型枯萎。此外,拟南芥表达GmNHX1与野生型相比,在盐胁迫条件下长得更高,产生更多的莲座叶片。外生的表达GmNHX1导致钠含量增加+随着钠含量的降低,转运到叶片的能力减弱+根系吸收,从而维持高钾+/ Na+在盐胁迫条件下。GmNHX1-GFP转化的洋葱鳞茎内皮细胞呈现荧光模式,其中GFP荧光信号在液泡膜中富集。采用无创显微检查技术(NMT),我们发现Na+盐处理后野生型和转化型植物的排出率均显著高于盐处理前。此外,钠+盐处理后转化植株的排出率显著高于野生型。同时,三个渗透胁迫相关基因的转录水平,SKOR, SOS1和AKT1都被上调了吗GmNHX1-在盐胁迫条件下表达的植物。
结论
空泡的membrane-localizedGmNHX1通过维持高钾来提高植物的耐盐性+/ Na+比例随着诱导的表达SKOR, SOS1和AKT1.我们的发现提供了关于GmNHX1以及类似的钠/氢交换剂在调节耐盐性方面的作用。
背景
植物在生长过程中会受到各种生物和非生物的胁迫。由于全球盐碱化日益加剧[1],再加上寒冷和干旱等非生物胁迫,盐胁迫造成的破坏明显更严重。植物保留了许多耐受盐胁迫的方法,包括盐的外排和细胞内的分配[2].耐盐,与许多其他代谢过程相似,需要适当控制细胞的pH值[3.].Na+/小时+交换剂(NHXs)是催化钾的电中性交换的完整膜转运体+或Na+对H+并与细胞膨胀有关[4)、发展(5,离子内稳态[6]及耐盐性[7].的拟南芥基因组包含8个NHX同源编码基因,根据其序列相似性和定位,将其分为3类,分别富集于质膜(NHX7/SOS1和NHX8)、内体/囊泡(NHX5, NHX6)和液泡膜(NHX1, NHX2, NHX3, NHX4) [2].在拟南芥,一般认为,定位于液泡和质膜的NHXs对维持钠离子是至关重要的+/ K+体内平衡(8].而NHX5和NHX6则作为高尔基、反高尔基网络和液泡前室的pH调节因子,调节新合成肽的分选和高尔基货物的移动方向[9].
尽管如此甘氨酸大豆(野生大豆)通常不受盐胁迫的影响[10,它的近亲大豆(大豆)通常对渗透敏感[11].因此,鉴定和鉴定与大豆耐盐调控相关的内源基因对大豆的遗传育种具有重要意义。过度的GmNAC15,大豆NAC转录因子家族成员,增强大豆毛状根的耐盐性[12].此外,过度的GmSK1,多亚基E3连接酶之一,转化为烟草后可增强对高盐和干旱胁迫的耐受性(酶联)植物13].过度的GmBIN2,一种与油菜素内酯敏感性相关的丝氨酸/苏氨酸激酶,增加细胞钙2+降低钠的含量+含量,共同提高转基因植物的耐盐性拟南芥植物(14].我们实验室之前的研究表明,过度表达GmNHX1(基因ID: LOC100816746)能够弥补酿酒酵母ena1-4, nhx1和nha1突变,减少盐胁迫对细胞生长的阻碍作用[15].在这个研究中,我们扩展了我们对功能的理解GmNHX1基因及其在调控耐盐性中的作用。我们揭示了它的亚细胞定位以及它的转录如何响应大豆的盐胁迫。我们进一步使用拟南芥作为宿主,对植物的功能和机制进行了评价GmNHX1在盐胁迫条件下。我们揭示了GmNHX1利用该模式生物,维持较高的钠含量+外流速率和K+/ Na+在盐胁迫下的比率。我们的发现为理解植物耐盐性的分子基础提供了重要的启示。
结果
GmNHX1该基因与植物抗盐胁迫有关
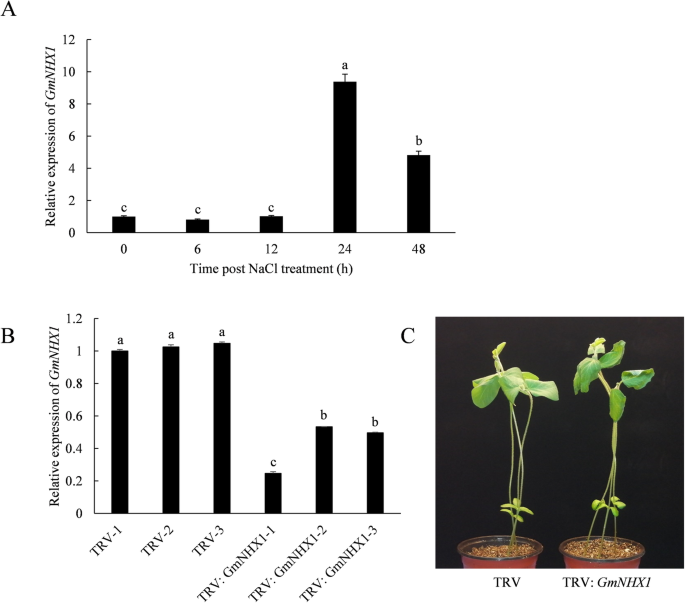
为了检验两者的关系GmNHX1和大豆对盐胁迫的响应,我们检测了转录水平GmNHX1在大豆品种“吉斗7号”中。我们观察到增加了GmNHX1盐处理后基因表达量最高,为处理前(0 hpt)的10倍左右。的表达GmNHX1然后在48 hpt时开始下降到0 hpt时的约5倍(图3)。1a).的上调GmNHX1盐胁迫下的表达表明其与大豆的盐胁迫反应有关,并可能在调节大豆的耐盐性方面发挥作用。
然后我们在GmNHX1编码区域,构建TRV-VIGS矢量,并表达GmNHX1基因沉默后采用RT-qPCR检测。结果表明,常规TRV-VIGS对大豆植株有较好的沉默效果。与EV(非沉默植物)相比,TRV载体携带GmNHX1特异性片段降低表达水平GmNHX1在染病的大豆中,其含量增加了近50%。1由于…的沉默GmNHX1与EV相比,200 mM NaCl溶液处理后植株顶部下垂,叶片枯萎(图2)。1c),这表明GmNHX1是参与植物适应盐胁迫过程的关键基因。
GmNHX1提高植物的耐盐性拟南芥
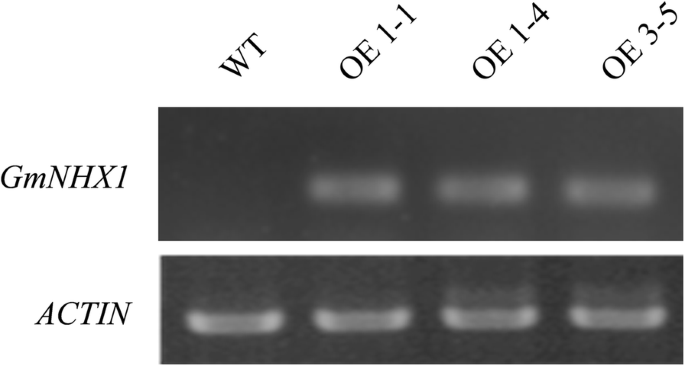
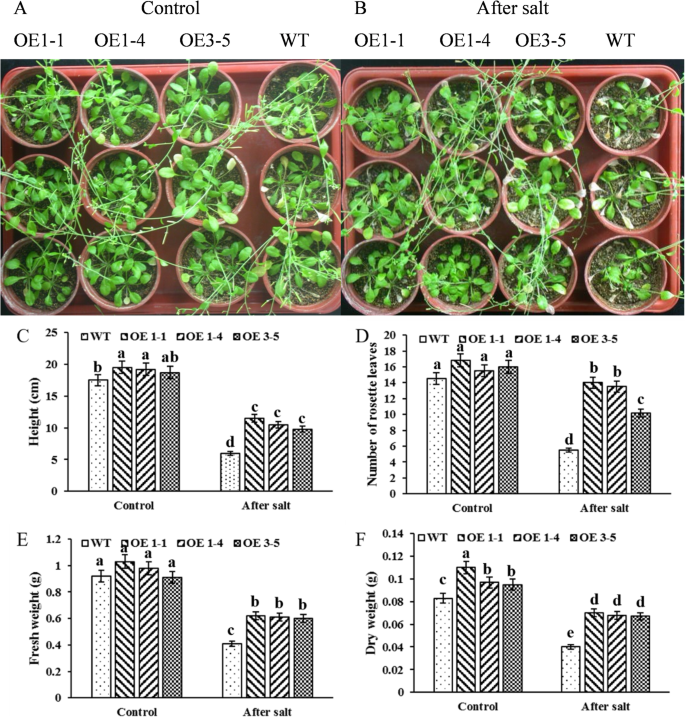
自从沉默GmNHX1降低大豆对盐胁迫的抗性,我们想知道该基因的外源表达是否会导致相反的结果。我们构造了的编码序列GmNHX1基因进入T-DNA,在T-DNA中GmNHX1表达式由CaMV 35 s启动子,然后这个结构被转化成拟南芥Col-0。的表达GmNHX1通过RT-PCR验证。我们观察到该基因在转化植物中显著表达,但在未转化的col-0中表达水平无法检测(图。2).为了调查是否GmNHX1过度表达可以增强21天的耐盐性拟南芥植物表达GmNHX1采用170 mM NaCl溶液灌溉20 d,以水灌植株为对照。盐胁迫处理后,野生型植株出现萎蔫和褪绿表型,而表达品系仅出现轻微的褪绿表型GmNHX1体内(无花果。3.a, b).还测定了茎长、莲座叶数、鲜重和干重等参数。植物表达GmNHX1茎长的测量值显著升高(图。3.c)、莲座叶(图。3.d)、鲜重(图。3.e)和干重(图。3.F),与盐胁迫处理下的野生型相比。综上所述,我们得出结论GmNHX1增强植物对盐胁迫的抵抗力。
GmNHX1通过维持钾离子来增强耐盐性+/ Na+比根
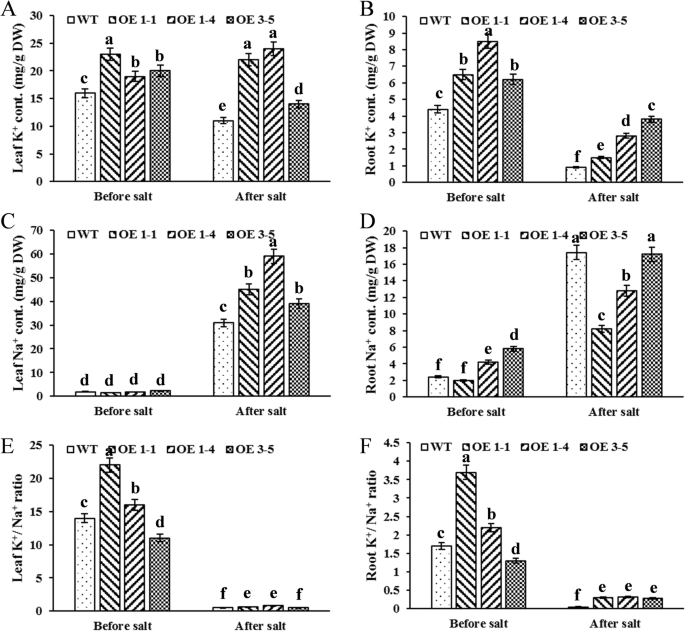
在揭示了……的积极作用之后GmNHX1在耐盐性方面,我们想知道其背后的分子机制GmNHX1介导的耐盐性。GmNHX1具有一个典型的NHX结构域,该结构域编码一个抽吸Na的功能单元+用质子来交换浓度压力。因此我们测量了K+和钠+内容GmNHX1表达盐胁迫前后的植物。K+三种方法的内容GmNHX1盐胁迫处理前后,根和叶中表达品系的表达量显著增加(图2)。4a, b).至于Na+内容,全部三行表达GmNHX1与野生型相比,盐胁迫处理前叶片无显著差异(图。4c),但三条线的Na值都较高+与野生型相比,盐胁迫处理后叶片的叶绿素含量显著增加(图。4c).在此期间,没有+盐胁迫处理后,3个表达品系中有2个的根系含量显著降低GmNHX1(OE 1-1和OE 1-4)。4d).这些结果表明,外源表达GmNHX1可能提升Na+转运至叶片,降低钠含量+内容的根源。
维持一个高K+/ Na+植物细胞内的比例是介导植物耐盐性的关键因素之一[16,特别是对根组织。而K+/ Na+比(图。4e), K+/ Na+三种植物的根中比例均显著较高GmNHX1盐胁迫处理后,与野生型比较(图。4f). GmNHX1因此有助于高K+/ Na+根的比例,与我们上面的结果一致。
液泡膜定位的GmNHX1调控K+和钠+流出
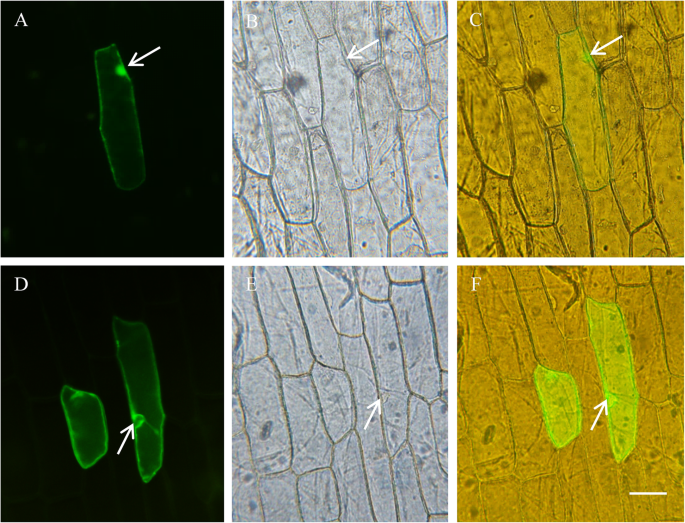
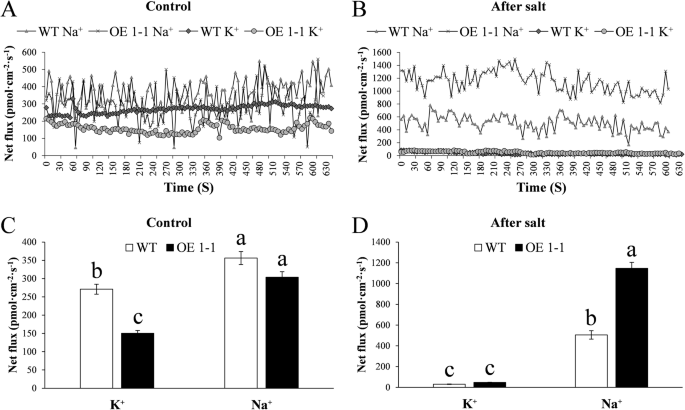
植物通过调节钠来克服盐胁迫+和钠的分配+在空泡的(2].鉴于上述观察结果,我们想知道GmNHX1是否通过调节这两个离子分子的外流来调节盐耐受性,或修改细胞的离子存储。为了解决这个问题,我们检测了GmNHX1的亚细胞定位。将一个eGFP融合到GmNHX1的c端,得到的融合蛋白在aCaMV 35 s启动子。转化的洋葱鳞茎内皮细胞表现出GFP荧光,信号在液泡膜中富集(图)。5).探讨钠的吸收规律+和K+在盐胁迫下拟南芥等位基因表达GmNHX1,我们用NMT检测Na的流动变化+和K+100mm NaCl处理25 h后。结果表明,K+转化植株中Na含量显著低于野生型,Na含量差异不显著+盐处理前后的外排。K+转化型和野生型的外流拟南芥盐处理后钠的含量明显低于盐处理前,但钠的含量明显低于盐处理前+转化植株的排出量大于野生型。钠的速率+转化型和野生型的外流拟南芥盐处理后钠的含量显著高于盐处理前,且钠的含量显著高于盐处理前+盐处理后转化植株的排出量显著高于野生型(图。6).这个结果表明拟南芥植物表达GmNHX1,一种液泡膜定位蛋白,维持K+/ Na+通过提高钠的比值+随着钠离子的减少,根中钠离子的外流速率增加+因此避免了细胞中过量盐的毒性作用。
GmNHX1调控应激反应基因
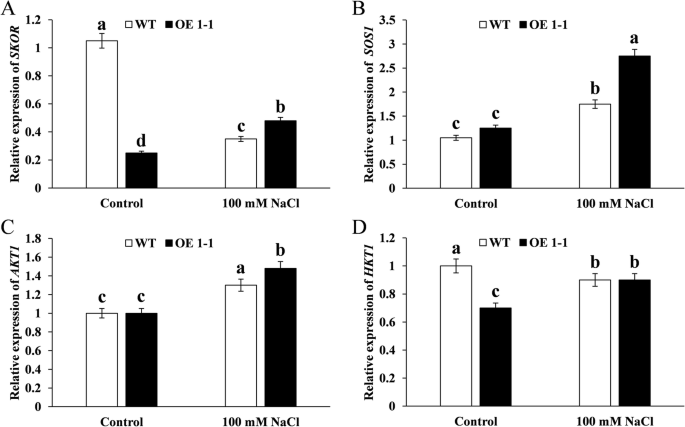
上面看似矛盾的观察,GmNHX1定位于液泡膜,而它能够介导Na+这促使我们怀疑是否有其他机制参与其中。植物的盐胁迫防御过程依赖于一系列应激反应基因的调控[17].为了揭示GmNHX1与应激响应基因的关系,我们采用RT-qPCR定量分析GmNHX1基因的表达AKT1,HKT1,SOS1和SKOR,与盐胁迫反应密切相关[2].在盐胁迫处理前SKOR和HKT1转化植株的产量显著低于野生型SOS1,AKT1两者之间无显著差异(图。7).盐胁迫处理提高了SOS1和AKT1,并减少了的表达SKOR和HKT1.盐处理后,GmNHX1上调表达SKOR, SOS1和AKT1,但不HKT1.
讨论
Na+/小时+交换剂(NHX)主要通过增加钠离子来调节细胞内离子稳态+细胞的排泄(例如SOS1) [18或分隔Na+进入液泡,如AtNHX1,以提高植物的耐盐性[19].Apse等认为AtNHX1对植物抗盐胁迫至关重要[20.].自GmNHX1在其序列中具有经典的钠/氢交换器(NHX)特征,因此我们想知道GmNHX1也与抗盐胁迫有关。本研究利用VIGS技术研究了GmNHX1在盐胁迫下大豆中的作用。VIGS是一种快速、简单和可靠的方法,已被用于许多功能生物学研究,但由于难以找到兼容的植物病毒染色剂,它仍然受到限制[21].和富(烟草使病毒)介导的VIGS已被广泛应用于许多功能生物学研究[22,根据Liu等人的研究,也适用于大豆。[23].我们发现植物的耐盐性在GmNHX1表明该基因与植物抗盐胁迫能力密切相关。以往的研究表明,菊花的异种表达DgNHX1能提高烟草的耐盐性,导致Na+和K+在烟叶中积累[24].ZxNHX1和ZxVP1-1能提高根系的耐盐性和抗旱性,增加Na的积累+K+和Ca2+在叶子25].同样,耐盐植物海马的异体表达SbNHX1能提高耐盐性吗麻风树,增加钠+K含量降低+200mm NaCl胁迫下叶片的含量[26].落花生hypogaea植物表达AtNHX1耐干旱,Na+和K+在树叶中增加[27].Stress-inducible表达TaNHX2显著改善生长性能和Na+和K+叶和根组织的含量2转基因茄子(茄属植物melongenaL.)在盐胁迫下,与非转化植物相比[28].甜高粱中NHX主要参与Na的运输+,促进钠+随着盐浓度的增加而产生的内稳态[29].我们的工作表明,Na+和K+根系中钾含量显著增加+/ Na+在植物表达中比例也显著增加GmNHX1在盐胁迫下,根据这些报告。
以往的研究表明SOS1,膜钠+/小时+交换蛋白,介导钠的外流+在根30.,前人研究表明,高效的K+通道蛋白HKT1位于细胞膜上,在维持K的稳态中起着重要作用+和钠+在植物的地上部分[31,32,33].SOS1和HKT1位于细胞膜上,在调控K中起关键作用+土壤对根细胞的吸收和钾+和钠+体内平衡(34].AKT1编码一个内部整流器K+通道蛋白,主要调控体内K+流入根细胞[35].SKOR作为外部整流器K+通道蛋白主要参与K+从柱状细胞到木质部的装载[36].Yuan等[37证明ZxNHX1调控整株K+/ Na+离子转运蛋白等基因的表达SKOR,SOS1,AKT1和HKT1明显衰减。在NMT结果中,K的净通量+与RT-qPCR结果一致GmNHX1下调表达SKOR和HKT1基因在拟南芥在正常情况下,但几乎没有影响SOS1和AKT1.盐胁迫诱导表达SOS1和AKT1,减少了的表达SKOR和HKT1.在盐胁迫下,与WT相比,SKOR,SOS1和AKT1在GmNHX1转化植株显著增加,但没有HKT1,这也许可以解释为什么钠外流+在盐处理后的转化植株中明显大于野生型植株。
我们表明,GmNHX1过表达增强耐盐性拟南芥.我们推测,一方面,通过增加Na的外流+在根细胞中,钠+因此,钾在根中的含量降低了+/ Na+比例增加;另一方面,Na+K+/ Na+比例保持稳定。在盐胁迫下,钠的外流速率+根系中Na的表达显著增加,可能与膜间Na的表达有关+/小时+换热器SOS1由GmNHX1诱导。本研究结果进一步证实了转基因植株的耐盐性拟南芥主要是通过调节纳+分布于植物。
结论
综上所述,大豆钠+/小时+换热器GmNHX1响应和调节植物对盐胁迫的耐性。在改变了拟南芥它表达了GmNHX1, GmNHX1改变了K的流量+和钠+在根细胞中通过改变表达SKOR和SOS1,以调节K的积累+和钠+在根和叶中,以及维持高钾+/ Na+同时提高植物对盐胁迫的耐受力。
方法
植物材料的栽培和盐处理
大豆的简历。吉豆7号来自河北省农林科学院粮油作物研究所,在25℃恒温条件下,光照14 h /暗10 h, 700 μmol光子m−2年代−1.将10日龄大豆幼苗转入霍格兰营养液24 h,再转入含170 mM NaCl的霍格兰营养液,分别在0 h、6 h、12 h、24 h和48 h取样,然后进行RT-qPCR分析。拟南芥生态型Col-0取自拟南芥生物资源中心(ABRC;http://abrc.osu.edu).野生型和转化型拟南芥种子表面消毒后,种植在MS培养基上,转移到蛭石上20天,在Hoagland营养液中浇灌。盐处理,21天拟南芥用170 mM NaCl溶液灌洗,测定植株的株高、莲座数、鲜重和干重+和钠+盐胁迫开始后20 d,测定盐胁迫相关基因的含量和表达量。
病毒诱导基因沉默
一个特定的片段GmNHX1是引物对扩增的吗GmNHX1- f和GmNHX1- r(表1),与PrimeSTAR HS DNA聚合酶(TaKaRa)。用来保持沉默的病毒载体GmNHX1pTRV2 -GmNHX1,通过插入的扩增片段构建GmNHX1转化为pTRV2向量BamH我和Kpn我识别网站。TRV-VIGS是根据以前的报告进行的[22].大豆幼苗侵染后,用170 mM NaCl溶液处理24 hGmNHX1RT-qPCR检测沉默效率。
rt - pcr和RT-qPCR
用UNlQ-10 Column Trizol Total RNA Isolation Kit (Sangon)从植物材料中分离总RNA,用PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa)进行逆转录。RT-PCR和RT-qPCR分别使用Ex Taq DNA聚合酶(TaKaRa)和SYBR Premix DimerEraser (TaKaRa)根据使用说明书进行肌动蛋白参考基因。表中列出了RT-PCR和RT-qPCR实验中用到的引物1.
拟南芥转换
全长光盘GmNHX1采用引物对OE GmNHX1 F/ R进行PCR扩增(表1),并在限制性内切酶识别位点之间构建二元载体pCAMBIA1300Kpn我和Xba我,在控制之下CaMV 35 s启动子。
体内K+和钠+
干燥的植物材料被磨成细粉。将浓硫酸加入磨粉中,170℃煮沸20 min。加入少量30%双氧水,直至出现大量白烟,220℃消化40 min, 330℃消化2 h。钠含量+和K+离子测量使用火焰分光光度计(Sherwood M410)。
GmNHX1的亚细胞定位
采用引物对GFP GmNHX1 F/ R PCR扩增GmNHX1全长CDS(见表)1),并构建成pCAMBIA1300-绿色荧光蛋白,在限制性内切酶识别位点之间以区域我和SmaI,并融合到GFP的N '端,形成融合蛋白,在调控下表达CaMV 35 s启动子。纯化pCAMBIA1300 -GmNHX1-绿色荧光蛋白用粒子枪(BioRad PDS- 1000/He)轰击质粒。转化后的洋葱鳞茎内皮细胞在1/ 2ms培养基中培养24 h,荧光显微镜(Olympus BX53)分析。
测量钠+和K+流量
Na的通量+和K+用NMT测量。7-day-old拟南芥将幼苗转移到含100 mM NaCl的MS培养基上,由徐悦(北京)科学进行NMT试验。& tech co., ltd.,根据以前的报告[38].
数据和材料的可用性
在本研究中使用和/或分析的数据集可从通讯作者在合理要求。
缩写
- 成:
-
小时后处理
- NHX:
-
Na+/小时+换热器
- NMT:
-
非侵入性的微观检测技术
- 聚合酶链反应:
-
聚合酶链反应
- 和:
-
烟草使病毒
- 中收取:
-
病毒诱导基因沉默
参考文献
- 1.
徐颖。环境类型学对作物植物环境影响的解译。Theor Appl Genet. 2016; 129:653-73施普林格。
- 2.
徐国强,徐国强,徐国强。植物耐盐机制。植物科学进展。2014;19:371-9。
- 3.
陈旭,鲍华,郭建军,贾伟,邰峰,聂林,等。Na+/小时+交换剂1参与烟草疾病防御疫霉parasitica通过影响液泡pH值和启动抗氧化系统来改变烟草。J Exp Bot. 2014; 65:6107-22。
- 4.
Walker DJ, Leigh RA, Miller AJ。液泡状植物细胞中的钾稳态(胞质K+/胞质pH /植物液泡)。植物医学杂志。1996;93:10510-4。
- 5.
王志强,王志强,王志强,等。的拟南芥细胞内钠+/小时+反转运体NHX5和NHX6是植物生长发育所必需的核内体。植物细胞。2011;23:224-39。
- 6.
阿尔梅达DM,玛格丽达奥利维拉M,西博NJM。Na的监管+和K+植物内稳态:提高作物植物的耐盐性。Genet Mol Biol. 2017; 40:326-45。
- 7.
高军,孙军,曹鹏,任磊,刘超,陈胜,等。组织Na变异+内容与活动SOS1菊花两种近缘属的基因。BMC Plant Biol. 2016; 16:1-15。
- 8.
梁永春,梁永春,梁永春,等。的拟南芥Na+/小时+反转运体NHX1和NHX2控制液泡pH和K+调节生长、花的发育和繁殖的内环境平衡。植物细胞。2011;23:3482 - 97。
- 9.
Reguera M, Bassil E, Tajima H, Wimmer M, Chanoca A, Otegui MS, et al. NHX-type Antiporters的pH调节是受体介导的蛋白运输到液泡所必需的拟南芥.植物细胞。2015;27:1200-17。
- 10.
纪伟,李勇,李军,戴春华,王旭,白旭,等。NaCl处理后表达序列标签的生成与分析甘氨酸大豆.BMC Plant Biol. 2006;6:4。
- 11.
李敏,郭锐,焦艳,金旭,张辉,石磊大豆基于幼苗根系代谢组学。植物学报2017;
- 12.
李明,郑虎,姜启元,等。GmNAC15毛状根的过度表达增强了大豆的耐盐性。农业工程学报。2018;17(3):530-8。
- 13.
陈勇,陈志勇,陈志强,等。GmSK1,一个SKP1大豆的同源物,参与耐盐和耐旱。植物生理生化。2018;127:25-31。
- 14.
魏凌双,陈庆山,徐大伟,等。过度的GmBIN2,一个大豆糖原合成酶激酶3基因,提高耐盐和干旱转基因拟南芥大豆毛状根。中国农业科学,2018;17(9):1959-71。
- 15.
范丽,孙涛,杨静,张军,王东。一株胞状Na的克隆及功能鉴定+/小时+逆向转运基因(GmNHX1从大豆)。河北农业大学学报。2015;38:7 - 12,24。
- 16.
李军,鲍胜,张勇,马雪峰,孙建军,等。Paxillus involutusMAJ和NAU介导的K (+) / Na (+)内稳态真菌杨树xcanescens在氯化钠的压力下。植物杂志。2012;159:1771 - 86。
- 17.
维拉里诺GH,邦米利A,乔凡诺尼JJ,斯坎伦MJ,马特森NS。转录组分析佩妮矮牵牛利用高通量RNA测序来应对盐胁迫。《公共科学图书馆•综合》。2014;9:1-13。
- 18.
邱秋生,郭勇,马迪特里希,Schumaker KS,朱建坤。SOS1调控质膜Na+/小时+换热器在拟南芥,由SOS2和SOS3。中国科学院院刊2002;99:8436-41。
- 19.
拱点MP。钠液泡的过度表达赋予耐盐性+/小时+反向转运中拟南芥.科学。1999;285:1256-8。
- 20.
(1)植物液泡的拓扑结构分析+/小时+反转运蛋白揭示了调控反转运蛋白阳离子选择性的管腔C端。美国国家科学研究院2003;100:12510-5。
- 21.
Ramegowda V, Mysore KS, Senthil-Kumar M.病毒诱导的基因沉默是揭示作物植物中多个非生物胁迫响应基因功能相关性的一个通用工具。植物科学学报2014;5:1-12。
- 22.
Senthil-Kumar M, Mysore KS。烟草响尾蛇病毒介导的基因沉默烟草benthamiana.Nat Protoc。2014;9:1549 - 62。
- 23.
刘晓霞,刘宁,李飞,吴磊,张军,王东。trv介导的大豆瞬时基因沉默系统的建立。中国农业科学。2015;48:2479-86。
- 24.
刘清良,徐川坤,钟敏,潘玉忠,姜宝宝,刘国良,等。一种新型液泡钠的克隆与鉴定+/小时+逆向转运基因(DgNHX1从菊花)。《公共科学图书馆•综合》。2013;8:1-7。
- 25.
吴国强,冯荣军,王世民,王春梅,鲍安康,魏林,等。Co-expression的旱生植物霸王属xanthoxylumZxNHX和ZxVP1-1增强嵌合甜菜的耐盐性甜菜属l .)。植物学报2015;6:1-11。
- 26.
Jha B, Mishra A, Jha A, Joshi mSbNHX1一种在盐碱地栽培的极端盐生植物的基因。《公共科学图书馆•综合》。2013;8 (8):e71136。
- 27.
朱丽,沈光拟南芥钠/质子逆向转运基因(AtNHX1),以改善耐盐性。植物学报2012;6(1):59-67。
- 28.
Yarra R, Kirti PB。表达I类小麦NHX (TaNHX2)基因在茄子(茄属植物melongena(L.)提高植物在盐条件下的生长性能。功能整合基因组学。2019;19:541-54。
- 29.
顾文婷,周立邦,刘瑞英,金文娟,曲宇,等。NHX、AKT1和SOS1对甜高粱突变体Na+稳态调控的协同效应12C6 +离子辐照。核科学技术。2018;29:10。
- 30.
植物细胞内钠转运系统的研究。植物科学学报2013;4:410。
- 31.
达文波特RJ, Muñoz-Mayor A, Jha D, Essah PA, Rus A, Tester M. Na+转运蛋白AtHKT1;1控制Na的恢复+从木质部拟南芥.植物学报2007;30:497-507。
- 32.
王志强,王志强,王志强,等。AtHKT1的功能分析拟南芥表明,钠+韧皮部的再循环对耐盐性至关重要。EMBO j . 2003; 22:2004-14。
- 33.
Mäser P, Eckelman B, Vaidyanathan R, Horie T, Fairbairn DJ, Kubo M,等。改变拍摄/根Na+分布和分岔盐敏感性拟南芥Na基因的破坏+运输机AtHKT1。2月。2002;531:157 - 61。
- 34.
Assaha DVM, Ueda A, Saneoka H, Al-Yahyai R, Yaish MW。Na的角色+和K+糖植物盐胁迫适应的转运体。杂志。2017;8:509。
- 35.
徐静,李洪东,陈立强,王勇,刘丽丽,何磊,等。一种蛋白激酶,与两种钙调磷酸酶b样蛋白相互作用,调节K+运输中AKT1拟南芥.细胞。2006;125:1347-60。
- 36.
刘凯,李丽,栾树华+敏感的SKOR,激振器类型K+通道从拟南芥.植物j . 2006; 46:260-8。
- 37.
袁慧娟,马强,吴国强,王鹏,胡军,王思敏。ZxNHX控制钠+和K+在整个植物水平的内稳态霸王属xanthoxylum通过反馈调节参与转运的基因的表达。安机器人。2015;115(3):495 - 507。
- 38.
孙军,陈胜,戴胜,王锐,李宁,申旭,等。nacl诱导耐盐和盐敏感杨树根系细胞和组织离子通量的变化。植物杂志。2008;149:1141-53。
确认
我们感谢太平洋路德大学塔科马分校的Clara Elizabeth和加州大学伯克利分校的Zhou-Liang YU,感谢他们对本文语言的润色。
资金
本研究的资金来源由中国农业部和河北省科技厅通过以下项目提供:
(1)转基因生物新品种选育重大科技项目(2009ZX08004-001B),王冬梅;
(2)转基因生物新品种选育重大科技项目(2014ZX0800402B-001),王冬梅;
(3)外国留学生资助项目介绍(CN201706),张杰。
资助机构在研究设计、数据收集和分析、决定发表或编写手稿方面没有作用。
作者信息
从属关系
贡献
TJS撰写本文,TJS、LF、JY进行实验,RZC、CYY提供技术支持,JZ、DMW构思设计实验。所有作者都已阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
太阳,TJ。,Fan, L., Yang, J.et al。一个大豆钠/氢交换剂通过维持较高的钠含量来提高耐盐性+外流速率和K+/ Na+比例拟南芥.BMC植物杂志19,469(2019)。https://doi.org/10.1186/s12870-019-2084-4
收到了:
接受:
发表:
关键字
- 大豆
- GmNHX1
- 盐胁迫
- 中收取
- K+/ Na+比