- 研究文章
- 开放访问
- 发布:
氮的可用性通过上调抗氧化剂和渗透性代谢和次级代谢产物积累,防止盐度对小麦生长和光合作用的氧化效应,以及次生代谢物积累
BMC植物生物学体积19.文章编号:479.(2019)
抽象的
背景
盐度是有害的非生物胁迫因子之一。已提出适当的管理技术,以大大降低盐碱化强度对作物生长和生产力的影响。因此,本研究通过对抗氧化剂、渗透物质和次生代谢产物的分析,探讨氮素添加对小麦生长和耐盐胁迫的影响。
结果
盐胁迫(100mm NaCl)对叶绿素和类胡萝卜素的合成及光合效率均有不利影响。补氮增加了光合速率、气孔导度和内部CO2高氮浓度处理的幼苗,其效应更为明显。在N水平的非盐条件下,蛋白酶和脂氧合酶活性显著降低,反映出氧化损伤的减少。这种效应伴随着过氧化氢和超氧化物等有毒自由基的产生减少,以及补充氮的幼苗中的脂质过氧化。在盐和非盐的生长条件下,由于氮的补充,抗氧化防御系统被上调,从而保护主要的细胞过程,如光合作用、膜结构和功能以及矿物质同化。增加渗透压和次生代谢物的积累,以及补充氮的植物中的氧化还原成分通过进一步加强抗氧化机制来调节活性氧代谢和耐盐性。
结论
本研究结果表明,氮的有效性通过减少钠的吸收和加强关键的耐盐机制来调节耐盐性。
背景
植物不断面临各种各样的环境胁迫,导致生长迟缓和产量下降。盐胁迫被认为是影响全球作物代谢和生产力的破坏性非生物胁迫因素之一[1,2]盐分的增加被认为是对粮食安全的全球性威胁,导致农业耕地大量转化为非生产性荒地。盐分影响矿物质的吸收和同化、酶活性、光合作用、蛋白质表达和激素代谢[2,3.].生长介质中过量的盐浓度诱导渗透和离子胁迫,导致明显的生长变化,包括叶面积减少、坏死和脱落[4,5].耐盐性是一个复杂的性状,涉及多种生理、生化、分子和基因网络[6].盐度干扰离子平衡,导致含水量降低,并因过量活性氧(ROS)的积累而导致氧化损伤,从而导致脂质过氧化[3.,7].必须鉴定用于增强盐度耐受的物理生化和分子属性[6].据报道,盐胁迫影响氮、磷、钾、硫和钙等必需元素的吸收和代谢,导致光合效率和相关耐受机制的显著变化[1,7]盐环境中最有害的产物包括活性氧,如超氧化物、过氧化氢、过氧化氢和羟基自由基[1,8].为了避免盐分介导的生长限制,植物会上调某些自身产生的耐受机制,如抗氧化系统、渗透压和次生代谢物积累[6,9].盐胁迫下ROS的增加导致蛋白质、脂类、核酸等重要分子的氧化损伤。增加的ROS积累阻碍了氧化还原稳态,降低了光合效率[7],营养和渗透性代谢[1].为了抵抗盐度介导的ROS诱导的有害对生长的有害影响抗氧化系统和OSMoregulatory组分是上调的[2].此外,根和液泡水平的盐排斥被认为是调节植物耐盐性的重要关键机制[10.,11.].据报道,在添加矿物离子的选择性积累的选择性积累中显示出更大的抗氧化剂和渗透性代谢的植物表现出对盐度的耐受性增加[2,7].每个细胞隔间都有自己的一套ROS产生和中和途径,以维持ROS的稳定水平和氧化还原状态,从而在不同的细胞隔间产生不同的ROS信号[1,8,12.].据信不同的ROS签名通过介导全系统信号传导来确定应力适应特异性。抗氧化系统由酶和非酶促成分构成[12.,13.].像脯氨酸、甘氨酸甜菜碱和糖这样的相容渗透剂可以帮助抗氧化系统中和多余的ROS。渗透蛋白作为营养物质和代谢物信号分子,激活特定的或激素串扰转导途径,并修改基因表达和蛋白质组模式[13.]氮(N),一种大量元素,积极参与调节酶活性、光合作用、蛋白质合成、抗氧化剂和渗透压代谢[14.,15.,16.].N形成主要分子,包括核酸,蛋白质,叶绿素等,并且在氧化损伤的膜,光合抑制其缺乏可用性结果和阻碍养分吸收[的部件17.,18.].N可用性调节荷尔蒙的合成,渗透渗透剂[16.,19.,次级代谢物[20.]和抗氧化系统的活性[15.].此前Ahanger和阿加瓦尔[1,21.有报道称,上调抗氧化剂和渗透代谢可以通过保护氮和次级代谢产物来防止盐胁迫和水分胁迫介导的生长抑制。然而,氮有效性在盐胁迫下调节抗氧化剂、渗透和次生代谢中的作用仍是研究较少的领域。在此背景下,我们假设(a) N补充是否通过调节抗氧化、渗透和次级代谢来增强耐盐性,以及(b)改善N补充在减缓盐介导的生长和生理生化属性变化方面的有效性。
结果
氮的补充减少了钠的积累,提高了钾的吸收
氮素有效性对Na和K吸收的影响如表所示1.Relative to control, accumulation of Na increased by 56.94% due to NaCl treatment which was declined by 40.36 and 56.15% due to supplementation of N at 50 and 100 mg kg- 1分别在NaCl胁迫对应物上的土壤(N1和N2)。在正常条件下,N N显着降低N的Na积累,最大下降65.05%,用100mg kg观察到- 1(n2)。通过增加N补充率为N2,通过增加32.74%的N 2来显着提高K摄取。氮补充证明有益于在NaCl胁迫植物上减少18.50和34.63%的百分比的NaCl介导的下降18.50和34.63%(表1).
在NaCl胁迫下,补氮促进了色素的合成和光合作用
盐度应力降低了叶绿素和类胡萝卜素颜料的合成,导致光合速率下降。总叶绿素,类胡萝卜素,光合速率,气孔电导,细胞间有限公司2观察到浓度和蒸腾速率随着N 2的对照植物而达到38.71,32.08,51.47,33.71,29.37和33.47%的增加。盐度介导的最大改善介导的下降,N 2,总叶绿素的47.36%,对于类胡萝卜素的47.3.3%,光合速率为54.31%,对于气孔电导30.91%,细胞间CO的33.64%2蒸腾速率和蒸腾速率分别为42.81%和42.81%2).
在盐胁迫下,氮的有效性诱导渗透体的合成
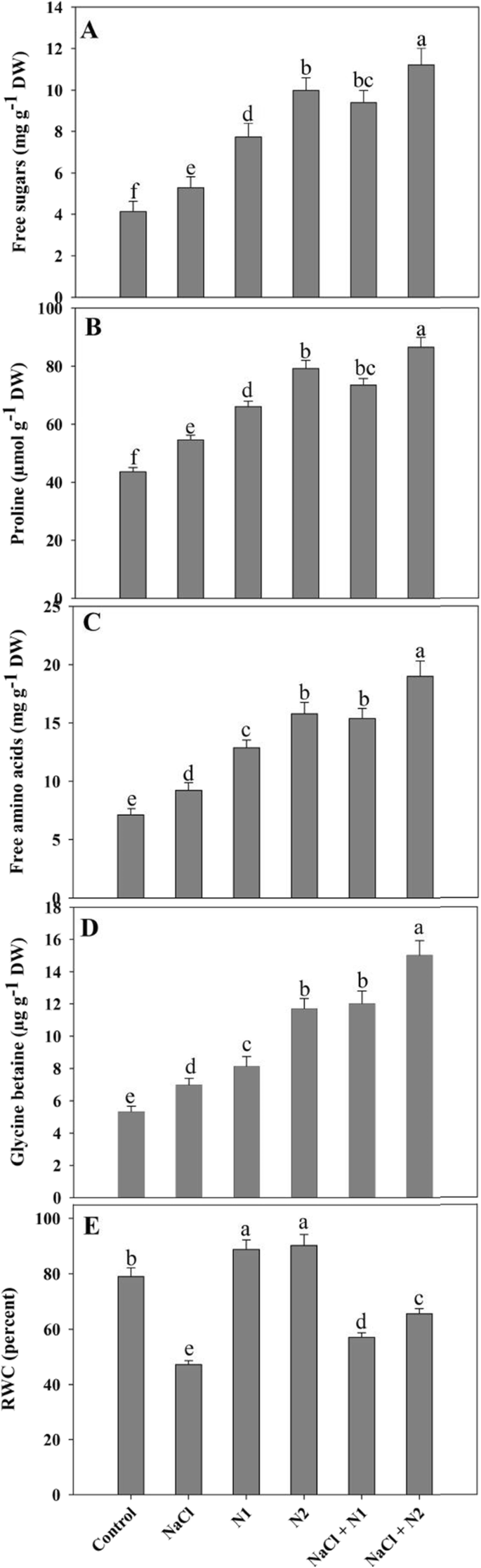
由于补充N和最大积累,脯氨酸,游离氨基酸,甘氨酸甜菜碱和糖的增加,用较高的N剂量观察到。相对于对照,脯氨酸,游离氨基酸,甘氨酸甜菜碱和糖增加了34.07,442,46.57和34.52%,因为补充了50 n和44.95,54.87,54.52和58.61%,由于100 n N.最大百分比增加49.61对于脯氨酸,62.50%的游离氨基酸,64.03%对甘氨酸甜菜碱,在NaCl + 100n中观察到63.19%的糖,对照组(图。1),这些值远高于NaCl胁迫下的值。
增加施氮量可降低氧化应激
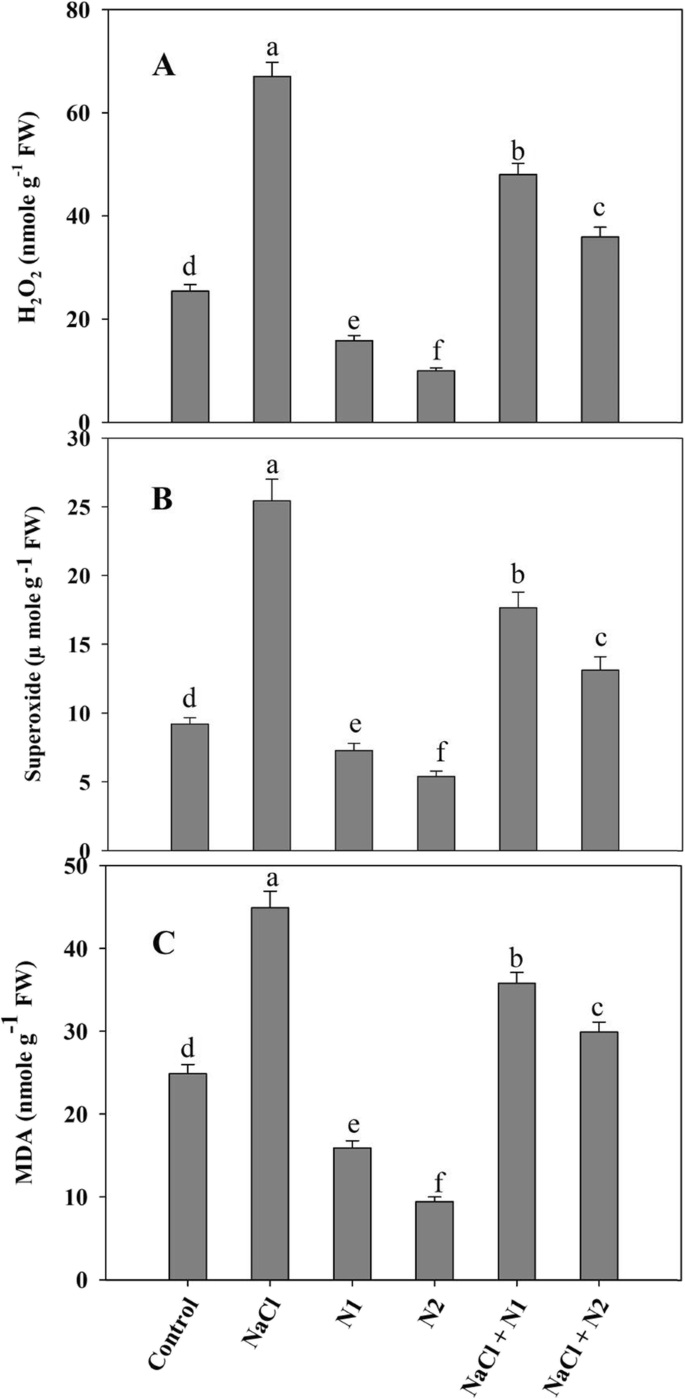
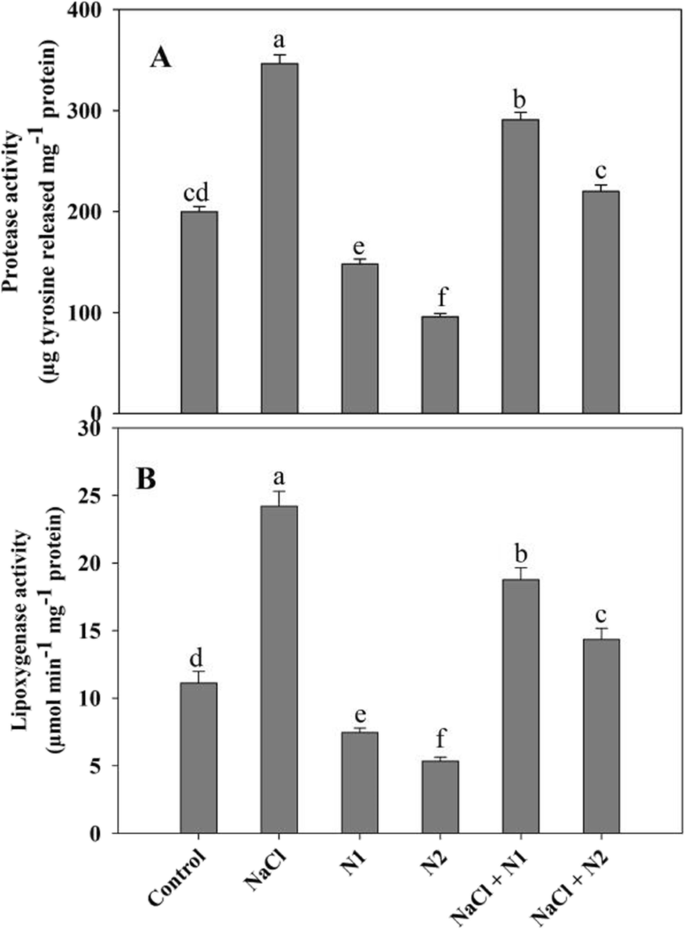
暴露在盐度下的幼苗表现出H2O2和O2-与对照组和补氮组相比,H2O2和O2-NaCl浓度分别为62.11和63.78%,脂质过氧化水平较对照提高44.60%。与对照相比,施氮显著降低了H2O2(2.5倍)和O2-(1.7倍)导致脂质过氧化下降62.01%。在NaCl胁迫下,添加N2可最大限度地改善H2O2和O2-与NaCl胁迫相比,脂质过氧化降低了33.42%(图。2A-C)。Ñ供给幼苗比对照表现出蛋白酶和脂氧合酶的活性明显下降以及NaCl的强调了与最大下降那些具有较高N.相对于对照,蛋白酶观察lypoxygenase增加1.73和2.17倍在NaCl胁迫植物,但是补充N个保持即使在NaCl的条件下的效果。At 100 N (N2), protease and lypoxygenase decreased by 52.00 and 51.97% respectively, and NaCl + N2 treated plants exhibited a decline of 36.54 and 40.72% over the NaCl stressed counterparts (Fig.3.a - b)。
n补充升压抗氧化系统
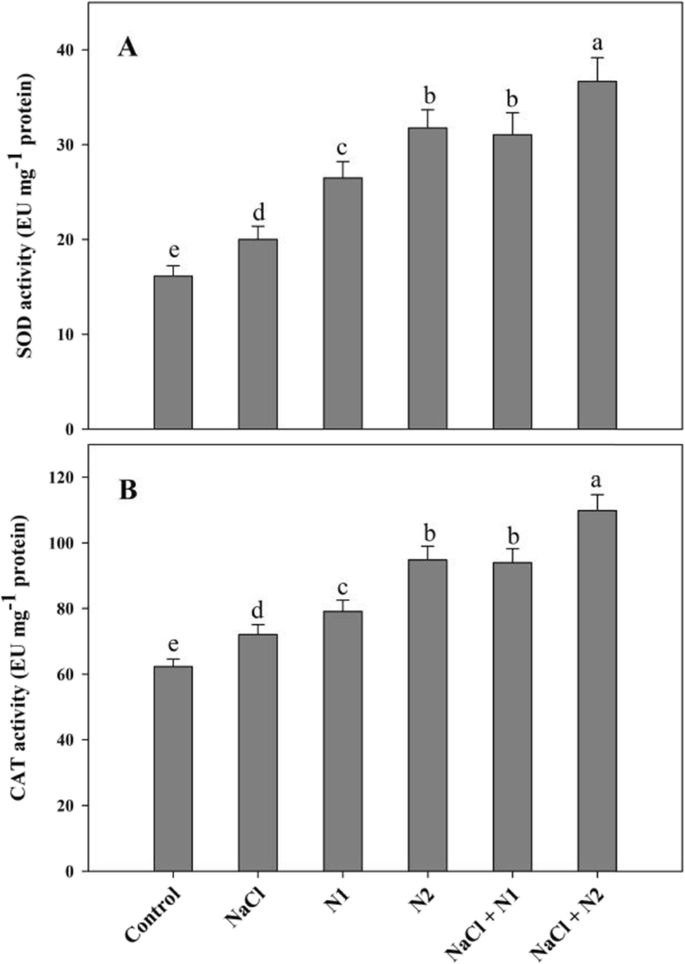
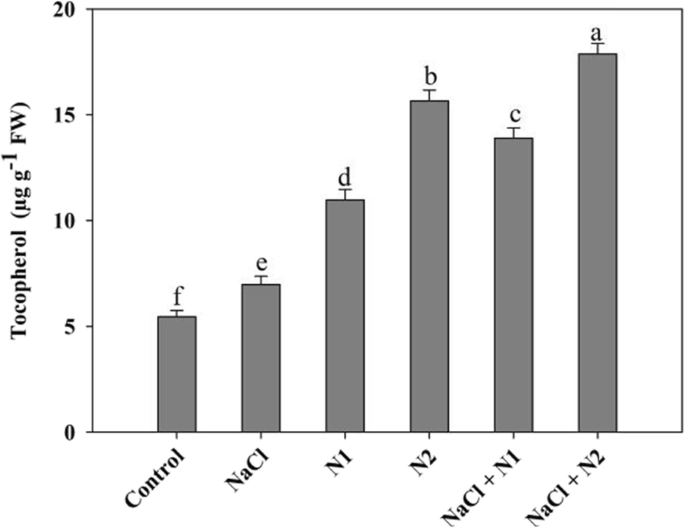
结果表明,N的有效利用显著影响了抗氧化系统中SOD、CAT、APX、GR、MDHAR、DHAR的活性以及AsA和GSH的合成。与对照组相比,在正常条件下,100 N (N2)时SOD、CAT、APX、GR、MDHAR、DHAR、AsA、GSH分别增加1.96倍、1.52倍、2.28倍、2.16倍、1.71倍、1.73倍、1.47倍。虽然生理盐水压力引发抗氧化酶的活性,N补充幼苗表现出最大活动增加SOD的2.27折,1.76折的猫,APX型2.89折,2.39折,GR MDHAR 2.10折、1.93折达1.61折,谷胱甘肽在生理盐水+ N2处理幼苗(无花果。4和5).生育酚含量也随施氮增加而显著增加。与对照组相比,添加N1和N2后生育酚含量分别提高了50.27和65.17%。在NaCl条件下,施用N (N100)保持了对生育酚的影响,比NaCl胁迫下的生育酚提高了60.99%(图1)。6).
酚类和黄酮类化合物在补充幼苗中增加
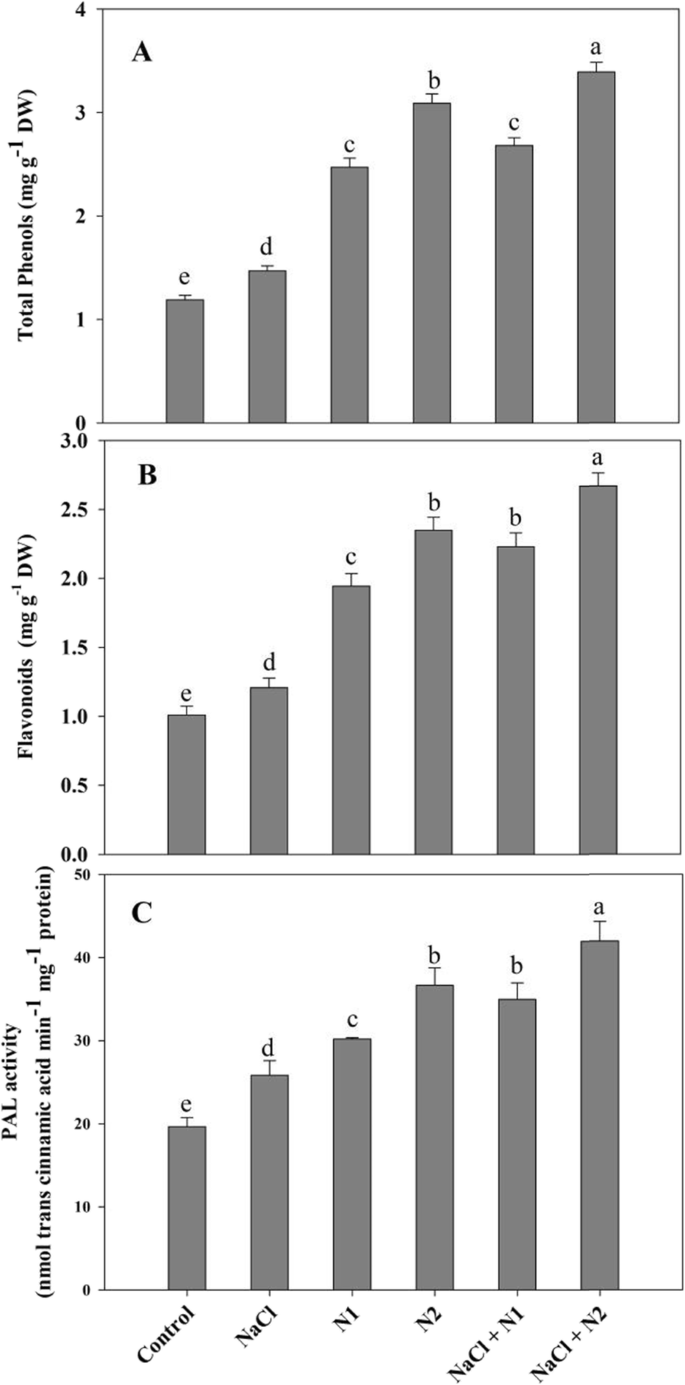
在正常和NaCl胁迫条件下,添加N的幼苗中酚类和类黄酮含量最高。在NaCl胁迫下,酚和黄酮类化合物的含量分别增加了19.04和16.54%,在NaCl + 100 N处理下,酚和黄酮类化合物的含量达到最大值。施氮量对PAL活性有显著影响,在50和100 N时PAL活性分别增加1.53和1.86倍,在NaCl + 100 N时PAL活性最高可达53.14%(图2)。7).
NR活性和氮含量与补充的N含量上升
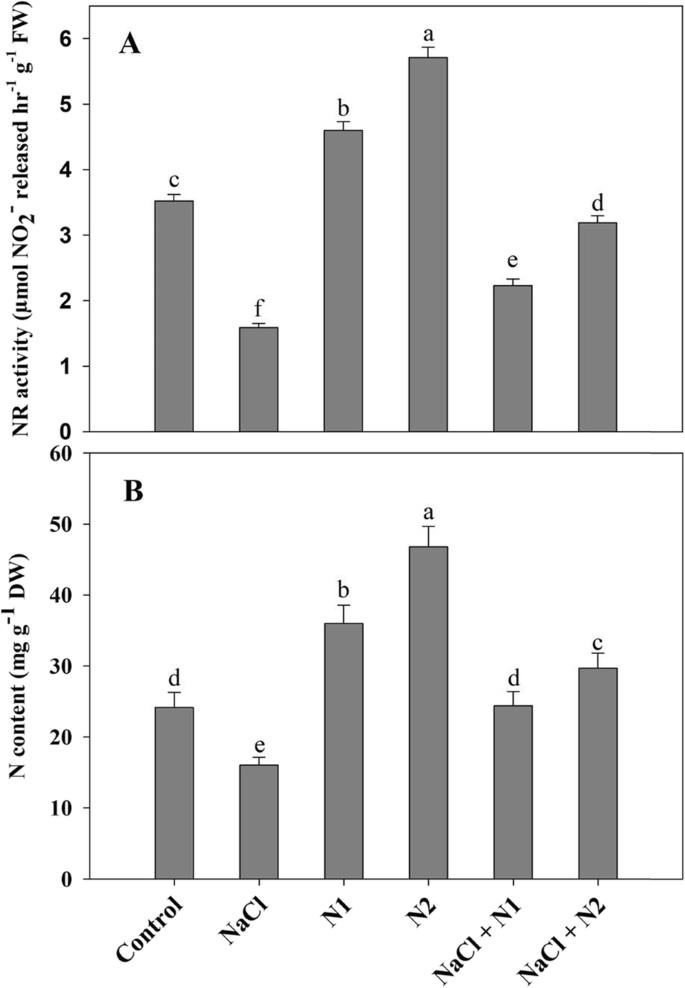
添加氮显著提高了对照植株的NR活性,同时也改善了NaCl对NR活性的影响。与对照相比,NaCl处理NR和N含量分别下降了54.82%和33.62%。50和100 N处理下NR活性分别提高了1.30和1.62倍,叶片N含量分别增加了1.49和1.93倍。与NaCl胁迫相比,NaCl + 100 N处理对NR活性和N含量的最大改善量分别为50.15和46.02%(图2)。8).
讨论
由于盐对作物植物的代谢具有毒性,因此盐一直是可持续农业生产力的主要问题之一[22.].Na和其他有毒离子的积累改变了植物细胞的生理稳定性,导致其结构和功能的稳定性受到相当大的破坏[23.].因此,以减轻或减少过量的Na植物的有害作用倾向于通过提高旨在通过减少的Na提高耐盐性的策略,以减少盐诱导的毒性离子+在光合器官中积聚[24.],提高ķ+导致增强的钾水平+/ na.+比率 [1,25.].这种选择性离子传输导致Na+据报道,内稳态是由一些代谢成分驱动的,如ROS [26.],植物激素[3.,兼容渗透物积聚[1,以及矿物质的摄取和吸收[27.].在本研究中,我们研究了在耐盐性通过在生理生化水平修改调节中的关键矿物(N)的可用性一个的作用。据观察,N有效性通过限制钠与在K.缺氮伴随改善摄取显著影响小麦幼苗的生长下降的细胞分裂从而降低了细胞数目和组织增殖[28.]Juppner等人[29.研究表明,含氮化合物的积累在激酶活性的控制下调控细胞周期进程、生长和生物量积累。过量的钠通过Na/H交换剂(NHX)流出液泡或通过根水平的SOS1蛋白[30.].参与钠离子主动分隔和隔离的运输蛋白活性的提高显著有助于植物耐盐胁迫[31.在本研究中,氮有效性介导的Na积累下降可能是由于运输蛋白表达的增加阻碍了根系对Na的吸收。增加施氮量显著增加了N和K的吸收,同时减少了Na的积累。早先,增加N的改善作用[19.]和K [1研究认为,在盐胁迫下补给量的增加可能是为了防止钠的积累。K在植物生长发育、逆境缓解、酶活性和渗透物质产生中普遍存在[1,12.,21.]另外,K本身是重要的无机渗透物[1,32.].N的补充提高了NR的活性,促进其快速转化为N前体,合成氨基酸和蛋白质。较高的氮利用率通过影响Rubisco的合成直接影响光合作用过程[33.].最近,Iqbal等人[19.]也表明添加N的幼苗Rubisco活性增加,显著改善了盐度介导的光合作用下降。N的补充提高了Rubisco大亚基和小亚基的表达[34.]在目前的研究中,增加氮的补充使色素合成和光合效率明显增强,并且很明显,由于NaCl处理,补充氮的幼苗表现出较少的下降。盐胁迫通过对叶绿素和Ru的合成产生有害影响而降低光合效率比斯科蛋白[19.]光合效率与氮、Rubisco浓度和内源CO有关2浓度[35.,而在本研究中,高氮对光合作用的调节效果显著。需要进一步的研究来揭示确切的机制。添加氮显著提高了脯氨酸、甜菜碱、糖和游离氨基酸等相容溶质的含量,显著高于对照和盐胁迫下的对照。增加氮的补充在提高渗透积累方面效果显著,反映在维持生长,从而改善盐胁迫引起的生长迟缓。除了参与维持组织含水量外,渗透剂还通过介导应激信号导致下游耐受机制的激活来保护主要的细胞功能[36.,37.,38.].渗压剂包括糖和氨基酸如脯氨酸用作ROS清除剂[39.,40].N介导的相容溶质积累增加通过消除ROS和氧化还原稳态保护光合电子传输,从而防止氧化损伤诱导的生长限制。脯氨酸和甘氨酸甜菜碱的积累显著地防止了盐诱导的光合抑制[7].通过不可逆合成化合物或通过合成和降解的组合保持相容性溶质的组织浓度,并且渗透物的积累与外部渗透性成比例[6].渗透剂通过维持水的流入来保护细胞的结构和渗透平衡[37.].脯氨酸,糖和甜菜碱保护Rubisco酶[的羧化酶活性41.,42.],因此,施氮增加了它们的积累,可能有助于提高光合效率。Martino等[43.]的研究表明,积累的甘氨酸、甜菜碱和游离氨基酸构成了最大的含氮渗透体。因此,补氮通过提高水分含量和光合效率,阻止了盐胁迫对小麦幼苗生长的影响。累积的渗透物质有助于压力释放后的快速生长恢复[1,21.,44.].氮利用率通过上调关键抗氧化酶活性和非酶组分含量,显著改善了抗氧化代谢。N介导的抗氧化能力的提高可显著减轻盐诱导的氧化损伤。超氧化物歧化酶(SOD)对超氧自由基的分解和防止光合机制的破坏是不可缺少的。抗氧化功能的增强减少了压力介导的对膜、蛋白质、核酸的损害,因此保持了功能的稳定性[2,8].早些时候据报道,SOD,猫和ASA-GSH功能增加,防止压力引发氧化损伤[2,45.,46.].然而,关于氮利用诱导的抗氧化系统调控的报道很少,进一步的研究有助于理解实际的潜在机制。盐胁迫降低了氧化还原稳态,从而阻碍了依赖氧化还原的细胞功能,如电子传递和能量产生[7,47.].上调的ASA-GSH循环功能通过维持叶绿体中的NADP水平来防止多种毒性自由基。抗坏血酸,谷胱甘肽和生育酚是低分子量的氧化还原缓冲剂,也可以与许多其他细胞组分相互作用。在防御中的明显作用中,作为酶辅助因子,这些氧化还原成分通过调节丝分裂,细胞伸长,衰老等的关键方法调节植物的生长和发育。[47.,48.].生育酚优选中和除其他活性氧外的单线态氧[48.,49.]AsA-GSH途径的酶有助于高效的H2O2通过维持氧化还原稳态,从而减少自由基形成的机会,从而防止对关键细胞过程(如电子传递)的氧化损伤[50].N介导的抗氧化系统的上调伴随着脂肪加氧酶和蛋白酶活性的降低,反映出对脂质和蛋白质更大的保护。应激诱导的脂质和蛋白质的降解降低了细胞的结构和功能完整性,补充氮通过阻止过量ROS的生成,缓解了盐度介导的膜降解。此前Ahanger和阿加瓦尔[1,21.]的研究表明,由于最适补充钾,蛋白酶活性降低,但尚未有讨论氮肥利用率影响的报道。压力通过诱导蛋白酶来影响植物的新陈代谢[1,21.,44.]和lypoxygenase活性45.].氧化信号是用于在变化的环境条件[减轻休眠和静止,引发细胞周期激活和遗传以及表观遗传控制托换生长和分化至关重要的响应51].氧化还原信号传导枢纽与植物激素网络协同互动,用于压力下的生长调节和调制[51,52].可见,氮的有效利用对酚类和类黄酮等次生代谢产物的合成有有利的影响。次生代谢物包括酚和类黄酮参与调控生长素运输、光保护、机械支持、种子传播和对昆虫食草性的保护[53]植物改善黄酮类化合物的合成,以保护应激介导的氧化还原失衡诱导的代谢变化,此外,植物还参与缓冲活性氧稳态的变化,以调节活性氧介导的信号级联[54].包括黄酮类化合物的次级代谢物通过抑制ROS的形成来防止氧化损伤并通过清除超氧化物(如超氧化物)保护细胞功能[53].酚类化合物积累增加,自由基清除能力增强,在应激条件下表现为明显的生长改善[1,21.].次级代谢物化合物如绿原酸,咖啡酸,槲皮素和儿茶素在质外体中接受电子,从而保护细胞壁成分,也极大地促进抗坏血酸池的生成,从而改善AsA-GSH循环的功能[49.].PAL是调节次级代谢物和在本研究中其活性的合成N介导的增加关键酶描绘了N于次级代谢产物积累的明显的影响。非酶抗氧化剂中和活性氧酶时,系统变得效率较低。它可以从本发明的发现,通过上调抗氧化剂和渗透质的代谢,和次生代谢产物的积累增加对盐度介导的氧化作用Ñ补充保护小麦幼苗来推断。
结论
结论,通过抗氧化系统的上调,渗透压和次生代谢产物积累,增加了N补充的增加了保护小麦幼苗的生长和代谢。n介导的氧化还原性稳态的维持阻止了盐度对光合作用的不良影响。在两个级别的n在改善盐度引发的氧化损伤到显着程度的情况下证明是有益的。抗氧化剂组分,酶促和非酶促组分由于N补充而增加,其活跃于其表达水平赋予其活性程度。因此,显而易见的是,增加N补充通过抗氧化剂,渗透剂和代谢物代谢中的调节来调节小麦的耐盐性。
方法
实验设计,植物材料和生长条件
小麦(小麦l)从中国杨凌陕西大学农业学院采购种子。使用0.01%HGCL灭菌种子2接着用蒸馏水充分洗涤,并在底部穿孔的盆中填充有泥炭,堆肥和砂播种(3:1:1)。Soil in pots was supplied with 0, 50 and 100 mg N kg- 1尿素形式的土壤。10 d后,用100 mM NaCl (100 mL /盆)交替处理20 d,诱导幼苗生长。土壤中N、P、K的天然浓度分别为65.98、18.78、80.67 mg kg- 1soil respectively with pH 7.57 and water field capacity 52.21%. Pots were arranged in complete randomized block design with five replicates for each treatment and were maintained under green house conditions at the College of Life Science, NorthWest A&F University Yaangling Shaanxi China. After fourty days of growth seedlings were analyzed for photosynthetic parameters, antioxidant and osmotic constituents, secondary metabolite accumulation and oxidative stress parameters.
色素和光合参数的估计
用杵和研钵将新鲜叶片浸泡在80%丙酮中,提取总叶绿素和类胡萝卜素。在480、645和663处记录吸光度 纳米对抗[55].光合效率,细胞间CO2使用光合作用仪Li-6400(美国Li-COR公司)测量完全展开叶片中的浓度和气孔导度。
测定叶片含水量、可溶性糖、脯氨酸和甜菜碱含量
叶片相对含水量(RWC)的测定采用Smart和Bingham [56].游离糖含量[57,58],游离氨基酸[59],游离脯氨酸[60]甘氨酸甜菜碱[61在治疗和未处理的样品中估计粉末状干燥样品。
过氧化氢和超氧化物的估计
H的估计2O2,10.0 mg fresh leaf tissue was homogenised in 5 mL of 0.1% trichloro acetic acid (TCA) and subjected to centrifugation at 10,000 g for 10 min. 500 μL supernatant was mixed with equal volume of potassium phosphate buffer (pH 7.0) followed by addition of 1 mL potassium iodide. After thorough mixing absorbance was recorded at 390 nm [62的O]。对于测量2-浓度的新鲜组织在磷酸钾缓冲液(65 mM, pH 7.8)中均质,匀浆在5000 g离心10分钟。上清液与10 mM盐酸羟胺混合,静置20 min后加入磺胺、萘胺。在25°C孵育20分钟后,在530 nm处测量吸光度[63]和计算使用纳米标准曲线进行2.
脂质过氧化,脂氧合酶和蛋白酶活性
脂质过氧化测定为丙二醛(MDA)生成量 mg新鲜叶组织用1%TCA浸渍,然后在10000℃下离心 g代表5 最低1.0 mL上清液与0.5%硫代巴比妥酸(4)反应 mL)在95 摄氏30度 随后在冰浴中冷却,然后在5000℃下离心 g代表5 在532和600处测量上清液的最小吸光度 纳米[64].LOX(EC 1.13.11.12)的活性根据Doderer等人的方法来估计。[65] and increase in absorbance was recorded at 234 nm using linoleic acid as substrate. An extinction coefficient of 25 mM- 1 cm- 1,以1 μmol底物氧化min- 1)毫克- 1蛋白质。蛋白酶(EC 3.4.21.40)活性的测定方法是将新鲜组织置于含有1% PVP的冷冻50 mM钠钾缓冲液(pH 7.4)中匀浆,并将匀浆在4°C下5000 g离心5分钟。在40°C孵育1ml酪蛋白上清液并与Folin Ciocalteu试剂在碱性介质中反应后,在660 nm处读取释放的酪氨酸。活性以酪氨酸释放量mg表示- 1蛋白质 [66].
硝酸还原酶的测定
为了测定硝酸还原酶(NR)活性,将300 mg新鲜叶片组织置于含有200 mM KNO的100 mM磷酸钾缓冲液(pH 7.5)中培养3.在30℃下为0.5%N-丙醇(v / v),在黑暗中为3小时。此后,将等分试样(1mL)与等体积的1%磺酰胺和0.2%1-旁苯二甲基二盐酸盐混合,并使混合物静置20分钟。此后,在540nm处记录吸光度[67].
抗氧化酶的含量测定
For extraction of antioxidant enzymes fresh 5.0 g leaf tissue was homogenised in pre-chilled pestle and mortar using phosphate buffer (100 mM, pH 7.8) containing 1% polyvinyl pyrolidine and 1 mM EDTA. The homogenate was centrifuged at 12,000 g for 15 min at 4 °C. For ascorbate peroxidase (APX) extraction buffer was supplemented with 2 mM ascorbate. Supernatant was used as enzyme source. Activity of superoxide dismutase (SOD, EC 1.15.1.1) was assayed by monitoring the ability of enzyme to inhibit the photochemical reduction of nitroblue tetrazolium chloride (NBT) at 560 nm [68[检测混合物在荧光灯下孵育15分钟,记录吸光度对非照明空白和活性表示为EU mg- 1Aebi后测定蛋白质过氧化氢酶(EC 1.11.1.6)活性[69]在含有50mM磷酸钾缓冲液(pH7.0),H的测定混合物中,在240nm处监测吸光度的变化2分钟。2O2和100μl酶提取物。消光系数为0.036毫米- 1 cm- 1用于计算。抗坏血酸过氧化物酶(APX, EC 1.11.1.11)的测定方法:70H2O2在290 nm处检测吸光度下降3分钟。消光系数2.8 mM- 1 cm- 1用于计算,活性用EU-mg表示- 1为了估算谷胱甘肽还原酶(GR;EC 1.6.4.2)活性,在340℃时,通过吸光度变化监测NADPH的谷胱甘肽依赖性氧化 2纳米 闵[71].活动表示为EU mg- 1蛋白质和消光系数为6.2毫米- 1 cm- 1用于计算。在含有Tris-HCl缓冲液(50 mM, pH 7.5)、200 μM NADPH、250 μM AsA和酶的反应混合物中测定MDHAR (EC: 1.6.5.4)的活性。在340 nm下读取吸光度2 min [72]消光系数为6.2 嗯- 1 cm- 1用于计算。DHAR(EC:1.8.5.1)的活性测定如下中野和浅田[70在含有50 mM磷酸钾缓冲液(pH 7.0)、GSH (2.5 mM)和100 μM DHA的检测混合物中。在265 nm处读取光密度变化2分钟,消光系数为14 mM- 1 cm- 1用于计算。
抗坏血酸,还原型谷胱甘肽和生育酚的估计
用6%三氯乙烯(TCA)浸渍新鲜植物材料,上清液与2%二硝基苯肼和10%硫脲混合,测定抗坏血酸(AsA)含量。样品在水浴中孵育15分钟后冷却,5 mL冷却80% H2所以4在530处测量吸光度 纳米[73].采用AsA标准曲线进行计算。还原型谷胱甘肽(GSH)的估算采用Ellman描述的以下方法进行[74].在磷酸盐缓冲液中均化100mg新鲜组织(pH8.0),将500μl上清液与5,5-二硫代石-2-硝基苯甲酸混合。在412nm处读取光密度,并从GSH的标准图确定GSH的浓度。在乙醇和石油醚(1.6:2)中萃取生育酚。将离心上清液与2%2,2-二吡啶酰度温育后,然后加入O蒸馏水(4mL)。吸光度在520 nm时记录[75]采用标准曲线进行计算。
总酚类、黄酮类化合物的测定及苯丙氨酸解氨酶的测定
通过遵循麦利克和辛格的方法来估计总酚和黄酮类化合物[76和Zhishen等[77].Zucker后测定苯丙氨酸氨酶(PAL)[78在290 nm处测定反式肉桂酸的形成。
Na、K和N的估算
Ahanger等人用火焰光度法对Na和K进行了估计[79].Jackson提出的Micro-Kzeldahl方法[80]由Iswaran和Marwaha修改[81.]被用于N含量的估计。
统计分析
数据是三种重复的平均值(±SE),并且对于数据的测试意义,使用一种方式进行Duncan的多个范围测试,计算ANOVA和最低差异(LSD)计算P< 0.05.
数据和材料的可用性
本研究中生成或分析的所有数据均包含在本文中。
参考文献
- 1。
Ahanger MA,Agarwal RM.盐胁迫诱导小麦抗氧化代谢和氮同化的变化(小麦L)通过补充钾的影响。植物理性生物化学。2017; 115:449-60。
- 2。
补充硅(Si)可减轻绿豆NaCl毒性[j]。豇豆属辐射动物(L.)维尔泽克]通过生理生化属性和关键抗氧化酶的修改。Ĵ植物生长雷古尔。2019; 38(1):70-82。
- 3.
法特玛M,马苏德A,佩尔TS,汗纳。一氧化氮通过与芥菜硫同化相互作用缓解盐胁迫抑制的光合性能。前沿植物科学。2016;25:521.https://doi.org/10.3389/fpls.2016.00521.
- 4.
李志强,李志强。植物耐盐性及盐胁迫效应研究进展。环境科学学报。2005;60(3):324-49。
- 5.
Negrao S,SchmöckelSM,测试仪M.评估植物的生理反应以盐度应力。Ann Bot。2017; 119(1):1-11。
- 6.
黄建平,黄建平。植物耐盐机制的研究进展。基因组学杂志。2014;701596。https://doi.org/10.1155/2014/701596.
- 7.
Khan Mir,Asgher M,Khan Na。通过水杨酸缓解盐诱导的光合作用和生长抑制涉及甘氨酸甜菜碱和血糖中的乙烯(豇豆属辐射动物l .)。植物生理生化。2014;80:67-74。
- 8。
陈志强,陈志强,陈志强,等。植物抗氧化活性的研究进展[j]。《生物技术评论》2010;30:161-75。
- 9。
郭锐,石丽霞,闫超,钟旭,顾凤凤,刘强,夏旭,李慧。玉米中性盐和碱性盐胁迫的Ionomic和代谢响应(英文)玉米L.)幼苗。BMC植物BIOL。2017; 17:41。https://doi.org/10.1186/s12870-017-0994-6.
- 10.
Deinlein U,Stephan Ab,Horie T,Luo W,Xu G,Schroeder Ji。植物盐耐腐蚀机制。趋势植物SCI。2014; 19(6):371-9。
- 11.
豪瑟女,堀江T.保守由HKT转运蛋白介导初级耐盐机制:排除钠和高K值的维护机构+/ na.+盐度胁迫期间比在叶子。植物细胞环境。2010; 33:552-65。
- 12.
Ahanger MA,托马尔NS,Tittal男,ARGAL S,阿加瓦尔RM。水/盐胁迫下的植物生长:ROS的产生;抗氧化剂和这样的条件下加入氢的意义。physiolmol biol植物。2017; 23(4):731-44。
- 13。
《可溶性糖在植物活性氧平衡和氧化应激反应中的作用》,植物学报,2006;57:449-59。
- 14。
上官Z,邵呒,氮营养对冬小麦净光合速率和叶绿素荧光水分亏缺的Dyckmans J.影响。J植物理性。2000; 156:46-51。
- 15。
Vanacker H,Sandalio LM,Jimenez A,Palma JM,Corpas FJ,Meseguer V,Gomez M,Sevilla F,Leterrier M,Foyer CH,del Rio LA.氧化还原调节在不同氮营养源下生长的豌豆植株叶片衰老中的作用.J Exp Bot.2006;57(8):1735-45。
- 16.
Martinez的-安杜哈尔C,加尼姆ME,阿尔巴塞特A,佩雷斯 - Alfocea F.响应营养番茄的硝酸盐/铵(番茄茄L.)植物过表达原核NH4+端依赖天冬酰胺合成酶。植物生理学报。2013;37(4):591 - 598。
- 17.
Tewari rk,kumar p,sharma pn。在氮气,磷或钾缺乏下生长的桑树植物幼叶中的氧化应激和抗氧化反应。J Intent Plant Biol。2007; 49(3):313-22。
- 18.
Chokshi K,潘沙我,戈什A,米什拉S.氮饥饿诱导ROS清除抗氧化剂的细胞串扰和植物激素增强型绿色微藻生物燃料的潜力Acutodesmus dimorphus.《生物技术生物燃料》,2017;10:60。https://doi.org/10.1186/s13068-017-0747-7.
- 19。
伊克巴尔N,欧麦尔S,汗NA。氮可用性调节脯氨酸和乙烯生产和芥菜的缓解盐度胁迫(芥菜)。J植物理性。2015年,178:84-91。
- 20
Giorgi A, Mingozzi M, Madeo M, Speranza G, Cocucci M. 2009。氮饥饿对蓍草酚代谢和抗氧化性能的影响科里纳蓍贝克尔Rchb交货)。食品化学。2009;114:204-11。
- 21.
Ahanger Ma,agarwal rm。钾改善了抗氧化代谢,并在水中减轻了水下的生长抑制,小麦渗透压(小麦l)。原生质。2017; 254(4):1471-86。
- 22.
潘YJ,刘升,林YC,祖YG,李LP,唐ZH。乙烯通过乙烯,球袋的转录控制和拟南芥衰老相关基因拮抗盐诱导生长迟缓和细胞死亡的过程。前植物SCI。2016; 7:696。https://doi.org/10.3389/fpls.2016.00696.
- 23。
外源激动素通过上调抗氧化系统、抗坏血酸-谷胱甘肽循环和乙二醛酶系统保护番茄茄免受nacl诱导的氧化应激。《公共科学图书馆•综合》。2018;13 (9):e0202175。https://doi.org/10.1371/journal.pone.0202175.
- 24。
James RA,Davenport RJ,Munns R.Na两个基因的生理特性+硬质小麦除外,Nax1和Nax2.植物杂志。2006;142:1537-47。
- 25。
谢巴拉,崔塔。钾的运输和植物耐盐性。生理植物。2008;133:651-69。
- 26。
蒋志强,王志强,王志强。ros介导的维管稳态控制根-茎间土壤钠输送拟南芥.EMBO J. 2012; 31:4359-70。
- 27。
Ahanger Ma,Tittal M,MiR Ra,Agarwal RM。缓解水和渗透胁迫诱导的氮代谢酶的变化小麦《钾的品种》。原生质体。2017;254(5):1953-63。
- 28.
王志强,王志强,王志强,等。氮缺乏对紫花苜蓿叶片细胞分裂和生长发育的影响萝藦acta botanica yunshan(云南植物研究). 1999;22(1):81-9。
- 29.
Juppner J,Mubeen U,LiseSe A,Caldana C,Wiszniewski A,Steinhauser D,Giavalisco P.雷帕霉素激酶的目标通过改变同步的碳/氮气平衡来影响生物质积累和细胞周期进展衣藻reinhardtii《细胞》,植物杂志,2018;93(2):355-76。
- 30
Keisham男,慕克吉S,SC Bhatla。在植物中,进展和挑战钠转运机制。int j mol sci。2018; 19(3):647。https://doi.org/10.3390/ijms19030647.
- 31
曾勇,李强,王浩,张军,杜军,冯华,余磊,徐国刚Helianthus Tuberosus.提高水稻对盐分和营养缺乏胁迫的耐受性。植物生物技术杂志,2018;16(1):310-21。
- 32
钾离子诱导开花植物发生变化。在:花的回顾和展望(教授Vishwambhar Puri出生百年卷)。德里:SR科学出版物;2009.p . 158 - 86。
- 33.
Heckathorn SA,Poeller GJ,科尔曼JS,Hallberg的RL。氮可用性和营养发育的影响核酮糖-1,5-二磷酸羧化酶/加氧酶,磷酸烯醇丙酮酸羧,和热休克蛋白含量的在响应于热应力玉米acta botanica yunshan(云南植物研究),1996;
- 34.
今井K,铃木Y,湄T,牧野A. 2008变迁的Rubisco的水稻叶片相对于衰老和N涌入的合成。Ann Bot。2008; 101(1):135-44。
- 35。
水稻叶片光合作用与植株生长的关系。土壤钪植物坚果。2003;49(3):319-27。
- 36。
Eveland AL, Jackson DP。糖、信号传导和植物发育。中国生物医学工程学报。2012;63(9):3367-77。https://doi.org/10.1093/jxb/err379.
- 37。
陈志强,陈志强,陈志强,等。植物抗旱性的研究进展。植物营养与肥料学报。植物在环境变化下的生理机制与适应策略Ahmad P, Wani MR. New York:施普林格Science+Business Media, Inc. 2014; 25-56。
- 38。
Smeekens S,Hellmann Ha。植物中的糖感测和信号。前植物SCI。2014; 5:113.26。https://doi.org/10.3389/fpls.2014.00113.
- 39。
Hayat S,Hayat Q,Alyemeni MN,Wani AS,Pichtel J,Ahmad A.脯氨酸在变化环境中的作用:综述.植物信号行为.2012;7:1456-66。
- 40。
Keunen E,Peshev D,Vangronsveld J,Ende WVD,Cuypers A.植物糖是非生物压力期间氧化挑战中的关键球员:延长了传统概念。植物细胞环境。2013; 36:1242-55。
- 41。
脯氨酸缓解盐胁迫诱导的核酮糖-1,5-二磷酸加氧酶活性的增强。生物化学学报。2000;279(2):512-5。
- 42
西瓦库玛P,Harmila P,耆那V,Saradhi PP。糖有潜力的Rubisco的削减氧酶活性。Biochem Biophys Res Communce。2002; 298(2):247-50。
- 43
Martino的CD,Delfine S,Pizzuto R,F.洛雷托游离氨基酸和菠菜叶渗透调节甘氨酸甜菜碱响应增加盐胁迫。新植物。2003; 158(3):455-63。
- 44
关键词:渗透胁迫,渗透胁迫,胁迫释放,水稻植物生长规律。2004;42:79-87。
- 45.
Nahar K、Hasanuzzaman M、Rahman A、Alam MM、Mahmud JA、Suzuki T、Fujita M.多胺赋予绿豆耐盐性(豇豆属辐射动物通过减少钠的摄取,改善营养平衡,抗氧化防御和甲基乙二醛解毒系统。前面。植物科学。2016;7:1104。https://doi.org/10.3389/fpls.2016.01104.
- 46.
多胺诱导绿豆铝耐性的研究:抗氧化防御和甲基乙二醛解毒系统。生态毒理学,2017,26(1):58 - 73。
- 47。
Anjum NA,Gill R,Kaushik M,Hasanuzzaman M,Pereira E,Ahmad I,Tuteja N,Gill SS.ATP磺酰化酶,硫化合物和植物抗逆性.前沿植物科学.2015;6:210。https://doi.org/10.3389/fpls.2015.00210.
- 48。
陈志强,王志强,王志强,等。l-半乳糖-1,4-内酯脱氢酶基因的克隆与表达。足底。2005;220(6):854 - 63。
- 49。
氧化还原稳态和抗氧化信号:应激感知和生理反应之间的代谢界面。植物细胞。2005;17(7):1866 - 75。
- 50.
抗坏血酸、谷胱甘肽和生育酚在叶绿体中的保护和信号传导功能。《光合作用和呼吸作用的研究进展:光保护、光抑制、基因调控和环境》,19,B. Demmig-Adams, W.W. Adams, (Dordrecht:施普林格Science Publishers)。2005; 241 - 268。
- 51.
寄生MJ,Foyer Ch。氧化还原调控植物发育。抗氧化氧化还原信号。2014; 21(9):1305-26。
- 52。
瑞安Ch,Van Dongen JH。射击生长,SAM维护和开花的氧化还原调节。CurrOp植物BIOL。2016; 29:121-8。
- 53。
关键词:胡萝卜,苯丙酸,热胁迫,细胞培养,抗氧化能力植物学报2016;7:1439。https://doi.org/10.3389/fpls.2016.01439..
- 54
Brunetti C,Fini A,Sebastiani F,Gori A,Tattini M.植物激素信号传导的调节:植物环境相互作用中黄酮类化合物的主要功能。前植物SCI。2018; 9:1042。https://doi.org/10.3389/fpls.2018.01042.
- 55
亚迪。分离叶绿体多酚氧化酶中的铜酶普通贝塔.植物理性。1949年; 24:1-15。
- 56
斯马特·雷,比哈姆·GE.相对含水量的快速估算.植物生理学.1974;53:258-60。
- 57.
方军。肝中糖原的超微量测定。蒽酮法与还原糖法的比较。生物化学学报。1953;45(2):319-26。
- 58.
Jain VK, Guruprasad KN。氯胆碱和赤霉酸对萝卜幼苗花青素合成的影响。植物杂志。1989;75:233-6。
- 59。
Sadasivam S,Manickam A.《生物化学方法》,第二版。新德里:新时代国际有限公司出版社;2004年。
- 60
Bates LS, Waldre RP, Teare ID。水分胁迫研究中游离脯氨酸的快速测定。植物科学。1973;39:205-7。
- 61.
格里夫CM,格拉顿SR。快速测定法测定的水溶性季铵化合物。植物土壤。1983; 70:303-7。
- 62.
Velikova V,Yordanov我,Edreva A.氧化应激和酸雨处理豆类植物的一些抗氧化系统,外源性多胺的保护作用。植物SCI。2000; 151:59-66。
- 63.
杨华,吴芳,程军。一氧化氮降低黄瓜冷害及其抗氧化反应。食品化学。2011;127:1237-42。
- 64。
荒地RL,封隔器L.光过氧化中分离叶绿体:I.动力学和的脂肪酸过氧化的化学计量。拱生物学生生物糖。1968; 125:189-98。
- 65。
Doderer A,Kokkelink我,范德维恩S,德沃克B,施拉姆A,杜马A.纯化及大麦发芽脂氧合酶2种同工酶的表征。Biochim Biophys Acta。1992; 112:97-104。
- 66
Green NM,Neurath H.蛋白水解酶。作者:Neurath H,Valey K,编辑。《蛋白质》,第二卷。纽约:B部分,学术出版社;1954P1057–198.
- 67
塔瓦HS。在玉米幼苗体内硝酸还原酶的活性。印度生物化学与生物物理学。1974; 11:230-2。
- 68
拜耳WF,Fridovich JL.超氧化物歧化酶活性测定:条件微小变化的一些重大后果.肛门生物化学.1987;161:559-66。
- 69.
过氧化氢酶的体外培养。方法Enzymol。1984;105:121-6。
- 70
过氧化氢被菠菜叶绿体中的抗坏血酸特异性过氧化物酶清除。《植物细胞生理》1981;22:867-80。
- 71
Foyer Ch,Halliwell B.在叶绿体中存在谷胱甘肽和谷胱甘肽还原酶:抗坏血酸代谢中的提出作用。Planta。1976年; 133:21-5。
- 72
Hossain Ma,Nakano Y,亚纳达K.摩天大麦咯岩酯还原酶在菠菜叶绿体中还原酶及其参与抗坏血酸的再生,用于清除过氧化氢。植物细胞生理。1984; 25:385-95。
- 73.
慕克吉SP,Choudhuri MA。水分胁迫诱导的豇豆幼苗内源抗坏血酸和过氧化氢水平变化的含义。生理植物。1983;58:166–70.
- 74.
组织巯基。Arch Biochem biophysics . 1959; 82:70-7。
- 75.
贝克尔H,弗兰克·O,德Angells B,法因戈尔德S.血浆中维生素E的人在摄入免费或ocetylaned生育酚之后在不同时间。营养学众议员诠释。1980; 21:531-6。
- 76。
《植物酶学与组织酶学》。新德里:Kalyani出版社;1980.p。286。
- 77。
智深J,孟成T,建明W.桑树中黄酮类化合物含量的测定及其对超氧自由基的清除作用.食品化学.1999;64:555-9。
- 78
Zucker M.光的诱导苯丙氨酸脱氨酶的诱导及其与马铃薯块组织的绿原酸合成的关系。植物理性。1965; 40:779-84。
- 79
Ahanger MA、Agarwal RM、Tomar NS、Shrivastava M.钾可诱导燕麦氮代谢和抗氧化系统发生积极变化(Avena Sativa.L品种Kent)。植物学报。2015;10(1):211-23。
- 80.
土壤化学分析。新德里:印度私人有限公司的Prentice Hall;1973.
- 81
Iswaran v,Marwaha Ts。一种改进的快速kjeldahl方法,用于测定农业和生物材料中总氮。Geobios。1980; 7:281E282。
致谢
作者感谢陕西杨凌西北农林科技大学生命科学学院提供研究设施和资助研究小组。第一作者感谢西北农林科技大学陕西杨凌博士后研究项目。国家重点研发计划项目(No. 2017YFE0114000)资助。MAES和AAA感谢研究人员支持项目编号(RSP-2019/86),位于沙特阿拉伯利雅得的沙特国王大学。
资金
西北农林科技大学,国家重点研究中国的发展计划(编号:2017YFE0114000)和RSP-八十六分之二千零十九。
作者信息
隶属关系
贡献
MAA和LZ设计了实验。MAA、CQ、XXD和QM进行了实验。MAA, CQ, NB, MEE撰写并修改稿件。MAA, NB和MAES收集文献。MAES和AAA进行了统计分析和格式化。所有作者都已阅读并批准了最终稿。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Ahanger,M.A.,Qin,C.,Begum,N。et al。氮有效性通过上调抗氧化剂和渗透物质的代谢以及次生代谢产物的积累,阻止了盐度对小麦生长和光合作用的氧化效应。BMC植物BIOL.19,479(2019)。https://doi.org/10.1186/s12870-019-2085-3
收到:
接受:
出版:
关键字
- 氮
- 抗氧化剂
- ASA-GSH循环
- 氧化损伤
- 盐度
- 小麦