摘要
背景
异柠檬酸裂解酶(ICL)是乙醛酸循环中的关键酶。在之前的水稻研究中,icl编码基因的表达(OsICL)在盐胁迫下高度诱导,在过表达的转基因水稻中表达增强OsCam1-1钙调素(CaM)编码基因。CaM与植物的耐盐机制有关;然而,CaM介导的细胞机制尚不清楚。在本研究中,OsICL利用转基因植物研究了CaM在植物耐盐机制中的作用及其可能的参与机制OsICL或OsCam1-1.
结果
OsICL在衰老叶片中表达量高,在盐胁迫下表达量显著增加OsCam1-1过表达的转基因水稻和野生型(WT)。在WT幼叶中,虽然OsICL3个转基因株系均表现出较高的诱导表达水平,且不受盐胁迫的影响。盐胁迫对拟南芥种子萌发和幼苗生长均有不利影响AtICL敲除突变体(Aticl突变体)。检查的角色OsICL我们获得了以下转基因拟南芥株系Aticl突变体表达OsICL在当地人的驱使下AtICL启动子,Aticl突变overexpressingOsICL由35SCaMV启动子驱动,WT过表达OsICL由35SCaMV推广者驱动。在盐胁迫下,黄瓜的发芽率和幼苗的鲜、干重OsICL表达-的线条高于对照组Aticl变种人,还有两条线icl突变背景与WT相似Fv/F米莲座叶的温度OsICL-表达株系受盐胁迫的影响较小Aticl突变体。最后,葡萄糖和果糖的含量Aticl盐胁迫下突变体数量最多,而盐胁迫下突变体数量最多OsICL-表达谱与WT相似或低于WT。
结论
OsICL在转基因拟南芥株系中发现了盐反应基因OsICL表达可逆转盐敏感表型Aticl敲除突变体。本研究提供了新的证据,支持了ICL通过乙醛酸循环在植物耐盐过程中的作用,以及可能参与植物耐盐过程OsCam1-1调节其转录。
背景
盐度是植物的一个主要的非生物约束,因为它引起渗透和离子胁迫。植物对这些胁迫的反应涉及复杂的分子和生化机制。盐度在许多方面对植物产生负面影响,包括抑制生长、发育、光合作用和产量[1,2].植物有系统的适应过程来应对盐胁迫,从胁迫感知机制开始,通过信号级联和基因表达调控来响应生理反应。先前的驯化过程包括通过渗透积累来调节根系的渗透压,通过根系形态的适应来最小化根系表面,通过气孔关闭来减少水分流失,消除多余的Na+通过挤压,隔室和重吸收过程,以及抗氧化系统[3.].这些过程需要来自呼吸的大量能量,需要通过成本效益高的策略来进行,这样植物才能保持缓慢生长的能力,并产生可收获的产量[4].
Ca2 +长期以来一直被认为是真核细胞信号转导途径中的主要第二信使。植物利用钙信号来感知和响应环境刺激,包括非生物胁迫[5].钙信号通路参与钙的改变2 +由于钙的释放而导致的细胞质浓度2 +来自细胞内的细胞器或来自细胞外的[5,6].首先,膜受体识别应激信号,导致磷脂酶C的激活。激活的磷脂酶C将磷脂酰肌醇-4,5-二磷酸水解为肌醇-1,4,5-三磷酸,介导细胞质钙浓度的增加2 +.这个信号被Ca感知到2 +传感器,通过调节应激反应基因表达的激酶或磷酸酶来增强下游效应,从而导致适应性生理反应[7,8].在拟南芥中已经鉴定出超过250种钙传感器蛋白,它们被分为三个主要家族:钙调蛋白(CaM)和钙调蛋白样蛋白,钙调神经蛋白b样蛋白,钙依赖蛋白激酶和钙和钙依赖蛋白激酶[9].
我们之前的转录组分析表明,水稻异柠檬酸裂解酶基因(OsICL)是盐胁迫诱导的,盐胁迫和过表达水稻钙调蛋白基因(OsCam1-1) [10].异柠檬酸裂解酶(Isocitrate裂解酶,ICL)是乙醛酸循环的关键酶,是TCA循环的旁路途径,将异柠檬酸转化为乙醛酸和琥珀酸。在拟南芥萌发过程中,ICL通过乙醛酸循环和糖异生作用,在利用β-氧化产物乙酰辅酶a的乙酰基单位进行脂糖转化中发挥重要作用[11,12].ICL是两种水稻的单拷贝基因[13]及拟南芥[14].核苷酸序列ICL水稻基因和拟南芥编码的氨基酸序列的同源性分别为66.07和72.50%。库珀和比弗斯[15]研究了蓖麻胚乳线粒体和乙醛糖体,发现乙醛糖体中85%以上的酶活性来自ICL和乙醛酸合酶,乙醛酸循环中的另一关键酶苹果酸合酶。ICL和苹果酸合成酶参与了叶片过氧化物酶体向乙醛酶体的转化,这一过程与衰老有关[16].
由于CaM作用涉及到许多广泛分布于细胞中的下游组分,CaM与这些组分联合的作用尚未完全了解,特别是CaM在盐胁迫响应中的作用。尽管CaM已被证明有助于植物的耐盐性[17,18],其实际机制还没有被描述。我们之前的研究表明OsICL表达是由OsCam1-1超表达(10然而,据我们所知,目前还没有明确的证据表明ICL促进植物耐盐性。因此,角色OsICL研究了CaM在耐盐性和CaM参与中的作用。
结果
诱导OsICL表达在米线过度表达OsCam1-1盐胁迫下
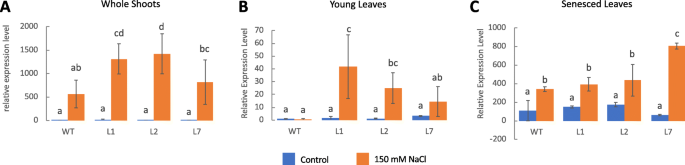
验证我们之前报道的转基因水稻过表达的转录组结果OsCam1-1[10],转录表达水平OsICL利用qRT-PCR技术对3个独立转基因株系L1、L2和L7的3周龄幼苗枝条进行检测。我们用了2——(ΔΔCT)方法分析基因表达随基因表达的相对变化OsICL以野生型(WT)水稻在非胁迫条件下为基准。表达水平OsICL在非胁迫条件下,野生型与3个转基因株系之间的差异无统计学意义。在盐胁迫条件下,OsICL3个转基因株系的表达量急剧增加,且远高于WT(图;1一个)。OsICL与基线相比,WT的表达水平增加了约500倍,L1、L2和L7的表达水平分别增加了约1300倍、1400倍和800倍。
我们确定了表达水平OsICL在野生型和三个转基因水稻株系中,第一片叶子(最低的叶子)代表衰老的叶子,第三片叶子代表年轻的叶子。在非胁迫条件下,叶片衰老程度显著升高OsICL表达水平高于幼叶。在盐胁迫条件下OsICL两种叶片的表达量均有所增加,但衰老叶片的表达量仍较高OsICL表达量高于幼叶(图1)。1b, c).在WT, L1, L2和L7中,在非胁迫条件下,衰老叶片的折变量分别比WT幼叶的基线值高约340,390,435和800。然而,与盐胁迫下野生型衰老叶片相比,这些变化仅在L7上具有统计学意义。有趣的是,三种转基因品系的幼叶数量都有所增加OsICLL1, L2和L7的表达水平比基线有大约40,25和15倍的fold change,而WT在幼叶中没有这样的变化(图。1b)。
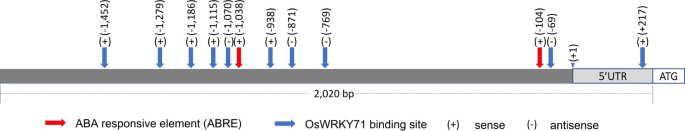
检查基因的启动子序列OsICL,我们使用了2020 bp的上游序列,其中包括一个来自Phytozome数据库的248 bp的预测5'UTR [19]并使用PLACE进行分析,PLACE是一种基于网络的工具,用于分析顺式作用的调控DNA元件[20.].在5'UTR上游预测了9个OsWRKY71 (LOC_Os02g08440)结合区域,在5'UTR预测了1个OsWRKY71结合区域。此外,在5'UTR上游发现了两个ABA响应元件(ABRE)。2).
转基因拟南芥表达的生成与验证OsICL
三种转基因拟南芥株系OsICL3FL9,Aticl拟南芥突变体表达OsICL由2138 bp的上游序列驱动AtICL基因;牛OsICL/icl,Aticl突变体表达OsICL由35SCaMV启动子驱动;和牛OsICL/WT, WT拟南芥表达OsICL由35SCaMV推广者驱动。PCR和琼脂糖凝胶电泳证实了重组质粒的构建1A和B)和所有5株植物的背景基因型:3FL9, OXOsICL/icl,牛OsICL/ WT,Aticl和WT(附加文件1C)和OsICL全部基因插入OsICL-表达转基因拟南芥株系(附加文件1D)。
qRT-PCR分析表明OsICL在含有该基因构建的3个转基因拟南芥中均有表达,而在野生型中没有表达Aticl非胁迫和盐胁迫条件下的突变体(Table1).在3个转基因拟南芥株系中,OXOsICL/WT表现出显著的高OsICL非胁迫和盐胁迫条件下的表达水平;然而,OsICL盐胁迫下的表达量显著高于非胁迫条件下。对于3FL9和OX这两个转基因拟南芥株系OsICL/icl,Aticl突变的背景下,OsICL表达量低于OXOsICL/ WT,但它的OsICLOX表达量较高OsICL/icl比3 fl9。拟南芥异柠檬酸裂解酶基因的表达(AtICL)结果表明,在盐胁迫下,AtICL只在WT和OX中检测到表达OsICL/WT,有WT背景的两行(表2).
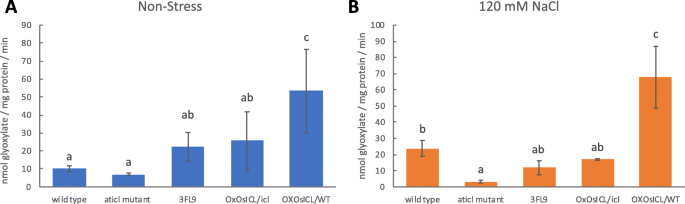
ICL的活性是通过测定乙醛酸的产生量来确定的。OX的ICL活性最高OsICL/WT在非胁迫和盐胁迫条件下(图;3.).在非胁迫条件下,3FL9和OX的ICL活性较高OsICL/icl比WT和Aticl在盐胁迫下,突变体的ICL活性增加,而在盐胁迫下,突变体的ICL活性没有增加Aticl变种人和其他同系人Aticl突变体的背景。
转基因拟南芥表达OsICL幼苗在盐胁迫下的萌发和生长均较好Aticl突变体
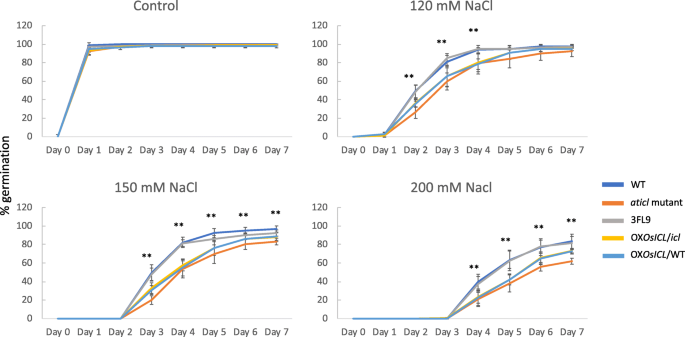
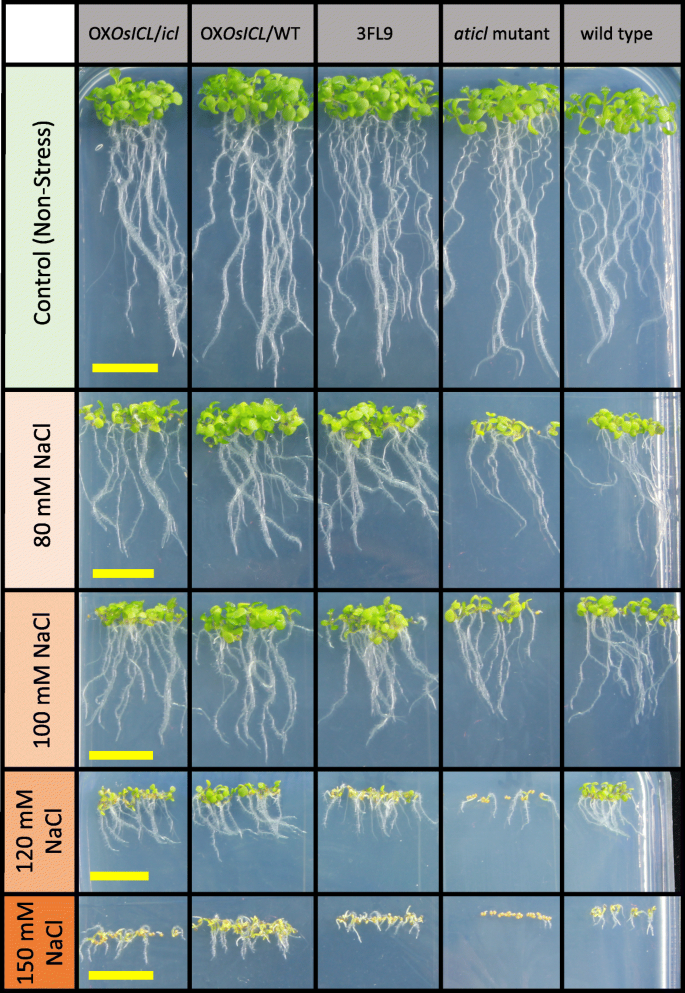
在非胁迫条件下,所有拟南芥株系在1天后几乎完全萌发(图1)。4).在120 mM NaCl胁迫下,WT和3FL9的发芽率最高Aticl拟南芥突变体的发芽率最低。有趣的是,尽管两种转基因拟南芥株系过度表达OsICL在35SCaMV启动子OX的控制下OsICL/ WT和牛OsICL/icl的种子萌发率低于野生型和3FL9,但盐胁迫下的种子萌发率高于野生型Aticl在较高的NaCl浓度下,这一现象更为明显。
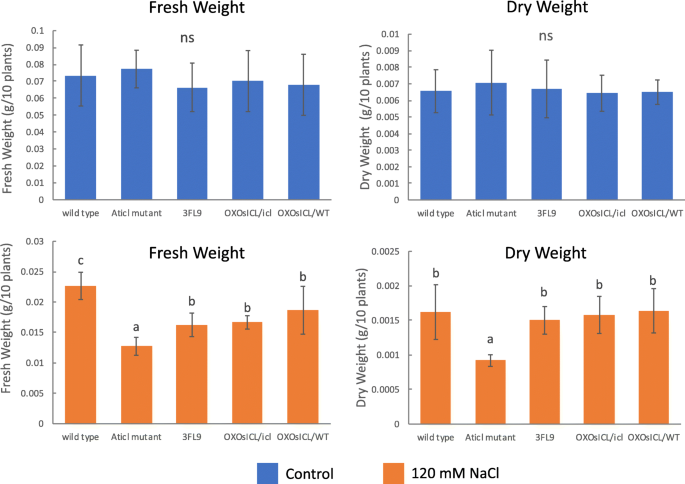
为了研究OsICL测定了5个拟南芥品系盐胁迫下幼苗生长的表达量、鲜重和干重。结果表明,在非胁迫条件下,5个拟南芥品系的鲜重和干重差异不显著。在盐胁迫下,鲜重和干重的变化规律相似,其中Aticl突变体的鲜重和干重显著低于其他拟南芥株系(图3)。5).此外,从外观上看,Aticl在盐胁迫下,突变体比其他拟南芥株系更容易出现生长缺陷,尤其是在高盐胁迫下(图3)。6).
转基因拟南芥表达OsICL盐胁迫对小鼠的影响较小Aticl突变体
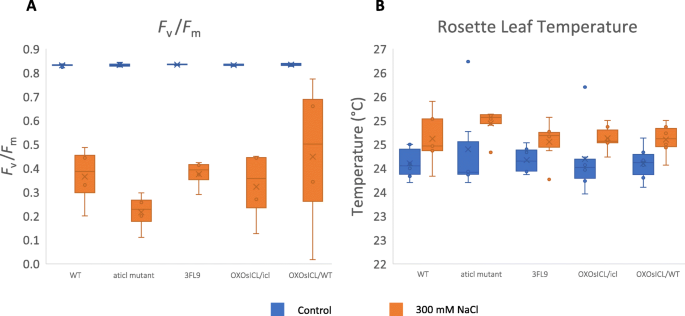
为了研究盐胁迫对光合作用的影响,Fv/ F米,表明光系统II在暗适应状态下的最大潜在量子效率[21],是用袖珍叶绿素荧光计测量的。结果表明,在无应力条件下,两种材料之间无显著差异Fv/ F米在5个拟南芥株系中,7a).在盐胁迫下Fv/ F米5个拟南芥株系均显著降低;的Aticl突变体的几率最低Fv/ F米价值观和牛OsICL/WT最高。4周龄转基因拟南芥株系的莲座叶温度OsICL, WT,和Aticl在不胁迫和300 mM NaCl胁迫3 d后测定突变体。在非胁迫条件下,5个拟南芥株系的温度没有差异(图3)。7b、附加文件2).在盐胁迫下,5个品系的温度均呈上升趋势,其中尤以Aticl莲座叶温度最高的突变体。总的来说,变化Fv/ F米莲座叶温度表明Aticl在5个拟南芥株系中,受盐胁迫影响最大的是突变体OsICL表达逆转了这些盐敏感表型Aticl敲除突变体。
对糖含量的影响OsICL盐胁迫下拟南芥的表达
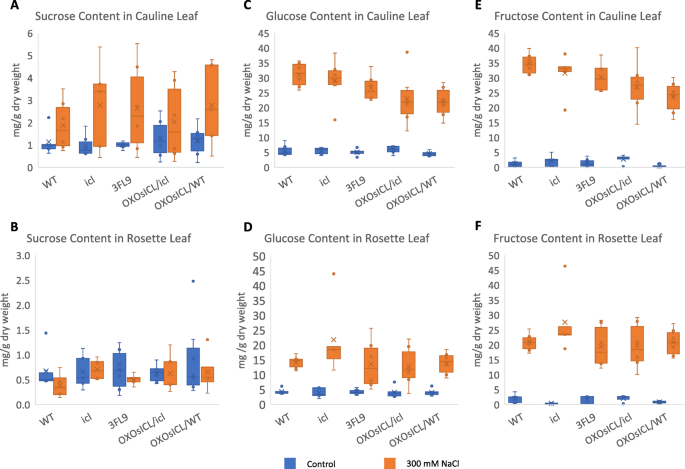
ICL在植物乙醛酸循环中的作用包括绕过TCA和通过糖异生过程将脂质转化为糖,因此我们测定了4周大的转基因拟南芥株系茎叶和莲座叶中蔗糖、葡萄糖和果糖的含量OsICL,Aticl在非胁迫和300 mM NaCl胁迫下,突变体和WT。我们发现,盐胁迫下5个拟南芥株系茎叶的蔗糖含量均有所增加,而莲座叶的蔗糖含量则没有增加。8a, b),而在相同的盐胁迫条件下,茎叶和莲座叶的葡萄糖和果糖含量均显著增加(图2)。8氟)。令人惊讶的是,茎叶和莲座叶中的葡萄糖和果糖含量Aticl盐胁迫下的突变体数量是5个拟南芥株系中最高的。在茎叶中,葡萄糖和果糖的含量OsICL-表达拟南芥系,尤其是OXOsICL/WT,显著低于盐胁迫下的含量Aticl突变体,与WT相似(图。8c, e).有趣的是在莲座叶中,葡萄糖和果糖的含量Aticl盐胁迫下突变体的葡萄糖和果糖含量显著高于野生型OsICL-表达拟南芥株系的多样性更强,与WT的株系相似。8d, f)。
讨论
转基因水稻过度表达OsCam1-1,表现出比WT更高的耐盐性[18的研究表明,它们的发病率大幅上升OsICL相比之下,盐胁迫下的转录水平松果体pinea在盐胁迫下,ICL活性降低[22].这表明,ICL可能在水稻耐盐机制中发挥重要作用。众所周知,衰老会影响ICL基因(23,24,我们找到了OsICL在非胁迫条件下,衰老叶片中表达量高于幼嫩叶片,这可能是一个预先编程的发育过程。在以前的报告,ICL也与衰老有关。例如,Gut和Matile [25)发现,ICLMcLaughlin和Smith [26)发现,ICL黑暗条件下,醋酸盐诱导基因表达。在大麦叶片和黄瓜子叶中,在黑暗诱导衰老过程中,不添加蔗糖时ICL蛋白丰度增加,叶绿素和蛋白质含量下降,而添加蔗糖则降低了其丰度,表明衰老过程中ICL和乙醛酸循环在缺碳水化合物组织中的作用[27].作者认为,ICL可能参与脂质转化为有机酸,然后用于从叶片蛋白质动员氨基酸。的增加OsICL我们观察到的盐胁迫下的表达可能会在碳可用性降低期间触发类似的代谢调整。
我们发现OsICL盐胁迫下野生型衰老叶片转录水平升高,而幼叶转录水平不升高。已有研究报道盐胁迫可诱导植物衰老。例如,Munns [28]报道了Na的毒性+导致早衰,Lutts等[29研究发现,NaCl处理可影响水稻叶片衰老相关参数,包括叶绿素荧光、膜透性、蛋白质和叶绿素浓度。此前有研究表明CaM1通过叶片黄化、活性氧(ROS)积累和基因表达调控拟南芥叶片衰老SAG12一个衰老相关基因,在拟南芥过表达中增强CaM1[30.].虽然我们发现OsICL盐胁迫对水稻衰老叶片的调控作用OsCam1-1-过表达株系与WT的差异不明显,可能是其表达量已经很高了OsICL该基因在黄芪幼叶中表达量显著上调OsCam1-1这些结果表明,高上调OsICL在幼叶中由OsCam1-1过表达可能导致耐盐表型。
转基因水稻过度表达OsCam1-1此前的研究表明,盐胁迫下ABA含量高于野生型[18].在2kb的上游序列中存在两个假定的ABREsOsICL表明,OsICLABA诱导盐胁迫下的表达量。ABA是植物体内的一种应激激素,参与长距离运输、气孔行为和气体交换的变化[31].ABA通过调控转录因子DREB2A/2B、AREB1、RD22BP1和MYC/MYB的相互作用调控靶基因的转录,并分别调控其顺式作用元件DRE/CRT、ABRE和MYCRS/MYBRS [32].ABA也能促进衰老[33].此外,在我们之前的转录组研究中,我们发现OsWRKY71(LOC_Os02g08440)表达诱导和增强OsCam1-1超表达(10],这反过来可能会上调表达OsICL.这一发现支持了9个假设的OsWRKY71结合区域的存在,这些区域在2 kb的上游序列中被检测到OsICL.另一份关于大米糊粉细胞的报告显示OsWRKY71ABA诱导[34].总之,这些结果表明转录OsICL可能直接受OsWRKY71转录因子驱动,而OsWRKY71转录因子受盐胁迫诱导的衰老、ABA和OsCam1-1表达式。
3种转基因植物苗期的生长参数,即发芽率、鲜重和干重OsICL-表达拟南芥株系与Aticl结果表明OsICL活性对盐胁迫下植物生长的影响。盐胁迫下幼苗生长受抑制程度最高的品种为Aticl结果表明,ICL在种子萌发生长阶段影响盐胁迫抗性。拟南芥是一种油料种子植物[35因此,在种子萌发过程中,储存在种子中的脂质需要转化为可用的碳源来产生能量。之前的研究表明icl突变拟南芥幼苗在无蔗糖补充的培养基中生长有缺陷,特别是在黑暗条件下,有趣的是,当[14C]醋酸盐被供应给icl突变系的数量14c标记的糖icl突变系显著低于WT [11,12].这表明,ICL可能在种子萌发过程中发挥作用,通过乙醛酸循环和糖异生作用,利用储存的脂质被β-氧化降解的产物乙酰辅酶a中的乙酰基单元合成糖。通过对两个甜菜杂交种的研究表明,高活力杂交种具有较高的抗病性ICL转录水平和ICL活性高于低活力杂交种,尤其是盐和H2O2因此,ICL可以作为幼苗活力的一个标记[36].综上所述,ICL可能通过调节植物的能量代谢发挥多种功能,包括耐盐作用。
营养期的结果进一步表明,盐胁迫对紫菜的生长发育有一定的影响OsICL-表示较低程度的行,如较高程度所示Fv/F米值与叶片中较低的温度相比Aticl突变体。在盐胁迫下,紫花苜蓿莲座叶温度Aticl突变体最高Fv/F米在所有被测植物中是最低的,这表明Aticl变种人更加混乱。有报道称,水稻在高盐胁迫下,红外热成像测得的叶片温度较高,且与气孔导度和相对含水量呈负相关[37].这表明Aticl突变体受盐胁迫和盐胁迫的影响最大OsICL表达逆转盐敏感表型Aticl突变体。这一观点得到了OsICL-过表达行对WT背景的影响最小Fv/F米盐胁迫下的价值。
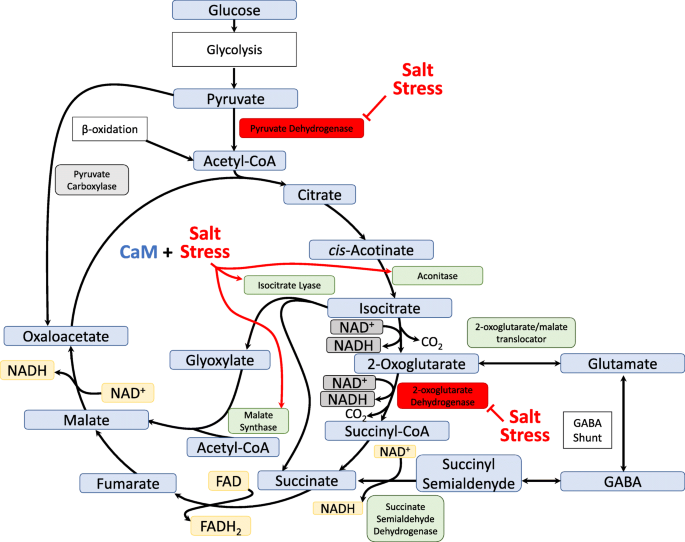
数字9描述了一种盐响应的ICL调控机制,可以在盐胁迫期间将能量代谢从TCA循环转移到乙醛酸循环。在乙醛酸循环中,ICL生成琥珀酸和乙醛酸,乙醛酸是苹果酸的前体。琥珀酸催化富马酸生成一个FADH2苹果酸催化草酰乙酸生成1个NADH。乙醛酸循环绕过了TCA循环的两个脱羧步骤。乙醛酸循环使用乙酰辅酶a的乙酰基单元,即乙醛酸转化为苹果酸盐和草酰乙酸转化为柠檬酸盐。乙酰辅酶a可由某些氨基酸(亮氨酸、异亮氨酸、缬氨酸、丙氨酸、丝氨酸、半胱氨酸)β-氧化或分解代谢产生[38].此前有研究表明,小麦的主要呼吸过程TCA循环受到盐胁迫的抑制,丙酮酸脱氢酶和2-氧戊二酸脱氢酶复合物对盐敏感;因此,呼吸代谢被转移到GABA分流途径,以提供替代碳源[39].在我们之前对水稻的研究中,我们发现编码乌头酶和苹果酸合酶的基因在盐胁迫和盐胁迫下表达量上调OsCam1-1超表达(10].由于丙酮酸脱氢酶复合物对盐胁迫很敏感,我们推测丙酮酸可能会转化为丙酮酸羧化酶生成草酰乙酸。此外,2-氧戊二酸脱氢酶复合物在盐胁迫下可能受到抑制。因此,我们提出,中断的TCA循环可能导致代谢产物流入乙醛酸循环,绕过盐抑制酶。
盐胁迫下,ICL可将能量代谢从三羧酸循环转移到乙醛酸循环。盐胁迫联合CaM诱导乌头酸酶、异柠檬酸裂解酶和苹果酸合酶基因表达[10].在乙醛酸循环中,ICL催化苹果酸生成草酰乙酸生成一个NADH和一个FADH2通过催化琥珀酸生成富马酸盐,绕过TCA循环的两个脱羧步骤。乙醛酸循环使用乙酰辅酶a的乙酰基单元,即乙醛酸转化为苹果酸盐和草酰乙酸转化为柠檬酸盐。在盐胁迫下,丙酮酸脱氢酶和2-氧戊二酸脱氢酶复合物受到抑制[39].此前有人提议将呼吸代谢转移到GABA分流途径,以提供替代碳源[39].因为丙酮酸脱氢酶复合物对盐胁迫很敏感,所以丙酮酸可能会转化为丙酮酸羧化酶,生成草酰乙酸。此外,由于2-氧戊二酸脱氢酶复合物在盐胁迫下受到抑制,中断的TCA循环可能导致代谢产物流入乙醛酸循环,绕过盐抑制的酶
乙醛酸循环产生NADH和FADH2被送入电子传递链以产生能量因此,如前所述,缺乏ICL的重要活性会破坏乙醛酸循环的代谢通量,而随着盐胁迫下丙酮酸脱氢酶和2-氧戊二酸脱氢酶的抑制,这可能会导致葡萄糖和果糖无法有效地进入中枢能量代谢过程的代谢通量中。我们发现,葡萄糖和果糖的含量Aticl在5个拟南芥植株中,盐敏感性最强的突变体株数最高OsICL恢复它的表达。这些结果为支持乙醛酸循环中的关键酶ICL在植物耐盐性中的作用提供了新的证据。
结论
这项研究表明,在大米中,OsICL在盐胁迫下通过适应能量代谢发挥作用OsCam1-1可能参与调控其转录。的作用OsICL在转基因拟南芥中发现了一个盐响应基因ICL表达逆转了盐敏感表型以及葡萄糖和果糖含量Aticl突变体。综上所述,在盐胁迫下,ICL可能促进能量代谢向乙醛酸循环的转变,从而调节碳平衡,提供必要的能量,从而促进植物的耐盐性。
方法
植物材料及生长条件
转基因Khao Dawk Mali 105(盐敏感)水稻三系过表达OsCam1-1[18]在吉田溶液中水培生长[40],为期3周,采用完全随机设计。然后用150mm NaCl处理4h。采集幼苗,液氮速冻。种子的Aticl拟南芥突变体(GK-008E03)产自英国诺丁汉拟南芥储备中心。种子用75%乙醇快速冲洗去污染,用2% NaOCl浸泡10分钟,然后用含吐温80的消毒水冲洗5-8次,然后转移到Murashige & Skoog (MS)培养基(PhytoTechnology Laboratories®,USA), 1% w/v蔗糖板。将种子播种在平板上,在4°C保存2天。然后将平板移入25°C的生长室或生长室,在16小时/8小时的明暗周期下进行1周。将植物转移到一个花盆中,花盆中含有种植材料,泥炭苔藓:珍珠岩:蛭石,比例为3:1:1,在相同的条件下生长,每2-3天浇水,直到植物成熟。种子在4℃下采收并储存。
存在分析
用冷冻的研钵和研杵,用液氮研磨植物叶片样本,直到它们变成细粉。按照制造商的规程,使用TRI-Reagent®(分子研究中心,美国)提取总RNA,然后将RNA溶解在二乙基焦碳酸酯处理的水中。用分光光度法和琼脂糖凝胶电泳法检测提取RNA的数量和质量。用无rnase - DNase I (Thermo Fisher, USA)处理RNA,使用iScript™cDNA Synthesis Kit (Bio-Rad, USA)转化为cDNA。qrt - pcr使用SsoFast™EvaGreen®Supermixes (Bio-Rad,美国)进行。本研究所用引物的序列和PCR条件见附加文件3..利用2——(ΔΔCT)和2——(ΔCT)方法EF1 -α作为内部控制。水稻基因表达分析采用4个生物重复,拟南芥基因表达分析采用5个生物重复。
表达OsICL的转基因拟南芥的构建
构建了两个重组质粒进行表达OsICL拟南芥中的pAtICL-OsICL-pK2GW7,设计用于驱动OsICL表达式,使用本机AtICL子,p35SCaMV -OsICL-pK2GW7,设计用于驱动OsICL利用35花菜花叶病毒(35SCaMV)启动子过表达。利用拟南芥异柠檬酸裂解酶基因上游2138 bp的pCAMBIA1301序列中β-葡萄糖醛酸酶和诺帕林合成酶终止子(GUS-NOS) 3个片段构建重组质粒(pAtICL)和水稻异柠檬酸裂解酶(OsICL)的编码序列(AK063353, KOME克隆号001-114-C03)。首先,DNA片段OsICL编码序列是用濒死经历我利用引物在5 '端限制位点濒死经历I_OsICL_F和OsICL_R(附加文件4),克隆到pTZ57R/T之前,使用氨苄西林平板上的蓝白色菌落筛选,TA克隆质粒(Thermo Fisher,美国),得到OsICL -pTZ57R / T。pAtICL序列是由Xba我和濒死经历我使用引物限制位点XbaI_pAtICL_F和pAtICL_濒死经历I_R(附加文件4),并克隆成OsICL -pTZ57R / T的Xba我和濒死经历我限制的网站。结果pAtICL-OsICL-pTZ57R/T经EcoR我和Xba一、GUS-NOS片段被设计EcoR我和XbaI利用引物限制位点;EcoRI_DTOPO_GUS-NOS_F和GUS-NOS_XbaI_R(附加文件4),然后克隆到pAtICL-OsICL-pTZ57R/T,得到重组质粒GUS-NOS-pAtICL-OsICL-pTZ57R / T。然后是一盒GUS-NOS-pAtICL-OsICL用DTOPO_GUS-NOS_F和OsICL_R引物(附加文件4).的GUS-NOS-pAtICL-OsICL将该片段插入到pENTR/D-TOPO gateway定向克隆质粒(Invitrogen™,美国)中。GUS-NOS-p卡带AtICL-OsICL利用LR克隆酶II (Invitrogen公司,美国)通过Gateway克隆法将pENTR/D-TOPO克隆到pK2GW7载体上。设计该重组质粒用于表达OsICL在本机AtICL启动子。另外两个质粒被设计成过表达OsICL而且OsCam1-1都是用OsICL片段,利用引物DTOPO_在起始密码子前加入CACCOsICL_F和OsICL_R(附加文件4).将该片段定向克隆到pENTR-DTOPO载体中,再通过Gateway克隆到pK2GW7载体中。因此,OsICL应该由pK2GW7载体上的35SCaMV启动子驱动。重组质粒GUS-NOS-p的DNA序列AtICL-OsICL -pK2GW7(附加文件5),牛OsICL -pK2GW7(附加文件6)测定。根癌土壤杆菌用单个质粒转化GV3101,用于浸花[41)的Aticl拟南芥突变体产生表达拟南芥株系OsICL在2138 bp的上游序列下AtICL(3 fl9), overexpressingOsICL(牛OsICL/icl).农也被OXOsICL -pK2GW7,用于WT拟南芥的花浸渍产生OsICL(牛OsICL/ WT) overexpressing线。
选取T1拟南芥种子,在1% w/v蔗糖MS + 50 ~ 100 μg/ml卡那霉素的培养基上进行培养。每个T1植株在卡那霉素下萌发30-100粒种子,测定T2种子的成活率。无对偶基因的半合子T2的预期存活率为75%。的χ2进行检验,并确定统计学意义为p< 0.05。将接受存活率为3:1的T2种子进一步培养获得后代种子(T3)。将T3种子置于加卡那霉素的MS培养基上,在半合子和纯合子的混合植株中寻找纯合子株系。因此,纯合子植株的存活率有望达到100%。
转基因拟南芥植株的PCR基因分型
基因组DNA是通过在1.5毫升的微管中使用密炼机MM 400 (Retsch,德国)研磨植物叶片(约100毫克)来提取的。然后取含200 mM Tris缓冲液(pH 7.5)、25 mM EDTA、250 mM NaCl和0.05% w/v SDS的植物基因组提取缓冲液300 μl与样品混合。在样品混合物中加入等体积的99%异丙醇,混合。12,000×g离心15 min,弃上清。将球团在室温下干燥约15分钟或直到异丙醇完全蒸发。加入50 μl灭菌蒸馏水使颗粒溶解。
采用LP、RP、LB三种引物进行PCR分型(附加文件)7).LP和RP位于该基因上,LB位于At第4外显子插入的T-DNA上ICL(附加文件8).在不插入T-DNA (WT)的拟南芥中,LP和RP引物的PCR产物约为911 bp,而在插入T-DNA的拟南芥中,LB和RP引物的PCR产物约为500 bpAtICL(Aticl突变体)。插入突变体的T-DNA足够长,可以阻止使用LP和RP引物进行PCR扩增。在杂合子植株中,期望得到两个911 bp和500 bp左右的PCR产物;因此,还需要再选一代纯合子植株,获得突变体供进一步实验。
采用特异性引物OsICL_Seq_M3_F的PCR基因分型(附加文件7),位于的编码区OsICL和35S_Terminator_Seq_R(附加文件7)进行确认OsICL插入到转基因拟南芥中。转基因拟南芥的PCR产物大小OsICL预计约为460 bp。
异柠檬酸裂解酶活性测定
拟南芥株系3FL9、OX的叶片组织总量约为50 mgOsICL/icl,牛OsICL/ WT,Aticl从3个生物重复中收集突变体和WT,在1% w/v蔗糖MS培养基中生长10天,在液氮中冷冻,并用密炼机研磨成细粉。然后,提取缓冲液500 μl (100 mM磷酸钾缓冲液,pH 7.6, 10 mM MgCl)2, 1毫米EDTA和1毫米DTT) [22]加入到地面样品中,通过涡流混合。4℃,12,000×g离心20分钟。上清液转移到新的微管中作为粗蛋白提取液用于酶活性测定,颗粒被丢弃。
然后,将提取的蛋白50 μl加入到含有50 mM磷酸钾缓冲液的440 μl反应缓冲液中,pH为6.9,50 mM MgCl2、10 mM EDTA和40 mM苯肼,由Cooper和Beevers [15],然后用移液管在路径长度为1厘米的1毫升夸脱试管中,在30°C混合。反应混合物在A处的吸光度324用分光光度计测定,待其稳定后,加入500 mM D-L异柠檬酸10 μl,混合均匀。然后,反应混合物在A处的吸光度324测量10分钟。0分钟和10分钟之间的差A324数值用来计算每10分钟的乙醛酸产量,使用乙醛酸标准曲线。在96孔板上,用Bradford试剂测定粗蛋白提取物馏分的蛋白质含量。吸光度的595使用酶标仪Synergy H1 (Biotek®,美国)进行测量,并使用牛血清白蛋白构建标准曲线。
增长的测量
拟南芥5个系的种子;3 fl9,牛OsICL/icl,牛OsICL/ WT,Aticl对突变体和WT进行如上去污处理。然后,将种子依次播种在NaCl浓度为0、100、120、150或200 mM的MS培养基上。拟南芥平板在4℃保存2天。移入生长环境后,每天观察萌发种子的数量,持续7天。我们进行了5个生物重复,每个生物重复包含每个品系的50粒种子。发芽率以百分数表示,并以标准差表示。
随着这些植物的生长步骤,生长期延长到10天。然后,每个生物复制10株幼苗Aticl拟南芥突变体和WT, 3FL9, OXOsICL/icl,牛OsICL称取鲜重/WT,测定鲜重。然后将样品放入热风烘箱中,60-70°C烘烤5-7天。将烤好的样品称量以确定干重。
叶Fv/ F米和温度测量
拟南芥株系3FL9、OX的4周营养期OsICL/icl,牛OsICL/ WT,Aticl在泥炭苔藓:珍珠岩:蛭石配比为3:1:1的花盆中生长,用300 mM NaCl处理3天。然后允许黑暗适应30分钟前Fv/ F米在黑暗条件下使用袖珍PEA荧光计(Hansatech,英国)进行测量。莲座叶温度测量采用前视红外C2热像仪(FLIR,美国)。为Fv/ F米, 4个生物重复,叶片温度6个生物重复。
糖含量的测量
拟南芥株系3FL9、OX的4周营养期OsICL/icl,牛OsICL/ WT,Aticl在6个生物重复的泥炭苔藓:珍珠岩:蛭石3:1:1的花盆中生长,用300 mM NaCl处理3天。采集莲座叶,液氮冷冻,冻干。测量干重,将样品磨成细粉。样品用去离子水提取并过滤。采用高效液相色谱(HPLC)(日本岛町)和Hi-Plex Ca (Duo)柱(Agilent,美国)测定葡萄糖、蔗糖和果糖的含量。HPLC流速为0.25 ml/min,柱温为85°C,以100%超纯水为流动相,采用折射率检测器(RID)检测糖。
统计分析
q rt - pcr、酶活性测定和生长参数数据的比较采用方差分析(ANOVA),平均值与Duncan多重极差检验进行比较,显著性设为p< 0.05。发芽率数据采用方差分析进行比较,平均值采用Duncan多极差检验进行比较,显著性设为p< 0.01。
数据和材料的可用性
所有相关数据都包含在本文及其附加文件中。
缩写
- 阿坝:
-
脱落酸
- AtICL:
-
拟南芥异柠檬酸裂解酶基因
- 凸轮:
-
钙调蛋白
- ICL:
-
异柠檬酸裂解酶
- OsCam1-1:
-
栽培稻L. calmodulin 1-1基因
- OsICL:
-
栽培稻L.异柠檬酸裂解酶基因
- 柠檬酸:
-
三羧酸循环
- WT:
-
野生型
参考文献
张志强,张志强,张志强,等。干旱和盐胁迫下植物光合作用的调控机制。安机器人。2009;103(4):551 - 60。
曾玲、MC香农、Lesch SM。盐度胁迫的时机对水稻生长和产量构成有影响。水资源管理。2001;48(3):191-206。
黄晓东,张晓东,张晓东,等。水稻耐盐生理机制的研究进展。大米。2012;5(1):11。
陈志辉,陈志辉,陈志辉,陈志辉,陈志辉,等。作物耐盐性的能量消耗。新植醇。2019;0(0)。在新闻
植物非生物胁迫中的钙信号。载:《细胞学国际评论-细胞生物学概览》,第195卷;1999.p . 269 - 324。
植物钙信号网络的研究进展。植物信号行为。2007;2(2):79-85。
Einspahr KJ, Thompson GA。植物磷脂酰肌醇4,5-二磷酸水解的跨膜信号传导。植物杂志。1990;93(2):361。
寒冷、盐度和干旱胁迫:综述。生物化学。2005;444(2):139-58。
黄志强,张志强,张志强,等。钙离子传感器在植物对生物和非生物胁迫响应中的作用。植物学报,2016;
杨永勇,李志强,李志强,李志强。水稻盐胁迫下钙调素信号转导途径的转录组分析及靶基因鉴定。植物学报,2018;18(1):335。
JE Cornah, Germain V, Ward JL, Beale MH, Smith SM。缺乏乙醛酸循环酶苹果酸合酶的拟南芥突变体的脂质利用、糖异生和幼苗生长。生物化学学报。2004;27(4):329 - 331。
Eastmond PJ, Germain V, Lange PR, Bryce JH, Smith SM, Graham IA。缺乏gloxylate循环的油籽萌发后生长和脂质分解代谢。美国国家科学院。2000, 97(10): 5669 - 74。
陆勇,吴玉蓉,韩波。水稻幼苗异柠檬酸裂解酶和苹果酸合酶的厌氧诱导表明乙醛酸循环的重要代谢作用。生物学报,2005;37(6):406-14。
桑尼克罗夫特·D,谢尔森·SM,史密斯·SM。利用基因敲除研究植物代谢。中国地质大学学报(自然科学版)2001;
蓖麻胚乳中的线粒体和乙醛糖体:酶的组成和催化能力。中国生物化学学报,1997,16(3):357 - 362。
李志强,李志强。南瓜子叶衰老过程中乙醛酸循环酶的发育。植物生理学报。1991;32(4):555-61。
张志强,张志强,张志强,等,Bülow L.牛钙调素在烟草中的表达使烟草在生理盐水培养基中萌发更快。植物科学。2004;166(6):1595 - 604。
黄建平,李建平,李建平,等。oscam -1盐胁迫传感器在水稻ABA积累和耐盐性中的作用。植物学报,2012;55(3):198-208。
刘志强,刘志强,刘志强,刘志强,刘志强,等。植物体:绿色植物基因组学的比较平台。中国生物医学工程学报(英文版),2012;40(D1): D1178-86。
K Higo, Ugawa Y, Iwamoto M, Korenaga T. Plant cis-acting regulatory DNA elements (PLACE)数据库:1999。中国生物医学工程学报1999;27(1):297-300。
叶绿素a荧光图像的光合效率分解为光化学和非光化学组分- qP和Fv−/Fm-的计算;没有测量Fo。Photosynth杂志1997;54(2):135 - 42。
干旱、盐度和高温对松果种子萌发的影响不同。森林Res-Jpn J。2008; 13(5): 326 - 30。
黄永杰,杜坤勇,叶敏恩,蒋文杰,孙德福,陈绍刚。甘薯叶片衰老上调基因的克隆与鉴定。杂志杆菌。2001;113(3):384 - 91。
李朗,王春春,黄丽莲,陈思光。水稻叶片衰老:衰老上调基因的克隆与鉴定中国生物医学工程学报,2001;20(3):317 - 322。
衰老大麦叶片乙醛酸循环关键酶的诱导。足底。1988;176(4):548 - 50。
McLaughlin JC, Smith SM。离体黄瓜子叶和原生质体中乙醛酸循环酶合成的代谢调控。足底。1994;195(1):结束。
陈泽,Walker R, Acheson R, Técsi LI, Wingler A, Lea P, Leegood R.异柠檬酸裂解酶和磷酸烯醇化丙酮酸羧激酶参与大麦和黄瓜子叶衰老过程中的糖异生?植物生理学报。2000;41:96 - 7。
盐胁迫和水分胁迫的比较生理学。植物细胞环境。2002;25(2):239-50。
刘文华,李文杰,李文杰,等。耐盐性不同的水稻品种叶片nacl诱导衰老的研究。安机器人。1996;78(3):389 - 98。
戴晨,李毅,李ic,南HG,郭晋明。钙调素1调控拟南芥衰老和ABA反应。植物学报,2018;9:803。
Wilkinson S, Davies WJ。基于aba的化学信号:协调植物对压力的反应。植物细胞环境。2002;25(2):195-210。
脱落酸与非生物胁迫信号传导。植物信号行为。2007;2(3):135-8。
毛晨,卢胜,吕波,张波,沈娟,何晶,罗玲,席丹,陈晓明。水稻NAC转录因子ABA生物合成对叶片衰老的促进作用。植物杂志。2017;174(3):1747。
谢智,张志良,邹霞,黄杰,鲁思P,汤普生,沈启杰。水稻WRKY基因超家族的注释和功能分析揭示了糊粉层细胞中脱落酸信号的正调控和负调控。植物杂志。2005;137(1):176。
李艳,李志强,李志强,等。拟南芥种子含油量与植物间变异的关系。植物化学。2006;67(9):904 - 15所示。
de los Reyes BG, Myers SJ, McGrath JM。甜菜幼苗活力标记物乙醛酸循环酶的胁迫差异诱导(甜菜属).基因组学。2003;269(5):692 - 698。
宋泽民,郑日日,P Sung-Han, K taek - ryun, L kang - seob, J Mi-Jeong, K kyuwhan, L Seong-Kon, P Soo-Chul .高通量红外成像技术对盐胁迫下水稻表型的影响。机器人学报,2014;73(1):312-21。
Hildebrandt Tatjana M, Nunes Nesi A, Araújo Wagner L,博朗惠普。植物氨基酸分解代谢。摩尔。2015;(11):1563 - 79。
Che-Othman MH, Jacoby RP, Millar AH, Taylor NL。盐胁迫下小麦线粒体呼吸从三羧酸循环转向GABA分流。新植醇。2019;0(0)。在新闻
Yoshida S, Forno AD, Cock HJ, Gomez AK。水稻生理研究实验室手册。马尼拉:国际水稻研究所;1976.
花浸渍法:一种农杆菌介导的拟南芥转化的简化方法。植物j . 1998; 16(6): 735 - 43。
确认
我们感谢Thammaporn Kojonna的帮助Fv/ F米测量。我们感谢来自Edanz集团(www.edanzediting.com/ac),以批判性地审查和编辑该手稿的草稿。
资金
这项工作得到了泰国研究基金的部分资助。BRG5680019)和朱拉隆功大学基金(Ratchadaphiseksompot捐赠基金)。wy获泰国研究基金皇家金禧博士项目rgj (PHD/0043/2556-4.C.CU/56/G.1.O.XX)资助。组学科学和生物信息学中心是朱拉隆功大学卓越研究绩效项目的资助项目:朱拉隆功大学学术进步进入第二个世纪项目(CUAASC)。各资助机构均以研究计划为基础发放经费,对实验设计、数据收集、分析和解释以及稿件撰写均无影响。
作者信息
从属关系
贡献
WY与SS和LQ合作开展实验室工作,WY和TB进行数据分析和解释。WY准备了数据和表格。WY和TB起草了手稿。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
额外的文件1。
A) PCR扩增验证克隆GUS-NOS,AtICL上游序列,OsICL编码序列进入重组质粒GUS-NOS上游,AtICL-OsICL-pK2GW7: lane M, DNA标记;lane 1,克隆的PCR产物GUS-NOS尺寸约为2300bp;道2,克隆的PCR产物AtICL上游序列大小约为2100 bp;lane 3,克隆的PCR产物OsICL编码序列大小约为1700 bp。B) PCR扩增验证插入OsICL重组质粒中的编码序列OsICL-pK2GW7: lane M, DNA标记;lane 1,克隆的PCR产物OsICL编码序列大小约为1700 bp。C)拟南芥转基因背景的PCR分型:M巷,DNA标记;巷1aticl突变体;巷2野生型;3巷3 fl9;巷4牛OsICL/icl;巷5头牛OsICL/ WT。D) PCR扩增验证OsICL基因插入:lane M, DNA标记;巷1aticl突变体;巷2野生型;3巷3 fl9;巷4牛OsICL/icl;巷5头牛OsICL/ WT。用1%琼脂糖凝胶TAE缓冲液在100 mV下进行30 min的琼脂糖凝胶电泳分析。
额外的文件2。
基于FLIR C2热像仪的拟南芥5个株系的热像图。
额外的文件3。
用于qRT-PCR的引物核苷酸序列和PCR条件。
额外的文件4。
引物的核苷酸序列用于构建重组质粒进行表达OsICL.加粗字符表示酶切位点,斜体字符表示添加的有利于酶切结合的核苷酸,下划线字符表示有利于定向TOPO克隆的序列。
额外的文件5。
用于表达的重组质粒的结构示意图OsICL在…的控制下AtICL启动子。A)采用酶切位点克隆策略将3个片段插入pTZ57R/T,从重组质粒GUS-NOS-p中扩增目的片段AtICL-OsICL通过PCR -pTZ57R / T。B) GUS-NOS-pAtICL-OsICL利用“CACC”位点将卡带定向插入到pENTR/DTOPO中,采用Gateway克隆策略将其亚克隆到目的载体pK2GW7中。
额外的文件6。
过表达重组质粒的构建示意图OsICL采用定向TOPO和Gateway克隆策略。
额外的文件7。
引物的核苷酸序列用于野生型的PCR分型aticl突变体和转基因拟南芥株系。
额外的文件8。
插入的T-DNA位置在icl拟南芥突变体GK-008E03及其引物的位置icl拟南芥突变体基因分型:LP和RP分别为位于拟南芥突变体上的引物AtICL基因和LB代表引物位于插入的T-DNA上。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
袁勇,W., Sirikantaramas, S., Qu, LJ。et al。异柠檬酸裂解酶在植物耐盐性中起着重要作用。BMC植物杂志19日,472(2019)。https://doi.org/10.1186/s12870-019-2086-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2086-2
关键字
- 异柠檬酸裂解酶
- 钙调蛋白
- OsCam1-1
- OsICL
- 盐胁迫