摘要
背景
草豌豆(Lathyrus巨大成功)是一种未充分利用的作物具有高耐干旱和洪水的压力和潜在的维护粮食和营养安全在气候变化面前。在植物的组织中的神经毒素β-L-草-2,3-二氨基丙酸(β-L-ODAP)的存在限制了其通过作为主食作物。为了帮助检测材料具有非常低的神经毒素水平,我们已经开发了两种新的方法来测定ODAP。第一,一个版本一种广泛使用的分光光度测定的,修饰的,可提高吞吐率,允许对低毒素线大量人口的种质的快速筛选和第二个是一个新颖的,质谱过程以检测非常少量ODAP的用于研究目的和新品种鉴定。
结果
描述了一种基于建立的高通量ODAP测量的分光光度法的平板分析方法。此外,本文还介绍了一种基于液相色谱质谱(LCMS)的β- l - odap定量方法。这种方法使用一个内部标准(二13.c标记的β-L-ODAP),允许在草豌豆组织样本中准确定量β-L-ODAP。还介绍了本标准的合成方法。对两种方法进行了比较;分光光度法在鹰嘴豆和豌豆中检测不到β-L-ODAP样吸光度,但灵敏度较低。在此基础上,采用LCMS方法对不同组织中β-L-ODAP进行了定量分析。
结论
板基分光光度法允许在大量样品中定量总ODAP,但其低灵敏度和不能区分α-和β-L-ODAP限制了其在低ODAP样品中准确定量的用处。再加上LCMS的稳定同位素内标,能够以高灵敏度准确定量草豆样品中的β-L-ODAP,这些方法允许鉴定和表征ODAP含量非常低的草豆品系。LCMS方法为β-L-ODAP定量提供了新的“金标准”,特别是对现有和新的低和/或零β-L-ODAP基因型的验证。
背景
草豌豆(Lathyrus巨大成功)是一种豆科作物,对环境胁迫因素,特别是干旱和洪水,具有特殊的耐受性[1,2,3.].这使得这种作物在改善世界缺水地区的粮食安全方面具有相当大的潜力[3.,4].目前,25%的农业土地和40%的灌溉农业土地遭受水资源紧张[5].由于气候变化的影响,这些比例在21世纪可能会迅速增长[6].尽管它具有粮食安全的潜力和8000年的种植历史[7,8,9,10.],而草豆仍未得到充分利用,主要原因是它与神经鞘炎有关[11.,12.,13.,14.,15.,16.,17.β-毒素引起的N-oxalyl-L-α,β二氨基丙酸(β-L-ODAP),也被称为β-N-草酸-氨基- l-丙氨酸(BOAA)或dencicine,由Lathyrus巨大成功和相近的物种[18.].少量β-L-ODAP含量降低的品种已被公布,但还没有完全不含β-L-ODAP的品种[4,19.,20.,21.].低β-L-ODAP品种或β-L-ODAP无品种的开发一直由缺乏相应的检测到屏幕人口众多的草豌豆加入或突变体的背面。第一种测定法开发用于测量ODAP依靠一个分光光度法[22.后来被许多其他研究人员采用[23.,24.].该测定是使用最广泛的[25.,26.,27.,28.,因为它的设置和运行成本低,但缺乏敏感性和特异性。该分析的所有变化都基于2,3-二氨基丙酸与β-巯基乙醇的相同反应o-phthalaldehyde (OPA) in the presence of a tetraborate buffer system to form a yellow soluble pigment the concentration of which is measured by spectrophotometry at 420 nm. None of them, however, distinguishes between the α - and the β-isomers of ODAP and so they are subject to a slight overestimation of the toxin content since grass pea contains a small amount of the α-isomer and only the β-isomer is the active neurotoxin [29.].
已经描述了多种比分光光度法灵敏度和准确度更高的β-L-ODAP测定方法,包括毛细管区带电泳[29.,薄层色谱法[30.]及高效液相色谱法[30.,31.,32.,33.].使用液相色谱质谱(LCMS)技术[34.]或气相色谱质谱联用(GCMS) [35.]测定人参中β- l - oddap (帕纳克斯,但尚未应用于草豌豆。然而,这些方法往往依赖于费力和昂贵的制备步骤,这限制了资源贫乏环境下的吞吐量和效用。为了解决这些局限性,我们开发了一种成本效益高的筛选方法,该方法基于Rao首次描述的平行光度法[22.](以下称为Rao分析),采用96孔格式。这种简化的方法适用于群体筛选、育种和常规安全性分析。此外,我们描述了一种新的、高精度、灵敏度高的液相色谱柱色谱法测定β-L-ODAP含量。这种方法使用重同位素标记的β-L-ODAP内部标准,为未来低β-L-ODAP和零β-L-ODAP草豆品种的特征提供了“金标准”分析。
结果
高通量平板分光光度法测定ODAP
饶测定的化学[22.,以允许使用标准的96孔板格式同时处理多个样品。出于筛选的目的,高精度是不需要的,因为人们希望减少来自大种群的噪声来识别异常值(例如非常低到零ODAP包含线),然后可以使用额外的方法在分层方法中精确测量其ODAP含量。简而言之,该分析方法包括直接将植物材料收集到96孔板中,冷冻干燥材料(此时可存储),粉碎,然后以μL体积提取。就粗筛的目的而言,如果样品是同一类型的,例如嫩枝尖,则不需要预先称重。提取液再细分,其中一部分与KOH水解生成l -2,3-二氨基丙酸(L-DAP),然后与Rao试剂(OPA和β-巯基乙醇)反应生成色素。第二个分馏物与Rao试剂平行直接反应,提供一个非水解的“背景”读数,然后从水解提取物的读数中减去。这消除了由ODAP以外的物质引起的噪声,导致在420 nm处的吸光度[24.].用读版分光光度计测定两板孔的吸光度,并按方法部分计算odp含量。每一版都含有一系列标准量的L-DAP供参考,以确保板间的一致性。数字1显示L-DAP连续稀释产生的吸光度值随L-DAP浓度线性增加。在L-DAP浓度低于0.025 mM时,吸光度测量显示读数之间有很大的差异,这表明本测定法的检测限。添加了L-DAP的非水解草豆提取物在低L-DAP浓度下的读数明显高于L-DAP标准(绿色曲线)。这说明,为了去除提取液中其他化合物引起的背景吸光度,需要进行消隐处理。在减去非水解提取物的吸光度测量值后,空白加标提取物的读数(橙色曲线)与单独使用L-DAP的稀释系列读数没有区别。因此,测量非水解样品产生的吸光度是必要的,以产生准确的测量,特别是在低浓度的L-DAP/β- l - oddap。我们基于平板的分析方法足够灵敏和准确,可以在草豆样品中测量β-L-ODAP,并可能用于检测大群体材料中ODAP含量的变化,因为一个操作人员每天可以处理超过1000个样品。
一种准确的β -L-ODAP质谱分析方法
为了在低ODAP样品中量化ODAP,并证明我们的高通量分光光度法的有效性,我们希望开发一种具有高特异性、灵敏度和准确性的“金标准”方法。此类分析通常基于液相色谱和串联质谱,使用选择性反应监测(SRM)。ODAP是一种困难的分析物,因为它不适合反相色谱;它非常亲水,不会被保留。Ghosh等人[30.],最近提出了一种基于HPLC的测定中,但ODAP在柱的死体积洗脱。由于没有柱上保留,ODAP不能充分相对于提取物中的其它亲水性组分中选择。对于我们的“金标准”实验中,我们选择了衍生处理ODAP添加疏水性。ODAP可以通过适用于氨基酸的任何常规方法进行衍生,但我们选择的沃特世的AccQ-标签™系统,是根据它的使用,可靠性简单,和衍生产品的高稳定性。我们选择以检测串联质谱产品,但的AccQ-标签™衍生化还提供了荧光和紫外吸收作为替代,尽管检测的不太准确,手段。质谱是从不同的电离效率和选择性的敏感,但受到影响。也可以在提取过程中丢失的分析物。误差的两个源可以通过使用内标是所述分析物的同位素的被校正。因为它是化学上相同的被分析物,它会遭受同样的损失和电离效率相同的变化,但它可以从由质谱仪分析物区分开来,基于其增加的质量。
质谱内标的合成
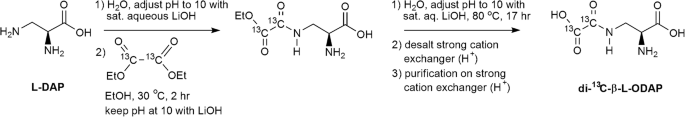
为了产生稳定同位素标记的β-L-ODAP,我们考虑用氘标记,13.C,15.N或其组合。基于已公布的合成程序和稳定同位素标记起始材料的可用性,我们决定13.C-β标签-L-ODAP的草组。可使用草酸盐甲基钾[来实现L-DAP的酰化36.但是在我们手中,由于准备考试的困难,结果并不令人满意13.C标记的试剂。
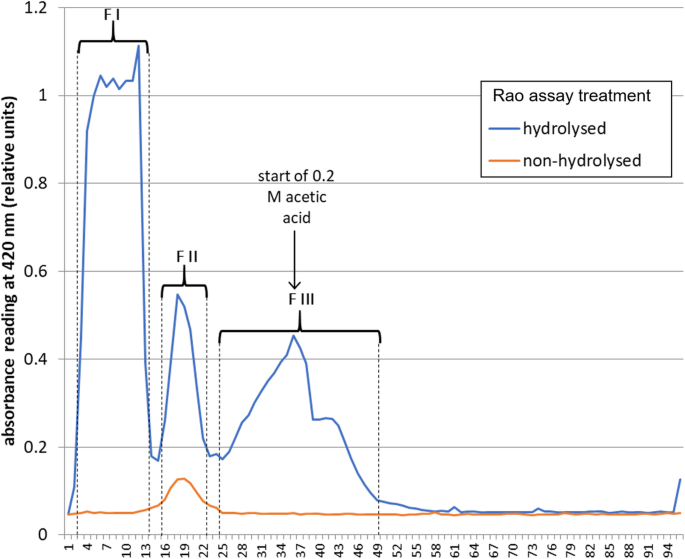
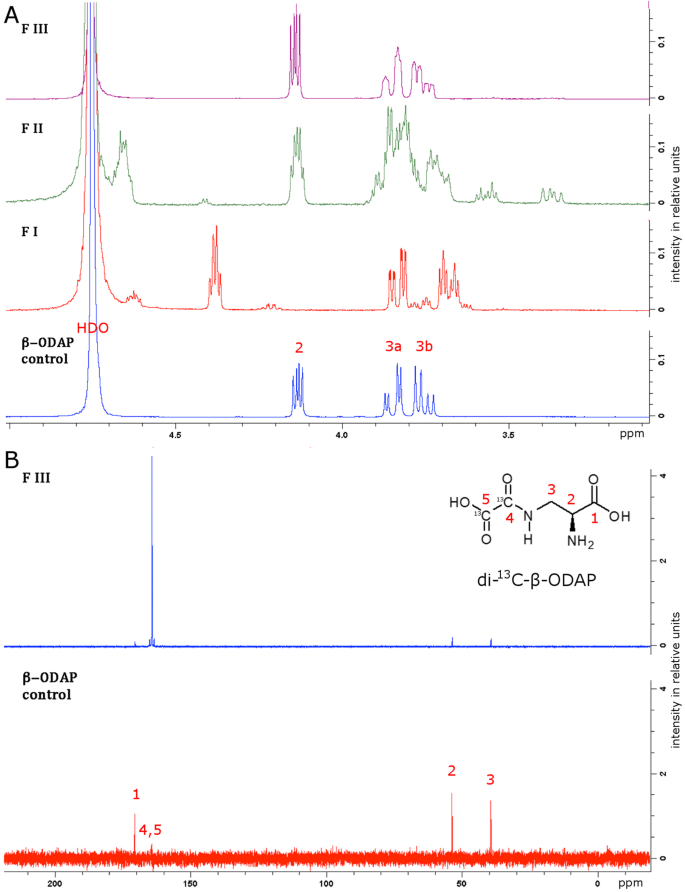
另一种选择是草酸二乙酯[37.]带来的β氨基的在L-DAP的酰化(图2).当使用草酸二乙酯-13.C2反应产生了复杂的中间产物混合物,所有中间产物都受到碱(氢氧化锂,LiOH)催化酯水解。采用强酸性阳离子交换树脂(Dowex 50WX8-400)去除锂离子。将脱盐后的样品用醋酸酸化至ph5,并应用于新鲜的阳离子交换树脂柱中。先用水洗脱柱,然后用乙酸洗脱柱。每个馏分(5 mL)采用Rao测定β-L-ODAP含量(图5)。3.);将馏分合并(FI到FIII),如图所示。3..1H - - -13.C-NMR谱进行鉴定二13.C-β-ODAP三个合并的级分。部分Ⅲ的质子NMR谱对应于一个真实的β-L-ODAP标准(图3的光谱。4光谱与Abegaz等人报告的数据吻合良好[38.].
净化di -13.C -β-ODAP。从离子交换色谱收集的组分FI到FIII的核磁共振分析。一个1馏分FI到FIII的H NMR谱图(见图)。3.)的光谱比较真实的β-L-ODAP标准。组分III的光谱与β-ODAP标准相对应。b13.FIII的C-NMR谱与正宗β-L-ODAP的谱进行比较。两个非常强的信号在164.4和164.3 ppm对应13.C-labelled乙二酰集团
为最终确认二13.C-β-ODAP,馏分III收集用于13.理化性质(无花果。4观测到的峰值分别为170.6、164.4、164.3、53.7和39.4 ppm13.C-NMR谱图显示,β-L-ODAP标准品的化学位移和相对强度,除164 ppm的两个峰(C4和C5)外,其余峰的化学位移和相对强度要高得多13.C-β-ODAP样品,提示高度13.在草酰部分的两个位置上。未观察到其他峰,表明分离得到的二氯苯的纯度13.C -β-ODAP。反应共产生4.2 mg的二-13.C-β-ODAP为理论收率的6.6%。低得率可以解释为各种副产物的生产,包括二13.C-α-ODAP,在其他馏分中捕获。
分光光度法和LCMS测定β-ODAP的含量具有高度相关性
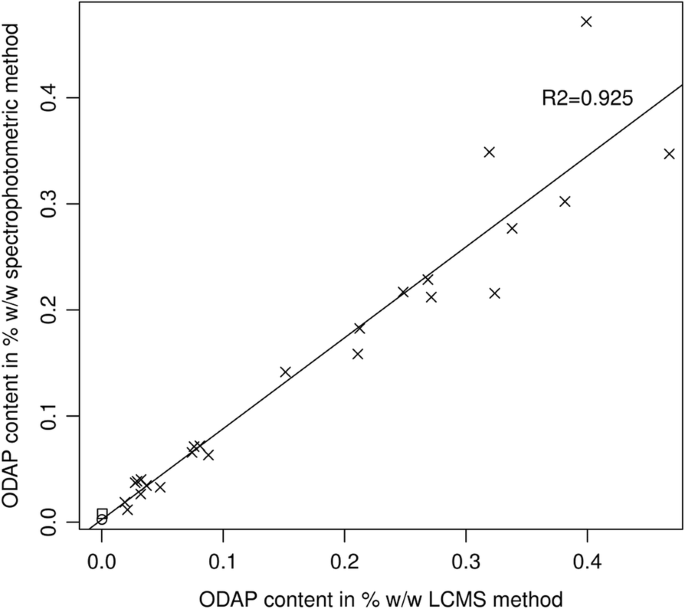
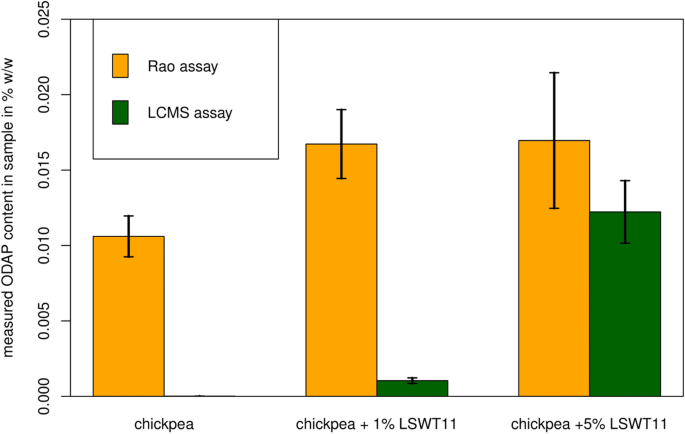
数字5显示了24个草豆种子样本以及一个豌豆和鹰嘴豆种子样本的数据集,每个样本都使用分光光度法(Rao)和基于lcms的内标新方法测量odp含量。本研究选取的草豆样品分为高ODAP和低ODAP基因型,ODAP含量在0.01 ~ 0.47% w/w之间,生长条件相同。两种方法高度相关,线性回归R20.925价值。相同的数据示于表1基因型。
使用LCMS测定β-L-ODAP的敏感性和准确性
两种方法对ODAP的敏感性和选择性明显不同。虽然该方法对草豆样品具有良好的一致性,但对豌豆和鹰嘴豆样品,分光光度法产生的读数分别相当于0.008和0.003% ODAP。相比之下,LCMS方法在两个样品中均未发现可检测到的β-L-ODAP (< 0.0005%;表格1).
基于lcms的方法的特异性是基于色谱保留时间、前体离子的质量和前体形成的片段,这使得该方法与Rao分析互补。在AccQ-Tag™衍生的氨基酸中,主要的片段是标签本身。因此,我们使用质量跃迁来定量β-L-ODAP和二-13.C-β-ODAP是m / z347.1→171.1,349.1→171.1。该方法适用于具有适当分子量和保留时间的胺类化合物;鹰嘴豆和豌豆不含这种化合物。
任何分析方法的灵敏度都受到其选择性的限制,因为在与分析物难以区分的高水平背景信号存在的情况下,不可能检测或定量低浓度的正确分析物。为了检验LCMS和分光光度法的灵敏度,我们测定了鹰嘴豆籽粕中添加1%或5%草豆籽粕(LSWT11)样品中的ODAP含量,结果如图所示。6.二聚氰胺的平均回收率13.C-β-ODAP在所有种子粕样品中的标准差为80.0%±6.6%。二氰的平均回收率13.C-β-ODAP一个cross the standard series was 100.0% ± 7.5% std. error. The spectrophotometric assay did not show a significant difference between the 1 and 5% grass pea samples, indicating that at this very low abundance, corresponding to 0.01% w/w ODAP, the spectrophotometric assay is limited to detection of the presence of ODAP but cannot reliably quantify the amount present. The LCMS-based assay allowed quantification of β-L-ODAP in the 1% spiked samples, corresponding to a β-L-ODAP concentration of 0.002% w/w. No peak corresponding to β-L-ODAP was detected in the pure chickpea sample using the LCMS-assay.
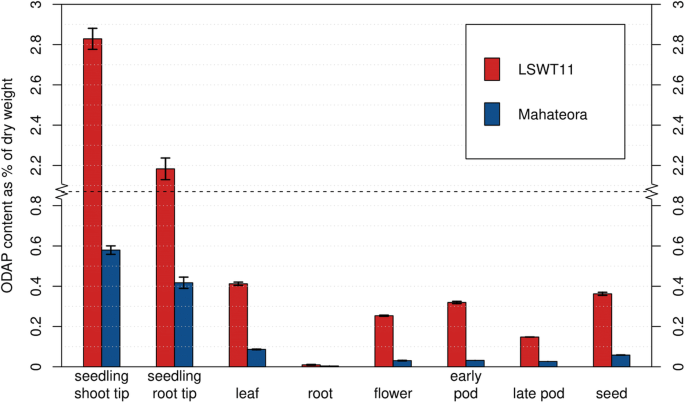
利用萃取前的内标液相色谱法,我们定量了印度高odap地方品种LSWT11和低odap品种maateora(图2)多个组织中的β-L-ODAP含量。7).试验检测的8个组织分别是幼苗茎尖、幼苗根尖、叶片、根、花、早荚、晚荚和种子。结果表明,β-L-ODAP在不同组织间存在较大差异,以LSWT11为例,幼苗茎尖干重为2.829%±0.052% (std. error),根干重为0.010%±0.002%,种子为0.362%±0.007%。β-L-ODAP在所有组织中都有可测量的浓度,但在成熟的根中只存在微量。
在各组织中,maateora的β-L-ODAP含量显著低于LSWT11p< 0.001水平,但根的差异不显著(p> 0.08)。β-L-ODAP在maateora各组织中均检测到,在幼苗茎尖为0.579%±0.021% w/w,在根中为0.004±0.000%,种子β-L-ODAP含量为0.058%±0.001%。
讨论
植物组织中ODAP的测定长期依赖于已建立的Rao [22.].This uses the difference of absorbance measurements at 420 nm between hydrolysed and non-hydrolysed samples following treatment witho苯二醛。它的特异性是基于水解反应和成色反应。在大多数应用程序中,o-邻苯二醛与氨基酸反应生成荧光产物,在420 nm处无吸光度,ODAP除外。Rao将ODAP的行为归因于其邻近的胺基[22.].因此,Rao分析是对任何水解产生邻近胺基的化合物的测量,从豌豆和鹰嘴豆的假阳性测量可能表明存在另一种低水平的此类化合物。如果草豆中也存在这类化合物,可能会导致对ODAP真实浓度的高估。当寻找含有少量β-L-ODAP的草豌豆线时,Rao方法的局限性变得明显。首先是分光光度法无法区分β-L-ODAP及其无毒异构体α-L-ODAP [41,约占草豌豆组织总ODAP的5%。这是因为该方法依赖于ODAP的碱性水解成L-DAP,而ODAP的两个同分异构体水解产生的是相同的化合物[38.].因此,分光光度法所产生的测量是总ODAP的综合测量,而不是β-L-ODAP的单独测量。第二,如上所述,分光光度法似乎能检测除ODAP以外的其他化合物。因此,它倾向于高估ODAP的活性含量。在比较不同组织中的ODAP含量时,技术差异和背景问题也特别相关,因为在分光光度分析中,其他化合物在420 nm波长吸收光导致组织之间的背景差异。在测量低ODAP基因型的绿色组织样本时,由于样本变化引起的噪声淹没了ODAP产生的信号,会导致ODAP值为负。这使得分光光度法不适用于低ODAP、绿色组织中ODAP含量的测定。然而,通过发展rao高通量分光光度法,并将其与更精确的LCMS方法相结合,就有可能识别低或不含β- l - odap的草豌豆品种。在测量ODAP时还要考虑的最后一个问题是,其含量受到环境变化的严重影响,包括同一领域的年比年变化[31.,40].因此,为了比较不同基因型的ODAP含量,需要在一致的条件下生长用于实验的组织。如果结合代谢全基因组关联研究(mGWAS)的群体基因组数据或分离群体的基因分型数据来鉴定代谢数量性状位点(mQTL),这里描述的分析方法允许研究这种环境响应的遗传学基础。了解基因型x环境互作对β-L-ODAP的影响对指导未来育种工作至关重要。β-L-ODAP分子的稳定重同位素标记版本的合成和使用使天然化合物的测定比以前的研究更准确。涉及稳定同位素标记(SIL)内部标准的技术被认为是LCMS分析中的“金标准”[42].如果SIL标准在提取或任何处理之前包含在样品中,它的行为就像化学上几乎相同的天然化合物。但由于其分子量不同,在质谱中可以区分,提供了一个强度峰,对应于已知的标准量,从而弥补了提取和加工过程中的任何损失。我们在这里描述的合成产生了高纯度的重同位素标记标准品,尽管这个反应的收率很低(6.6%)。过量使用相对便宜的底物l -2,3-二氨基丙酸会导致形成更大比例的不必要的二肽副产物。然而,因为在分析中只需要非常少量的内标,一次合成就足以测试几百个样品。
内部标准也提供了一种手段证实缺乏β-L-ODAP从一个样本,因为它排除了可能性,少量的β-L-ODAP在示例是蒙面的化学效应影响高效液相色谱柱上洗脱或质谱电离作用,这种影响也会影响SIL-standard [42,43,44].因此,使用内标的LCMS方法可以用来表征任何未来的零odap草豌豆基因型。合成SIL标准的成本和复杂性可能使这种方法不适用于大量样本的检测,但它提供了一种表征新基因型的“金标准”方法。
本文所述的分析方法提供了非常广泛的动态范围。标准系列范围从ODAP浓度相当于1%至0.00046%干重。β-L-ODAP在LSWT11和maateora不同组织中的含量分布在1000倍范围内(从LSWT11幼苗茎尖到maateora根),但在单个试验中定量。由于三重四倍LCMS系统的高灵敏度,该范围可以通过使用小于或大于500倍的稀释后衍生。基于lcms的新方法显示出高度的一致性(R2= 0.925),采用板基版的广泛使用的分光光度法ODAP测定。敏感而低于LCMS-based化验和容易干扰其他化合物吸收的波长420 nm,光谱分析是一种廉价的方法筛选成百上千的样品在一个实验中,如突变体使用的屏幕,和常规安全控制领域种植材料。然而,在准确测定潜在的低odap品种的β-ODAP浓度时,LCMS方法更优。
从组织样品中提取β-ODAP的方法是在100°C下使用去离子水[24.], 60%乙醇在室温下[22.,23.],在室温下则为70% [45已经描述。几个萃取介质是由Hussain等人相比较。[24.],谁发现了β-ODAP测量无显著差异。其中萃取介质是最合适的还取决于所用的组织。When extracting seed meal with water at 95 °C, the high carbohydrate content causes a heterogeneous gel to form. Conversely, extraction with ethanol also extracts chlorophyll from green tissues, increasing noise in the spectrophotometric assay. This is not an issue for the LCMS assay which includes extraction with ethanol, evaporation and re-dissolving in water and does not rely on absorbance. Applying the LCMS method to compare a low- and high-ODAP containing grass pea varieties, the seed β-L-ODAP content measured for the variety Mahateora (0.06% of dry weight) was below the commonly applied threshold [46,47为0.1%的低odap基因型,其结果低于其他研究该基因型的人员所获得的结果[48].β-L-ODAP在基因型LSWT11和Mahateora的8个组织中均存在低odap表型,Mahateora的β-L-ODAP含量比LSWT11低2.5倍(根)至10.5倍(早荚)。这些数据表明,无论什么因素导致maateora的低odap表型,它们都不会影响毒素在植物中的分布,而是涉及β-L-ODAP生物合成的全球减少或β-L-ODAP分解的变化。
如前所述,我们的LCMS方法通过液相色谱分解两种ODAP异构体,β-L-ODAP的洗脱时间略早于α-L-ODAP,允许对两种化合物进行测量。同样,LCMS分析允许直接测量L-DAP, β-L-ODAP合成的最终中间体。L-DAP不能直接用分光光度法测定,因为样品中已经存在的任何L-DAP产生的吸光度都会对水解和非水解样品的吸光度有影响,不能与其他来源的背景吸光度区分开来。因此,本研究所描述的LCMS方法是第一个能够同时测量β-L-ODAP、α-L-ODAP和L-DAP的高灵敏度方法。尽管检测阈值较低,但在任何草豌豆组织中均未观察到定量水平的L-DAP。
结论
基于板的分光光度检测这里描述允许快速,在种质筛选和育种的目的大集合草豌豆样品ODAP的具有成本效益的量化。它可以进一步适合于屏幕非常大的种群定性,例如用于从诱变群体低或高ODAP线的识别。高灵敏度测定LCMS使用的重同位素标记的内标表示为可以用于表征新颖草豌豆基因型β-L-ODAP一个新的“黄金标准”测定法。由于其低的检测的阈值,该方法将是首选的测定法来表征任何未来零-β-L-ODAP基因型,一旦防止广泛使用草豌豆的这一关键限制(种子的β-L-ODAP含量)粮食安全最终被删除。
方法
一般
l -2,3-二氨基丙酸盐酸盐和草酸二乙酯13.C2购自Sigma-Aldrich。在Bruker Avance III 400 MHz谱仪上记录核磁共振谱。化学变化11 H NMR信号记录在d2O与δ处的残余HDO有关H4.75 ppm。
Ceora的种子由澳大利亚珀斯的西澳大利亚大学的Kadambot Siddique教授提供。LS8246种子来自美国农业部的种质资源收集,美国华盛顿州普尔曼。豌豆种子(品种Cameor)、LSWT11、LS007和品种Nirmal、Mahateora和P-24的种子均来自英国Norwich的John Innes中心种质资源。LSWT11和LS007分别以加入号EC859045和EC862759存放在印度NBPGR。这项研究中使用的所有种子材料都在约翰英纳斯中心的温室中繁殖。鹰嘴豆种子粉(KTC克面粉)是商业获得的(产品编号7565125,J Sainsbury plc,伦敦,英国)。
植物材料制备
拍摄技巧。幼苗在堆肥(含20%沙砾的John Innes 2号堆肥12 × 19孔托盘)和温室(最低15°C,无光照)中播种后7-9天取幼苗的幼嫩茎尖组织(5-10 mm长)。播种前,用120粗氧化铝砂纸摩擦种子约15秒,以促进种子同时发芽。在干冰上96孔微量滴定板上收集茎尖,冷冻干燥36 h。在每孔的干燥材料中加入4 mm的钢珠,并以18 Hz的频率振荡1 min将样品粉碎。
种子。8个基因型草豆3个成熟干种子,原印度“低odap”品种P-24 [47](现在归类为中间型),低odap的印度品种Mahateora [45]及Ratan [20.源自P-24,中间odap印度品种Nirmal [48],高odap线LSWT11,低odap品种Ceora [21.源自澳大利亚,low-ODAP基因型LS8246 [40来自加拿大和英国的高ODAP欧洲基因型LS007。在这个实验中使用的所有种子来自于JIC温室生长的植物收集。
样品材料从种子中钻取子叶(benchtop drill, Xenox, Föhren, Germany)提取种子粉。豌豆和鹰嘴豆的种子也作为对照,因为它们预计不含ODAP。将餐食冷冻干燥,并取准确称重的样品(约25 mg)来计算β-ODAP浓度。
多组织表征的。幼苗茎尖和幼苗根尖从7日龄幼苗在无菌水中发芽收集。1:1:1个体积混合物叶和根是从含有砂,珍珠岩,蛭石2烧瓶中生长5周龄植物中收获。每个烧瓶的地下部分覆盖在黑色塑料。花,荚早期和晚期豆荚从土壤中生长的温室2个月大的植物收获。Mature seeds were harvested from the same plants, 4 months after planting. Three biological replicates were prepared for each tissue. Individual seeds were drilled as above. All other tissues (seedling shoot tip, seedling root tip, leaves, roots, flowers, early pods and late pods) were collected in liquid nitrogen and ground using a pestle and mortar chilled with liquid nitrogen. The sample powders were freeze-dried overnight and approximately 6.5 mg of dry powder of each sample was weighed out, recording accurate weights for calculating ODAP content.
并行化96孔板改性饶测定
该方法是基于Rao等人开发的分光光度法[22.并由Briggs等人改编[23.,24.].该方法通过缩小试剂数量和调整操作步骤进一步改进,以允许在96孔微滴定板中并行处理样品。
将样品研磨后,加入60% v/v乙醇(去离子水)600 μL,在室温下摇瓶过夜,使样品悬浮,提取ODAP。在2500 × g的条件下离心10分钟后,取80 μL等量溶液入含有160 μL 3 M KOH(氢氧化钾)溶液的96孔微量滴定板(Sterilin)中测定ODAP含量。钢板密封牢固,夹紧以防泄漏。在95℃水浴中浸泡30 min,将ODAP水解为L-DAP。之后,在干燥和松开夹子之前,将平板浸入室温的水中冷却,以防止溶液中的乙醇沸腾。
的o将5.29 g四硼酸钾(Sigma-Aldrich)溶解在42 mL的dH中,制备-邻苯二醛/四硼酸盐反应缓冲液2通过摇晃和温和地加热混合物。另外,34.6毫克o-邻苯二醛(Sigma-Aldrich)溶于346 μL无水乙醇和69 μL β-巯基乙醇。一旦这两个o-邻苯二醛与四硼酸钾完全溶解,溶液结合。得到的42.4 mL试剂缓冲液足以在两个微滴定板(水解和非水解各一块)上平行处理96个样品。将30 μL的水解液与220 μL的OPA/四硼酸盐缓冲液混合在96孔平板(Greiner Bio-One)上进行显色反应。
同时,在另一个平板上加载20 μL的3m氢氧化钾溶液和10 μL隔夜提取的未水解上清液,然后立即加载220 μL的OPA/四硼酸缓冲液。在室温下,如果不允许孵育时间,水解反应不发生。然而,在非水解处理中加入KOH仍然是必要的,因为它的存在会影响420 nm处的吸光度。
为了在少量样品中准确测量ODAP,例如在种质筛选中,使用已知的材料重量。采用600 μL 60%乙醇蒸馏水(v/v)从种子粕中提取游离氨基酸l -2,3-二氨基丙酸(L-DAP)和β-L-ODAP,室温摇瓶培养22 h。样品在16,250 x g的台式离心机中离心10分钟。为准确定量ODAP,每个样品板中包含一系列标准品,包括一个空白和11个L-DAP。盐酸浓度从0.0044 mg/mL到0.176 mg/mL不等,溶解在去离子水中。取10 μL各标准溶液与20 μL 3 M KOH溶液和220 μL OPA试剂缓冲液混合。L-DAP与OPA和β-巯基乙醇在成色反应中不需要水解,但需要KOH的加入来调节样品的pH值。
的colour-forming reaction mixture in each well was mixed by gentle sideways tapping the plate and left to incubate at room temperature for 30 min. Absorbance at 420 nm was measured using an optical plate reader (VersaMax, Molecular Devices). For each sample, the colour-forming reaction was carried out with and without first undergoing hydrolysis treatment at 95 °C. The absorbance measurement of the non-hydrolysed sample was subtracted from the absorbance measurement of the hydrolysed sample to exclude any absorbance caused by compounds other than ODAP. The slope of the linear regression was used to calculate seed ODAP concentrations using the following formula taking into account the dilutions used during extraction:
| 浓缩的 | 种子ODAP浓度在% w/w |
| 一个海德拉巴 | 吸光度是亮度形成反应之后读取水解样品的相对吸光度单位(RAU)(横跨技术重复平均值) |
| 一个non-hyd | 非水解样品在RAU中的吸光度读数 |
| Vext. | 提取缓冲液体积mL |
| 米样本 | 种子粉样品的质量(毫克) |
| 一个标准 | 标准曲线在RAU*mL/mg下的斜率 |
合成di -13.C-β-ODAP
重同位素标记内标采用Harrison等人的方法合成[37.].l -2,3-二氨基丙酸盐酸盐(50 mg, 0.36 mmol)溶于去离子水(0.9 mL)中。用LiOH(饱和水)调节溶液的pH至10。在这个溶液中,草酸二乙酯13.C2(0.5 mL, 3.7 mmol) dissolved in ethanol (0.54 mL) was added dropwise over the course of 2 h, while stirring at 30 °C and maintaining the solution at pH 10 by addition of LiOH. The reaction mixture was stirred for an additional 30 min and then evaporated to dryness under vacuum. The residue was dissolved in water (25 mL) and adjusted to pH 10 using LiOH. The stirred mixture was hydrolysed by heating to 70 °C for 20 h.
反应混合物冷却至室温后,通过预洗离子交换剂(10 g, Dowex 50WX8-400, H+形式)以除去李+离子。用水洗脱柱,将洗脱液(100ml)冷冻干燥。将脱盐的样品溶解在水中(50 mL),并使用冰醋酸调节pH为5。将溶液应用于预洗离子交换剂(19.8 g, Dowex 50WX8-400, H+形式),用水(100 mL)洗脱,然后用AcOH水溶液(0.2 M, 300 mL)。收集各馏分(5 mL),用Rao法检测各馏分。将含有该产品的馏分混合并冷冻干燥,得到纯二13.C-β-ODAP(4.2 mg, 6.6%). NMR spectra are shown in Fig.4.1H NMR (D2啊,400 MHz):δ.H4.14 (1 h,弟弟,3.J4,9-= 4.0赫兹,3.J2,3b= 7.0赫兹,H2), 3.87 - -3.82 (1 h, m, H3a), 3.78 - -3.72 (1 h, m, H3b)。13.C NMR(d2O, 100 MHz):δ.C170.6 (1C, C1), 164.4和164.3 (2C, C4和C5), 53.7 (1C, C2), 39.4 (1C, C3)。的1H NMR谱图与文献吻合较好[38.,50].
β-L-ODAP的LCMS定量
的13.c标记的β-L-ODAP标准品溶于去离子水中,制成250 μg/mL溶液。提取前加10 μL内标准液。为准确定量预期ODAP含量高于干重1%的组织(LSWT11幼苗茎尖和幼苗根尖),添加40 μL内标。提取后,将样品稀释4倍,使其ODAP浓度在标准曲线范围内。
采用Kuo等人描述的方法进行提取[49]为游离氨基酸,包括β-L-ODAP提取,从亚洲人参(人参).对每个经过精细研磨、冻干的组织样品,在ro -水中加入70% hplc级乙醇500 μL,在摇瓶培养箱中提取过夜。样品在16,250 x g离心30分钟,上清液吸入新管中,颗粒在500 μL 70%乙醇中重新悬浮,再离心2次。将三个提取周期的上清液结合,在EZ-2蒸发器(GeneVac, Ipswich, UK)中干燥,并重新溶解在1ml RO-water中。
采用0.05 mg/mL连续稀释法制备β-L-ODAP(印度Hyderabad市Lathyrus Technologies公司)标准品。结果表明,标准溶液相当于5 mg草豌豆组织样品的提取物,β-L-ODAP含量在干重0.00046 ~ 1%之间。将重同位素标记的标准品加入到每个标准溶液中,浓度为2.5 μg/mL,与样品提取物的浓度相同。
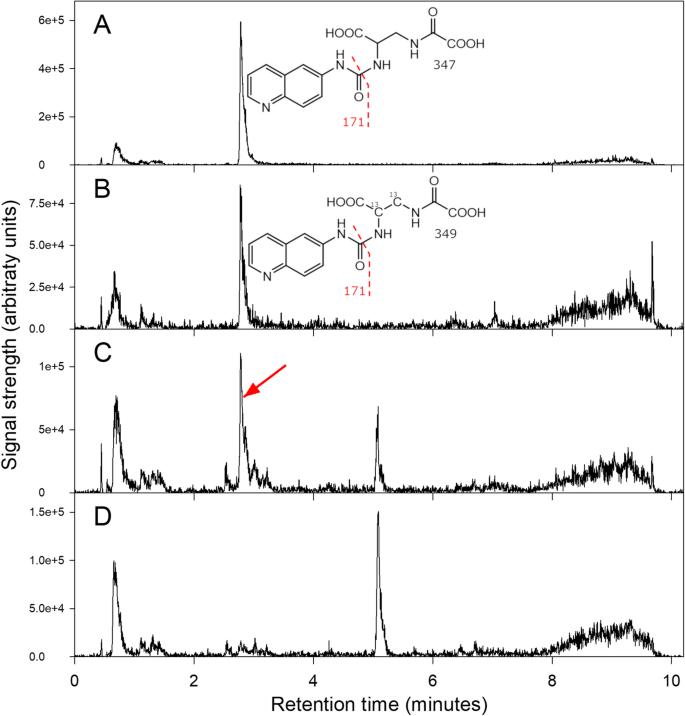
样品提取物和β-L-ODAP标准品使用AccQ-Tag™试剂(Waters, Milford, Massachusetts, USA)按照制造商的说明进行衍生。简单地说,每个样品提取液和每个标准溶液的20 μL与60 μL的AccQ-Tag™硼酸缓冲液混合。在此基础上,加入20 μL溶解的AccQ-Tag™试剂,立即混合,在55°C孵育10分钟。样品经1∶500稀释后进行LCMS分析。AccQ-Tag™衍生标准品和植物组织样品的色谱图如图所示。8.
的AccQ-标签™-derivatised植物材料和标准的色谱。一个:Mass transition 347 → 171 for derivatised12.C-ODAP标准。b:质量跃迁349→171,对于衍生二13.C-ODAP内标,鹰嘴豆种子粉与LSWT11草豌豆粉的1%的混合物的样品中;请注意,内部标准峰明确规定的,附近没有干扰峰。c:与(B)相同样品的质量跃迁347→171;注意与衍生对应的明确定义的峰12.C-ODAP来源于样品。d:鹰嘴豆籽粉样品的质量转变347→171;注意,ODAP峰值现在不见了。综上所示,trace (C)和trace (D)表明lc - ms方法在种子粕生物背景中检测ODAP的清晰度和特异性为0.004%
衍生样品和标准品使用Xevo三重四极TQ-S仪器(Waters, Milford, Massachusetts, USA)进行定量。色谱柱为100 × 2.1 mm 2.6 μm 100 Å Kinetex EVO C18色谱柱(Phenomenex),以乙腈(溶剂B)和0.1%甲酸水溶液为梯度,0.4 mL.min- 1和30°C: 0 min, 1% B;0.4 min, 1% B;7分钟,25% B;8.5 min, 90% B;9.0 min, 90% B;9.1 min, 1% B;12.6 min, 1% B.检测采用正模式电喷雾质谱,采用以下质量转换,每个化合物以AccQ-Tag™衍生形式检测:β-L-ODAP, 347.1→171.1;di -13.C -β-l-odap, 349.1→171.1;对于L-DAP, 275.1→171.1和445.1→171.1。每种情况下的锥体电压为4 V,碰撞能量为18 V。这些条件使用Waters的MassLynx软件提供的自动化方法开发工具(intellisstart)进行优化;检测标准为β-L-ODAP和L-DAP。喷雾室条件为600°C脱溶温度,1000 L.hr。- 1脱溶剂气,150升/小时。- 1cone gas and 6.0 bar nebuliser pressure. Quantification was carried out using TargetLynx software.
为了评估分光光度法和基于lcms方法的结果之间的相关性,使用R版本3.6 lm()函数生成了一个线性回归模型。
核磁共振
质子和13.使用Bruker Avance III 400 MHz NMR仪器(Bruker, Billerica, Massachusetts, USA)测量C谱。样品在500 μL D中溶解2O在5毫米NMR管。光谱分析使用TopSpin 3.2版软件包(Bruker, Billerica, Massachusetts, USA)进行。
数据和材料的可用性
在这篇文章中所使用的所有植物材料都可以从相应的作者。在当前研究期间使用和分析的数据集可从合理的请求中获得相应的作者。
缩写
- BOAA:
-
β-N-草酰 - 氨基-L-丙氨酸(同义词β-L-ODAP)
- 全球大气环流模型:
-
气相色谱 - 质谱
- HPLC:
-
高效液相色谱
- LCMS:
-
液相色谱质谱法
- L-DAP:
-
l2, 3-diaminopropionic酸
- 核磁共振:
-
核磁共振
- 劳:
-
相对吸光度单位
- RO-Water:
-
反渗透纯化水
- SIL:
-
Stable-isotope-labelled
- TMS-diazomethane:
-
(三甲基硅烷基)重氮甲烷
- β-L-ODAP:
-
β-L-oxalyl-2, 3-diaminopropionic酸
参考文献
- 1。
性能指数:一种快速筛选旱藓属植物抗旱性的工具。acta botanica yunnanica(云南植物研究),2014;
- 2。
瓦斯Patto MC,费尔南德斯 - 阿帕里西奥男,道德A,白粉病(豌豆白粉菌)电阻山黧豆的种质资源收集的鲁维亚莱斯D.表征。植物品种。2006; 125:308-10。
- 3.
杨慧敏,张晓燕。关于草豆在我国重新引种的思考。《Lathyrus lathyism通讯》2005;4:22-6。
- 4.
埃塞俄比亚草豌豆的遗传改良:一个未实现的承诺。植物品种。2012;131:231-6。
- 5.
世界四分之一的农业种植在高度缺水地区,2013;2016 02/09/2016。http://www.wri.org/blog/2013/10/one-quarter-world 's-agriculture-grows-highly-water-stressed-areas.
- 6.
戴A.在观测和模拟全球变暖背景下日益严重的干旱。NAT CILCH CHANG。2013; 3:52-8。
- 7.
新石器时代植物经济从近东到西北欧的传播:系统发育分析。考古学报2008;35:42-56。
- 8.
基色路我。山黧豆和山黧豆(豆科)栽培的起源。经济学机器人。1989;43:262 - 70。
- 9.
来自保加利亚新石器时代早期的考古植物学数据。在:Colledge S, Conolly J,编辑。西南亚和欧洲国内植物的起源和传播。伦敦大学学院考古学研究所;2007.p . 93 - 109。
- 10。
Peña-Chocarro L, Pérez Jordà G, Morales Mateos J, Zapata L.新石器时代植物在西地中海地区的使用:来自AGRIWESTMED项目的初步结果。Annali di Botanica. 2013; 3:135-41。
- 11.
Cantani A. Latirismo(lathyrismus)illustrata达TRE卡西clinici。伊尔莫干。意大利米兰;1873年; 15:745-765。
- 12.
Dastur DK,艾耶CGS。山黧豆与odoratism。营养学启1959; 17:33-6。
- 13。
郭玉华,王志强,王志强,等。气候因子、土壤因子和海拔因子对埃塞俄比亚5个地区小麦产量和毒性的影响。食品化学毒物。2011;49:623-30。
- 14。
埃塞俄比亚神经纤维瘤的流行病学分析。《柳叶刀》杂志。1999;354:306-7。
- 15.
木屑病仍在埃塞俄比亚北部流行吗?-阿姆哈拉民族地区州南部Wollo区Legambo Woreda(区)的案例。埃塞俄比亚卫生发展杂志,2005;19:230-6。
- 16.
Hendley AG。山黧豆中毒。BR医学J. 1903; 2:707-9。
- 17.
Manna PK, Mohanta GP, Valliappan K, Manavalan R. Lathyrus and lathyrism:评论。Int J Food Prop. 1999; 2:197-203。
- 18.
斯宾塞PS,Ludolph A,Dwivedi MP,罗伊DN,于贡Ĵ,Schaumburg的HH。山黧豆:为神经兴奋氨基酸BOAA的作用的证据。柳叶刀。1986; 328:1066-7。
- 19.
草豆神经毒素(β-ODAP)的遗传改良。食品化学学报2011;49:589-600。
- 20.
低ODAP体细胞无性系的研究Lathyrus巨大成功.《Lathyrus lathyism通讯》2001;2:42。
- 21.
注册' Ceora '草豌豆由CSSA注册。作物科学。2006;46:986。
- 22。
Rao SLN。建立了一种灵敏、特异的测定α, β-二氨基丙酸和板蓝根神经毒素的比色法。学生物化学肛门。1978;86:386 - 95。
- 23。
布里格斯CJ,帕雷诺N,坎贝尔CG。对于神经毒剂山黧豆种植物化学的评估,β-N-草-L-α-β-二氨基丙酸。Planta Med。1983; 47:188-90。
- 24。
Hussain M, Chowdhurry B, Haque R, Wouters G, Campbell CG。邻苯二醛法测定经不同实验室修饰的神经毒素3- n -草酸- l- 2,3-二氨基丙酸的比较研究。Phytochem肛门。1994;5:247-50。
- 25。
有机农业中传统豆类(扁豆,Lens culinaris L.和草豌豆,Lathyrus sativus L.)的化学物理和营养特性:一项探索性研究。Org阿格利司。2015;5:179 - 87。
- 26。
Larbi A, Abd El-Moneim A, Nakkoul H, Jammal B, Hassan S. .草(L. sativus L.)。饲料科学技术。2010;161:9-18。
- 27.
Shinomol GK,Muralidhara。在雄性小鼠的脑区域的氧化损伤的差动感应以下Khesari木豆的亚慢性消耗(Lathyrus巨大成功)和为Khesari dhal解毒。神经毒理学。2007; 28:798 - 806。
- 28.
王志强,王志强,王志强,等。埃塞俄比亚栽培的山羊草的近源成分、矿物质、β-ODAP和抗营养成分的评价。中国农业科学。2005;5(1):1 - 15。
- 29.
Arentoft AMK,Greirson BN。3-(N-草)的分析-L-2,3-二氨基丙酸和毛细管区带电泳其的α-异构体在草豌豆(山黧豆)。JAgric Food Chem。1995; 43:942-5。
- 30.
戈什B,米特拉Ĵ,Chakraborty的S,巴氏Ĵ,Chakraborty的A,森SK,等人。对于抗营养因子β-ODAP存在于简单的检测方法Lathyrus巨大成功L采用高压液相色谱和薄层色谱。《公共科学图书馆•综合》。2015;10:e0140649。
- 31.
研究了不同基因型禾草(Lathyrus sativus L.)种子中神经兴奋性氨基酸β-ODAP (β- n -草酸- L -α, β-二氨基丙酸)及其它游离氨基酸和蛋白质的含量。食品化学。2008;110:422-7。
- 32.
关键词:草藓,神经毒素,β-二氨基丙酸,α-ODAP,非神经毒素异构体色谱学。2005;61:231-6。
- 33.
朱军,刘克勤,付明明,李志伟。柱前衍生高效液相色谱法分析丹参碱。中国众尧杂志。2006;31:1865-8。
- 34。
苏梅H,刘A,陈EC。亲水性相互作用液相色谱串联质谱法用于人参药用植物物种未衍生三七素(β-N-草-L-α,β二氨基丙酸)的确定。快速COMMUN大众Spectrom。2005; 19:1237年至1244年。
- 35。
谢光霞,邱艳萍,邱明明,高晓芳,刘玉梅,贾伟。氯甲酸乙酯衍生气相色谱-质谱联用分析三七中的胆碱。J Pharm Biomed Anal. 2007; 43:920-5。
- 36。
Rao SLN。N-β - 草-L-α的化学合成,β二氨基丙酸,并在其神经毒性作用的光学特异性。生物化学。1975; 14:5218-21。
- 37。
哈里森FL,纳恩PB,山RR。的α-合成和β-N-草酰-1-α,β二氨基酸和从种子它们的分离Lathyrus巨大成功.植物化学。1977;16:1211-5。
- 38。
二氨基酸n -草酸衍生物的热异构化。植物化学。1993;33:1121-3。
- 39.
Srivastava RP, Singh J, Singh NP, Singh D. khesari (Lathyrus sativus)基因型的神经毒素和其他抗营养物质及其通过水浸泡和脱壳的减少。印度农业生物化学。2015;28:172-7。
- 40.
Campbell CG Briggs CJ, Campbell CJ Briggs CG。低含量神经毒素草种质LS 8246的登记。作物科学。1987;27:821。
- 41.
大通RA,皮尔森S,纳恩PB,兰托斯PL。的α-和β-N-草酰-1-α,β二氨基酸比较毒性对大鼠脊髓。神经科学快报。1985; 55:89-94。
- 42.
北京大学学报(自然科学版);稳定同位素标记内标在液相色谱/质谱定量生物分析中的应用:是否必要?快速公共质谱。2005;19:401-7。
- 43.
肖建峰,周波,李松HW。LC-MS/ ms代谢组学中代谢物的鉴定和定量。TrAC Trends Anal Chem. 2012; 32:1-14。
- 44.
Ciccimaro E, Blair IA。稳定同位素稀释LC-MS定量生物标志物分析。生物分析法。2010;2:311-41。
- 45.
郭Y型H,池上楼Lambein F.神经活性,并在种子和人参幼苗等游离氨基酸。植物化学。2003; 62:1087至1091年。
- 46。
就是为了一个。问题地区的牧草栽培:目前的对策。出版:Arora RK, Mathur PN, Riley KW, Adham Y,编辑。亚洲椴树遗传资源。赖布尔:国际植物遗传资源研究所;1995.143 - 8页。
- 47。
Chakrabarti A, Santha IM, Mehta SL.油菜低ODAP体细胞无性系的分子特征。植物生物化学学报1999;8:25-9。
- 48。
开发萨斯特里A.品种和释放由英迪拉·甘地Krishi Vishwavidyalaya。赖布尔:英迪拉·甘地Krishi Vishwavidyalya;2008年。
- 49。
就是为了一个。出版:Arora RK, Mathur PN, Riley KW, Adham Y,编辑。亚洲椴树遗传资源:区域研讨会论文集。新德里:IPGRI南亚办公室;1996.p。144。
- 50.
De Bruyn A, Van Haver D, Lambein F, Abegaz b。霍博肯:威利;1999.
确认
我们要感谢约翰英尼斯园艺服务人员在准备本文中使用的植物方面提供的帮助。
资金
这项研究得到了BBSRC/DBT作物基因组学联合呼吁下提供的“脱毒草豌豆:压力环境的可持续维持”拨款的支持。PMFE的学生奖学金是由约翰英尼斯基金会的学生轮转项目资助的。该研究的设计、数据的收集、分析和解释以及手稿的撰写均未涉及资助机构。
作者信息
从属关系
贡献
PFME进行化学合成,设计出基于板的分光光度法,进行LCMS和分光光度分析和起草的手稿。MR监督化学合成工作和进行NMR实验和分析。LH和PB开发的LCMS方法和特征的内标物。AE和AS促成了分光光度分析。TLW,CM和RAF设计并监督所有的实验工作。TLW和CM设计的助学金项目PMFE和所有作者已检讨和批判修订稿,并已阅读并同意本手稿的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Emmrich, p.m.f., Rejzek, M., Hill, L.et al。将快速通量平板分析与高灵敏度稳定同位素标记LCMS定量相结合,可以对低β-L-ODAP草豆品系进行鉴定和表征。BMC植物杂志19,489(2019)。https://doi.org/10.1186/s12870-019-2091-5
收到了:
接受:
发表:
关键字
- β-L-ODAP
- BOAA
- 鹰嘴豆
- 草豌豆
- 13.C-internal标准
- Lathyrus巨大成功
- LCMS
- 豌豆
- 分光光度测定
- 稳定同位素标记