摘要
背景
植物高度是由于其对耐腐蚀性和产量性能的影响,许多作物中最重要的农艺性状之一。虽然在使用矮化基因在作物改善方面取得了进展,但鉴定新的矮种种质仍然对育种品种的繁殖仍然有益。
结果
在这里,我们描述了一个占主导地位的矮人突变体G7芸苔属植物显著为了探索导致矮秆表型的遗传变异,将该突变体与常规品系杂交,形成分离的F2人口。通过MutMap高通量测序分析,矮秆和常规株高的植株形成大块。矮化突变的间隔为0.6 Mb显著C05染色体。候选基因分析显示,一个SNP位点引起的II型结构域氨基酸变化Bna.IAA7。C05可能与矮化表型有关。这与功能获得的表型是一致的indole-3-acetic酸(IAA.)突变体Bna.IAA7。C05最近报道。GO和KEGG对RNA-seq数据的分析显示,生长素相关基因的下调,包括许多其他基因IAA.和小幅上调反应(阿富汗二月)基因,在侏儒突变体中。
结论
我们的研究描述了一种新的等位基因Bna.IAA7。C05负责组织培养产生的矮化突变体。这为植物抗倒伏育种和矮化育种提供了宝贵的遗传资源显著.
背景
株高是与抗倒伏、收获指数和肥料反应有关的关键性状[1].在小麦和水稻等重要作物中,绿色革命通过将高产矮化品种的选育与农业机械化和施肥结合起来,使产量显著增加[2].极端矮化品种通常与较差的农艺性能和性状相关,如粒小、分蘖过多或叶片狭窄[3.,4]因此,半矮秆品种被用来提高产量和抗倒伏性[5,6].
影响株高的特定基因在作物改良中得到广泛应用。水稻中的半矮秆基因sd1,调控赤霉酸生物合成的关键步骤,已在世界范围内用于水稻生产[5].的使用Rht参与GA信号转导的(降低身高)基因,在小麦和其他作物的“绿色革命”中发挥了重要作用[7].许多植物激素,包括GA、油菜素内酯(BR)、独角金内酯(SL)、生长素、脱落酸(ABA)和乙烯(ETH),已被报道影响作物高度[3.,8,9,10.,11.,12.].其他途径的矮化基因也被证明可以决定植株高度[13.].这种复杂特征背后的机制在很大程度上仍未被理解。
显著(油菜籽)是中国最重要的油料作物之一,也是世界第二大油料作物[14.].株高是油菜生产的关键农艺性状,因为它的冠层较重,容易倒伏。矮化既能提高抗倒伏能力,又能提高产量[15.].在显著已鉴定出几个矮秆突变体,并克隆了致病基因。矮秆基因Breizh.,通过RAPD和RFLP标记进行定位[16.,17.].矮基因Brrga1-d,编码一种DELLA蛋白,首次在二倍体中发现,芸苔属植物拉伯,在转移之前显著[18.,19.].遗传分析表明Brrga1-d改变GA信号通路从而降低植株高度[20.].半矮秆基因DS-1,被定位到A06染色体上,也编码一个DELLA蛋白。VHYNP基序中脯氨酸到亮氨酸的单一氨基酸替换导致GA信号通路中功能获得突变[21.].另一个半矮秆基因,DS-3,编码突变的DELLA蛋白,在保守的VHYNP基序中也有脯氨酸到亮氨酸的替代[6].隐性矮化基因,BnaC.dwf,被证明对外源GA3不敏感[22.].侏儒突变体“NDF-1”显著被发现是由一个主基因控制,在GID1启动子(23.].另一种叶片下弯的矮生突变体(Bndwf / dcl1)被映射到175kb的区域显著染色体C05 [15.].
生长素调节植物发育的许多方面[24.]在拟南芥中,ARFs和Aux/IAA控制的生长素信号已经得到了很好的研究[25.].在较低的生长素浓度下,Aux/IAA蛋白相互作用,抑制了生长素反应因子(auxin RESPONSE FACTOR, ARFs)的活性,从而抑制了生长素反应基因的表达[26.].当细胞内生长素浓度较高时,生长素被TIR1/ AFB1-3受体感知,Aux/IAA蛋白随后通过泛素-蛋白酶体途径降解。这释放了arf的抑制,生长素反应基因被激活[25.].十二种中任何一种失去功能的突变体辅助/ IAA拟南芥的基因没有表现出明显的表型[26.].然而,Aux/IAA蛋白中II域保守基元的氨基酸突变导致了戏剧性的功能获得表型[27.].29个拟南芥中10个功能获得突变体辅助/ IAA,包括iaa1,3.,6,7,12.,14.,17.,18.,19.和28.,已被报告[28.,29.,30.,31.,32.,33.,34.,35.,36.,37.,38.,39.].所有突变体都是由GWPPV II结构域保守基序的一个氨基酸替换引起的。这导致TIR结合减少,扰乱Aux/IAA的降解,因此增加了ARFs的抑制[40,41.].
本研究发现了一个显性矮化突变体显著.转基因元件及表达结果表明,这种效应并非T-DNA插入所致,极有可能是组织培养过程中产生的体细胞突变所致。在构建分离群体后,我们使用MutMap将候选区域映射到染色体上的一个0.6 Mb区间Bna此外,该区域的表型和相关性分析与显著最近报道的侏儒突变体[42.,43.].该区域的18个候选基因在编码区域内发现了非同义SNPs。候选基因保守结构域II中的单个核苷酸替换(G到A)Bna.IAA7.C05导致将GWPPV主题更改为EWPPV。保守域II的C至T替换BnaIAA7最近,将GWPPV基序改变为GWLPV已被证明会导致侏儒症表型[42.,43.].因此,我们推测另一个等位基因突变的保守结构域IIBna.IAA7.C05导致矮化表型七国集团(G7).该矮秆突变体具有株高紧凑和株高降低的表型,利用该突变体将有助于培育抗倒伏品种。
结果
G7矮秆突变体的产生及表型研究
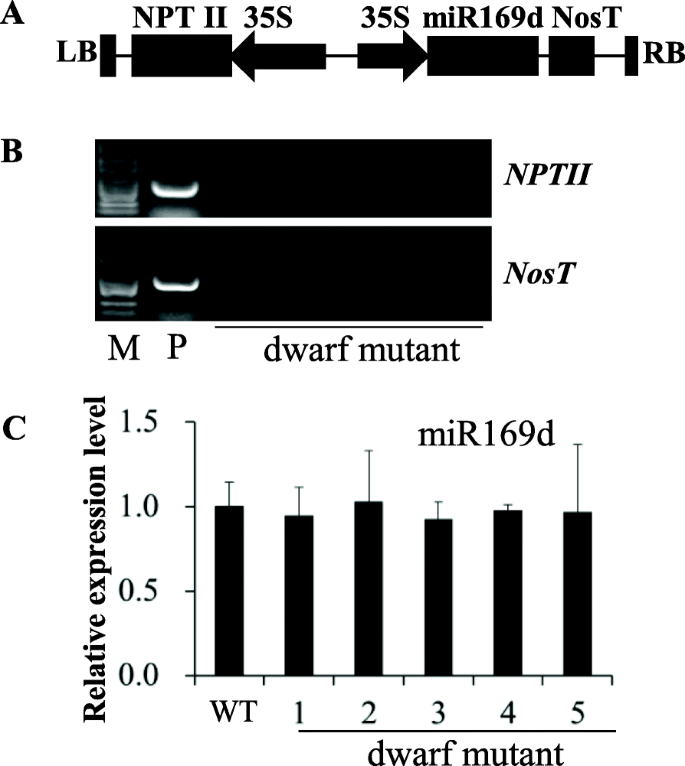
确定mir169d的功能显著,我们之前使用图中所示的载体在油菜中过表达miR169d。1a.我们通过遗传转化获得了14株转基因植株,其中只有1株表现出叶片下弯的矮化表型。检测《不扩散核武器条约》和号在矢量内的存在(图。1a)表明矮化突变体不含转基因元件(图。1B.)这表明该表型不是由miR169d过度表达引起的。检测miR169d表达水平的干环RT-qPCR显示表达没有显著增加(图。1c) 因此,我们假设该突变体是在组织培养过程中产生的。
与野生型相比,该矮化突变体苗期叶片向下弯曲,株高降低。2a).在花过渡之后,突变植株表现出紧凑和显著矮化的植株身材(图。2b)。由于节省间长度,矮种突变体的植物高度比Wt(〜150cm)显着短(〜30厘米)。该矮种突变体的叶子变得略微皱起皱折,弯曲(图。2c).显微镜下显示了矮生植物叶片的细胞大小(图。2e)与WT相比显着降低(图。2d)。
矮化表型的遗传
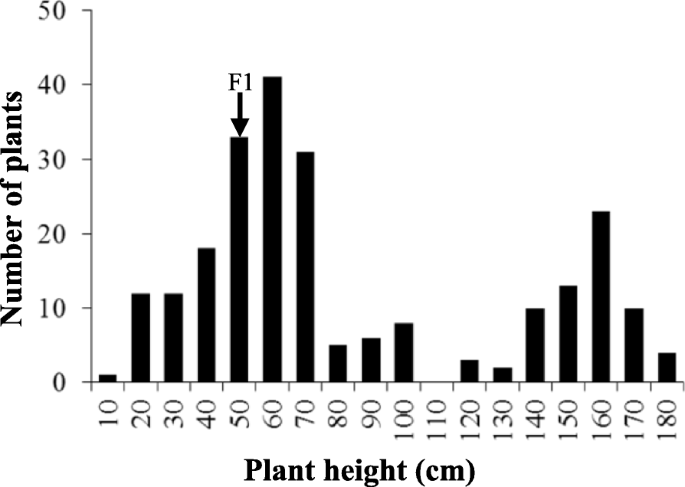
矮化突变体G7和WT变种48,557被用来构建一个分离群体。结果F1株系(48557 × G7)叶片下弯,表型卷曲,表明G7突变受显性基因控制。突变体G7叶片呈卷曲和波浪状,产量相关性状较正常品种48,557下降。F1植株的株高处于双亲之间。虽然分枝数和总角果数降低,但荚果层密度较高。来自F的植物2群体可分为两个明显的群体:WT(高叶正常)和G7表型(矮叶下弯)。在苗期,从F2人口包括190个G7工厂到65个WT工厂。卡方检验表明,该分离模式符合3:1孟德尔分离比(P= 0.857 > 0.0520.05 = 0.0327 < χ20.05= 3.842)。来自f的二十四个g7突变植物2人口在开花前死亡。剩余的植物高度2个体表现为双峰分布(图。3.)再次证明孟德尔分离比为3:1 (P= 0.2443 >20.05= 1.356 < χ20.05= 3.842)。因此,我们认为G7矮化表型可能是由单一显性基因控制的。
利用MutMap鉴定候选基因组区域
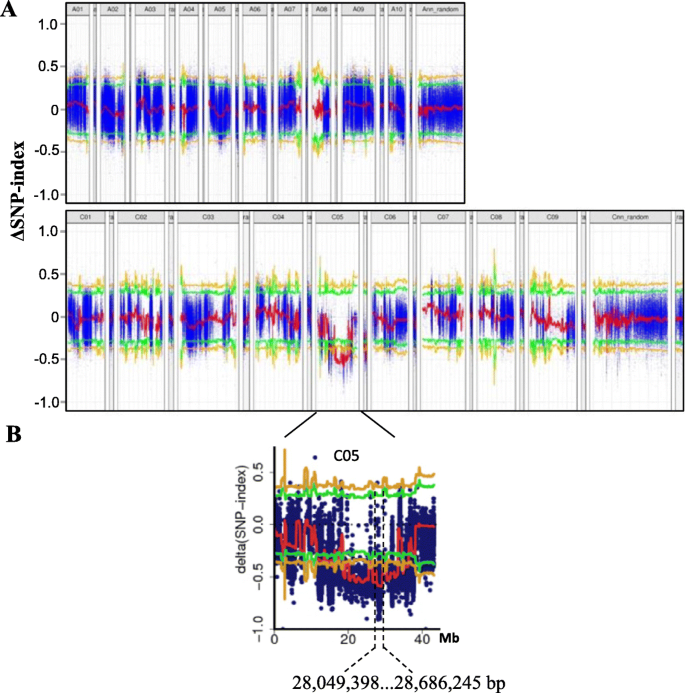
对两个亲本(G7和48,557)和两个库(dwarf-pool和WT-pool)的基因组DNA进行测序,分别得到510 946、104、523、601、254、438、302、148和411 082、480个clean reads。将clean reads与参考基因组序列比对后,我们分别从dwarf-pool和WT-pool中获得了232,279,673和215,670,613条unique mapping reads,分别对应于53和52.46%的基因组覆盖率。最终,在两个DNA库和参考基因组之间分别鉴定出5,388,850和5,370,965个SNPs。从dwarf-pool和WT-pool中计算SNP-index后,根据A和C亚基因组位置绘制Δ SNP-index(图2)。4一种)。在99%的显着性水平下,用峰值ΔSnP指数值鉴定染色体CO5上的Dwarf表型的一个显着轨迹(从28.0-28.6Mb)(图。4b)。
利用MutMap进行候选基因鉴定
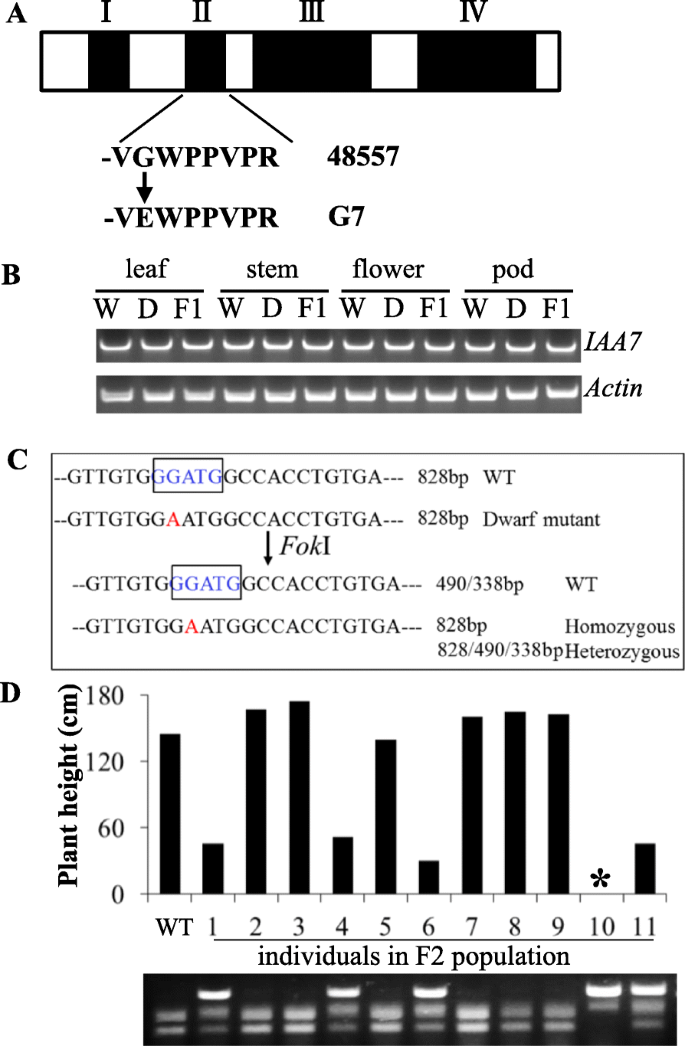
在候选人区域内BnaC05,在18个候选基因中鉴定了导致氨基酸变异的snp(附加文件)1:表S1)。推测的基因功能预测表明,除了基因外,没有一个候选基因与植物构型的控制有关BNAC05G29300D的同系物AtIAA7在拟南芥。苏格兰民族党在BNAC05G29300D结果在甘氨酸到谷氨酸(G到E)的氨基酸取代中Bna.IAA7.C05(无花果。5a)在保守结构域II内导致核心序列由GWPPV转变为EWPPV。许多生长素功能获得突变等位基因辅助/ iaa在拟南芥中表现出形态异常,包括顶端优势降低、株高降低和严重发育不良。因此,该基因是G7矮化突变最有可能的候选基因。表达分析表明Bna.IAA7。C05基因在叶、花、茎和荚中组成表达。5b).突变体与野生型的表达水平无明显差异(图2)。5b)。
一个.IAA7基因结构分为四个结构域。在G7矮化突变体和WT之间进行了SNP分析,结果表明,在Bna.IAA7.C05的II结构域内,G (WT)到E (G7突变体)的氨基酸发生了置换。b.Bna.IAA7基因表达。C05between WT (W), dwarf mutant (D) and F1 lines across multiple tissues was detected by RT-PCR.BnaActin作为对照。c.限制性内切酶识别位点的变异霍英东I(蓝框序列)用于开发内部SNP的dCAPs标记Bna.IAA7.C05.d.与dCAPs标记共分离的F2个体株高(*植株在荚果成熟时死亡)
矮化表型与dCAPs标记共分离SNP变异Bna.IAA7.C05
的Bna.IAA7.C05基因已从两个矮化EMS突变体中克隆,并经遗传转化证实其功能[42.,43.].序列分析表明,这两种突变体的矮化表型均是由于GWPPV基序(GWPPV ~ GWLPV)的氨基酸突变所致Bna。IAA7,从而导致相同的侏儒症表型。基于苏格兰民族党内部Bna.IAA7.C05,我们开发了一个dCAPs标记来分类从F2人口(图。5c).该标记与株高共分离(图。5d),因此是一个适合的早期诊断工具G7矮化突变。
RNA-seq分析显示,G7矮化突变体的生长素信号通路富集
为了进一步了解其调控机制,我们对G7矮化和WT植物进行了转录组分析。在G7和48,557之间共发现了9516个差异表达基因(DEGs)。6a).在生物过程分类中,发现生长素激活的信号通路被过度表征(图2)。6b).为了研究DEGs的潜在作用,我们进行了KEGG(京都基因和基因组百科全书)分析。研究发现,包括细胞、代谢、遗传环境和生物在内的五个过程中都富集了DEGs(图。6c).我们还发现,在环境过程中,信号转导途径类别的比例过高(图。6c)。
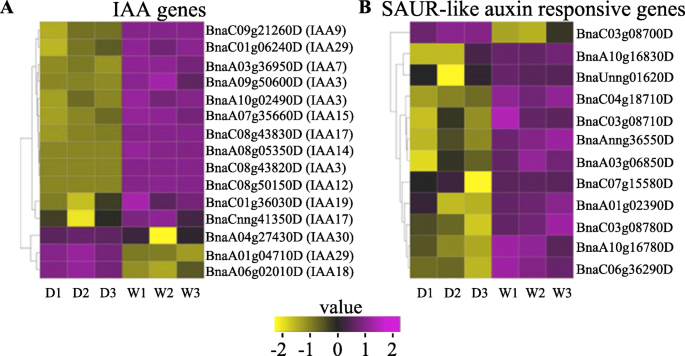
生长素在植物生长发育的诸多过程中起着重要的调节作用。IAA蛋白结构域II突变显著抑制生长素诱导的拟南芥其他IAA基因的表达[41.].在本研究中,我们发现与WT相比,G7矮化突变体中有12个IAA基因下调(图。7a).生长素诱导小生长素up rna (SAUR)的表达。各种拟南芥SAURs的过表达诱导细胞伸长和生长[44.].许多人的表达水平阿富汗二月基因在矮化突变体中也受到抑制。7b)。
讨论
对株高的研究已经很多,但矮化基因的应用仍然很少。新发现的矮化基因为培育抗倒伏和植物结构紧凑的作物提供了重要的变异来源[45.].矮化和紧密突变体也被证明对施肥有更好的反应[1].在本研究中,我们在组织培养中进行miR169d过表达转化时,偶然获得了一个矮化突变体。遗传变异可由化学诱变剂和物理治疗或组织培养引起[46.],因此单独组织培养或与化学和生物制剂联合使用可增加遗传变异,为新的商业品种生产提供资源[47.,48.].在组织培养本身内,愈伤组织、器官培养、原生质体和体细胞胚胎发生都可能产生突变[48.].体细胞变异诱导的突变体已成功地用于在马铃薯、小米和其他作物上创造潜在的新品种[49.,50,51].我们研究中的组织培养产生的矮种突变体具有育种品种的潜力,具有增加的植入抗性和改善的肥料反应。
MutMap可以通过测序DNA库来方便地筛选和定位基因,并已成功应用于许多物种,如拟南芥、水稻、黄瓜和油菜[45.,52,53].在本研究中,通过MutMap在C05染色体(28.0-28.6 Mb)上鉴定了一个显著的G7矮化表型位点,SNP-index值为Δ。4b) .一个新的矮秆突变体Bndwf / dcl1最近报道了EMS-诱变。突变体Bndwf / dcl1在幼苗阶段显示出急剧下降弯曲和皱折的表型,幼苗阶段的短叶柄[15.].在本研究中,我们还观察到G7突变体中相同的表型。Bndwf / dcl1已映射到6.58 cm区间上BnaC05。进一步的映射缩小了Bndwf / dcl1至175kb (C05: 29.76-29.94 Mb)。这个区域与我们研究中的ΔSNP-index值的峰值相邻。推测的基因功能预测显示,其中一个候选基因,BNAC05G29300D据报道,编码IAA7导致拟南芥的矮化和其他工厂架构变异。同时,两个EMS矮人突变体的精细映射也确定了内部的因果变化Bna.IAA7.C05[42.,43.].序列分析表明,这两个突变体均存在SNP变异,导致其II域保守的GWPPV基序(GWPPV ~ GWLPV)发生氨基酸变化Bna.IAA7.C05.在目前的研究中,保守基序的核苷酸变化导致GWPPV的变化为ewppv。另一个EMS突变体IAA7基因显著A3基因组也有一个保守的GWPPV域SNP (GWPPV to EWLPV) [54].因此,这是保守的GWPPV主题中的等位基因突变IAA7基因在显著这导致了侏儒症表型。
在拟南芥中,AUX/IAA家族包含4个保守结构域,并表现出强烈的基因冗余,即使是3个功能缺失突变体也没有显示出植物表型缺陷[26.].相反,与wt相比,Aux / IAA获得功能突变揭示了对开发的显着变化。拟南芥中报告了奥克斯/ IAA的许多功能突变体[39.],包括II结构域保守的GWPPV基序中单个氨基酸取代引起的突变[55,56,57].功能的突变IAA.拟南芥的突变体表现出较短的茎下降。从GWPPV基序的序列变化与G7的矮化表型共同分离的GWPPV基序中的序列变异开发的DCAPS标记。因此,我们假设具有G7的下弯曲叶片的矮化表型最有可能是由G〜E在GWPPV主题中的氨基酸取代引起的Bna.IAA7.C05.
在野生型植物中,当生长素浓度增加时,生长素会与TIR(生长素转运抑制剂反应)结合,导致Aux/IAA泛素化降解。这将释放arf,并最终促进它们的表达[24.].然而,GWPPV基段的氨基酸变化降低了TIR结合活性,扰乱了Aux/IAA的降解,导致Aux/IAA蛋白积累,增加了对ARFs的抑制[40].小型养羊酸rnas(saur),是由蟾蜍引发的最大的基因家族[58]SAUR蛋白参与细胞扩张、植物生长和发育[59,60,61].在目前的研究中,包括许多SAURs在内的生长素诱导的响应基因在矮化突变体中被抑制(图。7b). ARFs等生长素应答基因的低表达最终导致生长素过量产生和发育缺陷。
结论
综上所述,从组织培养过程中获得了一个矮化、下弯叶片的功能获得突变体。侏儒症的候选区域被定位到一个0.6 Mb的区域显著染色体C05的MutMap方法。这些结果与之前报道的矮化突变体定位结果一致显著.进一步的候选基因分析发现,GWPPV的保守基序中有一个氨基酸从G到E的替换Bna.IAA7.C05也可能导致侏儒症表型。这种突变的Bna.IAA7.C05导致他人表达减少IAA.生长素反应基因的表达。我们的发现发现了一个新的等位基因Bna.IAA7.C05对植物矮化表型的研究提供了重要的理论依据,并为了解植物中占优势的矮化突变体提供了理论依据显著.
方法
株高的材料和表型
的显著矮化突变体原自组织培养(甘肃农业科学院)。用48,557(野生型,母本)和G7矮秆(花粉供体)杂交,获得F1这些植物随后自交产生一个分离的F2人口。所有材料均在中国农业科学院武汉油料作物研究所田间种植。在花期末植株达到最大株高时测定株高。277名F2将具有矮化表型的植株混合形成矮化体,并将50株高植株混合形成高体进行MutMap分析,如[52].
显微镜分析
茎段芸苔属植物显著用50% FAA (Formalin-acetic acid-alcohol)溶液固定。经过脱水和渗透步骤后,将样品包埋在石蜡Plus中。组织切片成8 ~ 10 μm(徕卡RM2265),用0.05%甲苯胺蓝染色。图像在尼康显微镜下观察。
Mutmap分析NGS数据的生成与分析
根据制造商的说明,使用DNA样品制备试剂盒(中国北京天根)提取DNA。定量和质量验证由Nanodrop one(马萨诸塞州,美国)检测。从两个DNA块或两个亲本中提取约2 μg基因组DNA,用于测序文库的构建。序列数据由Illumina HiSeq X ten (San Diego, California, USA)生成,端对(PE150),读长350 bp。序列质量和适配器修剪由SOAPnuke 1.4(华大基因,中国深圳)进行,并由Benagen公司(中国武汉)分析DNA块和亲本。原始读取包括适配器序列和低质量读取被Trimmomatic软件处理后删除[45.].然后用高质量的干净读取,然后对齐到显著BWA (Burrows-Wheeler Aligner)软件的参考基因组[62,63,64].使用SAMtools软件从对齐文件中创建BAM文件[65].
MutMap分析确定候选基因变异
SNP呼叫和SNP索引作为先前的研究报告进行了[52]。将GFF3文件与显著突变体与正常株系之间的纯合子SNPs由Variant filtering - gatk软件使用默认设置生成的VCF文件实现[45.,66].SNP指数是包含SNP(与参考基因组不同的核苷酸)的reads与包含SNP的总reads的比率[52].通过减去矮子和正常DNA库的snp指数,得到Δ的snp指数。采用滑动窗口法检测整个区域的snp指数显著基因组(45.].ΔSnP指数穿过染色体显著采用滑动窗口分析,窗口大小为1 Mb,步长为10 kb [45.].ΔSNP指数的统计置信区间按照之前报告的描述定义为95和99% [53,67].
半定量RT-PCR和RT-QPCR对幼苗候选基因的表达分析
为了检测候选基因的表达模式,分别从矮化突变体G7和Westar的5个个体中提取茎、叶和花芽等不同的样本。采用RNAprep Pure试剂盒(中国天根)提取RNA。质量检测后,按说明书使用FastQuant RT试剂盒进行逆转录(中国天根)。基因半定量RT-PCRBna.IAA7.C05(BNAC05G29300D),使用引物(AHC5F和AHC5R)进行32个循环2S2:表。BnaActin基因(BnaC02g00690D)甘蓝型油菜作为RNA样本的对照。半定量RT-PCR反应32个周期,95℃30 s, 57℃45 s, 72℃50 s。采用Stem-loop RT-qPCR方法检测miR169d的表达水平[68].在CFX96 Real Time System (Bio-Rad, Hercules, California, USA)中使用SYBR Green mix (Transgen Biotech, Beijing)进行茎环qRT-PCR。反应程序如下:95℃30 s, 95℃5 s, 60℃30 s,循环40次。用于茎环RT-qPCR的引物列于附加文件2S2:表。
差异基因表达的rna序列
选择G7矮秆和WT(Westar)幼苗提取RNA,收集样本,在液氮中冷冻,并储存在低温下− 70 °C用于RNA制备。根据制造商协议(中国天根RNA试剂盒)从散装样品中提取总RNA。总RNA的完整性通过1%琼脂糖凝胶电泳检测。所有RNA样本通过Nanodrop 2000检测,以分析A260/A280值的蛋白质污染和A230/A280值的试剂污染。浓度通过Nano Drop(美国加利福尼亚州拉霍拉市赛默科学公司)检测并通过安捷伦2100生物分析仪(安捷伦美国)检查RNA的纯度 根据手动说明,使用μl RNA样本构建测序文库。序列数据由Illumina HiSeq X ten(美国加利福尼亚州圣地亚哥)生成,具有配对末端(PE150)和350 由SOAPnuke 1.4(中国深圳BGI)进行读取长度、序列质量和适配器修剪的bp。干净的读取被映射到显著的软件[62,63,64].
转录组分析主要按照之前研究的描述进行[68].使用少于0.01的假发现率(FDR)截止值来确定次数。通过使用DESEQ2软件将不同样品与FDR≤0.001之间的不同样品之间的log2比率≥2之间的绝对值被确定为DEGS [67].所有注释的基因都被映射到GO和KEGG数据库中。KOBAS软件富集KEGG途径中的DEGs [69].通过BLAST2GO软件进行了批注[70].对每个样品进行3次生物重复。使用log2转换后的FPKM值创建热图。颜色键从黄色到紫色表示用log2转换后的FPKM值的表达式级别。负值和正值分别代表低电平和高电平。对于每个基因,log2转化的FPKM值在每行归一化。
统计分析
RT-QPCR结果分析由学生的T检验进行(P< 0.05)或(P< 0.01)。对3个生物重复进行RT-qPCR。
缩写
- 度:
-
差异表达基因
- 国际宇航科学院:
-
indole-3-acetic-acid
- Mutmap:
-
突变的映射
- 阿富汗二月:
-
小幅上调反应
工具书类
- 1。
胡什GS。绿色革命:前进之路。纳特·杰内牧师。2001;2:815–22.
- 2。
Hargrove TR, Cabanilla VL。半矮化品种对亚洲水稻育种计划的影响。生物科学。1979;29:731-5。
- 3.
Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y, Kato H, Iwasaki Y.一种新的细胞色素P450与油菜素内酯生物合成有关,通过对水稻矮化突变体dwarf11的描述,缩短了种子长度。植物细胞。2005;17:776 - 90。
- 4.
Ueguchi-Tanaka M, Ashikari M, Nakajima M, Itoh H, Katoh E, Kobayashi M, Chow TY,邢毅,Kitano H, Yamaguchi I, Matsuoka M. GIBBERELLIN INSENSITIVE型DWARF1编码赤霉素可溶性受体。大自然。2005;437:693-8。
- 5.
绿色革命的基因。趋势麝猫。2003;19:5-9。
- 6.
赵波,李华,李军,王波,戴超,王军,刘科。芸苔属植物显著DS-3编码DELLA蛋白,通过赤霉素信号通路负调控茎伸长。应用电子学报。2017;130:727-41。
- 7.
植物生物学。荷尔蒙和绿色革命。科学。2003;302:71-2。
- 8.
Ashikari M, Sasaki A, Ueguchi-Tanaka M, Itoh H, Nishimura A, Datta S, Ishiyama K, Saito T, Kobayashi M, Khush GS。水稻赤霉素生物合成基因GA20氧化酶(GA20ox-2)功能的缺失导致了水稻的“绿色革命”。Sci繁殖。2002;52:143-50。
- 9.
Ueguchi-Tanaka M, Fujisawa Y, Kobayashi M, Ashikari M, Iwasaki Y, Kitano H, Matsuoka M.水稻矮化突变体d1,在异三联体G蛋白α亚基缺陷,影响赤霉素信号转导。美国国家科学学院2000;97:11638-43。
- 10.
洪Z, Ueguchi-Tanaka M, Umemura K, Uozu S, Fujioka S, Takatsuto S, Yoshida S, Ashikari M, Kitano H, Matsuoka M.一种水稻brassino类固醇缺陷突变体,ebisu dwarf (d2),是由细胞色素P450的一个新成员的功能丧失引起的。植物细胞。2003;15:2900-10。
- 11.
Itoh H, Tatsumi T, Sakamoto T, Otomo K, Toyomasu T, Kitano H, Ashikari M, Ichihara S, Matsuoka M.水稻半矮秆基因tano - ginbozu (D35)编码赤霉素生物合成酶- T -kaurene氧化酶。acta botanica sinica(云南植物学报);2004;54:533-47。
- 12.
林浩,王荣荣,钱强,严明,孟X,傅志华,严超,姜波,苏中,李军,王玉华。水稻分蘖芽生长发育的铁蛋白DWARF27调控。植物细胞。2009;21:1512-25。
- 13。
刘飞,王鹏,张旭,李旭,严旭,付东,吴国栋。水稻作物高度的遗传和分子基础。足底。2018;247(1):1-26。
- 14。
胡Q,华伟,尹Y,张X,刘力,史杰,赵Y,秦力,陈C,王HZ.中国油菜研究与生产.作物杂志.2017;5:127-35。
- 15.
Wang Y, Chen W, Chu P ., Wan S ., Yang M ., Wang M ., Guan R. QTL的定位芸苔属植物显著使用单核苷酸多态性标记方法。植物学报。2016;16(1):178。
- 16.
关键词:矮秆,BREIZH (Bzh)基因,分子标记芸苔属植物显著.Al Appl Genet。1995年; 91(5):756-61。
- 17.
陈志强,陈志强,陈志强,等。甘蓝型油菜矮秆基因brizh (Bzh)分子标记的研究进展[j] .应用生态学报,1998,19(2):427 - 434。
- 18.
Muangprom A, Mauriera I, Osborn TC油菜矮秆基因的转移显著,对农艺性状的影响,以及为选择开发“完美”标记。摩尔品种。2006;17(2):101 - 10。
- 19.
Muangprom A, Osborn TC。矮化基因的特征芸苔属植物拉伯,包括候选基因的鉴定。Thero Appl Genet.2004;108(7):1378-84。
- 20.
Muangprom A, Thomas SG, Sun TP, Osborn TC。一种绿色革命基因的新型矮化突变芸苔属植物拉伯.植物杂志。2005;137(3):931 - 8。
- 21.
Liu C, Wang J, Huang T, Wang F, Yuan F, Cheng X, Zhang Y, Shi S, Wu J, Liu K. A missense mutation of VHYNP motif induced A semi-dwarf mutation in . acta physica sinica(生物谷biosciences, 2017芸苔属植物显著.中国科学(d辑:地球科学)2010;
- 22.
陈曾X,朱L, Y,气L, Pu Y,温家宝J,彝族B,沈J,马C,你J, et al。矮秆突变体的鉴定、精细定位和特征分析(bnaC.dwf)芸苔属植物显著.中国科学:地球科学。2011;122(2):421-8。
- 23。
李红霞,王玉英,李晓霞,高艳,王志忠,赵颖,王明。甘蓝型油菜ga钝感矮秆突变体与GID1启动子嘧啶盒突变的相关性研究。中国人民大学学报(自然科学版)2011;38(1):191-7。
- 24。
赵玉玲,赵玉玲。生长素感知与下游事件。植物学报2016;33:8-14。
- 25。
对生长素激素的转录反应。植物生物学学报。2016;67:539-74。
- 26。
刘志强,王志强,王志强,等。植物生长素途径的研究进展。植物细胞。2008;20:1738-46。
- 27.
Mockaitis K,Estelle M.植物素受体和植物开发:一种新的信号范式。Annu Rev Cell Dev Biol。2008; 24:55-80。
- 28.
在拟南芥(Arabidopsis thaliana)中,CRANE/IAA18的Domain II突变抑制侧根的形成并影响茎的发育。acta botanica yunnanica(云南植物研究). 2008;49:1025-38。
- 29.
田强,李志伟。拟南芥SHY2/IAA3基因调控生长素调控的根发育。发展。1999;126:711-21。
- 30.
Kim Bc,Soh Ms,Kang Bj,Furuya M,Nam Hg。拟南芥的两种显性光学突变鉴定为Hy2的抑制突变。工厂J. 1996; 9:441-56。
- 31.
利斯科姆E,里德JW。aux/IAA和ARF在植物生长发育中的作用。植物学报2002;49:387-400。
- 32.
在拟南芥中,一个显性突变具有对生长素、乙烯和脱落酸的抗性。孟根。1990;222:377-83。
- 33.
Nagpal P, Walker LM, Young JC, Sonawala, Timpte C, Estelle M, Reed JW。AXR2编码aux/IAA蛋白家族的一个成员。植物杂志。2000;123:563 - 73。
- 34.
关键词:拟南芥,生长素钝感bodenlos突变,胚根形成,根尖-基底模式发展。1999;126:1387 - 95。
- 35。
拟南芥BODENLOS基因编码一个生长素反应蛋白,抑制monopteros介导的胚胎模式形成。基因Dev。2002;16:1610-5。
- 36。
作者:fuaki H, Tameda S, Masuda H, Tasaka M.在拟南芥的lone - root /IAA14基因中,一个功能获得突变阻断了侧根的形成。植物j . 2002; 29:153 - 68。
- 37。
拟南芥AXR3基因突变导致生长素反应改变,包括SAUR-AC1启动子的异位表达。植物j . 1996; 10:403-13。
- 38。
Rouse D, Mackay P, Stirnberg P, Estelle M. Leyser O. auxin response from AUX/IAA gene mutation: Science;1998.
- 39.
Yang X, Lee S, So JH, Dharmasiri S, Dharmasiri N, Ge L, Jensen C, Hangarter R, Hobbie L, Estelle M. IAA1蛋白由AXR5编码,是SCFTIR1的底物。植物j . 2004; 40:772 - 82。
- 40.
李晓东,郑宁宁,李晓东。植物生长素对植物生长的影响。2:a005546。
- 41.
马丽娜迪,刘杰,恩德斯·塔,巴特尔·B,斯特拉德·LC。IAA16的功能获得突变导致对生长素和脱落酸的反应降低,并阻碍植物生长和繁殖。植物分子生物学。2012;79:359–73.
- 42.
Zheng M, Hu M, Yang H, Tang M, Zhang L, Liu H, Li X, Liu J, Sun X, Fan S, Zhang J, Terzaghi W, Pu H, Hua W芸苔属植物显著l .)。植物细胞代表2019。
- 43.
赵斌,王波,李志华,郭涛,赵军,管志华,刘凯。水稻矮缩基因DS-4编码aux/IAA7蛋白的初步鉴定芸苔属植物显著. 应用基因理论。2019;132(5):1435–49.
- 44.
SAUR基因家族:植物适应生长发育的工具箱。J Exp Bot. 2019; 70:17-27。
- 45.
王浩,程辉,王伟,刘军,郝敏,梅丹,周锐,付玲,胡强BnaYUCCA6作为甘蓝型油菜分枝角的候选基因。Sci众议员2016;6:38493。
- 46.
王志强,王志强,王志强,等。植物体细胞无性系变异的原因及检测方法。植物生长规律。2011;63:147-73。
- 47.
Rasheed S,Tahira F,Khurram B,Tayyab H,Shiekh R.Shiekh R.Shipa Basmati Rice中躯体变种的农艺和生理学特征。Pak J Biol Sci。2003; 6:844-8。
- 48。
Orbović V, Ćalović M, Viloria Z, Nielsen B, Gmitter F, Castle W, Grosser J.利用RAPD和流式细胞术分析不同组织培养来源的柠檬植物群体的遗传变异。Euphytica。2008;161:329-35。
- 49。
Thieme R,Griess H.马铃薯块茎状性状的糖瘤变异。土豆店。2005; 48:153-65。
- 50.
王勇,王芳,翟华,刘强。一种利用慢性辐照制备甘薯突变体的方法。Sci Hortic。2007;111:173-8。
- 51.
Baer G,Yemets A,Stadnichuk N,Rakhmetov D,Blume Y.体细胞无性系变异作为小米新品种创造的来源(Eleusine coracana(l)Gaertn)。Cytol麝猫。2007;41:204-8。
- 52.
Abe A, Kosugi S, Yoshida K, Natsume S, Takagi H, Kanzaki H, Matsumura H, Yoshida K, Mitsuoka C, Tamiru M, Innan H, Cano L, Kamoun S, Terauchi r。生物科技Nat》。2012;30:174-8。
- 53.
Takagi H, Tamiru M, Abe A, Yoshida K, Uemura A, Yaegashi H, Obara T, Oikawa K, Utsushi H, Kanzaki E, Mitsuoka C, Natsume S, Kosugi S, Kanzaki H, Matsumura H, Urasaki N, Kamoun S, Terauchi R. MutMap加速了耐盐水稻品种的选育。生物科技Nat》。2015;33:445。
- 54.
李华,李军,宋健,赵波,郭超,王波,张强,王杰,王广杰,刘坤。生长素信号转导基因的研究进展BnaA3。IAA7有助于改善油菜籽的植物建筑和产量杂种优势。新植物。2019; 222:837-51。
- 55.
Kepinski S, Leyser O.生长素诱导的SCFTIR1-aux/IAA相互作用涉及SCFTIR1复合物的稳定修饰。美国国家科学研究院2004;101:12381-6。
- 56.
植物生长激素在植物发育中的作用。咕咕叫医学杂志。2005;15:208-10。
- 57.
F-box蛋白TIR1是一种生长素受体。大自然。2005;435:441-5。
- 58.
任慧,王志强。SAUR蛋白作为植物生长中的激素和环境信号的效应体。摩尔。2015;8:1153 - 64。
- 59.
Chae K, Isaacs CG, Reeves PH, Maloney GS, Muday GK, Nagpal P, Reed JW。拟南芥小生长素UP RNA63促进下胚轴和雄蕊丝伸长。植物j . 2012; 71:684 - 97。
- 60.
Spartz AK, Lee SH, Wenger JP, Gonzalez N, Itoh H, Inzé D, Peer WA, Murphy AS, Overvoorde PJ, Gray WM。SAUR19亚家族的小生长素UP RNA基因促进细胞扩张。植物j . 2012; 70:978 - 90。
- 61.
孔艳艳,朱玉英,高春,她文,林伟,陈勇,韩宁,边辉,朱敏,王建军。植物生长素UP RNA41的组织特异性表达对拟南芥细胞扩展和根分生组织模式的调控。植物学报。2013;54:609-21。
- 62.
李洪波,李洪波。基于盲轮变换的短读快速定位。生物信息学。2009;25:1754-60。
- 63.
刘绍峰,刘志强,唐华,等。植物遗传学。新石器时代后的早期异源多倍体进化芸苔属植物显著油料基因组。科学。2014;345:950-3。
- 64.
太阳F, G粉丝,胡问,周Y,关M,通C,李J, Du D,气C,江L,刘W,黄年代,陈W, Yu J,梅D,孟J,曾庆红P, J,刘K,王X,王X, Y,梁X, Z,黄G,董C, H,李J,张Y,李L, C,王J,李SM,关C,徐X,刘,刘X, Chalhoub B,华W,王的高质量的基因组芸苔属植物显著品种“ZS11”揭示了半冬季形态类型的导入历史。《植物杂志》,2017年;92:452–68.
- 65.
Li H, Handsaker B, Wysoker A, Fennell T, ruj, Homer N, Marth G, Abecasis G. Durbin R;1000个基因组项目数据处理子组。序列对齐/映射格式和SAMtools。生物信息学。2009;25:2078-9。
- 66.
王凯,李敏,Hakonarson H. ANNOVAR:高通量测序数据中基因变异的功能注释。核酸学报2010;38:e164。
- 67.
Takagi H、Uemura A、Yaegashi H、Tamiru M、Abe A、Mitsuoka C、Utsushi H、Natsume S、Kanzaki H、Matsumura H、Saitoh H、Yoshida K、Cano LM、Kamoun S、Terauchi R.MutMap gap:突变F2子代的全基因组重测序与gap区域的从头组装相结合,确定水稻抗稻瘟病基因Pii。新植物醇。2013;200:276–83.
- 68.
程浩,郝明,王伟,梅丹,Wells R,刘军,王浩,桑松,唐敏,周瑞,楚伟,傅丽,胡强。植物生长素信号通路在植物分枝角调控中的作用显著.国际分子生物学杂志。2017:18(5)。
- 69.
毛学志,蔡涛,李雅琪,魏立平。使用KEGG Orthology (KO)作为控制词汇的自动化基因组注释和路径识别。生物信息学。2005;21(19):3787 - 93。
- 70.
Blast2GO:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。
致谢
不适用。
资金
甘肃省农业科学院农业科技创新项目(No. 2018GAAS04);湖北省科技创新重点项目(No. 2016ABA084);甘肃省农业科研体系专项资金,No. 2018GAAS04农业部油料作物生物科学与遗传改良重点实验室开放研究基金(KF2017010);中央公益性科研机构基本科研业务费专项资金(1610172017005)。资助机构参与了材料的创作、研究的设计、数据的收集和手稿的撰写。
作者信息
从属关系
贡献
HTC, YD, QH设计并进行了研究。BLD、YD和HTC对株高进行了调查,提取了DNA。MYH和FWJ进行了表达式模式分析。YH和YW分析了数据。HTC撰写了这份手稿。QZ, RW和QH对手稿进行了修改。所有作者阅读并批准。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充资料
附加文件1:表S1。
染色体C05候选区域上的基因芸苔属植物显著。
附加文件2:表S2。
本研究使用的引物。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
程华,金芳,柴曼et al。鉴定Bna.IAA7.C05作为油菜组织培养矮化突变体的等位基因。BMC植物杂志19,500(2019)。https://doi.org/10.1186/s12870-019-2094-2
收到了:
接受:
发表:
关键字
- 芸苔属植物显著
- 矮
- IAA7
- MutMap
- 生长素
- 组织培养