抽象的
背景
芹菜是一种广泛种植的蔬菜,富含抗坏血酸(AsA),抗坏血酸是一种能清除植物非生物胁迫产生的自由基的天然植物抗氧化剂。抗坏血酸过氧化物酶(APX)是一种植物抗氧化酶,在合成AsA和清除多余的过氧化氢中起重要作用。然而,芹菜APX的特性和功能至今仍不清楚。
结果
在这项研究中,从芹菜和命名的芹菜克隆了编码APX的基因AgAPX1.转录水平AgAPX1干旱胁迫下基因表达显著上调。AgAPX1在大肠杆菌BL21 (DE3)并纯化。rAgAPX1的预测分子量为33.16 kDa,经SDS-PAGE分析证实。rAgAPX1的最适pH和温度分别为7.0和55℃。转基因拟南芥托管AgAPX1基因表现出较高的AsA含量、抗氧化能力和抗旱性。净光合速率、叶绿素含量和相对含水量的降低较小,转基因植株的成活率较高拟南芥行后干旱。
结论
芹菜中APX的特征与其他物种不同。过表达的增强的抗旱性AgAPX1在拟南芥可以通过增加ASA的积累来实现,增强各种抗氧化酶的活性,促进气孔闭合。我们的工作提供了新的证据,了解APX及其对芹菜干旱压力的响应机制。
背景
在非生物胁迫下,植物产生许多反应性氧(ROS),包括超氧化物自由基,过氧化氢(H.2O.2)和脂质过氧化物。ROS通过脂质过氧化和蛋白质氧化造成植物细胞的过度积累[1那2]。许多酶促和非酶促抗氧化剂可以降低ROS水平,以维持细胞氧化还原平衡[1]。植物含有多种酶促抗氧化剂,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX),以及非酶促抗氧化剂,如抗坏血酸(AsA)、谷胱甘肽、类黄酮和类胡萝卜素用于清除ROS [3.那4.]。
血红素过氧化物酶超家族的APX [5.那6.]参与植物中的ASA和环境应激反应的回收途径。ASA是一种着名的植物抗氧化剂。由于对人类的有益效果,天然抗氧化剂引起了越来越长的关注[7.]。植物抗性也是植物科学领域的持久主题[8.那9.]。一些研究人员专注于提高植物耐受非生物胁迫的能力,包括盐碱[10],干旱[11)、热(12],冷却[13那14]。APX是asa -谷胱甘肽(AsA-GSH)途径中去除过量H的关键酶2O.2在正常和胁迫条件下的植物细胞中[15]。APX催化H的还原2O.2使用AsA作为水和单脱氢抗坏血酸的电子给体[16]。然后单脱氢抗坏血酸自动转化为脱氢抗坏血酸。
APX因其在高等植物中的重要作用而得到广泛的研究。它也存在于真核藻类中[17]。APX已被纯化并在茶中研究[18], 白饭 [19], komatsuna [20.),土豆21]和许多其他物种。APX的物理化学性质在不同的物种中变化。
干旱仍然是作物生产和粮食安全的最重要制约因素,特别是在农业水资源不足的地区。全球变暖和日益严重的干旱加剧了农业经济的损失[22]。许多研究报道APX参与AsA积累和盐胁迫等非生物胁迫[23那24那25]。然而,在抗旱方面的相关报道较少。
芹菜是一种营养价值丰富的伞科蔬菜,其生长受到多种非生物胁迫的影响[26那27那28]。在我们之前的研究中,我们确定了APX型基因在芹菜发育阶段[29]。然而,芹菜干旱胁迫下APX的特征和转录调控机制仍然未知。在本研究中,AgAPX1从芹菜中克隆了该基因,并检测了其在模拟干旱胁迫下的表达水平。获得活性重组蛋白rAgAPX1,并对其进行表征。进一步研究了AgAPX1的亚细胞定位。AsA含量、抗氧化能力和耐旱性拟南芥overexpressingAgAPX1也进行了检测和分析。本研究结果表明,AgAPX1可以增强芹菜的抗旱性,可作为基因工程育种的潜在靶点。
结果
核苷酸序列和推导的AGAPX1氨基酸序列
如附加文件所示1那AgAPX1cDNA由753bp核苷酸组成,编码250个氨基酸。分子量和理论π天然AGAPX1分别为27.72kDa和5.41。蛋白质配方是c1244.H1926年N332O.371S.8.亲水性弱的。推导出的AgAPX1氨基酸序列与其他物种的同源序列进行比对,包括Pisum一那拟南芥那Brassica Rapa.,奥雅萨苜蓿使用ESPript 3.0网站[30.]。芹菜APX序列的相似性P. Sativum.是最高的(80.8%)(图。1一种)。系统发育树表明APX蛋白来自Apium graveolens和Spuriopimpinella brachycarpa属于同一分支,来自同一家族的其他植物的APX蛋白也聚在一起(图。1b).来自其他单子叶植物的AgAPX1和APX蛋白在进化过程中距离较远。此外,AgAPX1蛋白在25 - 227位点有一个特定的过氧化物酶结构域(图25 - 227)。1c).以豌豆蛋白(PDB ID:1apx)为模板的三维结构分析表明,AgAPX1包含13个TM α-螺旋和2个β-薄片(图1)。1d)。
AgAPX1蛋白序列特征分析。一种AGAPX1与其他抗坏血酸过氧化物酶的推导氨基酸序列的对准Pisum一(加入。P48534.2),拟南芥(加入。Q05431.2),Brassica Rapa.(加入ACV92696.1),奥雅萨苜蓿(登录号Q10N21.1)包含次级结构元件(具有Quiggles的螺旋,带有箭头的β-股和TT字母转动)。B.AgAPX1和其他APX蛋白氨基酸序列的系统发育关系。拟南芥(Q05431.2),Brassica Rapa.(ACV92696.1),山茶花杜鹃花(akp06507.1),番薯甘薯(ALP06091.1),番薯trifida(AGT80152.1),烟草(AAA86689.1),奥雅萨苜蓿(Q10n21.1),Pisum一(P48534.2),Spuriopimpinella brachycarpa(AAF22246.1),Zea Mays.(NP_001105500.2)。C预测的AgAPX1的域位置。D.AGAPX1的三维结构。红色和蓝色零件分别标记Alpha Helix和Beta转弯
表达谱的AgAPX1PEG 6000处理下的芹菜
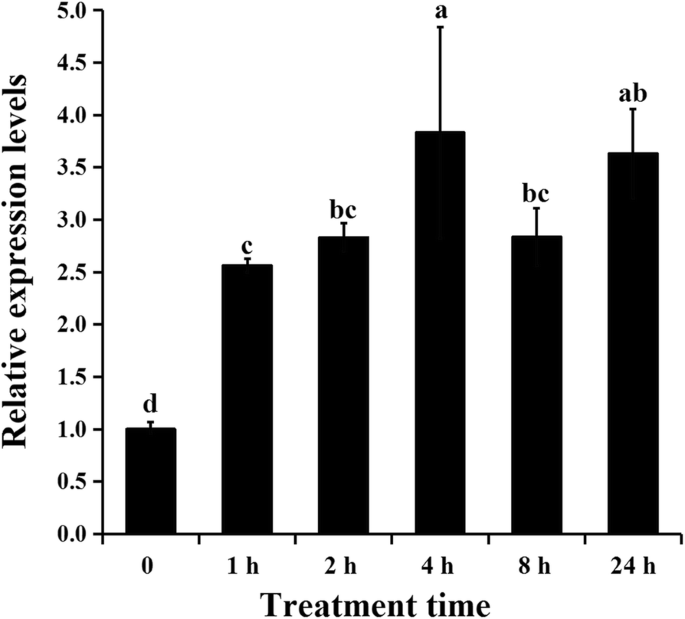
的表达式概况AgAPX1测定其在芹菜脱水胁迫下的反应。如图所示。2的表达式级别AgAPX1PEG处理1 h时,基因表达量为对照的2.56倍,在4 h时达到峰值,随后下降。结果表明AgAPX1PEG 6000处理与芹菜脱水胁迫相关。
AgAPX1在大肠杆菌并纯化重组AGAPX1
这AgAPX1基因被克隆到PET30载体中以构建蛋白质表达载体(PET-30a(+) - Agapx1),然后表达大肠杆菌BL21 (DE3)。制备纯化的AgAPX1重组蛋白,命名为rAgAPX1。通过ExPASy计算其分子量为33.16 kDa。纯化的rAgAPX1蛋白经考马西染色SDS-PAGE显示约34 kDa的单带,与计算结果一致(附文件)2).
表征rAgAPX1
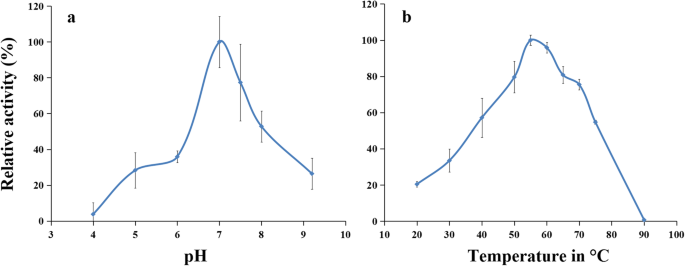
用于ASA的RAGAPX1催化氧化的最佳pH是pH 7.0(图。3.a). rAgAPX1的相对酶活性在酸性环境中较低,在pH 7.0前保持上升,然后下降。结果表明,该酶适宜的反应环境为中性。rAgAPX1的最适温度为55℃(图5)。3.b). rAgAPX1酶活性随反应温度从20°C到55°C升高,在55°C达到峰值后下降,在90°C失活。
AgAPX1蛋白的亚细胞定位
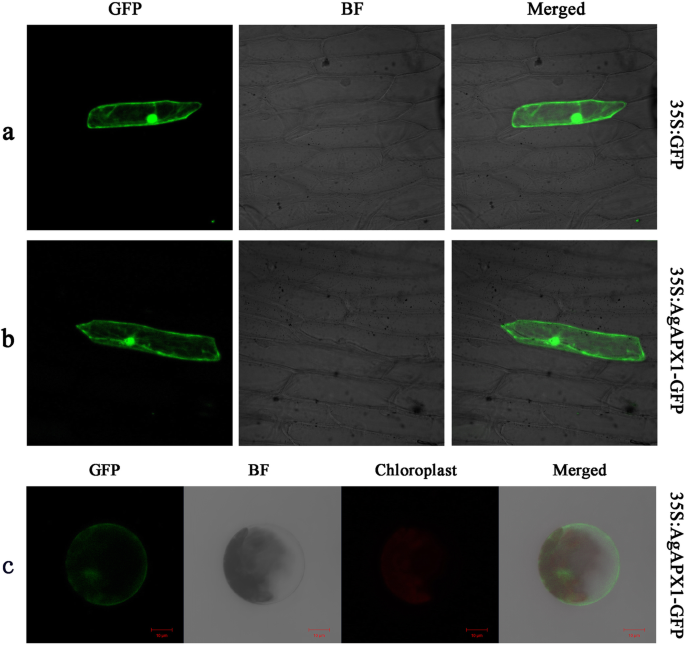
空载体(PA7-GFP)和重组载体(AGAPX1-GFP)在洋葱表皮细胞中表达,以研究AgAPX1的亚细胞定位。具有空载体的洋葱表皮细胞在整个细胞中显示出强烈的荧光(图。4.一种)。同时,由重组载体转化的洋葱表皮细胞显示出与空载体的绿色荧光的类似分布(图。4.b)。35S:AGAPX1-GFP融合构建体也表达拟南芥叶肉原生质体。绿色荧光信号主要显示在细胞核和质膜中,并且不与叶绿体荧光重叠(图。4.C)。这些结果表明AgAPX1位于核和膜中而不是在叶绿体中。
异源表达AgAPX1在拟南芥提高了AsA含量和总抗氧化能力
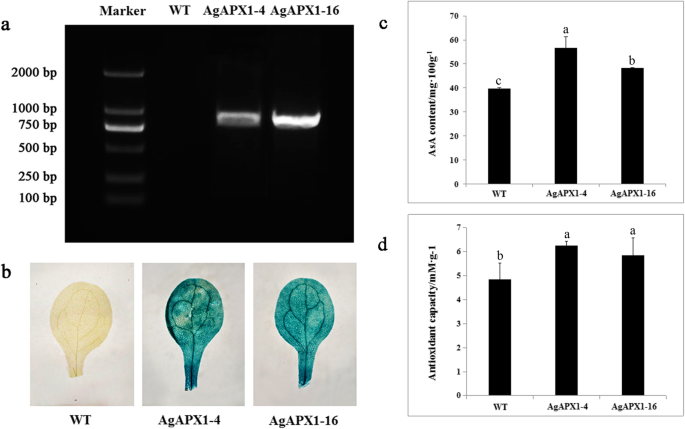
转基因拟南芥过表达的植物AgAPX1基因的产生,以进一步研究其分子功能AgAPX1.托管的阳性转基因素AgAPX1基因特异性扩增证实(图。5.一种)。两种转基因系通过β-葡糖醛酸酶(GUS)染色显示蓝色(图。5.b).在4周大时评估AsA水平拟南芥叶子通过HPLC。两种转基因系中的ASA含量明显高于野生型(WT)拟南芥植物(图5.c和附加文件3.).AgAPX1-4系的AsA含量最高,约为野生型植株的1.4倍。通过FRAP分析,AgAPX1-4和AgAPX1-16细胞系的总抗氧化能力分别提高了29.10和21.16%(图2)。5.d)。
过度表达AgAPX1在拟南芥通过调节气孔开度正向调节抗旱性
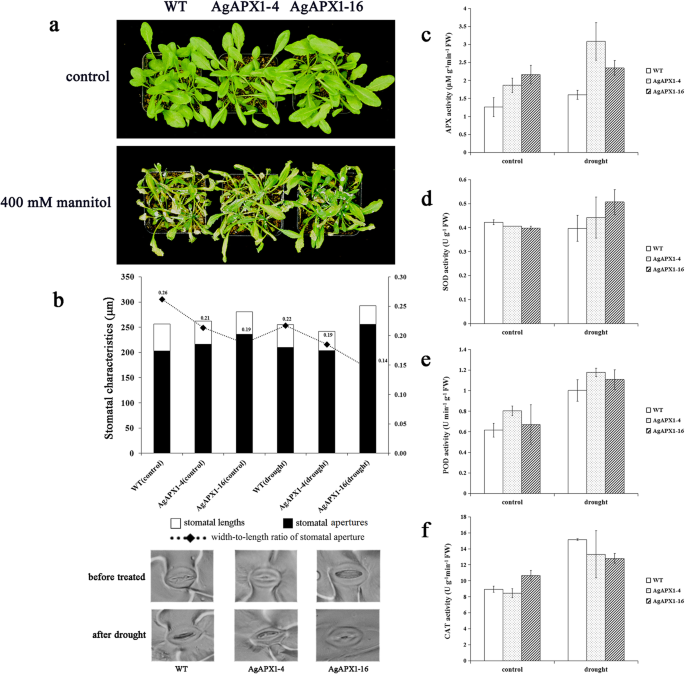
转基因和WT拟南芥用400mM甘露醇处理植物,以研究对干旱胁迫的耐受性。表型拟南芥在甘露醇治疗7天后观察到植物(图。6.a).转基因株系在干旱条件下表现出较好的状态。野生型和转基因株系的气孔孔径均因胁迫而减小。这两种转基因拟南芥干旱处理24 h后,株系气孔孔径变小。两种转基因植物的气孔宽度与长度之比拟南芥植物降低到0.85和0.66倍多,在野生型植物(图6.b)。
在治疗前后转基因系中抗氧化酶活性的分析
在野生型和两种转基因动物体内测定了APX、SOD、POD和CAT四种关键酶的活性拟南芥正常情况下的线条和干旱治疗。APX,SOD和POD是ROS清除系统中的主要酶。猫也是植物中重要的抗氧化酶[31]。在植物的生命周期中,H2O.2在各种非生物胁迫下积累[1]。过多的H.2O.2直接或间接氧化生物大分子(核酸、蛋白质),破坏细胞膜,加速细胞衰老、解体。CAT能清除H2O.2维持植物体内ROS代谢的平衡。植物组织中CAT的活性也与植物的抗逆性密切相关[31那32]。
转基因拟南芥线具有比WT植物更高的APX活动(图。6.C)。所有样品的APX活动在干旱治疗后增加,并且在AgAPX1-4转基因系中增加了更显着的。此外,与WT植物相比,干旱胁迫增强了两种转基因系中的SOD活性(图。6.d).干旱胁迫后,所有供试样品的POD活性均增加(图2)。6.e)。然而,WT植物中的猫活性显示出比干旱治疗后两种转基因系中的那些显着增加(图。6.F)。
生理变化拟南芥叶暴露在干旱胁迫下
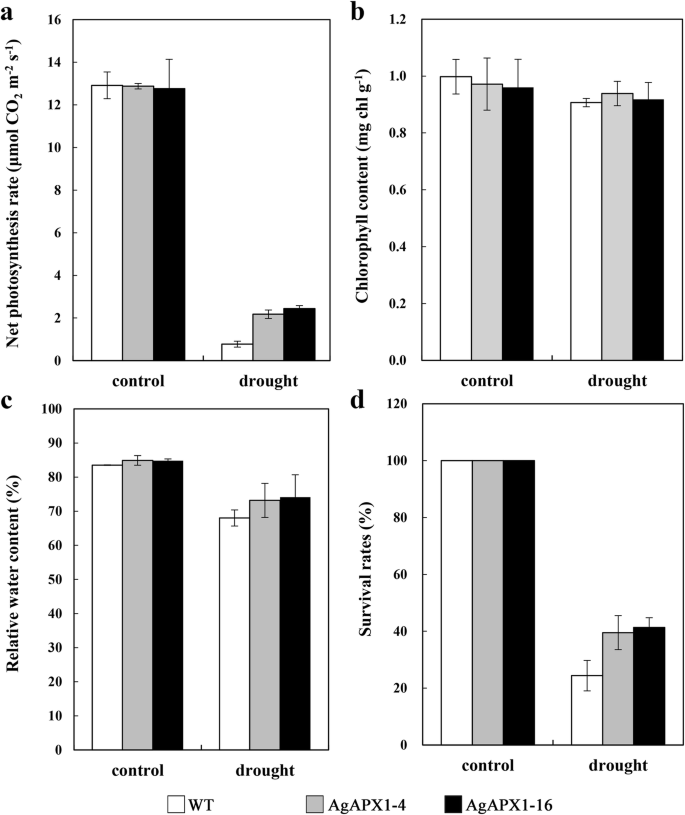
通过测定净光合速率(Pn)来评价野生型和转基因植物的光合活性拟南芥干旱胁迫下。如图所示。7.A,在干旱胁迫下,在转基因型中,PN在转基因中显着降低。结果表明,WT的光合体系造成比转基因素更严重的损伤。与转基因素相比,总叶绿素和相对含水量(RWC)在WT植物中也显着降低(图。7.B和C)。使用存活率来进一步证明转基因素的耐旱性,结果表明,治疗后的两个转基因系保留了较高的存活率(图。7.d)。
讨论
APX蛋白含有对抗坏血酸具有高特异性的血红蛋白。APX也具有更高的亲和力2O.2并利用ASA作为特定的电子给体,其在调节或消除H中起着至关重要的作用2O.2从细胞和维持细胞氧化还原平衡[33那34那35]。富含ASA的芹菜在全球范围内广泛培育[29]。在目前的工作中,AgAPX1从芹菜株系中克隆得到该基因。“Jinnanshiqin”。对AgAPX1特异结构的预测将有助于我们了解其特异功能。AgAPX1高度保守,具有过氧化物酶结构域。推测的AgAPX1与APX的氨基酸序列相似性最高P. Sativum..AgAPX1非常保守,与其他APXs具有高度同源性。系统发育分析表明,同一家族的APX蛋白在进化上更接近,APX的序列差异可能与其他结构基因一样,在单子体-双子体分裂后发生[36]。
从植物组织中纯化APX的报道较多大肠杆菌细胞以研究其功能[19那20.那37]。以往的研究表明,纯化的APX分子质量在28 kDa ~ 31 kDa之间[20.那21那38]。芹菜中rAgAPX1的分子量较高,SDS-PAGE测定约为34 kDa。rAgAPX1酶的最适温度为55℃,pH值为7.0。相比之下,在小松属(komatsuna)中,最佳的胞质APX活性是在38°C和pH 6.5的条件下[20.]。在Liverwort中,APX酶的最佳温度为40°C,最佳pH值为6.0 [38]。不同物种间理化性质的差异可能是由于APX基因序列的差异造成的。另一个原因可能是由于在rAgAPX1蛋白的n端插入了His-tag、S-tag、肠激酶和凝血酶序列[39那40]。
基因表达分析是了解高等植物逆境响应分子机制的重要手段。以往的研究报道,植物在逆境条件下通常表现出APX活性的增加,这通常与耐受性的增加有关[41那42]。同时,表达APX型可以诱导基因以防止氧化应激[42]。当受到冷和盐胁迫时,APX酶的活性增强了[16那43]。另外,表示的是APX型基因在干旱胁迫下上调Eleusine Coracana.[44]。在本研究中,转录水平AgAPX1在“金南石琴”植物中,peg诱导的脱水胁迫显著上调,这与前人的研究结果一致[45那46]。结果表明AgAPX1参与芹菜对干旱胁迫反应的基因。响应AgAPX1逆境的基因可能归因于不同物种之间的APX序列。此外,大多数与抗氧化酶相关的差异表达基因均在线粒体,叶绿体和过氧缺血中局部化[47那48]。APXs根据其在植物细胞中的分布有几种形式的同工酶,包括基质(sAPX)、叶绿体中的类囊体膜(tAPX)、微体APX (mAPX)和胞质APX (cAPX) [17]。我们的研究表明,AgAPX1主要定位于细胞核和细胞膜。APX在细胞核中的可能功能是协调ROS信号,调控相关基因的表达,从而调控植物的生理变化和应激反应[49那50]。
干旱压力是一个限制园艺生产率的全球问题。植物中的一些防御机制是在压力下引起的,以保护自己免受氧化应激的损伤[51]。既往研究也报道过表达APX型在植物中提高耐受寒冷和炎热应力[50]。过度表达SSAPX.孤立的基因Suaeda Salsa.在拟南芥保护植物免受盐诱导的氧化应激[52]。Asa是一种天然抗氧化剂,直接作用于植物反应中和对非生物胁迫的超氧化物自由基[24]。AsA代谢相关基因的过度表达,如GMP.[36],GGP[53], 和DHAR[54,通过调节植物中AsA的产生,提高植物对非生物胁迫的抗性。我们发现这是过度表达AgAPX1在拟南芥显示显着增加了ASA内容。在干旱胁迫下,转基因拟南芥(AGAPX1-4和AGAPX1-16)线路显示出比WT植物更好的增长状态。多种酶促抗氧化剂在清除毒性ROS并保护植物免受氧化损伤的影响作用55]。转基因APX的酶活性拟南芥也增加了。AgAPX-16系的APX活性高于AgAPX-4系。可能的原因是AsA的生物合成受到除APX活性外的许多因素的复杂调控[29]。干旱胁迫使转基因植株中APX、SOD和POD等抗氧化酶活性显著升高拟南芥植物。这些结果表明转基因拟南芥植物托管AgAPX1通过增强ASA积累和抗氧化酶的活性,对干旱胁迫具有增加的耐受性。AGAPX1-16线显示APX活动的较低增量,而不是AGAPX1-4响应干旱。转基因系的APX活性的差异可以与靶基因的插入部位,转录和后翻页相关联。WT植物显示比转基因植物更高的猫活性升高。猫,直接h2O.2清除酶,清除过量的H2O.2在植物的抗氧化防御系统中从干旱胁迫产生[56]。
抗逆性的提高也可能与植物气孔关闭有关。气孔关闭在植物先天免疫中的关键作用已被描述[57]。在高等植物中,非生物胁迫可诱导气孔关闭。有限公司2这促进了RuBP的氧化以产生额外的H2O.2[58那59]。ROS种类如h2O.2是APXs的主要目标[33]。因此,对转基因的气孔孔减小和升高的抗氧化酶活性拟南芥干旱胁迫下的植物是合理的。同时,转基因系中的净光合速率,相对含水量和叶绿素含量的干旱诱导的降低比在WT植物中低得多。这些结果与之前的报告同意[60那61]。在过表达的转基因植物中,叶绿素降解和脂质过氧化降低APX型在以前的研究中,在几种逆境下的基因[62那63]。我们的结论是AgAPX1转录水平是芹菜和转基因中非生物胁迫的重要调节机制拟南芥.
此外,基因沉默和敲除是验证植物中基因的功能的重要技术手段。基因沉默通常使用RNA干扰(RNAi)来实现[64]。CRISPR/Cas9系统已被常规用于基因敲除[65]。然而,这两种技术都基于转基因技术,并且尚未在芹菜中建立有效的转化系统。我们将专注于消除这种限制,以产生稳定的功能损失,以便在未来的工作中进一步努力验证。
结论
本研究确定并表征了芹菜,AgAPX1的ASA-GSH循环的关键酶。目前的结果提供了有关APX酶的潜在特征的重要信息。对的响应AgAPX1干旱在芹菜和的异源表达AgAPX1基因拟南芥进一步阐明了AgAPX1的重要作用。AgAPX1转基因株系可为筛选抗旱性强的作物植株提供参考,增加转基因技术在芹菜中同源表达的可信度和基础,提高其抗逆性。这些发现对干旱地区的农业非常重要。
方法
植物材料和胁迫处理
拟南芥哥伦比亚生态型(对照拟南芥)和芹菜品种。“Jinnanshiqin”在作物遗传和种质创新南京农业大学的国家重点实验室沉积(32°04'N,118°85'E)。这plants were grown in pots containing a mixture of organic soil and vermiculite (3:1, v/v) in an artificial climate chamber (a 16-h photoperiod, an illumination of 240 μmol m−2年代−1昼/夜温度为25/16°C,相对湿度为70%)。对于脱水胁迫,用20% PEG 6000处理两个月的芹菜植株。“金南石琴”叶片在1、2、4、8、12、24 h后采收,立即用液氮冷冻,-80℃保存至分析。这拟南芥种子在MS固体培养基上播种7 d后,转入商品盆栽土壤混合物,置于22℃、相对湿度70%的对照生长室(12h: 12h,光照:黑暗)。见面答:芥seedlings were irrigated with 400 mM mannitol solution. The samples were collected at 24 h after treatment for further analysis.
基因搜索,克隆和生物信息学分析
DcAPX (Accession No. No.)的氨基酸序列。利用来自胡萝卜的APX基因AKH49594.1)对我们的芹菜转录组数据库进行blast,以获得编码APX的基因[66那67]。Comp120_c0_seq1中的开放阅读框(ORF)与DCAPX的序列最相似。这个ORF被指定为AgAPX1在这项研究中。通过PCR扩增,从‘金南石芹’芹菜的cDNA中克隆出该基因。的克隆引物AgAPX1分别为5 ' -ATGGGAAAGTGCTATCCAATTGT-3 '和5 ' -TTAGGCCTCAGCAAACCCAAGT-3 '。然后,利用ExPASy (http://expasy.org/tools/).使用智能程序分析AGAPX1蛋白的功能域。使用CPHModels 3.2服务器进行三维结构建模(http://www.cbs.dtu.dk/services/CPHmodels/)在线分析软件。来自不同物种的APX蛋白的氨基酸序列在群集X程序中对齐,使用Mega 6.0构建系统发育树[68]。
的表达模式AgAPX1基因
采用SYBR预混料在CFX96 Real-Time PCR系统(Bio-Rad)上进行RT-qPCRTaq交货.RNA提取使用rnaprep.纯植物试剂盒(天根生物,北京,中国)按照制造商的说明,然后反转录到cDNA。采用15倍稀释的cDNA进行RT-qPCR分析。这AgActin基因被用作标准化的内部标准[69]。引物对AgAPX1RT-qPCR检测到5 ' -GCCGCTTGCCTGATGCTACTT-3 '和5 ' -CCTTCAAACCCAGAACGCTCCTT-3 '。用2-ΔΔct方法(70]。每种样品进行三种生物重复。
AgAPX1在大肠杆菌
这AgAPX1基因克隆到载体pET-30a(+)之间BAM你好,囊我的网站。重组正向引物和反向引物分别为5 ' - gccatggctgatatcggccatgggaaagtgctatccaattgt -3 '和5 ' -GCAAGCTTGTCGACGGAGCTCTTAGGCCTCAGCAAACCCAAGT-3 '。放大的载体被转化成大肠杆菌DH5α,并经DNA测序证实。大肠杆菌用BL21(DE3)细胞(TransGen,北京,中国)表达pET-30a (+)-AgAPX1。转化的细菌细胞在含50 mg·L的LB培养基中培养−1卡那霉素在37℃下搅拌约4小时,230 rpm摇晃至OD值600价值达到0.4-0.6。通过将异丙基β-D-1-硫代甲酰胺(IPTG)加入18℃的终浓度为1.0mm,继续培养,继续摇动重组蛋白,并且继续摇动(220rpm)超过12小时。
重组蛋白AGAPX1的纯化
重组蛋白纯化的所有步骤均在4°C下进行。离心收集细胞;悬浮在4 mL的裂解缓冲液(pH = 7.5)中,其中含有50 mM的NaH2宝4.、300 mM NaCl、10%甘油、10 mM β-巯基乙醇和10 mM咪唑;在冰上被超声波干扰20分钟。超声后的细胞匀浆在4℃,12,000 rpm离心10分钟,上清液用0.22-μm微滤膜过滤。将混合物加载在含有ni - nta -琼脂糖树脂(1.5 mL床积)的柱上(Qiagen, Hilden, Germany),并用平衡缓冲液(50 mM NaH)进行平衡2宝4., 300mm NaCl, 10%甘油和10mm咪唑,pH = 7.5)。用pH = 7.5的缓冲液(含50 mM NaH)洗涤2宝4.用300 mM NaCl、10%甘油、10 mM β-巯基乙醇和50 mM咪唑进行6次以上洗脱。然后,用50 mM NaH洗脱缓冲液溶解his标记的AgAPX12宝4., 300 mM NaCl, 10%甘油,10 mM β-巯基乙醇和10 mM咪唑,pH = 7.5),然后用平衡缓冲液清洗,使柱重新平衡。如前所述,纯化的酶被收集,然后在-20°C保存以供进一步分析。根据Laemmli的描述,使用12% (w/v) SDS-PAGE检测活性组分的纯度[71],然后用考马斯亮蓝染色。
AgAPX1活动分析
如先前由Nakano&Asada(1987)描述的APX活性[72经过一些修改。简而言之,反应混合物含有50mM PBS(pH = 7.0),0.1mm EDTA-NA2, 0.5 mM AsA和0.1 mM H2O.2,约50 μg纯化rAgAPX1,最终体积为300 μL。反应由H的加入引起2O.2.酶的活性是通过测量在290 nm处的吸光度下降(Ɛ290./ 2.8毫米−1厘米−1)由于氧化在几分钟内。根据使用牛血清白蛋白(BSA)作为标准的Bradford的方法,用Coomassie亮蓝G-250测定蛋白质浓度。
pH和温度对AgAPX1活性的影响
在50mM柠檬酸-NA中测定酶活性的最佳pH值2HPO.4.(pH = 4.0-5.0), 50 mM NaH2宝4.na2HPO.4.(pH = 6.0-8.0)和50mM甘氨酸 - NaOH(pH = 9.2)。温度(20℃-90℃)对酶活性的影响在50mM PBS的pH 7.0中测定5分钟。
亚细胞本地化
全长序列AgAPX1扩增没有终止剂的基因,然后插入GFP融合表达载体PA7中。通过使用氦从驱动的颗粒促进剂(PDS-1000,Bio-rad),通过生物化方法将重组载体(AgAPX1-GFP)和空载体(PA7-GFP)转移到洋葱细胞中。在25℃的黑暗培养箱中,在MS固体培养基上涂布洋葱表皮细胞超过16小时。此外,重组载体35s:AgAPX1-GFP转化为拟南芥由于有些APXs位于叶绿体中,而洋葱表皮细胞缺乏叶绿体,因此利用叶肉原生质体来识别AgAPX1的真实位置。的隔离拟南芥根据Yoo等人的peg介导转化方法进行叶肉原生质体和瞬时基因表达[73经过一些修改。转化后的原生质体在25℃暗培养箱中培养16小时以上。使用LSM780共聚焦显微镜成像系统(Zeiss Co., Oberkochen, Germany)观察GFP融合蛋白和红色叶绿体自荧光的荧光信号。
过表达载体构建和拟南芥转型
的全长ORFAgAPX1使用特定引物(前进:5'-tttacaattackatggggatcatggggaAgtgctatccaattgt-3'和反向:5'-AcckatgataCgaacgctctaggccagcaAAAcccaAGT-3')扩增,并将其亚克隆到载体pcambia-1301中。通过PCR和测序验证构建体。含有35s的重组载体(CAMV 35S:AGAPX1):引入了GUS报道基因序列农杆菌肿瘤术电穿孔法分离菌株GV3101。如前所述,WT植物的转化使用花浸法进行[74]。转基因线拟南芥在含湿霉素(40 mg/L)的MS培养基上筛选,然后种植。种子随后被收获。以进一步验证AgAPX1在转基因中拟南芥,进行GUS染色和PCR扩增。独立的转基因拟南芥通过筛选获得的线在下一个实验中使用。
AsA含量的测定
AsA含量是按照由段稍作修改[描述的方法测定75]。简而言之,约0.3 g转基因和野生型的新鲜叶子拟南芥用2ml 1%(w / v)预冷的草酸研磨植物。将匀浆在12,000rpm下离心10分钟,在4℃下将上清液通过0.45μm膜注射器过滤过滤。使用Agilent 1200 HPLC系统进行样品分析,用于在245nm波长下的ASA水平测定。流动相由0.1%(v / v)乙酸,流速为1ml / min。ASA含量表示为Mg / 100g(鲜重,FW)。
抗氧化能力分析
采用FRAP(铁还原抗氧化电位)法测定样品的抗氧化能力。根据制造商的说明,使用T-AOC检测试剂盒(S0116, Beyotime,上海,中国)进行检测。大约0.2克新鲜叶子拟南芥植物用1 mL PBS (pH = 7.0)匀浆,在593 nm处用分光光度计监测吸光度。抗氧化活性记录为mM铁2+每G鲜重(mm fe2+/ g Fw)。
气孔特征分析
用树叶从4周龄脱落的表皮背面获得了气孔的照片拟南芥在干旱胁迫24小时之前和之后的植物。使用电子显微镜和细胞图像软件随机完成气孔长度和孔的观察和统计。
粗酶提取及酶活性测定
从转基因和非转基因的4周龄叶中提取粗酶拟南芥400 mM甘露醇处理24小时后。SOD和POD活性测定,用50 mM PBS (pH 7.8)提取约0.2 g新鲜样品,用Wang 's法检测[76]。用于测定APX和CAT活性,新鲜拟南芥叶子用50mM PBS(pH7.0,含0.1mM EDTA)匀浆。粗APX活性的试验与上述相同。通过修改的方法进行猫活性测定Sahu.et al。[77]。每个实验有三个独立的重复。
光合速率,总叶绿素含量,RWC和植物存活率的测量
光合速率测定采用Li-6400便携式光合系统。总叶绿素含量采用Lichtenthaler和Wellburn法测定[78]。RWC的测量方法如前所述[79]。这是根据公式计算:RWC = [Fw-Dw] / [Tw-Dw] X100,弗兰克-威廉姆斯在哪里新鲜叶片的重量,重量和Tw水化后叶在水中孵化8 h,然后干燥在烤箱80°C,直至恒重记录为Dw。此外,拟南芥先不浇水10 d,恢复后再浇水3 d,观察存活率。以上试验均采用4周龄叶片进行。
统计分析
在本研究报告的所有值分别为三个独立的重复测量的手段,除非另有说明。这D.一种ta were expressed as mean ± standard deviation (SD) of three replicates. Statistical significance of the differences was analyzed by SPSS 20.0 software (SPSS Inc., Chicago, IL, USA) using Duncan’s multiple-range test with a significance level of 0.05 (P < 0.05).
数据和材料的可用性
支持这篇文章的结论数据集包括在项目和其他文件中。
拟南芥哥伦比亚生态型(对照拟南芥)南京农业大学作物遗传学和种质增强国家重点实验室,芹菜'金南志勤人员。
缩写
- APX型:
-
抗坏血酸盐过氧化物酶
- 作为一个:
-
抗坏血酸盐
- BSA:
-
牛血清白蛋白
- 猫:
-
催化剂
- DHA:
-
脱氢血萎树脂
- EDTA:
-
乙二胺四乙酸
- 弗兰克-威廉姆斯:
-
鲜重
- GUS:
-
β-葡糖醛酸酶染色
- IPTG:
-
异丙基β-D-1-硫代乳酸酐
- MDA:
-
Monodehydroascorbate
- PBS:
-
磷酸盐缓冲溶液
- PN:
-
净光合速率
- 圆荚体:
-
过氧化物酶
- Ragapx1:
-
重组agapx1蛋白
- ROS:
-
活性氧
- rpm:
-
革命每分钟
- RWC:
-
相对含水量
- 草皮:
-
超氧化物歧化酶
参考
- 1.
鳃SS,Tuteja N.作物植物中非生物胁迫耐受性耐受性氧气和抗氧化机械。植物理性生物化学。2010; 48(12):909-30。
- 2.
Petrov Vd,Van Breusegem F.过氧化氢 - 用于植物细胞中信息流动的中心枢纽。AOB植物。2012; 2012(1):PLS014。
- 3.
宋学森,胡文辉,毛文辉,Ogweno JO,周永红,于建强。抗坏血酸过氧化物酶同工酶和抗坏血酸再生系统对非生物胁迫的响应Cucumis sativusacta botanica sinica(云南植物研究). 2005;43(12):1082-8。
- 4.
亚达夫的偏纯化与抗坏血酸过氧化物酶从成熟BER(Ziziphus MauritianaL)水果。生物技术学报。2014;13(32):3323-31。
- 5.
抗坏血酸过氧化物酶在抗坏血酸生物合成中的研究进展。生物化学学报。2008;72(5):1143-54。
- 6.
Lazzarotto F,Teixeira Fk,Rosa SB,Dunand C,Fennandes Cl,Fontenele AV,Silveira Ja,Verli H,Margis R,Margis-Pinheiro M.抗坏血酸过氧化物酶相关(APX-R)是一种功能相关的新血红素蛋白用抗坏血酸过氧化物酶但进化地发散。新植物。2011; 191(1):234-50。
- 7.
自由基、抗氧化剂和功能食品:对人体健康的影响。Pharmacogn启2010;4(8):118 - 26所示。
- 8。
Braun HJ, Rajaram S, Ginkel MV。CIMMYT为广泛适应育种的方法。Euphytica。1996;92(2):175 - 83。
- 9。
then MP, Davila Olivas NH, Kloth KJ, Coolen S, Huang PP, Aarts MG, Bac-Molenaar JA, Bakker J, Bouwmeester HJ, Broekgaarden C,等。植物抗逆性的遗传结构:多性状全基因组关联图谱。新植醇。2017;213(3):1346 - 62。
- 10.
关Q,王Z,王X,高野T,刘S.过氧化物酶APXPuccinellia Tenuiflora.提高转基因的非生物胁迫耐受性拟南芥通过H的降低2O.2积累。acta botanica yunnanica(云南植物研究). 2015;
- 11.
Faize M, Burgos L, Faize L, Piqueras A, Nicolas E, Barbaespin G, Clementemoreno MJ, Alcobendas R, Artlip T, Hernandez JA。胞质抗坏血酸过氧化物酶和cu/ zn超氧化物歧化酶对抗旱性的影响。J Exp Bot. 2011;62(8): 2599-613。
- 12.
蒋敏,钱华林,陈立佛,熊正忠,蒋敏,陈淑萍,林国强。抗坏血酸过氧化物酶基因的过表达芸苔CameStris.增强转基因植物的耐热性拟南芥.杆菌的杂志。2015;59(2):305 - 15所示。
- 13.
Hu Y, Wu Q, Sprague SA, Park J, Oh M, Rajashekar CB, Koiwa H, Nakata PA, Cheng N, Hirschi KD, White FF, Park S.番茄表达拟南芥戊二胺毒素基因Atgrxs17通过调制冷响应分量来赋予冷颤的耐受性。Hortic Res。2015; 2:15051。
- 14.
王丽,张qy,王f,孟x,萌qw。抗坏血酸在减轻低温诱导的氧化应激中起着关键作用拟南芥.Speckynthetica。2012; 50(4):602-12。
- 15.
Mittlle R,Zilinskas Ba。豌豆细胞溶质抗坏血酸过氧化物酶的纯化与表征。植物理性。1991; 97(3):962-8。
- 16.
穆罕默德马,Largani ZK,Sajedi Rh。冷应力下三种柑橘类水果的抗氧化剂活性的定量与定性比较。Aust J Croc SCI。2012; 6(3):402-6。
- 17.
Shigeoka S,Ishikawa T,Tamoi M,Miyagawa Y,Takeda T,Yabuta Y,Yoshimura K.抗坏血酸过氧化物酶同工酶的调节和功能。J Exp Bot。2002; 53(372):1305-19。
- 18.
Chen GX,Asada K.茶叶抗坏血酸过氧化物酶:两种同工酶的发生以及其酶促和分子特性的差异。植物细胞生理。1989; 30(7):987-98。
- 19。
Lu Z,Takano T,Liu S.两种抗坏血酸过氧酶的纯化和表征(奥雅萨苜蓿L.)表达大肠杆菌.Biotechnol Lett。2005; 27(1):63-7。
- 20。
Ishikawa T,Takeda T,Shigeoka S.来自小松植物的细胞溶质抗坏血酸过氧化物酶的纯化和表征(Brassica Rapa.).植物科学。1996;120(1):11 - 8。
- 21。
Leonardis Sd,Dipierro N,Dipierro S.来自马铃薯块茎线粒体抗坏血酸过氧化物酶的纯化和表征。植物理性生物化学。2000; 38(10):773-9。
- 22。
太阳MH,徐义,黄杰,江泽民,舒人,王鹤,张思兹。MAPKKK基因的全局鉴定,分类和表达分析:功能表征MdRaf5揭示苹果的进化和干旱响应剖面。Sci众议员2017;7(1):13511。
- 23。
外源应用抗坏血酸缓解小麦盐诱导的氧化应激。环境实验机器人。2008;63(3):224-31。
- 24。
Shalata A, Neumann PM。外源性抗坏血酸(维生素C)增强对盐胁迫的抵抗力,降低脂质过氧化。中国农业科学(英文版),2001;52(364):2207-11。
- 25。
严浩,李强,Park SC,王旭,刘永军,张永刚,唐伟,寇敏,马德发。CuZnSOD和APX的过表达增强了甘薯的耐盐性。植物生理生化。2016;109:20-7。
- 26。
江Q,徐泽,王F,李我,ma j,xiong as。非生物胁迫对杂志表达的影响Lhcb1基因与光合作用Oenanthe Javanica和Apium graveolens.58杆菌杂志。2014;(2):256 - 64。
- 27。
李明明,侯小林,王芳,谭发国,徐志生,熊安生。芹菜是一种重要的伞科蔬菜作物。生物技术进展。2018;38(2):172-83。
- 28。
李美明,冯伟,钱军,荆敏,熊安生。两种芹菜品种SSRs及差异表达基因的鉴定Apium graveolens通过深层转录组测序。Hortic杂志2014;1:10。
- 29。
黄伟,王光良,李辉,王峰,徐志生,熊安生。芹菜叶片发育三个阶段中抗坏血酸合成、循环和降解相关基因的转录分析。中国生物医学工程学报。2016;29(6):2131-43。
- 30.
Robert X,Gouet P.用新的Andick服务器解密蛋白质结构中的密钥特征。核酸RES。2014; 42(Web服务器问题):W320-4。
- 31.
邢y,贾有,张jh。Atmek1通过触发H介导CAT1过氧化氢酶的应激诱导的基因表达2O.2生产拟南芥.中国生物医学工程学报。2007;58(11):2969-81。
- 32.
Cantarello C,Volpe V,Azzolin C,BerteA C.酶活性的调节和与黄瓜UV-B胁迫响应初级和次生代谢相关的基因的表达(Cucumis sativusl .)。植物学报。2005;1(3):151-61。
- 33.
抗氧化应激、抗氧化剂与应激耐受性。植物科学进展。2002;7(9):405-10。
- 34.
沈春华,吴玉萍,叶伟华。一氧化氮对抗坏血酸盐抑制植物开花的作用。Sci众议员2016;6:35246。
- 35.
干旱和盐胁迫对植物抗坏血酸过氧化物酶和过氧化氢酶活性的影响。中华医学杂志。2015;16(6):13561-78。
- 36.
王海生,于超,朱志军,于晓春。番茄GMPase基因在烟草中的过表达通过增强抗氧化能力提高了对低温和高温胁迫的耐受性。植物学报2011;30(6):1029-40。
- 37.
孙思成,王明华,李文华,李文华。抗坏血酸过氧化物酶基因的克隆与表达Pimpinella Brachycarpa..植物生理学杂志。2002;159(9):1029-35。
- 38.
王志强,王志强,王志强,等。叶苔属植物Pallavicinia lyelli的分离纯化及动力学研究。美国灰色。胞质抗坏血酸盐过氧化物酶。植物生理生化学报。2010;48(9):758-63。
- 39.
冯轲,徐志生,刘建新,李建伟,王峰,熊安生。分离、纯化和表征agucgalt1.,参与紫芹菜中的花青素半乳糖基化的半乳糖基转移酶(Apium graveolensl .)。Planta。2018; 247(6):1363-75。
- 40.
徐志生,景明,冯伟,马海英,王启新,熊安生。鉴定和表征DcUCGalT1,负责紫色胡萝卜中的花青素吡酰基的半乳糖基转移酶(胡萝卜胡萝卜l .)主根。Sci众议员2016;6:27356。
- 41.
Allen Rd。使用转基因植物解剖氧化胁迫耐受性。植物理性。1995年; 107(4):1049-54。
- 42.
菠菜抗坏血酸过氧化物酶同工酶在氧化应激反应中的表达。植物杂志。2000;123(1):223 - 34。
- 43。
米什拉,班杜。NaCl短期暴露对番茄幼苗光化学活性和抗氧化酶活性的影响Bruguiera Parviflora.,一个非分泌者红树林。Acta physiol植物。2004; 26(3):317-26。
- 44。
BHATT D,Saxena SC,Jain S,Dobriyal Ak,Mavee M,arora S.克隆,表达和干旱诱导抗坏血酸过氧化物酶(EC-APX1)的功能验证Eleusine Coracana..Mol Biol rep. 2013; 40(2):1155-65。
- 45。
抗坏血酸过氧化物酶的全基因组鉴定和表达谱分析(APX型)和谷胱甘肽过氧化物酶(GPX)基因在干旱胁迫下的表达高粱二色的l .)。J工厂增长调节。2018; 37(3):925-36。
- 46。
Akcay UC,Ercan O,Kavas M,Yildiz L,Yilmaz C,Oktem HA,Yucel M.干旱诱导的氧化损伤和花生抗氧化反应(arachis hypogaea.L.)幼苗。植物生长调节。2010; 61(1):21-8。
- 47。
Palma JM,JiménezA,Sandalio Lm,Corpas FJ,Lundqvist M,GómezM,塞维利亚F,DelRíoLa。叶绿体,线粒体和过氧化血剂的抗氧化酶在叶片衰老的结节豌豆植物期间。J Exp Bot。2006; 57(8):1747-58。
- 48。
Palma JM,Sevilla F,JiménezA,RíoLad,Corpas FJ,MoralesPád,Camejo DM。辣椒果实的生理学和抗氧化剂的代谢:叶绿体,短片菌和过氧化血剂。Ann Bot。2015; 116(4):627-36。
- 49。
Caverzan A,Passaia G,Rosa SB,Ribeiro CW,Lazzarotto F,Margis-Pinheiro M.植物反应对抗:抗坏血酸过氧化物酶在抗氧化剂保护中的作用。Genet mol Biol。2012年; 35(4):1011-9。
- 50.
王j,吴b,尹h,风扇z,li x,sui n,他l,li J.过度表达Caapx.诱导编排活性氧清除作用和在烟草提高冷热公差。生物医学RES诠释。2017; 2017:4049534。
- 51.
Azooz MM, Ismail AM, Elhamd MFA。生长、脂质过氧化和抗氧化酶活性是盐胁迫下玉米品种耐盐性的选择标准。国际农业生物学杂志。2009;11(1):572-7。
- 52.
李克,庞安,丁F,隋n,冯泽,王bs。过度表达Suaeda Salsa.基质抗坏血酸过氧化物酶拟南芥叶绿体增强植物的耐盐性。acta botanica sinica(云南植物学报)2012;
- 53.
张玉,刘仁,张cq,唐kx,太阳mf,燕g,刘qq。水稻L-Galaction途径的操纵:转基因过度表达对抗坏血酸盐累积和非生物应激耐受性的评价。Plos一个。2015; 10(5):E0125870。
- 54.
李琦,李益,李世,玉克。通过过表达脱氢血管缺陷酶的增强抗坏血酸积累赋予番茄中甲基Viologen和盐胁迫的耐受性。捷克j群植物。2012; 48(2):74-86。
- 55.
抗坏血酸和谷胱甘肽:控制活性氧。植物生理学杂志。1998;49(1):249-79。
- 56.
干旱驯化通过诱导小麦幼苗细胞和亚细胞水平的协同抗氧化防御来增强其抗氧化能力。杂志足底。2006;127(3):494 - 506。
- 57.
梅特托米,康德伍德W,Koczan J,Nomura K,他Sy。植物气孔功能在对细菌侵袭的先天免疫中的作用。细胞。2006; 126(5):969-80。
- 58.
黄W,张某,胡H.太阳留下了上调了光致途径,保持了高速公路2烟草中的同化。前植物SCI。2014; 5:688。
- 59.
周y,黄l,张y,shi k,yu j,noguéss. rubp羧化和相关的容量降低2O.2通过嫁接到斐·葫芦,减轻了黄瓜叶中的累积。Ann Bot。2007; 100(4):839-48。
- 60。
顾俊峰,邱敏,杨建军。转基因水稻对干旱的耐受性增强4.光合作用酶。作物J. 2013; 1(2):105-14。
- 61.
邓平,东鹤。核黄素结合蛋白基因的异位表达TsRfBP矛盾的是,在转基因植物中增强了植物的生长和抗旱性拟南芥.J工厂增长调节。2013; 32(1):170-81。
- 62.
李DH,DC哦,哦,YS,Malinverni JC,Kukor JJ,Kahng HY。克隆和光合细菌深红红螺菌S1单官能过氧化氢酶的表征。Ĵ微生物生物技术。2007; 17(9):1460-8。
- 63.
Murgia I,Tarantino D,Vannini C,Bracale M,Carravieri S,Soave C.拟南芥过表达紫杉醇抗坏血酸过氧化物酶过表达的植物显示出对鸟类诱导的光氧化胁迫和一氧化氮诱导的细胞死亡的抗性增加。工厂J. 2004; 38(6):940-53。
- 64.
Tang W,Luo XY,Sanmuels V.基因沉默:双链RNA介导的mRNA降解和基因失活。细胞res。2001; 11(3):181-6。
- 65.
徐泽,冯克,熊。CRISPR / CAS9介导的橙色和紫色胡萝卜植物中的繁殖靶向诱变。莫尔生物科技。2019; 61(3):191-9。
- 66.
贾XL,王格,熊f,yu xr,xu zs,王f,xiong as。德诺维组装、转录组特征、木质素积累和解剖特征:对芹菜叶片发育过程中木质素生物合成的新见解。Sci众议员2015;5:8259。
- 67。
冯k,侯xl,李我,江q,徐血,刘jx,雄根。CelerydB:芹菜基因组数据库。数据库。2018; 2018:Bay070。
- 68。
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 69。
李美明,冯伟,钱军,王光良,常涛,熊安生。芹菜qPCR正规化内参基因的验证与比较Apium graveolens)在不同的发展阶段。植物科学学报2016;7:313。
- 70.
pfaffl mw。实时RT-PCR中相对量化的新数学模型。核酸RES。2001; 29(9):E45。
- 71.
Laemmli英国。在T4噬菌体头部组装过程中结构蛋白的分裂。大自然。1970;227(5259):680 - 5。
- 72.
菠菜叶绿体中抗坏血酸过氧化物酶的纯化它在抗坏血酸贫介质中的失活和单脱氢抗坏血酸自由基的活化。植物生理学报。1987;28(1):131-40。
- 73.
刘sd,赵永华,辛J。拟南芥叶肉原生质体:用于瞬时基因表达分析的多功能细胞系统。Nat Protoc。2007;2(7):1565 - 72。
- 74.
张x,亨罗基r,林ss,niu qw,chua nh。农杆菌属介断的转换拟南芥使用花浸法。Nat Protoc。2006;1(2):641 - 6。
- 75.
李H,刘ZW,吴ZJ,王yx,腾仁,壮族型蛋白质和基因分析揭示了温度对收获茶叶抗坏血酸代谢的影响。Hortic Res。2018; 5:65。
- 76.
王y,gao c,梁y,杨c,刘g。一本小说Bzip.基因Tamarix Hispida.在烟草植物中介导对盐胁迫的生理反应。J植物理性。2010; 167(3):222-30。
- 77.
外源水杨酸对小麦根系和叶片组织生长、色素含量和抗氧化剂的影响植物生理学杂志。2011;23(3):209-18。
- 78.
不同溶剂中叶提取物总类胡萝卜素和胆碱酯a和b的测定。生物化学学报1983;11(5):591-2。
- 79.
格里菲斯A,Bray Ea。ABA要求基因响应土壤干燥的诱导诱导。J Exp Bot。1996; 47(10):1525-31。
致谢
不适用。
资金
本研究由江苏省农业科技创新基金[CX(18)2007],新世纪高校优秀人才(NCET-11-0670),国家自然科学基金(31272175),江苏省高校学术优先发展项目(PAPD)资助。
作者信息
隶属关系
贡献
ASX和JXL启动并设计了研究,JXL,AQD,HL和QQY进行了实验;JXL,KF和ZSX分析了数据;ASX贡献试剂/材料/分析工具;JXL写了这篇论文;ASX和KF修改了论文。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘,JX。,冯,k。,段,aq。et al。芹菜和过表达的抗坏血酸过氧化物酶的分离,纯化和表征AgAPX1基因增强了抗坏血酸含量和抗旱性拟南芥.BMC植物杂志19,488(2019)。https://doi.org/10.1186/s12870-019-2095-1
收到了:
公认:
发表:
关键字
- 抗坏血酸盐过氧化物酶
- 纯化
- 超表达
- 拟南芥
- 干旱压力
- 芹菜