抽象的
背景
polygonum cuspidatum.蓼科植物是一种传统的药用植物,具有许多生物活性化合物,在人类健康和应激反应中发挥重要作用。研究试图识别该物种的生物合成基因和代谢途径,实时荧光定量PCR (RT-qPCR)因其快速、灵敏度和特异性而被广泛应用于基因表达检测。但是,没有P. Cuspidatum.已经发现了内参基因,这阻碍了基因表达的研究。在这里,我们的目的是确定合适的内参基因,以准确和可靠的标准化P. Cuspidatum.RT-QPCR数据。
结果
12个候选参考基因,包括九个常见(行为那tu那浴缸那GAPDH那EF-1γ那UBQ.那UBC.那60srrna., 和EIF6A)和三个小说(SKD1那YLS8, 和ndufa13.),在不同的组织(根,茎和叶)中分析,在非生物应激(盐,紫外线[紫外线],冷,热和干旱)和激素刺激(脱离酸[ABA],乙烯[Eth],Gibberellin [Ga3.[茉莉甲酸甲酯[MEJA]和水杨酸[SA])。使用该样品中的表达稳定性△CT方法,geNorm, NormFinder, BestKeeper, RefFinder。两个内参基因(ndufa13.和EF-1γ)足以使所有样本集的基因表达正常化。它们也是非生物压力和不同组织中最稳定的两个基因,然而ndufa13.和SKD1是激素刺激的两大选择。考虑个人实验组,GAPDH在ABA、ETH和GA下排名最高的基因是哪个3.治疗,而在60srrna.在Meja和冷治疗下表现出良好的稳定性。行为那UBC., 和浴缸分别为干旱、UV和ABA处理的适宜基因。tu因其在不同条件下表达差异较大,不适宜。的表达模式PCPAL,PCST, 和PcMYB4在UV和SA处理下,以及在不同组织中通过稳定内参基因和不稳定内参基因进行归一化,证明了最优内参基因的适用性。
结论
我们建议ndufa13.和EF-1γ作为参照基因进行正常化P. Cuspidatum.表达数据。据我们所知,这是第一次对参考基因的系统研究P. Cuspidatum.这有助于提前分子生物学研究P. Cuspidatum.和盟友的物种。
背景
polygonum cuspidatum.是一家常年草药的聚四多酸科家族,是一种着名的中医。它的第一家药用申请记录日期超过1800年Mingyi Bielu.[1].长期以来在中国民间医学中用于治疗腹部肿块、产后血瘀、尿道炎、化脓性溃疡、咽喉痛、牙痛、慢性支气管炎、痔疮等疾病[1那2].最近,其加工产品的口服摄入或外部应用显示在肝炎,高血压,高脂血症,糖尿病,黄疸,关节炎,皮肤灼伤和鳞片中有效[3.].
已分离出许多活性化合物并鉴定出来P. Cuspidatum.迄今为止,如蒽醌类、黄酮类、二苯乙烯类、有机酸类、香豆素类、儿茶素和木脂素[3.].白藜芦醇,斯蒂尔贝烯的含量更高P. Cuspidatum.而不是在其他植物中[4.[几种生理和药理学研究报道了用于白藜芦醇的抗氧化,抗癌,抗炎,抗肿瘤,抗抑制剂和抗病毒作用,以及通过与多个靶标的相互作用的神经保护和代谢调节[5.].其他组件P. Cuspidatum.在细胞或动物模型中也显示出显著的健康促进作用[6.那7.].有趣的是,绝大多数活性化合物是在正常植物生长期间合成的次生代谢物或响应环境压力[8.那9.].但是,机制P. Cuspidatum.需要彻底探索对非生物胁迫和激素刺激以及各种组织的反应,以更好地了解这些活性成分的生产。
苯丙烯和黄酮类化合物,苯丙烷型途径的衍生物,积极参与对抗应力的抗性,包括病原体,紫外线(UV)辐射,低/高温,干旱,重金属,茉莉酸甲酯(Meja)和乙烯(Eth)[8.那9.].苯丙氨酸氨裂解酶(PAL)催化L-苯丙氨酸的转化为肉桂酸,这是苯丙烷型途径的首个承诺步骤。斯蒂烯合成酶(STS)和Chalcone合酶使用相同的底物4-香豆素-CoA和丙酰基 - CoA,以产生白藜芦醇和四羟基甲甲酰胺,其是斯蒂尔比和黄酮途径中的分支位点[10.].各种转录因子涉及苯丙基丙烷途径的调节[11.], 和myb4.在拟南芥UV和SA胁迫抑制苯丙素途径基因表达[12.那13.].
基因表达模式的分析可以为复杂的代谢过程提供见解。定量实时PCR(RT-QPCR)通常用于检测不同物种的基因表达,因为其简单,速度,敏感度,特异性和高吞吐量[14.].然而,尽管有这些优点,初始材料的可变性,RNA完整性,RT-PCR效率,QPCR效率和固有的技术变异将不可避免地导致错误,因此有必要使用参考基因作为内部控制[15.].适当的内参基因应在被调查的样本中不断表达[15.].用于RT-QPCR数据归一化的经典参考基因,例如肌动蛋白,微管蛋白,遍在蛋白,伸长因子,翻译引发因子和核糖体RNA,用于细胞中的基本和必要方法。然而,增加实验证据表明,一些这些基因与以前认为的一些基因不那么稳定[16.].因此,已经使用来自基因组和转录组数据集的筛选鉴定了许多高度稳定的新参考基因[17.那18.].以前,参考基因在不同的物种和组织中并不总是稳定,或在单一物种中的不同发育阶段和实验条件下进行稳定[19.].因此,在使用前的特定条件下评估表达稳定性概率至关重要。此外,期望两个或更多个参考基因是为了避免对靶基因表达的变化的偏置或误解解释[20.].
在这种情况下,△CT方法(21.],改变[22.], NormFinder [23.],bestkeeper [24.和RefFinder [25.]已经被发展来评估生物样本中基因的稳定性。它们已被成功地应用于多种药用植物中,如秦艽[26.],achyranthes bidentata.[27.], 和Euscaphis Konishi.一世 [18.].在P. Cuspidatum.那PcPKS1[28.],PcPKS2[29.],PcCHS1[30.],PCSTS.[31.],PcMYB1[32.], 和PCWRKY33.[33.已经被克隆并进行了研究。然而,缺乏P. Cuspidatum.内参基因已成为该物种基因表达研究的主要障碍。由于缺乏序列和表达信息,我们进行了转录组测序P. Cuspidatum.我们实验室的营养组织(根、茎、叶)和不同处理(UV和MeJA)下的叶片(未发表数据),为我们当前选择合适的内参基因提供了丰富的资源。
本研究进行了表征候选参考基因,用于RT-QPCR数据归一化P. Cuspidatum..12个基因(肌动蛋白[行为],微管素-α[tu],管蛋白β[浴缸],甘油醛-3磷酸脱氢酶[GAPDH],伸长因子1-gamma[EF-1γ],泛素domain-containing蛋白质[UBQ.],泛素缀合酶[UBC.],60s核糖体RNA[60srrna.],真核翻译起始因子6A[EIF6A],K+转运生长缺陷抑制因子1[SKD1],thioredoxin-like蛋白质[YLS8], 和NADH脱氢酶[泛醌]1个alpha子追容子单元13-a[ndufa13.])从中筛选出来P. Cuspidatum.转录组,并通过RT-QPCR在所有样品中检测到它们的表达水平。这些包括三种组织(根,茎和叶),32个非生物处理的样品(盐,紫外线,冷,热和干旱)和30个激素处理的样品(脱酸酸[ABA],Eth,Gibberellin [Ga3.]、MeJA和水杨酸[SA])。表达式稳定性使用△CT,Genorm,Normfinder,BestKeeper和Reffinder。另外,三个靶基因的表达(PcPAL那PCSTS., 和PcMYB4)通过UV和SA治疗和不同组织通过最且最稳定的基因分开归一化,以证明推荐参考基因的适用性。我们的结果为未来的基因表达量化提供了一些有用的资源P. Cuspidatum.和盟友的物种。
结果
鉴定候选参考基因
在这项工作中,9个经典参照基因(行为那tu那浴缸那GAPDH那EF-1γ那UBQ.那UBC.那60srrna., 和EIF6A)及三个新的内参基因(SKD1那YLS8, 和ndufa13.)P. Cuspidatum.转录组作为候选参考基因。用于设计特异性QPCR引物的这12个基因的全长CDNA被提交给NCBI Genbank(表1).
评估引物特异性和效率
PCR产品放大P. Cuspidatum.将叶cDNA用1%(m / v)琼脂糖凝胶电泳检查,显示每个引物对的单个预期大小(附加文件1:图S1)。此外,每个基因的熔化曲线中的一个单峰证实了引物的特异性(附加文件1:图S2)。QPCR效率(E.)由86% (浴缸)至103% (SKD1)相关系数(R.2)从0.994到0.999范围(附加文件1:图S3)。因此,每个引物对具有高效且特异于目标区域。
候选参考基因的表达分析
12候选参考基因的表达水平(行为那tu那浴缸那GAPDH那EF-1γ那UBQ.那UBC.那60srrna.那EIF6A那SKD1那YLS8, 和ndufa13.)对65个不同组织和非生物和激素刺激下的叶片样本进行CT评价。所有样本中12个基因的原始CT值显示在附加文件中2,并直接用Boxplot绘制(图。1).CT值从19.84(GAPDH)至33.46(SKD1)在所有样本中。因为基因表达水平与CT值呈负相关,行为是最高的表达基因,平均CT值(21.60),而SKD1在12个基因中是具有最高平均CT值(27.42)的最小基因。每个基因的65个样品中的表达变异范围为4.12(EIF6A)至8.779(SKD1).没有一个基因在所有条件下表达水平不变,因此有必要在特定的实验条件下鉴定内参基因P. cuspidatum。
候选参考基因的表达稳定性
在我们的研究中,在11个实验组中评估了每种参考基因,首先单独分析。为了获得更全面的分析,然后将该套分为四种不同的组:(1)“非生物胁迫”(盐,紫外线,冷,热和干旱)(2)“激素刺激”(ABA,Eth,Ga3.,Meja和Sa)(3)“不同的组织”(根,茎和叶),和(4)“全部”(所有实验组)。更具体地,通过分析12个候选参考基因的稳定性△CT方法,geNorm, NormFinder, BestKeeper, RefFinder。
geNorm估计了准确可靠的RT-qPCR归一化所需的内参基因的最佳数量。如图所示。2, V2/3对于所有不同组的值远低于0.15的截止值,表明两种参考基因足以准确可靠地标准化基因表达数据。
对于“非生物压力”,60srrna.和EF-1γ是最低的m价值(0.25),然后是ndufa13.(0.35),表明这3个基因在geNorm分析中最稳定。ndufa13.和EF-1γ是常官场和常规的两个排名基因△CT分析,而EIF6A和60srrna.在BestKeeper的分析中位居榜首。根据RefFinder的计算,EF-1γ和ndufa13.是非生物胁迫条件下最合适的参考基因。每种特定非生物压力的综合排序顺序并不完全一致。EF-1γ那ndufa13., 和60srrna.也是热处理条件下最稳定的3个内参基因,但EF-1γ和ndufa13.但却不在四个最稳定的基因之列60srrna.在寒冷条件下排名第一。盐治疗,YLS8是排名排名的基因,其次是EF-1γ那浴缸, 和ndufa13..对于紫外线治疗,UBC.稳定性最高,而且EF-1γ那ndufa13., 和60srrna.也表现出良好的稳定性。ndufa13.是干旱治疗下的最佳参考基因,其次是EF-1γ和60srrna.低CVS.(桌子2额外的文件3.:表S1)。
对于“激素刺激”,最好的参考基因是60srrna.和EF-1γ在geNorm分析。ndufa13.和SKD1两者都是两个最稳定的参考基因△CT和NARMFINDER,但行为和SKD1由BESTKEYPER确定。在综合分析中,ndufa13.和SKD1是激素刺激条件下的两个最佳内参基因。在考虑每一种激素治疗时,ndufa13.是除ABA外所有激素处理中最稳定的3个内参基因之一;GAPDH和SKD1是ABA,ETH和GA条件下的四个最稳定的基因中(表2额外的文件3.:表S1)。
“不同的组织”,ndufa13.和EF-1γ是种族血管分析中最稳定的组合。看到了类似的结果△CT。ndufa13.和EF-1γ旁边GAPDH是NormFinder分析中排名靠前的基因。在BestKeeper分析中,行为首先排名最低的稳定值(0.06),而ndufa13.和EF-1γ排名第二和第四。ndufa13.和EF-1γ建议在不同的组织中P. Cuspidatum.通过reffinder(表2额外的文件3.:表S1)。
当考虑所有样本时,60srrna.那EF-1γ, 和ndufa13.排名最高,是最高的,△CT和Normfinder分析。但是,它们在BestKeeper分析中排名较低。REFFIDEDER从最高到最低稳定性中排名候选参考基因,如下所示:ndufa13.>EF-1γ>60srrna.>UBQ.>EIF6A>行为>YLS8>浴缸>UBC.>GAPDH>tu>SKD1(桌子2).一起携带,ndufa13.和EF-1γ是所有样本的两个最合适的参考基因P. Cuspidatum..此外,很清楚tu根据所有估值系统的所有实验条件下是一个不稳定的基因(表2额外的文件3.:表S1)。
候选内参基因的验证
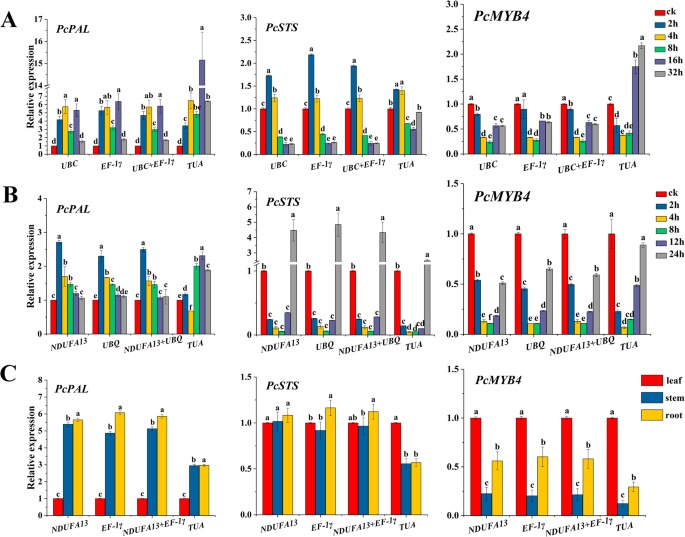
为了确保结果的准确性和可靠性,相对表达模式PcPAL那PCSTS., 和PcMYB4在非生物胁迫(UV)、激素刺激(SA)和不同组织(叶、茎、根)中进行分析。两个最稳定的内参基因(ndufa13.和UBQ.对于SA,UBC.和EF-1γ对于紫外线,ndufa13.和EF-1γ和一个不稳定基因(tu选择用于标准化QPCR数据。
如图所示。3.a,在紫外线治疗下,PcPAL在所有分析的应力时间显著诱导。而在16 h和32 h,表达水平与tu正常化程度要比两者都高得多UBC.那EF-1γ或者他们的几何平均值。表达PcMYB4紫外光处理对其有抑制作用,在8 h时达到最低水平后开始降低,随后又升高。然而,表达水平PcMYB4在16和32 h时被高估tu正常化。在分析中发生类似的误导PCSTS.表达数据。在SA处理下也观察结果中的一些分歧(图。3.b)。表达水平PcPAL与ndufa13.那UBQ.或者它们的几何平均值在加入2小时后达到最高,并且在4小时越高,而且对照,而相反的结果是显示的tu正常化。PCSTS.和PcMYB4迅速响应SA,长时间保持低表达水平(2-12小时)。tu归一化类似地导致了对相对表达模式的错误解释PcMYB4.在不同的组织(图。3.C)、表达模式PcPAL那PCSTS., 和PcMYB4类似的,ndufa13.那EF-1γ, 和tu用于归一化,但根本和茎的折叠变化被归一化低估tu.
总的来说,表达模式PcPAL那PCSTS., 要么PcMYB4在使用稳定内参基因进行归一化时,表达水平几乎相同,而在tu是使用。此外,经稳定内参基因归一化后的RT-qPCR结果与来自不同组织的目的基因表达谱更为一致P. Cuspidatum.转录组数据(附加文件3.:表S2)。因此,通过上述软件计算的最合适的参考基因适用于某些特定条件下。
讨论
RT-QPCR是在分子生物学中获得基因表达谱的最常用的技术之一。这样做的先决条件是选择适当的参考基因,以确保结果的准确性和可靠性[15.].通过测序产生的大规模基因段和基因表达数据为参考基因的鉴定和评估提供了丰富的资源,尤其是非模型物种[18.那26.].
在这项工作中,我们充分利用我们实验室现有的转录组测序数据来识别候选内参基因P. Cuspidatum..表达稳定性用△CT方法,geNorm, NormFinder, BestKeeper,虽然得到的结果不完全一致。此前的一些研究也报告了这种稳定性排名上的差异[34.].有趣的是,我们发现排名由△CT,Genorm和Normfinder是相似的,特别是对于个体套装,但与Bestkeeper的不同;在其他研究中报道了类似的结果[19.那34.].例如,在我们的工作中,在ETH下,GA3., SA治疗,行为通过BestKeeper分析,被鉴定为最稳定的基因,但在△CT, NormFinder和geNorm分析。因此,利用RefFinder对不同软件的多个结果进行综合分析,有助于选择更合适的内参基因。
行为那tu, 和浴缸(编码细胞骨架蛋白)广泛用作参考基因,并且在许多植物中报告了它们的高稳定性[35.那36.].然而,我们证明了这一点tu在所有样本集上的表现都很差,行为在大多数情况下表现不佳,浴缸受SA、寒冷等环境因素影响较大;这与之前在杜仲乌罗米多亚[37.].GAPDH编码大多数细胞类型中存在的丰富的糖酵解酶,并且普遍用作RT-QPCR中的参考基因。GAPDH在欧芹和胡萝卜叶对“激素刺激”的反应中表现良好,但在大多数非生物胁迫下表现不稳定[36.那38.].表现GAPDH在我们的研究中,除了对Meja和Drougrous的反应之外,与先前研究的研究相对一致。泛素是一种在真核生物大部分组织中发现的小型调节蛋白。我们表明了这一点UBC.是紫外线治疗中最稳定的基因,同意钻孔的调查结果[39.].而且,UBQ.是SA治疗下的两个最稳定的基因之一,与所获得的结果不同achyranthes bidentata.[27.]和胡萝卜[36.].然而,UBC.和UBQ.在所有其他集合中表现不佳,这与欧芹中看到的结果一致[38.].因此,UBC.和UBQ.并不是我们研究中首选的基因选择。
在许多研究中据报道了真核翻译引发因子和核糖体RNA作为参考基因,例如EIF4A在牛筋面[40], 和EIF5A和60s核糖体RNA在人参[41.].在我们的研究中,表演EIF6A和60srrna.在“非生物应激”、“激素刺激”和“所有”组中并不总是最好的,但在可接受的范围内。延伸因子1 (EF-1)由四个亚基EF-1α、EF-1β、EF-1δ和EF-1γ组成,在蛋白质生物合成中起核心作用[42.].EF-1α,编码g蛋白,用于一些药用植物的qPCR数据的标准化,如g . macrophylla[26.] 和答:bidentata[27.].EF-1γ的主要功能是确保EF-1复合物中不同亚基的正确脚手架以及引导其细胞内定位[43.].表达稳定性EF-1γ曾在P.人参[34.] 和摘要研究选择性[44.].在我们的研究中,EF-1γ是两个最合适的内参基因之一,在各种实验条件下表达量稳定。
新颖的参考基因,如SKD1那YLS8, 和ndufa13.也被大量组学数据的应用选择为基因归一化。SKD1,编码一种有助于真空运输和维持植物细胞的大型中央储液的蛋白质[45.,首次被选为梨的内参基因[46.].在这项研究中,SKD1优选在“激素刺激”条件下,但由于其低表达和高变异,必须在“非生物胁迫”和“不同组织”条件下丢弃。YLS8编码有丝分裂中涉及的蛋白质,并在ABA,Meja和盐条件下表现良好,但在其他单独的套件和三个组合群体中表现不佳。这些结果与先前获得的结果不相同[46.那47.].尤其,ndufa13.在个体组(ABA组除外)和组合组中均表现出显著的稳定性,表明它是一个几乎理想的内参基因。NDUFA13由核基因组编码,是线粒体呼吸链复合物I的附属亚基,它将电子从烟酰胺腺嘌呤二核苷酸转移到泛素酮[48.].线粒体被认为是真核细胞的动力源,这一事实或许可以解释其中的原因ndufa13.在本研究中,在各种条件下均表现出稳定的表达。ndufa13.以前报告为参考基因Apostichopus japonicus.[49.,但尚未有研究调查其在植物中的潜力。在这方面,本研究是已知的第一个关于ndufa13.作为植物中的参照基因。
朋友那STS, 和MYB图4是苯丙醇丙烷途径中的三个重要调节基因。使用稳定的参考基因时,相对表达模式PcPAL和PcMYB4与先前的报告一致;例如,myb4.通过暴露于UV-B光来下调拟南芥蒂利亚纳[12.] 和Brassica Rapa.[50.], 和朋友UV和SA在A. Thaliana.[51.] 和juglans regia.[52.].据我们所知,STS只存在于少数植物中,而不在拟南芥或烟草。研究STS表达目前集中在葡萄中,在那里它被证明是由UV-C强烈诱导的[53.]和sa [54.].我们观察到相反的表达模式STS回应SAP. Cuspidatum.,快速减少表达持续12小时。这些差异可能反映UV波长或物种的变化。此外,我们的结果与P. Cuspidatum.转录组数据。很明显,在我们的结果中有明显的低估或高估在最不稳定的基因,tu.我们的结果证明了使用稳定参考基因进行归一化以获得准确结果的重要性。
基于以上分析,我们建议不应在所有物种、组织或处理中使用单个基因进行归一化。因此,应探索适合特定物种和条件的内参基因。
结论
我们评估了不同组织中12个候选参考基因的表达稳定性P. Cuspidatum.在不同的处理条件下。ndufa13.和EF-1γ被鉴定为用于归一化RT-QPCR基因表达数据的最佳两种参考基因。他们的可靠性和有效性验证了PcPAL那PCSTS., 和PcMYB4.据我们所知,目前的工作是第一次系统分析合适的内参基因,将有助于进一步研究的分子生物学P. Cuspidatum.和其他紧密相关的物种。
方法
植物材料
种子P. Cuspidatum.从中国科学院植物学研究所(北京,中国)的药用植物园收集。在24℃下,在生长室中在Murashige和Skoog(MS)琼脂培养基上被表面灭菌和播种,在24℃下,具有16h / 8 H光/暗循环。1个月后,将类似的幼苗提交给不同的治疗方法。对于激素处理,幼苗用0.5mm Meja,1 mm Sa,0.1mm aba,0.5mm Ga均匀喷涂幼苗3.或0.5 g/L ethrl。冷热处理分别保存在4°C和42°C光照箱中。UV照射时,将幼苗置于UV- b透照器下20分钟。盐处理时,将幼苗移栽到含100 mM NaCl的MS琼脂培养基上。分别在UV和MeJA处理后0、2、4、8、16和32 h以及其他处理后0、2、4、8、12和24 h采集叶片样品。干旱处理,植物生长2个月塑料罐含土壤/蛭石混合(1:1)在同等条件下保存在干燥的土壤为1周,然后患者每天取样(0,1,2,3,4,5,6,7,8 d)。组织样本(根,茎,叶)收集从植物生长对土壤中2个月。所有65个样本,包括3个组织特异性样本(根、茎和叶),32个胁迫处理样本(盐、紫外线、冷、热和干旱处理的叶片),30个激素处理样本(ABA-、ETH-、GA)3.- ,Meja-和SA治疗的叶子),分别在三个生物重复中收集。将所有样品立即在液氮中冷冻并在RNA提取之前储存在-70℃。
RNA分离和cDNA合成
按照制造商的说明,使用植物总RNA纯化试剂盒(genmark,中国台湾)从样品中分离总RNA。用1% (m/v)琼脂糖凝胶检查RNA的完整性。使用NanoDrop 2000分光光度计(Thermo Fisher Scientific, Waltham, MA, USA)记录260/280 nm和260/230 nm处的吸光度,以评估总RNA样品的数量和质量。仅RNA样品1.8 < OD260/280 < 2.2 and OD260/230>2。0 were used for subsequent cDNA synthesis. Total RNA (3 μg) was reverse-transcribed into cDNA using the Hifair™ II 1st Strand cDNA Synthesis SuperMix (Yeasen, Shanghai, China) with oligo (dT) primers according to the manufacturer’s instructions. cDNA was diluted at 1:20 with the EASY dilution solution (Takara, Japan), then stored at − 20 °C until required as template for qPCR.
选择候选参考基因
unigenes的表达水平通常由每千碱基的转录本片段估计,每百万图读值[55.].候选参考基因应以小的变化系数(简历)[56.].在这项工作中简历计算公式是:简历=每百万映射读数(RPKM)/平均RPKM每千碱基读数的标准偏差。我们下载了九个经典参考基因的序列(行为那tu那浴缸那GAPDH那EF-1γ那UBQ.那UBC.那60srrna., 和EIF6A)在其他物种中鉴定,并对此进行抨击查询P. Cuspidatum.转录组。然后,将最高正交序列与拟南芥并记录在表中1.另外,三个新的候选基因,SKD1那YLS8, 和ndufa13.,是根据他们的低简历和适当的RPKM值(附加文件3.:表S3)。这些候选参考基因的cDNA和基因组DNA序列被示出为额外的文件4.和附加文件5.,分别。
引物设计
利用Primer 5软件设计特异性引物,由GENEWIZ公司(中国天津)合成。基因特征及引物详细信息见表1.通过扩增和熔化曲线分析评估各引物对的特异性。相关系数(R.2)及放大效率(E.)对于所有引物对,通过使用汇集的cDNA的四倍稀释液(1/4,1 / 16,1 / 64,1 / 256和1/1024)通过标准曲线评估。
RT-QPCR.
所有QPCR都是在96孔板中使用QuantStudio™实时PCR软件(美国应用生物系统,USA)进行了Hieff™QPCRSybr®绿色大师组合(Yeasen,Shanghai,China)。包括每种10μl反应:5.0μl2×Hieff™QPCRSybr®Green主混合物,0.2μl的每个引物(10μm),1.0μl稀释(1:20)cDNA模板,和3.6μl的无RNase-水.产品扩增的循环程序为:95℃,5分钟(热启动激活),然后进行40℃,10s(变性),58℃,20s(退火),72℃20秒(延期)。在40次循环后产生熔化曲线,以以0.05℃/ s的加热速率在60-95℃的温度范围内测试每个引物对的特异性。每个样品使用三种技术复制。
候选参考基因表现的数据分析与评估
CT值表示每个候选参考基因的表达水平。扩增效率计算:E.(%)=(10−1 /坡 − 1) × 100 [57.].基因表达的稳定性通过△CT方法(21.],改变[22.], NormFinder [23.],bestkeeper [24.和RefFinder [25.].
这△CT方法通过计算平均标准偏差来对基因进行排名(SD基于候选参考基因的所有成对组合的相对表达。最低的基因SD被鉴定为最稳定的参考基因[21.].geNorm计算表达式的稳定性值(m-Value)对每个基因。最低的基因m值具有最稳定的表达式。geNorm确定成对变化(V.)的特定基因。V的截止值n / n + 1 < 0.15 means that further addition of reference genes no longer makes any significant contribution to the normalization. For instance, V2/3< 0.15表示有两个参照基因就足以进行数据归一化[22.].NormFinder提供了一个稳定值(SV.),它考虑了群体间和群体内的关系。SV越低,稳定性越好[23.].BestKeeper根据所有基因的CT值计算三个变量:相关系数(R.),标准偏差(SD),方差系数(简历).更稳定的基因表现出较低的基因SD ± 简历价值 [24.].Reffinder基于通过上述四种计算方法计算的所有基因的重量的几何平均值给出每个候选参考基因的全面排名。排名值的较低几何平均值表示更稳定的表达式[25.].
筛选候选内参基因的验证
为了验证所选参考基因,进行QPCR以分析靶基因表达水平(PcMYB4那PcPAL, 和PCSTS.)在紫外线和SA治疗和不同的组织下。同源P. Cuspidatum.基因AtMYB4和AtPAL1被克隆并命名PcMYB4和PcPAL分别为(表1额外的文件4.额外的文件5.).PCSTS.(EU647245.1)在我们实验室的先前研究中被分离出[31.].根据上述方法对这三个基因进行引物设计和检测。用2−△△CT.方法。
数据和材料的可用性
支持本研究结论的数据和材料包括在文章及其附加文件中。
缩写
- 60srrna.:
-
60s核糖体RNA
- 阿坝:
-
脱盐酸
- 行为:
-
actin 7.
- EF-1γ:
-
伸长因子1-gamma
- EIF6A:
-
真核翻译起始因子6A
- 乙:
-
乙烯
- 赤霉素:
-
吉布林素
- GAPDH:
-
甘油醛3磷酸
- Meja:
-
茉莉酸甲酯
- myb4.:
-
转录阻遏MYB4
- ndufa13.:
-
NADH脱氢酶[泛素酮]1 α
- PcPAL:
-
苯丙氨酸ammonia-lyase
- PCSTS.:
-
斯蒂替斯合成酶
- SA:
-
水杨酸
- SKD1:
-
K+转运生长缺陷抑制因子1
- tu:
-
小管素-6
- 浴缸:
-
Tubulin-beta 2
- UBC.:
-
Ubiquitin-conjugating酶
- UBQ.:
-
泛素domain-containing
- 紫外线:
-
紫外线
- YLS8:
-
硫昔单蛋白蛋白YLS8
参考
- 1。
陶h明毅派璐。北京:人民卫生出版社;1986年。
- 2。
李深圳。本曹刚木。北京:人民卫生出版社;1979.
- 3.
彭W,秦立朗,李XL,周H.植物学,植物化学,药理学和潜在应用polygonum cuspidatum.摘要。E.t Zucc.: a review. J Ethnopharmacol. 2013;148:729–45.
- 4.
Jayatilake GS,Jayasuriya H,Lee Es,Koonchanok Nm,Gehlen RL,Ashendel Cl,等。激酶抑制剂来自蓼属植物cuspzdatum.J Nat Prod。1993年; 56:1805-10。
- 5。
白藜芦醇的分子靶标。中国生物化学学报(英文版);2015:1114-23。
- 6。
Peluso I,Miglio C,Morabito G,Ioannone F,Serafini M.Flavonoids和人类免疫功能:系统评论。CRIT REV FOOD SCI NUTR。2015; 55:383-95。
- 7。
黄Q,Lu G,SBEN HM,CBUNC MCM,ONG CN。大黄的蒽醌的抗癌性质。Med Res Rev. 2007; 27:609-30。
- 8。
黄酮类化合物是植物与环境相互作用的重要分子。分子。2014;19:16240 - 65。
- 9。
Chong J,Poutaraud A,Hugueney P.植物中斯蒂芬的代谢和角色。植物SCI。2009; 177:143-55。
- 10。
Emiliani G,Fondi M,Fani RGribaldo S.苯丙烷代谢起源的水平基因转移:植物到陆地的关键适应。Biol Direct。2009; 4:7。
- 11.
Boudet am。酚类化合物研究的演变与现状。植物化学。2007; 68:2722-35。
- 12.
金海林,康明内利,李晓东,等。AtMYB4的转录抑制控制了紫外线防护防晒霜的生产拟南芥.Embo J. 2000; 19:6150-61。
- 13。
陈永华,杨学勇,何科,刘明辉,李景国,高志富,等。拟南芥MYB转录因子超家族的表达分析及与水稻MYB家族的系统发育比较植物学报。2006;60:107-24。
- 14。
bestin SA, Benes V, Nolan T, Pfaffl MW。定量实时RT-PCR——一个展望。中华内分泌杂志。2005;34:597-601。
- 15.
DerveAux S,Vandesompele J,Hellemans J.如何使用实时PCR进行成功的基因表达分析。方法。2010; 50:227-30。
- 16。
陈志强,陈志强,陈志强,等。缺乏对内参基因的系统验证:在植物的逆转录聚合酶链反应(RT-PCR)分析中,一个被低估的严重缺陷。生物技术学报2008;6:609-18。
- 17。
Czechowski t,stitt m,altmann t,udvardi mk,scheible wr。基因组 - 用于转录标准化的优异参考基因的基因组鉴定和测试拟南芥.植物理性。2005; 139:5-17。
- 18。
梁伟,邹旭,孙伟,袁旭,等。qRT-PCR内参基因的选择与评价Euscaphis konishii称来自哈塔塔基于转录组数据。植物方法。2018; 14:42。
- 19。
黄志强,李志强,李志强,等。水稻叶片和花发育过程中内参基因的实时荧光定量PCR鉴定佩妮矮牵牛.BMC Plant Biol. 2010;10:4。
- 20.
Schmid H,Cohen CD,Henger A,Irrgang S,Schlondorff D,Kretzler M.在微放射人肾活量中基因表达分析内源性对照的验证。肾脏int。2003; 64:356-60。
- 21.
关键词:网织红细胞,实时荧光定量PCR,管家基因,基因表达BMC Mol Biol. 2006;7:33。
- 22.
VandeSompele J,De Preter K,Pattyn F,Poppe B,Van Roy N,De Paepe A等。通过多个内部对照基因的几何平均来精确正常化实时定量RT-PCR数据。基因组Biol。2002; 3:34。
- 23.
Andersen CL, Jensen JL, Orntoft TF。实时定量逆转录- pcr数据的归一化:一种基于模型的方差估计方法来识别适合归一化的基因,应用于膀胱癌和结肠癌数据集。实用癌症杂志2004;64:5245-50。
- 24.
Pfaffl MW, Tichopad A, Prgomet C, Neuvians TP。确定稳定的管家基因,差异调控的靶基因和样本完整性:Bestkeeper -基于成对相关性的工具。Biotechnol。2004;26:509-15。
- 25.
谢F,肖P,陈达,徐L,张B.蒙剑机:植物小RNA深序的MiRNA分析工具。植物mol biol。2012年; 80:75-84。
- 26。
他,闫H,华虎,黄y,王z.测量实时PCR的参考基因的选择和验证秦艽.植物学报2016;7:945。
- 27。
李军,韩旭,王超,齐伟,张伟,唐磊,等。RT-qPCR数据适用内参基因的验证achyranthes bidentata.在不同的实验条件下的布卢姆。前植物SCI。2017; 8:776。
- 28。
马LQ,Guo Yw,Gao Dy,Ma Dm,Wang Yn,Li Gf等。鉴定A.polygonum cuspidatum.编码III型聚酮二酮合成酶的三种内外基因,产生鼻腔蛋白和P.-hydroxybenzalacetone。足底。2009;229:1077 - 86。
- 29。
马立强,庞晓波,沈海英,蒲国宝,王洪辉,雷春英,等。一种新型III型聚酮合酶,由三内含子基因编码polygonum cuspidatum..足底。2009;229:457 - 69。
- 30。
李X,王H.克隆与表征PcCHS1从蓼属植物cuspidatum.J Graduate School academy Sci. 2013; 30:206-12。
- 31。
郭yw,guo hl,li x,huang ll,张bn,pang xb等。来自两种III型型聚酮合成酶蓼属植物cuspidatum:基因结构,进化途径和代谢物。植物Biotechnol rep. 2013; 7:371-81。
- 32。
刘Z,雷杰,李X,刘C,秦j,徐f等。转录因子的克隆和原核表达PcMYB1基因polygonum cuspidatum..J Henan Agricultral SCI。2018; 47:96-102。
- 33。
宝w,王x,陈m,柴翅声。一种腕骨转录因子,pcwrky33,来自蓼属植物cuspidatum降低转基因植物的耐盐性拟南芥蒂利亚纳.植物细胞代表2018; 37:1033-48。
- 34。
王敏,卢森。适宜内参基因定量表达分析的验证人参.前植物SCI。2016; 6:1259。
- 35。
MA S,NIU H,Liu C,张J,HOU C,王D.大豆不同应力条件下RT-QPCR候选参考基因的表达稳定性。Plos一个。2013; 8(10):E75271。
- 36。
田超,姜强,王峰,王光良,徐志生,熊安生。胡萝卜叶片非生物胁迫和激素刺激下qPCR规范化内参基因的选择《公共科学图书馆•综合》。2015;10 (2):e0117569。
- 37。
YE J,Jin CF,Li N,Liu MH,Fei ZX,Dong Lz等。不同实验条件下QRT-PCR标准化的合适参考基因的选择杜仲乌罗米多亚Oliv。SCI批准。2018; 8:15043。
- 38。
李美美,宋旭,王芳,熊爱华。适用于欧芹基因精确表达分析的内参基因(Petroselinum crispum)对于非生物胁迫和激素刺激。前植物SCI。2016; 7:1481。
- 39。
Borges AF,Fonseca C,Ferreira RB,Lourenco AM,Monteiro S.在生物和非生物胁迫下定量RT-PCR的参考基因验证vitis Vinifera.《公共科学图书馆•综合》。2014;9 (10):e111399。
- 40.
陈俊,黄泽,黄鹤,魏某,刘义,江卡,等。在鹅草中的基因表达研究中选择相对精确的参考基因(牛筋面除草剂胁迫下。Sci众议员2017;7:46494。
- 41.
刘继,王Q,太阳M,朱L,杨米,赵y。参考基因的定量实时PCR标准化选择人参在不同的生长阶段和不同的器官。《公共科学图书馆•综合》。2014;9 (11):e112177。
- 42.
Tarou S,Tsukamoto S,Kobayashi S,Ejiri S.编码翻译伸长因子1b(EEF1bγ)γ亚基的水稻cDNA的分离和表征。费用。1998年; 434:382-6。
- 43.
eEF1B复合物的两个大分子亚群的细胞共存。2月。2006;580:2755-60。
- 44.
王WX,Zhu,Li Kl,Chen LF,Lai FX,傅Q.分子表征,伸长因子1α和1γ的分子表征,表达分析和RNAi敲击摘要研究选择性及其酵母如糖果。公牛entomol res。2017; 107:303-12。
- 45.
等。SKD1调控因子LIP5和IST1-LIKE1在核内体分类和植物发育中的作用。植物杂志。2016;171:251 - 64。
- 46.
刘Z,Cheng K,Qin Z,Wu T,Li X,Tu J等。不同训练系统下梨叶组织QRT-PCR分析合适参考基因的选择与验证。Plos一个。2018; 13(8):E0202472。
- 47.
关键词:实时RT-PCR,数据归一化,内参基因橡胶树取代巴西橡胶树蔗糖转运体基因的表达验证HBsut3..植物科学。2011;181:132-9。
- 48.
Emahazion T,Beskow A,Gyllensten U,Brookes Aj。基于内含子辐射杂交杂交映射,其11个络合物I电子传输链的I基因。细胞生成细胞类型。1998年; 82:115-9。
- 49.
赵y,陈米,王t,sun l,xu d,杨h.海参基因表达的QRT-PCR分析参考基因的选择Apostichopus japonicus.在度夏。中国海洋石油。2014;32:1248-56。
- 50.
张L,王Y,Sun M,Wang J,Kawabata Sli Y.BRMYB4,苯丙烷类化合物和花青素生物合成基因的抑制因子由UV-B下调,但不是通过萝卜CV的颜料诱导阳光来调节。Tsuda植物细胞生理。2014; 55:2092-101。
- 51.
黄杰,古米,赖泽,粉丝B,Shi K,周Y-H等。拟南芥的功能分析朋友植物生长发育及其对环境胁迫的响应的基因家族。植物杂志。2010;153:1526-38。
- 52。
徐F,邓克,郑铮,张W,黄X,Li L等。苯丙氨酸氨 - 裂解酶基因的分子克隆,表征及表达juglans regia..分子。2012; 17:7810-23。
- 53。
潘Qh,王l,李杰。葡萄红浆料对紫外线辐照的芪合成酶的量和亚细胞定位。植物SCI。2009; 176:360-6。
- 54。
基谢列夫KV,杜布罗维纳AS,伊萨耶娃GA,朱拉夫列夫YN。水杨酸对苯丙氨酸解氨酶和二苯乙烯合酶基因表达的影响血管血管血管细胞培养。acta botanica yunnanica(云南植物研究). 2010;57:415-21。
- 55。
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,等。通过RNA-SEQ的转录程序组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28:511-5。
- 56。
de Jonge HJM,Fehrmann RSN,De Bont Esjm,Hofstra RMW,Gerbens F,Kamps Wa,等。基于证据的家务基因选择。Plos一个。2007; 2(9):E898。
- 57。
rujter JM, Ramakers C, Hoogaars WMH, Karlen Y, Bakker O, van den Hoff MJB等。扩增效率:定量PCR数据分析中的连接基线和偏倚。核酸学报2009;37(6):e45。
致谢
谢谢莎拉威廉姆斯,博士,刘文彪,艾丹·彼皮斯集团中国(www.liwenbianji.cn),编辑本手稿草稿的英文文本。
资金
这项工作得到了国家自然科学基金的支持(授予No.61672489; 61379081; 61972374)和中国科学院(Grant No.KJRH2016)。
作者信息
从属关系
贡献
WXW和HW构思和设计了本研究。WXW、ZJW、WQB、YHH、MC采集样本并进行RNA提取实验。WXW对所描述的转录组数据进行分析,并进行RT-qPCR实验。WXW、ZJW和WQB对RT-qPCR数据进行分析。WXW, TYC, HW撰写并修改了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
12个候选内参基因和3个目的基因的PCR扩增图谱。目标是行为(1),tu(2),浴缸(3),GAPDH(4),EF-1γ(5),ndufa13.(6),UBQ.(7),UBC.(8),60srrna.(9),SKD1(10),YLS8(11),EIF6A(12),PcMYB4(13),PcPAL(14),PCSTS.(15)。图S2。12个候选参考基因的熔化曲线和3个靶基因polygonum cuspidatum。图S3。12个候选参考基因的标准曲线和3个靶基因polygonum cuspidatum..
附加文件2:
所有样本的12个候选参考基因的原始CT值polygonum cuspidatum..
附加文件3:表S1
.基因表达稳定性排名△CT, BestKeeper, NormFinder, geNorm和RefFinder在个人条件下。表S2。3个靶基因的RPKM值polygonum cuspidatum.转录组。表S3。3个新基因覆盖7个转录组数据的RPKM值polygonum cuspidatum..
额外的文件4。
12个候选参考基因和3个靶基因的cDNA序列。编码序列(CDS)标记为绿色。
附加文件5。
12个候选参考基因和3个靶基因的基因组DNA序列。外显子呈绿色遮荫,QPCR引物标记为黄色。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
王,X.,吴,Z.,Bao,W。et al。实时荧光定量PCR分析内参基因的鉴定与评价polygonum cuspidatum.基于转录组数据。BMC植物BIOL.19,498(2019)。https://doi.org/10.1186/s12870-019-2108-0
已收到:
公认:
发表:
关键字
- polygonum cuspidatum.
- 参考基因
- RT-QPCR.
- 转录组
- 苯丙烷途径途径