- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发布:GydF4y2Ba
双苄基和黄酮类生物合成调节涉及肝脏BHLH转录因子的功能性表征GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba, 文章编号:GydF4y2Ba497.GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
基本的螺旋环 - 螺旋(BHLH)转录因子(TFS)是TFS最大的家族之一,在许多次生代谢物的调节中起重要作用,包括类黄酮类化合物。它们在黄酮植物中的参与在血管植物中是很好的,但在血疱疮中没有。在肝脏中,均比苄基和黄酮类化合物均通过苯丙醇丙烷途径来衍生,并占据几种上游酶。GydF4y2Ba
结果GydF4y2Ba
在本研究中,我们克隆了由苔类植物编码的bHLH家族蛋白PabHLH1,并对其功能进行了表征GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.PabHLH1与参与类黄酮生物合成的IIIf亚家族bHLHs具有亲缘关系。瞬时表达实验表明,PabHLH1沉积在细胞核和细胞质中,而酵母杂交实验表明它具有反转录活性。当PabHLH1在GydF4y2Bap . appendiculatumGydF4y2Ba在苄苄基和黄酮类化合物的含量和这些化合物的生物合成途径中的相应基因的转录丰度之间建立了阳性相关性。pabhlh1的异源表达GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba导致激活黄酮类化合物和花青素合成,涉及在黄酮类化合物合成途径早期和晚期作用的结构基因的上调。pabhlh1的转录水平GydF4y2Bap . appendiculatumGydF4y2Ba菌体对紫外线照射或水杨酸处理诱导的应激反应呈阳性。GydF4y2Ba
结论GydF4y2Ba
PabhlH1参与了肝曲线中黄酮类化合物的生物合成的调节,并刺激了黄酮和花青素在拟南芥中的积累。GydF4y2Ba
背景GydF4y2Ba
属于非血管苔藓植物的亚组的Liverworts产生各种次生代谢物,包括双苄基[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba),类黄酮(GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba]和萜类化合物[GydF4y2Ba5.GydF4y2Ba].许多简单的黄酮类,如黄酮GydF4y2BaCGydF4y2Ba——或者GydF4y2BaO.GydF4y2Ba- 葡萄原体,黄酮,三羟基苯吡喃酮和异黄酮(例如,5,3',4'-Trihydroxyisoflavone-7-GydF4y2BaO.GydF4y2Ba葡萄糖苷)在Liverworts中发现[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba].苄苄基和环状双(苯苄基)是通过肝曲线产生的主要酚类化合物[GydF4y2Ba6.GydF4y2Ba].突出的实例是苄苄血管酸,其脱羧产品呼吸素和各种偶联环状双(苯苄基)化合物[GydF4y2Ba6.GydF4y2Ba].这些物质含有两种偏苄基部分,其由乙醚桥和/或C-C键合浓缩[GydF4y2Ba6.GydF4y2Ba]表现出明显的抗真菌和抗肿瘤活动[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].如在多种更高的植物物种中重复显示的,通过苯丙烷丙烷和聚酮途径合成黄酮类化合物。双苄基也通过苯基丙醇和聚酮化合物途径衍生,从L-苯丙氨酸和通过肉桂酸开始,GydF4y2BaP.GydF4y2Ba-coumaric acid,二氢 -GydF4y2BaP.GydF4y2Ba-coumaric酸形成二氢 -GydF4y2BaP.GydF4y2Ba-coumaryl coa [GydF4y2Ba9.GydF4y2Ba].二氢的缩合GydF4y2BaP.GydF4y2Ba-Coumaryl CoA与三种丙酰基 - COA形成气血酸;当通过细胞色素P450单氧基酶催化时,两个肺酸分子浓缩,得到BIB苄基[GydF4y2Ba9.GydF4y2Ba].双苄苄基的生物合成和黄酮类化合物在Liverworts中分享了几个上游步骤[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba(图。GydF4y2Ba1GydF4y2Ba).GydF4y2Ba
在植物中,类黄酮生物合成的结构基因主要受转录水平的调控,受两类转录因子(MYB和bHLH)以及WD40蛋白的控制。bHLH转录因子对R2R3 MYB伴侣的活性至关重要,同时也增强了启动子的活性,该启动子包含一个顺式调节元件,该元件保存在几种类黄酮和花青素生物合成基因中[GydF4y2Ba12.GydF4y2Ba].BHLH系列已分为26个子组[GydF4y2Ba13.GydF4y2Ba,调控广泛的细胞过程,包括表皮细胞的命运、激素反应、金属内环境平衡、光形态发生和花器官的发育[GydF4y2Ba14.GydF4y2Ba].与黄酮类生物合成相关的bHLHs被归为一个亚群,编号为IIIf。第一批被发现的成员之一是玉米GydF4y2BaR.GydF4y2Ba基因,其编码的调控花青素在谷物中的积累[GydF4y2Ba15.GydF4y2Ba].编码BHLH因子的Delila(Del)基因调节红色花青素色素沉着的模式GydF4y2Ba金鱼草majusGydF4y2Ba植物(GydF4y2Ba16.GydF4y2Ba].这GydF4y2Ba拟南芥蒂利亚纳GydF4y2BabHLH蛋白AtTT8、AtGL3和AtEGL3均参与各种类黄酮的合成[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba].喇叭花的花青素1(AN1)是合成花青素颜料所需的BHLH转录因子[GydF4y2Ba20.GydF4y2Ba].在米饭中,产品GydF4y2Barc.GydF4y2Ba和GydF4y2Bard.GydF4y2BabHLH是控制籽粒果皮原花青素合成的转录因子,而烟草是基因吗GydF4y2Bantan1a.GydF4y2Ba和GydF4y2BaNTAN1B.GydF4y2Ba编码花青素在花中积累的增强子[GydF4y2Ba21.GydF4y2Ba].在GydF4y2Ba大丽花瓦里亚尔,GydF4y2Badvvs (bHLH转录因子An1亚群成员)参与调控射线小花花青素合成[GydF4y2Ba22.GydF4y2Ba].在辉煌的辉煌中,IPIVS调节种子和花青素中的花青蛋白积累在花中的生物合成[GydF4y2Ba23.GydF4y2Ba].两种葡萄化葡萄酒BHLH蛋白VVMYC1和VVMYCA1分别生产,分别是花青素和原霉素的生产[GydF4y2Ba24.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba].GydF4y2Ba
在血管植物中广泛研究了BHLH TFS的黄酮类化合物的调节,但尚是众所周知的关于它们参与肝曲线中的双苄基和黄酮类化合物合成。Liverworts代表了苔藓植物种类的分裂,是最早的土地植物的分歧谱系,所述土地植物的日益早期的祖国师GydF4y2Ba期GydF4y2Ba(约488万到444万年)。涉及来自Liverworts的黄酮类生物合成调节的BHLH基因的表征将阐明BHLH转录因子的起源和演化的阐明。在我们之前的研究中,Pabhlh已被隔离和功能,其特征是来自Liverworts的二拜苄基生物合成的阳性调节剂GydF4y2Bap . appendiculatumGydF4y2Ba[GydF4y2Ba26.GydF4y2Ba].在这里,我们表征了另一种BHLH(PabhlH1)基因GydF4y2Bap . appendiculatumGydF4y2Ba通过过度表达GydF4y2Bap . appendiculatumGydF4y2Ba异源表达GydF4y2Ba答:芥GydF4y2Ba.PabhlH1积极地调节双苄基和黄酮类化合物生物合成GydF4y2Bap . appendiculatumGydF4y2Ba并刺激黄酮酚和花青素在拟南芥中的积累。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
p . appendiculatumGydF4y2BaThallus(一点点样本最初是从四川省,然后在我们的绿色房子中培养和繁殖,并由Xueen Wen教授进行身份验证。凭借No.20091010-01的凭证已被存入制药科学学校,山东大学。收集该样本的研究目的无需具体许可。)在绿色房屋中升高,占山东大学的恒定温度和12小时光周期。收获了两月的杀伤,并在液氮中冷冻冷冻并储存在-80℃。Axenic Thallus和愈伤组织分别在半力量Murashige和Skoog(1962)(MS)中[GydF4y2Ba27.GydF4y2Ba]添加0.5 mg LGydF4y2Ba- 1GydF4y2Ba6-benzyladenine。培养物暴露于12 h的光周期和22°C/20°C的昼夜温度条件下。GydF4y2Ba答:芥GydF4y2Ba在恒定温度为22℃的恒定温度下,在16小时光周期下在生长室中升高在生长室中的生态型COL-0(从拟南芥生物资源资源中心)。这GydF4y2Ba尼古利亚娜·宾夕法尼亚州GydF4y2Ba(从生命科学教授捐赠了山东大学)施工大学所需的植物在12h光周期和24°C / 22°C的一天/夜温度制度下瞬态表达实验所需的植物5-6周.GydF4y2Ba
核酸提取及基因分离GydF4y2Ba
提取总RNAGydF4y2Bap . appendiculatumGydF4y2Ba笨拙或GydF4y2Ba答:芥GydF4y2Ba分别使用基于ctab的方法[GydF4y2Ba28.GydF4y2Ba]和Rnaiso加试剂(Takara,Kusatsu,Shiga,日本)。根据制造商的协议,使用Primescript™RT主混合物(Takara,Otsu,Japan)的总RNA的制备合成cDNA。一种GydF4y2Bapabhlh1.GydF4y2Ba缺失完整编码区域的片段从GydF4y2Bap . appendiculatumGydF4y2Ba转录组测序数据库(SRP073827)。然后应用3 ' -RACE方法恢复缺失的3 '序列:该反应的模板为3 ' -Ready cDNA,引物对为PabHLH1-NGP(序列见附加文件)GydF4y2Ba1GydF4y2Ba表S1),以及SMART RACE cDNA Amplification kit (Clontech, USA)提供的UPM引物。一旦完成开放阅读框(ORF)的序列GydF4y2Bapabhlh1.GydF4y2Ba是后天获得的,是后天放大的GydF4y2Bap . appendiculatumGydF4y2Ba胎儿cDNA使用引物对PabhlH1-F / R(在附加文件中给出的序列GydF4y2Ba1GydF4y2Ba:表S1);然后将扩增子插入PMD19-T中并进行测序以用于验证目的。GydF4y2Ba
序列分析GydF4y2Ba
预测的pabhlH1多肽序列与其植物同源物的那些对准GydF4y2Ba答:芥GydF4y2BaTT8 (CAC14865),GydF4y2BaIpomoea purpureaGydF4y2Baipiv (BAD18982)和GydF4y2Ba葡萄GydF4y2BaMYC1(EU447172)使用DNAMAN V5.2.2软件(Lynnon Biosoft,Canada)。基于Mega V4.0软件中实现的最大似然方法进行系统发育分析[GydF4y2Ba29.GydF4y2Ba,基于1000个引导复制。GydF4y2Ba
压力治疗GydF4y2Bap . appendiculatumGydF4y2Ba菌体GydF4y2Ba
一百个月大GydF4y2Bap . appendiculatumGydF4y2Ba用UV-B 311 NM窄带灯(Philips,PL-S 9 W / 01 / 2P,波兰)照射Thallus(60 mJ / cmGydF4y2Ba2GydF4y2Ba)或1mM水杨酸(Sa)10分钟,然后在0,6,12,24,36,48和60h后收获。将该材料在液氮中冷冻冷冻并在-80℃下储存直至如上所述的QRT-PCR测定处理。GydF4y2Ba
定量实时PCR(QRT-PCR)分析GydF4y2Ba
QRT-PCR方法用于表征转录行为GydF4y2Bapabhlh1.GydF4y2Ba在三种不同的组织中。表达GydF4y2Bapabhlh1.GydF4y2Ba随着许多苯基丙醇途径基因,使用QRT-PCR在野生型和转基因中分析了类黄酮结构基因和苄苄基合成基因GydF4y2Bap . appendiculatumGydF4y2Ba和GydF4y2Ba答:芥GydF4y2Ba.所需的cDNA模板从上述RNA提取物中提取,使用Eppendorf Mastercycler ep realplex RealTime PCR System (Eppendorf, Germany)进行qrt -PCR。相关的引物在附加文件中列出GydF4y2Ba2GydF4y2BaS2:表。每个10 μL反应由2 μL SYBR、1 μL模板cDNA、0.5 μL引物对(10 μM)和6.5 μL RNase-free dH组成GydF4y2Ba2GydF4y2Ba参考基因GydF4y2Bap . appendiculatumGydF4y2Ba样品编码伸长系数,其由引物对放大GydF4y2Bap . appendiculatumGydF4y2Ba伸长率f / r [GydF4y2Ba30.GydF4y2Ba].在三个独立实验中评估所有样品。GydF4y2Ba
亚细胞定位和转录活性测定GydF4y2Ba
使用包括attb重组位点的引物(额外文件中给出的序列提供的引物(在附加档案中给出的序列)的全长ORF(缺少止轭密码子)进行PCR扩增。GydF4y2Ba1GydF4y2Ba:表S1),并进行扩增子进行BP克隆酶反应,以将其插入载体PDONR207(Invitrogen,Carlsbad,CA,USA)中。重组质粒在网关LR克隆酶反应(Invitrogen,Carlsbad,Ca,USA)中加工,用PGWB5载体,以通过CAMV 35S启动子驱动的PabhlH1-GFP融合[GydF4y2Ba31GydF4y2Ba].这个结构被转移到GydF4y2Ba根癌土壤杆菌GydF4y2Ba用冻融法将EHA105菌株分离,并将其转化为GydF4y2BaN. Benthamiana.GydF4y2Ba表皮叶细胞或洋葱表皮细胞[GydF4y2Ba26.GydF4y2Ba为它短暂的表情。洋葱表皮细胞用0.1 mg ml培养GydF4y2Ba- 1GydF4y2BaDAPI 10分钟,细胞核染色。GFP和DAPI荧光通过共聚焦激光扫描显微镜(LSM 700, Carl Zeiss, Inc, New York, USA)或荧光显微镜(Olympus IX71;奥林巴斯公司,东京,日本)。四个不同的部分GydF4y2Bapabhlh1.GydF4y2Ba是由的GydF4y2BaNDE.GydF4y2Ba我- - - - - -GydF4y2BaBamGydF4y2BaH我或GydF4y2BaNCOGydF4y2Ba我- - - - - -GydF4y2BaBamGydF4y2BaH I酶切得到与残基1-261、262-460、461-702和1-460序列对应的基因片段;这些分别连接到pGBKT7质粒(Clontech,美国)。由于PabHLH1的全长序列缺乏可用的限制性内切酶位点,因此使用Stratagene QuickChange位点定向诱变方法创建了一个单核苷酸替换(a957c)。引物X软件设计的必要突变引物(GydF4y2Bawww.bioinformatics.org/primerxGydF4y2Ba)(表S1)。PCR产物经凝胶纯化,用Dpn I (Thermo Scientific, USA)在37°C下酶切4 h,并转化成GydF4y2Ba大肠杆菌GydF4y2BaDH5α。测序后,突变基因(PabHLH1-a957c)经Nde I和Nco I酶切后插入pGBKT7 (Clontech, USA)载体(本研究使用的引物如表S1所示)。然后用PEG/LiAC法将每个构建物转化为酵母株AH109 [GydF4y2Ba32GydF4y2Ba].在缺乏色氨酸(SD-TRP)的合成液体中培养酵母转化体。在其基于PCR的验证之后,测试转化的菌落,用于对缺乏色氨酸,组氨酸和腺嘌呤(SD-TRP-HIS-ADE)的三重选择SD培养基生长的能力。GydF4y2Ba
植物转型GydF4y2Ba
这GydF4y2Bapabhlh1.GydF4y2Ba通过Gateway克隆技术将pDONR207内的编码序列置于CaMV 35S启动子控制下的pGWB5载体中[GydF4y2Ba32GydF4y2Ba然后被引入到GydF4y2BaA. Tumefaciens.GydF4y2BaEHA105。1毫升一晚上的量GydF4y2BaA. Tumefaciens.GydF4y2Ba将培养菌接种到含有50 mg/L卡那霉素的100 mL酵母膏蛋白胨培养基中,30℃摇瓶至ODGydF4y2Ba600GydF4y2Ba已达到1.5 - -2.0。采用离心(4000GydF4y2BaGGydF4y2Ba然后再悬浮在含有100 μM乙酰丁香酮(Sigma-Aldrich, St. Louis, MO, USA)的50 mL液体半强度MS培养基(pH 5.2)中。大约50GydF4y2Bap . appendiculatumGydF4y2Ba叶状体被切成小块并并入GydF4y2BaA. Tumefaciens.GydF4y2Ba暂停。将混合物用摇动保持1小时,然后在22℃下在含有100μM乙酰苯乙烯酮的固体半强度MS培养基(pH 5.6-5.8)上培养72小时。将晶片在无菌去离子水中漂洗三次,然后转移到含有25mg / L潮霉素和200mg / L头孢噻肟的半强度MS培养基。2-3周后,存活的晶粒在含有50mg / L潮霉素和50mg / L头孢噻肟的半强度MS培养基上培养,培养基以两周间隔刷新。GydF4y2Ba答:芥GydF4y2Ba生态型col0转化为GydF4y2BaA. Tumefaciens.GydF4y2Ba使用花浸法携带转基因的GV3101 [GydF4y2Ba33GydF4y2Ba].在22℃下在16小时的光周期下升高再生植物,并推定GydF4y2Ba1GydF4y2Ba利用引物对PabHLH1-vector-F/−R(序列见附加文件)对转化子进行pcr验证GydF4y2Ba1GydF4y2Ba:表S1)。GydF4y2Ba
组成分析GydF4y2Bap . appendiculatumGydF4y2Ba菌体GydF4y2Ba
转基因和非转基因GydF4y2Bap . appendiculatumGydF4y2Ba在半强度MS培养基上培养约20 d后,进行冻干处理。取25 mg溶液悬浮于500 μL甲醇中,超声1 h提取联苯甲醇(以黄芩苷为内标)。离心后,上清液用反相Luna 5u C18(2) 100A色谱柱(4.6 × 250 mm, Phenomenex, CA, USA)分离,采用Agilent 1260系列系统(Agilent, CA, USA)。HPLC参数为:溶剂A: 0.1% (v/v)甲酸水溶液,溶剂B:乙腈;流速为0.8 mL/min。初始溶剂为60% A/40% B, 33% A/67% B为45 min, 10% A/90% B为5 min, 100% B为5 min,检测波长为280 nm。通过相应的标准样品鉴定出主要的联苯类化合物月骨酸、利卡丁C和利卡丁D,并根据相应化合物的标准曲线进行定量。将冻干后的菌体10 mg悬浮于800 μl 80%甲醇中,超声处理1 h(内标加入杨梅素)。通过制备酸水解提取物,测定黄酮作为苷元的含量。取400 μL上清加入120 μL 3NHCl酸水解,90℃孵育1 h,再与200 μL甲醇混合。 An Agilent 1260 series HPLC system equipped with a Luna 5u C18(2) 100A column (4.6 × 250 mm, Phenomenex, CA, USA) was used for chromatographic analysis. The HPLC conditions were as follows: the mobile phase consisted of solvent A (acetonitrile) and solvent B (1% acetic acid in water, v/v). The gradient elution program was: 0–10 min, 30% solvent A; 10–30 min, 30–45% solvent A; 30–35 min, 45–100% solvent A; 35–45 min, 100–30% solvent A. The detection wavelength was set at 330 nm. The flavonoid was quantified as the relative content in wild type and transgenicp . appendiculatumGydF4y2Ba根据峰面积扭伤。在三个独立实验中评估所有样品。GydF4y2Ba
转基因植物中黄酮类和木质素的测定GydF4y2Ba答:芥GydF4y2Ba
十天旧的转基因和野生型(wt)GydF4y2Ba答:芥GydF4y2Ba幼苗被冻干并磨成细粉。以800 μL甲醇:水(80:20,v/v)为溶剂,超声(1 h)提取15 mg,测定黄酮类化合物的含量[GydF4y2Ba34GydF4y2Ba].离心后(16000GydF4y2BaGGydF4y2Ba采用Luna 5u C18(2) 100A色谱柱(4.6 × 250 mm, Phenomenex, CA, USA)进行反相高效液相色谱。流动相为5-85%乙腈和95-15%水(0.1% v/v甲酸),流速为0.8 mL/min,流速超过40 min。检测波长为364 nm。经质谱和紫外光谱分析鉴定为特定山奈酚衍生物[GydF4y2Ba34GydF4y2Ba].蛹被用作峰值的内标,并计算各种黄酮的相对贡献。在培养5天培养后,在培养的半强度MS(pH 5.8)组成的蔗糖(3%,w / v)和琼脂(0.8%,w / v)组成后,在培养5天培养后,在视觉上筛选幼苗。对于转基因和野生型线的总花青素分析,将100mg的新鲜植物材料悬浮在400μl甲醇中,其中1%HCl(v / v)并超声处理1小时。离心(15,000g,10分钟)后,将上清液转移到新鲜管中,通过使用分光光度计(Shimadzu,Kyoto,Japan)测量A530和A657的OD来测定总花青素。通过计算吸光度a =(a530-0.25×a657)测定花青素的量。使用下式计算原始样品中的花青素颜料的浓度:花青素颜料(Mg / L)=(mw×df×1000)/(ε×1),其中Mw是Cyandindin-3的分子量-Glucoside(449.2),DF是稀释因子,ε是青霉素-3-葡糖苷(26,900)的摩尔吸收率[GydF4y2Ba35GydF4y2Ba].木质素在5 - 7叶期植物中的分布模式是通过按照上述步骤对茎段进行染色获得的[GydF4y2Ba36GydF4y2Ba].通过分光光度法(280nm)分析乙酰溴提取物的分光光度法(280nm)分析量化茎组织的木质素含量。将样品研磨成液氮中的粉末,然后依次萃取,用70%乙醇,氯仿/甲醇(1:1 V / V)和用于细胞壁制备的丙酮。根据乙酰溴方法[GydF4y2Ba37GydF4y2Ba[70℃,将6mg干燥样品在70℃下用1ml 25%乙酰溴消化30分钟,并在冰浴中冷却10分钟后顺序加入5ml乙酸。然后将300μl上清液通过400μL1.5M NaOH和300μl0.5μl羟胺盐酸盐混合,然后将1.5ml乙酸稀释。灭绝系数GydF4y2Ba答:芥GydF4y2Ba木质素为23.35 gGydF4y2Ba- 1GydF4y2Ba L cm- 1GydF4y2Ba在280 nm。在三个独立实验中评估所有样品。GydF4y2Ba
结果GydF4y2Ba
这GydF4y2Bapabhlh1.GydF4y2Ba顺序GydF4y2Ba
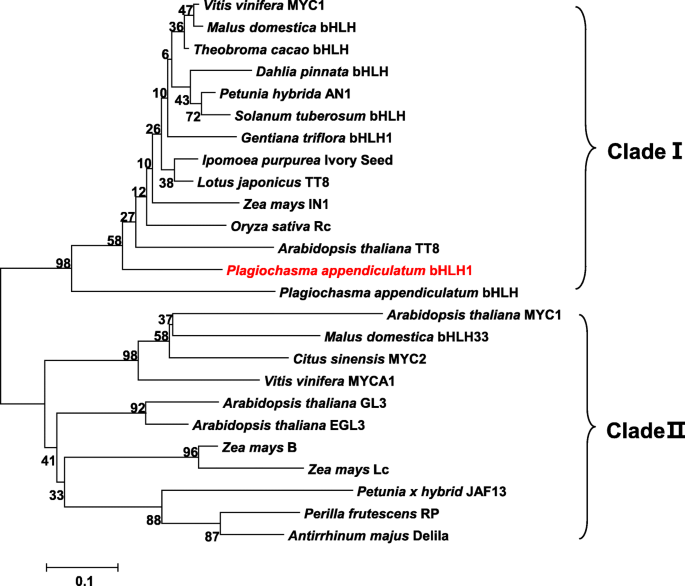
全长orfGydF4y2Bapabhlh1.GydF4y2Ba通过3'-rame从部分转录物中回收。其长度为2109 BP,其预测产物是分子量76.86kDa和Pi 6.03的702残基蛋白。预测的多肽的序列分别与其最近同源物ATTT8,IPIVs和VVMYC1共享27.9,28.7和30.9%的序列(图。GydF4y2Ba2GydF4y2Ba);已知后三种蛋白质调节花青素合成。尽管序列同一性的总体水平相对较低,但pabhlH1序列保留了BHLH结构域DNA结合她的基序(包括他/ Lys9,Glu13和Arg17)[GydF4y2Ba38GydF4y2Ba那GydF4y2Ba39GydF4y2Ba].在N末端区域中,在MYB相互作用区域(MIR)内注意到高水平的同源性。此外,蛋白质保留了K165,A167残基显示为转录激活至关重要[GydF4y2Ba40GydF4y2Ba].一项涉及植物bHLHs IIIf亚群的系统发育分析将蛋白质分为两个分支(图。GydF4y2Ba3.GydF4y2Ba):分支I包括AtTT8、玉米IN1、葡萄MYC1和水稻Rc,均参与调控黄酮类化合物的生物合成;分支II包括矮牵花JAF13、拟南芥GL3、金鱼草Delila (Del)和玉米Lc等转录因子。PabHLH1序列与之前报道的PabHLH序列一样,聚集在分支I内,位于分支的外围位置,这表明在陆基植物苔类中,PabHLH和PabHLH1转录因子可能代表了维管植物同源物的一个祖先外群。GydF4y2Ba
PabHLH1和其他植物bHLH转录因子结构域的系统发育树。该树由MEGA v4.0程序使用邻居连接方法构造。使用的TFs序列为GydF4y2Ba葡萄GydF4y2Bamyc1(eu447172),GydF4y2BaMalus Domestica.GydF4y2BaBHLH(ADL36597),GydF4y2BaTheobroma Cacao.GydF4y2BabHLH (XP_007050639.1),GydF4y2Ba大丽花pinnataGydF4y2BaBHLH(BAM84239),GydF4y2Ba矮牵牛织布达GydF4y2BaAN1(AAG25927),GydF4y2BaSolanum Tuberosum.GydF4y2BaBHLH(AGC31677.1),GydF4y2BaGentiana Triflora.GydF4y2BaBHLH1(BAH03387),GydF4y2BaIpomoea purpureaGydF4y2Ba象牙种子(BAD18982),GydF4y2Ba莲花japonicus.GydF4y2BaTT8(BAH28881),GydF4y2BaZea Mays.GydF4y2BaIn1(AAB03841),GydF4y2Ba栽培稻GydF4y2BaRc (BAF42668),GydF4y2Ba拟南芥蒂利亚纳GydF4y2BaTT8 (CAC14865),GydF4y2BaPlagiochasma appendiculatumGydF4y2BabHLH (MF983804);GydF4y2BaPlagiochasma appendiculatumGydF4y2BabHLH1 (AXO67713);GydF4y2Ba拟南芥蒂利亚纳GydF4y2BaMYC1 (NP_001329692.1),GydF4y2BaMalus Domestica.GydF4y2BabHLH33 (ABB84474),GydF4y2BaCitus sinensisGydF4y2Bamyc2(abr68793),GydF4y2Ba葡萄GydF4y2BaMYCA1 (EF193002);GydF4y2Ba拟南芥蒂利亚纳GydF4y2BaGL3(NP_680372),GydF4y2Ba拟南芥蒂利亚纳GydF4y2BaEGL3(NP_176552.1),GydF4y2BaZea Mays.GydF4y2BaB (CAA40544),GydF4y2BaZea Mays.GydF4y2BaLc (NP_001105339),GydF4y2Ba喇叭花杂交GydF4y2BaJAF13(AAC39455),GydF4y2Ba白苏子GydF4y2BaRP (BAA75513),GydF4y2Ba金鱼草majusGydF4y2BaDelila (AAA32663)GydF4y2Ba
pabhlh1在不同组织中的表达及其对应力的反应GydF4y2Ba
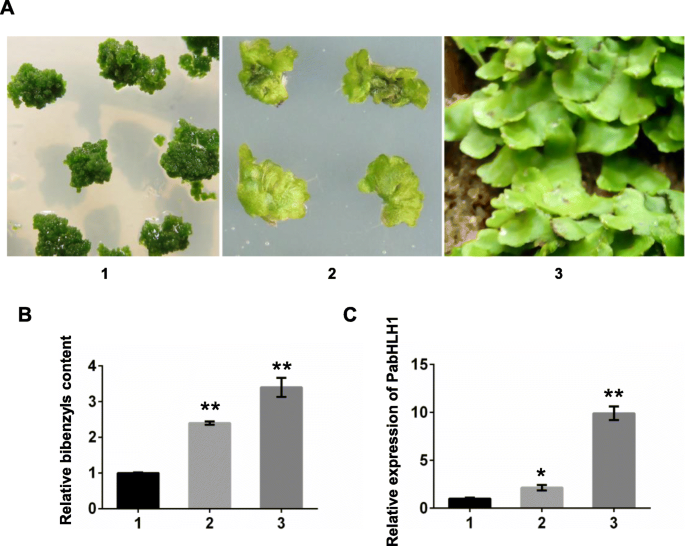
探讨PabHLH1表达谱与靶代谢物积累、双联苯含量及表达模式的关系GydF4y2Bapabhlh1.GydF4y2Ba在温室中的三种不同的组织,腋k,炎症和野生菌株生长(图。GydF4y2Ba4.GydF4y2Baa),量化。温室生长的妊娠的双苄基含量最高,轴静脉的含量高于愈伤组织(图。GydF4y2Ba4.GydF4y2Bab)。同时,表达模式GydF4y2Bapabhlh1.GydF4y2Ba证明在三种不同的Liverwort组织中显示出与双苄基含量一致表达趋势(图。GydF4y2Ba4.GydF4y2BaC)。GydF4y2Ba
双双苄基相对含量和PabHLH1的表达水平GydF4y2Bap . appendiculatumGydF4y2Ba.GydF4y2Ba一种GydF4y2Ba三种不同的组织GydF4y2Bap . appendiculatumGydF4y2Ba,1,2:在MS培养基上培养的轴烯愈伤组织和菌株;3:敏锐的温室生长。GydF4y2BaB.GydF4y2Ba相对双苄酰基含量在三种组织中(GydF4y2Ba一种GydF4y2Ba).GydF4y2BaCGydF4y2Ba通过qRT-PCR,在(GydF4y2Ba一种GydF4y2Ba).数据为平均值±标准差三次生物重复。*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01 according to Student’s t-test
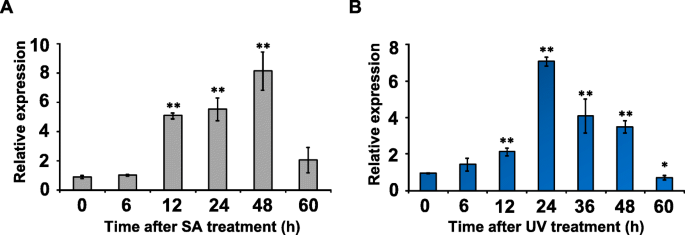
暴露的效果GydF4y2Bap . appendiculatumGydF4y2Ba紫外光照射或水杨酸处理均可上调其表达GydF4y2Bapabhlh1.GydF4y2Ba.在前48小时内,SA处理增加了转录物丰度到背景水平的大约八个倍数,但是转录物的丰度在随后的12小时方面急剧下降(图。GydF4y2Ba5.GydF4y2Ba一种)。对紫外线照射的反应较少,在前24小时内增加,然后逐渐下降(图。GydF4y2Ba5.GydF4y2Bab)。GydF4y2Ba
PabHLH1的亚细胞定位和反式激活能力GydF4y2Ba
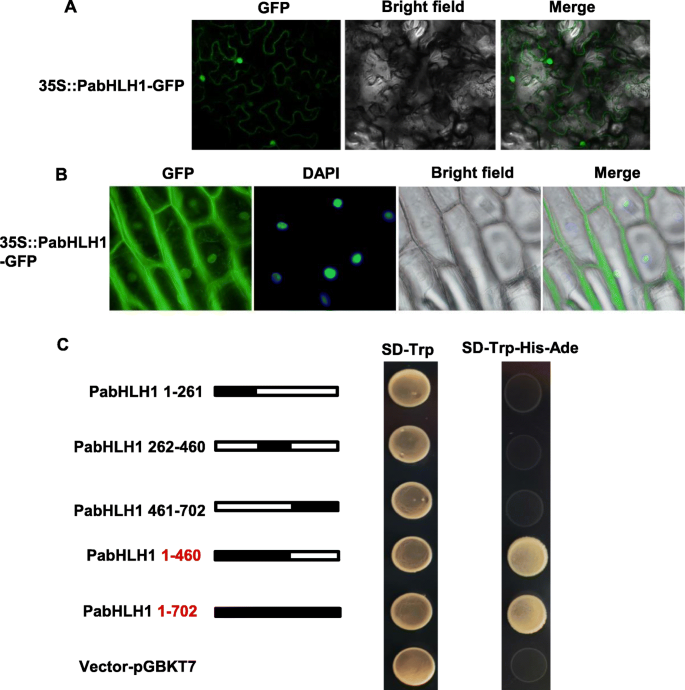
为了分析PabHLH1蛋白的亚细胞定位,将全长编码序列与GFP基因融合并在细胞内瞬时表达GydF4y2BaN. Benthamiana.GydF4y2Ba叶或洋葱表皮细胞。结果表明,PabhlH1蛋白沉积在细胞核和细胞质中(图。GydF4y2Ba6.GydF4y2Baa,b)。使用酵母一种杂合测定来验证pabhlH1的转移活性。通过将序列分成五个区段(残基1-261和1-460形成的N个末端区段,以及C末端段262-460,461-702和1-702来研究各种区域的作用见图。GydF4y2Ba6.GydF4y2Bac).当PabHLH1片段的存在允许酵母细胞生长时,可以推断反式激活活性。在SD-Trp培养基上,4个片段和空载体存在时细胞都可以生长,但在SD-Trp- his - ade培养基上,携带1-460片段和全长蛋白1-702的细胞存活。结论是,PabHLH1的反式活性依赖于位于片段1-460的序列。GydF4y2Ba
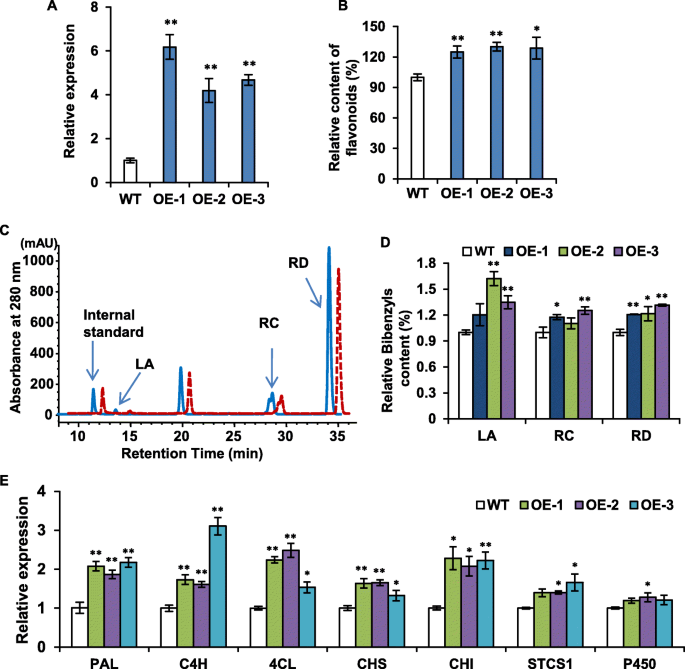
过表达PabHLH1后,黄酮类化合物含量增加GydF4y2Bap . appendiculatumGydF4y2Ba菌体GydF4y2Ba
为了解剖PabHLH1在体内的功能,我们将PabHLH1基因编码区亚克隆到二元载体pGWB5中并转化GydF4y2Bap . appendiculatumGydF4y2Ba叶状体通过GydF4y2Ba农杆菌GydF4y2Ba介导的方法[GydF4y2Ba26.GydF4y2Ba].qRT-PCR分析证实了较高的丰度GydF4y2Bapabhlh1.GydF4y2Ba转基因中的转录物比在WT骨盆中(图。GydF4y2Ba7.GydF4y2Ba一种)。通过制备酸水解提取物,测定黄酮作为苷元的含量。HPLC分析中的主要峰显示与斜纹素素相同的保留时间和典型的UV光谱(附加文件GydF4y2Ba3.GydF4y2Ba:图S1)。因此,黄酮类化合物的含量可分为野生型和转基因型的相对含量GydF4y2Bap . appendiculatumGydF4y2Ba晶粒和结果表明,转基因累积比野生型胎粪更多的黄酮(图。GydF4y2Ba7.GydF4y2Bab).菌体提取物的高效液相色谱分离结果显示,菌体中含有联苯月桂酸、利卡丁C和利卡丁D(图。GydF4y2Ba7.GydF4y2Bac,d),基于相应的标准样本识别(附加文件GydF4y2Ba4.GydF4y2Ba:图S2),在转基因菌体中比在WT中积累更强。Real-time PCR结果显示,PAL、C4H和4CL编码基因在转基因菌体中均显著上调(图2)。GydF4y2Ba7.GydF4y2Bae),与编码黄酮类化合物合成酶的那些,Chalcone异构酶(Chi)和Chalcone合酶(CHS)。编码斯蒂芬羧酸合酶(STCS1)的基因和参与宾苄基合成的细胞色素P450,略微上调。GydF4y2Ba
转基因PabHLH1的转录和生化分析GydF4y2Bap . appendiculatum叶状体GydF4y2Ba.GydF4y2Ba一种GydF4y2Bapabhlh1的转录GydF4y2Bap . appendiculatumGydF4y2Ba野生型(WT)和转基因过表达PabhlH1基因菌丝(OE)。GydF4y2BaB.GydF4y2BaWT和OE菌体中黄酮类化合物的含量。GydF4y2BaCGydF4y2Ba从OE晶片(实线)和WT晶片(红色虚线)提取的甲醇型苄苄基的代表性HPLC谱。确定的主要苄基苄基是:La =肺酸,Rc = Riccardin C,Rd = Riccardin D.内标是Baicalein。GydF4y2BaD.GydF4y2Ba根据WT和OE的HPLC分析量化的苄苄基含量GydF4y2Bap . appendiculatumGydF4y2Ba使用La,RC和Rd的相应Sdandard曲线的Thallus。GydF4y2BaE.GydF4y2BaWT和OE菌体中参与联苯基和类黄酮合成的基因编码酶的转录丰度。数据为平均值±标准差三次生物重复。*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01 according to Student’s t-test
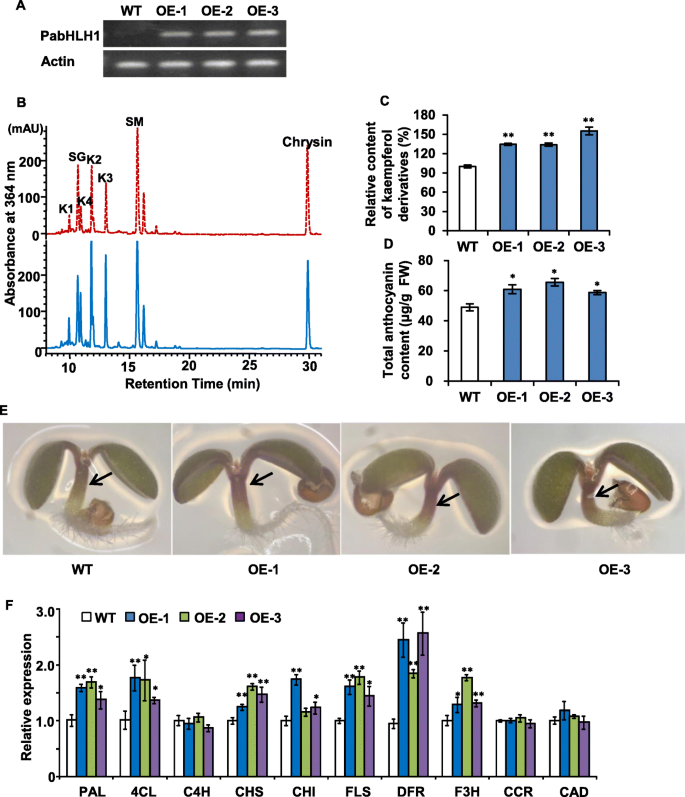
黄酮和木质素在转基因植物中的积累GydF4y2Ba答:芥GydF4y2Ba
为探明PabHLH1对拟南芥类黄酮生物合成的调控作用,将pGWB5质粒中含有总PabHLH1 ORF的构建物转化为拟南芥GydF4y2Ba答:芥GydF4y2Ba.GydF4y2Bapabhlh1.GydF4y2Ba在TGydF4y2Ba3.GydF4y2Ba植物(图。GydF4y2Ba8.GydF4y2Baa).对3个转基因纯合植株在半强度MS培养基上生长约10天的分析表明,转基因植株中黄酮醇衍生物的总体积累量高于野生型植株(图2)。GydF4y2Ba8.GydF4y2Bab, c)。在花青素诱导培养基上,转基因拟南芥比野生型积累了更多的花青素(图2)。GydF4y2Ba8.GydF4y2Bad)。在野生型幼苗的子叶和野生植物的结垢中积聚的花青素颜料小于转基因系中的野生型幼苗(图。GydF4y2Ba8.GydF4y2Ba这与这些植物幼苗中总花青素含量的定量结果一致(图2)。GydF4y2Ba8.GydF4y2Bad)。然而,Lignin含量的Wiesner的染色和乙酰溴分析显示PabhlH1-OE和WT线之间没有显着差异(附加文件GydF4y2Ba5.GydF4y2Ba:图S3)。通过qRT-PCR对编码类黄酮合成结构酶的基因的转录反应进行表征,发现PAL、CHS、CHI、F3H、DFR、FLS等编码基因的表达均上调(尤其明显)GydF4y2BaDFR.GydF4y2Ba)(图。GydF4y2Ba8.GydF4y2Baf).编码肉桂酰辅酶a还原酶(CCR)和肉桂酰醇脱氢酶(CAD)的基因转录丰度(这两种酶都参与木质素合成)不受转基因的影响(图)。GydF4y2Ba8.GydF4y2BaF)。GydF4y2Ba
pabhlh1的异源表达GydF4y2Ba答:芥GydF4y2Ba
(GydF4y2Ba一种GydF4y2Ba) RT-PCR分析PabHLH1在WT和PabHLH1- oe转基因拟南芥幼苗中的表达水平。WT,野生型GydF4y2Ba答:芥GydF4y2Ba;OE:转基因GydF4y2Ba答:芥GydF4y2Ba行PabHLH1。GydF4y2BaB.GydF4y2Ba转基因甲醇提取物的代表性HPLC谱GydF4y2Ba拟南芥GydF4y2Ba幼苗线(蓝实线)和WT幼苗线(红虚线)。主要的类黄酮或芥酸衍生物有:K1、山奈酚3-GydF4y2BaO.GydF4y2Ba- [6“ -GydF4y2BaO.GydF4y2Ba——(rhamnosyl) 7 -葡萄糖苷GydF4y2BaO.GydF4y2Ba-rhamnoside;K2,山柰酚3 -GydF4y2BaO.GydF4y2Ba-Glucoside 7-GydF4y2BaO.GydF4y2Ba-rhamnoside;K3,Kaempferol 3-GydF4y2BaO.GydF4y2Ba-rhamnoside 7 -GydF4y2BaO.GydF4y2Ba-rhamnoside;K4,Kaempferol 3-GydF4y2BaO.GydF4y2Ba-rhamnoside 7 -GydF4y2BaO.GydF4y2Ba葡萄糖苷;SM, sinapoyl酸盐;SG, sinapoyl葡萄糖。内标白菊素被标记。GydF4y2BaCGydF4y2Ba甲醇提取物中Kaempferol衍生物的含量GydF4y2Ba拟南芥GydF4y2Ba幼苗的高效液相色谱分析。GydF4y2BaD.GydF4y2Ba研究了黄芪甲醇提取物中花青素的含量GydF4y2Ba拟南芥GydF4y2Ba幼苗。GydF4y2BaE.GydF4y2Ba野生型和转基因系OE1,OE2和OE3萌发后5天的幼苗GydF4y2Ba那GydF4y2Ba箭头所示为转基因株系下胚轴中花青素积累较多。GydF4y2BaFGydF4y2Ba对品系OE1、OE2、OE3关键酶基因进行qRT-PCR分析。数据为平均值±标准差三次生物重复。*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01 according to Student’s t-test.
讨论GydF4y2Ba
bhlh是最大的植物转录因子家族之一,调控广泛的植物发育和生理过程[GydF4y2Ba12.GydF4y2Ba],包括黄酮类化合物的生物合成。目前,只有一种BHLH序列,丙比苄基生物合成的阳性调节剂,已从Liverworts中分离出[GydF4y2Ba26.GydF4y2Ba].在本研究中,通过搜索bHLH转录因子,获得了新的bHLH转录因子PabHLH1GydF4y2Bap . appendiculatumGydF4y2Ba转录组数据库。它与已知调节类黄酮合成的bHLH的系统发育关系表明该基因属于bHLH IIIf亚群[GydF4y2Ba41GydF4y2Ba].其序列的分析显示它已保留了BHLH区域(参与同质和异二聚体)和基本DNA结合区域[GydF4y2Ba41GydF4y2Ba].此外,它保留了他/ Lys9,Glu13和Arg17(她的主题)残留物,其赋予G-Box的结合[GydF4y2Ba38GydF4y2Ba那GydF4y2Ba39GydF4y2Ba].除了BHLH域外,PabhlH1还具有表示与MYB型TFS交互的终端域的HARBORS N和C终端域[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba42GydF4y2Ba].PabHLH1在细胞核和细胞质中均有反转录活性。碱性螺旋-环-螺旋转录因子有望定位于细胞核。然而,一些参与类黄酮生物合成调控的bHLH蛋白也与细胞质相关[GydF4y2Ba24.GydF4y2Ba].GydF4y2Ba
联苯类化合物是由苔类植物产生的一类独特的化合物,具有广泛的生物和药理活性。像黄酮类化合物和木质素一样,它们是苯丙素途径的产物,放射性标记前体的命运表明了这一点[GydF4y2Ba9.GydF4y2Ba].Liverworts中苄基和黄酮类化合物的合成可涉及常见的结构基因和转录调节剂。这里,Pabhlh1的过表达GydF4y2Bap . appendiculatumGydF4y2BaThallus具有促进培苄基的积累和编码PAL,C4H,4CL和STCS1的上调节基因的积累(图。GydF4y2Ba7.GydF4y2Ba).苄苄基的含量和PAL的丰度,C4h和4CR转录物与PabhlH1的转录物丰度相关。这些结果表明在GydF4y2Bap . appendiculatumGydF4y2Ba,PabhlH1通过其上调苯丙烷途径早期作用的结构基因的上调来影响苄苄基合成。PabhlH1过表达诱导的类黄酮含量的增加伴随着编码类黄酮合成酶Chi和Chs的基因的显着上调。GydF4y2Ba
PabHLH1的结构性表达GydF4y2Ba答:芥GydF4y2Ba提高了黄酮和花青素的积累,但对木质素含量没有影响。在基因水平上,转基因植株PAL、4CL、CHS、CHI、F3H、DFR和FLS基因表达上调,未影响木质素合成相关基因CCR和CAD的转录。DFR是花青素合成的第一个关键酶,其上调幅度为> 2倍。两者的乘积GydF4y2Ba矮牵牛织布达GydF4y2BaAN1和AtTT8控制类黄酮合成途径结构基因CHS、CHI、F3H、FLS1和DFR的表达[GydF4y2Ba17.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba],虽然早晨的辉煌TF IPIVs除外GydF4y2BaF3h.GydF4y2Ba[GydF4y2Ba23.GydF4y2Ba].DVIVS是激活花青素生物合成基因,包括DVCHS1,DVF3H,DVDFR和DVANS的转录因子GydF4y2Ba大丽花摘要GydF4y2Ba[GydF4y2Ba22.GydF4y2Ba]GydF4y2Ba.GydF4y2BaPabhlH1似乎能够影响PAL,4CL,CHS,CHI,F3H,DFR和FLS的表达。这些结果表明,IIIF亚组中的BHLHS转录因子通过同时控制几种结构基因的表达来调节黄酮类化合物和花青素生物合成。GydF4y2Ba
许多次生代谢物,包括苄苄基和黄酮类化合物,用作非生物应激保护剂,其合成通常由环境应力引发。在某些情况下,应力信号通过植物激素进行转导,使得与SA的外源性处理可以模拟应力响应。作为次生新陈代谢合成的调节剂,BHLH TFS诱导盐度和极端温度,以及用植物激素治疗[GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba43GydF4y2Ba].在这里,Pabhlh1的转录GydF4y2Bap . appendiculatumGydF4y2Ba菌体对SA处理和紫外线照射都有积极反应,许多编码苯丙素合成关键酶的基因也是如此[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba44GydF4y2Ba].C4H和4CL1的转录,其编码的酶作用于苯丙素合成的前两个步骤,已知对外源性SA处理有积极响应[GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba45GydF4y2Ba].同时,通过这种治疗显着诱导了对类黄酮合成的“守门员”进行了CHS [GydF4y2Ba44GydF4y2Ba].该指示是pabhlh1起动调节一系列基因,这有助于防御非生物胁迫。GydF4y2Ba
结论GydF4y2Ba
从苔类植物中分离到bHLH TF,并对其进行了表征GydF4y2Bap . appendiculatumGydF4y2Ba.过表达时,PabHLH1能够调控双联苯的生物合成GydF4y2Ba答:芥GydF4y2Ba,调控类黄酮和花青素的生物合成;在这两种情况下,基因的作用都是通过影响相关结构基因的转录。苔草转录因子的功能鉴定对追踪次生代谢产物合成的进化具有重要意义,同时也可能为提高植物中有价值分子的生产提供策略。GydF4y2Ba
可用性数据和材料GydF4y2Ba
支持本文中给出的结果的数据作为附加文件包含。如欲索取资料,请联络a.x.c (GydF4y2Baaxiacheng@sdu.edu.cn.GydF4y2Ba).GydF4y2Ba
缩写GydF4y2Ba
- 4CL:GydF4y2Ba
-
4coumarate:辅酶是一个连接酶GydF4y2Ba
- 答:GydF4y2Ba
-
花青素合成酶GydF4y2Ba
- C4H:GydF4y2Ba
-
肉桂酸4-羟基化GydF4y2Ba
- Chi:GydF4y2Ba
-
查耳酮异构酶GydF4y2Ba
- CHS:GydF4y2Ba
-
Chalcone合成酶GydF4y2Ba
- DBR:GydF4y2Ba
-
双键还原酶GydF4y2Ba
- DFR:GydF4y2Ba
-
二氢酚酰酚醇还原酶GydF4y2Ba
- F3H:GydF4y2Ba
-
黄烷酮3β羟化酶GydF4y2Ba
- 弗尔斯:GydF4y2Ba
-
黄酮醇合成酶GydF4y2Ba
- 朋友:GydF4y2Ba
-
苯丙氨酸氨裂解酶GydF4y2Ba
- stc):GydF4y2Ba
-
Stilbenecarboxylate合酶GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
杨志刚。苔藓植物的植物化学研究进展[j]。acta botanica sinica(云南植物学报)2001;56(3):297-312。GydF4y2Ba
- 2。GydF4y2Ba
Asakawa Y,Ludwiczuk A,Nagashima F.苔藓植物的化学成分:生物和化学多样性,生物活性和化学系统。化学素。2013; 44(12):1-796。GydF4y2Ba
- 3.GydF4y2Ba
黄酮类化合物在低等植物中的分布及其进化意义。类黄酮。查普曼和霍尔,伦敦,1988;427 - 468。GydF4y2Ba
- 4.GydF4y2Ba
浅川Y.苔藓植物的化学成分。BERLINE:有机天然产品化学的进展。Springer维也纳;1995. p。1-562。GydF4y2Ba
- 5.GydF4y2Ba
Qu JB,Zhu Rl,Zhang Yl,Guo Hf,Wang xn,谢Cf,yu wt,ji m,lou hx。来自Liverwort的Ent-Kaurane DiterpenoidsGydF4y2BaJungermannia AtrobrunneaGydF4y2Ba.J Nat Prod。2008; 71:1418-22。GydF4y2Ba
- 6.GydF4y2Ba
Asakawa Y,Ludwiczuk A.在Markantiophyta(Liverworts),蕨类植物和更高的植物和生物活性,生物合成和总合成中分布循环和无环苄苄酰基。杂环。2012; 86(2):891-917。GydF4y2Ba
- 7.GydF4y2Ba
石玉强,朱长昌,袁华强,李宝强,高娟,曲晓军,孙波,程亚宁,李松,李旭,娄海霞。马尚汀C,一种新型的肝草微管抑制剂,具有体内外抗肿瘤活性。癌症。2009;276(2):160 - 70。GydF4y2Ba
- 8.GydF4y2Ba
吴Xz,chang wq,cheng ax,sun lm,lou hx。Plagiochin E,一种抗真菌活性大环BIS(丁基),诱导细胞凋亡GydF4y2Ba念珠菌白葡萄酒GydF4y2Ba通过metacaspase依赖的凋亡途径。生物物理学报。2010;19(4):439-47。GydF4y2Ba
- 9.GydF4y2Ba
王志强。环双(联苯)化合物的生物合成GydF4y2BaMarchantia polymorphaGydF4y2Ba.植物化学。1999;(4):589 - 98。GydF4y2Ba
- 10。GydF4y2Ba
俞恩,刘XY,高,汉XJ,郑斧,娄HX。利物曲线苯丙氨酸氨酶的分子克隆和功能表征GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.植物细胞组织器官邪教。2014; 117(2):265-77。GydF4y2Ba
- 11.GydF4y2Ba
高S,Yu Hn,徐Rx,Cheng Ax,Lou HX。肝脏4-香豆素COA连接酶的克隆与功能表征GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.植物化学。2015;111:48-58。GydF4y2Ba
- 12.GydF4y2Ba
Feller A,Machemer K,Braun El,Grotewold E. MyB和BHLH植物转录因子的进化和比较分析。工厂J1111; 66(1):94-116。GydF4y2Ba
- 13。GydF4y2Ba
植物中碱性螺旋-环-螺旋蛋白的起源和多样性。中国生物医学工程学报。2011;27(4):862-74。GydF4y2Ba
- 14.GydF4y2Ba
黄酮类化合物生物合成途径的转录调控研究进展acta photonica sinica . 2011;62(8): 2465-83。GydF4y2Ba
- 15.GydF4y2Ba
Ludwig SR,Habera LF,Dellaporta SL,Wessler SR。LC是负责组织特异性的花青素产生的玉米R基因家族的成员,编码类似于转录活化剂的蛋白质,含有Myc-Moarology地区。PROC NATL ACAD SCI。1989; 86(18):7092-6。GydF4y2Ba
- 16.GydF4y2Ba
Goodrich J, Carpenter R, Coen ES。一个共同的基因调控不同植物的色素沉着模式。细胞。1992;68(5):955 - 64。GydF4y2Ba
- 17.GydF4y2Ba
Nesi N, Debeaujon I, Jond C, Pelletier G, Caboche M, Lepiniec L. TT8基因编码表达DFR和BAN基因所需的基本螺旋-环-螺旋结构域蛋白GydF4y2Ba拟南芥GydF4y2Ba长角果。植物细胞。2000;12(10):1863 - 78。GydF4y2Ba
- 18.GydF4y2Ba
Payne C, Zhang F. Lloyd, A.M.GL3编码bHLH蛋白,调节毛状体的发育GydF4y2Ba拟南芥GydF4y2Ba通过与GL1和TTG1相互作用。遗传学2000;156(3): 1349 - 1362。GydF4y2Ba
- 19.GydF4y2Ba
张F,Gonzalez Am,Payne CT,Lloyd A.冗余BHLH蛋白的网络在所有TTG1依赖性途径中GydF4y2Ba拟南芥GydF4y2Ba.发展。2003;130(20):4859 - 69。GydF4y2Ba
- 20。GydF4y2Ba
拼写的C,Quattrocchio F,Mol JN,Petonia的koes R.Hocyanin1编码了直接激活结构花青素基因的转录的基本螺旋环螺旋蛋白。植物细胞。2000; 12(9):1619-32。GydF4y2Ba
- 21。GydF4y2Ba
Bai Y,Pattanaik S,Patra B,Werkman Jr,谢Ch,携带烟草的黄化类基本螺旋升温器,NTAN1A和NTAN1B,烟草的起源于两颗祖先并在功能上有效。Planta。2011; 234(2):363-75。GydF4y2Ba
- 22。GydF4y2Ba
Ohno S,Hosokawa M,Hoshino A,Kitamura Y,Morita Y,Park K. A BHLH转录因子DVIVs参与了大丽花的花青素合成(GydF4y2Ba大丽花摘要GydF4y2Ba).J Exp Bot。2011; 62(14):5105-16。GydF4y2Ba
- 23。GydF4y2Ba
在花青素生物合成的转录调控基因的基因内串联复制,使淡色的花和种子具有细斑点GydF4y2BaIpomoea tricolor.GydF4y2Ba.植物j . 2004; 38(5): 840 - 9。GydF4y2Ba
- 24。GydF4y2Ba
hhicri I, Heppel SC, Pillet J, Léon C, Czemmel S, Delrot S.碱性螺旋-环-螺旋转录因子MYC1参与调控葡萄藤类黄酮生物合成途径。摩尔。2010;3(3):509 - 23所示。GydF4y2Ba
- 25。GydF4y2Ba
Matus JT, Poupin MJ, Cañón P, boru E, Alcalde JA, Arcejohnson P.葡萄中类黄酮合成相关WDR和bHLH基因的分离(GydF4y2Ba葡萄GydF4y2BaL.)。植物mol biol。2010; 72(6):607-20。GydF4y2Ba
- 26.GydF4y2Ba
吴毅,赵y,刘xy,帅哥,郑斧,娄hx。BHLH转录因子调节Limerwort中的Bisbigenzyl生物合成GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.植物细胞生理。2018; 59(6):1187-99。GydF4y2Ba
- 27.GydF4y2Ba
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志杆菌。1962;15(3):473 - 97。GydF4y2Ba
- 28.GydF4y2Ba
Gambino G,Perrone I,Gribaudo I.一种快速有效的葡萄树和其他木质植物组织的RNA提取方法。Phytochem肛门。2008; 19(6):520-5。GydF4y2Ba
- 29.GydF4y2Ba
Tamura K,Dudley J,Nei M,Kumar S. Mega4:分子进化遗传学分析(Mega)软件版本4.0。mol Biol Evol。2007; 24(24):1596-9。GydF4y2Ba
- 30.GydF4y2Ba
孙y,吴y,赵y,汉x,lou h,cheng ax。来自肝曲线的两淀粉醇脱氢酶的分子克隆和生化特征GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.植物生理生化。2013;70:133-41。GydF4y2Ba
- 31。GydF4y2Ba
柯蒂斯MD,Grossniklaus U.一种在Planta中基因的高通量功能分析的网关克隆传染媒介。植物理性。2003; 133(2):462-9。GydF4y2Ba
- 32。GydF4y2Ba
Gietz D,Jean As,Woods Ra,Schiestl Rh。完整酵母细胞高效转化的改进方法。核酸RES。1992年; 20(6):1425。GydF4y2Ba
- 33。GydF4y2Ba
阵伤SJ,弯曲AF。花卉浸:农杆菌介导转化的简化方法GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.植物j . 1998; 16(6): 735 - 43。GydF4y2Ba
- 34。GydF4y2Ba
Rispail N,Morris P,WebB KJ。酚类化合物:提取和分析。莲花japonicus手册。斯普林斯荷兰2005;349-354。GydF4y2Ba
- 35。GydF4y2Ba
张旭,苟敏,刘昌成。拟南芥Kelch重复F-box蛋白通过控制苯丙氨酸解氨酶的周转来调控苯丙氨酸的生物合成。植物细胞。2013;25(12):4994 - 5010。GydF4y2Ba
- 36。GydF4y2Ba
Pomar F,Merino F,BarcelóAR。紫杉布壁中的O-4连接的果皮和SINAPEL醛是WIENNER(甘黄油-HCl)反应的主要靶标。原生质。2002; 220(1-2):17-28。GydF4y2Ba
- 37。GydF4y2Ba
Chang XF,Chandra R,Berleth T,Beatson RP。快速,微观,基于乙酰溴的高通量测定木质素含量的方法GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.农业食品化学学报。2008;56(16):6825-34。GydF4y2Ba
- 38.GydF4y2Ba
Massari Me,Murre C. Helix-Loop-Helix蛋白质:核心化生物中的转录调节器。Mol细胞Biol。2000; 20(2):429-40。GydF4y2Ba
- 39.GydF4y2Ba
拟南芥碱性/螺旋-环-螺旋转录因子家族。植物细胞。2003;15(8):1749 - 70。GydF4y2Ba
- 40.GydF4y2Ba
Pattanaik S,谢Ch,元L.植物Myc样BHLH转录因子的相互作用域可以调节反式激活强度。Planta。2008; 227(3):707-15。GydF4y2Ba
- 41。GydF4y2Ba
Heim Ma,Jakoby M,Werber M,Martin C,Weisshaar B,Bailey PC。植物中基本螺旋环 - 螺旋转录因子家族:蛋白质结构和功能多样性的基因组研究。mol Biol Evol。2003; 20(5):735-47。GydF4y2Ba
- 42。GydF4y2Ba
Feller A,Hernandez JM,Grotewold E.一种类似的域名参与几种植物基本螺旋环 - 螺旋转录因子的二聚化。J Biol Chem。2006; 281(39):28964-74。GydF4y2Ba
- 43。GydF4y2Ba
Seo JS, Joo J, Kim MJ, Kim YK, Nahm BH, Song SI。OsbHLH148是一种基本的螺旋-环-螺旋蛋白,在一个茉莉酸信号通路中与OsJAZ蛋白相互作用,导致水稻的耐旱性。植物j . 2011; 65(6): 907 - 21所示。GydF4y2Ba
- 44。GydF4y2Ba
俞恩,王我,太阳b,高s,郑斧,娄hx。来自Liverwort的Chalcone合酶的功能表征GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba.植物细胞批准。2015; 34(2):233-45。GydF4y2Ba
- 45。GydF4y2Ba
刘小燕,于海宁,帅刚,吴玉峰,程爱森,娄海霞。3个肝苔桂皮酸4-羟化酶基因的分离及功能鉴定。植物生理生化学报。2017;117:42-50。GydF4y2Ba
确认GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
本研究由国家自然科学基金项目(No. 31370330, No. 31770330)和山东省科技发展计划项目(No. 2016GSF121032)资助。资助方没有参与实验设计、数据收集和分析或手稿的撰写。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
AXC和HXL构思了研究计划并设计了实验;YZ,YYZ,HL,XSZ,RN,PYW和SG进行了实验;AXC和HXL监督实验并分析数据;YYZ和AXC写了这篇论文。所有作者阅读并认可的终稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
Plagiochasma appendiculatumGydF4y2Ba样本收集符合所有相关机构、国家和国际准则。在中国,GydF4y2BaPlagiochasma appendiculatumGydF4y2Ba不是一种脆弱的物种,因此没有具体许可需要收集这种植物进行研究目的。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人没有对本调查的利益冲突。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表S1。GydF4y2Ba
本研究中使用的寡核苷酸引物的序列。GydF4y2Ba
附加文件2:表S2。GydF4y2Ba
用于转录分析的引物序列。GydF4y2Ba
附加文件3:图S1。GydF4y2Ba
WT和PabHLH1-OE转基因植株的黄酮分析GydF4y2Bap . appendiculatumGydF4y2Ba菌体。(A)WT,(B)OE-1转基因线,(C)OE-2转基因系,和(D)叶黄素标准。(e)紫氏菌素P1和(F)紫外光光谱的UV光谱。标记内部标准MyRicetin。GydF4y2Ba
附加文件4:图S2。GydF4y2Ba
转基因PabHLH1双苄的HPLC图谱GydF4y2Bap . appendiculatumGydF4y2BaThallus(D)和相应的标准(A-C)。(a)内标是Baicalein;(b)LA,肺酸和RC,Riccardin C;(c)Rd,Riccardin D.(e)la,(g)rc和(i)rd标准的紫外线谱;从PabhlH1转基因系,La(F),RC(H)和RD(J)中提取的苄苄酰基苄基的UV光谱。GydF4y2Ba
附加文件5:图S3。GydF4y2Ba
木质素分析GydF4y2Ba答:芥GydF4y2Ba外源表达PabHLH1。(A)用Wiesner方法染色的茎冷冻切片中的一个维管束。(B)木质素含量的定量。WT,野生型GydF4y2Ba答:芥GydF4y2Ba;OE:转基因GydF4y2Ba答:芥GydF4y2Ba行PabHLH1。GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
赵颖,张媛媛。刘,H。GydF4y2Ba等等。GydF4y2Ba脱哌苯和黄酮化生物合成调节的Liverworts BHLH转录因子的功能表征。GydF4y2BaBMC植物杂志GydF4y2Ba19,GydF4y2Ba497(2019)。https://doi.org/10.1186/s12870-019-2109-z.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-2109-z.GydF4y2Ba
关键词GydF4y2Ba
- bHLH转录因子GydF4y2Ba
- Liverworts.GydF4y2Ba
- Bisbibenzyls.GydF4y2Ba
- 类黄酮GydF4y2Ba
- p . appendiculatumGydF4y2Ba