抽象的
背景
Dicer酶样蛋白(DCL中)在RNA沉默机制必不可少的球员,在通过的miRNA基因调控及在植物抗病毒的保护作用,并也被关联到其他生物和非生物胁迫。据我们所知,尽管一些农作物被识别,棉花的DCL还没有被定性到现在。在这项工作中,我们的特点dcl分析了3种棉花在生物胁迫下的表达谱。
结果
作为主要结果,11dcl在异源四倍体棉花中陆地棉二倍体中的7和6g . arboreum和g . raimondii就,被确定,分别。在一些dcl在这些基因组中观察到的重复,是额外的DCL3在三种棉种中均检测到,而在其他棉种中未发现。所有的DCL在异源四倍体棉花基因组中通过硅分析鉴定的类型能够产生转录本,通过在不同组织中的基因表达分析观察到这一点。基于棉花dcl对植物病毒防御的重要性,分析了棉花dcl对polerovirus CLRDV侵染的敏感品种(FM966)和抗性品种(DO)对病毒侵染和/或草食动物侵染的响应。cvs。对病毒感染的反应不同在接种部位,抗性cv。表现出强烈的诱导DCL2a和B.,而易受影响的履历。显示出这些基因的下调DCL4表达高度诱导。一个时间的过程DCL在离接种点较远的地上部分沿侵染方向表达DCL2b和DCL4在敏感的棉花中感染后24小时被压抑。随着CLRDV被蚜虫传播,也检查了草食病攻击。相反的表达模式DCL2a和B.和DCL4结果表明,蚜虫单独取食可引起DCL调节。
结论
几乎所有allotetraploide的dclsg .分子在他们的相对二倍体中发现了棉花。重复DCL2和DCL3在三个物种中都发现了。四类DCL均对蚜虫侵染和病毒侵染有反应g .分子。dcl对病毒本身和/或草食动物攻击的最初反应可能有助于增强病毒抵抗力。
背景
DICER蛋白是普遍存在的一类RNAse III酶,对RNA干扰(RNAi)的建立至关重要。dcl识别并切割长ds-RNA底物,释放21 - 24 nt小RNA双链,其两端均有2-nt 3 '悬垂[1那2那3.].这些小rna在真菌、植物和动物中是重要的核糖调控因子,通过碱基配对负调控特定靶基因的表达。小rna的功能主要描述在植物的发育和对非生物和生物胁迫的反应[4.那5.那6.].植物小rna一般分为短干扰rna (short-interfering rna, sirna)和microRNAs (microRNAs, miRNAs)。不同种类的sirna以前被描述为自然反义sirna (natsiRNA)和反式作用sirna (tasiRNAS),它们作为miRNAs,通过降解其mRNA靶标或抑制其翻译参与转录后基因调控。异染色质相关sirna (hcsiRNA)与染色质修饰和靶DNA的转录抑制有关位点.通过在病毒感染期间通过Dicer切割的中间病毒基因组结构的长期非转化的RNA(LsiRNA)和病毒小RNA(vsiRNA)产生。一旦生产,将小RNA掺入Argonaute(前) - 触及RNA诱导的沉默复合物(RISC)以在RNA信息的沉默中赋予序列特异性[3.那5.那7.那8.].在植物和真菌中,细胞RNA依赖RNA聚合酶(RDR)将异常RNA转化为双链RNA,导致小RNA扩增和更密集的RNA沉默[3.那9.那10].
这些蛋白在植物中被称为DICER-like (DCLs),它们有6个结构域:位于n端的DEAD、Helicase-C和DUF283结构域,位于中部的Piwi/Argonaute/Zwille (PAZ)结构域和位于c端半的双RNAse III结构域,后面是一个或两个dsrna结合结构域[11那12].在低等真核生物中,可能没有一个或多个这样的结构域[4.].解旋酶结构域用于招募辅助因子调节蛋白[13那14那15].ATP水解用于实现LONG DSRNA底物的逐渐切割。死区充当ATP绑定域[16].PAZ结构域反过来介导dsRNA底物末端的识别,而PAZ与RNAse III催化中心之间的距离决定了产生的小rna的大小[17那18].两个RNase III结构域中的每一个切割DSRNA链中的一种,在产品的3'末端留下特征2-NT突出[19那20.那21, c端dsrna结合域(dsRBD或DSRM)除了具有dsrna结合功能外,还作为蛋白-蛋白相互作用界面和核定位信号。dsRBD介导不同RNA底物的识别和随后的效应复合物的合并[22那23那24].然而,多重dsRBD可能通过识别特定rna的二级结构而联合作用[13].
在拟南芥中,4个基因(DCL1-4已经发现编码DCl蛋白[12那25].这四个atdcl中的每一个都参与了特定小RNA物种的生物发生。然而,它们可能在不同的srna的产生中扮演冗余和分级的角色[26].AtDCL1负责miRNA的生物合成。AtDCL2生成22-nt的siRNA和从内源性倒重复序列,整合的病毒,转基因和RDR-扩增病毒的dsRNA [病毒的siRNA(vsiRNAs)26那27那28].AtDCL3与转录沉默相关,通过rna依赖的DNA甲基化和组蛋白修饰产生24nt长度的sirna,参与异染色质状态的建立和维持[29那30.].这24个sinas大多来自重复的DNA位点和转座子,以及DNA区域的反转录转座子插入。AtDCL4响应初级vsirna的生物发生,这些vsirna具有21-nt,是由病毒基因组复制中间体切割生成的。这种DCL还负责分阶段sirna、ta- sirna和病毒激活sirna (vasiRNAs,一种由病毒感染诱导的内源性rdr1依赖的sirna)的产生[31那32那33].DCL4在病毒性抗性中非常重要,引发原发性感染细胞的病毒沉默[33].初级vsiRNAs还可以发起次级siRNA的生产,AtDCL2和AtDCL4的作用下,与其它基因[25那34那35].因此,DCL2和dcl4即使在易感植物中也是控制病毒复制的关键水平。次级vsirna的产生使得病毒防御的幅度增加,使得RNAi在植物的抗病毒防御中至关重要。
与拟南芥中DCL的特性和功能的报道相比,在其他植物中描述DCL的报道很少。一般来说,这些报告显示存在4类dcl,每个类有多个成员。七个dcl已在番茄中识别出来Solanum lycopersicum.[36[米中八个[37],五是玉米[38,五棵白杨树[12那39,四个葡萄藤[40), 8芸苔栗鸟[41],三进来Archis duranensis,鹰嘴豆,鸽子豆,A. iPaensis.[42]和胡椒4 [43].到目前为止,棉花dcl仅在G.raimondii就基因组(44],但他们并没有被在棉花物种调查通过比较进化和表达分析。
棉花作物对30多个国家的经济都很重要,是世界纺织工业中天然纤维的主要来源。除棉纤维外,棉油还广泛用于人类消费。进化Gossypium属有两个重要的事件。首先,5-10万年前发生了一次分化(MYA),当时a和D二倍体基因组形成了两个分离的分支。随后,大约1-2 MYA, A和b基因组祖先之间的种间杂交发生异源多倍体事件g . arboreum和G. Raimondii,分别产生新的Gossypium种,如栽培的g .分子(AADD)其他人[44那45].由于异源多倍体化,成千上万的基因被复制并表现出不同的表达水平,这解释了异源多倍体棉花与二倍体棉花相比所观察到的剧烈的植物形态变化g . arboreum和g . raimondii就[44].
在这里,我们鉴定并描述了异源四倍体的DCL家族g .分子和两个二倍体,g . arboreum和G. Raimondii,棉花品种。如上文所述g . raimondii就[44], 一个额外的DCL3也存在于g . arboreum和g .,它是目前表达的。鉴于DCL在病毒防御中的重要性,我们研究了DCL的表达模式g .分子2个商品棉品种(cv.)在CLRDV (棉花卷叶矮缩病毒)感染和/或食草动物攻击蚜虫棉.抗clrdv和感clrdv棉花品种的比较。在感染过程中表现为DCL尤其是表达式DCL2a那2 b, 和DCL4,这或许可以解释每次登录所表现出的不同病毒反应。有趣的是,两个棉DCL3在病毒感染期间也有差异调节。
结果
棉花dicer样基因家族的鉴定及染色体定位
使用拟南芥和大米dcl作为查询序列,我们确定Dicer-like两个二倍体棉花的基因,g . raimondii就和g . arboreum以及异源四倍体G. Hirsutum Acc..TM-1是通过搜索棉花基因组数据库确定的[46那47那48].基于这些查询和BLAST工具分析,我们确定了编码DCL蛋白的6个基因g . raimondii就7在g . arboreum而在异源四倍体11g .分子分别为(表1).
DCL基因根据最接近的底特语命名答:芥.在4DCL基因答:芥那AtDCL1那AtDCL2那AtDCL3, 和AtDCL4在棉花方面有相似之处。AtDCL1只有一个同系物g . raimondii就和g . arboreum和两者g .分子。AtDCL2在2个直系同源基因G. Raimondii,3g . arboreum, 4英寸g .分子。AtDCL3两个二倍体基因组中有2个同源基因,3个同源基因g .分子.所有三种棉质物种都存在两种DCL3。似乎这种重复可能与棉花演变相关,因为它在这里研究的三种物种存在;但是,我们不能排除它是中立的可能性。AtDCL4在四倍体棉花中有2个同源基因,而在二倍体棉花中只有1个同源基因.根据其在同源染色体上的排列顺序,将棉花dcl的不同平行链编码为a和b。
这些基因的详细信息列于表中1,包括染色体位置,ORF和蛋白质长度,分子量和理论等电点。新发现的Dicer-like基因座编码氨基酸多肽1209 ~ 2009个,预测分子量分别为132.99 ~ 220.99 kDa。在g . arboreum对于DCL2A(Cotton_A_34031),其长度为770氨基酸(84.7kDa)。它代表了一个额外的DCL2A,仅存在于此g . arboreum基因组。
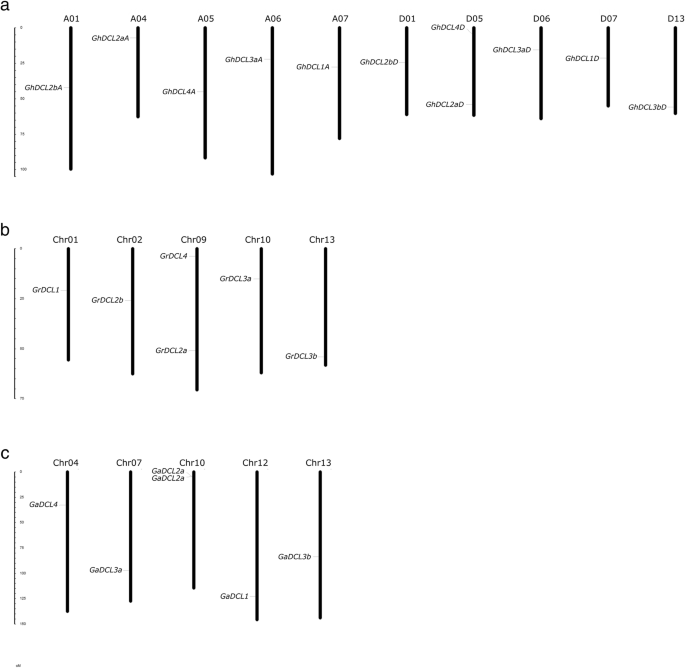
三大棉种的物理位置DCL基因如图所示。1.总共十一ghdcl.基因分布在10g .分子染色体。所有染色体(A01,A04,A05,A06,A07,D01,D06,D07和D13)包含单个代表ghdcl.,除了包含的染色体D05之外ghdcl2a.和GhDCL4.奇怪的是,几乎所有的GhDCLs是否与遗传自亲本相关物种的染色体相关.g . raimondii就提出6DCL基因分布在5条染色体上g . arboreum7有dcl分布在5条染色体和一个支架区域(scaffold3086),该区域尚未被纳入染色体的物理图谱。g . arboreum提出了两个DCL2a位于10号染色体上非常接近的位置,相隔约9 kb。这两个DCL2as(以本文命名为gadcl2a31和32)高度相似,在氨基酸水平上分享93.4%的同一性。预测的gadcl2a32.在5 '端/ n端丢失了核苷酸/氨基酸。
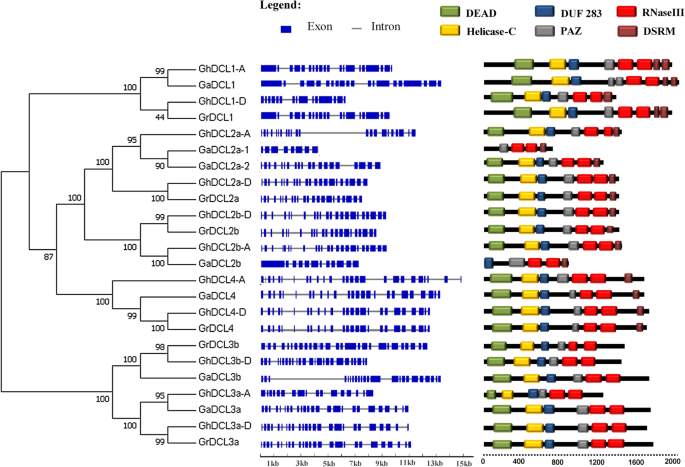
表中显示了内含子/外显子(I / E)分布以及内含子数1和无花果。2.G一种DCL1(棉花_A_14097) showed the longest ORF of 6027 bp and coding potential for a polypeptide of 2009 amino acids. The maximum number of introns, 25, was found inDCL3a和B.的g . raimondii就.DCL4所有三个不同的物种都表现出非常相似的内含子/外显子分布。同样的情况也可以观察到DCL3a的g . arboreum那g . raimondii就, 和g .分子从subgenome D。GhDCL3a然而,从亚基因组A,显示了一个独特的模式在基因的5 '末端。它似乎失去了这个区域的部分核苷酸。内含子和外显子的分布也非常相似DCL2b的g . raimondii就和g .分子亚因子A和D.gadcl2b.另一方面,I/E的分布却大不相同。
棉花dcl的系统发育树、基因结构和结构域组成。采用mega7.0软件构建系统发育树。外显子/内含子的结构DCL基因分别由蓝框和灰色线代表。蛋白质结构域分析由不同的颜色表示。使用的序列在附加文件中列出1
棉DCL系统发育和域组成分析
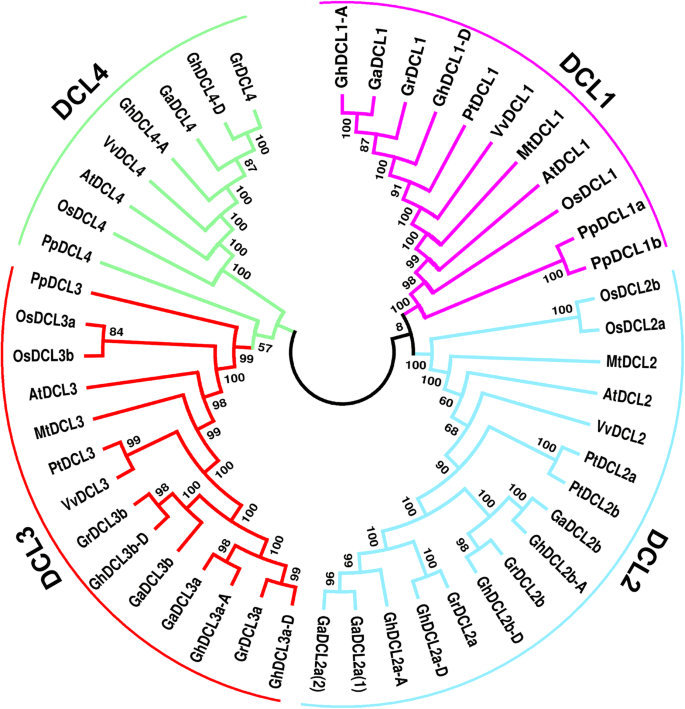
三种棉质氨基酸序列的系统发育关系(雷蒙地弓形虫,乔木地弓形虫, 和分子)使用MEGA 7.0软件构建邻域连接(N-J)系统发生树(图7)。2).这些分析表明DCL基因聚集在两个单独的枝条上,一个组成DCL1那2, 和4.另一个DCL3s.这两个ghdcl.亚科毛利人进一步分为许多明显分组的亚克士dcl从亲本/祖先二倍体物种与每个相应的亚基因组在异源四倍体棉花。额外的东西DCL3,在此命名为DCL3b,但异源四倍体棉花的基因组中只有一个该基因的成员,表现出最接近的亲缘关系GrDCL3b.我们可以假设DCL3b基因,它是从g . arboreum在g .分子进化,已经失去了。另外,它也可能是由三个物种在异源四倍体杂交后独立获得的。这两个DCL2a从g . arboreum形成一个群体ghdcl2a.来自亚基因A,表明它们可能在四倍体杂交后复制。构造的树建议了高水平的序列保护DCL二倍体物种和异源四倍体的序列g .分子在进化过程中。
利用SMART技术鉴定三个物种中所有Dicer-like基因的DCL结构域(图。2).所有dcl均含有DEAD、helicase-C、DUF283和PAZ结构域,但GaDCL2a31和GaDCL2b不存在DEAD或helicase-C结构域。事实上,GaDCL2a31是一个截断型DCL,因为它也不存在DUF283结构域。所有DCL蛋白中均存在2个RNase III结构域,22个棉花DCL蛋白中有15个至少存在1个DSRM结构域。所有7个棉花DCL3s蛋白都有一个dsRB结构域,这是DCL3植物蛋白的一个特征。有趣的是,来自D亚基因组的GhDCL1似乎失去了一个DSRM结构域,而来自a亚基因组的DCL1保持了2个DSRB结构域。
棉花DCL蛋白与拟南芥、水稻、杨树、葡萄和水稻的DCL蛋白比较Medicago.结果表明,棉花DCL1s与葡萄和杨树DCL1s有共同的祖先。3.).而棉花的DCL2a和2b与杨树DCL2s的亲缘关系更大。葡萄藤和杨树的DCL3与棉花的DCL3亲缘关系最密切。水稻的DCL3重复似乎发生在棉花DCL3重复之前,但在双子叶/单子叶分化之后。DCL3在棉花中的重复可能发生在异源四倍体杂交之前,因此超过1.2 MYA。DCL4似乎是本文分析的最保守的DCL。
DCL基因表达谱不同g .分子器官
以评估是否在硅鉴定dcl在能够生成转录本的棉花中,我们从温室栽培的两种不同商品棉花的根、叶、茎和花中收集了组织样本g .分子Cv., Fibermax 966 (FM966) and Delta Opal (DO), at 60 days post germination (60 dpg) and analyzed gene expression by quantitative real-time PCR (RT-qPCR). These two cultivars were especially selected because they show contrasting phenotypes against an important worldwide distributed cotton virus disease, the cotton blue disease (CBD). Fibermax is susceptible to CBD, while Delta Opal is resistant.
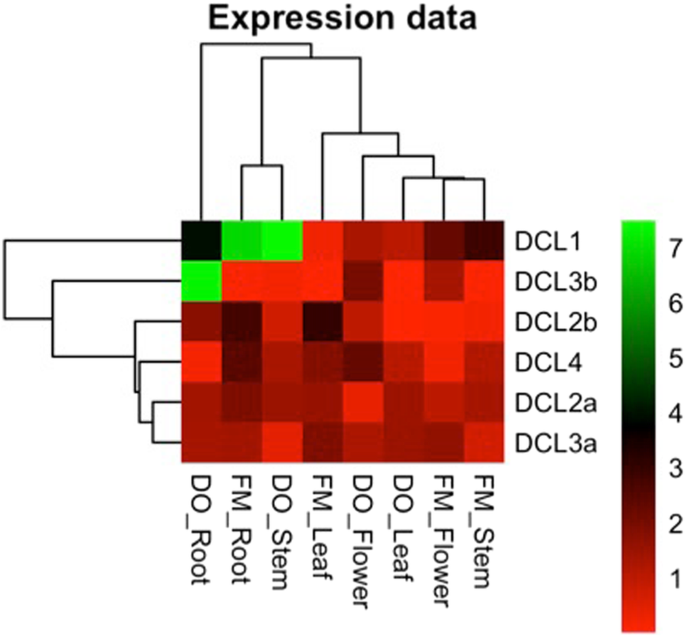
如图所示。4.,所有6的成绩单dcl类型在g .分子植物。DCL1在来自CV的所有分析的组织中表达。FM并做,以及DCL2a那DCL3a, 和DCL4.DCL2b在DO cv的叶片中未检测到。和鲜花的cv。调频,而DCL3b在FM和叶子中几乎不可检测到两种品种。DCL4,是细胞内抗病毒沉默所必需的,在FM和DO植物中表达水平相同DCL2a.然而,DCL2b基本表达水平略有差异。额外的东西DCL3在棉花中鉴定似乎是重要的,特别是在来自健康植物的花和根组织中。
Real-time PCR表达谱Dicer-like基因在不同棉花组织。DCL所有棉花的表达水平dcl对两种商品棉品种的茎、花、叶、根进行了性状分析。Fibermax 966 (FM)和Delta Opal (DO)在60 dag的qRT-PCR。热图是通过实时PCR数据的对数变换生成的,如ΔCt (CtDCL- - - - - - CtGhmiR390/GhPP2A).表达式值的详细信息请参见附加文件2:表S3
DCL基因表达被调节以响应草食动物的攻击和病毒感染
植物DCLS启动RNAi先天防御系统反对入侵病毒,因为它们识别并将进入的病毒和转座核酸进入21,22和24 NTS的小siRNA。因此,我们有兴趣脱落一些棉花DCL在RNA病毒感染过程中,利用抗病毒和感病毒对照棉花的表达被调节。:分别是Delta Opal和FM966。棉花卷叶矮缩病毒(CLRDV)(属,Polerovirus;的家庭,叶氏蓟体),只由蚜虫媒介传播(蚜虫棉),是棉花蓝病的致病因子[49].CLRDV是韧皮部限制的,其基因组由单链、阳性、非聚腺苷化RNA (5.8 kb)组成,包含6个开放阅读框(ORFs) [50].
由于CLRDV仅通过其蚜虫载体传播,另一个重点是了解DCL调制中的蚜虫载体成分。因此,我们评估了棉花DCL在蚜虫食草性攻击中表达的模式蚜虫棉和/或CLRDV感染。
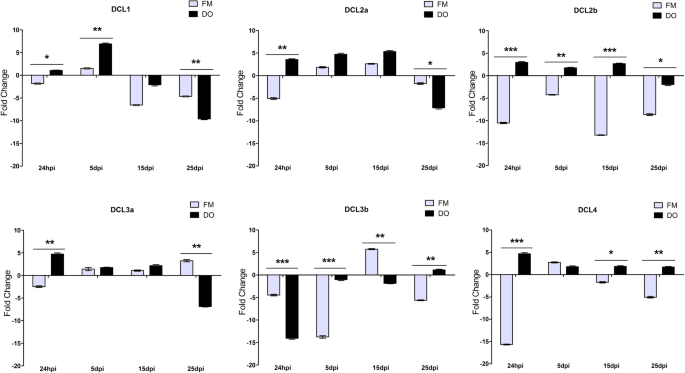
为了分析草食动物攻击对DCL表达的影响,将30株dag棉植株接种无病毒蚜虫。每株限蚜1个基叶(接种叶),接种24 h后施用杀虫剂消灭蚜虫。在与蚜虫接触后,以24 hpi、5 hpi、15 hpi和25 dpi分别测定了所有棉花幼苗系统叶片(接种叶片以上的3-4个叶片)中DCLs的表达水平。5.).对于CLRDV感染,采用类似的生物学方法对携带CLRDV的毒力蚜虫进行了研究。
棉花表达谱DCL利用RT-qPCR分析草食动物的攻击行为。Fibermax 966和Delta Opal棉株与10只蚜虫接触24 h。在24 hpi、5、15和25 dpi下采集系统叶片进行评价DCL随着时间的推移水平。fold change是用2-ΔΔCT所述方法[51].标准差用误差柱表示,“*”表示显著差异,使用GraphPad Prism程序计算。*P.< 0.1 * *P.<0.01 ***P.< 0.001。Hpi为蚜后接种数小时,dpi为蚜后接种数天
一般来说,所有dcl在蚜虫接触后诱导病毒抗性植物中的表达水平诱导(图。5.).当这些植物同时受到蚜虫和病毒的影响时,在有毒蚜虫接触的情况下,DODCL水平显示了另一种压抑模式。在病毒敏感株中,观察到相反的情况(图。6.).
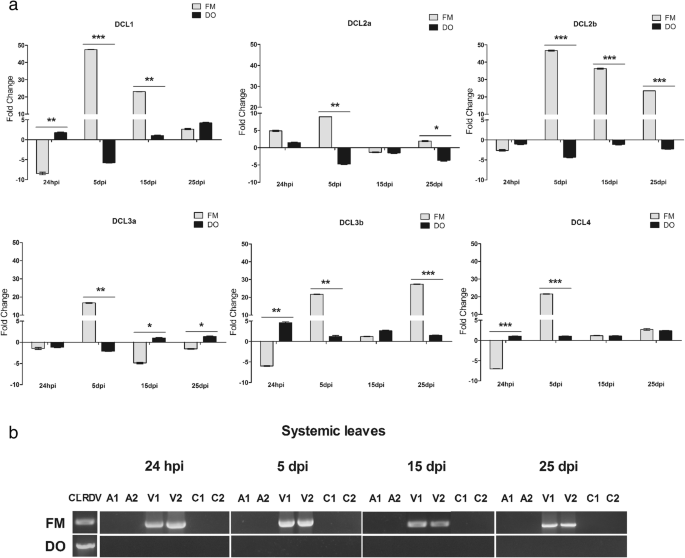
棉花的表达概况dclCLRDV病毒感染后,RT-qPCR分析。cv中的棉花植株。将易感CLRDV感染的Fibermax和耐CLRDV感染的Delta Opal接种于CLRDV载体。接种24小时后将载体清除。一种以24 hpi、5、15和25 dpi分别采集Fibermax 966和Delta Opal植株的系统叶片进行评价DCL随着时间的推移水平。fold change是用2-ΔΔCT所述方法[52].标准差用误差柱表示,“*”表示显著差异,使用GraphPad Prism程序计算。*P.< 0.1 * *P.<0.01 ***P.< 0.001。Hpi -病毒感染后数小时,dpi -病毒感染后数天。B.在所有全身叶片中进行嵌套RT-PCR用于CLRDV胶囊蛋白(CP)基因扩增以检查病毒存在在无病毒蚜虫接种(A),CLRDV感染(V)和未征收的植物(C)中。第1和2号代表了处理植物的独立池。FM - CLRDV易感厂和DO - CLRDV耐药
有趣的是,观察到在前24个hpi之后,所有的细胞都发生了系统性的调节dclMRNA在棉CV中发生。意味着接种叶片中的蚜虫饲料是诱导系统性的反应。对于FM植物,这种系统响应比DO植物更加明显。在24 HPI,FM工厂表现出涉及病毒防御的三种棉花DCL的强调调节,DCL2a那2 b和4.,分别减少约5倍、10倍和15倍。相比之下,DO植物显示出这些dcl的系统性上调。蚜虫对dcl的这种对比调节可能使对CBD敏感的FM基因发生突变。更容易受到病毒感染,因为他们拥有的较少DCL2和4.堆积在传入病毒组织。而对于DO植物,当病毒从本地感染的网站试图传播,它面临着全身组织认为目前3-5较高水平的强的抗病毒沉默预激活DCL2a那2 b和4.而不是健康的植物组织由蚜虫喂养引起的这些DCL在远端系统积累,有助于这些植物阻止病毒在远离局部感染位点的新细胞中建立感染周期。
DCL1在DO cv系统叶片中,mRNA的表达也受到了调控。24 hpi,接触蚜虫后5天。在15和25 dpi时,DCL1FM和DO基因表达均降低。与健康的对照植物相比(图5.).
DCL3a蚜虫在DO和FM两种细胞株中均可诱导表达。在所有的时间点分析。重要的例外是FM在24 hpi和DO在25 dpi,此时DCL下调。相比之下,棉花是额外的DCL3(DCL3b)在前24 hpi到5 dpi之间表现出强烈的抑制。
何时感染毒性蚜虫,FM植物(图。6.)、棉花dcl与占用病毒蚜虫接种的人相比,在全身叶中显示出一种不同的表达模式,表明病毒的存在也调节DCL表达式(无花果。6.和额外的文件2:图S2)。在FM clrdv感染植株和FM模拟植株(无病毒蚜虫接种物)之间的折数变化分析表明,病毒的存在诱导了几乎所有植株的系统下调dcl在病毒感染的最初阶段(24 hpi),除DCL2a.然而,五天后,所有FM的水平dcl显著增加,表现出近60倍、10倍、47倍、17倍、28倍和28倍的变异DCL1那DCL2a那DCL2b那DCL3a那DCL3b, 和DCL4,分别。相比之下,DCL从所有时间点进行植物的转录水平被轻微诱导或压制,维持与未感染的模拟植物非常相似的水平。即使在易感植物FM中观察到的强烈DCL调制,CLRDV也可以在24 HPI的系统性叶中容易地检测到,即使具有抗病毒机械的广泛努力,病毒也在整个植物中复制和扩散(图。6.b)。这种强烈调制DCL在DO植物中未观察到表达dcl只有轻微的诱导或降低至25dpi,并且在24hpi至25dpi之间的任何系统叶片中都未检测到病毒(图。6.b). DO植物缺乏病毒积累可能解释为什么DO dcl几乎没有在这些叶片上被诱导。
来自CLRDV FM感染植物的病毒小RNA的深度测序,以前在全身叶子上的同一时间点进行的,表明,最丰富的病毒siRNA为22 nt [53],突出在远离接种叶打击病毒在地上部分的扩散和/或复制DCL2的重要性。这些努力是不够的病毒感染的封锁。既DCL2s可能参与处理/为22个NTS这些第二病毒的siRNA的产生切割病毒dsRNA的。然而,由于DCL2b水平超过4倍DCL2a全身感染的叶片细胞的水平5 dpi,我们可以假设这一点DCL2b是22-nt的病毒的siRNA一代最重要的。
局部感染网站病毒/蚜虫感染的DCL2和DCL4表达的调节
在拟南芥中,DCL4是细胞内抗病毒沉默的重要组成部分,而DCL4和DCL2对全身感染的抑制都是必要的。我们的结果表明DCL4在抗病棉花地上部分,几乎不受CLRDV侵染的影响,而DCL2a和2 b表达下调(无花果。6.).然而,在易感植物中,DCL4在感染开始时系统性地强烈下调。因此,下一步是检查这些问题dcl在感染遗址表达。因此,在病毒感染后,我们将样品从接种的叶子接种24小时收集样品并分析DCL通过RT-qPCR(图mRNA表达谱。7.).
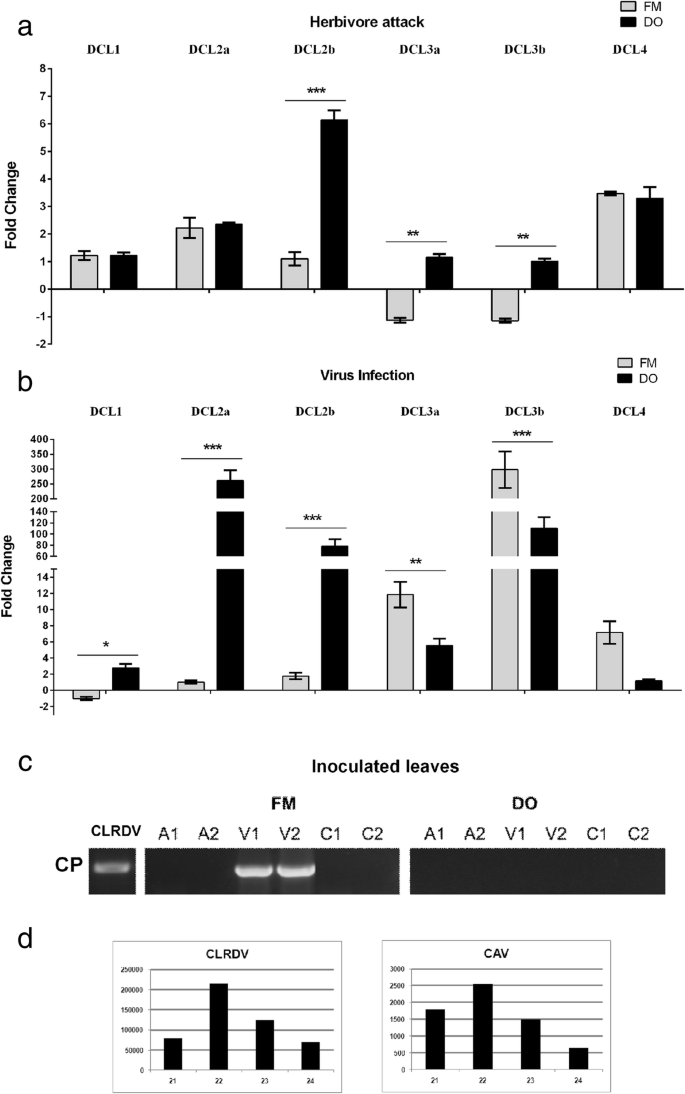
概要文件的棉花DCL在接种位点的表达。一种DCL在24 HPI时蚜虫接种叶片中的表达谱。B.棉花DCLCLRDV在24 hpi的表达谱。CCLRDV在接种叶片中的复制鉴定。采用巢式RT-PCR法检测感染CLRDV的蚜虫(A)、感染CLRDV的植株(C)和未感染CLRDV的植株(C)的病毒复制情况。D.来自棉花植物感染的病毒小rnas的谱。以前通过[中的CLRDV SViRNA谱54]并且在这里显示只是为了说明目的。数字1和2代表了经过处理的植物的独立池。FM - CLRDV易感厂和DO - CLRDV抗性植物。CAV - 棉花植物病毒病毒
蚜虫接触诱导DCL2a和DCL4FM和DO cvs的表达水平相似。(无花果。7.一个)。DCL2b结果表明,DO的诱导量是FM的6倍。局部蚜虫攻击调节反应似乎是相同的抗性/敏感性表型DCL4两株植株在接种叶片上表现出相似的DCL诱导水平。
相反,病毒的存在诱导几乎所有DCL的更强的调制。在病毒感染网站,DCL2a那DCL2b, 和DCL3b在抗病品种中分别发生约250倍、70倍和100倍的突变。在24 hpi时(图。7.b)。强壮的人DCL2a和2 b诱导似乎与病毒抗性有关,因为病毒在DO植物中的系统传播完全被抑制(图。6.b)。甚至在病毒接种叶片中的病毒复制是抑制的,如通过用于CLRDV检测的高灵敏度嵌套RT_PCR所观察到的(图。7.c).易感cv。FM不响应病毒存在的方式与DO cv相同。,只是一个非常轻微的归纳DCL2a和B.在接种叶子中在24小时观察到。在这些植物中,在系统性和24小时以来,在全身和接种的叶子中观察到病毒积累(图。6.乐队7.c,分别)。
调频感应DCL46x高于那样的DCL4也观察到。这一发现表明,敏感和抗性植株的产量都更高DCL4抗击病毒入侵;然而,这种过度表达似乎不足以抑制感染的传播,因为FM植物产生更多DCL4比DO更容易受到影响。因此,这两种DCL2s对避免病毒在接种位点的传播和积累似乎非常重要,而DCL4可能具有次要作用。然而,根据这些结果,我们不能说DCL2的强烈诱导是DO CLRDV耐药表型的原因,因为不相关的耐药机制也可能起作用。奇怪的是,DCL3a和3 b在FM cv中是高度诱导的。(分别是模拟感染植株的11倍和260倍,DO植株的2倍以上)DCL3b在DO cv中诱导。(大约是模拟表达式的100倍)。这些结果表明DCL3b在最初的病毒防御激活过程中似乎很重要。
我们的结果表明,FM和DO植物证明的对比CLRDV易感表型可能与蚜虫饲料和病毒感染介导的不同DCL调制有关。
证实棉花的重要性DCL2在挥手病毒感染中,通过深度测序获得CLRDV和另一种酚道感染棉植物的DCL切割产生的vsirnas的轮廓。如图1所示。7.d,在同时感染CLRDV和棉花花青素病病毒(Cotton花青素病virus, CAV)的植株中,22 nt的svirna比21 nt的svirna积累量大,表明棉花DCL2s在病毒防御中的相关论文。
生物和非生物应激反应顺-作用调控元件存在于陆地棉DCL基因的启动子中
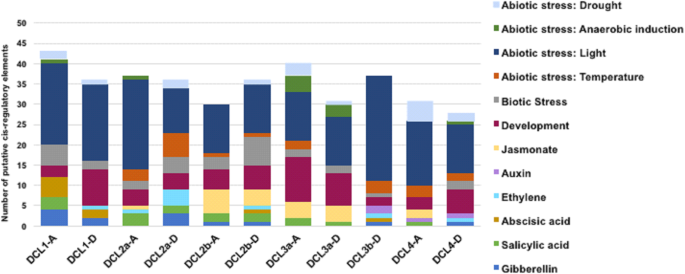
启动子序列位于所有翻译起始点上游1.5 kb处g .分子DCL基因从棉花基因组计划获得试图了解棉花dcl由病毒感染和食草动物攻击调节。转录响应顺元素的DCL利用PlantCare对基因启动子进行分析。11种陆地棉的启动区分析DCL基因揭示了各种生物和非生物响应响应性CIS作用调节元件的存在,包括TCA元素,IRE和ABRE。轻度应力响应元件在隆棉的启动子中相对丰富DCL基因,特别是Box 1, Box 4和GT1-motif(图1)。8.和额外的文件3.:图S3和附加文件4.),提示所有DCL蛋白可能在光胁迫反应中起重要的功能作用。所有DCL推动者展示了其发展顺元素,尤其是HD-ZIP1和2,以及响应干旱(特别是MBS),水杨酸(TCA)和其他生物应力的几乎所有元素(如WUN,BOX-W1,ELI-BOX 3,富含TC的重复),盒子,jere和gcc盒子),揭示了几乎所有的机制dcl旱地棉花的耐旱性和生物胁迫反应g .分子.出奇,GhDCL4A没有表现出典型的生物胁迫或乙烯响应的顺式元件,但在GhDCL4D.总体而言,不同DCL基因家族检测到的启动子元件的平均比例存在显著差异,同一家族之间也存在显著差异dcl源自一个独特的亲本棉二倍体(图8.).然而,非生物胁迫的元素呈现了最高的平均比例在所有dcl.植物激素响应元件,特别是与乙烯和赤霉素相关的DCL1那DCL2a和2 b那DCL3b, 和DCL4,而与me -茉莉酸相关的则占主导地位DCL2b那DCL3, 和DCL4-A.在所有的dcl中发现了大量的增强器元素(附加文件3.:图S3),这表明所有的dcl从这两个亚基因组中可以生成转录本。
分析g .分子DCL启动子序列。转录的1.5 kB上游启动子序列每个DCL基因被检索和用于推定的分析是否存在顺元素。不同的顺-具有相同或类似功能的元素以相同颜色显示。增强器顺元素显示在附加文件中3.:图S3
讨论
在本研究中,我们首先对dcl3种棉花(商品化的异源四倍体)g .分子和它时常g . arboreum和g . raimondii就)在基因组水平上。我们的结果表明,棉花携带了额外的拷贝DCL2和DCL3.额外的东西DCL2此前已报道在杨树、水稻和玉米之间的其他植物。我们的系统发育分析证实了其他发现,表明DCL2经过遗传分离后,复制似乎在单声道和销售中独立进化。的DCL3这里显示的复制是eudicots中的一个独特的事件[12].额外的东西DCL3,此处记为DCL3b,显示了完整的DCL3异源四倍体的结构g .分子在二倍体中g . arboreum和G. Raimondii。定量RT-PCR结果表明,该基因在棉花的花、根等不同组织/器官中均有表达。这个额外的重要性DCL3对棉花的研究是必须的,但我们可以假设,这可能与棉花基因组中检测到的大量转座子有关。g . raimondii就那g . arboreum和g .分子基因组分别占逆转录转座子的大约53,67和62% [44].奇怪的是,在异源四倍体棉花中,我们只发现了一组DCL3b,这可能导致它的g . raimondii就- 般的父母种类。DCL3b从父母的g . arboreum似乎在进化过程中被忽略了。
分析这些棉花额外DCL转录本在病毒感染和草食动物攻击期间的表达,我们可以观察到它们似乎是功能性的,并且在两种胁迫中都受到调节。然而,进一步对异体系统中所有的棉花DCL2s和DCL3s进行表征,将有助于理解这些DCL2s在RNA沉默机制中的额外拷贝。
本组前期研究表明,CLRDV感染在g .分子从数量和质量上影响小RNA积累[54那55].我们的深度测序确定了几个棉花mirna,它们在易感FiberMax 966的CLRDV感染期间下调或上调g .分子的简历(56].所有这些miRNA家族参与不同的和重叠的网络,如植物抗病(miR393, 403和472),叶片发育(miR159, 164, 319和393),开花时间(miR172, 156和157),逆境营养(miR395, 397, 398和408)和miRNA通路(miR403) [55].除了在CLRDV感染过程中gh - mirna的整体变化外,我们还观察到受感染植物中24-nt sRNA的频率下降,且富集吉普赛,和copia-like逆转录转座子成绩单(56].相比之下,感染过程中的CLRDV病毒siRNA谱揭示了22-NT Vsirnas的更大丰度[54].因此,棉花dcl有望在介导CLRDV:棉花互作过程中发挥重要作用。
在这里,分析了6种棉花的表现dcl在两种不同的对病毒敏感的商品棉花中那中two types of biotic stress, revealed that almost all DCLs were modulated during these stresses. The CLRDV-susceptible cv. FM966 showed a strong downregulation ofDCL2a那2 b那3那3 b, 和4.在蚜虫接触后的初始小时内在植物的空中部分。这个下调是维持的,直到25 dpiDCL2b那DCL2b, 和DCL4在大多数分析的时间点。耐clrdv cv。δ蛋白石,这种下调没有被观察到,除了DCL3b,在24 hpi时,与模拟感染的对照植株相比,其抑制率几乎是对照植株的15倍。5.).因此,对蚜虫吸吮的感知能够进行明显的调节DCL表达在这两个cvs的空中部分。与蚜虫没有接触的昆虫。然而,在接种后的叶片(图。7.)DCL2a和DCL4草食动物的攻击对两种棉花植株的调节作用非常相似。因此,病毒抗性和/或易感性似乎不是蚜虫最初接触部位对蚜虫攻击的不同反应的结果,而更可能是病毒与cv的结果。交互。Bozorov等人[57研究了……的影响n attenuata则DCL沉默的表现Manduca sexta幼虫。他们发现了NaDCL2那NaDCL3, 和NaDCL4参与许多不同基因的调控,导致信号传导和防御代谢产物的激活,以应对食草动物的攻击。因此,像N.Attenuata DCLS.、棉花dcl显然在抗病食反防激活方面是重要的,因为它们在局部且尤其是通过蚜虫吸吮来清楚地调节。
dcl的抗病毒活性已被大量报道([58那59那60那61)等)。虽然DCL4是21-nt抗病毒siRNA的主要制造者,但DCL2在次要的22-nt siRNA介导的传递性病毒沉默中是必不可少的,并且可以补偿DCL4的缺失dcl4突变体(62那63那64那65].在potyvirus西葫芦黄花叶病毒(Zymv)感染n benthamiana例如,已经观察到DCL4限制病毒的全身运动[66].作者观察到双DCL2和4中的全身病毒积累的增强,特别是在三重敲低突变体DCL2 / 3/4中。检查调制DCLCLRDV在病毒感染过程中的表达表明,该病毒引起了强烈的系统性抑制DCL1那2 b那3 b, 和4.在易感的CV中。FM966在感染后的初始小时内。在抗性CV中未观察到这种激烈的抑制,其中所有这些的表达dcl仍然与被感染植物的模仿几乎类似。调查DCL在感染部位的表达调控表明FMDCL4比DODCL4,而这种高感应DCL4对初始感染的细胞的病毒限制不足。相比之下,两个FMDCL2a和B.几乎没有在接种叶诱导。其他作者曾报道说DCL2和DCL4可能在接种和系统叶不同的抗病毒活性[33那58那61].在这些研究中,观察到DCL4单独应对接种叶片的抗病毒沉默。然而,在全身叶子中,DCL2和DCL4都是触发病毒沉默所必需的。它也已经证明过DCL4可以表达下调DCL2表达式[58].调频DCL4过度表达可能会损害DCL2a和B.在感病棉花品种接种位点的表达。那一种llowing the cell-to-cell spread of the virus and establishment of systemic infection due to the noneffective intercellular antiviral activity of DCL2 at these sites. In DO-resistant plants, the high levels ofDCL2a和B.通过病毒的存在诱导可以有效地激活细胞间抗病毒沉默,导致在感染后的初始小时内将病毒限制为第一细胞 - 自主或接种的细胞,并且显着降低了病毒复制和中止感染完全扩散。
DCL2作用于细胞间VIGS,在病毒邻近的受体细胞中产生对抗病毒感染的第二前线[58].CLRDV与所有的polerovirus相似,只能在韧皮部的伴生细胞中复制DCL2在高水平的伴胞附近可以并处由22-nt的病毒小RNA介导强的抗病毒沉默,堵在耐DO植物随后组织病毒的传播。
Donaire等人[67]分析了来自8个不同属的9种病毒的vsirna。除tombusvirus外,大多数病毒的主要vsirna为21nt煤兰环斑病毒 -受感染的植物累积较高的22-NT vsirnas。最近,芸苔属植物黄化病毒(BRYV)在单一感染中分析vsiRNA积累N.benthamiana22 nt类代表了BrYV vsirna的优势类,其次是21 nt类[68].这些结果与我们以前的研究结果同意[53那54]和目前的研究,其中22-nt vsirna是polerovirus属其他两种病毒中最丰富的一类vsirna。22-nt vsirna的积累似乎是polerovirus感染的特征,突出了DCL2在抗病毒防御这些病毒中的重要作用,它可能超过DCL4。
除了经典的DCL4和DCL2抗病毒功能之外,若干作者还报告了DCL3通过从入侵病毒的高水平的24-NT SIRNA的生产来报告DCL3在病毒防御中的重要性[26那69那70],指导以前家庭成员切割病毒RNA或募集甲酸甲酯的病毒机制。在答:芥,DCL3还负责的正链RNA病毒的定向裂解,包括黄瓜花叶病毒(一种cucumovirus),油菜花叶病毒(烟草病毒)和萝卜皱纹病毒(carmovirus) (26那71.].因此,DCL3也在病毒沉默中起重要作用。在Clrdv感染的棉质中,GhDCL3a和B.在受感染的叶片(高水平表达)和系统叶片上诱导,表明这些dcl可能在病毒防御中发挥作用。
然而,我们的研究结果不排除其他与DCL2/4调制不直接相关的clrdv抗性机制在DO植物中活跃。这些抗性机制可能会降低病毒复制,从而降低这些植物的病毒胁迫水平。通过VIGS和CLRDV进一步侵染DO棉花,诱导每个棉花DCL基因单独或组合沉默,可以进一步验证本研究中观察到的DCL调节在DO棉花CLRDV抗性中的重要性。
结论
我们确定了g . raimondii就那g . arboreum和g .分子发现了DCL2和DCL3的重复。此外,我们发现g .分子dcl参与了polerovirus感染反应,特别是DCL2、DCL3和DCL4,病毒对这些dcl表达的调控可能对病毒的易感性和/或抗性反应至关重要。
方法
DCL家族的鉴定Gossypium
三种棉花的基因组序列,g . arboreum(BGI-CGB v2.0组装基因组),g . raimondii就(JGI组装v2.0数据)和g .分子acc。TM-1 (naun - nbi v1.1组装基因组),从植物带(http://www.phytozone.net./)及棉根(https://www.cottongen.org/)数据库。获得dicer样蛋白序列数据答:芥和o .漂白亚麻纤维卷从通用特征格式(GFF) le拟南芥信息资源(TAIR发布10,http://www.arabidopsis.org.)来自水稻基因组注释项目数据库(RGAP版本7,http://rice.plantbiology.msu.edu/index.shtml.).基因名称和ID列于其他文件中1在附加文件中2:表S1)。
利用ExPASy Compute pI/Mw工具预测棉花DCL蛋白的理化性质(http://au.expasy.org/tools/pi_tool.html.;bjellqvistetal bjellqvistetal,1993)。
染色体定位分析和系统发育树施工
使用MapInspect软件评估染色体中DCLS的位置(http://www.softsea.com/review/MapInspect.html),使用从基因组数据库中获得的每个开放读帧的起始和结束位置。
在MEGA 7.0软件中使用MUSCLE (Log-Expectation Multiple Sequence Comparison)比对和neighbor-Joining (NJ)方法构建系统发育树[72.,使用1000个复制的引导测试。Phytozome v12.1数据库的关键字搜索(https:////phytozome.jgi.doe.gov/pz.)国家生物技术信息数据库 - NCBI(https://www.ncbi.nlm.nih.gov进一步进行)以获得不同植物生物中的DCL基因。
Intron-Exon和DCL家族的域分析
基因结构显示服务器(http://gsds.cbi.pku.edu.cn/index.php),通过比较棉花的CDS,分析内含子-外显子结构DCL具有相应基因组序列的基因[45那73.].DCLS中的保守域通过智能识别(http://smart.embl-heidelberg.de.).
植物材料
两个陆地棉g .分子栽培品种用于DCL表达测定和病毒感染:ACC。fibermax966(FM966)(Aventis作物科学,澳大利亚)和ACC。Delta Opal(DO)(Delta和Pine Land Co.,美国)。Seeds由IMA,Insituto Matogrossense DoAlgodão,Primavera Do Leste,巴西Mato Grosso State,Mato Grosso State。如前所述的28 +/- 2°C在温室条件下植物在温室条件下生长[49].
棉花的器官DCL在萌发后30天(dag),收集独立植株的表达、叶片、芽、花和根的样本。调频和做。样品立即在液态氮中冷冻2保存至−80℃,直至RNA提取。
蚜虫接种与病毒侵染
棉 (陆地棉)植物的品种acc。FM966(对棉花蓝病敏感)和acc。在温室种植的DO(抗棉蓝病)在30 dag期感染棉花卷叶矮缩病毒(polerovirus CLRDV叶氏蓟体科),由具毒蚜虫(蚜虫棉如前所述,Glover)[56].将两个品种发育完全的叶片接种无毒蚜虫(脱毒蚜虫)。用双面胶带(3MM Co)将蚜虫限制在接种部位,接种药剂24 h后处死。在接种点周围用双面抽穗将蚜虫限制在接种叶上的接种点。
系统叶片,局部3-4叶在接种叶上方,在感染后24小时(HPI)和5,15和25天的感染后(DPI),具有CLRDV蚜虫或非毒性蚜虫。从相同的未感染植物的位置叶被用作未征收的对照。从3到5个独立接种植物中留下了每个生物重复。将样品储存在-80℃直至RNA分离和表达分析。
采用巢式RT-PCR技术扩增病毒外壳蛋白序列,对无蚜接种、感染CLRDV和未接种的所有样品进行检测[53].以CLRDV感病植株为对照。
实时定量RT-PCR(RT-qPCR的)
使用Invisorb Spin Plant RNA Kit (Invitek Molecular Co., Germany)分离总RNA。每个RNA样本的质量和浓度由琼脂糖凝胶电泳和NanoDrop 2000 (Thermo Fisher Scientific Co.)分光光度计测定。只使用260/280 nm比介于1.8-2.1和260/230比≥2.0的RNA样本。c-DNA第一链逆转录使用Revertaid First Strand cDNA, Synthesis Kit (Thermo Fisher Scientific Co.)按照制造商的说明进行。每个样品总RNA用DNAse I (Fermentas Co.)处理1微克,加入100 μM寡核苷酸dT24V引物合成cdna。g .分子DCL使用NCBI Primer-Blaster设计反向和转发引物(附加文件2:表S2)。根据制造商的说明,使用Maxima SYBR Green/ROX qPCR Master Mix(赛莫Fisher Scientific Co.)在7500 Fast Real-Time PCR系统(Applied Biosystems)中进行RT-qPCR。循环条件为95℃初始变性10 min, 95℃变性15 s, 60℃退火/拉伸30 s,循环40次。棉花GhmiR390和GhPP2A(磷酸酶2A催化亚基)作为内参基因进行分析DCL不同器官的表达,结果是通过△2−△△CT.方法用于分析DCL病毒感染和/或蚜虫接种期间的表达[51那52].棉花GhmiR390和GhPP2A(蛋白磷酸酶2),该基因以前被确定为CLRDV感染棉花研究的最佳内参基因[74.,将cDNA表达水平归一化。反应总体积为20 μL,其中SYBR绿主混料10 μL, cDNA模板2 μL, ddH 6 μL2O,和2μl的每个引物使终浓度为10μm。进行三种生物重复,每cDNA样品测定三种技术复制。
为了显示DCL在每个器官中的表达情况,需要一份热图dcl通过使用欧几里德距离的完整聚类方法分析建立表达式模式,并在R软件环境中计算。DCL CTS结果显示在附加文件中2:表S3。
CAV svirna的深度测序
利用巴西马托格罗索州感染棉花花青病病毒(CAV)的棉花叶片,利用Illumina平台进行总RNA提取、小RNA纯化和测序,步骤如下[54].
统计分析
DCL将不同样品在草食动物攻击和/或病毒感染下测定的相对表达水平与这些对照进行比较:未经处理的植物(对照)x蚜虫接种的植物进行草食动物表达分析,以及mock(无病毒蚜虫接种的植物)x clrdv -蚜虫接种的植物进行病毒感染使用参数单向方差分析P.≤0.05和P.≤0.01。为了检验来自FM和DO的dcl的相对表达水平是否有统计学意义,使用了T-student检验。
启动子地区顺表演元素分析
对于顺式调控元件存在于所述识别g .分子dcl,ATG星密码子上游1500个核苷酸序列从CottonGen网站(https://www.cottongen.org)和PlantCARE软件预测的顺式元素(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章中以及其补充信息文件中。
缩写
- CLRDV:
-
棉花卷叶矮缩病毒
- DCL:
-
Dicer-like蛋白质
- 做:
-
三角洲蛋白石棉花品种
- 调频:
-
Fibermax966棉花栽培
- GaDCL:
-
类似dicer的基因或蛋白质木本棉
- GhDCL:
-
类似dicer的基因或蛋白质陆地棉
- GrDCL:
-
类似dicer的基因或蛋白质Gossypium raimondii.
- RNAi:
-
RNA干扰
- vsiRNA:
-
病毒小干扰rna
参考
- 1.
Bartel DP。microrna:基因组学、生物起源、机制和功能。细胞。2004;116:281 - 97。https://doi.org/10.1016/s0092-8674(04)00045-5.
- 2.
亨德森IR,张X,鲁C,约翰逊L,迈尔斯BC,绿色PJ,雅各布森SE。解剖拟南芥蒂利亚纳Dicer功能在小RNA处理,基因沉默和DNA甲基化图案中。NAT Genet。2006; 38:721-5。https://doi.org/10.1038/ng1804..
- 3.
Borges F, Martienssen RA。植物中小rna不断扩展的世界。细胞生物学杂志。2015;16(12):727-41。https://doi.org/10.1038/nrm4085.
- 4.
刘QP,冯Y,朱ZJ。植物中的Dicer样(DCL)蛋白质。Funct综合基因组学。2009; 9(3):277-86。https://doi.org/10.1007/s10142-009-0111-5.
- 5.
Aliyari r,丁斯街。基于RNA的宿主免疫受体发起的基于RNA的病毒免疫。免疫素修订2009; 227:176-88。https://doi.org/10.1111/j.1600-065X.2008.00722.x.
- 6.
朱建平,朱建军。mirna和sirna在植物胁迫响应中的作用。生物物理学报。2012;19:137 - 48。https://doi.org/10.1016/j.bbagrm.2011.05.001.
- 7。
大厅TM。argonaute蛋白的结构和功能。结构。2005;13(10):1403 - 8。https://doi.org/10.1016/j.str.2005.08.00.
- 8。
关键词:Argonaute2, rna,重组人RISC中国生物医学工程学报。2005;12(4):340-9。https://doi.org/10.1038/nsmb918.
- 9。
拟南芥中一个依赖RNA的RNA聚合酶基因是由转基因介导的转录后基因沉默所必需的,而不是由病毒介导的。细胞。2000;101:543-53。
- 10.
王X,吴q,ito t,cillo f,li wx,chen x,yu jl,ding sw。RNAi介导的病毒免疫需要扩增拟南芥中病毒衍生的siRNA。Proc Natl Acad Sci USA。2010; 107:484-9。https://doi.org/10.1073/pnas.0904086107.
- 11.
伯恩斯坦E,考迪AA,哈蒙德SM,哈农GJ。双齿核糖核酸酶在RNA干扰起始步骤中的作用。大自然。2001;409:363-6。https://doi.org/10.1038/35053110.
- 12.
maris R, Fusaro AF, Smith NA, Curtin SJ, Watson JM, Finnegan EJ, Waterhouse PM。植物切丁的进化和多样化。2月。2006;580:2442-50。https://doi.org/10.1016/j.febslet.2006.03.072.
- 13.
Lee Y,Hur I,Park Sy,Kim Yk,Suh Mr,Kim VN。Pact在RNA沉默途径中的作用。Embo J. 2006; 25:522-32。https://doi.org/10.1038/sj.emboj.7600942.
- 14.
叶小春,Paroo Z,刘庆华。果蝇MicroRNA生成酶的功能解剖。J Biol Chem. 2007; 282:28373-8。https://doi.org/10.1074/jbc.M705208200.
- 15.
Dicer解旋酶结构域对于线虫内源性sirna的积累是必需的。RNA。2010; 16(5): 893 - 903。https://doi.org/10.1261/rna.2122010.
- 16.
Cenik ES, Fukunaga R, Lu G, Dutcher R, Wang YM, Hall TMT, Zamore PD。磷酸和R2D2限制了Dicer-2 (atp驱动的核糖核酸酶)底物的特异性。摩尔细胞。2011;42:172 - 84。https://doi.org/10.1016/j.molcel.2011.03.002.
- 17.
Macrae IJ,周K,李F,经济A,Brooks An,Cande Wz,Adams Pd,Douna Ja。双链RNA加工的结构基础。科学。2006; 311:195-8。https://doi.org/10.1126/science.1121638.
- 18。
MacRae IJ, Doudna JA。重新审视核糖核酸酶:对核糖核酸酶III家族酶的结构洞察。Curr Opin Struct Biol. 2007; 17:138-45。https://doi.org/10.1016/j.sbi.2006.12.002.
- 19。
Elbashir Sm,Harborth J,Lendeckel W,Yalcin A,Weber K,Tuschl T.21-核苷酸RNA的双链体介导培养的哺乳动物细胞中的RNA干扰。自然。2001; 411:494-8。https://doi.org/10.1038/35078107.
- 20.
Takeshita D,Zenno S,Lee WC,Nagata K,Saigo K,葡劳拉M.人类Dicer的C-末端RNase III结构域的同源二聚体结构和双链RNA切割活性。J Mol Biol。2007; 374:106-20。https://doi.org/10.1016/j.jmb.2007.08.069.
- 21.
张H,Kolb Fa,Jaskiewicz L,Westhof E,Filipowicz W.人类Dicer和细菌RNase III的单加工中心模型。细胞。2004; 118:57-68。https://doi.org/10.1016/j.cell.2004.06.017.
- 22.
Doyle M,Badertscher L,Jaskiewicz L,Güttingers,jurado s,hugenschmidt t,Kutay U,菲律宾语W.人类Dicer的双链RNA结合领域用作核定位信号。RNA。2013; 19:1238-52。https://doi.org/10.1261/rna.039255.113.
- 23.
Wostenberg C,拉里JW,萨胡d,Acevedo的R,夸尔斯KA,科尔JL,沙氏SA。人Dicer-dsRBD在加工小调控RNA的作用。Plos一个。2012; 7(12):e51829。https://doi.org/10.1371/journal.pone.0051829.
- 24.
Kini HK,Walton SP。单链RNA对人类加床的体外结合。费用。2007; 581:5611-6。https://doi.org/10.1016/j.febslet.2007.11.010.
- 25.
Moissiard G, Parizotto EA, Himber C, Voinnet O.在拟南芥中的传递性可以被启动,需要抗病毒药物Dicer-like 4和Dicer-like 2的冗余作用,并被病毒编码的抑制蛋白所抑制。RNA。2007; 13:1268 - 78。https://doi.org/10.1261/rna.541307.
- 26.
陈志强,王志强,王志强,等。植物DICER-like蛋白抗病毒防御机制的研究进展。科学。2006;313:68 - 71。https://doi.org/10.1126/science.1128214.
- 27.
Kurihara Y渡边Y。拟南芥通过Dicer-like 1蛋白功能的微rna生物发生。中国科学院院刊2004;101:12753-8。https://doi.org/10.1073/pnas.0403115101.
- 28.
Mlotshwa S, Pruss GJ, Peragine A, Endres MW, Li J, Chen X, Poethig RS, Bowman LH, Vance V. DICER-LIKE2在转基因的传递性沉默中起主要作用拟南芥.《公共科学图书馆•综合》。2008;3:e1755。https://doi.org/10.1371/journal.pone.0001755.
- 29.
Pontes O, Li CF, Costa Nunes P, Haag J, Ream T, Vitins A, Jacobsen SE, Pikaard CS。的拟南芥染色质修饰核siRNA途径涉及核仁RNA加工中心。细胞。2006;126:79 - 92。https://doi.org/10.1016/j.cell.2006.05.031.
- 30.
谢ZX,约翰森,古斯塔夫森,迦谢·克德,Lellis广告,Zilberman D,Jacobsen SE,Carrington JC。植物中小RNA途径的遗传与功能多样化。Plos Biol。2004; 2:642-52。https://doi.org/10.1371/journal.pbio.0020104.
- 31。
谢泽,Allen E, Wilken A, Carrington JC。DICER-LIKE 4在反式小干扰RNA生物发生和营养阶段变化中的作用拟南芥蒂利亚纳.国立台湾大学学报(自然科学版)2005;102:12984-9。https://doi.org/10.1073/pnas.0506426102.
- 32。
曹敏,杜鹏,王加霞,余永强,邱玉华,李伟,高尔昂C A,周超,李勇,丁少伟。病毒感染通过内源性sirna引起宿主基因的广泛沉默拟南芥.pnas。2014; 111(40):14613-8。https://doi.org/10.1073/pnas.1407131111.
- 33。
Dunoyer P, Himber C, Voinnet O. DICER-LIKE 4是RNA干扰所必需的,它产生21核苷酸的小干扰RNA成分,构成植物细胞间沉默信号。Nat麝猫。2005;37:1356-60。https://doi.org/10.1038/ng1675.
- 34.
王小波,Jovel J, Udomporn P,王勇,吴强,李文新,Gasciolli V, Vaucheret H,丁世文。21-核苷酸,而不是22-核苷酸,病毒二级小干扰rna直接有效的抗病毒防御,由两个合作的argonautes拟南芥蒂利亚纳.植物细胞。2011; 23:1625-38。https://doi.org/10.1105/tpc.110.082305.
- 35.
父母J-S,Bouteiller N,Elmayan T,Vaucheret H.各自的贡献拟南芥DCL2和DCL4对RNA沉默的影响。植物j . 2015; 81:223-32。https://doi.org/10.1111/tpj.12720.
- 36.
白敏,杨光国,陈文涛,毛志成,康海霞,陈光国,杨玉华,谢斌。基于Dicer-like、Argonaute和RNA依赖的RNA聚合酶基因家族的全基因组鉴定及其在病毒感染和非生物胁迫下的表达分析Solanum lycopersicum..基因。2012;501:52 - 62。https://doi.org/10.1016/j.gene.2012.02.009.
- 37.
水稻Dicer-like、Argonaute和RNA依赖RNA聚合酶基因家族的全基因组鉴定、组织和系统发育分析及其在生殖发育和胁迫中的表达分析BMC基因组学。2008;9:451。https://doi.org/10.1186/1471-2164-9-451.
- 38.
钱永强,程永华,程斌。玉米Dicer-like、Argonaute和RNA依赖RNA聚合酶基因家族的鉴定与鉴定。植物细胞。2011;30:1347 - 63。https://doi.org/10.1007/s00299-011-1046-6.
- 39.
赵克,赵立,陈Z,冯L,仁杰,蔡克,Xiang Y. Dicer样,argonaute和RNA依赖性RNA聚合酶基因族基因家族杨树trichocarpa:基因结构、基因表达、系统发育分析和进化。J麝猫。2015;94:317-21。
- 40.
赵辉,赵凯,王静,陈旭,陈智,蔡锐,向勇。葡萄植株Dicer-like、Argonaute和RNA依赖RNA聚合酶基因家族的综合分析葡萄).植物生长规律。2015;34:108-21。https://doi.org/10.1007/S00344-014-9448-7.
- 41.
曹JY,徐YP,李伟,李SS,拉赫曼H,蔡XZ。全基因组鉴定的切酶 - 样,的Argonaute,和RNA依赖性RNA聚合酶的基因家族中芸苔属植物物种和功能分析拟南芥在抵抗力的同源物菌核病sclerotiorum.植物科学学报2016;7:1614。https://doi.org/10.3389/fpls.2016.01614.
- 42.
Garg V,Agarwal G,Pazhamala Lt,Nayak Sn,Kudapa H,Khan AW,Doddamani D,Sharma M,Kishor PB,Varshney RK。小RNA生物发生的基因组鉴定,表征和表达分析,揭示了它们在三种豆科作物中的生物应激反应调节中的作用。前植物SCI。2017; 8:488。https://doi.org/10.3389/fpls.2017.00488.
- 43.
胡椒粉DCL、AGO和RDR基因家族的全基因组分析甜椒l .)。国际分子生物学杂志。2018;19:e1038。https://doi.org/10.3390/ijms19041038.
- 44.
Paterson AH, Wendel JF, Gundlach H, Guo H, Jenkins J, Jin D, Llewellyn D, Showmaker KC, Shu S, Udall J, Yoo M-J, Byers R, Vaslin MF,等。重复多倍化Gossypium基因组与可纺棉纤维的进化。大自然。2012;492:423-7。https://doi.org/10.1038/nature11798.
- 45.
李锋,范G,鲁C,小G,邹C,Kohel RJ,马Z,尚H,马X,吴Ĵ,梁X,黄G,珀西RG,刘K,阳W,陈炜,杜X施C,袁媛,叶W,等人。种植陆地棉的基因组序列(陆地棉TM-1)提供对基因组进化的见解。自然。2015; 3:524-30。https://doi.org/10.1038/nbt.3208.
- 46.
王克,王z,李f,ye w,王俊,歌,yue z,cong l,尚h,zhu s,zou c,李q,元y,lu c,wei h等。二倍体棉花草案Gossypium raimondii..Nat麝猫。2012;44:1098 - 103。https://doi.org/10.1038/ng.2371.
- 47.
李F,风扇g,王k,孙子f,元y,歌,李q,ma z,lu c,zou c,chen w,梁x,尚h,刘开,shi c,xiao g,gou c,ye w等人。栽培棉的基因组序列木本棉.Nat麝猫。2014;46:567 - 72。https://doi.org/10.1038/ng.2987.
- 48.
张涛,胡颖,姜伟,方磊,关旭,陈静,张健,Saski CA, Scheffler BE, Stelly DM, Hulse-Kemp AM,万强,刘波,刘超,王胜,潘敏,王颖,王德华,叶伟,常磊,等。异源四倍体棉花的测序(陆地棉l . acc。TM-1)为纤维改良提供资源。生物科技Nat》。2015; 33:531-7。https://doi.org/10.1038/nbt.3207.
- 49.
Correa RL, Silva TF, Simões-Araujo JL, Barroso PA, Vidal MS, Vaslin MF。家族病毒的分子特征叶氏蓟体与棉花蓝病有关。拱微生物学报。2005;150:1357 - 67。https://doi.org/10.1007/s00705-004-0475-8.
- 50.
Distefano AJ, Bonacic Kresic I, Hopp HE。与棉花蓝病有关的一种病毒——棉花卷叶矮化病毒的全基因组序列证实,它是该属的一个新成员Polerovirus.拱微生物学报。2010;155:1849-54。https://doi.org/10.1007/s00705-010-0764-3.
- 51.
Schmittgen TD, Livak KJ。采用比较Ct法分析实时荧光定量PCR数据。Nat Protoc。2008;3(6):1101 - 8。
- 52.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta Ct)方法分析相对基因表达数据。方法。2001;25:402-8。https://doi.org/10.1006/meth.2001.1262.
- 53.
Silva TF, Romanel EAC, Andrade RRS, Farinelli L, Osteras M, delen C, Correa RL, Scharago CEG, Vaslin MFS。棉花感染polerovirus后的小干扰rna谱棉花卷叶矮化vírus.BMC Mol Biol. 2011; 12:1471-2199。https://doi.org/10.1186/1471-2199-12-40.
- 54。
Andrade RSR,Vaslin MFS。搜索小RNA:使用小型RNA库数据进行病毒基因组件的图形界面工具。Virol J. 2014; 7:11-45。https://doi.org/10.1186/1743-422X-11-45.
- 55。
Mallory AC,VAUCHERET H. MicroRNA的功能和植物中相关的小RNA。NAT Genet。2006; 38:S31-6。https://doi.org/10.1038/ng1791.
- 56。
Romanel E,Silva TF,CorrêaRL,Farinelli L,Hawkins JS,Schrago Ce,Vaslin MF。全球棉花和转座子衍生的小RNA(陆地棉)中棉花卷叶矮polerovirus(CLRDV)感染。植物mol biol。2012; 80(4-5):443-60。https://doi.org/10.1007/s11103-012-9959-1.
- 57。
Bozorov TA, Pandey SP, Dinh ST, Kim SG, Heinrich M, Gase K, Baldwin IT。类dicer蛋白及其在植物-草食动物相互作用中的作用烟草衰减。J Intent Plant Biol。2012; 54:189-206。https://doi.org/10.1111/j.1744-7909.2012.01104.x.
- 58.
秦超,李波,范勇,张新宇,王辉,史宁,张鹏,等。Dicer-like蛋白2和4在细胞内和细胞间抗病毒沉默中的作用。植物杂志。2017;174:1067 - 81。https://doi.org/10.1104/pp.17.00475.
- 59.
迪亚兹Pendon JA,李锋,李W-X,鼎S-W上。抗病毒沉默抑制黄瓜花叶病毒2B蛋白拟南芥与大大减少三类病毒小干扰rna的积累有关。植物学报2007;19:2053-63。https://doi.org/10.1105/tpc.106.047449.
- 60。
张晓霞,张旭,李东,曲峰萝卜褶皱病毒感染的拟南芥植物依赖于RNA沉默的防御,要求DCL2,前2和Hen1。J病毒。2012; 86:6847-54。https://doi.org/10.1128/JVI.00497-12.
- 61。
Garcia-Ruiz H, Takeda A, Chapman EJ, Sullivan CM, Fahlgren N, Brempelis KJ, Carrington JC。拟南芥RNA依赖的RNA聚合酶和dicer-like蛋白在抗病毒防御和小干扰RNA生物发生期间芜菁花叶病毒感染。植物细胞。2010; 22:481-96。https://doi.org/10.1105/tpc.109.073056.
- 62。
Gasciolli V,Mallory AC,Bartel DP,Vaucheret H.部分冗余功能拟南芥DICER样酶和DCL4生产反式作用的siRNA的作用。Curr Biol。2005; 15:1494-500。https://doi.org/10.1016/j.cub.2005.07.024.
- 63。
Schauer SE, Jacobsen SE, Meinke DW, Ray A. DICER-LIKE1:盲人和大象在拟南芥发展。植物科学进展。2002;7:487-91。https://doi.org/10.1016/s1360-1385(02)02355-5.
- 64.
张志强,张志强,张志强,等拟南芥DCL2在开发中和DCL4在生成病毒siRNA时的新功能。Embo J. 2006; 25:3347-56。https://doi.org/10.1038/sj.emboj.7601217.
- 65.
曲凡,叶雪梅,莫里斯TJ。拟南芥DRB4,AGO1,AGO7和RDR6参加由DCL1负调控的DCL4发起的抗病毒RNA沉默途径。国家科学院院刊美A. 2008; 105:14732-7。https://doi.org/10.1073/pnas.0805760105.
- 66.
Cordero T, Cerdán L, Carbonell A, Katsarou K, Kalantidis K, Daròs JA。Dicer-like 4限制了系统的移动西葫芦黄花叶病毒在烟草benthamiana.Mol植物微生物相互作用。2017; 30:63-71。https://doi.org/10.1094/MPMI-11-16-0239-R.
- 67.
植物病毒小rna的深度测序揭示了病毒基因组的有效和广泛的靶向性。病毒学。2009;392:203-14。https://doi.org/10.1016/j.virol.2009.07.005.
- 68.
周传军,张新宇,刘思宇,王勇,李大伟,于建林,韩传刚。BrYV和pemv2的协同感染增加了BrYV和来自BrYV的sirna的积累烟草benthamiana.SCI批准。2017; 7:45132。https://doi.org/10.1038/srep45132.
- 69.
Fusaro AF,Matthew L,Smith Na,Curtin SJ,Dedic-Hagan J,等。植物中的RNA干扰诱导发夹rnas通过病毒防御途径作用。Embo Rep。2006; 7:1168-75。https://doi.org/10.1038/sj.embor.7400837..
- 70.
Llave C.病毒衍生的植物-病毒相互作用核心小干扰rna。植物科学进展。2010;15(12):701-7。https://doi.org/10.1016/j.tplants.2010.09.001.
- 71.
Blevins T, Rajeswaran R, Shivaprasad PV, Beknazariants D, Si-Ammour A, Park HS, Vazquez F, Robertson D, Meins F,等。四种植物Dicers介导病毒小RNA生物发生和DNA病毒诱导沉默。核酸学报2006;34:6233-46。https://doi.org/10.1093/nar/gkl886..
- 72.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。https://doi.org/10.1093/molbev/msw054.
- 73.
胡刚,许俊,刘俊杰,陈胜,温德尔JF。异源多倍体棉花基因表达的新颖性:蛋白质组学的观点。遗传学。2015;1:91 - 104。https://doi.org/10.1534/genetics.115.174367.
- 74.
Fausto Aks,Silva TF,Romanel E,Vaslin M. micrornas作为棉花中定量PCR的参考基因。Plos一个。2017; 12:E0174722。https://doi.org/10.1371/journal.pone.0174722.
确认
我们感谢Sarah M. Nardeli的帮助和感激的讨论。
资金
这项研究得到了Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq/巴西)、Fundação de Amparo à Pesquisa do Estado do里约热内卢de Janeiro (FAPERJ/巴西)和Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP/巴西)的资助。moh和AKSF分别获得了Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES/Brazil)的硕士和博士发展资助。没有一个资助机构参与研究的设计、数据的收集、分析和解释,也没有参与手稿的写作,手稿完全由作者完成。
作者信息
从属关系
贡献
MFSV和ER构思和设计了实验。妈妈和AKSF进行了实验。TFS,MOM,AKSF,AF和ER进行生物信息学分析和分析数据。FAFG进行转录组分析。妈妈和mfsv写了这篇论文。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1。
棉花DCL c-DNA和蛋白质序列。
附加文件2:表S1。
中dcl的基因名称和基因ID拟南芥那Medicago.、大米、杨树那Physcomatrella.和小道消息。表S2。引物及扩增子特性清单DCL基因。表S3。DCL在器官中的表达。图S1。DCL扩增熔化曲线。图S2。表达式模式g .分子acc。基于转录组测序数据的FM DCL基因。
附加文件3:图S3。
顺-元素在DCL启动子中与增强子元素分布。图S4。启动子序列陆地棉DCLS。
额外的文件4。
所有人的职位顺元素中发现g . hirustumdcl推动者。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
莫拉,作案手法,福斯托,a.k.s.,法内利,A。等等。棉花Dicer-like家族的全基因组鉴定及DCL表达对生物胁迫的响应分析BMC植物杂志19,503(2019)。https://doi.org/10.1186/s12870-019-2112-4
已收到:
公认:
发表:
关键词
- 棉花
- g .分子
- DCL
- Dicer-like
- CLRDV
- 生物压力