- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
减轻休眠gydF4y2BaBrassica oleraceagydF4y2Ba使用NO和KAR1具有乙烯生物合成途径,ROS和抗氧化酶的种子进行修饰gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19.gydF4y2Ba文章编号:gydF4y2Ba577.gydF4y2Ba(gydF4y2Ba2019年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
种子休眠是一个普遍的状况,其中种子不能发芽,即使是在有利的环境条件。收获gydF4y2BaBrassica oleraceagydF4y2Ba(大白菜)种子是休眠,通常在21°C时发芽(差)。本研究研究了乙烯,一氧化氮(NO)和Karrikin 1(Kar1)在次级休眠的休眠释放中的连接gydF4y2BaBrassica oleraceagydF4y2Ba种子。gydF4y2Ba
结果gydF4y2Ba
NO和KAR1能诱导种子萌发,并能刺激乙烯和1-氨基环丙烷-1-羧酸(ACC)的生成,以及乙烯生物合成酶ACC氧化酶(ACO)[1]和ACC合成酶(ACS)[2]的生成。在NO和KAR1存在的情况下,ACS和ACO活性分别在36和48 h达到最大值。乙烯的抑制剂2,5-降冰片二烯(NBD)有不良反应gydF4y2BaBrassica oleraceagydF4y2Ba种子萌发中的NO和KAR1的存在(抑制接近50%发芽的)。从NO和KAR1在次级休眠的发芽带来的好处gydF4y2BaBrassica oleraceagydF4y2Ba种子也与反应性氧物质(ROS)的显着增加有关(H.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ),并且在早期阶段发芽抗氧化酶活性。过氧化氢酶(CAT)和谷胱甘肽还原酶(GR)活性增加分别为2 d和4 d,处理后,而在超氧化物歧化酶(SOD)的活性,观察到下NO和KAR1应用没有显著变化。H中增加gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba在整个培养过程中观察到˙ˉ水平,在NO和KAR1存在的情况下增加了乙烯产量。NO和KAR1处理降低了ABA含量,增加了GA含量。用7个乙烯生物合成ACC合成酶(ACS)基因、2个乙烯受体(ETR)基因和1个ACO基因进行基因表达研究。我们的研究结果为NO和KAR1存在时乙烯参与诱导种子萌发提供了更多的证据。七分之三的乙烯生物合成基因(gydF4y2BaBoacs7,Boacs9.gydF4y2Ba和gydF4y2BaBOACS11gydF4y2Ba),两个乙烯受体(gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba)和一个ACO基因(gydF4y2BaBoaco1.gydF4y2Ba)在NO和KAR1存在时上调。gydF4y2Ba
结论gydF4y2Ba
因此,ACS活性、ACO活性和不同乙烯相关基因的表达增加,修改了ROS水平、抗氧化酶活性和乙烯生物合成途径,并成功地消除了(近98%)种子的次生休眠gydF4y2Ba甘蓝olereacegydF4y2Ba7天内的种子和kar1申请。gydF4y2Ba
背景gydF4y2Ba
种子休眠是一种普遍的条件,即使在有利的环境中也无法发芽种子[gydF4y2Ba1gydF4y2Ba].种子休眠可分为两种类型:gydF4y2Ba1gydF4y2Ba]主要休眠和[gydF4y2Ba2gydF4y2Ba]次级休眠。初级休眠受到环境因素和在种子发育的后期脱落酸(ABA)之间的相互作用引起的,而次级休眠在不同的发展阶段诱导受非生物胁迫包括缺氧,温度和光[引起gydF4y2Ba2gydF4y2Ba].缺氧可以增加二次休眠的强度[gydF4y2Ba2gydF4y2Ba].许多植物激素如细胞分裂素、油菜素内酯、一氧化氮和乙烯可以在减缓种子休眠和萌发中发挥关键作用[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].不同植物物种的休眠种子发芽,也可通过称为karrikin-1(KAR1)源自植物的烟化合物或丁烯酸内酯[调节gydF4y2Ba5gydF4y2Ba].据推测,卡瑞金斯是一个不同亚型的家族。KARs组中的六种亚型(KAR1至KAR6)和烟雾中的其他亚型[gydF4y2Ba6gydF4y2Ba],这些内源性化合物被认为是植物的激素[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
NO是一种信号传导分子,与植物激素联营打破种子休眠[gydF4y2Ba8gydF4y2Ba].在种子萌发过程中,no依赖蛋白的翻译后修饰是关键机制[gydF4y2Ba9gydF4y2Ba].酸化KNOgydF4y2Ba2gydF4y2Ba,gydF4y2BaS-nitroso-N-acetylpenicillaminegydF4y2Ba(SNAP),和gydF4y2BaS-nitrosoglutathionegydF4y2Ba(GSNO)是否的主要捐助者,这有助于释放不同植物种类的种子的休眠状况,例如莴苣,红外仔猪,大苹果[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].以往的研究表明,在一氧化氮和乙烯生物合成的相互作用下,苹果种子可以实现休眠释放[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba].gydF4y2Ba
称为乙烯植物激素参与在植物中的许多重要的机制,如熟化和反应以各种应力[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba].它在对早期萌发和减轻种子休眠的缓解方面也具有关键作用[gydF4y2Ba18.gydF4y2Ba].S-腺苷甲硫氨酸产生在种子中乙烯两个步骤:[gydF4y2Ba1gydF4y2Ba的转换gydF4y2Ba1-氨基环丙烷-1-羧酸gydF4y2Ba(ACC)存在ACC合成酶(ACS);和[gydF4y2Ba2gydF4y2Ba] ACC的氧化[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba,这与从其他植物部位发现的途径相同。ACC合酶被认为是乙烯生产的必需酶,而ACO是一种控制乙烯进化以打破种子休眠的酶[gydF4y2Ba20.gydF4y2Ba].在不同的植物物种中,ACS和ACO是两个家族,都包含多个基因[gydF4y2Ba21.gydF4y2Ba].这些科的成员调节种子从休眠到非休眠的过渡[gydF4y2Ba22.gydF4y2Ba].在寒冷的压力下,一切gydF4y2Baataco.gydF4y2Ba基因及两种ACS基因(gydF4y2BaAtACS2gydF4y2Ba和gydF4y2BaAtACS11gydF4y2Ba)被下调gydF4y2BaA. Thaliana.gydF4y2Ba[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba),而gydF4y2BaFSACO1.gydF4y2Ba转录水平上调以破坏种子休眠gydF4y2BaFagus sylvaticagydF4y2Ba[gydF4y2Ba26.gydF4y2Ba].在小麦籽粒中,有的表达水平gydF4y2BaTaACOsgydF4y2Ba成熟后基因增加[gydF4y2Ba27.gydF4y2Ba].gydF4y2Ba
活性氧(ROS)和活性氮(如羟自由基(gydF4y2Ba•gydF4y2BaOH),过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba),超氧阴离子(OgydF4y2Ba2gydF4y2Ba˙ˉ)、羟胺和硝酸盐有助于缓解多种植物的种子休眠。gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].当活性氮种或活性氧种达到一定水平时,种子通常开始发芽[gydF4y2Ba31.gydF4y2Ba].ROS累积释放向日葵种子休眠[gydF4y2Ba32.gydF4y2Ba].适当的ROS水平与其化合物的浓度和酶活性密切相关,如过氧化氢酶(CAT),谷胱甘肽还原酶(GR),超氧化物歧化酶(SOD),单去氢抗坏血酸还原酶(MDHAR),过氧化物酶,以及非酶活性化合物,如抗坏血酸[gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba,gydF4y2Ba32.gydF4y2Ba].在单子叶植物和双子叶植物中,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba已被认为是释放种子休眠的必需活性氧[gydF4y2Ba33.gydF4y2Ba].在转化猫开始其过程后,在SOD存在下转化为过氧化氢转化为过氧化氢并断裂gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba进入氧气和水,这两个酶促抗氧化剂SOD和猫也与抗坏血酸谷胱甘肽循环,脱氢血杂化酶(DHAR),抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)合作[gydF4y2Ba34.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba].早先的研究探讨了,灵敏度和平衡GA和ABA之间是种子休眠调节的原因[gydF4y2Ba36.gydF4y2Ba].ABA是种子中的一种关键激素,它也负责维持种子的休眠,因此ABA水平的降低降低了种子的休眠[gydF4y2Ba37.gydF4y2Ba].GA也被认为是一种重要的激素,有助于释放种子休眠。在植物数量上,GA调节种子萌发,减少休眠,而ABA调节种子休眠[gydF4y2Ba38.gydF4y2Ba].gydF4y2Ba
之前的数据显示,收获后,gydF4y2BaBrassica oleraceagydF4y2Ba(大白菜)种子在一段时间内表现出休眠[gydF4y2Ba39.gydF4y2Ba].gydF4y2Ba芸苔gydF4y2Ba种类有没有或很少初级休眠,因为主要休眠通常野生植物建立[gydF4y2Ba39.gydF4y2Ba].然而,环境压力下,二次休眠可在诱导gydF4y2Ba芸苔gydF4y2Ba品种(gydF4y2Ba39.gydF4y2Ba].在油菜籽中,一些非生物因素如温度、光照强度、湿度和气压的变化都会对种子的休眠和萌发产生影响[gydF4y2Ba40gydF4y2Ba].成功的破损gydF4y2Ba芸苔gydF4y2Ba种子休眠已记录的特定条件,例如光/暗制度下;交替的昼/夜温度;和HCN,次氯酸钠,NO和乙烯的相互作用[gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].因此,本研究的目的是检查休眠的萌发诱导gydF4y2BaBrassica oleraceagydF4y2Ba由NO和KAR1种子与乙烯改性,ROS的控制相关联的(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ)gydF4y2Ba,以及酶抗氧化活性。gydF4y2Ba
结果gydF4y2Ba
NO和KAR1对发芽的影响gydF4y2Ba
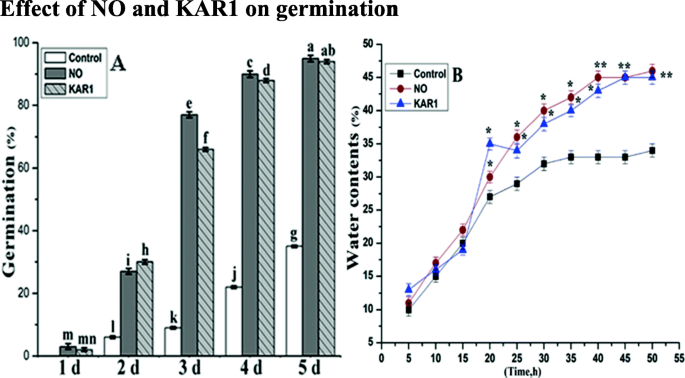
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M) are very effective in breaking seed dormancy and increasing seed germination. Secondary dormantBrassica oleraceagydF4y2BaL.种子用没有(5 mm)和Kar1(3×10gydF4y2Ba- 9gydF4y2Ba米)。在有利条件下,未治疗的二级休眠gydF4y2BaBrassica oleraceagydF4y2Ba年代eed年代were unable to germinate, and after 3 days of sowing only 9% germination was noted at 21 °C, as shown in Fig.1gydF4y2Baa.但在no和KAR1处理下,48 h后萌发率提高。氮氧化物和KAR1处理4、5 d后,种子发芽率提高更明显。发芽率与处理时间有很好的相关性;随着处理时间的延长,几乎所有种子都能萌发。我们观察到一氧化氮和karrikin1的作用依赖于治疗时间。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba)种子的发芽率,gydF4y2BabgydF4y2Ba二次休眠中的水含量gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba和gydF4y2BaPgydF4y2Ba≤0.01。卡尔,karrikin1;不,一氧化氮;h,小时gydF4y2Ba
为了检验NO和KAR1对水分吸收能力的影响,进行了二次休眠gydF4y2BaBrassica oleraceagydF4y2Ba种子在水中培养。记录NO和kar1处理种子5、10、20、30、40和50 h的水分含量。gydF4y2BaBrassica oleraceagydF4y2Ba用NO或KAR1处理的种子显示出水吸收的快速增加,孵育初始20小时后达到28-35%(图。gydF4y2Ba1gydF4y2Bab)。在Kar1 30小时后,没有治疗,观察到38-40%的水吸水。此外,在kar1中的40小时后,kar1和否,水吸收增加至约42-45%,并继续略微增加,直至50小时孵育结束。gydF4y2Ba
过氧化氢和超氧阴离子积累gydF4y2Ba
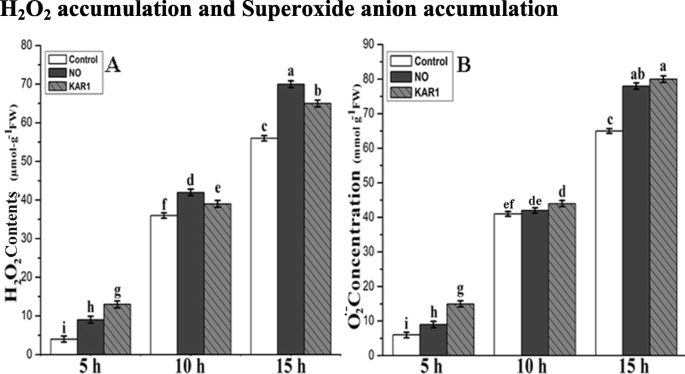
如上所述,在活性氧和酶活性到一定水平的增加可以减轻种子休眠。由于这些结果,我们还测量了^ hgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba以及处理过和未处理过的样品中超氧阴离子的浓度。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Baconcentration was measured after 1, 2, 3 and 4 d of treatments with NO (5 mM) and KAR1 (3 × 10- 9gydF4y2Ba米)。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在NO和1,2,3和4d后的kar1处理期间观察到浓度(图。gydF4y2Ba2gydF4y2Baa)和h的水平gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在对照样本中低于治疗样本。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度为6.5 μmol ggydF4y2Ba−1gydF4y2Ba在水中吸收的1 d后的对照样品中的FW,并且在否或kar1处理下增加超过双重。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba1天后浓度记录为6.5(μmol-ggydF4y2Ba−1gydF4y2BaFW)对照样品中,15(微摩尔 - 克gydF4y2Ba−1gydF4y2BaFW)和17 (μmol-ggydF4y2Ba−1gydF4y2BaFW)。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba2 d后浓度迅速升高至57 (μmol-ggydF4y2Ba−1gydF4y2BaFW)和46 (μmol-ggydF4y2Ba−1gydF4y2Ba分别在NO和KAR1处理下。处理3 d后,浓度为65 (μmol-g)gydF4y2Ba−1gydF4y2BaFW)在对照样品中,80(μmol-ggydF4y2Ba−1gydF4y2BaFW)在没有处理过的样品和78(μmol-ggydF4y2Ba−1gydF4y2BaFW)。该极大值hgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaNO和KAR1处理第4 d结束时,浓度显著增加。处理4 d后,浓度为74 (μmol-g)gydF4y2Ba−1gydF4y2BaFW), 85 (μmol-ggydF4y2Ba−1gydF4y2BaFW)和82 (μmol-ggydF4y2Ba−1gydF4y2BaFW)。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba) HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,gydF4y2BabgydF4y2BaOgydF4y2Ba2gydF4y2Ba- •gydF4y2Ba在二级休眠gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2,gydF4y2Ba过氧化氢;OgydF4y2Ba2gydF4y2Ba• -gydF4y2Ba超氧阴离子,h,小时gydF4y2Ba
在含水中吸收的1,2,3和4d后的未处理样品中,超氧化物阴离子浓度较低。在Kar1的存在下,我们记录了超氧化物积累的相当大的增加,而在1d中没有比kar1的刺激效果较低的样品(图。gydF4y2Ba2gydF4y2Bab)。在2,3和4d的NO或kar1溶液中孵育后,超氧化物阴离子水平迅速增加(图。gydF4y2Ba2gydF4y2Bab).对照样品1 d后超氧阴离子水平为16 (μmol-g)gydF4y2Ba−1gydF4y2BaFW),19(μmol-ggydF4y2Ba−1gydF4y2BaFW)和18 (μmol-ggydF4y2Ba−1gydF4y2BaFW)。2 d后超氧阴离子浓度增加至51 (μmol-g)gydF4y2Ba−1gydF4y2BaFW), 55 (μmol-ggydF4y2Ba−1gydF4y2BaFW)NO下,和58(微摩尔 - 克gydF4y2Ba−1gydF4y2BaFW)。处理3 d后,超氧阴离子水平为75 (μmol-g)gydF4y2Ba−1gydF4y2BaFW), 81 (μmol-ggydF4y2Ba−1gydF4y2Bafw)在否,84(μmol-ggydF4y2Ba−1gydF4y2BaFW)。处理4 d后,超氧阴离子水平上升至79 (μmol-g)gydF4y2Ba−1gydF4y2BaFW)在对照样品中,86(μmol-ggydF4y2Ba−1gydF4y2Bafw)在否,88(μmol-ggydF4y2Ba- 1gydF4y2BaFW)。gydF4y2Ba
SOD,CAT和GR的活动gydF4y2Ba
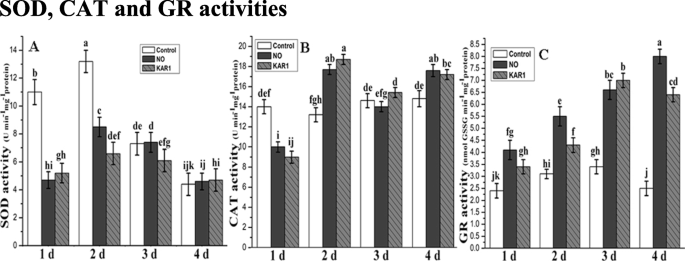
酶活性的不平衡也会导致种子休眠。二次休眠gydF4y2BaBrassica oleraceagydF4y2Ba种子用没有(5mm)和Kar1(3×10)治疗gydF4y2Ba- 9gydF4y2BaM)处理1、2、3、4 d,测定SOD、CAT和GR活性。SOD活性在对照中最高gydF4y2BaBrassica oleraceagydF4y2Ba1 d后胚胎(11 u mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白质)和2 d (13 U mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白),2-2和2-3倍较高,比处理的样品(图显著不同。gydF4y2Ba3.gydF4y2Ba一个)。这些结果证实处理的和非处理的胚胎之间的SOD活性的差异,和SOD水平如何逐渐后3和4 d减小。没有控制,NO和KAR1处理之间显著差异观察到的后治疗4 d中。总体而言,SOD活性的增加治疗的时间减少。SOD活性后1,2,3和4中d下NO或KAR1治疗比对照样品的样品低。另外,NO应用的SOD活性后2 d比KAR1处理的样品相对较高。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba)草皮,gydF4y2BabgydF4y2Ba猫,gydF4y2BacgydF4y2Ba二次休眠的遗传物gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;SOD,超氧化物歧化酶;CAT,过氧化氢酶;GR,谷胱甘肽还原酶;d,天gydF4y2Ba
过氧化氢酶活性gydF4y2BaBrassica oleraceagydF4y2Ba留在对照样品中一个稳定的水平在整个实验期间的胚胎;然而,后在水中2 d吸的,值降低(图gydF4y2Ba3.gydF4y2Bab). NO和KAR1处理的胚胎在2 d和4 d后CAT活性略有升高。在KAR1处理下,CAT活性达到最大值(19 U min)gydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白质)在2 d之后;在没有治疗下,最大值为18(UmgydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白);在对照样品中,最大CAT值(15 U mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白)中的溶液后3 d记录。gydF4y2Ba
在对照样品中记录最低GR活性。GR活性增加到3.3(Nmol GSSG mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白)对照样品中后2和3 d,但经过4 d中,GR活性又回到它的初始速度(图gydF4y2Ba3.gydF4y2BaC)。Meanwhile, in treated embryos, the GR activity increased continuously during germination with NO treatment, and GR values increased about three times and were significantly different than the control embryos after 4 days of imbibition (Fig.3.gydF4y2BaC)。最大GR值8(Mol GSSG mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba在没有治疗的4天后记录蛋白质;根据Kar1处理,最大值7(Mol GSSG mingydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白)中的溶液后处理3 d测定。gydF4y2Ba
KAR1和NO对ABA和GA含量的影响gydF4y2Ba
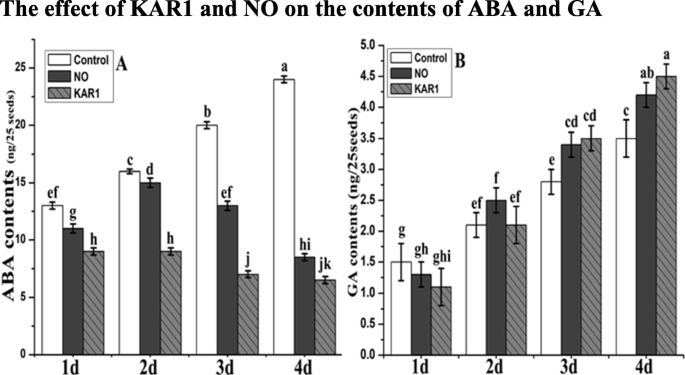
ABA和GA之间的平衡是调控休眠和萌发的关键。NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M) are very helpful to remove seed dormancy and increase seed germination. To check this we measured the ABA and GA contents in the presence of NO (5 mM) and KAR1 (3 × 10- 9gydF4y2BaM)为1、2、3、4 d。gydF4y2Ba4gydF4y2Baa和b)。我们记录了对照样品在整个孵育期ABA和GA含量的增加规律。未处理样品在施用4 d后ABA含量最高(24 ng/25种子),GA含量最高(5.5 ng/25种子)。gydF4y2Ba4gydF4y2Ba施用KAR1 4 d后ABA含量最低(6.5 ng/25粒)。在整个孵化期,赤霉素含量显著增加。在培养4 d后,在KAR1存在的情况下,GA含量升高(图1)。gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2BaABA含量,gydF4y2BabgydF4y2Ba次级休眠的GA内容gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;ABA,脱落酸;GA,赤霉酸;d,天gydF4y2Ba
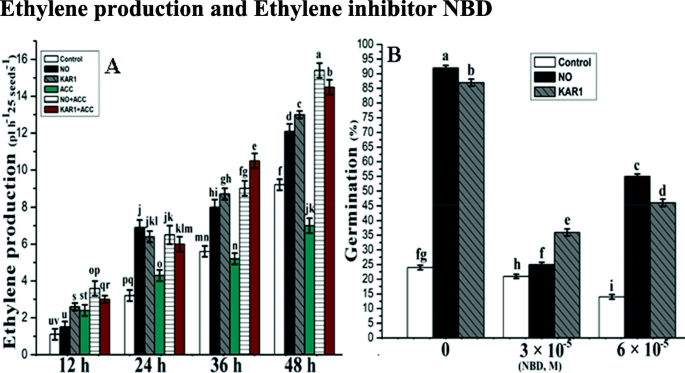
乙烯生产和乙烯抑制剂NBDgydF4y2Ba
已知乙烯生产的增加在减轻种子休眠方面发挥着重要作用。为了验证这一点,我们在乙烯抑制剂NBD的存在下测量乙烯生产,并在NO(5mm)和Kar1(3×10)存在下乙烯产生的增加/降低gydF4y2Ba- 9gydF4y2Ba米)。在不同的吸胀时间点(12、24、36和48 h),测定了水、NO和kar1处理下的乙烯生成速率(图2)。gydF4y2Ba5gydF4y2Baa).种子在NO、KAR1或水中培养12、24、36、48 h。Acc (1 × 10gydF4y2Ba- 4.gydF4y2BaM)也被应用,或单独或联合NO或KAR1。NO孵育12 h后,乙烯水平较低。未经处理的种子在相对稳定的低水平培养24小时后开始产生乙烯。然而,在ACC存在的情况下,乙烯产量没有显著变化。NO和KAR1与ACC联合应用后,48h后乙烯产量增加了两倍左右,表明ACO被激活。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba)乙烯生产,gydF4y2BabgydF4y2BaNBD处于次级休眠状态gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;NBD.gydF4y2Ba,gydF4y2Ba2,5-降冰片二烯;h,小时gydF4y2Ba
乙烯结合抑制剂,NBD(6×10gydF4y2Ba- 5gydF4y2Ba和3. × 10- 5gydF4y2Ba(M)还研究了乙烯是否参与了次生休眠种子对NO和KAR1的响应。gydF4y2BaBrassica oleraceagydF4y2Ba对照样品在21°C下4 d后种子萌发较差。gydF4y2Ba5gydF4y2Bab),而没有(5 mm)和kar1处理的种子(3×10gydF4y2Ba- 9gydF4y2BaM)萌发率为92%。我们的实验还表明,像NBD这样的乙烯信号抑制剂可以显著抑制种子的萌发gydF4y2Ba芸苔gydF4y2BaNO和KAR1诱导的种子。NO种子的萌发率为25-55%,KAR1种子的萌发率为36-46%。gydF4y2Ba5gydF4y2Bab)。gydF4y2Ba
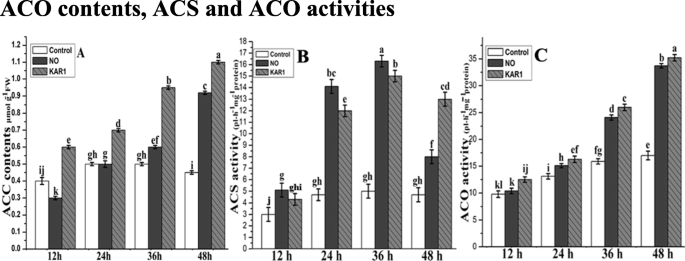
ACS和ACO的ACC含量和活性gydF4y2Ba
ACC是乙烯生物合成的直接前体。为了测定ACC含量,将种子置于NO (5 mM)和KAR1 (3 × 10)中培养gydF4y2Ba- 9gydF4y2Ba M) solutions or in water for 12, 24, 36, and 48 h. ACC contents recorded at 12 and 48 h of incubation in water were 0.4 and 0.45 μmol g−1gydF4y2Ba弗兰克-威廉姆斯。增加不大(0.5 μmol ggydF4y2Ba−1gydF4y2BaFW),在24和36 h时略有下降(0.45 μmol g .gydF4y2Ba−1gydF4y2Ba48 h后观察到FW)(图。gydF4y2Ba6gydF4y2Baa). NO存在12 h时ACC含量较低(0.3 μmol ggydF4y2Ba−1gydF4y2BaFW),但随着时间的推移和最大ACC内容(0.92μmolggydF4y2Ba−1gydF4y2Ba在48小时后注意到FW)(图。gydF4y2Ba6gydF4y2Ba一个)。The same pattern was observed in the presence of KAR1: after 12 h, ACC contents were 0.6 μmol g−1gydF4y2BaFW(即NO的治疗的两倍),并且连续增加在KAR1的存在下,直至培养结束时,观察到。After 48 h, maximum ACC contents (1.1 μmol g−1gydF4y2BaFW)。gydF4y2Ba6gydF4y2Ba一个)。gydF4y2Ba
NO(5 mm)和KAR1(3×10-9米)的影响(gydF4y2Ba一个gydF4y2Ba)ACC内容,(gydF4y2BabgydF4y2Ba) ACS活动,(gydF4y2BacgydF4y2Ba在次级休眠)ACO活性gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。值是平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;ACC合成酶,ACS,ACC氧化酶,ACO;h,小时gydF4y2Ba
ACS和ACO活动增加了乙烯生产,并(直接或间接)有助于缓解种子休眠。为了确定ACS和ACO活性,将种子在水中孵育或否(5 mm)和Kar1(3×10gydF4y2Ba- 9gydF4y2Ba M) solutions for 12, 24, 36, and 48 h. The ACS activity was relatively low with no significant changes observed in the control culture (Fig.6gydF4y2Bab),而在NO和KAR1存在的条件下孵育24和36 h后,ACS活性增加了2 - 3倍。而在NO预处理的样品中,ACS水平在自吸48 h后下降。gydF4y2Ba
ACO活性在潜伏期开始时也很低,无论是处理过的样品还是未处理过的样品(图2)。gydF4y2Ba6gydF4y2BaC)。然而,与对照组36小时后,ACO活性迅速增加,与对照相比,双重增加(图。gydF4y2Ba6gydF4y2BaC)。The significant stimulatory effects of NO and KAR1 on ACO activity in vitro were also observed after 48 h of imbibition (Fig.6gydF4y2Bac),ACO活动最大达到。gydF4y2Ba
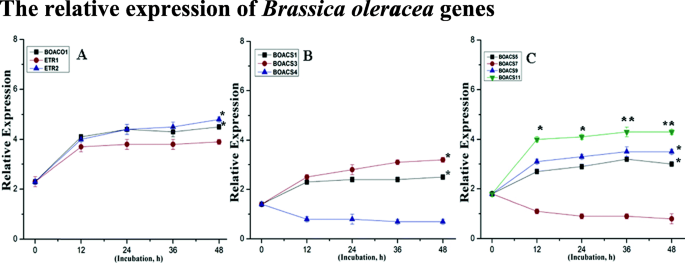
相对表达gydF4y2BaBrassica oleraceagydF4y2Ba乙烯相关基因gydF4y2Ba
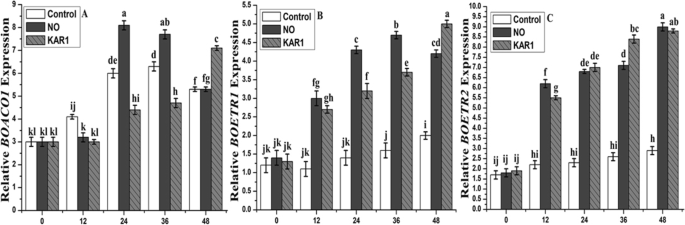
To thoroughly check the effects of NO (5 mM) and KAR1 (3 × 10- 9gydF4y2BaM),我们观察乙烯相关基因的表达。编码生物合成酶(一种ACO氧化酶(gydF4y2BaBoaco1.gydF4y2Ba),七个ACS合酶(gydF4y2BaBoacs1, boacs3, boacs4, boacs5, boacs7, boacs9gydF4y2Ba, 和gydF4y2BaBOACS11gydF4y2Ba)和两个乙烯受体(gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba在不同的孵化期(0、12、24、36和48 h),对种子在水中的吸胀过程进行了分析(图1)。gydF4y2Ba7gydF4y2Baa, b和c)。与干燥(0 h)种子相比,籽粒gydF4y2BaBOACS1.gydF4y2Ba在孵化期间,转录物保持不变,而gydF4y2BaBOACS3、BOACS5 BOACS9gydF4y2Ba和gydF4y2BaBOACS11gydF4y2Ba是差异。然而gydF4y2BaBoacs4.gydF4y2Ba和gydF4y2BaBoacs7.gydF4y2Ba在水中孵育过程中有不同程度的下调(图。gydF4y2Ba7gydF4y2Baa,b和c)。两个都gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba也上调,如图所示。gydF4y2Ba7gydF4y2Ba一个。gydF4y2Ba
BOACO1与乙烯受体基因的相对表达模式(gydF4y2Ba一个gydF4y2Ba)和乙烯生物合成基因(BOACS1、BOACS3、BOACS4、BOACS5、BOACS7、BOACS9、BOACS11) (gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)在次级休眠gydF4y2BaBrassica oleraceagydF4y2Ba年代eed年代incubated in water at 21 °C. Transcript levels for each gene were estimated by qRT-PCR. The fold changes indicate the expression patterns of analyzed genes relative to their transcript levels in dry seeds (0 h of incubation) with assumed value of 1. Statistical analyses: two-way ANOVA with post hoc Tukey’s (HSD) test with confidence interval 0.05, significance between groups indicated as * forPgydF4y2Ba≤0.05,**gydF4y2BaPgydF4y2Ba ≤ 0.01
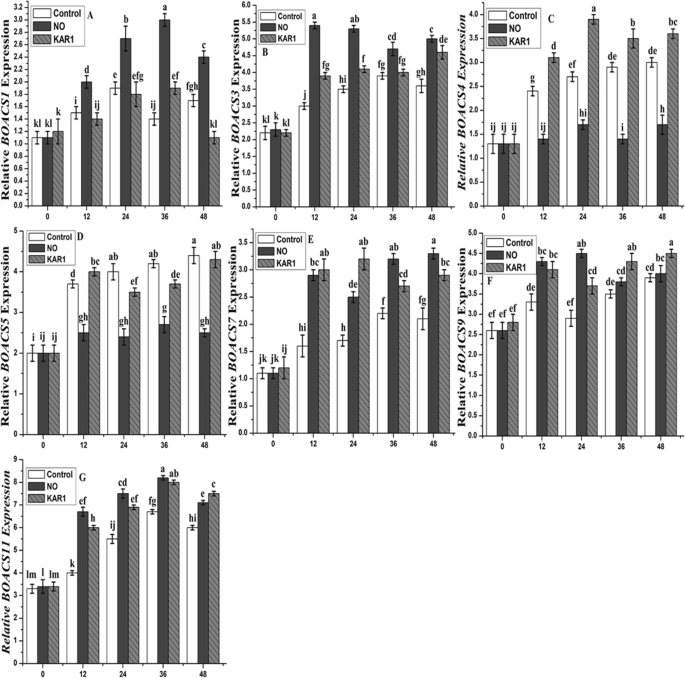
在NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2BaM),对上述所有基因进行不同潜伏期(0、12、24、36、48 h)的基因表达分析(图1)。gydF4y2Ba8gydF4y2Ba).gydF4y2BaBoact1.gydF4y2Ba(肌动蛋白基因)用作参考基因。Almost no change was observed in the expression of all genes at 0 h (Fig.8gydF4y2Ba).水平gydF4y2BaBOACS1.gydF4y2Ba在12,36和48小时后较低,但24小时后,kar1的存在水平较高(3×10gydF4y2Ba- 9gydF4y2BaM),比对照处理(图。gydF4y2Ba8gydF4y2BaA和B)。在kar1的存在下,表达gydF4y2BaBoacs2.gydF4y2Ba在12、24和48 h后,与对照组相比,差异无统计学意义,但在36 h后,差异无统计学意义。而在NO (5 mM)存在时,这两个基因的水平都较高,且与对照相比存在显著差异。gydF4y2BaBoacs4.gydF4y2Ba和gydF4y2BaBoacs5.gydF4y2Ba与KAR1和对照相比,NO处理下的表达量较低(图2)。gydF4y2Ba8gydF4y2Bac和d)。其余三个基因的表达水平(gydF4y2BaBoacs7,Boacs9.gydF4y2Ba和gydF4y2BaBOACS 11gydF4y2Ba)水平升高,而在两种治疗比对照治疗(图更显著。gydF4y2Ba8gydF4y2Bae, f和g)。gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2,gydF4y2Ba在吸收期间上调到不同程度的程度(图。gydF4y2Ba9gydF4y2Bab和c)。gydF4y2BaBOETR1gydF4y2Ba当吸收后12至48小时测量12至48小时时,稳定的双重诱导其转录活性(图。gydF4y2Ba9gydF4y2Bab)中,而大约在转录水平三倍变化观察到gydF4y2BaBOETR2gydF4y2Ba(图。gydF4y2Ba9gydF4y2Bac).生物合成酶编码基因的对比结果(图。gydF4y2Ba9gydF4y2Ba一个)。表达gydF4y2BaBoaco1.gydF4y2Bagenewas higher after 36 and 48 h of incubation (Fig.9gydF4y2Baa) NO存在时,KAR1的表达水平略低于对照。gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba)gydF4y2BaBOACS1.gydF4y2Ba,gydF4y2BabgydF4y2BaBOACS3,gydF4y2BacgydF4y2BaBOACS4,gydF4y2BadgydF4y2BaBOACS5,gydF4y2BaegydF4y2BaBoacs7,gydF4y2BafgydF4y2BaBOACS9.gydF4y2Ba,gydF4y2BaggydF4y2BaBOACS11gydF4y2Ba二次休眠的基因gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;h,小时gydF4y2Ba
NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba米)(gydF4y2Ba一个gydF4y2Ba)gydF4y2BaBoaco1.gydF4y2Ba,gydF4y2BabgydF4y2BaBOETR1,gydF4y2BacgydF4y2BaBOETR2gydF4y2Ba二次休眠的基因gydF4y2BaBrassica oleraceagydF4y2Ba在21°C的吸收过程中的种子(gydF4y2BangydF4y2Ba= 3)。数值为平均值±SE。通过双向方差分析(ANOVA)确定处理之间的显著差异,然后进行HSD Tukey检验。不同字母的意思在不同的位置上有显著的不同gydF4y2Bap < 0.05gydF4y2Ba.卡尔,karrikin1;不,一氧化氮;h,小时gydF4y2Ba
讨论gydF4y2Ba
NO和KAR1对种子萌发、过氧化氢和超氧阴离子水平的影响gydF4y2Ba
我们的实验数据表明,二次休眠gydF4y2BaBrassica oleraceagydF4y2Ba种子(在21°C时较差)处于休眠状态(图。gydF4y2Ba1gydF4y2Ba).The NO (5 mM) and KAR1 (3 × 10- 9gydF4y2Ba M) treatments effected onBrassica oleraceagydF4y2Ba休眠的种子发芽(图。gydF4y2Ba1gydF4y2Ba一个)。NO和KAR1治疗成功移除在次级休眠种子休眠gydF4y2BaBrassica oleraceagydF4y2Ba种子。我们的发现(图gydF4y2Ba1gydF4y2Ba), NO和KAR1均能打破种子休眠,诱导种子萌发,这与前人的研究一致[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].过去的研究还证明,周围环境中的缺点可以在种子萌发的早期阶段提高萌发[gydF4y2Ba45.gydF4y2Ba].但是,仍然需要进一步调查,以充分了解NO和KAR1在破坏休眠方面的监管作用。gydF4y2Ba
种子休眠的缓解不仅依赖于植物激素,还受ROS (HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和(OgydF4y2Ba2gydF4y2Ba活动。ROS是植物组织和种子中的小分子,可在毒性和信号中发挥双重作用[gydF4y2Ba31.gydF4y2Ba].在种子萌发过程中,ROS被释放到周围环境中促进自由基的产生[gydF4y2Ba46.gydF4y2Ba].以前的研究表明,ROS积累对于突破种子休眠和调节种子萌发中的各种植物物种至关重要[gydF4y2Ba31.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba].KAR1和no诱导的种子萌发也与HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ累积(图。gydF4y2Ba2gydF4y2Ba).在种子萌发的早期阶段,生产ROS(H.gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ)表明具有积极的生物反应,能连续发芽,幼苗生长旺盛。之前的一项研究也证实了HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba种子萌发过程的早期阶段[生产可以打破种子休眠gydF4y2Ba32.gydF4y2Ba].实验数据表明,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba˙ˉ累积/申请不危害gydF4y2Ba芸苔gydF4y2Ba与NO和KAR1高存活率(表示为种子发芽)种子处理的样品。这可能是由于细胞抗氧化系统[gydF4y2Ba48.gydF4y2Ba],也暗示在图1中。gydF4y2Ba2gydF4y2Ba.类似有趣的结果也注意到,在没有和HCN [处理苹果的种子gydF4y2Ba11.gydF4y2Ba].gydF4y2Ba
NO和KAR1对抗氧化酶、ABA和GA水平的影响gydF4y2Ba
KAR1对种子休眠和萌发的刺激作用已被许多研究者报道[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba].SOD是主要抗氧化剂[gydF4y2Ba50.gydF4y2Ba],在控制植物氧化应激方面发挥至关重要的作用。草皮和猫主要是线粒体和过氧化物的局部,对H不敏感gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba.我们的研究表明,gydF4y2BaBrassica oleraceagydF4y2Ba用NO和KAR1治疗的种子没有显着改变猫和SOD活性,仅略微刺激猫活动(图。gydF4y2Ba3.gydF4y2Ba)被记录。此外,NO和KAR1均未显著改变SOD和CAT活性(图1)。gydF4y2Ba3.gydF4y2Ba).NO和KAR1使CAT和SOD活性在处理2 d后达到最高水平。随后,随着处理时间的增加,SOD水平下降到5%(图2)。gydF4y2Ba3.gydF4y2Ba).申请3和4天后猫活动也降低了(图。gydF4y2Ba3.gydF4y2Ba).类似我们的调查结果,以前的研究已经表明,赤霉酸下调大麦SOD和CAT活性[gydF4y2Ba51.gydF4y2Ba],并在gydF4y2BaA. Fatua,gydF4y2BaGA3和KAR1下调CAT和SOD活性[gydF4y2Ba52.gydF4y2Ba].否而kar1逐渐增强gr电平(图。gydF4y2Ba3.gydF4y2BaC)。在NO-和GR活性,CAT和SOD活性的比较KAR1处理gydF4y2Ba芸苔gydF4y2Ba样本显示,GR活动是积极与应用的时间有关。gydF4y2Ba
在本研究中,我们观察到KAR1和NO在ABA和GA释放种子休眠的综合作用(图。gydF4y2Ba4gydF4y2Ba).NO和KAR1被发现,以减少ABA含量和GA含量增加。在以前的研究,GA被观察为负而ABA注意作为种子休眠发展正调节[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba].kar1休眠释放,没有gydF4y2Ba芸苔gydF4y2Ba伴随着ABA水平的降解(图。gydF4y2Ba4gydF4y2Ba).以前的 [gydF4y2Ba38.gydF4y2Ba]研究还支持我们的结果;种子休眠释放还取决于GA含量的增加和ABA内容物的降低。以前的研究表明,在休眠中gydF4y2Ba拟南芥蒂利亚纳gydF4y2BaGa Biosynthesis需要种子,Kar1 [gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
NO和KAR1对乙烯及乙烯抑制剂NBD的影响gydF4y2Ba
乙烯在种子休眠的减轻和种子萌发的调节中的作用还没有完全理解[gydF4y2Ba20.gydF4y2Ba].我们的研究,结合对乙烯生物合成途径和NBD应用的分析,清楚地表明,在NBD存在的情况下,NO和KAR1对种子萌发没有显著影响(图2)。gydF4y2Ba5gydF4y2Ba),主要是由于NBD抑制亚乙基作用(图。gydF4y2Ba5gydF4y2Ba).NO和KAR1的刺激效果依赖于乙烯信号传导,即使两者都被2,5-Nbd乙烯抑制剂抑制(图。gydF4y2Ba5gydF4y2Ba).我们的研究结果均符合协议[gydF4y2Ba54.gydF4y2Ba],谁发现NBD抑制乙烯产生在苹果种子,大麦和向日葵种子发芽[gydF4y2Ba55.gydF4y2Ba,gydF4y2Ba56.gydF4y2Ba].在研究中,我们发现乙烯在调控过程中增强了KAR1和NO预处理的影响gydF4y2BaBrassica oleraceagydF4y2Ba种子发芽。我们的研究证明,KAR1和NO分子都以乙烯依赖的方式调控种子萌发(图。gydF4y2Ba5gydF4y2Ba).用NBD进行的实验表明,乙烯是必需的gydF4y2Ba芸苔gydF4y2Ba种子发芽。gydF4y2Ba
NO和KAR1对ACS,ACO和乙烯相关基因的影响。gydF4y2Ba
在这项研究中,ACS活性在发芽过程中相对较低gydF4y2BaBrassica oleraceagydF4y2Ba在Kar1和无应用下12小时后的种子(图。gydF4y2Ba6gydF4y2Ba一个)。KAR1在孵化后24至36小时后,诱导ACS和ACO活性的快速增加;48小时后,ACS活性下降但ACO活性增加(图。gydF4y2Ba6gydF4y2Ba然而,我们的实验表明,即使ACS和ACO的活性很低,也能促进休眠的消除。之前的研究(gydF4y2Ba17.gydF4y2Ba研究还发现,由于ACS活性不足,ACC浓度低可能导致种子休眠。的预处理gydF4y2Ba芸苔gydF4y2Ba添加NO和KAR1的种子提高了ACO酶的活性(图。gydF4y2Ba6gydF4y2Bab)。在gydF4y2BaPisum sativum.gydF4y2Ba种子发芽gydF4y2Ba,gydF4y2Ba乙烯管制ACO活性[gydF4y2Ba57.gydF4y2Ba].我们的结果表明,在初始阶段gydF4y2Ba芸苔gydF4y2Ba种子萌发过程中ACC向乙烯的转化可能与ACO无关。在gydF4y2Ba拟南芥,豌豆,茄子,gydF4y2Ba和山毛榉木种子,ACO活动与ACO转录物之间的关系,在减轻休眠期间的转录水平提出调节[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba57.gydF4y2Ba].gydF4y2Ba
推测乙烯生成水平、ACS和ACO基因编码酶可能参与乙烯生物合成和种子萌发,我们的研究结果似乎支持这一假设(图3)。gydF4y2Ba6gydF4y2Ba).以往的研究表明,乙烯可以通过ACO调节自身的合成[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].类似的机制也可以在柑橘叶或豌豆幼苗的上胚轴中观察到[gydF4y2Ba58.gydF4y2Ba].gydF4y2Ba
在乙烯前体(ACC)的形成过程中,ACS基因依赖于磷酸吡啶醛(PLP)。在我们的研究中,我们选择了7个ACS基因和1个ACO基因,发现它们的表达水平与乙烯的产生相关(图2)。gydF4y2Ba7gydF4y2Ba).具有高表达水平的基因具有高乙烯生产有关。的ACO基因负责ACC转化成乙烯。的ACO和ACS基因的表达不是下NO和KAR1应用程序相同。的表达gydF4y2BaBOACS1,BOACS3,BOACS5,BOACS9gydF4y2Ba和gydF4y2BaBOACS11gydF4y2Ba均上调,和gydF4y2BaBoacs4.gydF4y2Ba和gydF4y2BaBoacs7.gydF4y2Ba在水中孵育过程中有不同程度的下调(图。gydF4y2Ba7gydF4y2Baa,b和c)。ACO和ACS基因上调不调节NO和KAR1应用下的调节乙烯生产(图。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
以前的研究还发现植物中不同类型的乙烯受体(ETR)[gydF4y2Ba59.gydF4y2Ba].在本研究中,我们使用了两种不同类型的乙烯受体基因(gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba)并且发现这两个基因在其表达和功能中不同(图。gydF4y2Ba7gydF4y2Ba和gydF4y2Ba9gydF4y2Ba).gydF4y2BaBOERT2gydF4y2Ba的表达水平比的更高gydF4y2BaBOETR1gydF4y2Ba在NO和KAR1治疗不足。在转基因番茄植物中,乙烯反应由受体表达的速率确定[gydF4y2Ba60.gydF4y2Ba].之前(gydF4y2Ba48.gydF4y2Ba]发现不与乙烯无限制的乙烯受体被认为是负调节因子,因为它们抑制了乙烯信号转导途径。乙烯生产在水中孵育期间没有显着增加(图。gydF4y2Ba5gydF4y2Ba一个),这表明任何乙烯 - 依赖性过程可能种子休眠减轻期间被抑制。在gydF4y2Ba芸苔gydF4y2Ba休眠种子,乙烯受体基因gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba水温育(图中被上调。gydF4y2Ba7gydF4y2Bab,c)。低敏感性gydF4y2BaBOETR1gydF4y2Ba和gydF4y2BaBOETR2gydF4y2Ba在NO和KAR1孵育过程中,这两种受体均表达上调。这些发现与之前报道的发现相似,提出了NO、KAR1和乙烯信号通路对种子休眠释放的刺激作用[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba61.gydF4y2Ba,gydF4y2Ba62.gydF4y2Ba].在NO和KAR1之间已经发现了一些相似之处,例如两种分子都是通过乙烯来打破休眠的。总之,我们成功地缓解了近98%的种子休眠gydF4y2Ba甘蓝olereacegydF4y2Ba7 d后,NO和KAR1处理改变了乙烯途径和抗氧化酶活性。gydF4y2Ba
结论gydF4y2Ba
抗氧化酶、过氧化氢、超氧阴离子和低水平的乙烯之间的不平衡导致植物种子休眠。NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2BaM)处理缓解种子休眠gydF4y2BaBrassica oleraceagydF4y2Ba种子并增强过氧化氢,超氧化物阴离子,GA含量,抗氧化酶和诱导种子萌发所需的乙烯水平。乙烯调节似乎是种子萌发诱导的重要因素。然而,进一步的研究是完全揭示途径组分,确定这两种化合物的等级,以及鉴定有助于阐明NO,KAR1和乙烯在继发性休眠中的精确作用的鉴定gydF4y2BaBrassica oleraceagydF4y2Ba萌发过程。gydF4y2Ba
材料与方法gydF4y2Ba
植物材料,生长条件和水含量的测定gydF4y2Ba
二次休眠gydF4y2BaBrassica oleraceagydF4y2BaL.种子采自安徽农业大学油菜栽培育种实验室。种子(每个处理3个重复,每个种子25粒)在100 μmol红外光的照射下吸水gydF4y2Ba·gydF4y2Ba米ydF4y2Ba2gydF4y2Ba·gydF4y2Ba年代gydF4y2Ba-gydF4y2Ba1gydF4y2Ba辐射)在5℃下,渗透潜力为-1600kPa,4天诱导继发性休眠。将4天后的种子储存在-20℃。通过用3%次氯酸钠(Aladin,Shandhai,China)洗涤灭菌种子,然后在蒸馏水中孵育8小时,然后在预湿润的温板上吸收1天。在21℃和70%相对湿度下在16小时光下的生长室和8小时暗循环条件下培养吸收的种子。gydF4y2Ba
检查种子发芽[gydF4y2Ba1gydF4y2Ba];滤纸置于培养皿中,用(a) 1.5 ml蒸馏水或(b) KAR1 (3 × 10)浸湿gydF4y2Ba- 9gydF4y2BaM)或(c) NO(5毫米)及[gydF4y2Ba2gydF4y2Ba]将种子放在湿润的滤纸上并用透明盖子覆盖5天。每24小时一次,萌发率明显最多5天。用可见的白色胚根(1mm,细涂层破碎后1mm)的种子被记录为发芽。为了保护从光效应或损伤的萌发,种子在生长室内生长在0.5μmolm的绿色,安全光下gydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba.为了确定处理的处理和未处理的种子的水含量(每次治疗三次重复的25种种子),将种子置于辊上(在10℃下24小时)。通过烘箱干燥5,10,20,30,40和50h,在105℃下进行烘箱。gydF4y2Ba
KAR1的合成和处理gydF4y2Ba芸苔gydF4y2Ba种子中含有NO、KAR1或ACCgydF4y2Ba
Kar1通过直接使用甲基丙酮酸,二氢-2H-吡喃-3-(4H) - 酮和Ti-Cross aldol [gydF4y2Ba63.gydF4y2Ba].为了得到晶体化合物,使用硅胶柱色谱法纯化所得产物。进行HRMS和1H NMR分析以确认结构。在Bruker AC 200光谱仪上分析(使用CD13作为溶剂)的NMR,具有200.13MHz频率。在Finnigan垫95光谱仪上分析了HRMS。gydF4y2Ba
以下是光照下一氧化氮对种子萌发的影响[gydF4y2Ba14.gydF4y2Ba)方法。用盐酸(0.1 M)和亚硝酸钠(20 mM)制备酸化的亚硝酸钠,如先前推荐的[gydF4y2Ba11.gydF4y2Ba].使用蒸馏水洗涤种子(每次治疗三次重复的25种种子),然后用蒸馏水洗涤,将种子放在培养皿中的滤纸(一层)上并用;(gydF4y2Ba一个gydF4y2Ba)1.5ml蒸馏水,或(gydF4y2BabgydF4y2Bakar1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M) with or without1-aminocyclopropane-1-carboxylic acid (ACC 1 × 10- 4.gydF4y2Ba M), or (cgydF4y2Ba)没有(5 mm),带有或没有1-氨基环丙烷-1-羧酸(ACC 1×10gydF4y2Ba- 4.gydF4y2Ba M), or (dgydF4y2Ba)1-氨基环丙烷-1-羧酸(ACC 1×10gydF4y2Ba- 4.gydF4y2Ba米)。gydF4y2Ba
过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)和超氧阴离子(OgydF4y2Ba2gydF4y2Ba˙ˉ)浓度测量gydF4y2Ba
以前的方法(gydF4y2Ba64.gydF4y2Ba]用于测定HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在种子中。种子(每次治疗三次重复的25种种子)在冰上均质化,3mL冷TCA 0.1%(w / v)。将得到的混合物在4℃下以13,000rpm离心15分钟。然后将(0.5mL)上清液和将1ml新鲜制备的Ki(1M)加入到0.5ml磷酸钾缓冲液(10mM和pH7.0)中。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba一个b年代orbance was measured using a spectrophotometer (Shanghai Yoke Instrument, Shanghai, China) at 390 nm.
以前的方法(gydF4y2Ba65.gydF4y2Ba]其次测量超氧阴离子的二次休眠的浓度水平gydF4y2BaBrassica oleraceagydF4y2Ba种子。种子(每个处理3个重复,每个25个种子)用3 ml 0.1%的冷TCA (w/v)均质。获得的混合物在4°C, 13,000 RPM下离心15分钟。将1.5 ml上清液和1.5 ml盐酸羟胺(1 mM)在50 mM钾缓冲液(pH 7.8)中避光,21℃孵育30分钟。取0.5 ml的混合物加入0.5 ml 2-萘胺(7 mM)和0.5 ml磺胺(17 mM)的混合物(在钾缓冲液中),在21℃黑暗中孵育30分钟。在13000 RPM的条件下再次离心10分钟。用分光光度计(上海优科仪器,中国上海)在A540 nm处测定超氧阴离子的吸光度。亚硝酸钠(纳米gydF4y2Ba2gydF4y2Ba)用于制备标定曲线。gydF4y2Ba
抗氧化酶(SOD,CAT和GR)测量分析gydF4y2Ba
使用EDTA(1mM),2%PVP,PMSF(0.01 mm)和DTT(5mm)将二级休眠种子(每次治疗三次重复)接地。gydF4y2Ba
然后将所得样品加入5 ml磷酸钾缓冲液(0.1 M, pH 7.0)中,在4°C, 10,000 RPM下离心15分钟。然后用Sephadex G-250色谱柱(BioRad)在磷酸盐缓冲液中脱盐得到混合物。gydF4y2Ba
HCl (40 mM), glycine buffer (0.05 M and pH 9.7) and 50 μl epinephrine solution (120 mM) were mixed together to a prepare reaction mixture, as previously described [66.gydF4y2Ba,gydF4y2Ba67.gydF4y2Ba)方法。Samples (50 μl) were homogenized in reaction mixture and acidified epinephrine was added to start reaction. A spectrophotometer (Shanghai Yoke Instrument, Shanghai, China) monitored the oxidation of epinephrine to adrenochrome at 480 nm.
品牌:Aebi的[gydF4y2Ba68.gydF4y2Ba遵循方法,测量次级休眠种子中的过氧化氢酶(猫)活性(每次治疗三种重复中的25种种子)。将样品(50μl)均化在磷酸钾缓冲液(0.07M)和6%H中均化gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba加入到反应开始。CAT activity was examined using a spectrophotometer (Shanghai Yoke Instrument, Shanghai, China) at 240 nm.
谷胱甘肽还原酶gydF4y2Ba(gydF4y2BaGR)活性用测定[gydF4y2Ba69.gydF4y2Ba)方法。用25粒种子测定GR活性,每个处理3个重复。GSSG (5mm)与磷酸钾缓冲液(0.05 M)混合,在21℃下加入样品10 min。用β-NADPH (2mm)启动反应。用分光光度计(上海优科仪器,中国上海)在340 nm处检测GR活性。布拉德福德的(gydF4y2Ba70gydF4y2Ba]方法学用于测量蛋白质含量。牛血清白蛋白(BSA)用作标准。gydF4y2Ba
测定ABA和GA内容gydF4y2Ba
ABA含量根据[gydF4y2Ba71.gydF4y2Ba)方法。在存在液氮种子(每次处理中的三种重复的每种重复中的25种)中,将研磨成粉末。然后将样品在甲醇中均化。D6-ABA被应用为内标。为了纯化样品,在Oasis Max固相存在下在甲醇中加入甲酸(7%)。在下一步骤中,将样品注入色谱 - 串联质谱系统中,配备有三重四点串联质谱仪和超级性液相色谱仪。gydF4y2Ba
GA含量的测定按[gydF4y2Ba71.gydF4y2Ba)方法。在液氮存在下,将种子(每次治疗的三种重复的25种种子)研磨成粉末。甲醇(85%v / v)用于萃取。通过乙醚萃取,固相萃取和反相纯化所得混合物。为了定量分析,将样品注入毛细管电泳 - 质谱(CE-MS)中。gydF4y2Ba
乙烯生产和NBD处理的测定gydF4y2Ba
利用(a) NO (5 mM)和(b) KAR1 (3 × 10)处理次级休眠种子(每个处理3个重复各25粒)gydF4y2Ba- 9gydF4y2Ba M), and (c) ACC (1 × 10- 4.gydF4y2Ba M) or without ACC for 12, 24, 36, and 48 h, as described previously [44.gydF4y2Ba].在润湿的滤纸的存在下,使用玻璃容器(10mL)在21℃下在黑暗中孵育处理的种子3小时。注射器用于从玻璃容器中取样。在此之后,将样品(1毫升)注入配备FID的Hewlett-Packard 5980 GC中,Pro Pack Q 80/100网格和不锈钢柱。然后将样品置于60℃的烘箱中以进行等温分离。乙烯的测量单元是pl hgydF4y2Ba- 1gydF4y2Ba25种子gydF4y2Ba- 1gydF4y2Ba.gydF4y2Ba
用乙烯抑制剂NBD考察了乙烯对种子二次萌发的影响。在密闭的玻璃容器(500毫升)中,将休眠种子(每次处理3个重复,每个重复25粒)置于滤纸上,用浸渍剂浸湿;(gydF4y2Ba一个gydF4y2Bakar1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M), or (bgydF4y2Ba) NO (5 mM)在2,5-降冰片二烯(NBD)存在下,根据[gydF4y2Ba44.gydF4y2Ba)方法。NBD(3×10gydF4y2Ba- 5gydF4y2Ba6 × 10gydF4y2Ba- 5gydF4y2Ba M) in liquid form was applied under the lid of the container. After 5 h of treatment, seeds were rinsed three times with deionized water and positioned for germination assay.
测定ACC含量、ACC合成酶和ACC氧化酶活性gydF4y2Ba
使用[gydF4y2Ba72.gydF4y2Ba)方法。使用乙醇(2mL和80%v / v)用于均质处理(无和kar1)和未处理的种子(每次治疗中的三种重复中的25种种子)。为了除去乙醇,在4℃下以13,000rpm离心样品15分钟。在此之后,使用Hewlett-Packard 5980 GC在室温下测量ACC内容物。ACC内容以μmolg-1 fw计算。gydF4y2Ba
ACC合酶(ACS)活性使用[检查gydF4y2Ba72.gydF4y2Ba,gydF4y2Ba73.gydF4y2Ba)方法。二硫醇(DTT)5mm,聚乙烯吡咯烷酮(PVPP)2%(w / v),苯基甲磺酰芳基(PMSF)0.01mm,HEPES-KOH缓冲液(0.1M pH 8.5)和10μM吡哆醛磷酸盐(PLP)混合在一起以制备均质化缓冲液。种子在冰上均质缓冲液中均质化。gydF4y2Ba
样品旋转10 s,然后在4°C 13000 RPM下离心15分钟。gydF4y2Ba
将PLP (10 μM)、HEPES - KOH (0.1 M, pH 8)和s -腺苷蛋氨酸(200 μM)混合制备反应混合物。然后样品在有反应混合物(0.6 ml)存在的玻璃容器中孵育(37℃)60分钟。HgClgydF4y2Ba2gydF4y2Ba用0.2 ml (10 mM)停止反应。gydF4y2Ba
在种子ACC氧化酶根据[测量gydF4y2Ba74.gydF4y2Ba] 协议。First, extraction buffer (E.B) was prepared by mixing glycerol 10% (v/v), 5% (v/v) Triton X-100, Tris–HCl 0.1 M, 7 mM DTT, 25 mM Na-ascorbate and 0.15 mM PMSF and then samples were homogenized in 4 ml E.B. ACC 2 mM, NaHCO3.gydF4y2Ba35 mm,DTT 1 mm,FeSO425μm,Na抗坏血酸30 mm,NaHCOgydF4y2Ba3.gydF4y2Ba30 mM和Tris-HCl 0.1 M的制备孵育缓冲液。样品在4°C 13,000 RPM下离心15分钟,并将所得混合物加入孵育缓冲液中。将获得的混合物(1 h)置于37°C的摇床上。以pl h计算ACO活性gydF4y2Ba- 1gydF4y2Ba mg- 1gydF4y2Ba蛋白质。gydF4y2Ba
的乙烯相关基因RNA提取和RT-qPCR的gydF4y2Ba
提取二次休眠的RNAgydF4y2BaBrassica oleraceagydF4y2Ba种子经NO (5 mM)和KAR1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M) for 0, 12, 24, 36, and 48 h to observe the expression levels of ethylene related genes [49.gydF4y2Ba].在这项研究中,我们选择了10个乙烯相关基因(表gydF4y2Ba1gydF4y2Ba).二十五个种子(每三个副本)与处理(gydF4y2Ba一个gydF4y2Ba)没有(5 mm)或(gydF4y2BabgydF4y2Bakar1 (3 × 10gydF4y2Ba- 9gydF4y2Ba M), or (cgydF4y2Ba) 水。为了制备第一链cDNA,使用OMEGA生物TEK试剂盒(Biotechnology,Shanghai,Shanghai,China)加入第一链CDNA,将DNA酶I加入到1μg总RNA的总RNA等上。不含核酸酶的水用于获得的样品(10%)。在此之后,Sybr选择Master Mix(Biotechnology,Shanghai,China)用于执行RT-QPCR。在95℃(10分钟)的反应中开始反应,然后在95℃(10 s),60℃(20 s)和72℃(20 s)下进行50个循环扩增,并在95℃下熔化(用于2:30分钟,60℃,30秒,然后连续增加至95℃。基因和QPCR引物序列在附加文件中给出gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
统计分析gydF4y2Ba
所有图表中显示的数据均为使用双向方差分析(ANOVA)的平均值±标准误差(SEs)。采用Tukey’s检验进行多重比较。gydF4y2BaPgydF4y2Ba ≤ 0.05 was used to measure the significant differences between the indicated treatment groups and control.
可用性数据和材料gydF4y2Ba
本文描述的RNA-seq序列数据已在NCBI (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/gydF4y2Ba的)基因和引物的.The详细信息中的其他文件中列出gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
缩写gydF4y2Ba
- ACC:gydF4y2Ba
-
合成酶2,5-降冰片二烯(NBD)gydF4y2Ba
- 华:gydF4y2Ba
-
氨基环丙烷-1-羧酸ACC氧化酶gydF4y2Ba
- 猫:gydF4y2Ba
-
催化剂gydF4y2Ba
- ETR:gydF4y2Ba
-
乙烯受体gydF4y2Ba
- gr:gydF4y2Ba
-
谷胱甘肽还原酶gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- Kar1:gydF4y2Ba
-
Karrikin1gydF4y2Ba
- 不:gydF4y2Ba
-
一氧化氮gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba˙ˉ:gydF4y2Ba
-
超氧阴离子gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
布雷JD。种子萌发和休眠。植物细胞。1997;9(7):1055。gydF4y2Ba
- 2。gydF4y2Ba
黄S,Gruber S,Stockmann F,Claupein W.油菜籽种子发展过程中休眠的动态(芸苔Napus L.)。种子sci res。2016; 26(3):245-53。gydF4y2Ba
- 3.gydF4y2Ba
KEÇPCZYńSKIJ,KEÇPCZYńSKAE.种子休眠和萌发中的乙烯。physiol platararum。1997; 101(4):720-6。gydF4y2Ba
- 4.gydF4y2Ba
Rodríguez-Gacio MD, Matilla-Vázquez MA, Matilla AJ。种子休眠与ABA信号转导的突破还在继续。植物信号学报。2009;4(11):1035-48。gydF4y2Ba
- 5。gydF4y2Ba
迪克森KW,梅里特DJ,Flematti GR,Ghisalberti EL。Karrikinolide-一个从烟雾衍生自具有在园艺,生态恢复和农业应用phytoreactive化合物。Acta Hortic。2009; 813:155-70。gydF4y2Ba
- 6。gydF4y2Ba
Flematti Gr,Ghisalberti El,Dixon Kw,Trengove Rd。来自烟雾的化合物,促进种子萌发。SCI。2004; 305(5686):977。gydF4y2Ba
- 7。gydF4y2Ba
尼尔森DC,莱斯勃拉芙地区JA,Flematti GR,史蒂文斯Ĵ,Ghisalberti EL,迪克森KW,史密斯SM。卡里金在烟雾触发发现gydF4y2Ba拟南芥gydF4y2Ba通过需要甘草酸合成和光的机制萌发。植物理性。2009; 149(2):863-73。gydF4y2Ba
- 8。gydF4y2Ba
Krasuska U,Ciacka K,Andryka-Dudek的P,Bogatek R,Gniazdowska A.“亚硝化门”在种子休眠缓解和萌发的影响。在:活性氧和氮物种信号和通信设备。湛:斯普林格;2015. p。215-37。gydF4y2Ba
- 9。gydF4y2Ba
Arc E,Galland M,Godin B,Cueff G,Rajjou L.在种子休眠和萌发中的一氧化氮意义。边疆植物科学。2013; 4:346。gydF4y2Ba
- 10。gydF4y2Ba
贝思克PC,居布莱楼雅各布森合资,琼斯RL。休眠gydF4y2Ba拟南芥gydF4y2Ba种子和大麦颗粒可以被一氧化氮破坏。足底。2004;219(5):847 - 55。gydF4y2Ba
- 11.gydF4y2Ba
Gniazdowska A, Krasuska U, Bogatek R.通过一氧化氮或氰化物去除苹果胚胎休眠涉及乙烯生物合成途径的修饰。足底。2010;232(6):1397 - 407。gydF4y2Ba
- 12.gydF4y2Ba
刘X,邓Z,程H,他X,宋S.亚硝酸盐,硝普钠,铁氰化钾和过氧化氢的释放休眠gydF4y2Ba苋属retroflexusgydF4y2Ba种子在一氧化氮依赖的方式。植物学报。2011;64(2):155-61。gydF4y2Ba
- 13。gydF4y2Ba
Kępczyńskij,sznigir p. ga 3,乙烯,no和hcn发芽的参与gydF4y2Ba苋属retroflexusgydF4y2BaL.种子具有各种休眠水平。ACTA植物生理学。2014; 36(6):1463-72。gydF4y2Ba
- 14。gydF4y2Ba
Gniazdowska A,DobrzyńskaU,Babaëczykt,Bogatek R.通过一氧化氮打破Apple Embryo休眠涉及刺激乙烯生产。Planta。2007; 225(4):1051-7。gydF4y2Ba
- 15.gydF4y2Ba
大厅BP,沙基尔SN,夏勒GE。乙烯受体:乙烯感知和信号转导。J植物生长纪录。2007; 26(2):118-30。gydF4y2Ba
- 16。gydF4y2Ba
Pierik R,Sasidharan R,Voesenek La。乙烯的生长控制:调整环境的表型。jplant成长reg。2007; 26(2):188-200。gydF4y2Ba
- 17。gydF4y2Ba
Corbineau F,夏Q,Bailly C,El-Maarouf-Bouth H.乙烯,是种子休眠调节的关键因素。边疆植物科学。2014; 5:539。gydF4y2Ba
- 18。gydF4y2Ba
Kucera B,Cohn Ma,Leubner-Metzger G.种子休眠释放过程中的植物激素相互作用和发芽。种子sci res。2005; 15(4):281-307。gydF4y2Ba
- 19。gydF4y2Ba
杨SF,霍夫曼NE。乙烯生物合成及其在高等植物调控。Annu Rev植物理性。1984; 35(1):155-89。gydF4y2Ba
- 20。gydF4y2Ba
MATILLA AJ,MATILLA - 巴斯克斯MA。在种子生理乙烯的参与。植物SCI。2008; 175(1-2):87-97。gydF4y2Ba
- 21。gydF4y2Ba
布克MA,德朗A.生产乙烯信号:调节和乙烯生物合成酶的多样化。植物理性。2015; 169(1):42-50。gydF4y2Ba
- 22。gydF4y2Ba
1-氨基环丙烷-1-羧酸氧化酶对乙烯生物合成的调控(gydF4y2BaACO.gydF4y2Ba基因。ACTA植物生理学。2013; 35(2):295-307。gydF4y2Ba
- 23。gydF4y2Ba
关键词:乙烯,赤霉素,后熟,基因表达模式gydF4y2Ba钻果大蒜芥gydF4y2Bal .种子。J Exp Bot。2009; 60(6):1645-61。gydF4y2Ba
- 24。gydF4y2Ba
acta ecolica sinica, 2010, 31 (3): 481 - 482 . acta ecolica sinica, 2010, 31 (3): 482 - 482 . acta ecolica sinica, 2010, 31 (3): 482 - 482 . acta ecolica sinica, 2010, 31 (3): 482 - 482gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2011;157(3):1342 - 62。gydF4y2Ba
- 25。gydF4y2Ba
陈志强,陈志强,陈志强。乙烯和茉莉酸对种子萌发的抑制作用。植物学报2012;31(2):253-70。gydF4y2Ba
- 26。gydF4y2Ba
卡尔沃AP,尼古拉斯C,洛伦佐O,尼古拉斯G,罗德里格斯D.证据由赤霉素和乙烯正调控gydF4y2BaACCgydF4y2Ba幼苗从休眠到萌发过程中氧化酶的表达和活性gydF4y2BaFagus sylvaticagydF4y2Bal .种子。植物生长学报2004;23(1):44-53。gydF4y2Ba
- 27。gydF4y2Ba
Chitnis VR,Gao F,Yao Z,Jordan Mc,Park S,Ayele Bt。熟发的小麦种子中荷尔蒙基因的转录变化:芸苔类固醇,乙烯,细胞素和水杨酸的病例。Plos一个。2014; 9(1):E87543。gydF4y2Ba
- 28。gydF4y2Ba
Hendricks Sb,Taylorson RB。促进硝酸盐,亚硝酸盐,羟胺和铵盐的种子萌发。植物理性。1974年; 54(3):304-9。gydF4y2Ba
- 29。gydF4y2Ba
El-Maarouf-Bouteau H,在种子萌发和休眠中被培养C.氧化信号传导。植物信号表现。2008; 3(3):175-82。gydF4y2Ba
- 30.gydF4y2Ba
关键词:活性氧;休眠gydF4y2Ba拜登pilosagydF4y2Bal .种子。南非J机器人。2010; 76(3):601-5。gydF4y2Ba
- 31。gydF4y2Ba
Bailly C,El-Maarouf-Bouth H,Corbineau F.从细胞内信号网络到细胞死亡:在种子生理中反应性氧气种类的双重作用。Comptes Rendus Biol。2008; 331(10):806-14。gydF4y2Ba
- 32。gydF4y2Ba
Oracz K,Bouteau HE,Farrant JM,库珀K,Belghazi男,作业C,工作d,Corbineau女,贝利C. ROS产生和蛋白质氧化作为一种新的机制用于种子休眠减轻。植物杂志2007; 50(3):452-65。gydF4y2Ba
- 33。gydF4y2Ba
迪亚兹-Vivancos P,巴尔巴-埃斯平G,埃尔南德斯JA。见解和观点:在种子发芽阐明激素/ ROS网络。植物细胞报道2013; 32(10):1491-502。gydF4y2Ba
- 34。gydF4y2Ba
Noctor G,Foyer Ch。抗坏血酸和谷胱甘肽:在控制下保持活性氧气。植物BIOL的ANNU REV。1998年; 49(1):249-79。gydF4y2Ba
- 35。gydF4y2Ba
关键词:卡尔1,赤霉素,休眠,释放gydF4y2Ba燕麦属fatuagydF4y2Ba颖果包括非酶促抗氧化剂和细胞周期激活的胚胎中的参与。Planta。2016; 243(2):531-48。gydF4y2Ba
- 36。gydF4y2Ba
CADMAN CS,TOOROP PE,HILHORST HW,FINCH-SAVAGE我们。基因表达谱gydF4y2Ba拟南芥gydF4y2BaCvi种子在休眠周期中表明一个共同的潜在的休眠控制机制。植物j . 2006; 46(5): 805 - 22所示。gydF4y2Ba
- 37。gydF4y2Ba
雀-野蛮WE,Leubner-梅茨格G.种子休眠和萌发的控制。新植物。2006; 171(3):501-23。gydF4y2Ba
- 38。gydF4y2Ba
hilhorst hw。种子休眠的定义和假设。annu工厂rev在线。2007; 27:50-71。gydF4y2Bahttps://doi.org/10.1002/9780470988848.ch3gydF4y2Ba.gydF4y2Ba
- 39。gydF4y2Ba
AWAN S,Footart S,Finch-Savage我们。母体环境的相互作用和种子活力基因的等位基因差异决定了种子性能gydF4y2BaBrassica oleraceagydF4y2Ba.工厂j . 2018, 94(6): 1098 - 108。gydF4y2Ba
- 40.gydF4y2Ba
胡j,sadowski j,奥斯本Tc,兰德里Bs,Quiros Cf.从四个独立的联动组对齐gydF4y2BaBrassica oleraceagydF4y2BaRFLP映射。基因组。1998; 41(2):226-35。gydF4y2Ba
- 41.gydF4y2Ba
Momoh EJ,周WJ,Kristansson B.压力条件下油菜基因型中的继发性休眠发展的变化。杂草res。2002; 42(6):446-55。gydF4y2Ba
- 42.gydF4y2Ba
Gulden Rh,Chiwocha S,Abrams S,McGregor I,Kermode A,Shirtliffe S.春季乳渣酸应用和激素谱的反应gydF4y2Ba芸苔栗鸟gydF4y2Ba种子相对于次级休眠。加拿大Ĵ博特。2004; 82(11):1618至1624年。gydF4y2Ba
- 43.gydF4y2Ba
Lan Th,Delmonte Ta,Reischmann Kp,Hyman J,Kowalski SP,McFerson J,Kresovich S,Paterson啊。富集的比较图gydF4y2BaBrassica oleraceagydF4y2Ba和gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.基因组研究》2000;10(6):776 - 88。gydF4y2Ba
- 44。gydF4y2Ba
KępczyńskiĴ,在控制休眠的发芽karrikinolide和乙烯的范施塔登J.相互作用gydF4y2Ba燕麦属fatuagydF4y2BaL. Caryopses。植物生长纪录。2012; 67(2):185-90。gydF4y2Ba
- 45。gydF4y2Ba
Simontacchi男,Jasid S,高粱种子的早期萌发期间Puntarulo S.一氧化氮的产生。植物SCI。2004; 167(4):839-47。gydF4y2Ba
- 46。gydF4y2Ba
Kranner I,罗奇T,贝克特RP,特克C,Minibayeva FV。种子萌发过程中的细胞外生产的活性氧和早期幼苗生长gydF4y2BaPisum sativum.gydF4y2Ba.J植物理性。2010; 167(10):805-11。gydF4y2Ba
- 47。gydF4y2Ba
Oracz K,埃尔 - 马鲁夫-Bouteau H,Kranner I,Bogatek R,Corbineau女,贝利C.由氰化氢参与种子休眠减轻绎活性氧物质如萌发期间细胞信号的关键因素的作用机制的研究。植物理性。2009; 150(1):494-505。gydF4y2Ba
- 48。gydF4y2Ba
Shaplel Sn,Wang X,Binder Bm,Schaller Ge。乙烯信号转导机制:受体家族中的重叠和非重叠信号作用。AOB植物。2013; 5:PLT010。gydF4y2Bahttps://doi.org/10.1093/aobpla/plt010gydF4y2Ba.gydF4y2Ba
- 49。gydF4y2Ba
Ruduōi,KępczyńskiJ.野外睡眠中休眠分子研究的参考基因选择(gydF4y2Ba燕麦属fatuagydF4y2Ba用RT-qPCR方法测定颖果。《公共科学图书馆•综合》。2018;13 (2):e0192343。gydF4y2Ba
- 50。gydF4y2Ba
alscher rg,erurk n,heath ls。超氧化物歧化酶(SOD)在植物中氧化应激控制中的作用。J Exp Bot。2002; 53(372):1331-41。gydF4y2Ba
- 51。gydF4y2Ba
贝斯克PC,琼斯RL。在大麦糊粉中,清除活性氧的酶在赤霉素诱导的程序性细胞死亡之前下调。植物杂志。2001;126(1):156 - 66。gydF4y2Ba
- 52。gydF4y2Ba
张志强,王志强,王志强,等。种子萌发诱导对种子萌发的影响gydF4y2Ba燕麦属fatuagydF4y2Ba通过KAR1和GA3涉及反应性氧物质的控制(H颖果gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和o.gydF4y2Ba2gydF4y2Ba-gydF4y2Ba)和酶抗氧化剂(超氧化物歧化酶和过氧化氢酶)在胚和糊粉层。植物生理学杂志。2015;76:169 - 79。gydF4y2Ba
- 53。gydF4y2Ba
Feurtado Ja,Kermode Ar。路径的合并:在种子休眠维持和缓解控制中脱离酸和荷尔蒙串扰。annu工厂rev在线。2018; 27:176-223。gydF4y2Bahttps://doi.org/10.1002/9781119312994.apr0282gydF4y2Ba.gydF4y2Ba
- 54。gydF4y2Ba
植物乙烯受体与乙烯的相互作用。植物医学杂志。2003;5(5):473 - 80。gydF4y2Ba
- 55。gydF4y2Ba
Locke Jm,Bryce Jh,Morris PC。乙烯感知和生物合成抑制剂对大麦萌发和幼苗生长的对比作用(gydF4y2Ba大麦芽gydF4y2BaL.)。J Exp Bot。2000; 51(352):1843-9。gydF4y2Ba
- 56。gydF4y2Ba
Oracz K,埃尔 - 马鲁夫-Bouteau H,Bogatek R,Corbineau女,向日葵种子休眠氰化物的贝利C.推出:串扰与乙烯信号转导途径。J Exp Bot。2008; 59(8):2241-51。gydF4y2Ba
- 57。gydF4y2Ba
Petruzzelli L,Coraggio I,Leubner-Metzger G.乙烯在豌豆种子萌发过程中促进乙烯生物合成,通过1-氨基环丙烷-1-羧酸氧化酶的阳性反馈调节。Planta。2000; 211(1):144-9。gydF4y2Ba
- 58。gydF4y2Ba
李志强,李志强,李志强,等。乙烯合成在豌豆黄化苗上的分布及其对乙烯的调控。acta botanica sinica(云南植物学报),1989;gydF4y2Ba
- 59。gydF4y2Ba
加里博士。植物中的乙烯受体 - 为什么这么多的复杂性?F1000prime批准。2015; 7:39。gydF4y2Bahttps://doi.org/10.12703/P7-39gydF4y2Ba.gydF4y2Ba
- 60.gydF4y2Ba
拟南芥etr1-1突变体乙烯受体在番茄中的诱导表达调控乙烯不敏感。植物杂志。2010;152(4):1928 - 39。gydF4y2Ba
- 61.gydF4y2Ba
Dobrzyn'ska U,Zielin'ska k,Gniazdowska A,Bogatek R.抗氧化系统在HCN中的参与和苹果胚胎的休眠去除。波兰J NAT SCI。2008; 5(SUP):164。gydF4y2Ba
- 62.gydF4y2Ba
Dōbskak,krasuska u,budnicka k,Bogatek r,Gniazdowska A.通过冷分层去除苹果种子与H的波动有关gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,没有生产和蛋白质羰基化水平。J植物理性。2013; 170(5):480-8。gydF4y2Ba
- 63.gydF4y2Ba
王志强,王志强,王志强,等。水稻种子萌发促进剂3-甲基呋喃[2,3 -c]吡喃-2-酮的合成。四面体。2008;49(29 - 30日):4509 - 12所示。gydF4y2Ba
- 64.gydF4y2Ba
Velikova V,Yordanov我,Edreva A.氧化应激和酸雨处理豆类植物的一些抗氧化系统:外源性多胺的保护作用。植物SCI。2000; 151(1):59-66。gydF4y2Ba
- 65.gydF4y2Ba
阮HM,Sako的K,松井A,铃木Y,Mostofa MG,哈CV,田中男,陈LS,土生Y,关M.乙醇通过解毒活性氧增强高盐度胁迫耐受性gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba和米饭。边疆植物科学。2017; 8:1001。gydF4y2Ba
- 66.gydF4y2Ba
ELSTNER EF,Heupel A.抑制亚硝酸盐形成的亚硝酸盐:超氧化物歧化酶的简单测定。肛门生物化学。1976; 70(2):616-20。gydF4y2Ba
- 67.gydF4y2Ba
Misra HP,Fridovich I.超氧化物阴离子在肾上腺素自氧化中的作用和超氧化物歧化酶的简单测定。J Bio Chem。1972; 247(10):3170-5。gydF4y2Ba
- 68。gydF4y2Ba
品牌:Aebi H.过氧化氢酶在体外。在:酶学方法,卷。105.欧洲PMC:科学出版社;1984. p。121-6。gydF4y2Bahttp://dx.doi.org/10.1016/S0076-68gydF4y2Ba.gydF4y2Ba
- 69。gydF4y2Ba
王志强,王志强。云杉针叶中谷胱甘肽和谷胱甘肽还原酶的季节变化。植物杂志。1978;61(1):119 - 21所示。gydF4y2Ba
- 70。gydF4y2Ba
布拉德福德mm。利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物化学。1976; 72(1-2):248-54。gydF4y2Ba
- 71。gydF4y2Ba
关键词:大豆,生长素,赤霉素/脱落酸(GA/ABA),发芽率Sci众议员2017;7(1):12620。gydF4y2Ba
- 72。gydF4y2Ba
康塞普西翁M,Lizada C,杨SF。用于1-氨基环丙烷-1-羧酸的简单敏感的测定。肛门生物化学。1979; 100(1):140-5。gydF4y2Ba
- 73。gydF4y2Ba
叶w,东jg,杨sf。苹果果实1-氨基环丙烷-1-羧酸盐合成酶的纯化与表征。植物理性。1991; 95(1):251-7。gydF4y2Ba
- 74。gydF4y2Ba
关键词:冬南瓜,中果皮,1-氨基环丙烷-1-羧酸氧化酶冈山大学农业科学学院1993;82(1):49-59。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Ying Feng博士在整个工作中的指导方针。gydF4y2Ba
资金gydF4y2Ba
该研究得到了中国安徽省安徽菜籽 - 棉花产业体系第13届五年(AHCYJSTX-04)和国家重点研发计划(2018年汇款0100600)的资金。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
如设计和执行的实验,MWR和ZXY分析了数据,ZZH和ZKJ在所有实验中提供了指导。所有作者都读过并批准了稿件。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
实验中使用的引物序列列表。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Sami,A.,Riaz,M.W.,Zhou,X.gydF4y2Baet al。gydF4y2Ba减轻休眠gydF4y2BaBrassica oleraceagydF4y2Ba使用NO和KAR1具有乙烯生物合成途径,ROS和抗氧化酶的种子进行修饰。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba577(2019)。https://doi.org/10.1186/s12870-019-2118-ygydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2118-ygydF4y2Ba
关键字gydF4y2Ba
- Brassica oleraceagydF4y2Ba
- KAR1gydF4y2Ba
- 一氧化氮gydF4y2Ba
- 乙烯gydF4y2Ba
- 种子休眠gydF4y2Ba
- 种子萌发gydF4y2Ba
- 罗斯gydF4y2Ba
- 抗氧化酶gydF4y2Ba