摘要
背景
白腐病是最危险的真菌病害之一,严重影响葡萄果实的生产和品质。然而,目前对白腐病的研究还很少,因此,寻找白腐病候选基因对选育抗病品种具有重要意义。通过田间观察和室内试验,栽培品种“维多利亚”和“卓色香”对白腐病的抗性差异显著。为了解其分子机制,利用Illumina和单分子实时(SMRT)测序技术对不同表型的葡萄叶片进行RNA测序。
结果
通过对两个葡萄品种的全长转录组测序,构建了一个包含53,906 reads的转录库,其中包括已知和新的转录本。参与水杨酸(SA)和茉莉酸(JA)合成途径的基因表达水平不同。此外,四个关键转录因子(TFs),NPR1、TGA4 Pti6, 和MYC2鉴定了SA和JA信号途径的所有参与,表达谱揭示了致病性相关蛋白1(PR1)抗性基因的不同调节,如四种TFS介导的那样。
结论
全长转录本测序可以大大提高葡萄基因预测和基因功能研究的准确性和完整性。本研究结果有助于鉴定候选抗白腐病基因,并进一步了解与葡萄抗白腐病相关的基因及其调控机制。
背景
葡萄藤 (vitis.spp., family Vitaceae) is a perennial woody vine with a history of cultivation extending over 8000 years [1].由于其适应不同环境的能力和较高的经济和社会价值,葡萄已经在世界范围内种植。根据国际葡萄酒和葡萄组织的数据,2017年葡萄种植面积达到870万公顷[2].根据联合国粮农组织(FAO)统计数据,2017年中国葡萄浆果产量1310万吨,居全球第一,占全球葡萄浆果产量的15.1% (http://www.fao.org/faostat/zh/#home).在中国,vitis ViniferaL.是主要鲜食葡萄浆果种类,但是,由于高温和降水是东亚季风气候的特点,V. Vinifera品种易受多种真菌病害的侵袭[3.,4,5].葡萄白色腐烂(由Coniothyrium diplodiella.(SPEG)孢)是影响葡萄藤的主要的真菌疾病之一。在受这种疾病影响许多葡萄浆果生产地区,生产已经减少了至少16.3%[6,7].白腐感染的组织包括树叶,浆果和新梢。造成天气事件,昆虫和其他真菌病伤是白腐病菌的主入口点。在葡萄浆果生产,不推荐使用抗真菌药物,因为它会导致严重的环境污染和食品安全问题。目前,许多品种的葡萄资源对于白腐病抗性,包括用于抗性基因识别和基线信息的强大资源为白腐病抗性育种。
在自然界中,植物可以将光能转化为碳水化合物,为自身的发育提供能量,而这些碳水化合物也是多种微生物的感染目标,包括生物营养、半生物营养和坏死营养物种[8].植物已经进化了病原识别和防御的复杂机制。模式识别受体(PRR) - 触发的免疫(PTI)是全身性获得性抗性(SAR)中的第一层植物免疫,其通过识别病原体相关分子模式(PAMP)来介导,并且对大多数病原体非常有效[9,10.,11.].然而,病原菌可以合成效应蛋白并释放到植物细胞中,对抗PTI的诱导,提高其在宿主细胞中的存活率。植物已经进化出抗性基因来应对这种效应引发的易感性;这些基因识别效应体和介导效应体触发免疫(ETI),植物免疫的第二层[12.,13.,14.].通过生物和非生物胁迫诱导发病性相关的蛋白质(PRS),并在植物SAR中发挥关键作用[15.];由病原性细菌感染后,PRS的表达可以增强植物抗性[16.].致病相关蛋白1 (pathogenesrelated 1, PR1)是PR家族中一个主要的抗病反应蛋白,参与植物对环境胁迫的保护[14.,17.].水杨酸(Salicylic acid, SA)和茉莉酸(jasmonic acid, JA)在植物SAR中起着至关重要的作用,PR1的表达机制受这些途径中多种酶和转录因子(transcription factor, TFs)的复杂机制调控[18.,19.,20.,21.].
下一代测序(NGS)是一项高通量、低成本的技术,极大地促进了基因组学的发展。然而,NGS的一个主要挑战是获得的读取长度很短[22.,23.,24.,25.].从太平洋生物科学公司(门洛帕克,CA,USA),单分子实时(SMRT)测序属于第三代测序26.],提供了一个可能的解决方案,以这个缺点。与SMRT测序,能够实现全长读取基于荧光标记的核苷酸的实时成像,因为它们是沿着单个DNA模板分子[合成27.],可广泛用于识别新的基因和转录本[28.,29.].在本研究中,两个葡萄品种与到白腐不同的电阻,即“维多利亚”(VT,V. Vinifera)和“卓思祥”(ZX;V. Vinifera×诉出发用离体叶片培养法感染白腐病孢子。利用不同侵染期(0 h和72 h)对两个品种的葡萄叶片进行RNA测序(RNA- seq)分析,基于Illumina (San Diego, CA, USA) X Ten和Pacific Biosciences Sequel平台。重要的抗白腐基因PR1其由SA和JA介导的调控网络进行了鉴定。参与这两种途径的基因提供了葡萄白腐病抗性育种所需的参考基因,并在这里获得将大大提高在今后的研究的准确性和小道消息成绩单分析的完整性全长成绩单。
结果
白腐病抗性评价
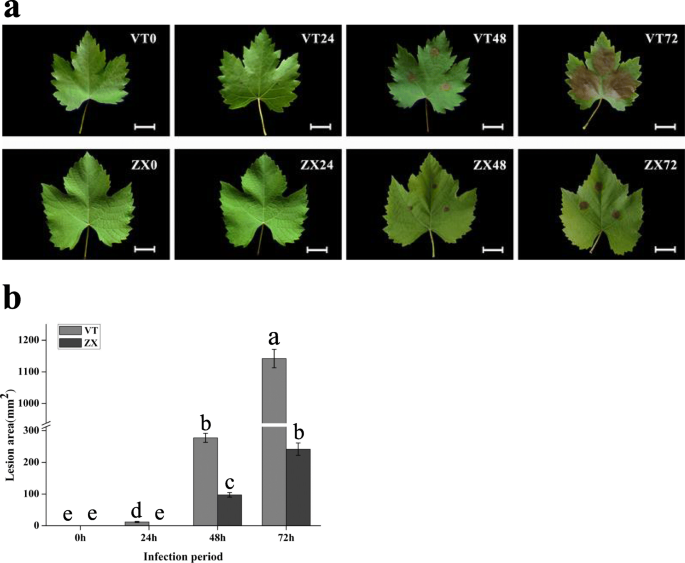
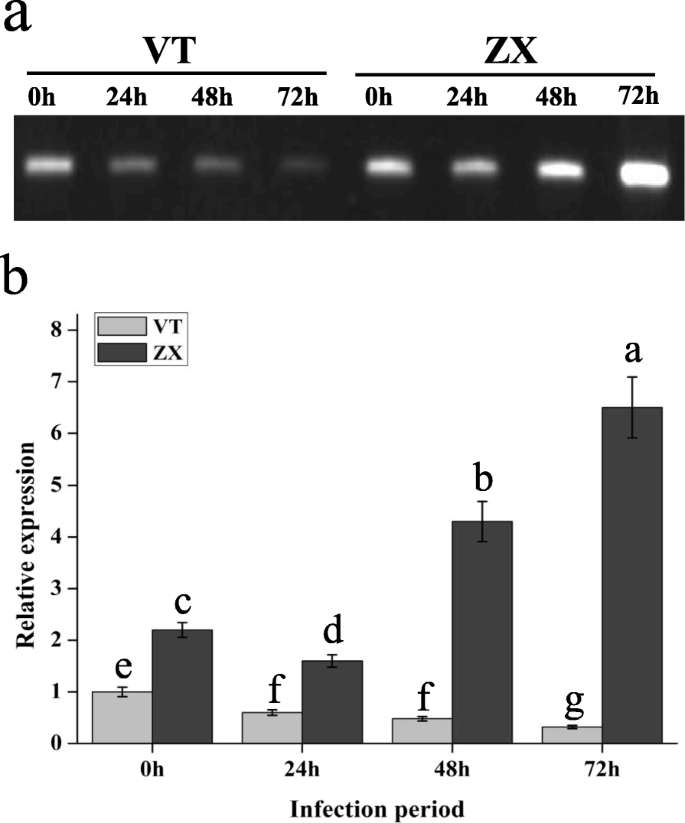
使用白色腐孔悬浮液感染来自品种vt和Zx不同分支的叶子。在感染后0,24,48和72小时,基于病变区域评估叶片的白色腐抗。72小时后,来自两种品种的叶片呈现出不同程度的白腐感染(图。1a).室速叶病变面积1141.86±29.13 mm2,这显着高于ZX(241.88±19.51毫米)2)(图。1b)。我们的研究结果表明,与VT相比,白腐能能够感染葡萄树叶的抗性叶片的能力,并且ZX表现出更高的白色腐蚀性。
Illumina和SMRT测序数据分析
葡萄叶在0和72小时的情况下用于RNA-SEQ分析。每个品种的12个样品(每次感染时段的三次重复)用于illumina测序。除去低质量读取和修剪适配器序列后,获得了321,687,667个清洁读取(附加文件1:表S1)。使用Pacific Biosciences Sequel平台对两个SMRT细胞进行SMRT测序。获得的647947个循环共识序列(CCS)中包括569624个全长非嵌合序列(FLNC)和78323个非FLNC序列。FLNC序列的平均长度为1059 bp。基于Illumina测序数据使用proofread软件对FLNC reads进行校正[30.],和493335 FLNC读取被保留并用于进一步的分析(附加文件2:表S2)。
基因结构与功能注释
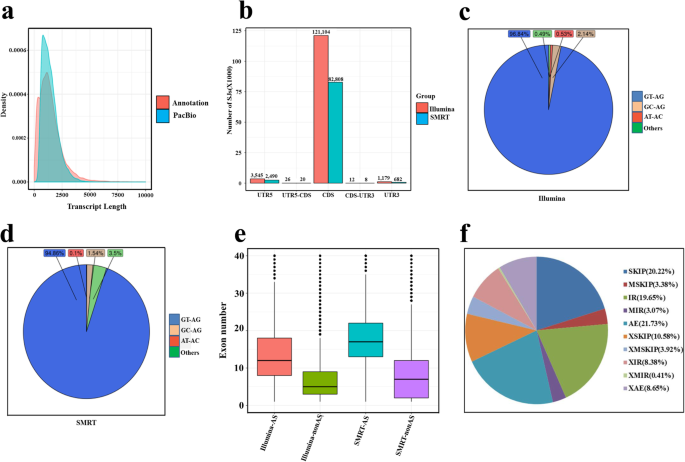
的V. Vinifera基于Pinot Noir近交系PN40024在2007年获得的基因组含有26,346个注释的转录物(http://www.genoscope..cns.fr /走读生GenomeBrowser /葡萄)。利用本研究获得的493,335个FLNC reads,在参考基因组基础上进行基因位点和转录本的鉴定。去除多余的转录本使转录本数量减少到37,010个,对应18,698个基因座,每个转录本代表一个唯一的全长转录本。总的来说,我们之前在葡萄基因组中注释了14699个基因位点,在我们的研究中,通过SMRT测序首次鉴定了3999个基因位点和27560个转录本(表)1).新同种型的长度和外显子数(附加文件3.:数据S1;每个外显子的开始和终点网站表示为“,”和每个同种型的不同外显子,以及它们的注释和表达水平[以每百万百万读的外显子模型的碎片(FPKM)值](附加文件4和5:分别为数据S2和数据S3)。通过SMRT测序产生的转录本数量在0到2500 bp之间,显著高于参考基因组(图。2a). SMRT测序数据中位外显子大小为122 bp,与参考基因组相同。每个基因的中位基因大小和平均编码外显子数分别为4080 bp和10.13个,高于参考基因组。选择性剪接(AS)是决定发育和应激反应中蛋白质多样性的因素之一[31.,32.].在SMRT和Illumina数据集中,大多数剪接连接(splicing junction, SJs)位于编码序列(coding sequences, CDS)中,这表明AS可能影响蛋白产品(图。2b).大多数剪接给体-受体位点为典型的u - ag位点(Illumina为96.84%,SMRT为94.86%)。2C,D),其次是GC-AG,Illumina的2.14%,SMRT中1.54%(图。2c, d)。AU-AC剪接位点在Illumina中仅占0.53%,在SMRT中仅占0.1%(图2)。2c,d),也称为u12型内含子,据报道具有重要的调控作用[33.].有趣的是,作为基因的外显子数高于非基因的外显子数量(图。2e)。其中作为类型,外显子跳跃具有最大的基因数(跳过,6376),然后是替代的外显子(AE,5084)和内含子保持(IR,5272)(图。2f和附加文件7:数据S4)。已知基因中有3275个进行了选择性剪接,每个基因的异构体编号和ID见附加文件6:数据S5,转录GSVIVT01031973001有34个同种型和编码肌醇半乳糖苷合酶,和基因GSVIVT01031973001有30个同种型和编码的富含甘氨酸的RNA结合蛋白GRP2A。我们还发现,1841长非编码RNA(LncRNAs)(附加文件8:数据S6),占所有新型同种型的6.47%;76个融合基因(附加文件9:数据S7),不同融合类型(染色体间和染色体内)的数量分别为38。此外,我们还从9039个基因中鉴定了22,638个polyA位点,其中5364个存在选择性聚腺苷酸化(APA)(附加文件)10.:数据S8)。
我们将SMRT测序鉴定的新转录本与参考基因组注释的转录本结合起来,构建了一个包含53,906份转录本的新转录本文库(26,346份来自参考基因组,27,560份来自新的和已知的基因座)11.:数据S9)。利用这些转录本对美国国家生物技术信息中心(NCBI)非冗余(NR)、瑞士- prot、基因本体(GO)、真核同源基因(KOG)集群蛋白数据库和京都基因基因组百科全书(KEGG)通路数据库进行检索,检索结果见表2.
根据Illumina公司和SMRT数据基因表达分析
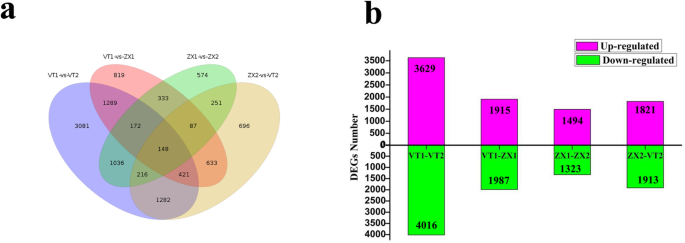
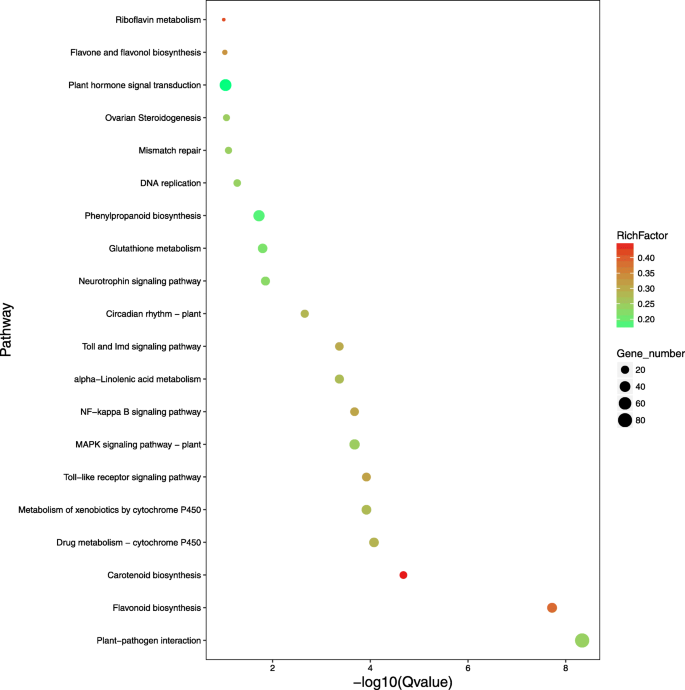
Illumina测序产生的321,687,667个clean reads使用Bowtie软件与新构建的转录本库进行了比对[34.],匹配速率在附加文件中显示12.:表S3。使用FPKM值和RSEM软件[计算VT1,VT2,ZX1,和ZX2样品的基因表达模式35.].使用DESeq方法对差异表达基因(DEGs)进行统计评估[36.].结果显示,在VT1 vs. VT2中发现7645个deg, ZX1 vs. ZX2中发现2817个deg, VT1 vs. ZX1中发现3902个deg, VT2 vs. ZX2中发现3734个deg;这四个文库共有148个deg(图。3.a,b)。VT1与VT2和ZX1与ZX2比较显示比在白腐感染后的Zx中的下调基因在VT和更上调的升压基因中显示出更多的下调基因。白色腐易感染的VT品种在感染过程中比白腐型品种ZX更加次数,表明葡萄白腐型在改变易感形式的叶片代谢时更成功。基于VT1与ZX1和ZX2与VT2比较,ZX中的基因下调比在感染后0小时的vt中的vt,ZX中的更高调节基因在72小时后的血液感染后,表明在感染后,在耐药品种中高度表达更白腐蚀基因。使用KEGG PATHWAY数据库搜索生物交互功能网络,我们为263 kegg路径分配了2078次。顶部20富集的Kegg路径如图2所示。4和额外的文件13.:数据S10。
候选基因的差异表达分析
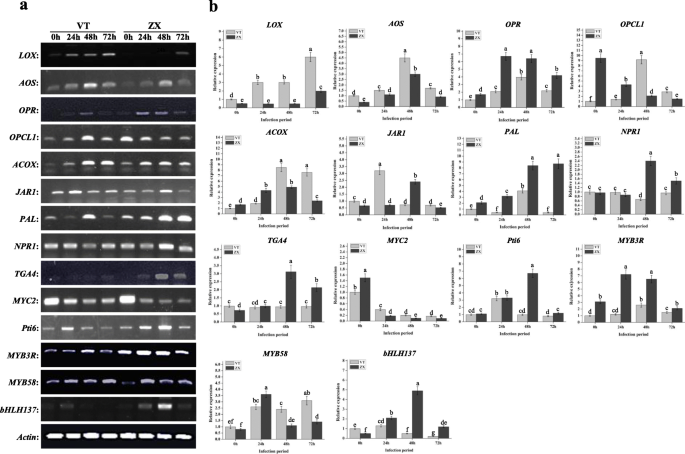
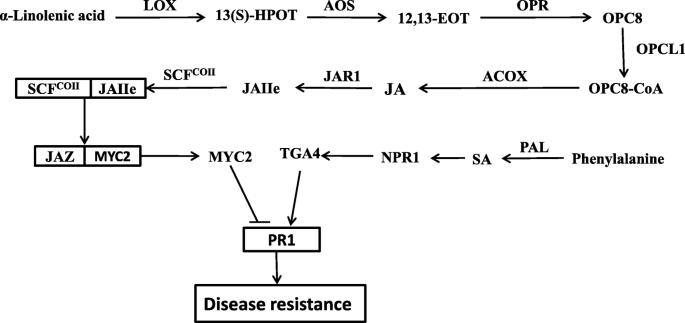
KEGG富集分析显示在“MAPK信号”中存在许多不同富集的基因(Pe值≤6.34- 6)、“植物与病原体相互作用”(Pe值≤1.73- 11.)、α -亚麻酸代谢(p值≤1.51E)- 5)途径在感染72小时后(图。4).根据我们的结果,葡萄PR1基因(GSVIVT01038540001,附加文件11.“MAPK信号通路”和“植物-病原互作”通路均有差异表达。经实时定量(qRT)和半定量PCR分析,表达PR1ZX在感染后24 h表达量下降,在48 ~ 72 h表达量上升(图2)。5).在植物SAR中,调节机制PR1涉及到一个复杂的网络PR1主要由SA和JA诱导表达。通过qRT-PCR和半定量PCR鉴定JA和SA合成相关基因的表达及信号通路。结果表明,白腐病侵染后,VT和ZX中几个位于JA合成上游的关键酶基因表达上调。的表达水平溶酶氧化酶(液态氧;GSVIVT01025340001,附加文件11.:数据S9)在ZX和VT中连续增加,在感染后72小时达到峰值;此外,VT中的表达水平高于ZX。联烯氧化物合成酶(AOS.;GSVIVT01009616001,附加的文件11.:数据S9)和酰基辅酶A氧化酶(ACOX;GSVIVT01016325001,附加的文件11.:在感染后也诱导数据S9,并且它们在感染后48小时达到达到的表达水平;VT中这两个基因的表达水平高于感染后48至72小时的ZX中的表达水平。表达12-oxo-phytodienoic酸还原酶(超载比;GSVIVT01013386001,附加的文件11.ZX基因和VT基因在感染后24 ~ 48 h表达量最高,VT基因在感染后48 h表达量最高,且ZX基因表达量高于VT基因辅酶a连接酶1(OPCL1;GSVIVT01008694001,附加的文件11.:Data S9) was repressed in ZX at the onset of white rot infection, but induced in VT peaking at 48 h post infection. As a key enzyme-coding gene involved in SA synthesis,朋友(GSVIVT01006148001,额外的文件11.:Data S9) was up-regulated and peaked at 48 h post infection in both ZX and VT, and its expression level was higher in ZX than in VT. The expression of genes and TFs located downstream the JA and SA pathways were also identified. In the JA pathway,茉莉酸抗性1(JAR1;GSVIVT01030558001,附加的文件11.:数据S9)在ZX和VT中上调,并在ZX后24小时发布的24小时达到峰值。转录因子MYC2(GSVIVT01027162001,附加文件11.:Data S9) was repressed after white rot infection, although its expression level was higher in VT than in ZX from 24 to 72 h post infection. Regarding the SA pathway,NPR1.(GSVIVT01015181001,额外的文件11.:数据S9)和TGA4(GSVIVT01033632001, Additional file 11: Data S9) ZX显著上调,并在感染后48 h达到峰值;在佛蒙特,NPR1.在感染后48小时内被抑制,而TGA4.感染后48 ~ 72 h,这两个基因在ZX中的表达量高于在VT中的表达量(图2)。6).这些结果表明,SA和JA可介导的表达PR1白腐病侵染后向相反的方向(图。7).
JA和SA合成及信号通路相关基因的半定量PCR和qRT-PCR分析。浅灰色条形代表品种VT,深灰色条形代表品种ZX。x轴为白腐病侵染期,误差条为3个生物重复的标准差。条形图上的小写字母代表了邓肯的多个范围测试(DMRT)的两个品种和不同感染时期之间的显着差异P< 0.05。缩写:液态氧:脂肪氧合酶;AOS.:氧化烯合成酶;OPCL1:OPC-8:0辅酶A连接酶1;ACOX:酰基 - CoA氧化酶;超载比: 12-氧植物二烯酸还原酶;朋友:苯丙氨酸ammonia-lyase;JAR1:茉莉酸电阻1;NPR1.:致病性相关基因1的非富态。TGA4:的bZIP转录因子4;MYC2: bHLH拉链型转录因子;PTI6.:ERF转录因子;MYB3R和MYB58:MYB转录因子;bHLH137:BHLH转录因子
一些TFS可能在植物开发和阻力中发挥重要作用,在VT2与ZX2比较中的表达式中呈现大的折叠变化。二my助教和一个基本螺旋循环螺旋(Bhlh.)TF后白腐病感染差异表达。然而MYB3R(GSVIVT01027493001,额外的文件11.:数据S9)和bHLH137(GSVIVT01008628001,附加文件11.:数据S9)在感染后24 ~ 72 h, ZX和VT均表达上调,且ZX的表达水平高于VT。MYB58(GSVIVT01036802001,额外的文件11.:数据S9)在白腐病感染后诱导了ZX和VT的表达,但ZX和VT在感染后24 h表达量最高,VT在感染后72 h表达量最高(图2)。6).
讨论
植物激素是小信号分子;除了调节植物的发展之外,他们还在植物防御中对通过SAR进行生物和非生物胁迫发挥重要作用。许多研究都强调了这一作用PR1辣椒疫霉病和青枯病的抗性[37.],在大麦[白粉病38.],烟草中的植物病和灰霉素[18.,39.),等等。在本研究中,葡萄白腐病由一种典型的坏死营养病原体引起,诱导一系列基因和转录因子,包括液态氧,AOS.,超载比,OPCL1,ACOX,JAR1,PAL,NPR1,TGA4, 和MYC2在JA和SA的合成和信号通路中。
越来越多的研究已经集中在植物SAR中SA和JA信号之间的串扰,包括调解PR1表达式[17.,40,41.,42.].Jasmonate ZIM-domain (JAZ)蛋白在JA信号通路中起重要作用。在没有环境胁迫的情况下,JAZ蛋白可以结合MYC2并抑制其监管功能。在SA信号路线中,NPR1.和TGA.积极促进的活动需要互动公关由SA介导[20.,21.].根据目前的结果,两者之间的相互作用NPR1.和TGA4可能在……中起重要作用PR1表达和白腐病抗性。Gu等研究表明SA可诱导表达PR1通过PTI4 / 5/6并增强植物的防御能力白粉病白粉菌和两pathovar番茄[18.].有趣的是,在拟南芥,乙烯反应因子(ERF)阿伯可以与TGA.然后调节表达公关基因(43.].在这里,我们发现,PTI6.(chr6.849.1,附加文件11.:数据S9), ERF家族在白腐病感染后诱导的TF,在ZX中表达高于VT(图。6).根据我们的结果,两者之间的互动TGA4和PTI6.也可能在促进PR1在白腐抗性表达。
根据这里得到的结果,MYC2, NPR1,TGA4, 和PTI6.可能会发挥重要角色PR1而SA和JA信号通路在这些转录因子的调控中具有拮抗作用。Spoel等人发现,作为SA信号通路的关键调控因子,NPR1.可以压抑的表达液态氧,涉及JA合成,从而压制JA的效果PR1表达式[44.].然而,Li等人指出两者之间的相互作用mdmyc2.和ERF2抑制的调节作用ERF2乙烯合成中的靶基因[45.].因此,两者之间的相互作用MYC2和PTI6.也可能在PR1表达和白腐病抗性。总体而言,转录因子MYC2负调控葡萄白腐病抗性NPR1.,TGA4, 和PTI6.积极调节它。迄今为止获得的结果表明这些TFS的监管机制PR1表达在葡萄白腐病抗性中是复杂而重要的。
转录因子my超级家庭有一个保守的my在调节植物发育和应对环境胁迫方面起着重要的作用。在A. Thaliana.,AtMYB96通过诱导SA生物合成来介导防止细菌感染[46.],AtMYB30通过非常长链脂肪酸代谢的转录激活,参与了对细菌感染的抗性和相关的细胞死亡反应[47.),而AtMYB44对韧皮部取食的桃蚜(Myzus persicae和食叶专家小菜蛾(小菜蛾L.)幼虫[48.].许多其他的myTFs,如ATMYB13,ATMYB15,ATMYB33,ATMYB70,ATMYB73,ATMYB77, 和AtMYB101,已被报告参与其中A. Thaliana.防御环境压力[49.,50.].到目前为止,还没有关于my转录因子介导了葡萄藤对白腐病的防御,这里,两个my转录因子(MYB3R和MYB58白腐病对葡萄植株的影响尤为显著MYB3R,这表明在ZX比VT高的表达水平。
转录因子Bhlh.超级家族也调节植物的抗性。在非生物胁迫下,bHLH122可以改善A. Thaliana.对干旱和渗透胁迫的抵抗力[51.].几项研究表明,在生物压力下,bHLH25, bHLH27, 和bHLH060是负调节因素A. Thaliana.防范囊肿线虫heterodera schachtii.施密特。和两[52.,53.].在本研究中,bHLH137被显著诱导VT和ZX后白腐病感染,从而揭示了该TF可能是葡萄白腐防线的正调节。
通过KEGG pathway分析发现,在- log10q值方面,前6个类别中有很多deg富集。“类胡萝卜素生物合成”途径富集程度最高,富集的DEGs与该途径相关15-CIS-植物 - 植物合酶(crtB),β-胡萝卜素异构酶(dwarf27),β-胡萝卜素3-hydroxylase(crtZ),玉米黄质环氧(齐柏林飞艇),胶囊素合成酶(CCS1),9-CIS-环氧丙酮蛋白二氧化酶(数控),淤积醛氧化酶(AAO3),(+)脱落酸羟化酶8”(CYP707A)和脱落β-葡糖基转移酶(AOG)合成。在“药物代谢-细胞色素P450”和“通过细胞色素P450代谢外源性药物”途径富集的DEGs与之相关二甲基苯胺单氧酶(FMO),谷胱甘肽S-transferase(GST),细胞色素p450家庭1亚家族含有多肽1(CYP1A1)。在“Toll样受体信号传导途径”中,富含富含的DEG与脂多糖结合蛋白(LBP),白细胞介素-1受体相关激酶1(IRAK1),白细胞介素-1受体 - 相关激酶4(IRAK4)。在“类黄酮生物合成”途径中,富集的DEGs与查耳酮合酶(CHS),类黄酮3 '单氧酶(CYP75B1),双功能二氢黄酮醇4-还原酶/黄酮4-还原酶(DFR),柚苷配基3-dioxygenase(F3H),类黄酮3 ',5 ' -羟化酶(CYP75A),花色素合成酶(ANS),leucoanthocyanidin还原酶(lar),和花青素还原酶(ANR)。上述大多数deg的功能已被研究,但主要集中在植物的次生代谢反应,如类胡萝卜素和类黄酮生物合成途径中的deg,以及cyp450相关的deg [54.,55.,56.,57.,58.,59.,60.,61.,62.,63,64,65,66,67,68].在“植物 - 病原体相互作用”途径丰富了DEGS大多参与了过敏反应,如相关度的视角呼吸爆发氧化酶(RBOH) [69,70),热休克蛋白90(HSP90)[71[白色腐烂感染后,Zx在Zx中的表达水平高于VT。总体而言,ZX中富含上述途径的大多数含量的表达均高于VT,尤其是“类胡萝卜素生物合成”和“黄酮类生物合成”途径的含量。这表明,除了植物SAR中涉及的基因外,还在植物次生代谢物生物合成中涉及的一些基因可能在葡萄白腐蚀性中发挥重要作用。但是,该监管网络复杂,需要进一步研究。
结论
在生物胁迫(白腐病感染)后,我们对葡萄转录组进行了SMRT和Illumina测序。SMRT数据显示了18698个基因位点和37010个全长转录本,其中3999个新基因位点和30860个新转录本。通过将这些新的转录本与葡萄藤参考基因组中注释的转录本相结合,我们构建了一个包含53,906个转录本的新文库。本文获得的新全长转录本为鉴定新的葡萄抗病基因,特别是与生物胁迫反应相关的抗病基因提供了重要参考。我们还发现PR1在葡萄白腐病抗性中,SA和JA的表达是至关重要的。本研究揭示的候选基因丰富了我们对葡萄白腐病抗性的认识,并为葡萄白腐病抗性育种提供了依据。
方法
植物材料与白腐病的侵染
“维多利亚”号幼而健康的叶片(V. Vinifera)和“珠仙”(V. Vinifera×诉出发从沉阳农业大学,辽宁省,P. R.中国的葡萄实验园收集L.)品种(E123°24',N41°50')。Coniothyrium diplodiella.菌株JZB3700001来源于北京市农林科学院华北果树病虫害环境友好治理北京市重点实验室。如前所述,对采集的叶片进行表面消毒[72].灭菌后,每个品种的叶子放在塑料培养皿刺破左侧,中间和右侧区域。10-μL106然后在伤口点上滴下/ ml白色腐雾悬浮液以诱导白腐害感染。将所有叶片在28℃的潮湿室中孵育95%相对湿度。七十二个小时后,感染的叶片用于白色腐烂感染调查,使用YMJ-C智能叶面积计(中国Tuopu仪器有限公司)测量感染区域的病变区。从两个感染阶段,0和72小时叶,然后在液氮中快速冷冻并储存在-80℃下进行进一步分析。
RNA提取和测序
采用植物总RNA分离试剂盒(Plant Total RNA Isolation Kit, Sangon Biotech, Shanghai, China)从不同葡萄品种叶片中提取总RNA。不。SK8631),根据制造商的说明。RNA纯度和完整性分别在NanoDrop 2000 (Thermo Fisher Scientific, Waltham, Ma, USA)和Agilent 2100 (Agilent Technologies, Santa Clara, CA, USA)设备中进行测量。
为了进行SMRT测序,将每个叶片样本的纯rna进行聚合,并使用SMARTer™PCR cDNA synthesis Kit (Takara Bio Inc., Mountain View, CA, USA)进行cDNA合成。逆转录酶(RT)在片段的聚(A)尾开始合成,然后合成与RNA互补的cDNA。第二次扩增经BluePippin系统检测的全长cDNA片段。制备出双链cDNA后,通过外切酶将剩余的悬垂部分转化为钝端,然后将带有发夹环结构的SMRT适配器连接到cDNA的末端。然后使用两个SMRT细胞在太平洋生物科学Sequel系统上对SMRTbell模板进行测序。使用SMRT Link v5.0对原始数据进行预处理和过滤,主要参数为:最小通过数= 1;最小预测精度= 0.8;最低阅读分数= 0.65。
通过Illumina测序,构建感染葡萄叶片在感染后0和72 h的cDNA文库,每个品种3个重复。cDNA文库在Illumina X Ten高通量测序平台上测序,对端reads为150 bp。
基因座和亚型的鉴定
FLNC的误差校正与高品质的Illumina使用Proovread版本2.12采用默认参数[进行短读取读取30.].校正后,FLNC序列与葡萄藤参考基因组(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)使用GAMP软件[73].亚型有至少两个FLNC读取,或者一个FLNC阅读百分比的身份(PID)高于99%,或者说是完全支持通过Illumina读取或葡萄基因组的注释是保留所有结点的支持。Isoforms with overlap > 20% (at least one exon overlap > 20%) were considered to be from the same gene locus. New loci and isoforms were identified as follows: 1) no overlap or the overlap region was less than 20% when blast with the genome annotation; 2) the overlap region was more than 20% but the isoform direction was opposite. Known gene novel isoforms were determined as follows: 1) when compared with the genome annotation, one or more new splice sites were discovered in the isoforms; 2) isoform in our study and the annotated transcript of reference genome are not signal exons gene at the same time.
可变剪接事件
由于事件被分类和表征,通过使用ASProfile软件比较相同基因座位的不同同种型[74]基于全长同种型由SMRT测序来实现,在本研究中的AS事件外显子跳跃和盒外显子(SKIP,MSKIP),单(IR)的保留和多个(MIR)内含子,可选的外显子末端(5',3',或两者)(AE),近似外显子跳跃(XSKIP)和盒外显子(XMSKIP),单(XIR的近似保留)和多个(XMIR)内含子和近似可变外显子的端部(XAE)。
融合基因,RNA信息港和替代多聚腺苷酸化(APA)预测
融合基因如下鉴定:1)FLNC重叠的来自参考基因组的两种或更多种基因座,每个基因座的重叠区域小于10bp;2)每个基因座的距离在参考基因组中大于50kb;3)FLNC与全局PID≥10%和局部PID≥90%;4)至少有两个Illumina读数必须支持每个基因座。本研究中的LNC RNA和APA预测根据引言[75,76使用CPATv1.2.2和Tapis软件。
基因功能注释
为了了解基因功能,使用Diamond软件对NCBI NR、Swiss-Prot和KOG数据库进行了注释[77].在Blast2GO (https://www.blast2go.com/)获取GO注释。KEGG路径分配使用KOBAS软件进行[78].
差异基因表达分析和qRT-PCR验证
Illumina的数据进行查询,以使用蝶形软件[新构建的文库(包括已知的和新的同种型)34.].利用RSEM通过FPKM计算基因表达水平[35.].使用DESEQ包用于识别具有阈值虚假发现率(FDR)<0.05的DEG,以及记录2fold change (FC)| > |1| [35.].使用超几何测试的Benjamini-Hochberg的多重检验调整进行基因本体和KEGG途径富集分析。如上所述,进行从在每个感染阶段每个品种的RNA提取。将cDNA从使用PrimeScript RT™试剂盒(。;目录RR047A TaKaRa公司,草津,日本)的RNA合成。cDNA的5倍稀释液作为模板。将反应溶液含有SYBR®PremixExTaq™II(TLI RNA酶H加)(TaKaRa公司;目录RR820A)和定量RT-PCR在ABI QuantStudio 6的Flex系统被进行(应用生物系统公司,福斯特城,CA,USA)。所选择的基因的相对表达水平,标准化为葡萄β肌动蛋白[79,用2——ΔΔCt方法。使用三种生物重复进行所有反应。用于验证DEG的引物列于其他文件中14.:表S4。
数据和材料的可用性
支持本文中给出的结果的数据作为附加文件包含。本研究生成的两个SMRT库和12个Illumina RNA-seq库的原始reads已上传到Sequence Read Archives Database (http://www.ncbi.nlm.nih.gov/sra/),加入号为SRP151613。
缩写
- AAO3:
-
淤积醛氧化酶
- ACOX:
-
酰基辅酶A氧化酶
- AE:
-
替代外显子结束
- ANR:
-
花青素还原酶
- ANS:
-
花青素合成酶
- aog:
-
脱落β-葡糖基转移酶
- 代谢:
-
联烯氧化物合成酶
- APA:
-
可变聚腺苷酸化
- 作为:
-
替代拼接
- bHLH137:
-
bHLH转录因子
- CCS技术:
-
圆形的共识序列
- CCS1:
-
辣椒红素合酶
- CHS:
-
Chalcone合成酶
- 基因crtB:
-
15 cis-phytoene合酶
- crtZ:
-
β-胡萝卜素3-hydroxylase
- CYP1A1:
-
细胞色素P450家族1点亚家族的多肽1
- CYP707A:
-
(+)脱落酸羟化酶8”
- CYP75A:
-
黄酮类化合物3',5'-羟化酶
- CYP75B1:
-
类黄酮3 '单氧酶
- 度:
-
差异表达基因
- DFR:
-
双功能二氢黄酮醇4-还原酶/黄烷酮4-还原酶
- DWARF27:
-
β-胡萝卜素异构酶
- 指数:
-
效应触发的免疫力
- F3H:
-
柚苷配基3-dioxygenase
- FLNC:
-
全长非嵌合
- 弗兰克-蒙塔吉尼:
-
二甲基苯胺单加氧酶
- FPKM:
-
每百万外显子模型的碱基片段读映射
- 走:
-
基因本体数据库
- 销售税:
-
谷胱甘肽S-transferase
- 一半:
-
热休克蛋白90
- 红外:
-
基因内区保留
- IRAK1:
-
白介素-1受体相关激酶1
- IRAK4:
-
白介素-1受体 - 相关激酶4
- JA:
-
茉莉酸
- JAR1:
-
茉莉酸性抗性1
- KEGG:
-
京都基因与基因组百科途径数据库
- KOG:
-
真核同源组数据库
- 政治:
-
Leucoanthocyanidin还原酶
- LBP:
-
脂多糖结合蛋白
- LncRNA:
-
长非编码rna
- 液态氧:
-
脂氧合酶
- myb3r和myb58:
-
MYB转录因子
- MYC2:
-
的bHLH拉链型的转录因子
- NCBI:
-
国家生物技术信息中心
- nced:
-
9-CIS-环氧丙酮蛋白二氧化酶
- NGS:
-
新一代测序
- NPR1:
-
发病相关基因的非表达
- NR:
-
NCBI非冗余蛋白质数据库
- OPCL1:
-
辅酶a连接酶1
- 超载比:
-
12-苯二甲二烯酸还原酶
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- pamp:
-
其分子模式
- PR1:
-
发病相关蛋白1
- PRR:
-
模式识别受体
- PRs:
-
Pathogenesis-related蛋白质
- PTI:
-
PRR触发的免疫力
- Pti6:
-
ERF转录因子
- RBOH:
-
呼吸爆发氧化酶
- 山:
-
水杨酸
- SAR:
-
系统获得性耐药
- 跳过:
-
外显子跳跃
- SMRT:
-
单分子实时
- TF:
-
转录因子
- TGA4:
-
bZIP转录因子4
- ZEP:
-
Zeaxanthin环氧酶
参考文献
- 1。
费歇尔BM,Salakhutdinov I,Akkurt男,艾巴赫R,爱德华兹KJ,特普费尔R,等人。真菌病抗性因素的葡萄的分子地图上数量性状基因座分析。Al Appl Genet。2004; 108(3):501-15。https://doi.org/10.1007/s00122-003-1445-3.
- 2。
OVI。全球状况报告:发展和趋势;2018.http://www.oiv.int/en/oiv-life/global-state-of-conditions-report-developments-and-trends-april-2018
- 3。
万瑞,侯旭,王旭,曲静,宋世胜,王勇,等。中国野生葡萄抗性基因型评价Botrytis cinerea以及耐药和易感宿主对感染的不同反应。6.植物科学学报2015;https://doi.org/10.3389/fpls.2015.00854.
- 4.
Sapkota S,陈LL,SS阳,Hyma KE,Cadle戴维森L,黄某CF.在高密度图谱和QTL检测霜霉病抗性的构建血管Aestivis一定的'诺顿'。Al Appl Genet。2018; 132(1):137-47。https://doi.org/10.1007/S00122-018-3203-6.
- 5。
Dániel P, Summaira R, Ian BD, Angelica J, Alan CT, Dario C,等。中国野生葡萄抗白粉病基因位点壬6和壬7的鉴定葡萄piasezkii.BMC植物BIOL。2016; 16:170。https://doi.org/10.1186/s12870-016-0855-8.
- 6。
他的电脑。葡萄栽培。北京:中国农业出版社;1999.
- 7.
李d,万Y,王Y,耐他P.关联性炭疽病和白腐病在中国野生葡萄。葡萄。2008; 47:213-5。https://doi.org/10.1007/s11295-007-0094-0.
- 8.
琼斯·杰恩·杰恩·杰恩迫使生物疗法寄生:我们可以将基因组联系起来吗?趋势植物SCI。2012; 17(8):448-57。https://doi.org/10.1016/j.tplants.2012.04.005.
- 9.
伯乐T,诱导子菲利克斯G.甲复兴:由图案-recognition受体微生物相关的分子模式和危险信号的感知。Annu Rev phytopathol。2009; 60(1):379-406。https://doi.org/10.1146/annurev.arplant.57.032905.105346.
- 10。
多兹PN,Rathjen JP。植物免疫:向植物病原体相互作用的综合视图。NAT Rev Genet。2010; 11(8):539-48。https://doi.org/10.1038/nrg2812.
- 11.
窦d,周JM。植物病原菌效应颠覆宿主免疫:不同的敌人,类似的战场。细胞宿主微生物。2012; 12(4):484-95。https://doi.org/10.1016/j.chom.2012.09.003.
- 12.
黄志强,王志强,王志强,等。保护绿色:气孔免疫的途径。植物生态学报。2013;26(6):626-32。https://doi.org/10.1094/MPMI-12-12-0288-CR.
- 13。
王克,Senthil-Kumar M,Ryu Cm,Kang L,Mysore Ks。植物甾醇通过调节营养流入植物糖,在植物生先生免疫中发挥关键作用。植物理性。2012; 158(4):1789-802。https://doi.org/10.1104/pp.111.189217.
- 14。
房龙LC,代表M, Pieterse CM。诱导性防御相关蛋白在受感染植物中的意义。植物病理学杂志。2006;44:135-62。https://doi.org/10.1146/annurev.phyto.44.070505.143425.
- 15.
SELS J,Mathys J,De Coninck BM,Cammue BP,De Bolle MF。植物发病机制相关(PR)蛋白:对PR肽的关注。植物理性生物化学。2008; 46(11):941-50。https://doi.org/10.1016/j.plaphy.2008.06.011.
- 16。
Wildermuth MC, Dewdney J, Wu G, Ausubel FM。异染色质合酶是合成水杨酸用于植物防御的必需酶。大自然。2001;414(6863):562 - 5。https://doi.org/10.1038/35107108.
- 17.
Godiard L, Ragueh F, Froissard D, legguay JJ, Grosset J, Chartier Y,等。烟草水分渗透叶片中几种致病相关蛋白的合成及亲和和不亲和分离株的分析青枯病.Mol植物微生物相互作用。2017; 3(4):207。https://doi.org/10.1094/MPMI-3-207.
- 18.
顾YQ,Wildermuth MC,Chakravarthy S,蕙YT,杨C,他X等。番茄转录因子PTI4.,PTI5.和PTI6.在表达时激活防御反应拟南芥.植物细胞。2002;14(4):817 - 31所示。https://doi.org/10.1105/TPC.000794.
- 19.
Lorenzo O, Chico JM, Sánchezserrano JJ, Solano R. JASMONATE-INSENSITIVE1编码了一个MYC转录因子,这是区分不同茉莉酸调控的防御反应的关键拟南芥.植物细胞。2004;16(7):1938 - 50。https://doi.org/10.1105/TPC.022319..
- 20。
Després C, DeLong C, Glaze S, Liu E, Fobert PR.拟南芥NPR1/NIM1蛋白增强了bZIP转录因子TGA家族的一个亚群的DNA结合活性。植物细胞。2000;12(2):279 - 90。https://doi.org/10.2307/3870928.
- 21。
王志强,王志强,王志强,等。拟南芥NPR1抗病蛋白是一种新型的辅助因子,它将DNA结合活性的氧化还原调节作用赋予基本结构域/亮氨酸拉链转录因子TGA1。植物细胞。2003;15(3):2181 - 91。https://doi.org/10.1105/tpc.012849.
- 22。
Dohm JC,Lottaz C,Borodina T,Himmelbauer H.来自高通量DNA测序的超短读数据集中大量偏见。核酸RES。2008; 36(16):E105。https://doi.org/10.1093/nar/gkn425.
- 23.
牛B,富升,孙S,李W.人工和天然焦磷酸测序读取复制宏基因组数据。BMC生物信息学。2010; 11(1):1-11。https://doi.org/10.1186/1471-2105-11-187.
- 24.
AIRD d,罗斯MG,陈WS,丹尼尔森男,芬内尔T,拉斯C,等人。分析与降低Illumina测序文库PCR扩增偏好。基因组Biol。2011; 12(2):R18。https://doi.org/10.1186/gb-2011-12-2-r18.
- 25.
Steijger T, Abril JF, Engström PG, Kokocinski F, Consortium TR, Hubbard TJ,等。RNA-seq转录本重建方法的评估。Nat方法。2013;10(12):1177 - 84。https://doi.org/10.1038/nmeth.2714.
- 26.
陈志强,陈志强,陈志强,等。实时DNA测序从单一聚合酶分子。科学。2009;323(5910):133 - 8。https://doi.org/10.1126/science.1162986.
- 27.
Roberts RJ, Carneiro MO, Schatz MC. SMRT测序的优势。基因组医学杂志。2013;14(7):405。https://doi.org/10.1186/gb-2013-14-6-405.
- 28.
董磊,刘洪,张建军,杨胜,孔光,褚建军,等。单分子实时转录本测序有助于普通小麦基因组注释和谷物转录组研究。BMC基因组学。2015;16:1039。https://doi.org/10.1186/s12864-015-2257-y.
- 29.
王斌,曾娥,王志强,等。通过单分子长读测序揭示玉米转录组的复杂性。Nat Commun。2016;7:11708。https://doi.org/10.1038/ncomms11708.
- 30.
校对:通过迭代短读共识进行大规模高精度PacBio校正。生物信息学。2014;30(21):3004 - 11。https://doi.org/10.1093/bioinformatics/btu392.
- 31。
王蓓蓓,周伟,王宝强,等。玉米选择性剪接的全基因组分析:景观和遗传调控。植物细胞。2014;26(9):3472 - 87。https://doi.org/10.1105/tpc.114.130773.
- 32。
基于Illumina公司,李源,戴C,胡C,刘Z,通过SMRT-和对比分析选择性剪接的康C.全球识别RNA-seq的草莓。植物杂志2017; 90(1):164-76。https://doi.org/10.1111/tpj.13462.
- 33。
帕特尔AA,麦卡锡男,施泰茨JA。U12型内含子的剪接可以是在基因表达中的限速步骤。EMBO J. 2002; 21(14):3804-15。https://doi.org/10.1093/emboj/cdf297.
- 34。
Langmead B.与Bowtie对齐短测序读取。Curr Protoc生物素。2010;第11章:单元11.7。https://doi.org/10.1002/0471250953.bi1107s32.
- 35。
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。https://doi.org/10.1186/1471-2105-12-323.
- 36。
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:R106。https://doi.org/10.1186/gb-2010-11-10-r106.
- 37。
Sarowar S,金YJ,金EN,金KD,Hawang BK,伊斯兰教R,等人。一个基本的胡椒病程相关蛋白1个基因在烟草植物中增强的耐重金属和病原体应力的过度表达。植物细胞报道,2005; 24(4):216-24。https://doi.org/10.1007/s00299-005-0928-x.
- 38。
Schultheiss H,德克特C,基拉伊L,福多Ĵ,米歇尔K,科格尔KH等人。大麦中病程相关蛋白PR-1b的功能评价。植物科学。2003; 165(6):1275年至1280年。https://doi.org/10.1016/s0168 - 9452 (03) 00336 - 4.
- 39。
Gamir J,Darwiche R,Hof PV,Choudhary V,Mauch F.促进生成相关蛋白1的甾醇结合活性揭示了抗微生物蛋白的作用方式。plantj。2016; 89(3):502-9。https://doi.org/10.1111/tpj.13398.
- 40。
连接生长和防御:油菜素内酯和赤霉素在植物先天免疫中的新角色。摩尔。2014;7(6):943 - 59。https://doi.org/10.1093/mp/ssu050.
- 41。
植物免疫中的小分子激素网络。化学学报。2009;5(5):308-16。https://doi.org/10.1038/nchembio.164.
- 42。
Bari R,Jones J.植物激素在植物防御反应中的作用。植物MOL BIOL REP。2009; 69(4):473-88。https://doi.org/10.1007/s11103-008-9435-0.
- 43。
Kesarwani男,柳JM,董XN。在发病相关基因和抗病性的调节TGA转录因子的遗传相互作用拟南芥.植物理性。2007; 144(1):336-46。https://doi.org/10.2307/40065343.
- 44。
Spoel Sh,Koornneef A,Claessens Sm,Korzelius JP,Van Pelt Ja,Muellr MJ,等。NPR1通过细胞溶溶胶中的新功能调节水杨酸和茉莉依赖的防御途径之间的串扰。植物细胞。2003; 15(3):760-70。https://doi.org/10.1105/tpc.009159.
- 45。
李涛,徐YX,张LC,姬YL,谭DM,袁H,等人。茉莉酸类激活的转录因子调节MdMYC2乙烯反应因子和乙烯生物合成基因苹果果实成熟期间促进乙烯生物合成。植物细胞。2017; 29(6):1316至1334年。https://doi.org/10.1105/tpc.17.00349.
- 46。
徐PJ,公园CM。MYB96介导的脱落酸信号通过促进水杨酸生物合成诱导病原抗性反应拟南芥.新植物。2010; 186(2):471-83。https://doi.org/10.1111/j.1469-8137.2010.03183.x.
- 47.
Canonne J,Marino D,Jauneau A,Pouzet C,Briere C,Ruby D等人。的Xanthomonas.III型效应器XOPD目标拟南芥转录因子MYB30抑制植物防御。植物细胞。2011;23(9):3498 - 511。https://doi.org/10.1105/tpc.111.088815.
- 48.
Lü BB,李晓军,孙伟伟,李林,高锐,朱强,等。AtMYB44通过激活受ein2影响的桃蚜和小菜蛾的防御来调节对桃蚜和小菜蛾的抗性拟南芥.植物医学杂志。2013;15(5):841 - 50。https://doi.org/10.1111/j.1438-8677.2012.00675.x.
- 49.
雷耶斯JL,NH蔡氏。miR159的ABA诱导控制在两个MYB因素转录水平拟南芥种子发芽。植物j . 2007; 49(4): 592 - 606。https://doi.org/10.1111/j.1365-313X.2006.02980.x.
- 50.
郑灿,徐俊生,韩世文,具元杰,金昌华,宋思,等。AtMYB44基因的过表达增强了转基因植物的气孔关闭,从而增强了转基因植物对非生物胁迫的耐受性拟南芥.植物杂志。2008;146(2):623 - 35。https://doi.org/10.1104/pp.107.110981.
- 51.
Liu W, Tai H, Li S, Gao W, Zhao M, Xie C, et al. bHLH122对干旱和渗透胁迫的抗性有重要意义拟南芥以及ABA分解代谢的抑制。新植醇。2014;201(4):1192 - 204。https://doi.org/10.1111/nph.12607.
- 52.
Jin J,Hewezi T,Baum TJ。的拟南芥bHLH25和bHLH27转录因子与囊线虫的易感性有关heterodera schachtii..植物j . 2011; 65(2): 319 - 28。https://doi.org/10.1111/j.1365-313x.2010.04424.x.
- 53.
关键词:小麦bHLH转录因子,TabHLH060,转基因拟南芥蒂利亚纳到两.Physiol Mol Plant P. 2015; 90:123-30。https://doi.org/10.1016/j.pmpp.2015.04.007.
- 54.
张健,周W,邓X的表达crtB来自Erwinia Herbicola的基因改善了转基因番茄中的类胡萝卜素合成。Acta Horticulturae Sinica。2010; 37(3):390-6。https://doi.org/10.3724/SP.J.1142.2010.40491.
- 55.
林H,王R,钱Q,Yan M,Meng X,Fu Z等。Dwarf27,粒状乳腺生物合成所需的含铁蛋白质,调节米饭分蘖芽源。植物细胞。2009; 21(5):1512-25。https://doi.org/10.1105/tpc.109.065987.
- 56。
彩SK,松田S,星野T,彭X,细菌β胡萝卜素的三泽N.表征3,3'-羟化酶,的CrtZ,和P450在虾青素生物合成途径和金盏花红素产量基因组合在大肠杆菌.应用微生物生物技术。2006; 53(3):641-6。https://doi.org/10.1007/s00253-006-0426-2.
- 57。
马琳,张志强,张志强,等。玉米黄质环氧化酶的分子鉴定尼古利亚娜朱姆比菲洛伐比亚,一个参与脱落酸生物合成的基因,与拟南芥的ABA位点相对应。EMBO j . 1996; 15(10): 2331 - 42。https://doi.org/10.1002/j.1460-2075.1996.tb00589.x.
- 58。
Jeknić Z, Morré JT, Jeknić S, Jevremović S, Subotić A,陈天祥。虎百合辣椒红素-衣红素合成酶基因的克隆及功能分析百合lancifolium研究。“Splendens”)。acta botanica yunnanica(云南植物研究). 2012;53(11):1999 - 912。https://doi.org/10.1093/pcp/pcs128.
- 59。
张敏,袁波,冷鹏。9-顺式环氧类胡萝卜素双加氧酶(NCED)基因克隆及ABA对果实成熟的影响。植物信号学报。2009;4(5):460-3。https://doi.org/10.4161/psb.4.5.8542.
- 60。
小岩井H,Nakaminami K,徐男,三桥W,Toyomasu T,脱落酸生物合成酶的小柴昌俊T.组织特异性定位,AAO3,在拟南芥.植物杂志。2004;134(4):1697 - 707。https://doi.org/10.1104/pp.103.036970.
- 61。
Kushiro T,Okamoto M,Nakabayashi K,Kitamura S,Asami T,Hirai N,等。拟南芥细胞色素P450 CYP707A编码ABA 8'-羟基酶:ABA分解代谢中的关键酶。禁止J. 2004; 23(7):1647-56。https://doi.org/10.1038/sj.emboj.7600121.
- 62。
徐志军,中岛敏,铃木Y,山口等。小豆脱落酸特异葡萄糖转移酶基因的克隆与鉴定。植物杂志。2002;129(3):1285 - 95。https://doi.org/10.1104/pp.001784.
- 63。
大野S,堀W,细川男,Tatsuzawa女,查耳酮合酶的土井M.转录后沉默涉及的表型不稳定性在花瓣和双色大丽花的叶(大丽花摘要)“Yuino”。Planta。2017; 247(2):1-16。https://doi.org/10.1007/s00425-017-2796-3.
- 64。
Sangkyu P,闵JC,钟YL,宰KK,孙HH,孙HL。分子和两个水稻的生化分析类黄酮3'-羟化酶在稻米类黄酮合成来评价自己的角色。int j mol sci。2016; 17(9):1549。https://doi.org/10.3390/ijms17091549.
- 65。
功能表达的二氢黄酮醇4-还原酶的分子克隆、底物特异性马吕斯有明显和Pyrus普通的品种及其对类黄酮代谢的影响。生物化学学报。2003;412(2):223-30。https://doi.org/10.1016/s0003-9861(03)00013-4.
- 66。
Suzuki JY, Amore TD, Calla B, Palmer NA, Scully ED, Sattler SE,等。花观赏祖种中代谢和色素生物合成途径的器官特异性转录组分析红掌amnicola德国。SCI批准。2017; 7(1):1596。https://doi.org/10.1038/s41598-017-00808-2.
- 67。
莫罗C,安布罗斯MJ,特纳L,希尔L,埃利斯TH,霍费尔JM。的b豌豆基因编码有缺陷的类黄酮3 ',5 ' -羟化酶,并赋予粉红色的花朵颜色。植物杂志。2012;159(2):759 - 68。https://doi.org/10.1104/pp.112.197517.
- 68。
刘y,shi z,maximova s,payne mj,guiltinan mj。花青素素合成theobroma可可:基因编码花色素合成酶,花青素还原酶和无色花色素还原酶。BMC植物BIOL。2013; 13:202。https://doi.org/10.1186/1471-2229-13-202.
- 69。
Yoshioka H, Numata N, Nakajima K, Katou S, Kawakita K, Rowland O, et al.;尼古利亚娜·宾夕法尼亚州GP91Phox.同源染色体NbrbohA和NbrbohB参与H2O2积累和耐5种.植物细胞。2003;15(3):706 - 18。https://doi.org/10.1105/tpc.008680.
- 70.
张华,方强,张志强,王玉华,郑晓霞。呼吸爆发氧化酶同源物在诱导子诱导的气孔关闭和超敏反应中的作用尼古利亚娜·宾夕法尼亚州.中国生物医学工程学报。2009;60(11):3109-22。https://doi.org/10.1093/jxb/erp146.
- 71.
刘志强,刘志强。马铃薯晚疫病抗性的蛋白质差异积累分析RB抗性基因。生理学分子植物P. 2010; 74(2):151-60。https://doi.org/10.1016/j.pmpp2009.11.001.
- 72.
周勇,张伟,邢庆坤,李晓华,严建勇。Coniella vitis.SP十一月是白腐病在中国葡萄园常见的病原体。植物DIS。2017; 101:12。https://doi.org/10.1094/PDIS-12-16-1741-RE.
- 73.
吴泰,瓦丹甲凯克。GMAP:MRNA和EST序列的基因组映射和对准程序。生物信息学。2005; 21(9):1859-75。https://doi.org/10.1093/bioinformatics/bti310.
- 74.
在16个人体组织中,数千个外显子跳过事件区分了不同的剪接模式。F1000Res。2013; 2:188。https://doi.org/10.12688/f1000Research.2-188.v1.
- 75.
关键词:CPAT, logistic回归模型,编码潜力评估核酸学报2013;41(6):e74。https://doi.org/10.1093/nar/gkt006..
- 76.
Abdel-Ghany SE, Hamilton M, Jacobi JL, Ngam P, Devitt N, Schilkey F,等。用单分子长读法对高粱转录组的调查。Nat Commun。2016;7:11706。https://doi.org/10.1038/ncomms11706.
- 77.
buchfink b,谢c,uson dh。使用金刚石的快速和敏感的蛋白质对齐。NAT方法。2015; 12(1):59-60。https://doi.org/10.1038/nmeth.3176.
- 78.
谢C,毛X,黄Ĵ,丁Y,吴Ĵ,董S等人。KOBAS 2.0:用于注释和富集途径和疾病的识别的Web服务器。核酸RES。2011; 39:W316-22。https://doi.org/10.1093/nar/gkr483.
- 79.
Fujimori N, Enoki S, Suzuki A, Naznin HA, Shimizu M, Suzuki S。Sci.Hortic-Amsterdam。2016; 200:105-10。https://doi.org/10.1016/j.scienta.2016.01.008.
确认
感谢北京市农林科学院华北果树病虫害环境友好管理北京市重点实验室李兴红博士提供的白腐菌株JZB3700001。
资金
国家自然科学基金面上项目(No. 31972368);辽宁省自然科学基金面上项目(No. 31972368);中国农业科学研究系统(批准号:2019-MS-280)沈阳市科技局基金资助项目(No. 18-013-0-35)、辽宁省科技厅基金资助项目(No. 2018104025-A12)。资助机构没有参与研究的设计、数据的收集、分析、解释和手稿的编写.
作者信息
隶属关系
贡献
YG和XG贡献到实验设计,KS进行了实验并写了稿件。YZ和HG进行了葡萄树叶制剂和RNA提取,ZL和KL是有助于在LM的帮助下进行SMRT和Illumina测序的数据分析。所有作者都读过并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
illumina测序评估和绘图率。
附加文件2:表S2。
SMRT数据的统计分析。
附加文件3:数据S1。
新同种型长度和外显子数的统计数据。
附加文件4:数据S2。
isoform注释消息统计。
附加文件5:Data S3。
以FPKM为代表的亚型表达水平
附加文件6:数据S4。
ASProfile软件预测的葡萄叶中的不同替代拼接事件。
附加文件7:数据S5。
基因亚型数量的统计数据进行选择性剪接。
附加文件8:数据S6。
基于SMRT数据的新基因和亚型,CPAT软件预测lncrna
附加文件9:数据S7。
基于SMRT数据预测的融合基因
附加文件10:Data S8。
基于SMRT数据预测可选择的聚腺苷酸化位点和相关转录本
附加文件11:数据S9。
将已知基因模型的转录本与SMRT的新亚型结合形成新的转录本库
附加文件12:表S3。
从Illumina测序比对中读取新构建的库
附加文件13:Data S10。
VT2和ZX2之间度的视角的KEGG富集
附加文件14:表S4。
用于半定量PCR和qRT-PCR验证
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
苏,K.,郭,Y.,赵,Y.等等。葡萄白腐病抗性候选基因基础上SMRT和Illumina测序。BMC植物BIOL.19,501(2019)。https://doi.org/10.1186/s12870-019-2119-x
已收到:
接受:
发表:
关键词
- 葡萄藤
- 白腐病
- SMRT测序
- 水杨酸
- 茉莉酸
- 耐药基因