摘要
背景
质体编码RNA聚合酶(PEP)通过调控参与光合作用的基因的表达,在叶绿体发育中发挥重要作用。至少有12种PEP相关蛋白(pap),包括FSD3/PAP4,通过调节PEP复合物的形成来调节PEP活性和叶绿体发育。
结果
在这项研究中,我们发现FSD3S的拼接变体FSD3;的FSD3而且FSD3S转录本编码n端相同,但c端不同的蛋白质。对FSD3和FSD3S蛋白的表征表明,FSD3S的c端区域含有一个跨膜结构域,该结构域促进FSD3S定位于叶绿体膜而不是类核,而FSD3定位于叶绿体类核。我们还发现过度表达FSD3S通过减少参与光合作用的基因表达,对光合活性和叶绿体发育产生负面影响。此外,FSD3S未能补充叶绿体发育缺陷fsd3突变体。
结论
这些结果表明,FSD3和FSD3S在叶绿体发育中具有不同的定位模式,FSD3S负调控pep依赖的叶绿体基因的表达和叶绿体发育。
背景
叶绿体具有独特的基因组和两种不同的RNA聚合酶,即核编码的RNA聚合酶(NEP)和质体编码的RNA聚合酶(PEP),它们介导质体基因的转录。NEP是一种单亚基RNA聚合酶,PEP是一种多聚体RNA聚合酶,由四个核心蛋白rpoA、rpoB、rpoC1和rpoC2组成[1,2,3.].NEP和PEP都是叶绿体发育所必需的[4,5].例如,基因缺陷的突变体RPOTp或RPOTmp编码NEP的突变体显示叶绿体生物发生延迟和生长迟缓,缺乏PEP活性的突变体显示白化/象牙表型[6,7,8,9,10,11].根据NEP和PEP活性的不同,认为NEP在叶绿体生物发生初期起作用,PEP在成熟叶绿体中起作用;NEP是负责表达的rpoB和其他管家基因,PEP负责光合作用相关基因的表达。然而,许多使用烟草的研究(烟草)或大麦(大麦芽)缺乏PEP活性的突变体表明NEP和PEP在叶绿体发育的各个阶段都有活性[4,5,7].
PEP活性对于完全活性叶绿体的形成至关重要,因为它促进光合作用相关基因的表达[3.].PEP与PEP相关蛋白(pap)形成复合物拟南芥核基因组至少包含12个人民行动党基因(3.,12],所有的pap也在类核或转录活性染色体(TAC)蛋白质组中被鉴定[13,14,15,16].先前的遗传学方法已经证明了PAPs在PEP活性和叶绿体发育调控中的重要作用。pep依赖基因的表达在不表达的突变植物中被抑制常常,导致叶绿体发育缺陷[13,16,17,18,19,20.,21,22,23,24].此外,蛋白质-蛋白质相互作用的研究表明,每个PAP都与其他PAP或PEP核心蛋白相互作用,这表明PEP复合物的建立是控制PEP活性和叶绿体发育的关键机制[3.].例如,pTAC3/PAP1与PEP的α核心亚基相互作用[17], pTAC14/PAP7与pTAC12/PAP5相互作用[21].果糖激酶样蛋白1 (FLN1)/PAP6与硫氧还蛋白Z (TrxZ)/PAP10和FLN2相互作用[22,24], FSD3/PAP4与FSD2/PAP9相互作用[20.].pTAC7/PAP12和pTAC10/PAP3显示出与其他pap的广泛相互作用[25,26].Pfalz等(2015)的研究表明pTAC2/PAP2、pTAC10/PAP3、pTAC12/PAP5、MurE/PAP11在促进完全组装PEP复合物的积累中起关键作用[27].
的拟南芥基因组包含三个编码铁超氧化物歧化酶的基因,FSD1,FSD2 / PAP9,FSD3 / PAP4;然而,一些证据表明FSD2和FSD3在叶绿体发育中起作用。FSD2和FSD3蛋白定位于叶绿体,FSD1定位于细胞质[20.,28].类似于其他突变植物,其中表达PAPs被打晕了,fsd2而且fsd3突变体在叶绿体发育中表现出缺陷,导致叶片漂白表型。不像fsd2而且fsd3突变植物fsd1突变体在叶片颜色上没有缺陷,虽然表达水平为FSD1大约是的50倍FSD3[20.,29].COPPER SUPEROXIDE DISMUTASE2 (CSD2)定位于叶绿体,在叶绿体中的活性氧(ROS)清除中起关键作用[30.,31].CSD2与其他超氧化物歧化酶基因相比,其表达量要高得多(约100倍)FSD3) [29].然而,csd2突变体不表现为漂白叶片表型人民行动党突变植物会[32,33].这些结果表明FSD2而且FSD3在叶绿体发育中具有专门的功能。
含有内含子的单个基因可以通过选择性剪接产生几种不同的mrna,从而有助于包括植物在内的真核生物蛋白质组的多样性[34].拟南芥和水稻(栽培稻),分别只有21.7和19.9%的基因缺乏内含子,表明选择性剪接深度参与植物发育和生理调控[35,36].选择性剪接模式受植物发育阶段的调控,并经常受到环境信号的影响[37,38].选择性剪接可以通过RNA降解途径(如无意义介导的衰变)调节转录本丰度[39].剪接变体可以编码具有不同亚细胞定位和功能的蛋白质异构体,这是由于插入或删除功能单元,如信号肽和跨膜(TM)结构域[40,41].
在植物衰老过程中,成熟的叶绿体转变为老年叶绿体,光合作用性能下降。PAPs在控制PEP的活性方面发挥重要作用,PEP负责叶绿体发育和光合活性。的功能PAPs在这个过程中,我们尝试了克隆PAPs和确认FSD3S的拼接变体FSD3 / PAP4其中包括两个未剪接的内含子.与定位于叶绿体类核的FSD3蛋白不同,FSD3S蛋白在c端区域有一个TM结构域,并倾向于定位于叶绿体膜。为了了解FSD3S在叶绿体发育中的作用,我们研究了FSD3S对叶绿体发育的影响FSD3S超表达。过度的FSD3S是否补充了叶绿体发育缺陷fsd3突变体。此外,过度表达FSD3S通过降低pep依赖基因的表达负调控光合活性和叶绿体发育。这些结果表明,FSD3和FSD3S在叶绿体发育中具有不同的功能,FSD3S参与了PEP活性和叶绿体发育的负调控。
结果
FSD3S的拼接变体FSD3
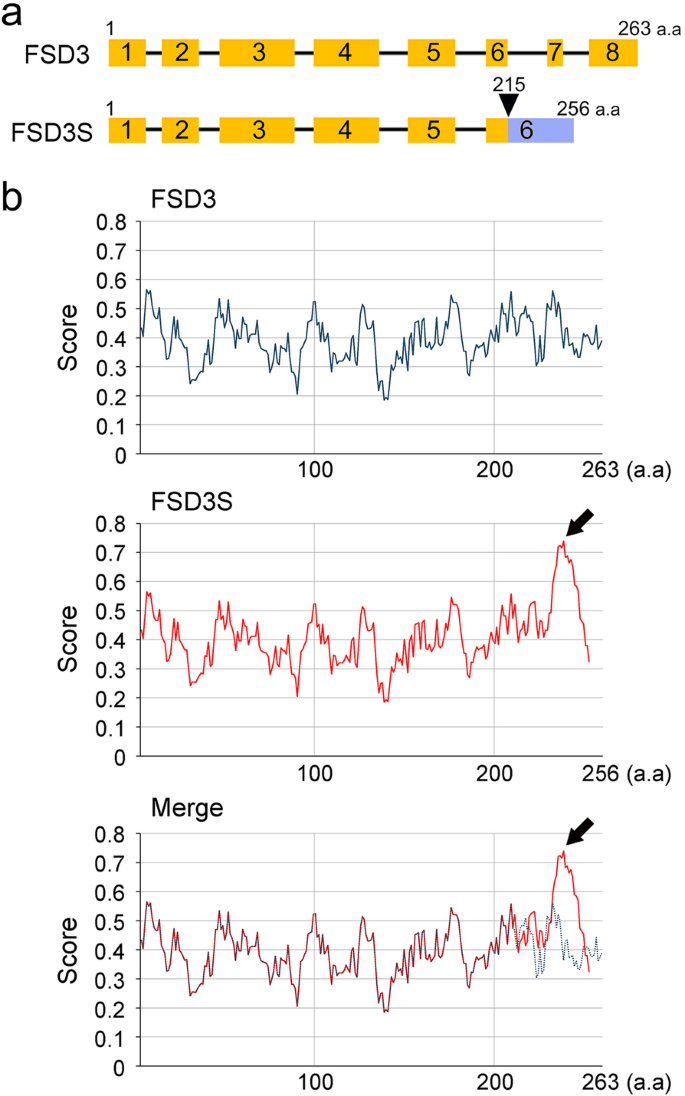
PAPs通过控制PEP复合物的活性来调节叶绿体的发育。我们确定了FSD3S的拼接变体FSD3 / PAP4.FSD3包含8个外显子和成熟的FSD3mRNA是通过剪接从pre-mRNA中去除7个内含子而生成的。相比之下,FSD3S只包含6个外显子;第6和第7个内含子保留在mRNA中(图。1a).对比FSD3和FSD3S预测的氨基酸序列,FSD3S的c端215-256氨基酸区由于存在第6和第7个内含子,由不同于FSD3的氨基酸组成(附加文件1:图S1)。的终止密码子FSD3S与FSD3 (792 bp)相比,位于更早的位置(771 bp)。因此,FSD3SmRNA编码一个由256个氨基酸组成的较短的蛋白质,而FSD3编码263个氨基酸。
的识别FSD3S的拼接变体FSD3.一个一个示意图FSD3而且FSD3S信使rna结构。蓝色框表示FSD3S的c端区域,该区域由与FSD3不同的氨基酸组成,箭头指向该区域的起点。bFSD3和FSD3S疏水性的差异。生物信息学分析(http://web.expasy.org/protscale/)预测了FSD3和FSD3S不同的疏水性。黑色箭头表示FSD3S的c端区域比FSD3具有更高的疏水性
未剪接内含子的存在也会影响FSD3S的性质(图2)。1b).预测FSD3和FSD3S的疏水性时(http://web.expasy.org/protscale/), FSD3和FSD3S的c端区,特别是位于230和250氨基酸之间的区域存在差异。FSD3S的c端疏水性远高于FSD3,提示FSD3S的功能可能与FSD3不同。
FSD3S超氧化物歧化酶活性
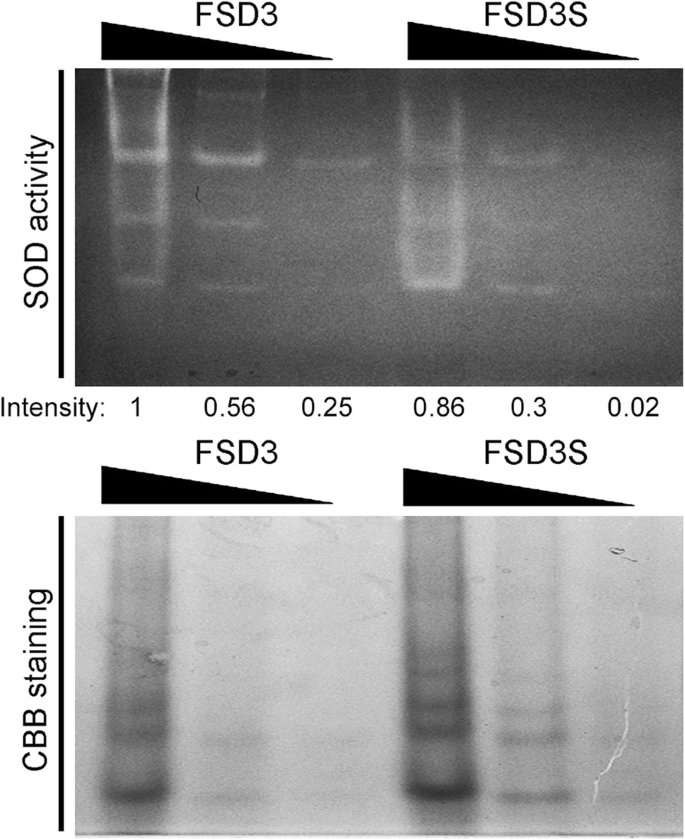
FSD3编码铁超氧化物歧化酶。由于FSD3和FSD3S蛋白具有不同的性质,因此可以预期FSD3S蛋白的超氧化物歧化酶(SOD)活性与FSD3蛋白不同。为了解决这个问题,我们分析了FSD3和FSD3S蛋白的SOD活性(图2)。2).我们将mbp融合的FSD3和FSD3S表达于大肠杆菌并用凝胶SOD活性测定法测定它们的活性。FSD3S蛋白表现出SOD活性,FSD3S的活性略低于或与FSD3相似。这些观察结果表明,疏水c端区域对FSD3S的SOD活性没有主要影响。
FSD3S的亚细胞定位
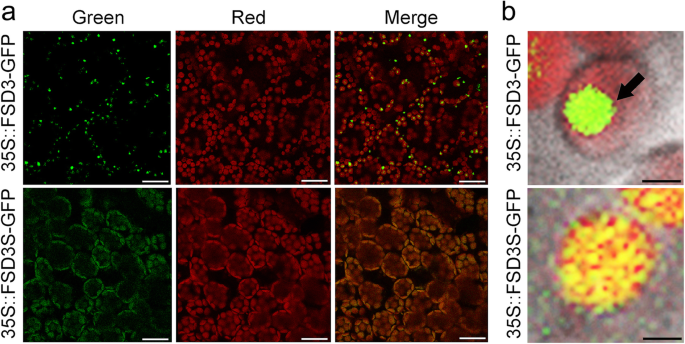
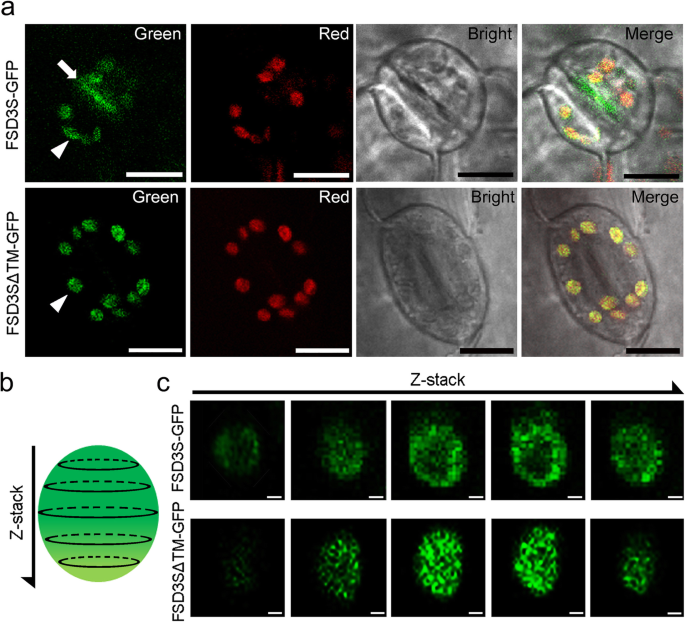
为了测试FSD3S的疏水c端区域是否影响其亚细胞定位,我们生成35 s:: FSD3-GFP而且35 s:: FSD3S-GFP通过监测这些转基因植物的荧光信号,分析了FSD3-GFP和FSD3S-GFP的定位。我们至少测试了四种独立的FSD3-GFP而且FSD3S-GFP转基因植物。尽管GFP信号强度存在一定差异,但所有转基因植株的叶绿体中均表现出绿色荧光信号。然而,荧光信号的亚细胞定位模式不同35 s:: FSD3-GFP而且35 s:: FSD3S-GFP植物(图。3.).与Myouga等人先前的研究一致。[20.]时,FSD3蛋白的荧光信号在叶绿体中呈点状结构(图。3.).利用核相关蛋白PEND (PEND- cfp)进行共定位试验[42]和FSD3 (FSD3-GFP)表明CFP和GFP信号在叶绿体中的位置相同(附加文件1:图S2)。这表明FSD3定位于类核,即PAPs和PEP复合物起作用的地方。然而,35 s:: FSD3S-GFPFSD3S蛋白的荧光信号倾向于分布在叶绿体的各个部位(图。3.).这些观察结果表明,FSD3定位于叶绿体类核,而FSD3S没有。这些结果表明FSD3S的疏水c端区域影响FSD3S的定位。
FSD3S的疏水c端区域含有一个跨膜结构域
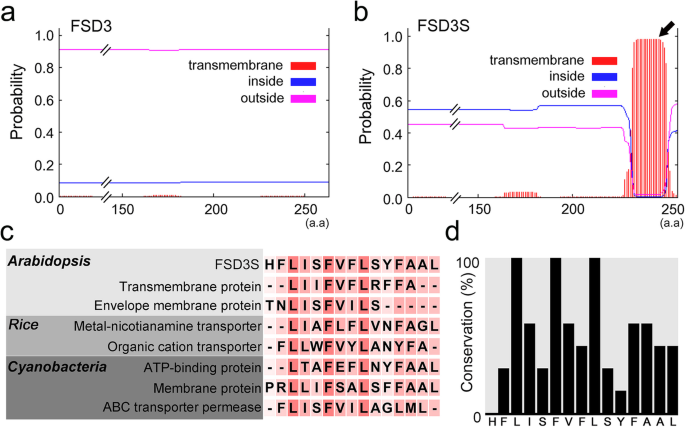
由于FSD3和FSD3S蛋白的n端区域相同,而c端区域不同,我们推测FSD3S蛋白的疏水c端区域可能决定了FSD3S蛋白的定位。为了探索这一问题,我们进行了生物信息学分析,以确定可能导致FSD3S (http://www.cbs.dtu.dk/services/TMHMM/).这揭示了FSD3S的疏水区域包含一个假定的TM螺旋结构域,该结构域在植物和微生物的许多膜蛋白和转运蛋白的TM结构域中是保守的(图2)。4模拟)。这些结果表明FSD3S的c端区域含有TM螺旋结构域,TM结构域影响FSD3S的定位。这一发现得到了水稻OsFSD3生物信息学分析的进一步支持(附加文件)1:图S3和图S4)。通过拟南芥FSD3全长氨基酸序列的蛋白BLAST搜索(http://rice.plantbiology.msu.edu/analyses_search_blast.shtml),我们鉴定出一种水稻同源物FSD3,LOC_Os06g05110.1(OsFSD3)及其拼接变体,LOC_Os06g05110.3(OsFSD3S).此外,OsFSD3S蛋白的c端区表现出比OsFSD3蛋白更高的疏水性,并与FSD3S蛋白一样包含一个预测的TM螺旋结构域。这些观察结果表明FSD3S在其疏水c端区域有一个TM螺旋结构域,TM结构域参与了FSD3S的定位。
FSD3S包含一个假定的跨膜螺旋结构域。通过生物信息学分析预测跨膜螺旋结构域(http://www.cbs.dtu.dk/services/TMHMM/).与FSD3不同(一个),预测在FSD3S的c端第231和245个氨基酸之间存在跨膜螺旋结构域(b).黑色箭头表示FSD3S c端区域的跨膜螺旋结构域。多氨基酸序列比对(c)和直方图(d)显示了FSD3S和拟南芥、水稻和蓝藻的其他膜或转运蛋白之间跨膜螺旋结构域的保守性。红框内(c)表示保守的氨基酸,较深的红色方框表示保守程度较高
FSD3S倾向于定位于叶绿体膜
为了进一步了解TM结构域在FSD3S定位中的作用,我们生成了表达gfp融合的缺乏TM结构域的FSD3S的转基因植物(FSD3SΔTM-GFP),并分析了FSD3SΔTM蛋白在叶绿体中的荧光信号。类似于35 s:: FSD3SGFP信号不定位于类核的植物,35 s: FSD3SΔTM-GFP植物在叶绿体中没有表现出点状信号,荧光信号是弥漫的,遍布整个叶绿体(图2)。5).然而,在保护细胞的造口膜上观察到FSD3S-GFP信号,而在FSD3SΔTM-GFP信号上没有观察到(图。5一个;额外的文件1:图S5)。这些结果表明,TM结构域影响FSD3S的定位,具有TM结构域的FSD3S倾向于定位到膜上。为了进一步探索FSD3S在叶绿体中的定位,我们使用共聚焦显微镜的z-stack函数进行了一系列光学切片。这种方法揭示了FSD3SΔTM的定位模式不同于FSD3S蛋白的定位模式(图2)。5b, c);FSD3S-GFP信号倾向于定位于叶绿体膜,而FSD3SΔTM-GFP信号倾向于弥漫性定位于整个叶绿体。这些观察结果表明,FSD3S的TM结构域促进了FSD3S在叶绿体膜上的定位。这一发现得到了蛋白质印迹实验的支持35 s:: FSD3S-GFP而且35 s: FSD3ΔTM-GFP叶绿体和GFP抗体(附加文件1:图S6)。可溶性部分均检测到FSD3和FSD3S蛋白。然而,与FSD3ΔTM不同,具有TM结构域的FSD3S蛋白也在不溶性部分中被检测到。这表明具有单一TM结构域的FSD3S蛋白具有定位于叶绿体膜的亲和性,但可以定位于叶绿体间质。
过度的FSD3S降低pep依赖基因的表达
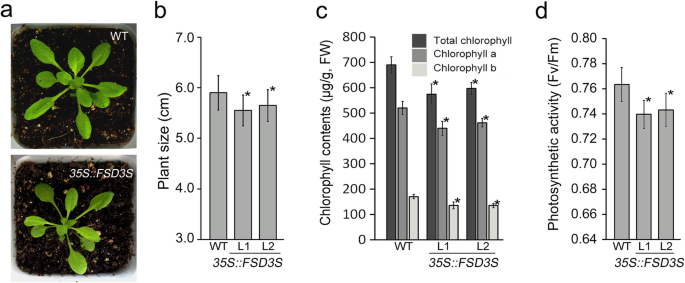
的功能FSD3S在叶绿体的发育过程中,我们产生了FSD3S -过度表达转基因植物(附加文件1:图S7)。转基因植物过度表达FSD3S比在相同生长条件下生长的野生型植物体积小(图2)。6a, b).过度表达FSD3S也影响叶绿素含量和光合活性(图;6c, d).叶片叶绿素含量35 s:: FSD3S转基因植物比在相同条件下生长的野生植物低约15%。此外,光合作用的活动FSD3S-过表达植物比野生型植物低约6%。这些观察表明FSD3S对叶绿体发育有负面影响,并发现其表达FSD3S不拯救fsd3突变表型支持这一点(附加文件1:图S8)。此外,植物生长和光合作用活性的降低也被发现FSD3S-GFP而且FSD3SΔTM-绿色荧光蛋白过度表达植物(附加文件1:图S9)。这表明FSD3S蛋白的减少是由基质中积累的FSD3S蛋白引起的。
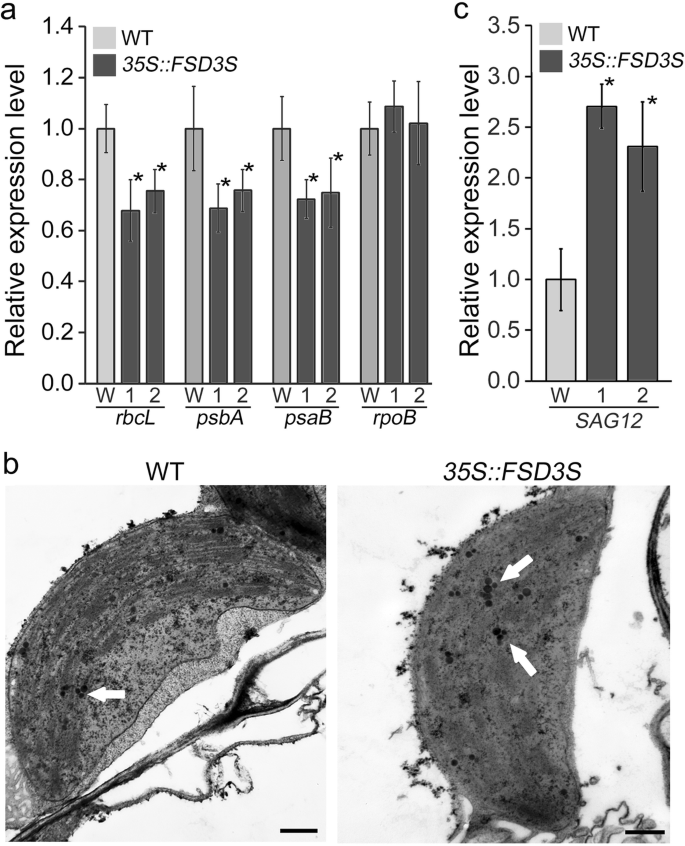
由于PAPs决定PEP复合物的活性,PEP复合物调节光合基因的表达,因此预期过表达FSD3S会影响光合作用基因的表达。为了探究FSD3S在光合作用中的功能,我们分析了在植物中pep依赖和nep依赖的叶绿体基因的表达35 s:: FSD3S转基因植物(图;7a). pep依赖基因的表达psbA:,而且psaB被下调了35 s:: FSD3S转基因植物,而nep依赖的表达rpoB与野生型植物相似或略高。这说明FSD3S负调控了pep依赖的叶绿体基因的表达,说明FSD3S负调控了pep依赖的光合基因参与了光合活性的降低。
此外,对野生型和野生型的叶绿体超微结构进行了分析35 s:: FSD3S在相同生长条件下生长的植物,FSD3S -过表达转基因植物比野生型植物在叶绿体中形成更多的塑蛋白(图2)。7b;额外的文件1:图S10)。由于质体蛋白的形成是随着衰老而促进的[43,44],我们假设过度表达FSD3S影响衰老。野生型与野生型在衰老方面无明显差异35 s:: FSD3S植物,我们发现了FSD3S过度表达促进衰老相关基因的表达SAG12其表达与衰老有关[45,46].在5周大的叶子中,SAG12表达水平较高35 s:: FSD3S与野生型植物相比(图;7c).这表明FSD3S负调控叶绿体发育,参与衰老。
的表达模式支持了这一发现FSD3S(附加文件1:图S11)。转录水平FSD3S10周衰老叶的转录水平高于3周新生叶,而FSD33周龄的幼叶比10周龄的衰老叶有更高的含量。因此,转录水平FSD3S大约比?低了20倍FSD3在年轻的叶子中,但在老叶中大约低2倍。这些结果支持了FSD3和FSD3S在叶绿体发育中具有不同功能的观点,并提示FSD3S负调控叶绿体发育。
过度的FSD3S不影响ROS水平
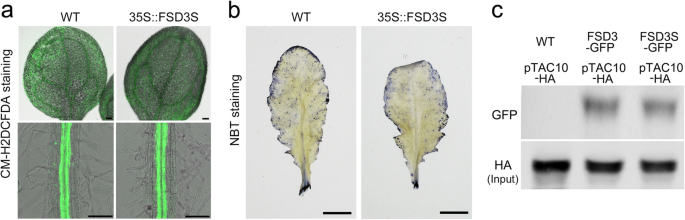
当分析野生型和野生型的活性氧(ROS)水平时35 s:: FSD3SCM-H2DCFDA染色,是一种对ros敏感的染料,具有良好的细胞内保留能力[47],我们观察到CM-H2DCFDA染色无明显差异(图;8a),表明这些植物之间的ROS水平相似。为了进一步验证这一点,我们用硝基蓝四氮唑(NBT)对这些植物进行染色,并将它们的信号可视化。与CM-H2DCFDA染色相似,植株NBT染色强度相似(图2)。8B),暗示过度表达FSD3S不影响ROS水平,FSD3S的SOD活性可能与FSD3S在光合作用中的负作用无关。相反,我们发现FSD3和FSD3S蛋白与PEP复合物的关键PAP pTAC10相互作用[18,26,27(图。8c).因为PEP复合物的形成是控制PEP活性和光合作用相关基因转录的关键过程[3.],提示FSD3S- ptac10相互作用可能参与了FSD3S在光合作用中的负向作用。
CM-H法分析ROS积累2DCFDA和NBT染色。分析了野生型和野生型的ROS积累35 s:: FSD3SCM-H法测定植物2DCFDA (一个)和NBT染色(b).CM-H2在野生型和野生型的叶和根中进行DCFDA染色35 s:: FSD3S植株在1/2 MS培养基上生长2周。NBT染色使用从指定植物中收集的6周大的莲座叶。cFSD3S与pTAC10的相互作用。Co-IP结果显示FSD3和FSD3S都与pTAC10相互作用。原生质体分离35 s:: FSD3-GFP而且35 s:: FSD3S-GFP植物被转化为35 s:: pTAC10-HA质粒。HA抗体下拉免疫复合物,GFP抗体检测pTAC10-FSD3或pTAC10-FSD3S的相互作用。比例尺= 100 μm in (一个)及2毫米(b)
讨论
PEP与pap相互作用形成功能转录复合物。最近的一个模型提出,pap通过PAP-PAP或PAP-PEP相互作用调节PEP复合物的结构建立,从而在叶绿体基因的表达和叶绿体的发育中发挥重要作用[3.,25].该模型得到了许多分子和遗传学研究的支持,这些研究表明每种PAP与其他PAP或PEP广泛相互作用,PAP或PEP的突变导致叶绿体发育缺陷[13,16,17,18,19,21,22,23,24,48].例如,FSD3/PAP4与其他pap相互作用,如pTAC10/PAP3和FSD2/PAP9fsd3突变体植物在叶绿体发育方面存在缺陷[20.,26].
选择性剪接可以从一个基因中产生两个或两个以上的蛋白质,这些蛋白质可以具有不同的功能[40].全部12株拟南芥人民行动党基因中含有内含子,提示变异的PAPs可能参与PEP复合物的形成和叶绿体发育。pTAC12 / PAP5在玉米中编码两种不同的蛋白质异构体,这两种不同的蛋白质组合成PEP复合体[27],尽管pTAC12/PAP5异构体不是通过选择性剪接产生的,而是通过转录后过程产生的,如选择性翻译起始或差异蛋白水解裂解。在这项研究中,我们发现FSD3S的拼接变体FSD3.FSD3而且FSD3S编码n端相同,c端不同的蛋白质。我们发现FSD3和FSD3S的c端区域参与了它们在叶绿体中的亚细胞定位。植物表达FSD3-GFP在叶绿体类核上特别表现出荧光信号,其中PAPs和PEP复合物作用于叶绿体基因的转录,而FSD3S-GFP植物在类核中不显示信号。FSD3S独特的本地化可以解释为什么FSD3S不能拯救fsd3敲除突变表型。
在本研究中,我们还发现过表达FSD3S减少光合作用。发现过度表达FSD3S下调了参与光合作用的pep依赖基因的转录水平,这表明植物的光合活性降低FSD3S -过度表达的植物可能是由负责光合作用基因转录的PEP活性降低引起的。我们的光学z-stack和western blot结果表明,具有单一TM结构域的FSD3S蛋白位于叶绿体膜和间质中。因为过表达也会引起光合活性的降低FSD3S-GFP而且FSD3SΔTM-GFP这些观察结果表明,FSD3S在叶绿体间质中的积累可能是负调控的原因。这一过程背后的分子机制尚不清楚。但是,FSD3S的SOD活性不太可能参与这一过程,因为野生型和野生型的ROS水平没有明显差异FSD3S-overexpressing植物。通过PEP - pap或PAP-PAP相互作用形成PEP复合物是控制PEP活性的关键过程[3.].先前的研究表明FSD3与其他pap相互作用,如FSD2/PAP9和pTAC10/PAP3 [20.,26].这表明FSD3S蛋白可能通过破坏PEP复合物的形成而对PEP活性产生负面影响,免疫共沉淀结果显示FSD3和FSD3S与pTAC10/PAP3相互作用部分支持这一观点。进一步的分子和遗传方法将扩大我们对这一过程背后机制的理解。
结论
由于PAPs调节叶绿体基因的表达,定位到PEP复合物作用的叶绿体类核对其功能至关重要。在本研究中,我们鉴定了FSD3S, FSD3的一种亚型。FSD3和FSD3S的第215个氨基酸上游的n端区域是相同的,但它们c端区域的氨基酸序列完全不同。表达FSD3- gfp的植株在叶绿体类核上具有特异性定位。而FSD3S的c端氨基酸序列与FSD3完全不同,因此无法定位到类核上。此外,c端区域包含一个TM结构域,促进FSD3S定位到叶绿体膜上。这些结果表明FSD3的c端区域负责FSD3的核特异性定位,支持了FSD3的c端区域对FSD3在叶绿体发育中的功能至关重要的理论。这些观察结果解释了为什么FSD3S不能拯救地球fsd3敲除突变表型。与此同时,研究发现过度表达FSD3S降低光合活性和pep依赖的叶绿体基因的表达,这表明FSD3S负调控叶绿体发育。
方法
植物材料和生长条件
拟南芥本研究以哥伦比亚生态型(Col-0)为对照。的fsd3-1突变体(Salk_103228)先前在Myouga等中描述过。[20.]来源于拟南芥生物资源中心。种子消毒后镀于1/2强度Murashige和Skoog(1/2倍MS)固体培养基上。4°C黑暗条件下春化2天后,在22°C光照条件为16/8小时(明/暗)的生长室中生长。幼苗移栽到土壤中进行成熟植株的分析。对于在连续光照或黑暗条件下的生长,植物在22°C的室内生长。
转基因植物重组DNA质粒的构建
利用GATEWAY系统(Invitrogen)构建重组DNA质粒。用于施工35 s:: FSD3S构造,全身FSD3SRT-PCR从拟南芥总RNA中扩增cDNA。通过BP反应将cDNA插入pDONR221载体(Invitrogen)中。然后通过LR反应将pENTRY克隆重组到修饰过的pMDC植物二元载体上,该载体携带35S启动子。用于建设35 s:: FSD3S-GFP而且35 s: FSD3SΔTM-GFP,每个pENTRY克隆包含FSD3S,或FSD3SΔTM通过LR反应将缺失终止密码子的cDNA与35S启动子和GFP进行框内重组。引物序列在附加文件中列出1:表S1。
超显微切片和透射电镜
为了分析叶绿体的超微结构,按照Motohashi等人(2001)先前的描述进行了超显微切片,只是稍加修改[49].从指示植物上采集叶片,使用固定液1 (0.86 M Na-P [pH 7.2], 1%戊二醛和1%多聚甲醛)在室温下固定1天。样品用0.137 M Na-P [pH 7.2]洗涤液洗涤3次,然后用固定液2 (0.86 M Na-P [pH 7.2], 2%四氧化锇)在室温下进行第二轮固定1小时。在洗涤三次后,用丙酮梯度(25,50,75和100%的ddH)脱水样品2O (v/v))各孵育1小时,然后在绝对丙酮中孵育过夜。脱水样品依次在斯普林尔树脂(Sigma)的梯度(25、50、75和100%丙酮(v/v)中孵卵2小时,并在绝对斯普林尔树脂中孵卵过夜。为了凝固,将样品置于模具中,在65°C下放置2天。用超微切片仪(EM UC7, Leica)取80 nm切片。图像由透射电子显微镜(TEM) JEM1010捕获。
叶绿素含量和光合活性的测定
在5周龄的Col-0和Col-0中测定叶绿素含量FSD3S-牛如Sumanta等人先前所述。[50].新鲜叶片(0.75 g)用植物组织均质机与15 ml 95%乙醇(v/v in ddH)均质2O).均质样品在4°C下,以12000 x g离心15分钟。上清液用95%乙醇稀释10倍。叶绿素含量用紫外/可见分光光度计(OPTIZEN POP, Mecasys)测定。为了测定这些转基因植株的光合活性,从5周龄的Col-0植株和指定转基因植株的第6 ~ 8片叶片中采集叶盘。叶片在黑暗中放置30分钟后进行测量。用脉冲调制荧光计(mini-PAM, Walz,德国)测定了叶片的Fv/Fm值。
凝胶SOD活性测定
的FSD3而且FSD3S利用网关系统(Invitrogen)将cdna融合到表达载体pMBP-DC中。每个构念都被引入大肠杆菌BL21(DE3) pLysS密码子分别加RIL株。1 mM异丙基-β- d -硫半乳糖苷在18℃下诱导表达14 h。粗提物用直链淀粉树脂(NEB)纯化。用提取缓冲液(20 mM Tris-HCl [pH 7.4], 200 mM NaCl, 1 mM EDTA和10 mM β-巯基乙醇)洗涤4次后,用含有10 mM麦芽糖的提取缓冲液进行洗脱。根据Beauchamp和Fridovich(1971)和Myouga等人(2008)之前的描述,分析了蛋白质的SOD活性[20.,51].每个蛋白质都被加载到原生page上。凝胶用ddH清洗2O三次,然后用NBT溶液(0.1% NBT在ddH中)孵育2O (w/v))在黑暗中轻轻摇动15分钟。用ddH清洗后2O,将凝胶浸泡在核黄素溶液(0.028 mM核黄素和28 mM TEMED在0.1 M磷酸钾缓冲液[pH 7.0]中)中15分钟,并用ddH冲洗2用白色灯箱照射凝胶,启动光化学反应。采用Image J软件对SOD活性进行定量。
叶绿体蛋白的纯化与分离
从野生型中分离出完整的叶绿体,35 s:: FSD3S-GFP,35 s: FSD3SΔTM-GFP植物使用微小的叶绿体分离试剂盒(发明生物技术)。用50 mM Tris-Cl [pH 7.5]悬浮液渗透溶解叶绿体。对样品进行大力涡旋,然后在4°C下以10,000 x g离心20分钟。用上清液作为可溶性部分。为了制备不溶性部分,将剩余颗粒悬浮并与2倍Laemmli样品缓冲液(Bio-Rad)一起煮沸5分钟。蛋白质被装载到10% sds -聚丙烯酰胺凝胶中,然后转移到聚偏氟乙烯膜上。为了检测fsd3p -GFP和FSD3SΔTM-GFP,采用GFP多克隆抗体(Santa Cruz)和抗兔酶标二抗(Thermo Fisher)进行免疫印迹试验。Western blot信号用Amersham ECL prime (GE Healthcare)检测。
定量rt - pcr
利用从指定植物中提取的总RNA进行定量RT-PCR分析。使用RNeasy植物mini-prep试剂盒(Qiagen)提取总RNA,并根据制造商的说明处理DNase 15分钟。用2 μg总RNA和Superscript III逆转录酶(Invitrogen)进行20 μL反应合成cDNA。在定量PCR中,使用LightCycler 480和SYBR GREEN I Master Mix (Roche)。采用LightCycler NANO Real-Time PCR仪(Roche)进行PCR和荧光检测。PCR条件按照制造商的说明进行编程(在95°C初始变性5分钟,然后在95°C变性10秒,在60°C退火10秒,在72°C延伸10秒)。用3个技术重复分析表达水平。AtACT2(At3g18780)被用作内部控制。使用3个生物重复对qrt - pcr进行了3个技术重复。引物序列信息列在附加文件中1:表S1。
免疫共沉淀和共定位检测
原生质体是从野生型中分离出来的,35 s:: FSD3-GFP,35 s:: FSD3S-GFP植物,并转化与35 s:: pTAC10-HA质粒。要构造35 s:: pTAC10-HA质粒, pTAC10dna被引入Bam你好/不使用Gilson组装系统(NEB)对pTAC10-HA的pE2C质粒进行i -酶切。通过LR反应将该入口克隆插入pMDC质粒。免疫共沉淀试验按照Chang等人(2017)的描述进行,但进行了轻微修改[26].为了分析FSD3-GFP和penda - cfp的共定位,从35 s:: FSD3-GFP使用了植物。用于建设35 s:: PEND-CFP,一个使悬而不决编码n端88个氨基酸序列的cDNA [42]被放大并被引入Bamhi -消化的pHBT-CFP质粒。用共聚焦显微镜(STED, Leica)检测原生质体中的荧光信号。
组织化学CM-H法检测ROS2DCFDA和NBT染色
为了可视化叶片中ROS的积累,CM-H2DCFDA染色如Foreman et al.(2003)先前描述的那样进行,只是稍加修改[47].两周大的野生型和35 s:: FSD3S在4℃、10 μM CM-H条件下孵育1 h2DCFDA解决方案。样品分别用0.1 mM KCl和0.1 mM氯化钙洗涤2(pH 6.0), RT. CM-H孵育1 h2使用共聚焦显微镜(STED, Leica)观察DCFDA信号。按照Hoffmann et al.(2005)之前的描述进行NBT染色,并进行了轻微修改[52].成熟的莲座丛叶采集自野生型和35 s:: FSD3S用NBT染色液(6 mM NBT, 2.7 mM KCl, 1.8 mM KH)处理在土壤中生长6周的植株2阿宝4, 10 mM NaH2阿宝4,和137 mM NaCl [pH 7.1])。在黑暗中真空浸渍10分钟后,在RT下光照20分钟,然后转移到无水乙醇中去除叶绿素。NBT染色图像使用数码相机Coolpix p300(尼康)拍摄。
数据和材料的可用性
本文序列数据可在拟南芥基因组计划或GenBank/EMBL数据库中找到,登录号如下:FSD3 (At5g23310)、FSD3S (KY471384)、PEND (At3g52170)、SAG12 (At5g45890)、rpoA (AtCg00740)、rpoB (AtCg00190)、rbcL (AtCg00490)、psbA (AtCg00020)、psaB (AtCg00340)和ACT2 (At3g18780)。本研究中使用的数据和材料均可根据合理要求从通讯作者处获得。
缩写
- 女性性功能障碍:
-
铁超氧化物歧化酶
- 人民行动党:
-
质体编码的RNA聚合酶相关蛋白
- 动员:
-
质体编码的RNA聚合酶
- 存在:
-
定量逆转录聚合酶链反应
- SOD:
-
超氧化物歧化酶
参考文献
Cahoon AB, Stern DB。质体转录:三合一?植物科学进展,2001;6(2):45-6。
高等植物的两种质体RNA聚合酶:一个演化的故事。植物科学进展,1998;3(1):4-6。
李志强,李志强,李志强,等。叶绿体早期发育中必需的核类蛋白。植物科学进展,2013;18(4):186-94。
Zhelyazkova P, Sharma CM, Förstner KU, Liere K, Vogel J, Börner T.大麦叶绿体的主要转录组:大量非编码RNA和质体编码RNA聚合酶的主导作用。植物学报。2012;24(1):123-36。
Börner T,阿列尼科娃AY,祖波YO,库什涅佐夫VV。叶绿体RNA聚合酶:在叶绿体生物发生中的作用。生物化学生物物理学报(BBA)。2015年,1847(9):761 - 9。
李志强,李志强,李志强,等。rpoB基因的缺失揭示了高等植物质体中第二个独特的转录系统。中国科学(d辑)。1996;15(11):2802。
勒根J,肯普S,克劳斯K,普罗凡特B,赫尔曼RG,迈尔RM。烟草全质体染色体转录谱的比较分析归因于野生型和pep缺陷型转录机制。植物学报,2002;31(2):171-88。
巴巴K,施密特J,埃斯皮诺萨-鲁伊斯A,比利亚雷霍A, Shiina T, Gardeström P,萨内AP,巴勒劳RP。rpoT对细胞器基因转录和幼苗早期发育有影响;拟南芥2个突变体。植物学报,2004;38(1):38 - 48。
Hricová A, Quesada V, Micol JL。SCABRA3核基因编码质体RpoTp RNA聚合酶,这是拟南芥叶绿体生物发生和叶肉细胞增殖所必需的。植物科学进展。2006;29(3):344 - 344。
Swiatecka-Hagenbruch M, Emanuel C, Hedtke B, Liere K, Börner T.叶绿体基因转录中噬菌体型RNA聚合酶RpoTp功能受损由第二噬菌体型RNA聚合酶补偿。中国生物医学工程学报,2008;36(3):785-92。
Kühn K, Richter U, Meyer EH, Delannoy E, de Longevialle AF, O'Toole N, Börner T, Millar AH, Small ID, Whelan J.噬菌体型RNA聚合酶RPOTmp在拟南芥线粒体中进行基因特异性转录。植物学报。2009;21(9):2762-79。
于秋波,黄超,杨志宁。与高等植物叶绿体转录机制相关的核编码因子。植物科学进展(英文版);
Steiner S, Schröter Y, Pfalz J, Pfannschmidt T.在质体编码的RNA聚合酶复合体中必需亚基的鉴定揭示了适当的质体发育的构建块。中国生物医学工程学报。2011;29(3):344 - 344。
Majeran W, Friso G, Asakura Y, Qu X, Huang M, Ponnala L, Watkins KP, Barkan A, Van Wijk KJ。玉米叶片质体和叶绿体发育过程中的核富集蛋白组类核函数的新概念框架。中国生物医学工程学报,2012;29(1):366 - 366。
王晓明,王晓明,王晓明,等。蛋白质组学研究中质体类核的多功能性。生物化学学报。2016;1864(8):1016-38。
Pfalz J, Liere K, Kandlbinder A, Dietz K-J, Oelmüller R. pTAC2,-6, and-12是质体基因表达所必需的转录活性质体染色体的组成部分。植物学报。2006;18(1):176-97。
Yagi Y, Ishizaki Y, Nakahira Y, Tozawa Y, Shiina T.真核型质体核样蛋白pTAC3是细菌型质体RNA聚合酶转录所必需的。中国生物医学工程学报,2012;29(4):344 - 344。
王丽娟,王丽娟,王丽娟,等。质体编码RNA聚合酶复合体在质体转移RNA表达中的作用。中国生物医学工程学报,2014;29(1):344 - 344。
陈敏,Galvão RM,李敏,Burger B, Bugea J, Bolado J, Chory J.拟南芥HEMERA/pTAC12通过光敏色素启动光形态建成。细胞。2010;141(7):1230 - 40。
Myouga F, Hosoda C, Umezawa T, Iizumi H, Kuromori T, Motohashi R, Shono Y, Nagata N, Ikeuchi M, Shinozaki K.铁超氧化物歧化酶的异络合物保护叶绿体类核免受氧化胁迫,对拟南芥叶绿体发育至关重要。植物学报。2008;20(11):3148-62。
高志平,于秋波,赵婷婷,马强,陈国祥,杨志宁。转录活性染色体复合体拟南芥pTAC14的功能组分与pTAC12/HEMERA相互作用并调节质体基因的表达。中国生物医学工程学报,2011;29(4):344 - 344。
Arsova B, Hoja U, Wimmelbacher M, Greiner E, Üstün Ş, Melzer M, Petersen K, Lein W, Börnke F. Plastidial硫氧还蛋白z与两种果糖激酶样蛋白相互作用,巯基依赖方式:在拟南芥和benthamiana叶绿体发育中起重要作用的证据。植物学报。2010;22(5):1498-515。
Schröter Y, Steiner S, Matthäi K, Pfannschmidt T.芥菜核酸结合蛋白叶绿体亚蛋白组中低聚蛋白复合物的分析揭示了质体基因表达的潜在氧化还原调控因子。蛋白质组学,2010;10(11):2191 - 204。
黄超,余秋波,吕荣华,尹秋青,陈国元,徐林,杨志宁。拟南芥fln2突变体中质体编码聚合酶依赖基因表达的减少导致其延迟变绿。公共科学学报,2013;8(9):e73092。
于庆宝,陆勇,马强,赵婷婷,黄超,赵海峰,张晓玲,吕荣荣,杨振忠。TAC7是拟南芥叶绿体转录活性染色体复合体的重要组成部分,与FLN1、TAC10、TAC12和TAC14相互作用,调控叶绿体基因的表达。中国生物医学工程学报。2013;29(3):344 - 344。
张晓霞,李淑娟,张国强,金金凯,杜彩云,张国强。pTAC10是一种促进叶绿体发育的关键亚基。中国生物医学工程学报,2017;29(1):344 - 344。
Pfalz J, Holtzegel U, Barkan A, Weisheit W, Mittag M, Pfannschmidt T. ZmpTAC12与单链核酸结合,对玉米质体编码聚合酶复合物的积累至关重要。植物学报。2015;206(3):1024-37。
李志强,李志强,李志强,等。叶绿体超氧化物歧化酶的生物学特性及其生理功能。生物化学生物物理学报(BBA)。2011, 1807(8): 989 - 98。
Kliebenstein DJ, Monde R-A, Last RL。拟南芥中的超氧化物歧化酶:一个具有不同调控和蛋白质定位的折衷酶家族。植物科学进展。1998;18(2):637-50。
Kleffmann T, Russenberger D, von Zychlinski A, Christopher W, Sjölander K, Gruissem W, Baginsky S.拟南芥叶绿体蛋白质组揭示了途径丰度和新的蛋白质功能。中国生物医学杂志,2004;14(5):354-62。
孙卡,朱继科。拟南芥中两个cu/Zn超氧化物歧化酶基因的转录后诱导是通过下调miR398介导的,对抗氧化应激很重要。植物学报。2006;18(8):2051-65。
李志强,李志强,李志强,等。在无胁迫条件下,水循环对叶绿体的保护至关重要。中国生物医学工程学报,2003;29(4):489 - 497。
陈艳,姜娟,宋安,陈松,单红,罗辉,顾超,孙娟,朱林,方伟。环境温度通过miR398增强菊花CdICE1拟南芥的抗冻性。中国生物医学工程学报,2013;
Filichkin SA, Priest HD, Givan SA, Shen R, Bryant DW, Fox SE, Wong W-K, Mockler TC。拟南芥选择性剪接的全基因组图谱。基因组学报,2010;20(1):45-58。
陈文华,吕刚,吕超,曾超,胡松。植物基因组中可选第一外显子的系统分析。植物学报。2007;7(1):55。
Jain M, Khurana P, Tyagi AK, Khurana JP。水稻和拟南芥无内含子基因的全基因组分析。中国生物医学工程学报。2008;8(1):69-78。
帕鲁萨SG,阿里GS,雷迪AS。拟南芥富含丝氨酸/精氨酸蛋白质的前mrna的选择性剪接:激素和应激的调节。植物学报,2007;49(6):1091-107。
马祖考特利,马斯特兰洛,马祖考特利,马祖考特利。植物非生物胁迫响应:转录后和翻译后调控调控转录。植物科学进展,2008;26(4):344 - 344。
Maquat勒。无意义介导的mRNA衰变:剪接、翻译和mRNP动力学。中国生物医学工程学报,2004;5(2):89-99。
Hiller M, house K, Platzer M, Backofen R.通过选择性剪接创建和破坏蛋白质特征——一种新的调节功能的机制。中国生物医学工程学报,2005;6(7):R58。
van Bentem SF, Vossen JH, Vermeer JE, de Vroomen MJ, Gadella TW, Haring MA, Cornelissen BJ。植物蛋白磷酸酶5亚型的亚细胞定位是通过选择性剪接确定的。植物科学进展。2003;33(2):344 - 344。
Terasawa K, Sato N.利用penda - gfp融合蛋白原位显示质体类核。植物物理学报。2005;46(4):649-60。
大豆生长、养分积累和超微结构基因型差异对锰铁供给的响应中国机械工程学报。2005;96(1):149-58。
杜德龙,李国强,李国强。玉米营养发育早期缺铁和铁再补给的影响。植物细胞环境。1997;20(8):1051-60。
甘S, Amasino RM。细胞分裂素的产生对叶片衰老的抑制作用。科学。1995;270(5244):1986 - 8。
韦弗LM,甘S,奎里诺B,阿马西诺RM。几种衰老相关基因在应激和激素治疗反应中的表达模式的比较。植物分子生物学,1998;37(3):455-69。
福尔曼J,德米奇克V,博思韦尔JH,米洛纳P,米德玛H,托雷斯MA,林斯特德P,科斯塔S,布朗利C,琼斯JD。NADPH氧化酶产生的活性氧调节植物细胞的生长。大自然。2003;422(6930):442 - 6。
Garcia M, Myouga F, Takechi K, Sato H, Nabeshima K, Nagata N, Takio S, Shinozaki K, Takano H.拟南芥细菌肽聚糖合成酶MurE的同源物在叶绿体发育中具有重要作用。植物学报,2008;36(6):344 - 344。
Motohashi R, Nagata N, Ito T, Takahashi S, Hobo T, Yoshida S, Shinozaki K. ΔpH-dependent蛋白转运体的TatC同源物在拟南芥叶绿体发育过程中类囊体膜形成中的重要作用。自然科学进展,2001;29(4):379 - 379。
杨晓明,王晓明,王晓明,等。不同提取溶剂对蕨类植物叶绿素和类胡萝卜素含量的影响。化学学报,2014;4(9):63-9。
超氧化物歧化酶:改进的测定方法和适用于丙烯酰胺凝胶的测定方法。生物化学。1971;44(1):276-87。
Hoffmann A, Hammes E, Plieth C, Desel C, Sattelmacher B, Hansen U-P。co2供给对拟南芥活性氧形成的影响。原生质。2005;227(1):3 - 9。
确认
我们感谢Sun Hyun Chang和Tae Young Um(首尔国立大学)在超显微切片/透射电镜和SOD活性测定方面的技术支持。
资金
这项工作是在农业科技发展合作研究计划(项目号:农业科技合作研究计划)的支持下进行的。PJ01323901和PJ01364301),韩国农村发展局,以及韩国政府(MOE)资助的韩国国家研究基金会[NRF-2019R1A2C1007103]。
作者信息
从属关系
贡献
GJ构思了最初的筛选和研究计划;GJ和YC监督实验。SL完成了大部分实验。GJ, JK和YC设计实验并分析数据;GJ和YC构思了这个项目,并在所有作者的贡献下撰写了文章;YJ和JK补充了写作。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
的核苷酸和氨基酸序列FSD3而且FSD3S.图S2。FSD3和PEND共定位。图S3。OsFSD3 (LOC_Os06g05110.1)与其异构体OsFSD3S (LOC_Os06g05110.3)疏水性的比较图S4。OsFSD3S中一个假定的跨膜螺旋结构域。图S5。FSD3S蛋白的定位。图S6。FSD3SΔTM-GFP和叶绿体中的FSD3S-GFP蛋白。图S7。表达水平FSD3S在35 s:: FSD3S转基因植物。图S8。的表达FSD3S没有营救fsd3突变表型。图S9。描述的FSD3S-GFP而且FSD3SΔTM-绿色荧光蛋白overexpressing植物。图S10。中血红蛋白的形成35 s:: FSD3S转基因植物。图S11。的变化FSD3而且FSD3S衰老过程中的转录水平。表S1。本研究中使用的引物。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
李世祥,郑永华,金志强,李志强。et al。质体RNA聚合酶相关蛋白FSD3的异构体负调控叶绿体发育。BMC植物生物学19日,524(2019)。https://doi.org/10.1186/s12870-019-2128-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2128-9
关键字
- 叶绿体
- 质体编码的RNA聚合酶
- PEP-associated蛋白质
- FSD3
- FSD3S
- 可变剪接