摘要
背景
疫霉物种分泌来自名为Crinkler(CRN)的家族的细胞质效应器,其特征在于N-和C末端区域的存在特定结构域。P. Parasitica.在广泛的宿主植物中引起疾病,然而CRN效应器在这些相互作用中的作用仍不清楚。在这里,我们的目标是:(i)识别候选人CRN编码基因P. Parasitica.基因组;(ii)评估转录表达PpCRN(疫霉parasiticaCrinkler候选人)期间P. Parasitica.互动柑橘神奇(高敏感)poncirus trifoliata(耐);(iii)从功能上描述两个PpCRNs在模型植物中烟草benthamiana.
结果
我们在硅分析中确定了80个假设PpCRN基因组中的效果P. Parasitica.隔离“IAC 01/95.1”。转录分析显示20PpCRN候选人在与易感敏感的互动过程中柑橘神奇和抗性poncirus trifoliata.我们也发现了P. Parasitica.是否能够识别不同的柑橘宿主并进行相应的调节PpCRNS表达。另外,通过瞬态基因表达进一步表征了两个PPCRN效应器,即PPCRN7和PPCRN20n benthamiana叶子。诱导的超敏反应(HR)通过加性效应增加PpCRN7表达,而PPCRN20表达抑制HR反应n benthamiana叶子。尽管与HR相关的功能存在差异,但两种效应器都增加了植物对HR的敏感性P. Parasitica..
结论
PpCRN7和PpCRN20有增加的能力P. Parasitica.并可能在不同的感染阶段发挥重要作用。这些与ppcrn相关的机制是目前生物技术研究的目标,旨在打破病原体的毒性和促进植物抗性。
背景
植物病原体相互作用是一种无情的战斗,因为病原体致力于侵入宿主组织以获得营养素并完成其生命周期。另一方面,植物试图限制病原体侵袭和殖民,以确保其自身的生存。通常,病原体的攻击策略依赖于效应蛋白的分泌,该蛋白质在感染和殖民化早期功能调节与宿主植物的相互作用[1那2那3.].植物识别保守的病原体相关的分子模式(PAMPS)并触发用于防御的模式触发的免疫(PTI)。为了破坏这种免疫过程,病原体分泌其浓度的效果,促进工厂中的效应触发敏感性(ETS)[4.那5.].
疫霉是oomycete的属,它形成了一组血清缺失的真核微生物,这是一种值得注意的植物病原体,影响各种各样的植物,并在天然和栽培生态系统中引起广泛的损害[6.].最臭名昭着的oomycete属于属疫霉(在希腊语中意为“植物破坏者”),其中包括100多个物种,可以说是双子叶植物中最具破坏性的病原体[7.].疫霉spp.是半生物营养病原体[8.和几种疫霉已经被描述为柑橘类疾病的致病因子,包括最重要和最广泛的P. Nicotiane.(=P. Parasitica.)Dastur和P.柑橘阵尔(Sm。& Sm)。Leonian, (9.].但是,也包括P. Boehmeriae.看到的,p .过(Lebert & Cohn) Srhöter,p . capsici莱昂安,p、肉桂兰德,p . ciricola看到的,p . drechsleri塔克p . hibernalis肉,p . megaspermaDrechsler,P. Palmivora.巴特勒(Butler),P. Nicotiane.(=P. Nicotiane.B. de haan var。)。疫霉属。根据感染的植物组织导致柑橘中的几种疾病,具有根腐肉和树干胶质胶质[10那11].柑橘胶质疾病被认为是影响全世界柑橘行业的最严重的疾病之一,若干地区造成了重大的经济损失[12].
属于该属的种疫霉是否对其进行测序,揭示了这种oomycete呈现了几种推定的效应蛋白编码基因,其可以潜在地操纵宿主植物的生理学。这些效果可以促进毒力或激活主体防御系统[13那14].通常,效应蛋白根据其位置分为质外体(在细胞外基质中分泌时)或胞质(在转运到宿主细胞时)[13那15].细胞质效应器,如RxLR或Crinkler (CRN),是在其n端携带保守结构域的模块化蛋白质[2那13那16那17].这些n端保守结构域与效应子向宿主细胞质的易位有关,并确定了效应子超家族。在c端区域,有更多种类的域,它们与蛋白质易位无关,而是与效应子的特定功能有关[15].
CRN蛋白主要分享高度保守的N-末端基序(亮氨酸 - 任何氨基酸 - 苯丙胺 - 丙氨酸 - 丙氨酸 - 丙氨酸 - 丙氨酸)[15].大多数CRN效应子在LxLFLAK motif下游还携带一个DWL域和一个HVLVXXP motif [15].这些效应蛋白主要与坏死诱导相关;然而;其中一些可能抑制或抑制由PAMP触发的编程的细胞死亡(PCD)[18那19那20.].
研究…的作用P. Parasitica.PPCRN效应家庭在植物病原体互动期间,这项工作呈现:(i)鉴定候选人PpCRN基因P. Parasitica.将“IAC_01 / 95.1”和基因组与其他分离物提供的基因组比较;(ii)候选人转录基因分析PpCRN年代期间表达P. Parasitica.与易感者相互作用柑橘神奇和抗性poncirus trifoliata;(iii)两者的功能表征PpCRN年代P. Parasitica.与模型工厂的互动烟草benthamiana.
结果
候选CRN效应P. Parasitica.(PpCRN)
在这里,我们探讨了可用的基因组P. Parasitica.在国际项目下存放”疫霉parasitica基因组主动性“数据库(https://www.ncbi.nlm.nih.gov/assembly/?term=phytophthora%20parasitica)获得基因组数据P. Parasitica.与不同主机和地理起源的分离株,以研究CRN效果。
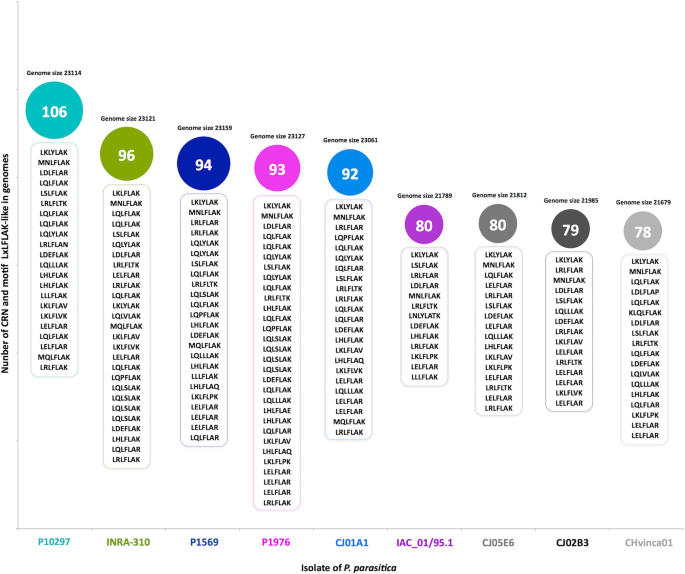
我们鉴定了在基因组中编码PPCRN效应蛋白的80个候选基因P. Parasitica.隔离IAC_01/95.1(图。1).同样,候选人PpCRN在其他的基因组中发现了效应器P. Parasitica.分离株中以P10297株最多PpCRN候选菌(106个),而分离菌‘CHvinca01’数量最少(78个)。在几个不同的PpCRN候选基因中发现了保守的LxLFLAK基序P. Parasitica.基因组,但在数量和序列多样性方面,从一个基因组到另一个基因组(图。1).仅在6个候选PpCRN中预测了分泌信号肽,即PpCRN2、PpCRN5、PpCRN7、PpCRN10、PpCRN14和PpCRN20,这相当于分离物“IAC 01/95.1”基因组中识别的候选蛋白总数的7.5%。
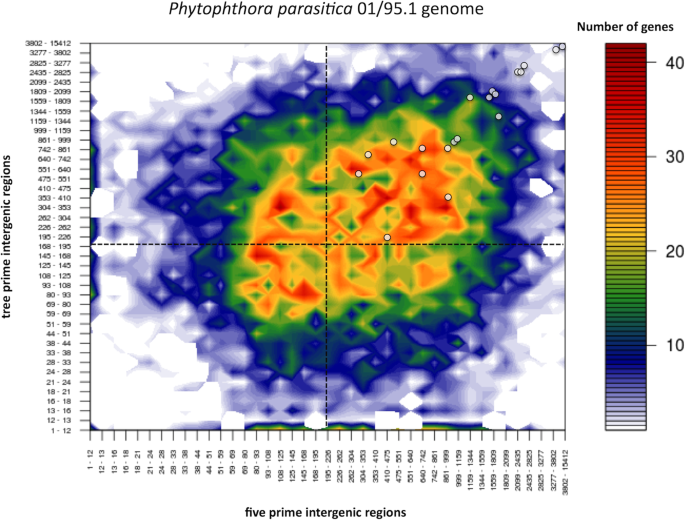
基因组结构可以提供有关基因功能、调控和适应的信息[15].在疫霉物种,一些地区富含复制和稀疏基因,其与致病性有关,包括效应编码基因。这P. Parasitica.基因组按基因间区域大小呈现异质性分布。基因组结构P. Parasitica.分离物IAC 01_95如图2所示。2.相邻基因间的侧翼距离(基因间区域)是基因密度局部分布的度量指标,可根据相邻基因间5′-和3′-端基因间区域长度绘制成二维图。基因组结构P. Parasitica.显示20个被选中的CRN基因位于基因组的稀疏区域(图。2).在稀疏区域,由于其可塑性,出现一个新的效应体或仅仅进化一个已经存在的蛋白质的机会比在稠密区域更有可能发生。
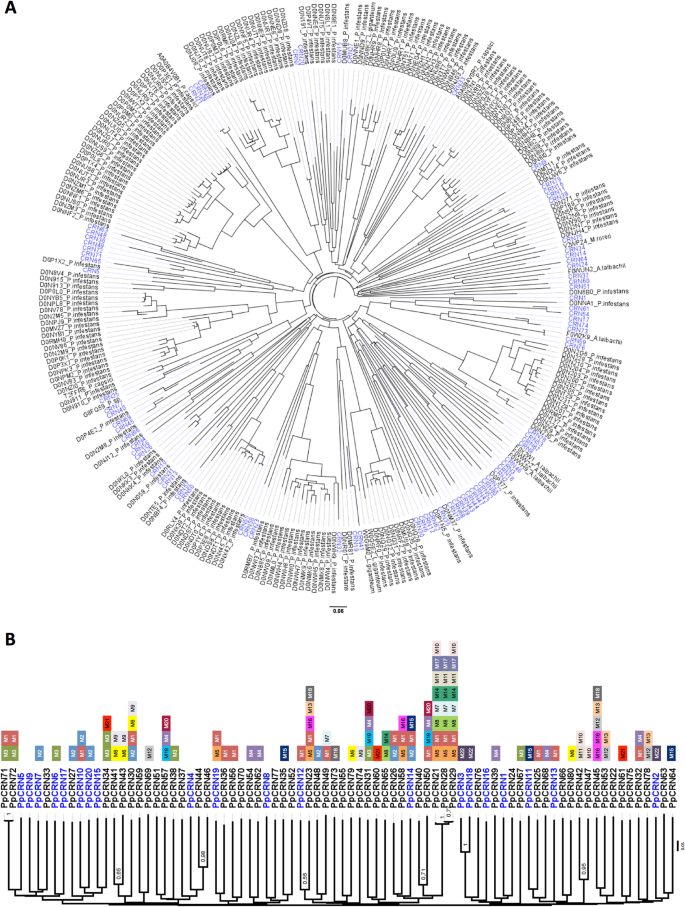
为了验证所识别的推定PPCRN蛋白序列和先前描述的CRN之间的相似性,使用来自UNIPROT数据库的所有识别的PPCRN和CRN序列预测邻接树(图。3.a). PpCRN序列在树中广泛分布,表明它们之间存在较大的序列差异。这种分布模式也遵循了P. Infestans.树中使用的序列。为了解决PpCRN序列之间的高差异,我们寻找它们之间的共同基序。预测22个基序至少存在于3个总序列中(图。3.b)。不同CRN基序的识别被命名为M1至M22(图。3.b). 80个PpCRN候选基因的序列和附加信息显示在附加文件中1.
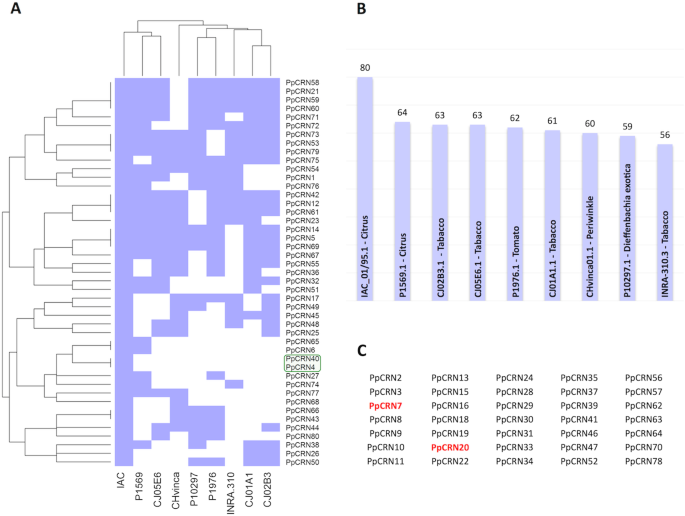
所有80都预测PpCRN以IAC_01/95.1分离株的基因组为查询源,在IAC_01/95.1分离株的其他8个基因组中搜索同源基因P. Parasitica.那which are named ‘P1569.1’, ‘P1976.1’, ‘INRA-310.3’, ‘P10297.1’, ‘CJ01A1.1’, ‘CJ05E6.1’, ‘CHvinca01’,‘CJ02B3.1’ (Fig.4.).我们在其他的基因组中找到了类似的PPCRNP. Parasitica.利用“IAC_01/95.1”基因组的80个PpCRN候选蛋白序列进行Blastp搜索。该基因组方法揭示了“IAC_01/95.1”分离物的80个ppcrn的基因组分布和邻近性。相似的序列PpCRN7和PPCRN20在所有九个中被发现P. Parasitica.基因组(附加文件3.:图。S1),而PpCRN4和PPCRN40'IAC_01 / 95.1'基因组是独一无二的(图。4.a)基于80名候选人PpCRN我们的分析显示,最接近的基因组P. Parasitica.隔离'IAC_01 / 95.1'是来自柑橘和烟草的分离物'P1569.1'和'CJ05E6'(图。4.a).大多数的PpCRN在“IAC_01/95.1”分离物中预测的候选物质也存在于其他分离物中,从柑橘分离物“P1569.1”中的80个候选物质中的64个到烟草分离物“INRA-310.3”中的80个候选物质中的56个。4.35 b)。预测PpCRNs(43.75%) IAC_01/95.1分离株的蛋白也存在于其他8个分离株中,且每个分离株中至少存在一个相应的蛋白P. Parasitica.分离基因组,呈现超过95%的同一性和50%覆盖率(图。4.C)。
不同分离株PPCRN的基因组分析P. Parasitica..一种Dendogar的距离八个P. Parasitica.从' IAC_01/95.1 '基因组中分离出' P1569.1 ', ' P1976.1 ', ' ina -310.3 ', ' P10297.1 ', ' CJ01A1.1 ', ' CJ05E6.1 ', ' CHvinca01.1 ', ' CJ02B3.1 '。绿框标记的是“IAC_01/95.1”基因组特有的PpCRN4和PpCRN40。B.在分离物“IAC_01/95.1”中预测的80个PpCRNs,以及在其他8个基因组中相应的存在。C鉴定所有9个基因中发现的35个预测PpCRNP. Parasitica.基因组。进一步表征的PpCRN7和PpCRN20用红色突出显示
预料到的PpCRNs在期间转录柑橘类-P. Parasitica.交互
二十PpCRN在植物-病原互作过程中选择候选基因进行基因表达分析P. Parasitica.和二柑橘类物种 (C. Sunki.和p . trifoliata).我们选择这两种柑橘是因为它们对疫霉parasitica感染;柑橘神奇是敏感的,poncirus trifoliata对这种病原体有抵抗力这些候选者,从PpCRN1到PpCRN20,是基于以下一个或多个特征的存在而选择的:(i)存在分泌信号肽;(ii)缺乏跨膜结构域;(iii)其他植物-病原互作研究中的差异基因表达;(iv)存在保守的CRN结构域;核或亚细胞定位信号;(vi)与来自其他物种的效应子序列同源性;(七)PpCRN位于基因组稀疏区域的基因。
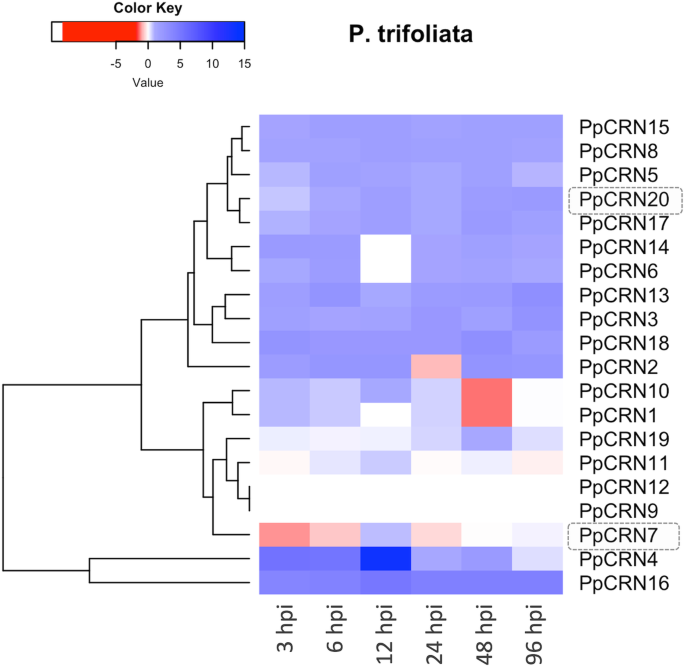
基因表达分析表明,该基因的表达动态PpCRN效应器在相互作用时P. Parasitica.柑橘类植物。我们的分析表明PpCRN根据柑橘种类和感染阶段,家族成员的转录水平发生了改变[11那21](图5.那6.和附加文件4.:图S2)。数字5.表明,在p . trifoliata,绝大多数PpCRNs除了候选基因沿着时间点上调PpCRN1那PpCRN7和PpCRN10至少在一个时间点被抑制了。PpCRN4,对于分离的'IAC 01 / 95.1'基因组是独一无二的,在此期间检测到最高的差异表达水平PpCRN候选人,其次是PPCRN16和PPCRN18两者都显示出高水平的转录本。候选人PpCRN9那PpCRN11和PPCRN12.,在分析的整个时间点显示恒定的表达水平。此外,PpCRN7最初在接种后3小时(hpi)表达被抑制,然后在6小时后稳定地恢复到基础水平,然而PPCRN20轻微诱导6 dpi向前(图。5.).
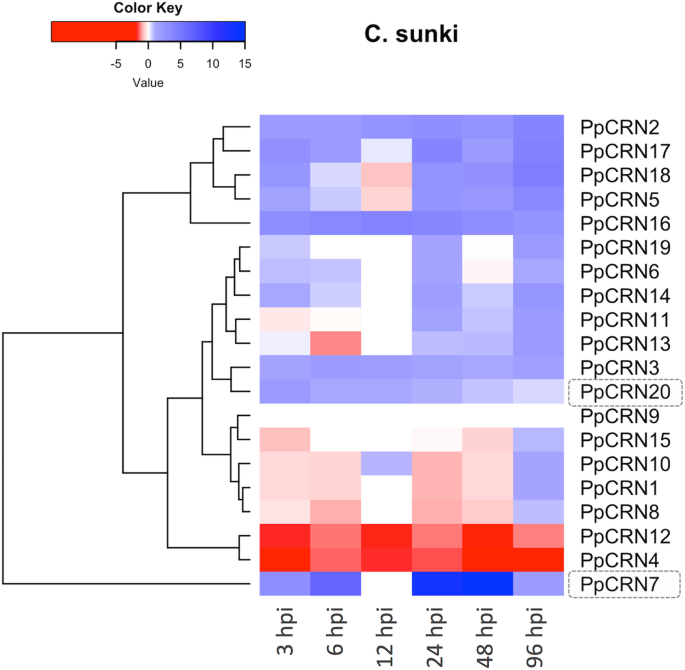
在C. Sunki.,大多数PpCRNs是转录诱导的(图。6.).然而,PpCRN4那PpCRN9和PPCRN12.转录物在所有时间点都被下调。PpCRN8和PPCRN13表达在大多数时间点都显示出部分抑制;在96 HPI,检测到其转录水平的增加。比较地,PpCRN7和PPCRN20表达在整个疾病的发展中诱导PpCRN7表现出最高的差异表达水平PpCRN候选人(图。6.).最近我们的小组发布了数据显示的数据P. Parasitica.有能力识别和调节基因表达水平的效果CRN那RxLR那Elicitin那CBEL和NPP-1随着时间的推移和相互作用C. Sunki.和p . trifoliata[11].
PPCRN7和PPCRN20的功能表征
我们进一步利用功能基因组学研究了两种PpCRN效应子在宿主植物中调控细胞和分子反应的潜在作用。我们在硅分析中确定了候选效应器PpCRN7和PPCRN20将是很好的候选特性,因为两者都显示:(i)分泌肽信号;(ii)缺乏跨膜结构域;在稀疏区域进行基因组定位;(iv)存在于所有的基因组中P. Parasitica.本文分析的分离株序列一致性高;和(v)已知保守物的存在CRN域(附加文件3.:图S1和附加文件1).
因此,揭示功能作用PpCRN7和PPCRN20,瞬时表达测定通过农毒反射进行n benthamiana叶子。插入PpCRN7和PPCRN20转基因植物表达载体pCambia1302(附加文件5.图S3A)经酶解凝胶电泳证实。核苷酸片段符合预期大小PpCRN7(430 pb)和PPCRN20(439pb)(附加文件5.:图S3B)。PpCRN7和PpCRN20蛋白的表达在植物中经Western blotting确认(附加文件5.:图S3C)。然后用这些构念来评估PpCRN7和PPCRN20诱导或抑制HRn benthamiana通过与Elicitin联合起来的叶子INF-1- 已知的细胞死亡诱导因子[22那23].众所周知,elicitin INF-1可诱导HR尼古利亚人物种。因此,它通常用于效果的功能表征研究[23].
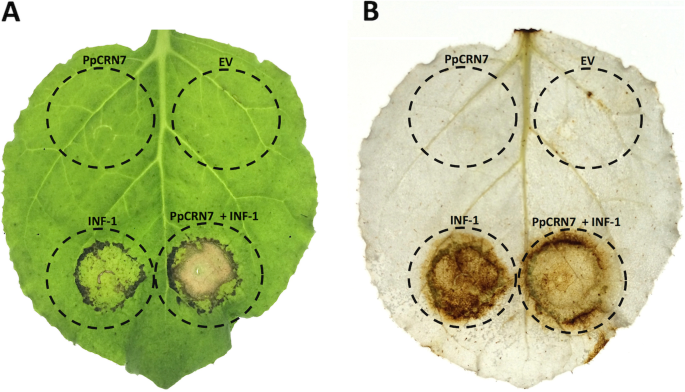
PpCRN7可增强inf -1诱导的HR反应
测试…的效果PpCRN7对Elicitin Inf-1介导的人力资源的表达,我们进行了含有(i)空载体的植物表达载体的植物特征形式,(ii)PpCRN7(3)INF-1,(iv)共同表达PpCRN7 + INF-1(图。7.一个)。空载体和空载体浸透的叶片无明显症状PpCRN7- 单独携带载体。然而,INF-1- 表达叶片显示HR反应,在农药中的明显组织坏死区,如叶子共同渗透的叶子中也观察到PpCRN7随着INF-1(图。7.a).因此,瞬时表示PpCRN7 + INF-1在n benthamiana由于收入的人力资源反应,叶片揭示了CRN效应器与ELITITIN的协同活性,导致人力资源响应,导致预期和更突出的PCD发生。
为了验证PpCRN7效应是否也影响活性氧(ROS)的释放和氧化爆发,进行了生化和比色测定n benthamiana农药过滤叶(图。7.b).在此分析中,底物DAB(3,3 ' -二氨基联苯胺)被过氧化氢氧化,生成深褐色沉淀,这允许视觉检测-组织越深,释放的ROS越多。这INF-1-表达区明显变暗,表明ROS是由活细胞产生的,而在共浸润区INF-1和PpCRN7与表达的区域相比,暗暗染色INF-1(图。7.b).这表明该区域的细胞已经死亡,由于预期和放大ROS的释放和随后的HR,由效应PpCRN7与INF-1的协同活性驱动。PpCRN7效应体的生化靶点很可能存在于下游,即INF-1激活ROS的释放,因为当单独存在时,没有INF-1, PpCRN7效应体没有释放ROS或诱导PCD的活性。
另外,我们测试了农浓度,因为瞬时表达检测可能与观察到的HR扩增有关(附加文件6.:图S4)。将AgronFiltration溶液调节至OD600,0.5和1.0,并用于共渗透PpCRN7随着INF-1,以及空向量(EV)INF-1.结果类似于PpCRN7增强INF-1- 诱导的人力资源响应,独立于农PpCRN7与INF-1协同调控植物防御机制,导致氧化破裂、程序性细胞死亡和组织坏死(附加文件)6.: 图。4.).
PpCRN20抑制inf -1诱导的HR反应
同样的方法被用于测试PPCRN20INF-1介导的对HR的表达。我们对含有(i)空载体(ii)的植物表达载体进行了农转化。PPCRN20(3)INF-1, (iv)PPCRN20 + INF-1.空载体和空载体浸透的叶片无明显症状PPCRN20-包含向量单独(图。8.然而,正如所料INF-1-表达的叶片表现出HR反应,在农业浸润区域有明显的组织坏死(图。8.b).共同渗透INF-1随着PPCRN20提出了强烈的削减INF-1全身症状。这一结果表明,PpCRN20作为inf -1诱导的HR反应的抑制因子(图。8.b)。
DAB测定n benthamiana叶子在表达空载体时显示没有ROS生产PPCRN20包含向量(图。8.C)。然而,叶子共同表达PPCRN20随着INF-1活性氧生成显著降低INF1.表达网站(无花果。8.d).组织坏死的消失和ROS生成的减少表明PpCRN20可能作为HR抑制因子。
瞬态的表达PpCRN7和PPCRN20增加n benthamiana磁化率
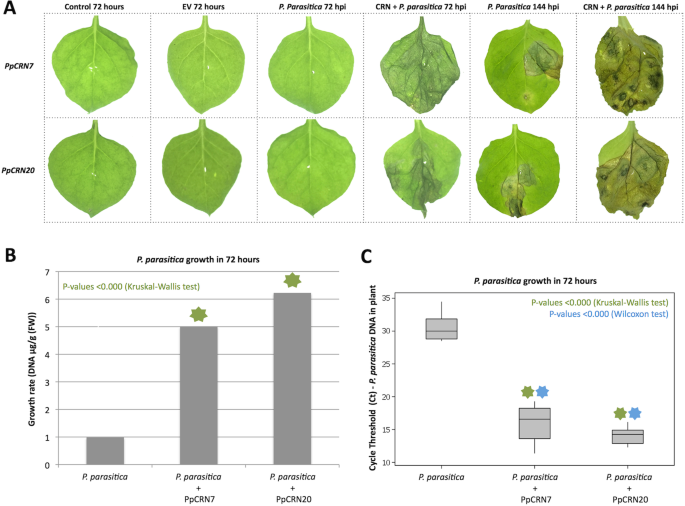
了解PpCRN7和PpCRN20在细胞凋亡过程中的生物学作用P. Parasitica.感染,n benthamiana叶片接种游动孢子P. Parasitica.,农业反演后24小时PpCRN7——或者PPCRN20包含向量。叶子,是暂时性的表达PpCRN7和PPCRN20,接种P. Parasitica.接种后72和144 h,游动孢子出现症状,包括严重萎蔫和组织坏死。而P. Parasitica.接种叶,没有PpCRN仅在144hpi时出现症状(图。9.a).未处理的叶片无症状P. Parasitica.表示空载体或任何载体的接种PpCRN(图。9.一个)。
瞬态的表达PpCRN7和PPCRN20在n benthamiana离开之后,P. Parasitica.感染。一种n benthamiana叶瞬变与效应器PpCRN7和PPCRN20然后接种10个6.游动P. Parasitica..表达叶面组织PpCRN7和PPCRN20并接种P. Parasitica.在接种后72和144 h出现严重的萎蔫和坏死症状。对照和农业渗透叶片PpCRN没有接种的基因P. Parasitica.游动孢子和被感染的叶子P. Parasitica.游动孢子没有出现明显症状。在144hpi时,所有的感染植株都出现症状,但这些症状在瞬时表达的植株中更强PpCRNs.B.侵染叶片DNA检测的差异P. Parasitica.(控制)和P. Parasitica. + PpCRN7那P. Parasitica. + PPCRN2072 hpi有高度统计学意义。C基因组DNA的数量P. Parasitica.对控制厂有统计不同,有值:P.-Value <0.000,由星号(kruskal-wallis测试)表示
P. Parasitica.来自叶组织的基因组DNA通过RT-QPCR定量为72hPI收集的样品,以验证Oomycete的生长速率和定植,这是一个指示n benthamiana易感性(图。9.b).在P. Parasitica.- 先前浸润的植物PpCRN- 缓解载体,仅接种植物(图。9.c).较高的P. Parasitica.基因组DNA在表达叶片中发现PpCRN7和PPCRN20与叶子相比没有PpCRN表达式(无花果。9.b, c)。在转化和随后接种的样品中,与仅接种的植株在72 hpi时相比,发现了显著差异。在表达PpCRN20的叶片中表达量最高P. Parasitica.基因组DNA,其次是表达PpCRN7的叶片。
讨论
植物病原体互动涉及复杂和复杂的攻击网络与防御策略。病原体旨在侵入宿主细胞以获得营养素并完成其生命周期。另一方面,该工厂使用防御系统含有感染并确保其自身的生存。攻击策略疫霉物种依赖于效应器的分泌,特别是调节与宿主植物防御的相互作用并使感染和定植过程成为可能的CRN效应器[18那19].尽管CRN效应剂主要与坏死的出现有关,但也有一些CRN效应剂可以抑制由PAMPs触发的细胞死亡[18].
在天然群体中,由宿主群的电阻结构驱动的效应频率的变化被遗传漂移互补,这可能产生显着的差异,因为在给定的地理条件下的个体病原体菌株的存活或消失空间 [24那25].另一方面,病原体种群的基因流动或迁移可能导致新种群的建立或在现有种群中引入新的毒力组合[26].候选人的数量PpCRN各基因组预测的效应基因不同P. Parasitica.以及lxlflak样基序在不同分离株之间的差异[15那18].然而,35预测PpCRN- 在所有九个分离物中发现了沉积基因。我们认为PPCRN效应器可能对此重要P. Parasitica.植物病原体相互作用期间的致病性,考虑到这些效应的复杂性和多样性P. Parasitica.分离物及其相应的生态系统。另一方面,预测PpCRN4和PPCRN40专门在分离物'IAC01 / 95.1'的基因组中发现的基因可能是对其起源的生态系统的适应性。
基于80预测PpCRN菌株IAC_01/95.1和P1569的亲缘关系最接近P. Parasitica.隔离。它们都是从柑橘类植物中分离出来的。这两个分离株较低的遗传变异可能与对感染同一宿主的适应性有关。此外,这种基因组接近性也可能与地理因素有关,考虑到最近的3个分离株(‘IAC_01/95.1’、‘P1569’和‘CJ05E6’)属于同一个美洲大陆,可能是从同一个祖先进化而来的。
来自80个CRN疗效候选的蛋白质初级结构P. Parasitica.在硅中被鉴定,并呈现出明显的LxLFLAK基元。这种复杂性和多样性可以归因于半生物营养生活方式P. Parasitica.,以及来自多种宿主植物的适应和共同进化的力量,这些宿主植物有250多个属[27].因此,在PpCRNs一级结构中发现的这种多样性可以被这样一个事实解释:效应分子是模块化的,并且在选择压力下它们的序列可能发生变化。这些基因序列的变化可能会使效应蛋白失活,或者提供一种新的功能,增加病原菌对环境挑战的适应能力(Haas et al., 2009)。PpCRN序列n端和c端部分的多样性与报道的一系列微生物的结果一致,包括Rhizophagus regularis, P. capsici, Batrachochytrium dendrobatidis, Albugo laibachi, A. cândida, Pythium ultimum, Hyaloperonospora arabidopsidis, P. infestans, Aphanomyces euteiches, P. sojae, P. ramorum[15那16那28那29那30.那31那32那33那34那35].
PpCRN7和PPCRN20在所有人中被发现P. Parasitica.本文研究的分离株具有高度的蛋白序列保守性,且位于稀疏区域,表明这两种效应子可能在相互作用中发挥了关键作用P. Parasitica.和宿主植物,可能调节植物的防御机制。这两个效应蛋白具有典型的CRN基元,即LxLFLAK-like基元,PpCRN7中的“LYLATK”和PpCRN20中的“LFLAK”疫霉spp.[15那29],后跟N末端区域的“DI”和“DWL”图案。
在硅分析和进一步的功能表征分析中,揭示了两个CRN效应的生物学作用P. Parasitica..为了研究这两种ppcrn效应子的作用,我们进行了功能基因组和蛋白质组学研究,以探索从该基因中获得的信息P. Parasitica.基因组,并评估调制n benthamiana防卫反应,基于激活或抑制HR反应。PpCRN7效应器与P. Infestans.Elicitin Inf-1通过预期和放大HR和PCDn benthamiana农农用叶子。这种效应诱导的细胞死亡促进了易感性,并且PICRN8和PSCRN63的效应蛋白已经报道了类似的结果。P. Infestans.和p .突变,分别[36那37].效应子PSCRN63的活性与植物ROS稳态的破坏有关,通过直接与宿主调用酶相互作用[38].我们的结果表明,PpCRN7效应体靶向/调节一种存在于ros释放激活下游的化合物,但该靶点的确切性质仍有待阐明。从营养的角度来看,这是有道理的P. Parasitica.只有在PAMP或效应体识别后,宿主的防御激活后,才会有/部署一个效应体来强化HR的反应。这将导致更大的坏死区域,这将有利于病原体的坏死营养阶段。强烈的HR反应可能无法杀死半生物营养病原体,例如P. Parasitica.,因为它们会以坏死组织为食。据报道[11]强大的防御反应柑橘神奇感染P. Parasitica.导致了一个活跃的HR的激活,这并不足以杀死病原体,而是增加了它的定植[11].
多种效应器可能在相同的途径中起作用,只有最有效的效应器可能占上风并表现出疾病症状。PPCRN7对INF-1功能具有添加效果,增强了HR。
相反,PpCRN20效应剂抑制了HR的反应,导致了ROS在农业渗透中积累的减少n benthamiana叶子。因此,它表明PPCRN20可能是使用的重要效应P. Parasitica.打击植物防御。已经显示出几种CRN效应器来抑制Elicitor-触发的植物细胞死亡[39那40].例如,p .突变PSCRN70和PSCRN115抑制PCD,减少H.2O.2累积和下调防御相关基因,包括PR1b那PR2B.那ERF1和熏鲑鱼基因[19],并与植物过氧化氢酶相互作用,通过ROS积累抑制PCD [20.].同样,P. Parasitica.RxLR效应体PpRxLR2能完全抑制INF-1诱导的细胞死亡n benthamiana叶子(22].
P. Parasitica.是一种血管营养病原体,因此具有饲料的能力或死亡组织。几位作者指出了血统养殖生活方式P. Parasitica.可以在两个时间阶段均衡,初始生物营养阶段和后面的病重阶段阶段[41那42那43].在此基础上,我们提出了两者相互作用的生物学模型P. Parasitica.和植物宿主,包括PPCRN7和PPCRN20效应器的时间和功能性。
我们的假设是PPCRN20在感染的初始阶段起作用,通过抑制植物中的HR和PCD发挥重要作用,从而有利于植物活组织的感染和定植。在这种生物营养阶段,植物细胞提供耐用且可再生的营养素,光合作用和代谢活性植物组织的完整性将有利于P. Parasitica.精力充沛的健身和细胞周期,并将有助于殖民化建立。后来感染,植物生理稳态可能已经损害,一些单个细胞或组织可能被损坏,导致宿主识别损伤相关的分子模式(DAMPS)和防御反应的激活,包括人力资源。通过PPCRN7的活性完成病原体结肠化方法,其增强HR,随后,PCD在植物组织中。这种死亡植物组织的显着增加提供了最终剂量的能量分子,该分子可以由病原体使用以完成其生命周期。我们的假设总结在图4中。10.
结论
PpCRN7和PpCRN20与侵袭性P. Parasitica.同时增强植物的敏感性,因此它们的机制现在是生物技术研究的目标,旨在破坏这些效应体的活性,打破病原体的侵略性,并促进植物的抗性。另一种方法是识别和编辑这些效应剂作用的植物分子靶标或易感基因,也导致抗性。
方法
Oomycete生长条件
疫霉parasitica分离物“IAC_01/95.1”(存储在IAC-Cordeiropolis-SP Brazil的微生物收集物中)在胡萝卜-琼脂培养基中,在25°C的黑暗中培养。根据Máximo et al.(2017)进行孢子囊发育[11那21那22].简单地说,当菌落达到平板容量的80%时,将无菌水倒在平板上,每天替换水,持续1周,诱导孢子囊发育。为了诱导游动孢子释放,培养皿在4°C、黑暗中培养1小时。收集游动孢子悬浮液并调整至105.游动孢子/毫升。在纽鲍尔室中计数悬浮游动孢子的数量。
植物感染和农药滤波器测定
“sunki”普通话的种子(柑橘神奇长的矮。和三叶橙(枳壳trifolita(l)英国皇家空军。cv, Rubidoux)从Centro de citrictura Sylvio Moreira/Instituto Agronômico de Campinas (CCSM/IAC), Cordeirópolis, São Paulo,巴西。的种子柑橘神奇和poncirus trifoliata在贫瘠的土壤中发芽。发芽3个月后,小心地去除基质,将幼苗转移到含有50 mL蒸馏水的Falcon试管中。暂停10分钟5.Zoospore / ml被添加到接收方中,并用Parafilm密封,以通过蒸发减少损失。在12小时的光周期下在20℃下在生长室中温育植物(250μmolm-2 s-1)。使用每种治疗的六种生物重复,测定重复两次。收获植物根样品0,3,6,394 12,24,48和96小时接种(HPI)以分析推定的表达PpCRN基因P. Parasitica..这些时间点是根据的P. Parasitica.半生物营养生活方式,以前描述过[11那21那22].n benthamiana种子取自Centro de citrictura Sylvio Moreira/Instituto Agronômico de Campinas (CCSM/IAC), Cordeirópolis, São Paulo,巴西。以4 ~ 6周龄的黄花苜蓿为试材,进行了农业渗透试验n benthamiana.在白天22-25℃下,在22-25℃,60%湿度下,在22-25℃,60%湿度下在60%湿度下生长植物。使用年轻和完全扩张的叶子。
识别和注释P. Parasitica.候选人CRN效应基因
候选CRN效应序列来自P. Parasitica.分离的'IAC_01 / 95.1'(PPCRN)被鉴定如下:(i)鉴定属于UNIPROT数据库中的CRN家族的蛋白质序列;(ii)在分离'IAC_01 / 95.1'的基因组中寻找同源序列,使用UNIPROT数据库中鉴定的序列作为BLAST分析的查询(BLASTP E-VALUE> 1E-05);(III)分析PPCRN蛋白序列用于鉴定保守结构域,并使用TMHMM 2.0软件存在/不存在跨膜域(http://www.cbs.dtu.dk/ services / TMHMM /);(iv)用SignalP 3.0软件识别肽信号(http://www.cbs.dtu.dk/services/SignalP-3.0/)使用WOLF PSORT软件来预测亚细胞本地化(http://wolfpsort.org/);(v)通过使用聚类分析和邻近接合方法,通过相似性对准并分组PPCRN蛋白序列。这些分析也使用“以下”的公共可用序列进行“疫霉菌基因组主动性', ' INRA-310.3 ', ' P10297.1 ', ' CJ01A1.1 ', ' CJ05E6.1 ', ' CHvinca01.1 ', ' CJ02B3.1 ',以确定这些分离物中可能的候选crn的数量。所有描述P. Parasitica.推测的CRN蛋白序列出现在附加文件中1.CRN候选序列,即PpCRN (疫霉parasiticaCrinkler)随后是我们在Silico分析中出现的数值顺序。
在其他的基因组中存在类似的CRN效应器P. Parasitica.利用取自“IAC_01/95.1”基因组的80个PpCRN候选蛋白序列进行Blastp搜索验证。在此分析中,最低的蛋白序列一致性和覆盖率分别为95和50%。基因的数量,频率,地理来源P. Parasitica.孤立和主机如表所示1.
基因组结构P. Parasitica.
预测80的分布PpCRN利用R软件,基于二元数据的二维方法,对“IAC 01_95”基因组进行了基因组结构分析。这种方法是灵活的,结合了基因组结构的热图和基因组环境的散点图和选定的基因池[44].
质粒设计与农业转化
基因序列的PpCRN7和PPCRN20通过基因合成获得与3xHA标签融合并克隆在载体pcambia 1302中(附加文件2和附加文件5.:图S3)。重组质粒测序并用于转化根癌土壤杆菌GV3101。转化农杆菌在添加卡那霉素50 μg/mL和利福平50 μg/mL的LB琼脂平板上28℃培养2-3天。从LB平板上的单个菌落中,在含抗生素的3 mL LB液体培养基中制备农杆菌预接种物,28℃,200 RPM,接种24 h。取预接种物40 μL,接种相同抗生素、2 μM乙酰丁香酮和10 mM MES的YEB(农杆菌生长培养基)10 ~ 15 mL,生长过夜,最终OD值约为1。沉淀培养基中的细菌(4000×g, 10 min),颗粒在MMA培养基中重悬20 g蔗糖,5 g MS盐,1.95 g MES, NaOH调整pH为5.6,1 ml乙酰丁香酮/L)。最后OD600海里调整为0.5-1.0。将细胞在室温下温育3小时。通过按下叶子下侧的无针注射器,用1mL注射器进行渗透。将植物在12小时光周期中在25℃下孵育。渗透后2-7天观察症状。PpCRN7- - -PPCRN20-含载体共浸润INF-1- 传染媒介。这些测定重复三次。
检测植物组织中的活性氧物质(ROS)评价HR
用于检测ROS,特别是H2O.2在叶子中n benthamiana,根据Thordal-Christensen等人(1997)[45萨利特等人。(1999)[46].用光学显微镜对染色后的叶片进行分析。
P. Parasitica.在植物中接种和定量他们的DNA,令疾病发展
评估活动的活动PpCRN7和PPCRN20在殖民和发展P. Parasitica.在n benthamiana叶子,我们进行了候选效应器的农药,然后进行了秋霉菌(农鸡过滤后24小时)。1×106.P. Parasitica.游动孢子接种于农业渗透点。用空载体浸渍的叶片作为对照。每个处理采用3个生物重复。在出现症状后采集叶片72 hpi,以评估基因组DNA的数量P. Parasitica..从胡萝卜固体培养基中提取的新鲜菌丝(100 mg)在液氮中研磨,然后使用DNeasy植物迷你试剂盒(Qiagen)进行DNA分离和纯化。根据制造商的建议,使用Wizard®Kit (Promega)进一步纯化DNA。通过紫外光谱(NanoDrop 8000, Thermo Scientific)对DNA样品的纯度和浓度进行评估。用稀释后的DNA (1:20 H)进行RT-qPCR2O)、GoTaq®Real-Time qPCR (Promega)和引物PN5b (5 ' gaacaatgcaacttattggacgtt3 ')和PN6 (5 ' AACCGAAGCTGCCACCCTAC3 ') (ITS区域)各10 pmol,最终体积为20 μL [47].反应进行如下热循环程序,初始变性在95°C 10 min和40个循环:95°C 15 s, 62°C 60s。Ct值绘制在已知DNA浓度的样本生成的标准曲线中,以确定评估样本中的DNA浓度。标准曲线中DNA浓度范围为1 pg ~ 10 ng DNA mL−1。研究结果由Kruskal-Wallis [48和威尔考克森检验[49].
蛋白质提取和Western印迹分析
叶组织n benthamiana使用无菌砂浆和杵在液氮下接地为细粉末,并用萃取缓冲液(Hepes 50mm,Kcl 150mM,Edta1mm,Triton X-100 0.1%,用KOH调节至7.5的pH调节至7.5)1mM DTT和蛋白酶抑制剂。将总蛋白质提取物转移至15%SDS-聚丙烯酰胺凝胶,并进一步分析了带的图案。将蛋白质转移到硝酸纤维素膜中,在2分钟内在PBST(PBS中的PBS中的PBS(PBS)洗涤,并在PBST-BSA的30分钟内封闭(PBS,0.1%吐温20和3%牛血清白蛋白(BSA)).将兔抗HA单克隆抗体加入到PBST-BSA缓冲液中,并使用该方法捕获20分钟。2.0蛋白质检测系统,然后用PBST洗涤步骤(三次)。然后除了与鲁米诺反应的化学发光的二抗体之外,还在PBST-BSA中孵育膜。通过使用鲁米诺碱的化学发光在X射线膜上检测免疫反应带,随后光调节。
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。分析使用的是根据[疫霉parasitica基因组计划],[https://www.ncbi.nlm.nih.gov/assembly/?term=phytophthora%20parasitica[uniprot] [https://www.uniprot.org/].
缩写
- °C:
-
摄氏度
- 反哈:
-
anti-Hemagglutinin(抗体)
- μg:
-
微克
- μL:
-
微升
- μM:
-
微摩尔的
- CA2 +:
-
钙离子
- CBEL:
-
纤维素结合,激发子和凝集素活性
- CHvinca01.1:
-
疫霉parasitica隔离/基因组
- CJ01A1.1:
-
疫霉parasitica隔离/基因组
- CJ02B3.1:
-
疫霉parasitica隔离/基因组
- CJ05E6.1:
-
疫霉parasitica隔离/基因组
- CRN:
-
Crinkler家族的效力
- 轻拍:
-
3, 3 ' -diaminobenzidine
- 抑制:
-
有关分子模式
- 迪:
-
蛋白质crinkler的主题
- DTT:
-
DL-Dithiothreitol
- 设计水线:
-
蛋白质crinkler的主题
- EDTA:
-
乙二胺四乙酸
- ERF1:
-
乙烯反应因子1
- 等:
-
乙烯
- 美国教育考试服务中心:
-
效应触发的易感性
- 电动汽车:
-
空向量
- 弗兰克-威廉姆斯:
-
鲜重
- G:
-
克
- GV3101:
-
根癌土壤杆菌应变
- H:
-
小时
- H2O.2:
-
过氧化氢
- HPI:
-
小时后接种
- 人力资源:
-
超敏反应
- HVLVXXP:
-
蛋白质crinkler的主题
- IAC_01/95.1:
-
疫霉parasitica隔离/基因组
- INF-1:
-
elicitin 1植物嗜睡症infestans.
- inra - 310.3:
-
疫霉parasitica隔离/基因组
- 是:
-
贾斯莫酸盐
- KCL:
-
氯化钾
- KOH:
-
氢氧化钾
- 李:
-
升
- 磅:
-
Luria-Bertani中亮氨酸 - 丙氨酸 - 赖氨酸
- LFLAK:
-
lxlflak样图案
- 熏鲑鱼:
-
(蛋白编码),赖氨酸氧化酶
- LXLFLAK:
-
卷曲蛋白亮氨酸-任何氨基酸-苯丙氨酸基序
- Lylatk:
-
lxlflak样图案
- 市场经济地位:
-
MES中
- mg:
-
毫克
- mL:
-
毫克
- mM:
-
毫克分子
- MMA:
-
MMA媒介
- MPKs:
-
增殖蛋白激酶
- NaOH:
-
氢氧化钠
- 吴:
-
纳米图
- 不:
-
一氧化氮
- NPP-1:
-
坏死诱导疫霉蛋白1
- OD:
-
光密度
- P10297.1:
-
疫霉parasitica隔离/基因组
- P1569.1:
-
疫霉parasitica隔离/基因组
- P1976.1:
-
疫霉parasitica隔离/基因组
- PAMPS:
-
病原体相关的分子模式
- PB:
-
碱基对
- PBS:
-
磷酸盐缓冲盐水
- 纤毛运动:
-
程序性细胞死亡
- PG:
-
沙克
- pH值:
-
潜在的氢
- PICRN8:
-
Phytophthora Infestans.Crinkler第8号
- PN5B:
-
偶对名称(Phytophthora Nicotianae.5 b)
- PN6:
-
偶对名称(Phytophthora Nicotianae.6)
- PpCRN:
-
候选人削减者效果疫霉parasitica基因组
- PpCRN:
-
基因组中编码皱缩效应蛋白的基因P. Parasitica.
- PpCRN20:
-
疫霉parasiticaCrinkler效应蛋白8号
- PPCRN7:
-
疫霉parasiticaCrinkler效应蛋白7号
- PR1b:
-
病因相关蛋白1B
- PR2B.:
-
病因相关蛋白2b
- PRRs:
-
模式识别受体
- PsCRN115:
-
Phytophthora sojae.皱纹115号
- PsCRN63:
-
Phytophthora sojae.皱纹63号
- PTI:
-
Pattern-Triggered免疫力
- ROS:
-
反应性氧气
- 转:
-
每分钟轮换
- RT-QPCR:
-
定量逆转录聚合酶链反应
- RxLR:
-
RxLR家族的效应器
- S3A:
-
40S核糖体蛋白S3a
- SA:
-
水杨酸
- SDS:
-
十二烷基硫酸钠
- 哥伦比亚大学:
-
泛素缀合酶
- YEB:
-
酵母提取牛肉培养基
- μmol m−2 s−1:
-
微摩尔每秒和平方米
参考文献
- 1.
卵菌效应体如何干扰植物生命?植物营养与肥料学报。
- 2.
Birch PR, Rehmany AP, Pritchard L, Kamoun S, Beynon JL。贩运臂:卵菌效应器进入宿主植物细胞。趋势Microbiol。2006;14:8-11。
- 3.
Oliva R,Win J,Raffaele S,Butemy L,Bozkurt到等。丝状植物病原体效应生物学的最新发展。细胞微生物学。2010; 12:705-15。
- 4.
赫恩我,Gilroy Em,Armstrong Mr,Birch Pr。oomycete植物相互作用中的Zig-Zag-Zig。莫尔植物途径。2009; 10:547-62。
- 5。
Jones JDG,Dangl JL。植物免疫系统。自然。2006,[S.L.],v.444,n。7117,p.323-329。
- 6。
Lamour K. Kamoun S.多样性、互动和研究工具。新泽西州- John Wiley & Sons:卵菌遗传学和基因组学;1997.
- 7。
克鲁恩LP, Brouwer H, de Cock AW, Govers F.植物疫霉菌属2012。植物病理学2012,102-348-364。
- 8。
辣椒疫霉(Phytophthora capsici)是一种广泛寄主的卵菌。植物病理学杂志。2012。
- 9。
Luz E. Doenças causadas por疫霉没有巴西。Campinas: Editora Rural. 2001; 1:1-22。
- 10.
Graham,J,Feichtenberger,E.Citrus-phytophthora疾病:管理挑战和成功。柑橘病理学杂志。2015年,IOCV_JOURNALCITRUSPALLOCAL_27203。
- 11.
Dalio, RJD, Máximo, HJ, Oliveira, TS, Azevedo, TM, Felizatti, HL, Camopos, MA, Machado, MA的分子基础柑橘神奇磁化率和poncirus trifoliata电阻上疫霉parasitica攻击。植物与微生物的相互作用,2018,31,3,386-398。https://doi.org/10.1094/MPMI-05-17-0112-FI.
- 12.
Dalio, RJD, Magalhães, DM, Rodrigues, CM, Arena, GD, Oliveira, TS, Souza- neto, RR, Picchi, SC, Martins, PMM, Santos, PJC, Maximo, HJ, Pacheco, IS, De Souza, AA, Machado, MA。柑橘与病原菌相互作用相关的PAMPs、PRRs、效应子和r -基因,植物学报,2017,第119卷,第5期,1页749-774,https://doi.org/10.1093/aob/mcw238.
- 13.
Kamouns.植物致病症症的效应症的目录。Annu Rev phytopathol。2006; 44:41-60。
- 14.
范德胡恩,陈志刚,陈志刚。植物相关生物效应生物学的新概念。植物与微生物互动学报2009;22:115-22。
- 15.
Haas BJ, Kamoun S, Zody MC, Jiang RH, Handsaker RE, Cano LM, Grabherr M, Kodira CD, Raffaele S, Torto-Alalibo T,等。爱尔兰马铃薯饥荒病原菌的基因组序列与分析Phytophthora Infestans..大自然。2009;461:393-8。
- 16。
Tyler B,Tripathy S,Zhang X,Dehal P,Jiang R等。疫霉基因组序列揭示进化起源和发病机制。科学。2006; 313:1261-6。
- 17。
植物致病性卵菌的RXLR效应。微生物学报。2007;10:332-8。
- 18。
CRN蛋白在基因组学时代的发展前景:进化,分类。运输和功能再访前沿植物科学。2017;8:99。https://doi.org/10.3389/fpls.2017.00099.
- 19。
张明霞,刘太林,徐静,刘玲,等。大豆疫霉效应体PsCRN70抑制植物防御烟草benthamiana.《公共科学图书馆•综合》。2014;9:e98114。
- 20.
张明霞,Rajput NA,沈大勇,孙鹏,曾文涛,刘天涛,等。一个Phytophthora sojae.细胞质效应子介导抗病性和非生物胁迫耐受性烟草benthamiana.Sci众议员2015;5:10837。
- 21.
MáximoHJ,Dalio RJD,Rodrigues CM,Breton MC,Machado Ma。RT-QPCR分析的参考基因柑橘类和Poncirus.被动物孢子感染了疫霉parasitica.热带植物病理学。2017; 42:76。
- 22.
Dalio, RJD, Máximo, HJ, Oliveira, TS, Dias, RO, Breton, MC, Felizatti, HL, Machado, MA。植物疫霉菌效应体PpRxLR2抑制烟草benthamiana免疫力。植物与微生物的相互作用,2018,31,4,481 - 493。https://doi.org/10.1094/mpmi-07-17-0158-fi..
- 23.
Kamouns,Van West P,Vleeshouwers Vgaa,De Grootke,Gove F.抵抗烟草benthamiana来Phytophthora Infestans.是由诱导子蛋白INF1在植物细胞中的识别介导的。卷。1998;10:1413-25。
- 24.
种群遗传学疫霉.植物病理学。1997年; 87:462-73。18945128.
- 25.
Raffaele S,Sophien K.基因组进化在丝状植物病原体:为什么要更好的可能更好。NAT Rev Microbiol。2012年; 10:417-30。
- 26.
安德森jp,gleason ca,foley rc,thrall ph,burdon jb,singh kb。植物与病原体:进化的军备竞赛。Funct植物Biol。2010; 37:499-512。
- 27.
Cline ET, Farr DF, Rossman AY。的剧情简介疫霉准确的科学名称、宿主范围和地理分布。植物健康进展,2008。https://doi.org/10.1094/php-20080318-01-rs。
- 28.
等。单核基因组测序显示内生菌根真菌的核高度相似。公共科学图书馆麝猫。2014;10:1-13。
- 29.
植物疫霉菌CRN效应子的鉴定与鉴定Capsici.显示模块化和功能多样性。Plos一个。2013,8:E59517。
- 30.
Sun G,Yang Z,Kosch T,夏天K,黄杰。致病性Chytrids中获取毒力效应的证据。BMC EVOL BIOL。2011; 11:195。
- 31.
Kemen E,Gardiner A,Schultz-Larsen T,Kemen Ac,Balmuth al,Robert-Seilaniantz A,Bailey K,Holub E,Studholme DJ,Maclane D,Jones JDG。在白色生锈病原体中的迫使寄生寄生过程中的基因增益和损失拟南芥.公共科学图书馆杂志。2011;9:e1001094。
- 32.
链接MG, Holub E, Jiang RHY, Sharpe AG, Hegedus D, Beynon E, Sillito D, Clarke WE, Uzuhashi S, Borhan MH. De novo序列组装角膜白斑假丝酵母揭示了一个相对于其他生物营养卵菌的小基因组。BMC基因组学。2011;12:503。
- 33.
Levesque Ca,Brouwer H,Cano L,Hamilton JP,Holt C,Huitema E,Raffaele S,Rocideau GP,Thines M,Win J等人。病原体病原体的基因组序列茄子Ultimum.揭示原始致病机制和效应剧目。基因组医学杂志。2010;11:pR73。
- 34.
Baxter L, Tripathy S, Ishaque N, Boot N, Cabral A, Kemen E, Thines M, Ah-Fong A, Anderson R, Badejoko W,等。生物营养适应的特征Hyaloperonospora arabidopsidis基因组。科学。2010;330:1549-51。
- 35.
高林等。纤维素结合域疫霉细胞壁蛋白质是新的病原体相关分子模式。植物细胞。2006; 18:1766-77。
- 36.
Schornack, S, van Damme, M, Bozkurt, T. O, Cano, L. M,吸烟者,M, Thines, M,等。易位卵菌效应体的远古类群以寄主细胞核为目标。Proc。国家的。学会科学。美国2010,107,17421-17426。
- 37.
刘t,ye w,ru y,yang x,gu b,tao k等。发病机制需要两种宿主细胞质效应器Phytophthora sojae.通过抑制宿主防御。植物理性。2011; 155:490-501。
- 38.
张MX,李琦,刘TL,刘L,沉d,朱y等。两种细胞质效应Phytophthora sojae.通过与植物催化剂的相互作用调节植物细胞死亡。植物理性。2015; 167:164-75。
- 39.
沉dy,刘tl,ye ww,liu l,liu ph,wu yr等。基因复制和片段重组驱动植物中植物中细胞质效应的超家族的重组驱动功能多样化。Plos一个。2013; 8:E70036。
- 40。
STAM R,Howden AJM,Delgado-Cerezo M,Amaro TMMM,Motion GB,PHAM J等。细胞死亡诱导的特征疫霉capsiciCRN效应表明宿主细胞核中有多种活动。植物学报2013;4:387。
- 41.
拟南芥卵菌对拟南芥根渗透的转录组动态疫霉parasitica.BMC基因组学。2014;15:538。
- 42.
Boava LP, Cristofani-Yaly M, Mafra VS, Kubo K, Kishi LT, Takita MA, Ribeiro-Alves M, Machado MA。整体基因表达Poncirus trifoliata citrus sunki及其在植物感染的杂种中植物对普罗西肝炎。BMC基因组学。2011; 12:39。
- 43.
Evangelisti E, Govetto B, Minet-Kebdani N, Kuhn ML, Attard A, Ponchet M, Panabieres F, Gourgues M. The疫霉parasiticaRXLR效应体穿透特异性效应体1通过干扰生长素生理而有利于拟南芥侵染。新植物学家。2013; 199:476 - 89。
- 44.
Raffaele S, Win J, Cano LM, Kamoun S.基因组结构和基因表达的分析揭示了新的候选毒力因子的分泌组Phytophthora Infestans..BMC基因组学。2010;11:637。https://doi.org/10.1186/1471-2164-11-637.
- 45.
张志强,魏勇,张志强。H2O.2在植物。H2O.2大麦与白粉病互作过程中乳突的积累和超敏反应。植物j . 1997; 11:1187 - 94。
- 46.
陈志强,陈志强,陈志强,等。过氧化氢在植物体内的积累Medicago Truncatula.由丛枝菌根形成真菌Glomus Morraycare殖民的根。Planta。1999; 208:319-25。
- 47.
IPPolito A,Schena L,Nigro F.检测Phytophthora Nicotianae.和p橼在柑橘根系和土壤中进行巢式PCR检测。acta botanica sinica(云南植物学报),2002;
- 48.
Kruskal HW,Wallis Aw。在一个标准方差分析中使用等级。J AM Stat Assoc。1952; 47(260):583-621。
- 49.
鲍尔DF。使用等级统计构造置信集。J Am Stat Assoc. 1972; 67:687-90。
确认
我们感谢MSC。Tiago Silva Oliveira和Dra。MichèleClaireBreton提供改进文本的评论。这项工作是HerosJoséMáximoPH.D的一部分。巴西国家坎帕纳州立大学功能与分子生物学系论文。
资金
本研究由Fundação de Amparo a Pesquisa no Estado de São Paulo (FAPESP 2015/14498-6)、Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq 445390/2014-0和465440/2014-2)和Fundação Nacional de Desenvolvimento de Ensino Superior Particular (FUNADESP 8800105/2018-0005-R172)资助。资助机构的作用是提供财政支持。资助方在研究设计、数据收集和分析、决定发表或手稿准备方面没有作用。
作者信息
从属关系
贡献
HJM贡献在所有生物测定,植物感染和农业渗透测定,鉴定和注释P. Parasitica.候选人CRN效应基因,基因组结构P. Parasitica.质粒设计和农业转化,活性氧的检测,P. Parasitica.在植物,蛋白质提取和蛋白质印迹分析中接种和定量,统计分析。RJDD有助于共同监督和建设研究,实验设计,质粒设计和农业转化,P. Parasitica.植物接种和定量,蛋白提取和western blot分析。ROD在识别和注释P. Parasitica.候选CRN效应基因和基因组结构P. Parasitica..HLF在采用统计模型和数据汇编的设计和统计分析中做出了有效的贡献。MAM在研究和试验设计的监督和建设中做出了有效的贡献。MAM, CGL, ROD, RJDD和HJM分析数据并撰写手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
“不适用”。
同意出版
“不适用”。
相互竞争的利益
所有作者声明,他们没有相互竞争的利益,不会干扰对分析和解释本研究结果的判断。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Maximo, h.j., Dalio, r.j.d., Dias, R.O.等等。PPCRN7和PPCRN20诱发parasitica调节植物细胞死亡,增强宿主的易感性。BMC植物BIOL.19,544(2019)。https://doi.org/10.1186/s12870-019-2129-8
收到了:
公认:
发表:
关键词
- Crinkler效果
- 血管营养
- 卵菌纲
- 柑橘类
- 过敏反应
- 毒性