- 研究文章
- 开放访问
- 发布:
GmWRKY40, WRKY转录因子基因的一个成员甘氨酸最大增强了对细菌的抗性Phytophthora sojae.
BMC植物生物学体积19.文章编号:598(2019年)
摘要
背景
WRKY蛋白是转录因子的一个超家族,其成员在植物生长、发育、衰老以及对生物和非生物胁迫的响应等多种生理过程的调节中发挥着重要作用。然而,相对于模式植物的研究进展,大多数WRKY家族成员在大豆中的生物学作用仍然知之甚少。
结果
在这项研究中,我们确定和特点GmWRKY40,这是一组的IIc怀疑基因。瞬时表达分析显示Gmwrky40蛋白位于植物细胞的核中。表达式GmWRKY40在感染后大豆强烈诱导Phytophthora sojae.或用茉莉酸甲酯,乙烯,水杨酸和脱落酸处理。此外,大豆毛的根沉默GmWRKY40增强的易感性P. sojae.与空载体转基因根感染相比。此外,抑制GmWRKY40减少活性氧(ROS)和几种氧化相关的基因修饰表达的积累。酵母双杂交实验中与RNA-SEQ分析相结合表明GmWRKY40相互作用与8个JAZ蛋白质具有或不GmWRKY40的WRKY结构域或锌指域,这表明有这些发生相互作用的蛋白之间不同的交互模式。
结论
总的来说,这些结果表明,GmWRKY40在大豆植物应答中起正调节作用P. sojae.通过调节过氧化氢积累和JA信号通路。
背景
疫霉属卵菌,对许多重要作物造成毁灭性的疾病。例如,病原体晚疫病负责在爱尔兰的土豆爆发的毁灭性爆发[1].Phytophthora sojae.是大豆第二大破坏性病原体,可导致疫霉根腐病和茎腐病(PRR),每年在全球造成约10-20亿美元的损失[2].P. sojae.广泛存在于所有主要大豆种植区。在高度敏感品种中,PRR会造成作物的全部损失。抗病育种是卵菌病害防治的主要策略。目前,PRR的管理主要基于宿主介导的耐药性(R.)基因。在大豆-P. sojae.病理系统,已经描述了阻力类型,包括由单一主导控制的种族特异性电阻rps.(抗P. sojae.)基因及由多基因提供的部分抗性[3.那4.].在大豆、33rps.已经鉴定并映射到八种染色体[5.那6.那7.那8.那9.].他们之中,rps1a.那rps1c.那RPS1K.那Rps3a那Rps6, 和Rps7已相继渗入商业领域[10.那11.].但是,在普遍存在的病原体感染后,将克服抗性基因,因此,它们的有效性通常是瞬态的[12.].偏离抗性不同rps.介导的阻力,它由位于多个基因座多基因控制,并且每个基因贡献了中等程度的影响[13.那14.].它已经显示,大豆的部分抗性可有效对抗多种致病型的P. sojae.[15.那16.].对这一病理系统机制的研究为其参与提供了证据R.防御信号途径的基因和组成部分[17.那18.那19.].Schneider等通过GWA分析识别候选基因和一致qtl,探讨部分抗性的机制假说,为减弱等不同假说提供证据R.基因反应和一些基因参与基础防御和信号通路[20.].使用RNAi方法,大豆GMSGT1.被鉴定为对部分抗性有积极贡献,并且对大豆的需求不同rps1a.那rps1c.那rps1d.那RPS1K.介导的疾病抵抗[21.].基因工程通过表达已知的防御信号传导途径的抗微生物组分,有可能对植物进行耐用和广谱抗性[22.].迄今为止,已经进行了研究以提高大豆抗性P. sojae.表达赋予对真菌病原体抗性的外源基因感染。大豆对凋亡死亡的后卫1(爸..),这可能参与内质网胁迫信号通路,在防御方面发挥着关键作用疫霉病原体[23.].含大豆新型BTB / POZ域的核蛋白质GMBTB / POZ在大豆反应中起着积极作用P. sojae.[24.].碱性螺旋 - 环 - 螺旋(bHLH)转录因子GmPIB1,其抑制表达GMSPOD1.通过直接与其启动子结合,增强大豆的抗病性P. sojae.[25.].过表达乙烯反应因子GmERF5和GmERF113提高了大豆的抗性P. sojae.并积极调节发病性相关基因的表达[26.那27.].
基因表达的转录调节主要是介导的反式-作用序列特异性DNA结合TFs特异性识别独联体-作用启动子元件[28.那29.].含有WRKY结构域的DNA结合蛋白是与植物防御反应相关的几个转录因子家族之一[30.那31.].wrky tfs存在一个或两个保守的包围结构域,其中约60个氨基酸,这些域,然后是cys2他的2或cys.2HisCys锌指motif [32.].在植物 - 病原体相互作用,转录因子WRKY涉及的植物防御机制(PTI和ETI)调节通过识别和结合于W-箱或W形箱式独联体元素或其他独联体在一些基因的启动子区域的元件[33.那34.].如拟南芥WRKY18,WRKY33和WRKY40绑定到W-BOX [TTGAC(C / T)]初期触发疫苗期间的图案[35.];OsWRKY51结合到独联体-Element W-Box和Dement基因启动子的WLE1 [(T)TGACA]OSPR10A,增强植物抵抗力XOO通过激活该基因的表达[36.].第一WRKY蛋白SPF1从甘薯于1994年克隆,到目前为止,有越来越多的WRKY基因已在各种植物物种鉴定,例如在至少72个成员拟南芥蒂利亚纳[31., 109 in rice [37.]和182大豆[38.].函数丧失和职能性研究已经证明,腕式转录因子在复杂的信号网络中起作用,因为疾病抵抗的正负调节器[31.那39.那40].大量研究表明,WRKY转录因子在植物对各种病原菌感染的防御反应中具有调节作用。例如,在拟南芥,过度的ATWRKY18.和Atwrky70.导致增加抵抗力两和增强的SA响应与发病机理相关(PR)基因[表达式39.那41.].此外,拟南芥Wrky33对防御至关重要葡萄孢菌并且参与SA信号传导,乙烯-JA介导的交叉通信和Camalexin生物合成的基因被鉴定为ATRWKY33的直接靶标[42.].在水稻中,过表达OsWRKY45导致增强的抗性Magnaporthe Grisea., 和OsWRKY45被认为在苯并噻二唑诱导和sa介导的水稻防御信号传导中发挥重要作用[43.].过度表达OsWRKY6在拟南芥表现出对Xanthomonas oryzae.通过诱导防御相关基因,如PR1那PDF1那NPR4和葡聚糖酶[44.].过度的胡椒CaWRKY40在烟草中增强了抗性Ralstonia solanacearum.并修改超敏反应(HR)相关及致病相关基因的表达[45.].属世纪疫霉是对农业和食品生产的最严重威胁,导致数百种植物主持人的毁灭性疾病[46.].最近WRKY转录因子参与了植物-疫霉进一步研究了相互作用。Adachi等。鉴定出通过MAPK磷酸化的Wrky TFS在RBOHB依赖性的ROS爆发和细胞死亡介导的免疫力中起重要作用晚疫病在尼古利亚娜·宾夕法尼亚州[47.].土豆StWRKY8积极规范拟南芥抵抗力P. Infestans.通过与苄基异喹啉生物碱的启动子相互作用生物合成基因[48.].在茄属植物pimpinellifolium,八个WRKY转录因子在被确定S. pimpinellifolium-p。infestans.相互作用和转基因番茄过表达SPWRKY3.表现出显着的抵抗力P. Infestans.[49.].过度表达SPWRKY1.在烟草赋予抵抗力p . nicotianae感染 [50.].
大豆(甘氨酸最大(L.)大豆 - )是一种豆科作物与世界各地的伟大的经济和农业的重要性。迄今为止,只有WRKY转录因子在大豆少数已经被克隆和功能特点。WRKY转录因子在非生物胁迫应答和大豆生长和发育中的作用已被确定。过度表达gmwrky21或者GmWRKY54增强冷,盐和耐旱性拟南芥蒂利亚纳而过表达时,对盐和甘露醇胁迫更敏感GmWRKY13[51.].病毒诱导的沉默GmWRKY58或者gmwrky76导致叶片膨胀和茎秆终止的降低[52.].相关的蛋白质Gmwrp1不仅在豆科植物共生中起重要作用,而且在豆科植物的生长和发展中也很重要[53.].然而,只有少数被描述为生物应激反应。据报道,过度表达GmWRKY31增强以抵抗P. sojae.,而沉默相同基因易感性增强[54.].在本研究中GmWRKY40,分析了推定的组IIC Wrky基因,并分析了响应于不同应激条件的基因表达模式。转基因大豆毛的根沉默GmWRKY40增加了易感性P. sojae..此外,在观察到ROS水平较低GmWRKY40-进一步的分析表明,GmWRKY40与JAZ蛋白发生物理相互作用。这些结果表明GmWRKY40大豆响应的功能P. sojae.通过调制ROS累积或JA信号通路,并且是大豆的必要组分疫霉病原体。
结果
GmWRKY40基因的鉴定与序列分析
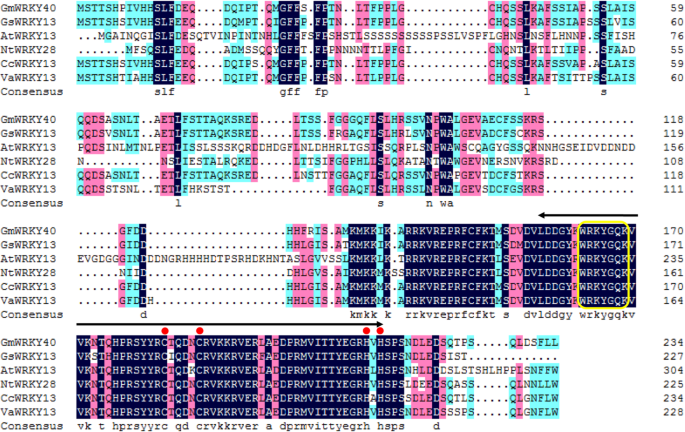
在之前的研究中,我们筛选了对P. sojae.根据Subramanian等人的方法,在大豆子叶中使用RNA沉默进行感染[55.]和yan等人。[21.].其中,沉默GmWRKY40在大豆子叶中表现出更强的易感性P. sojae..此外,GmWRKY40在感染后大豆的叶子上调P. sojae.(无花果。3.一个),GmWRKY40因此选择进一步分析其作用的作用P. sojae..GmWRKY40位于8号染色体,与指定的轨迹数Glyma.08G143400。GmWRKY40cDNA是1296 bp,具有708bp开放阅读框(ORF),编码具有235个氨基酸的蛋白质。蛋白质结构分析显示,Gmwrky40 Harbors由保守的氨基酸序列(Wrkygqk)和锌手指基序(C-X)组成的近似的60-氨基酸扭转结构域(C-x4-5-C-X.月22日至23日-H-X1-h),表明Gmwrky40属于Wrky家族的群体[32.].BLASTP分析显示,Gmwrky40的氨基酸序列与推定的腕骨转录因子13(KHN34020.1)具有90%的序列同一性甘氨酸突变和可能的Wrky转录因子13(XP_020215926.1)来自Cajanus毛竹,与可能的WRKY转录因子13 (XP_017432586.1)序列同源83%Vigna Angularis.与来自可能WRKY转录因子28(XP_016452899.1)的62%的序列同一性尼科尼亚塔哈瓦姆和来自WRKY13(NP_195651.1)的49%的序列同一性拟南芥蒂利亚纳(无花果。1).这些结果表明GmWRKY40在豆科植物中高度保守。
GmWRKY40的亚细胞定位
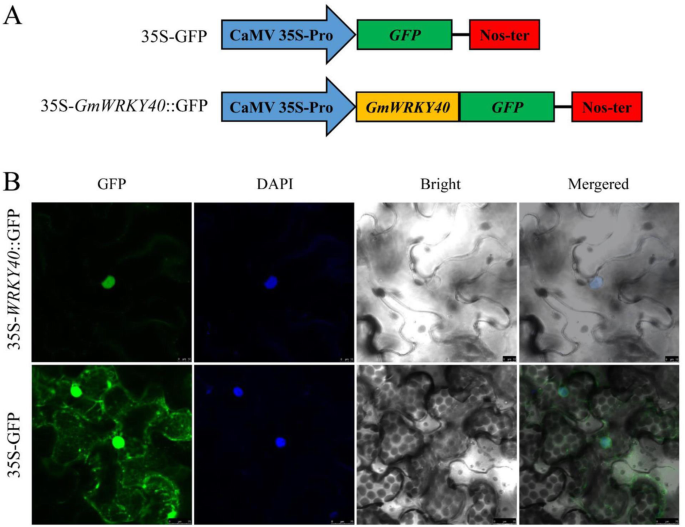
为了确定其核定位,生成了结构体,其中的完整ORFGmWRKY40在结构控制下与绿色荧光蛋白(GFP)在框架内融合Camv 35s.启动子,p35S-GFP作为阴性对照(图。2一种)。通过共聚焦显微镜观察用DAPI染色的荧光来检测细胞核。典型的结果表明,GFP荧光和DAPI染色主要定位于细胞核表达35 s-gmwrky40:: GFP,而这件事35S-GFP控制在核和细胞质中表现出荧光(图。2b).这提示GmWRKY40蛋白定位于细胞核内,这一定位可能有助于我们探索该蛋白的功能。
的反应GmWRKY40转录到P. sojae.感染和各种外源性植物激素
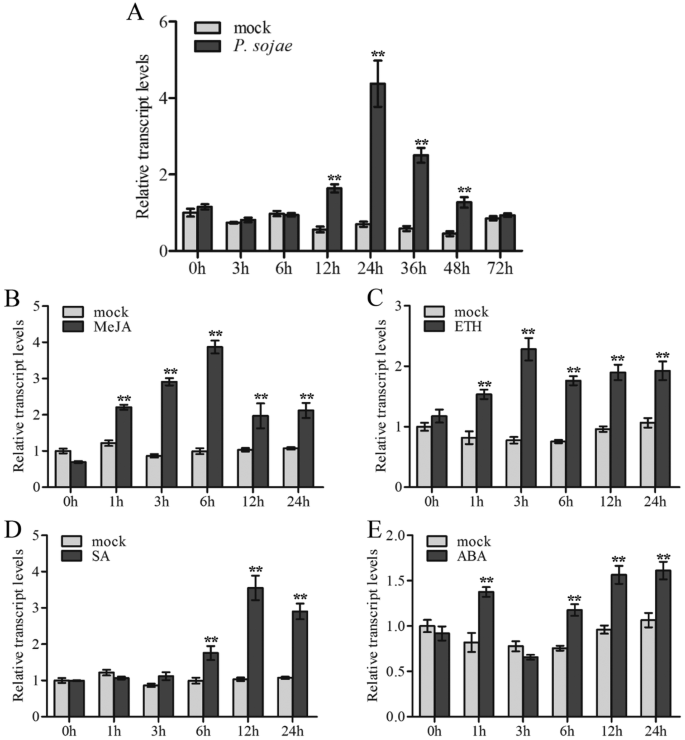
检验…的影响GmWRKY40在对病原体防御的反应中GmWRKY40在大豆的响应树叶感染P. sojae.,通过定量实时PCR确定(图。3.一种)。与模拟相比,GmWRKY40在接种后12-48小时的叶子上调节转录物P. sojae.,并在24小时达到峰值。的感应GmWRKY40笔录显示GmWRKY40可在植物抗性的重要作用,卵菌病原体。
植物激素等甲基己酸酯(MEJA),乙烯(Eth),水杨酸(SA)和脱落酸(ABA),作为对植物防御反应调控的重要信号分子,并在调解中发挥重要作用表达下游防御相关基因[56.].评估…的可能作用GmWRKY40在这些激素所利用的信号级联中,GmWRKY40转录水平通过qRT-PCR与茉莉酸甲酯,ETH,SA和ABA处理7日龄大豆根监测。如图1所示。3.B-e,100μmmeja治疗后,GmWRKY40表达在1小时内增加到后处理后,峰值为6小时(3.9倍)。应对2毫米的乙烯,GmWRKY40从1 h到24 h,转录水平显著升高。的表达GmWRKY406岁时明显诱导 h五点后 mM SA治疗,在12岁时接近最高水平(与模拟相比为3.4倍) h、 50岁以下 mM-ABA处理后,表达GmWRKY40在1小时内显着增加,并在3小时内降低到模拟处理水平,然后高度诱导约6h-24小时。这些结果表明GmWRKY40可以参与通过植物激素信号传导途径的病原体反应。
抑制GmWRKY40提高大豆易感性P. sojae.
为了评估生物学功能GmWRKY40那GmWRKY40在大豆毛的根部沉默,以测试对抗性的影响。分离具有GFP荧光的毛状根,用于测定(附加文件1:图S1A)。为了验证沉默效果,我们进行了实时荧光定量PCR,结果显示RNAi-显著降低GmWRKY40荧光根部与RNAi空载体控制根(附加文件)相比1:图S1B)。
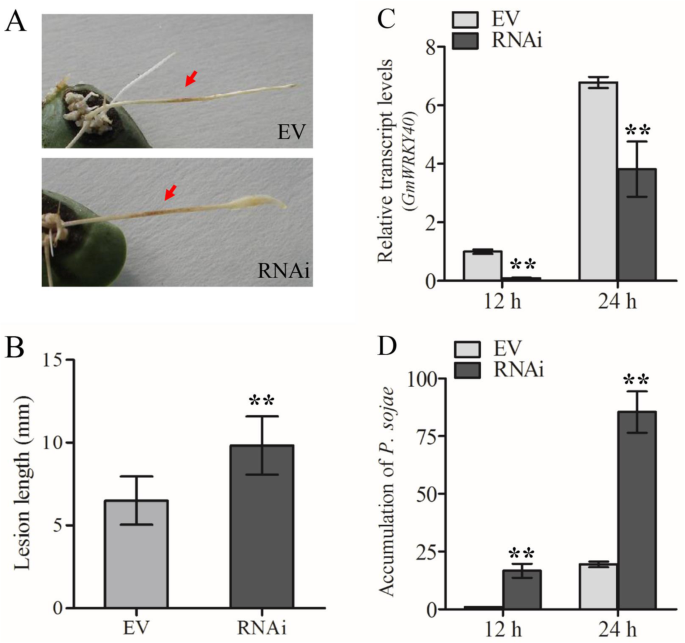
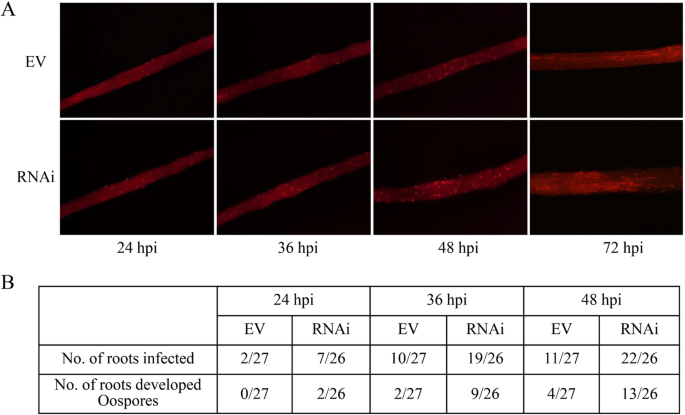
调查是否GmWRKY40参与大豆的阻力P. sojae.,表达RNAi-的转基因根GmWRKY40或RNAi空载体感染P. sojae..威廉姆斯82根表达的RNAi空载体表现出略微坏死HR损伤,而RNAi-的感染GmWRKY40根导致更严重的扩展病变(图。4.A-B)。
转基因大豆毛状根GmWRKY40沉默增强了对大豆毛状根的敏感性Phytophthora sojae..一种疾病表型GmWRKY40-RNAI威廉姆斯82用P6497接种后36小时的毛状根和控制。B.P6497感染毛茸茸根的病变长度。病变长度36 HPI。C相关的表达GmWRKY40was determined by qPCR at 12 and 24 hpi inGmWRKY40沉默或ev毛茸茸的根源(D.)P. sojae.在12和24 HPI时通过QPCR测定生物质GmWRKY40沉默或ev毛茸茸的根。实验全部重复三次,以及生物实验的至少三次独立重复。错误栏表示标准错误。星号表示统计上显着的差异(**P.< 0.01)
进一步分析的影响GmWRKY40将转基因大豆的根接种游动孢子悬浮液,以提高大豆的抗病能力P. sojae.菌株P6497R,其组成型表达红色荧光蛋白(RFP)。The number of roots that supported hyphae invading into root epidermis and oospore germination and extension at the inoculated area were counted at 24, 36 and 48 h post-inoculation, according to Wong et al. [57.].显然更多的接种rnai-GmWRKY40与表达RNAi空载体的根,允许剪切杂环侵入和Oospore开发,表达RNAi空载体指示RNAi-GmWRKY40根表现出超级易感性P. sojae.(无花果。5.).我们还确定了P. sojae.通过定量实时PCR使用特异于高度保守的重复序列的原始实时PCR的生物质积累P. sojae.基因组。RNAi-GmWRKY40转基因根表现出更高的生长速率P. sojae.用的RNAi空载体(图相比生物量。4.光盘)。这些结果表明GmWRKY40作为一个正稳压器在大豆抗性中起着枢轴作用P. sojae..
抑制GmWRKY40降低了ROS的积累
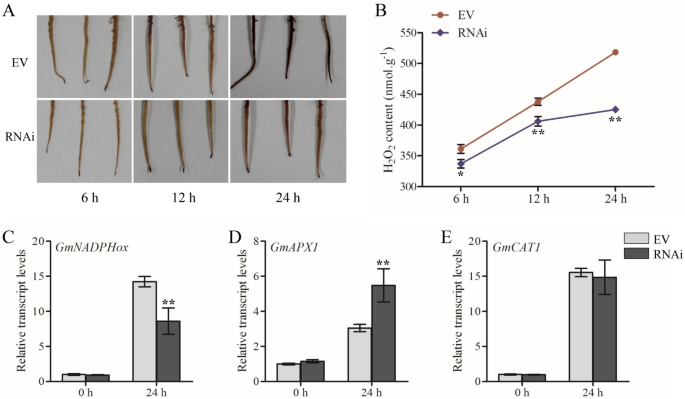
活性氧(ROS)作为信号分子在植物防御中发挥重要作用[58.].检查活性氧的积累是否与对P. sojae.在大豆的中,我们检测到H的积累2O.2在RNAi-GmWRKY40转基因根和RNAi空载体根P. sojae.,表现出显着降低的2O.2在RNAi-检测生产GmWRKY40相对于RNAi空向量根(图。6.b)。在RNAi-上染色的3,3'-二氨基苯胺(DAB)染色GmWRKY40转基因后根P. sojae.感染表现出较少棕色相对于空载体的根(图6.一个),这与上述测得的结果相一致。
探索减少H的潜在机制2O.2在抗病过程中,在转基因根中氧化相关基因的表达GmWRKY40分析转基因和对照根的反应P. sojae..如图1所示。6.C-E,转录水平NADPHOX.(NADPH氧化酶,H2O.2合成相关基因)[59.],APX1(抗坏血酸过氧化物酶1)和CAT1(过氧化氢酶1)(ROS清除相关基因)[60.那61.]是不是在RNAi-显著不同GmWRKY40转基因根前P. sojae.感染与对照根相比,表明GmWRKY40没有参加h的积累2O.2在正常情况下。接种后,表达gmnadphox.在RNAi-GmWRKY40转基因根显着低于对照根,否则的表达GMAPX1与H.相关2O.2清除是显著上调的,这表明GmWRKY40参加了H的积累2O.2在P. sojae.激活h感染2O.2合成途径及H抑制2O.2扫除。
GmWRKY40与JAZ蛋白相互作用
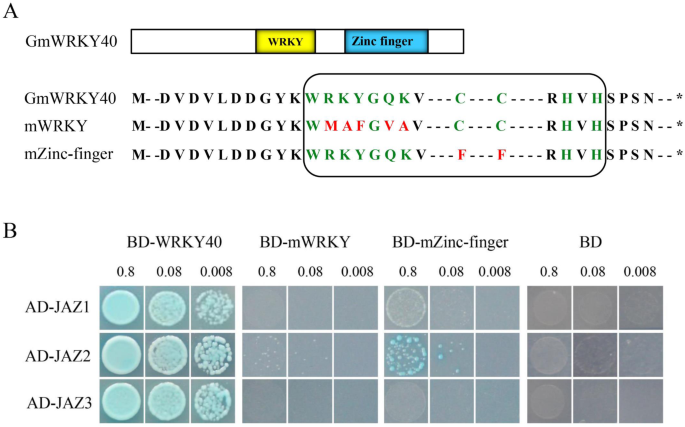
增加的证据表明wrky蛋白质通过与其他交流剂形成蛋白质复合物[33.].为了确定与GmWRKY40相互作用的蛋白,我们进行了酵母双杂交筛选,以确定与GmWRKY40相互作用的伴侣。候选相互作用体中有3个JAZ蛋白(jaz1 - glyma . 07g04140.1, jaz2 - glyma . 01g20440.1, jaz3 - glyma . 09g07160.1)(这里我们临时指定为JAZ1-JAZ8,包括下面提到的5个JAZ蛋白)。为了确定它们在酵母中的相互作用,将8个蛋白的开放阅读框序列与pGADT7载体的激活域(AD)融合,并与GmWRKY40进行进一步的互作实验。如图1所示。7.B,Gmwrky40与三个Jaz蛋白质强烈互动:Jaz1,Jaz2和Jaz3。为了进一步检查Gmwrky40蛋白的哪个域对与Jaz1,Jaz2或Jaz3的相互作用至关重要,使用含有腕部突变体或锌 - 手指结构域突变体的PGBKT7载体(图。7.a).结果表明,JAZ2与锌指结构域突变蛋白表现出弱互作,JAZ1和JAZ3与WRKY结构域突变蛋白和锌指结构域突变蛋白均无互作(图2)。7.b)。
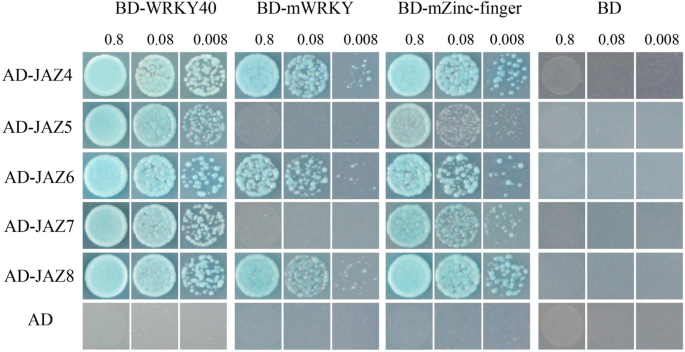
为进一步深入了解中降低阻力的潜在机制GmWRKY40-RNAi转基因大豆根,空载体对照和转基因根与接种之间的基因表达P. sojae.用RNA测序法测定和比较。我们检测到多个差异表达的应激相关基因,包括jaz.基因,ERF基因,过氧化物酶的基因,转录因子,和抗病性反应性基因(附加文件2:表S1)。值得注意的是8 jaz蛋白质(表1)被诱发GmWRKY40- 感染后的-rnai转基因大豆根P. sojae.,包括以前测试的三种蛋白质与Gmwrky40相互作用(图。7.b)。我们进一步研究了GmWRKY40其他5 JAZ蛋白质的相互作用,其结果是它们与GmWRKY40要么(图交互。8.).5个JAZ蛋白与GmWRKY40结构域突变的互作结果如图所示。8..GmWrky40的Wrky域是与Jaz5(Glyma.16G010000.1)和JAZ7(Glyma.15G179600.1)的交互的必要条件。Jaz4(Glyma.13G112000.1),Jaz6(Glyma.11g038600.1)和Jaz8(Glyma.17G047700.1)与Wrky域突变蛋白或锌 - 手指结构域突变蛋白表现出相互作用。结果表明,当GmWrky40与不同的Jaz蛋白相互作用时,存在不同的相互作用模式。
讨论
在植物对各种应力的反应中,激活了一些转录因子,然后随后进行了许多防御相关基因进行转录调节,这些变化对于建立的防御机制是必不可少的。基因在植物暴露于病原体攻击时对转录表达的协调变化进行了反应,然后导致细胞和生理重编程和对病原体感染的抵抗力增加[62.].大量的基因表达变化由各种TFS调节。大量的证据表明,Wrky TFS在植物对病原体感染的植物反应中发挥重要作用[33.].
在这项研究中,我们对大豆进行了功能分析WRKY40该基因已被证明能提高大豆对小麦的抗性P. sojae..据报道,WRKY转录因子在许多植物中响应生物胁迫,包括拟南芥[42.那63.], 白饭 [64.那65.],大麦[66.], 棉布 [67.], 胡椒 [40]和烟草[47.那68.],等等。据我们所知,有几个WRKY转录因子在功能上证明了大豆病原体相互作用。利用病毒诱导的基因沉默,潘迪AK等人。识别3个WRKY基因(GmWRKY36那GmWRKY40, 和WRKY45)发挥作用RPP2.- 呈现抗性Phakopsora pachyrhizi.[69.].对大豆WRKY家族进行了全基因组注释,鉴定出75个基因参与了大豆对WRKY的响应豆薯层锈菌基于转录调节的感染[38.].GmWRKY30和gmwrky6.在大豆中发挥作用Rsv1的极端抵抗大豆花叶病毒[70].Wrky转录因子反应的功能P. sojae.在大豆中也进行了表征。过表达和RNA干扰分析证实了这一点GmWRKY31增强以抵抗P. sojae.[54.].Lin等人进行了比较转录组分析,以描述与耐药性相关的基因和推定调控网络的多个分支P. sojae.在10个大豆NILs中,很明显,一些属于WRKY家族的基因在防御信号转导中发挥了关键作用[71].我们的调查表明,GmWRKY40是引起的P. sojae.感染(图。3.a),表明其潜在参与调制P. sojae..转基因根,其呈现降低的转录物GmWRKY40,表现出高度易感性P. sojae.(图。4.和5.).在这个实验中,我们也使用威廉姆斯(缺乏任何知名rps.基因)来检查GmWRKY40涉及到基础抗性P. sojae..结果表明,更严重的延伸病变和更大P. sojae.在RNAi-中测定生物质积累GmWRKY40与接种后的RNAi空载体根相比P. sojae.(附加文件1:图S2)。结果表明GmWRKY40需要大豆响应于P. sojae..此外,关于大豆BHLH转录因子GMPIB1的研究显示过表达转基因威廉姆斯(rps.)毛状根增强了抵抗力P. sojae., 尽管GMPIB1-RNAi转基因' L77-1863 ' (rps.1B)毛状根表现出更多易感性[25.].在大米中,过度表达oswrky62.减少基础防御和Xa21基因介导的抗性XOO,提示OsWRKY62作为负调控因子XOO在水稻[72].在这里,我们的结果表明GmWRKY40担任大豆的到防御反应的正调节P. sojae..
植物激素JA、SA、ET和ABA是参与植物对病原菌感染应答的重要信号分子[73].WRKY转录因子被发现是多种激素信号通路中的关键成分[42.那74].例如,WRKY70.充当的SA-诱导的基因的活化剂和JA-应答基因的阻遏,表明WRKY70.收敛过程中植物防御响应整合SA和JA信号[的一个重要节点41.].ATWRKY8.参与对TMV-cg的防御反应,通过直接调控ABI4那ACS6., 和ERF104.在TMV-CG和TMV-CG之间的相互作用期间介导ABA和乙烯信号之间的串扰。拟南芥[75].我们现在的研究表明,水平GmWRKY40mRNA转录通过了显著诱导P. sojae.和各种激素信号分子的压力(图。3.)此外,我们分析了SA信号通路相关基因的表达水平,包括GMNPR1那gmpr1a.和GmPR5.据透露GmWRKY40沉默导致了显著的下降GMNPR1那gmpr1a.和GmPR5与对照组比较P. sojae.(附加文件1:图S3)。我们推断GmWRKY40可能会参与大豆防御反应P. sojae.通过感染植物激素介导的信号传导途径。
ROS网络在对植物抗性对病原体的信号转导中起重要作用[58.那76].在感染病原体的植物中迅速产生ROS,然后防止病原体进入细胞或抗性基因诱导抑制病原体生长[77那78].在植物病原体相互作用,WRKYs发挥无论是在ROS爆发或ROS清除至关重要的作用。以前的工作表现为通过MAPK磷酸该WRKYs是由NADPH氧化酶的激活需要的植物免疫ROS爆发N. Benthamiana.[47.].在我们的调查中,降低^ h2O.2积累在RNAi-的转基因根观察GmWRKY40与接种后的对照根相比P. sojae.(无花果。6.A-B)。转录水平gmnadphox.,与h相关联2O.2合成 [79,在RNAi-中检测到较低GmWRKY40转基因根相对于对照根圈(图。6.C)。我们推理过沉默GmWRKY40下调表达gmnadphox.导致降低ħ2O.2积累和损害转基因大豆根系的抗性P. sojae..
JAZ蛋白被鉴定为JA信号的转录抑制因子[80].Jasmonate治疗导致Jaz降解,这种降解取决于SCF的活动COI1.泛素连接酶和26S蛋白酶体[81],导致各种转录因子的激活,随后调节其下游信号级联并调节各自的植物反应[82那83].已经报告了一些TFS作为Jaz蛋白的目标,例如BHLH TFS,MYB TFS和Dellas [84].在本研究中,我们发现GmWRKY40与多个JAZ蛋白相互作用(Figs。7.和8.)GmWRKY40- 感染后的-rnai转基因大豆根P. sojae.(桌子1).JAZ蛋白已被报道在病原体防御中发挥作用[83那85].在这里,我们推测,JAZ蛋白质的上调GmWRKY40沉默的转基因根增强了易感性P. sojae.通过抑制JA信号传导感染。需要更多的工作来了解这些jaz蛋白在大豆对病原体的反应中的作用。此外,WRKY TFS还采用转录水平jaz.基因的表达。姜和俞的研究表明WRKY57作为转录激活因子结合的启动子序列jaz1.和jaz5.与WRKY33的转录调节功能竞争,协调规范对拟南芥灰霉[86].我们还测试了负责与Jaz蛋白相互作用的GmWrky40的域名。GmWrky40的Wrky域是Jaz2 / 5/7-Gmwrky40相互作用所必需的,但是,Jaz4 / 6/8表现出与Wrky Domain突变体和锌 - 手指域突变蛋白相互作用。Jaz1 / 3既不与Wrky域突变蛋白也没有相互作用,也不是锌 - 手指结构域突变蛋白(图。7.和8.).因此,需要不同地需要Gmwrky40蛋白的腕部结构域和锌 - 手指结构域,以与不同的Jaz蛋白相互作用。这些jaz蛋白在大豆反应中的功能P. sojae.多样JAZ蛋白质的不同结构域相互作用的机制突变GmWRKY40将在未来的研究中加以解决,以阐明大豆防御反应GmWRKY40介导调控的根本。
结论
总的来说,本研究中提供的数据不仅揭示了一种重要的调节功能GmWRKY40在大豆抗性P. sojae.,也为进一步的研究提供了基础P. sojae.-诱导的信号通路GmWRKY40参加。我们的研究结果表明,GmWrky40用作大豆植物的正稳压器的反应P. sojae.通过调节过氧化氢积累或可以与Jaz蛋白相互作用。但是,功能调查GmJAZ过表达/ RNAI转基因植物是进一步确定大豆功能的必要条件GmWRKY40在生物应激抗性。此外,进一步探索鉴定GmWRKY40- 澄清的机制是有用的GmWRKY40在调节大豆的反应P. sojae..这些发现将扩展我们对其功能的理解GmWRKY40并将提供可宝贵的资源,以了解大豆之间的分子相互作用P. sojae..
材料和方法
植物材料、生长条件及处理
大豆(甘氨酸。马克斯)seeds of Williams 82 were grown in greenhouse at 25 °C under a 16-h-light and 8-h-dark photoperiod. Seven-days-old seedlings were infected withP. sojae.下胚轴接种法分离P6497 [87那88].接种后0、3、6、12、24、36、48和72 h采集样品,直接在液氮中冷冻,−80℃保存备用。大豆种子和P. sojae.在本研究中使用的是,在南京农业大学大豆改善国家大豆改善的实验室提供。
对于毛状根诱导,通过氯气通过氯气进行表面灭菌1小时,在灭菌水中浸泡过夜,然后在琼脂(0.8%)培养基上发芽并在生长室(25℃,16h Photopheriod)中生长6 days. Cotyledons were then collected for根出杆菌根草杆菌- 介质的毛茸茸的根转化。
For phytohormone treatment, soybean seeds were planted into vermiculite 7 days, then roots were cleaned and submerged in different hormones with the concentration of 100 μM methyl jasmonate (MeJA), 2 mM ethylene (ETH), 5 mM salicylic acid (SA) and 50 mM abscisic acid (ABA). Roots were harvested at 0, 1, 3, 6, 12 and 24 h, frozen in liquid nitrogen immediately and stored at − 80 °C until RNA extraction.
尼古利亚娜·宾夕法尼亚州植物在25℃下以温室为16小时光周期生长。5-6周龄的植物用于农业污染。
Phytophthora sojae.文化条件
P. sojae.将分离物P6497在1.5%V8果汁琼脂培养基上在25℃下培养。V8培养基含有40μgmL- 1遗传霉素被用于培养RFP标记的应变P6497R [89].For zoospore preparation, cultivate the newly cultured P6497R mycelium in V8 liquid medium, then incubated at 25 °C in dark for 2 days. The mycelium was then washed several times with sterile ddH2o并在25℃下在黑暗中孵育约12小时以释放动物孢子[90]最后,收集释放的游动孢子接种大豆毛状根。
矢量建设
生成GmWRKY40RNAi构建,全长302 bp的cDNA特异性片段GmWRKY40使用P12-Wrky40-F和P12-Wrky40-R的引物通过PCR扩增基因,然后克隆到PDONR221中,网关进入载体。最后,通过网关LR克隆酶反应,GmWRKY40片段克隆到pHellsGate12: GFP [21.].将构建的载体转化为根出杆菌根草杆菌K599菌株用于进一步的转化。
对于酵母 - 二杂化分析,全长GmWRKY40通过PCR使用Wrky40-BD-F和Wrky40-BD-R的PCR扩增cDNA,然后克隆到诱饵载体pGBKT7中,然后转化到酵母菌株AH109中。将全长Jaz1-Jaz8编码序列(CDS)克隆到捕食载体pGadt7中,然后转化到酵母菌株Y187中。用于酵母双杂种的引物在附加文件中列出3.S2:表。
GmWRKY40的亚细胞定位
完整的编码序列GmWRKY40引物WRKY40-SCL-F和WRKY40-SCL-R扩增出无终止密码子的序列Kpn我和SMA.我分别限制站点,然后构造成PBIN-GFP向量以产生CAMV 35S:GmWrky40-GFPconctruct。空白pin - gfp载体作为对照。这两个构念都被转换成农杆菌肿瘤术通过电穿孔菌株GV3101。The validated individual clones were shaken in 4 ml LB broth (with 50 mg L- 1卡那霉素)在28°C下保存24 h。菌液用10mm氯化镁洗涤2最后的OD6000.5。将菌悬液渗透到5 ~ 6周龄完全展开的烟叶背面。浸渗后,在温室中保存48 h接种,然后用dna特异性核菌株4′,6-二氨基-2-苯基吲哚(DAPI)培养10 min。用共聚焦荧光显微镜(Zeiss,德国)检测GFP信号。
农杆菌属文化和大豆子叶转化
用于沉默的质粒载体GmWRKY40将空载体pHellsGate12: GFP转化为答:rhizogenesK599通过电穿孔应变。LB介质,50μg·ml- 1卡那霉素用于选择阳性克隆,并菌落进行PCR以验证单个克隆。The single-positive colony was shaken in LB broth containing 50 μg·mL- 1Kanamycin在28℃下24小时。将细菌以4500rpm离心几分钟并悬浮在10mM MgCl中2(最终OD)600对于大豆子叶转化来获得大豆毛的根部是0.5)。
根据Graham等人进行大豆毛的根转化。[91]和yan等人。[21.].
测定P. sojae.大豆发根的感染
根接种,大豆的转化发根通过在载体中的GFP标签显微镜(OLYMPUS MVX10,日本)下筛选。然后,根用P6497菌丝体接种根据由Graham等人描述以前的琼脂上。[91].Venire Caliper用于测量病变长度,控制根系与RNAi之间的差异的重要性GmWRKY40根被执行学生确定T.测试。
分离的毛状根浸入游动孢子悬浮液中(约104.游动孢子毫升- 1)P. sojae.P6497R 10分钟。将接种的根在0.6%琼脂平板中在黑暗中在25℃下在0.6%琼脂平板中温育48小时。使用荧光显微镜(日本Olympus MVX10)监测疾病进展,包括菌丝延伸和卵孔发育。P. sojae.使用QPCR使用旨在放大的引物测量生物质TEF 1特异性的基因P. sojae.[21.].
分析H2O.2积累
H2O.2用3,3 ' -二氨基联苯胺(DAB, 1 mg/ml, pH 3.8)在25°C的黑暗条件下染色6-8小时,测定破裂程度。用相机拍摄典型表型。
H的含量2O.2采用过氧化氢检测试剂盒(Beyotime, S0038)根据生产协议进行分析。待测样品在室温下放置30分钟,立即用光谱仪在560 nm波长下测量。吸光度值按已知浓度H生成的标准曲线进行校正2O.2.
酵母双杂交筛选和确认
酵母转化由LIAC和聚乙二醇方法进行,如酵母方案手册(Clontech,USA)所述。用X-α-GAL筛选酵母转化体,筛选X-α-GAL但缺乏亮氨酸,色氨酸,组氨酸和腺嘌呤。蓝色菌落表明酵母中两种蛋白质之间的正相互作用。
RNA分离和定量RT-PCR
根据试剂盒说明,使用RNA简易总RNA试剂盒(中国天根)提取总RNA,总RNA样品用DNase I消化以去除基因组DNA。然后使用RNA逆转录酶合成第一条cDNA链(日本TaKaRa)根据制造商的方案。使用cDNA和基因特异性引物进行实时PCR(附加文件3.:表S2)。通过使用Aceq QPCRSybr®Greenmaster混合物(Vazyme,China)的定量PCR通过光圈®480(罗氏,德国)通过定量PCR扩增每个cDNA。大豆Gmcons 4.基因在反应中用作内部对照。2-△△CT.对比CT方法用于估计基因的相对表达水平。学生们'T.- 最低用于统计分析。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从相应的作者获得合理的请求。
缩写
- 阿坝:
-
脱落酸
- APX1:
-
抗坏血酸过氧化物酶1
- CAT1:
-
过氧化氢酶1
- 轻拍:
-
3, 3 ' -diaminobenzidine
- DAPI:
-
4′,6-二氨基-2-苯基吲哚
- eth:
-
乙烯
- eti:
-
Effector-triggered免疫力
- ETS:
-
效应触发易感性
- EV:
-
空载体
- 杰兹:
-
斋月zim-域
- 茉莉酸:
-
茉莉酸甲酯
- NADPHOX:
-
nad(p)h氧化酶
- PAMPS:
-
病原体相关分子模式
- PRRs:
-
模式识别受体
- PTI:
-
PAMP-triggered免疫力
- 存在:
-
定量逆转录PCR
- ROS:
-
活性氧
- SA:
-
水杨酸
- TFs:
-
转录因素
参考
- 1。
吉田K,Schuenemann VJ,卡诺LM,派斯男,米什拉B,夏尔马R,兰兹C,马丁FN,Kamoun S,克劳斯J,等。触发爱尔兰马铃薯饥荒的马铃薯晚疫病菌家族的兴衰。Elife。2013; 2:e00731。
- 2。
泰勒BM。植物炎素:大豆和模型oomycete的根腐病原体。莫尔植物途径。2007; 8(1):1-8。
- 3.
大豆疫霉菌表达序列的比较分析。植物杂志。2000;123(1):243 - 54。
- 4.
杉本T,加藤男,吉田S,松本I,小林T,加贺A,Hajika男,山本R,渡边K,艾诺M等人。大豆疫霉根腐病和育种策略的病原多样性发展疫性大豆。养殖科学。2012; 61(5):511-22。
- 5。
牛建平,郭宁,孙金堂,李丽华,曹永春,李国成,黄建林,赵建明,赵天军,邢辉。利用重组自交系和次级群体定位大豆疫霉抗性基因RpsHN。植物学报2017;8:538。
- 6。
李yp,sun sl,zhong c,王xm,吴Xf,朱泽。RPSQ共同分离标志物的遗传映射和发展,为大豆提供对植物磷酸的抗性。Al Appl Genet。2017; 130(6):1223-33。
- 7.
Sahoo DK, Abeysekara NS, Cianzio SR, Robertson AE, Bhattacharyya MK.一个新的大豆疫霉菌抗性Rps12基因定位到一个包含多个Rps基因的基因组区域。《公共科学图书馆•综合》。2017;12 (1):e0169950。
- 8.
程勇,马强,任华,夏强,宋娥,谭志,李树华,张国华,年华。大豆抗植物病基因RpsWY的高通量测序。应用电子学报。2017;130(5):1041-51。
- 9
钟C,孙S,李勇,段C,朱Z.新一代测序鉴定候选基因,并制定一个新的疫霉抗性基因,RpsHC18诊断标志物,大豆。Al Appl Genet。2018; 131(3):525-38。
- 10。
Abeysekara NS,Matthiesen RL,Cianzio SR,巴氏MK,罗伯逊AE。针对致病部分抗性的新颖来源大豆疫霉大豆PI 399036.作物科学2016; 56(5):2322-35。
- 11.
Lebreton A,拉韦C,德龙尼男,薛AG,马尔尚G,贝朗格RR。一个简单的水培试验的发展研究大豆和大豆疫霉菌的致病型的垂直和水平电阻。植物DIS。2018; 102(1):114-23。
- 12.
泰勒BM。进入和破坏:粪便植物病原体的毒力效应蛋白。细胞微生物。2009; 11(1):13-20。
- 13。
寇YJ,Wang SP.广谱和持久性:对定量抗病性的理解。Curr Opin Plant Biol.2010;13(2):181-5。
- 14。
圣克莱尔da。育种量的定量抗病性和定量抗性基因座。Annu Rev phytopathol。2010; 48:247-68。
- 15.
托雷PW,格劳CR。到疫霉根腐病˚FSP Glycinea率降低电阻在大豆的场特性。植物病理学。1984; 74(10):1201-8。
- 16。
Mideros S, Nita M, Dorrance AE。大豆对大豆疫霉部分抗性组分、Rps2和根系抗性组分的表征植物病理学。2007;97(5):655 - 62。
- 17
Wang HH, Wijeratne A, Wijeratne S, Lee S, Taylor CG, St Martin SK, McHale L, Dorrance AE。通过序列分析和基因表达分析分析了两个部分抗大豆疫病的QTL。BMC基因组学。2012;13:428。
- 18
维加 - 桑切斯ME,Redinbaugh MG,科斯坦佐S,多兰斯AE。在大豆品种具有不同水平的对大豆疫霉菌的部分抗性的防御相关基因的空间和时间表达分析。physiol mol植物疗法。2005; 66(5):175-82。
- 19
Zhou Lc,Mideros Sx,Bao L,Hanlon R,Arredondo FD,Tripathy S,Krampis K,Jerauld A,Evans C,St Martin Sk,等。感染和基因型重塑整个大豆转录组。BMC基因组学。2009; 10:49。
- 20。
王志强,王志强,宋庆杰,王志强。大豆疫霉部分抗性的全基因组关联分析。BMC基因组学。2016;17:607。
- 21。
严Q,崔X,苏力,徐N,郭N,邢H,窦D.大豆Rps基因介导和基础抗大豆疫霉性对GmSGT1的要求不同。植物细胞代表2014;33(8):1275-88。
- 22。
Gurr SJ,Rushton PJ。工程植物患疾病抵抗力增加:我们要表达什么?趋势生物技术。2005; 23(6):275-82。
- 23。
关键词:大豆,细胞死亡防御因子,GmDAD1,抗疫霉菌,抗性植物学报。2019;10:107。
- 24。
Zhang C, Gao H, Li R, Han D, Wang L, Wu J, Xu P, Zhang S. GmBTB/POZ蛋白对大豆疫霉菌感染的响应具有正向调控作用。植物学报。2019;20(1):78-91。
- 25。
程强,董磊,高涛,刘涛,李宁,王磊,常鑫,吴军,徐鹏,张树生。bHLH转录因子GmPIB1对大豆疫霉菌抗性的促进作用。J Exp Bot. 2018;69(10): 2527-41。
- 26。
董磊,程勇,吴军,程强,李伟,樊胜,江磊,徐志强,孔飞,张东,等。含ERF转录因子EAR基序的新成员GmERF5的过表达增强了大豆对疫霉菌的抗性。中国生物医学工程学报。2015;66(9):2635-47。
- 27。
赵Y, Chang X,气D,董L,王G,风扇,江L,程Q,陈X,汉族D, et al。一种新的大豆ERF转录因子GmERF113可提高大豆疫霉菌的抗性。植物学报2017;8:299。
- 28。
Suen Tc,Hung Mc。涉及Neu基因调节的多种CIS-和反式作用元件。Mol细胞Biol。1990; 10(12):6306-15。
- 29。
Kawaoka A,Kawamoto T,Sekine M,Yoshida K,Takano M,Shinmyo A.一种顺式作用元素和涉及卷曲诱导的辣根过氧化物酶基因表达的反作者。工厂J.994; 6(1):87-97。
- 30.
Ulker B,Somsich IE.WRKY转录因子:从DNA结合到生物功能。植物生物学。2004;7(5):491–8.
- 31。
Eulgem T, somsich IE。WRKY转录因子在防御信号中的网络。植物学报。2007;10(4):366-71。
- 32。
《植物转录因子的WRKY超家族》,趋势植物科学杂志,2000;5(5):199-206。
- 33。
沈庆杰。WRKY转录因子。植物科学进展,2010;15(5):247-58。
- 34。
陈楼胡Y,Vannozzi A,吴KC,蔡HY,秦Y,穆利斯A,林ZG,张LS。该WRKY转录因子家族在模型植物和作物。CRIT Rev Plant Sci。2017; 36(5-6):311-35。
- 35。
Birkenbihl RP,Kracher B,Roccaro M,Somssich Ie。在早期制动触发免疫期间诱导三个拟南芥毛骨转录因子的基因组宽结合。植物细胞。2017; 29(1):20-38。
- 36。
Hwang sh,kwon si,jangjy,方伊尼尔,李h,choi c,park s,ahn i,bae sc,hwang dj。Oswrky51,水稻转录因子,用作防御Xanthomonas oryzae PV的防御反应中的正调节因子。oryzae。植物细胞批准。2016; 35(9):1975-85。
- 37。
张YJ,王LJ。该WRKY转录因子家族:其在植物真核生物和扩张的源头。BMC EVOL BIOL。2005; 5:1。
- 38。
Bencke Malato M、Cabreira C、Wiebke Strohm B、Bucker Neto L、Mancini E、Osorio MB、Homrich MS、Turchetto Zolet AC、De Carvalho MCCG、Stolf R等。大豆WRKY家族的全基因组注释和参与响应厚皮粉虱感染的基因的功能表征。BMC Plant Biol.2014;14:236。
- 39。
Chen Ch,Chen ZX。ATWRKY18的发育监管植物防御反应的潜力诱导的拟南芥转录因子。植物理性。2002; 129(2):706-16。
- 40.
哦SK,BAEK KH,公园JM,易SY,俞SH,Kamoun S,崔D.辣椒WRKY蛋白CaWRKY1是防御病原体的负调节。新植物。2008; 177(4):977-89。
- 41.
李继,布拉德尔G,Palva等。WRKY70转录因子:含茉莉族介导和植物防御中的水杨酸盐介导的信号的收敛节点。植物细胞。2004; 16(2):319-31。
- 42。
Birkenbihl RP,Diezel C,Somssich IE。拟南芥WRKY33是对灰霉病感染激素和代谢反应的关键转录调节。植物理性。2012; 159(1):266-85。
- 43。
Shimono M, Sugano S, Nakayama A, Jiang CJ, Ono K, Toki S, Takatsuji H. Rice WRKY45在苯并噻唑诱导的稻瘟病抗性中起关键作用。植物细胞。2007;19(6):2064 - 76。
- 44。
Hwang Sh,Yie SW,Hwang DJ。OSWRKY6基因在拟南芥中的异源表达激活了防御相关基因的表达并增强了对病原体的抗性。植物SCI。2011; 181(3):316-23。
- 45。
党锋,王亚宁,于磊,Eulgem T,赖勇,刘志强,王旭,邱爱玲,张天祥,林杰,等。辣椒WRKY蛋白CaWRKY40在辣椒对热胁迫的耐受性和对茄科Ralstonia solanacearum侵染的抗性调控中发挥重要作用。植物学报。2013;36(4):757-74。
- 46。
Judelson HS, Blanco FA。疫霉菌的孢子:植物毁灭者的武器。微生物学杂志。2005;3(1):47-58。
- 47。
Adachi H, Nakano T, Miyagawa N, Ishihama N, Yoshioka M, Katou Y, Yaeno T, Shirasu K, Yoshioka H.通过MAPK磷酸化的WRKY转录因子调节本氏烟草的植物免疫NADPH氧化酶。植物细胞。2015;27(9):2645 - 63。
- 48。
Yogendra KN,Dhokane d,Kushalappa交流,萨米恩托楼罗德里格斯E,莫斯克拉T. StWRKY8转录因子调控对苄基异生物碱途径马铃薯赋予抗晚疫病。植物SCI。2017; 256:208-16。
- 49。
崔J,徐P,萌杰,李继,江n,植物植物染发剂诱导的番茄叶的转录组特征及转录因子Spwrky3的功能鉴定。Al Appl Genet。2018; 131(4):787-800。
- 50。
李杰,栾ys,刘Z。Spwrky1的过度表达促进对转基因烟草中植物的耐药性和对盐和干旱胁迫的耐受性。physiol植物。2015; 155(3):248-66。
- 51。
周庆云,田阿格,邹晓峰,谢志敏,雷庚,黄杰,王厘米,王HW,张JS,陈SY。大豆WRKY型转录因子基因GmWRKY13、GmWRKY21和GmWRKY54赋予转基因拟南芥植物对非生物胁迫的不同耐受性。植物生物技术杂志,2008;6(5):486–503.
- 52。
杨烨,志yj,王z,周y,风扇bf,陈泽。结构相关大豆Gmwrky58和Gmwrky76在植物生长发育中的功能分析。J Exp Bot。2016; 67(15):4727-42。
- 53。
王Z,李PF,杨勇,志YJ,范BF,陈ZX。豆科特异性WRKY和Exo70蛋白的新颖的组表达和功能分析来自大豆变体。SCI代表2016; 6:32090。
- 54。
粉丝SJ,东立,韩D,张F,吴吉,江莉,程Q,李瑞,卢WC,萌FS等。通过调节大豆中的防御相关的基因表达,Gmwrky31和GmHDL56通过调节与防御相关的基因表达来增强对植物的抗性。前植物SCI。2017; 8:781。
- 55。
Subramanian S,Graham My,Yu O,Graham TL。大豆异黄酮合成酶基因的RNA干扰导致对转化部位远端的组织中的沉默,并提高对植物孢子菌的敏感性。植物理性。2005; 137(4):1345-53。
- 56。
Bari R,Jones J.植物激素在植物防御反应中的作用。植物mol biol。2009; 69(4):473-88。
- 57。
黄Ĵ,高L,杨勇,翟Ĵ,Arikit S,俞Y,段S,陈V,熊Q,严杰,等。在对大豆疫霉菌感染大豆防御小RNA的作用。植物杂志2014; 79(6):928-40。
- 58。
李志刚,李志刚,李志刚。植物活性氧基因网络的研究进展。植物科学进展。2004;9(10):490-8。
- 59。
通过gp91的植物同源物产生超氧化物Phox.NADPH氧化酶。钙和烟草叶片病毒感染的活性调节。植物理性。2001; 126(3):1281-90。
- 60.
高桥H,陈志新,杜华,刘亚东,Klessig DF。过氧化氢酶水平严重降低的转基因烟草植株的坏死和抗病性的发展。植物j . 1997; 11(5): 993 - 1005。
- 61.
Noctor G,门厅CH。抗坏血酸和谷胱甘肽:保持活性氧的控制。Annu启植物生理学。1998; 49:249-79。
- 62.
张海龙,张海龙,张海龙。3个基因可分离的抗霜霉病基因信号通路的基因表达特征。植物杂志。2004;135(2):1129 - 44。
- 63.
Kim Kc,Lai ZB,风扇BF,Chen ZX。Arabidopsis Wrky38和Wrky62转录因子与基底防御中的组蛋白脱乙酰酶19相互作用。植物细胞。2008; 20(9):2357-71。
- 64.
Yokotani N,Sato Y,Tanabe S,Chujo T,Shimizu T,Okada K,Yamane H,Shimono M,Sugano S,Takatsuji H,等。Wrky76是一种稻米转录压缩机,在抗癌性和冷应力耐受性中起相反应的作用。J Exp Bot。2013; 64(16):5085-97。
- 65.
程,刘赫,邓益,萧杰,李旭,王硕。Wrky45-2 Wrky13 Wrky42转录调节级调节级级耐水稻对真菌病原体需要。植物理性。2015; 167(3):1087-99。
- 66。
孟Y,聪明的RP。HVWRKY10,HVWRKY19和HVWRKY28规范了MLA触发的免疫和基底防御,对大麦粉状霉菌。Mol植物微生物相互作用。2012; 25(11):1492-505。
- 67。
俞楼华夏Y,鲁W,吴C,曹X,郭X. GhWRKY15,从棉花中确定的WRKY转录因子家族中的一员(陆地棉),参与抗病和植物的发育。BMC植物BIOL。2012; 12:144。
- 68。
Ishihama N,山田R,吉冈男,加藤S,通过在防御反应MAPK函数的本塞姆氏烟草WRKY8转录因子的吉冈H.磷酸化。植物细胞。2011; 23(3):1153至1170年。
- 69。
Pandey AK, Yang CL, Zhang CQ, Graham MA, Horstman HD, Lee Y, Zabotina OA, Hill JH, Pedley KF, Whitham SA。Rpp2介导的亚洲大豆抗锈病途径功能分析。植物与微生物学报。2011;24(2):194-206。
- 70.
张CQ,Grosic S,惠瑟姆SA,山JH。多重防御基因大豆的需求RSV1介导的,以大豆花叶病毒极端抵抗。Mol植物微生物相互作用。2012; 25(10):1307年至1313年。
- 71.
林男,赵MX,鲍曼DD,平JQ,孙LJ,刘YF,张B,唐ZX,休斯E,Doerge RW等。病原体大豆疫霉根腐病近等基因系10大豆中的分子响应揭示转录比较。BMC基因组学。2014; 15:18。
- 72.
Peng Y,Bartley Le,Chen XW,Dardick C,Chern Ms,Ruan R,Canlas PE,Ronald PC。Oswrky62是基础和XA21介导的防御Xanthomonas oryzae PV的负调节器。玉米酸盐。莫尔植物。2008; 1(3):446-58。
- 73.
《小分子激素在植物免疫中的网络作用》,《自然化学生物学》2009;5(5):308-16。
- 74。
蒋宇军,于迪强。WRKY转录因子:植物激素和植物的过程之间的联系。科学生中国生活SCI。2015; 58(5):501-2。
- 75。
陈立国,张立平,李冬波,王芳,于迪强。WRKY8转录因子通过介导拟南芥中脱落酸和乙烯信号通路参与TMV-cg防御反应。中国科学(d辑:地球科学)2013;110(21):E1963-71
- 76。
魏世杰,志天然,朴基。双相乙烯和活性氧协同合成烟草对半生物营养疫霉菌的响应。植物杂志。2012;159(1):251 - 65。
- 77。
Thordal-Christensen H,张ZG,Wei Yd,Consling DB。h的亚细胞定位2O.2在植物中。H2O.2大麦白粉病相互作用过程中的乳头积累和超敏反应。《植物杂志》,1997年;11(6):1187–94.
- 78。
Shetty NP,Jorgensen HJL,Jensen JD,Colline DB,Shetty HS。反应性氧物种在植物与病原体相互作用中的作用。EUR J植物途径。2008; 121(3):267-80。
- 79。
Foreman J,Demidchik V,Bothwell JHF,Mylona P,Miedema H,托雷斯MA,Linstead P,Costa S,Brownlee C,Jones JDG等。NADPH氧化酶产生的活性氧物种调节植物细胞生长。自然。2003; 422(6930):442-6。
- 80。
Chini A,Fonseca S,Fernandez G,Adie B,Chico JM,Lorenzo O,Garcia-Casado G,Lopez-Vidriero I,Lozano FM,Ponce Mr,等。jaz家庭的阻遏者是茉莉ats信号传导中缺失的链接。自然。2007; 448(7154):666-U664。
- 81。
JAZ抑制蛋白是茉莉酸激酶信号转导过程中SCF (COI1)复合物的靶标。大自然。2007;448(7154):661 - 5。
- 82。
JAZ蛋白:茉莉酸信号级联的关键界面。植物细胞。2011;23(9):3089 - 100。
- 83。
何旭,朱立峰,瓦桑GM,王永军,苗永红,沙班敏,胡海云,孙辉,张晓丽。GhJAZ2通过抑制GhbHLH171的转录活性来降低棉花对生物胁迫的抗性。植物学报。2018;19(4):896-908。
- 84.
Kazan K,J.M.JAZ抑制因子与植物激素串扰的协调。植物科学趋势。2012;17(1):22-31。
- 85.
撒切尔LF,Cevik v,Grant M,Zhai B,Jones JD,Anaders JM,Kazan K. jaz7激活标记的拟南芥突变体的表征,随着对真菌病原体镰刀虫的易感性增加。J Exp Bot。2016; 67(8):2367-86。
- 86.
蒋宇军,于迪强。WRKY57转录因子通过转录方式影响茉莉酸zim结构域基因的表达,从而降低番茄灰霉病抗性。植物杂志。2016;171(4):2771 - 82。
- 87.
孙S,吴XL,赵JM,王YC,唐QH,俞DY,改JY,邢H.表征和RpsYu25的映射,一个新的抗性基因大豆疫霉菌。植物品种。2011; 130(2):139-43。
- 88.
Sun J,Li L,Zhao J,Huang J,Yan Q,Xing H,Guo N.RPSJS的细微映射,一种新的抗性基因在大豆中的植物,植物对植物细胞植物血清β[甘氨酸MAX(L.)Merr]。Al Appl Genet。2014; 127(4):913-9。
- 89.
熊Q,YE W,Choi D,Wong J,Qiao Y,Tao K,王Y,MA W.RNA沉默2的植物滴黄素2是促进大豆和拟南芥催化的保守RXLR效应。Mol植物微生物相互作用。2014; 27(12):1379-89。
- 90.
张敏,陆军,陶凯,叶伟,李爱玲,刘昕,孔林,董胜,郑旭,王玉英。大豆疫霉Myb转录因子在鼠孢子发育中的调控作用。《公共科学图书馆•综合》。2012;7 (6):e40246。
- 91.
Graham TL,Graham My,Subramanian S,Yu O.诱导或生物合成的基因的RNai沉默抑制了植物细胞的植物感染组织的种族特异性抗性和过敏细胞死亡。植物理性。2007; 144(2):728-40。
致谢
我们要感谢从南京农业大学的大龙窦教授,为酵母菌株Y187和AH109和PGBKT7和PGADT7提供。我们还感谢实验室成员寻求帮助,建议和讨论。
资金
中国国家重点研发计划(2017YFD01500),中央大学的基本研究资金(KYZ201811),遗传修饰的生物育种主要项目(2016ZX08004002),中国近代农业工业技术研究体系(Cars-04-PS10),大学长江学者和创新研究团队的计划(PCSIRT_17R55)和江苏协作创新中心,用于现代作物生产。资金代理只提供了财政支持,并没有涉及对数据的实验,收集,解释和分析的设计和起草稿件的设计。
作者信息
隶属关系
贡献
XC、QY和NG构思并设计了实验。XC、QY、SG和DX进行了实验。XC、QY和DX分析了数据。XC起草了手稿。NG、SG、HX、HW和JZ帮助修改了手稿。所有作者都阅读并批准了最终手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
绿色荧光的转基因大豆发根和沉默效率分析。(A)从一小部分观察到绿色荧光农杆菌属- 诱导毛茸茸的根。在荧光显微镜下检查根部。(b)表达GmWRKY40通过定量RT-PCR在每个单独的毛发根中验证。错误栏表示标准错误。星号表示统计上显着的差异(**P.< 0.01).图S2。GmWRKY40参与大豆基础抗病。(A)术后病变长度P. sojae.被威廉斯毛状根感染。病灶长度为24 hpi。(B)P. sojae.在12和24 HPI时通过QPCR测定生物质GmWRKY40沉默或威廉姆斯毛茸茸的根。上述实验重复三次,以及生物实验的至少三次独立重复。错误栏表示标准错误。星号表示统计上显着的差异(**P.< 0.01).图S3。RNAi中SA信号通路基因的表达模式GmWRKY40或EV毛状根。转基因毛状根接种游动孢子悬浮液P. sojae.接种后0和24 h采集样品。基因表达的GMNPR1那gmpr1a.和GmPR5通过QRT-PCR分析。实验重复三次。错误栏表示标准错误。星号表示统计上显着的差异(**P.< 0.01)
附加文件2:表S1。
RNAi的局部差异表达基因列表GmWRKY40转基因根感染后P. sojae.与控制根部相比
附加文件3:表S2。
本研究中使用的引物
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
崔雪峰,颜强,甘淑娟。et al。GmWRKY40, WRKY转录因子基因的一个成员甘氨酸最大增强了对细菌的抗性Phytophthora sojae..BMC植物BIOL.19,598(2019)。https://doi.org/10.1186/s12870-019-2132-0
已收到:
公认:
发表:
关键字
- 甘氨酸最大(L.)Merr
- Phytophthora sojae.
- GmWRKY40
- RNA干扰
- 酵母双杂交
- 大豆毛的根