抽象的
背景
长期非编码RNA(LNCRNA)在不同的生物过程中发挥着重要作用,近年来已被广泛研究。然而,LNCRNA在银杏中叶片颜料形成中的作用(银杏毕洛巴巴仍然缺乏了解。
结果
本研究通过高通量测序构建突变黄叶银杏和正常绿叶银杏的lncRNA文库。共获得2044个lncrna,平均长度为702 nt,通常含有2个外显子。我们鉴定了238个差异lncrna (DELs), 32个DELs和49个差异mrna (DEGs),它们构成了共表达网络。我们还发现了48个CIS.-Acting dels规定的72个靶基因和31反式-acting DELs调控31个不同的靶基因,为调控叶色突变提供了新的视角。由于lncrna在广泛的生物过程中具有重要的调控作用,我们对其进行了深入的研究,发现叶绿体类囊体膜亚类和光合途径(ko00195)最为丰富,表明其在叶片着色机制中可能发挥作用。此外,我们的相关分析表明,8个del和68个转录因子可能参与了相互作用网络。
结论
本研究丰富了lncrna的相关知识,对lncrna在叶色突变中的作用有了新的认识,对今后银杏的选择性育种具有重要意义。
背景
真核细胞在转录过程中产生的全部rna中,只有1 - 2%被编码产生蛋白质,其余的rna称为非编码rna (ncRNAs)。ncRNAs在细胞中发挥重要作用,如rrna和tRNAs在蛋白质合成中起重要作用,snrna在新生RNA剪接中起重要作用,microRNAs、sirna和piRNAs在抑制基因表达中起重要作用[1].在ncRNA中,有一类广泛分布的ncRNA转录本,其长度大于200个核苷酸,没有蛋白质编码功能,称为长非编码rna (long noncoding RNAs, lncRNAs) [2,3.,4,5].大多数lncrna由RNA聚合酶II转录,其结构与mRNA相似,如5 ' caps和3 ' poly (a) tails [6,7].根据lncRNA相对于相邻基因的基因组位置,可以将lncRNA分为5类:意义lncRNA、反义lncRNA、基因间lncRNA (lincRNA)、内含子lncRNA和双向lncRNA [8].此外,根据分子功能,lncrna可分为信号、诱饵、引导和支架[3.,9].
lncRNA可在分化过程中动态表达,通过聚腺苷酸化和不同的可变剪接事件形成不同的成熟lncRNA,使同一基因形成不同的lncRNA转录本[10.].LNCRNA普遍转录在真核细胞中并分布在细胞质,细胞器和核中,但主要在细胞核中。首先在2002年的小鼠的测序分析中鉴定LNCRNA [11.].目前,人类和动物中LNCRNA的功能机制已经过分研究了深度,特别是在疾病方面。近年来,随着生物信息学技术的不断改进,包括高通量测序技术和其他生物技术,植物LNCRNA的研究已经发展迅速,并受到了增加的关注。目前,LNCRNA已被广泛识别在植物中拟南芥蒂利亚纳[12.],玉米[13.],萨尔维亚米尔蒂希萨[14.),而杨树[15.].LNCRNA可以影响一系列生物过程,例如表观遗传调控,细胞周期调节,细胞分化调控和次级代谢物合成,通过调节靶基因水平[16.,17.,18.].
银杏(银杏毕洛巴巴L.)是一家着名的遗传植物,源于中国,被描述为“活化石”[19.].银杏作为一种多功能树种,具有重要的经济和药用价值[20.]并引起了研究人员对许多研究的注意力,这些研究已经报告了银杏的起源和演化,细胞学,分子生物学,树种繁殖和药用价值[19.,21.,22.,23.,24.,25.].银杏也是一个受欢迎的观赏物种,在全球范围内广泛培育[24.].但对其观赏特性的研究较少[26.].叶子颜色是银杏作为景观植物的重要特征。银杏的最具吸引力的装饰特征是其秋季的金色叶子[26.].在银杏中鉴定到的黄色突变体在整个叶发育期表现出黄色叶片的表型特征,叶期比普通银杏长[27.].该突变体不仅具有良好的观赏价值,而且为研究叶片色素合成的遗传控制提供了理想的材料。
以往的研究提供了对涉及叶色突变的蛋白质编码基因的理解[26.,27.,但lncrna在黄叶突变中的作用却鲜有报道。本研究以正常的银杏绿叶和突变的银杏黄叶为研究材料,探讨lncrna在叶色突变中的调控机制。我们的目标是:(1)建立lncRNA库,识别和描述推测的lncRNA表达;(2)构建差异lncrna (DELs)与差异mrna (DEGs)共表达网络;(3)预测靶基因CIS.- 和反式-Acting lncrnas及其功能;(4)在银杏叶中进行LNCRNA和转录因子(TFS)之间的相关分析。这些调查结果将为进一步研究叶子颜色突变的潜在功能提供科学的基础,从而有益于银杏的未来选择性育种和培养。
结果
银杏叶中lncrna的RNA测序及鉴定
获得综合的LNCRNA转录物(附加文件3.在Illumina HiSeq X平台上,利用6个(3个黄色叶片(YL)和3个正常绿色叶片(GL)) cDNA文库进行RNA测序(RNA-seq)。经对端测序,GL共产生493.71 M raw reads, YL共产生484.42 M raw reads(见表)1).原始测序数据以登录号SRP182122提交至Short Reads Archive (SRA)数据库。过滤掉低质量序列后,6个文库产生了约931.52 M的clean reads,平均GC含量为42.89%。其中93%以上的序列位于参考银杏基因组上。
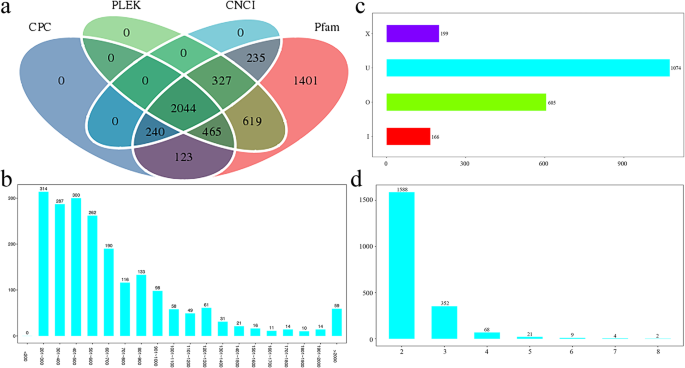
LncRNA是一类长度超过200bp且无蛋白编码能力的RNA分子。因此,预测转录本的编码潜能来判断转录本是否为lncrna。基于改进的k-mer方案(PLEK)分析方法,采用Coding Potential Calculator (CPC)分析、Coding- non -Coding Index (CNCI)分析、Protein Families (Pfam)蛋白结构域分析以及长链非编码rna和信使rna预测因子对候选lncrna进行进一步筛选(图)。1一种)。筛选候选LNCRNA后,最终预测2044个LNCRNA序列(≥200bp)。LNCRNA序列的平均长度为702,N50为840,所有LNCRNA序列的总长度为1,436,133。新预测的LNCRNA长度分布表明201和300bp之间的LNCRNA的数量至多314,1801和1900bp之间的LNCRNA数仅为10(图。1b).此外,根据lncRNA与已知蛋白编码转录本的位置关系,可以将其分为四种类型:基因间lncRNA (lincRNA, U)、内含子lncRNA (I)、反义lncRNA (X)和意义重叠lncRNA (O);结果显示u型lncrna的数量最多(1074个),几乎是i型lncrna的6.5倍(图2)。1c). lncrna中预测的外显子数如图所示。1d,表明lncrna主要含有两个外显子。此外,由于一些lncRNA可以作为植物中已知miRNA的前体,我们将miRNA前体与我们鉴定的lncRNA序列进行了比对。六个新的lncrna被鉴定为已知mirna的前体。结果显示,tcon_00021802具有最多的miRNA前体,而tcon_00016273具有最少的miRNA前体。
银杏特征长非划分RNA(LNCRNA)的概述。一个根据编码电位计算器(CPC)和编码 - 非编码指数(CNCI)以及基于改进的蛋白质家族(PFAM)和长度非编码RNA和Messenger RNA的蛋白质家族(PFAM)和蛋白质家族(PFAM)和预测器的候选LNCRNA的数量。基于改进的K-MER计划(PLEK)数据库。bLncRNA序列长度分布。纵轴为lncRNA编号,横轴为lncRNA长度范围。cLNCRNA类型的统计图表。垂直轴上的LNCRNA的类型和水平轴上的LNCRNA数。U:代际LNCRNA;I:内肠道LNCRNA;X:反义LNCRNA;o:感觉重叠的lncrna。d外显子数量的LNCRNA数。LNCRNA的数量位于垂直轴上,并且LNCRNA中包含的外显子数量位于水平轴上
lncrnas表达水平分析
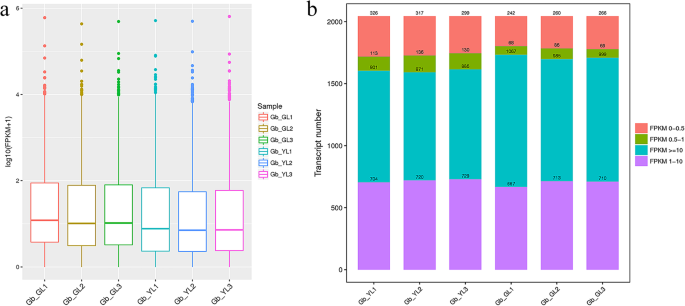
通过每百万读数(FPKM,附加文件,估计2044例LNCRNA转录物的表达水平估计(FPKM,附加文件4:数据S2)。结果表明,这些LNCRNA表达水平不同,如盒子盒中所示(图。2a). YL组的lncRNA平均表达水平明显低于GL组(F = 34.180,p = 0.004). The results of interval expression values showed that the transcript number and distribution of gene expression values were different between YL and GL groups (Fig.2b).大多数转录本FPKM值大于或等于10,而少数转录本FPKM值在0.5到1之间。显著性分析结果显示,YL组FPKM 0-0.5转录本数量较多(F = 29.252,p = 0.006) and FPKM 0.5–1 (F = 33.155,p= 0.005), FPKM≥10的数较少(F = 23.957,p = 0.008) than the counterpart.
GL和YL之间del的识别和验证
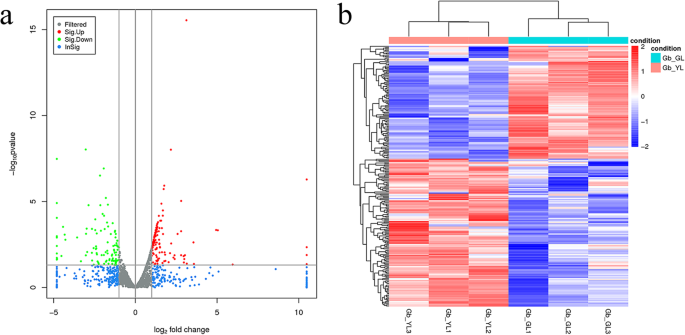
根据重要性测试的结果,筛选了总共238个德尔斯(附加文件5:GL和YL组之间的数据S3)。在这些DEL中,135显着上调,与GL组相比,在Y1中显着下调103例(图。3.).此外,还有更多的DEGS(1361,附加文件6: data S4)比del多。del的总体分布在一个火山图中描述。图中红色表示YL组中lncrna显著上调,绿色表示YL组中lncrna显著下调(图中绿色表示YL组中lncrna显著下调)。3.一种)。从热图聚类可以看出,通过聚类分析,相同类型的样品出现在同一群体中,并且相同簇中的基因可以具有相似的生物学功能(图。3.b)。
为了进一步验证来自RNA-SEQ分析的DEL的转录模式,在表达水平下使用定量实时PCR(QRT-PCR)随机选择并检查十个DEL。虽然由QRT-PCR验证的若干DEL的表达倍数与FPKM值的那些没有完全相同,但是从QRT-PCR分析中筛选的这10个DEL的表达水平与来自FPKM值推导的那些相一致(附加文件2:图S1,附加文件5:数据S3)。因此,这些结果表明转录组分析结果可重复性好、可靠性高,对于进一步研究银杏GL和YL中lncrna的功能(特别是DELs)具有重要意义。
del和deg coexpression分析
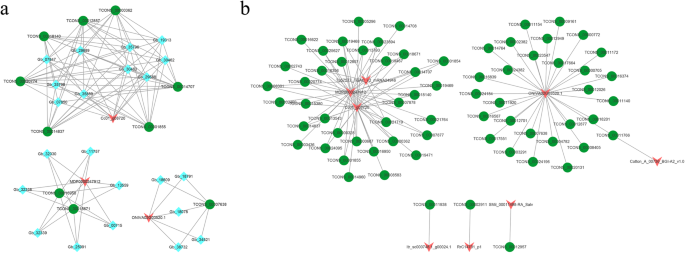
为了进一步探讨del和deg之间的函数关系,我们在图中构建了一个del和deg的共表达网络。4.结果表明,总共32个DEL和49次构成了共存网络。网络提供与颜料函数相关的候选DEL。其中,Tcons_00014724和六个参数具有共用网络。Tcons_00018140和四个参数(GB_32501,GB_08822,GB_29710和GB_06804)展现了共表达模式。GB_11361基因涉及KO00195光合途径,并根据Swissprot指定为照相I P700叶绿素A氯络合物A1。GB_11361与两个DEL共同表达(TCONS_00020469和TCONS_00023547)。大多数DEL和DEG可能有一对一的共表达模式。
Del靶基因的功能分析
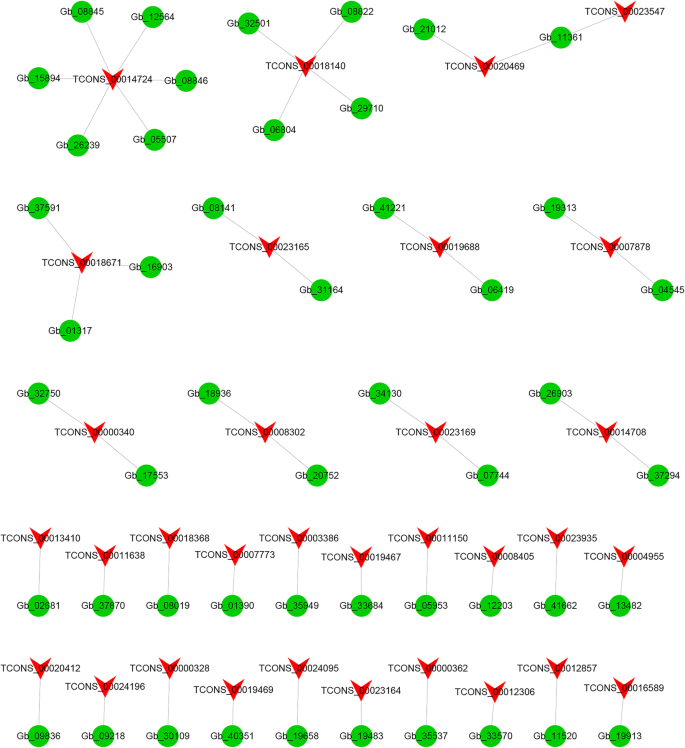
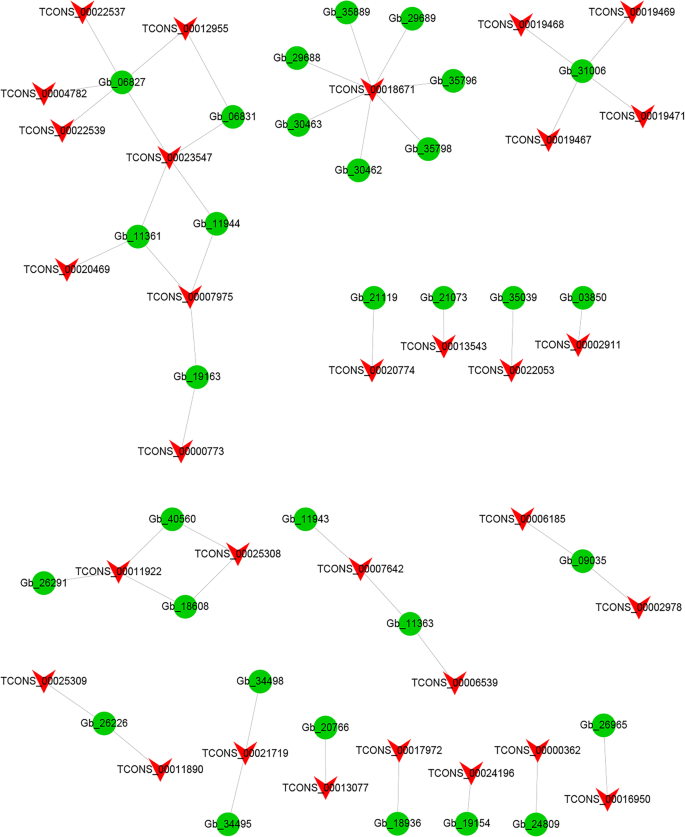
为了调查DELS的潜在功能,我们预测了候选人目标CIS.- 和反式代理lncRNA。为CIS.-acting lncrna,我们在DELs的上游和下游100 kb范围内搜索所有编码基因。这些基因与有显著共表达的lncrna相交。结果表明,48个DELs可以在100 kb范围内调控72个靶基因。这些基因在基因组上相邻并在表达模式中共同表达,可能受到lncrna的调控。为反式- 改造lncrnas(图。5),LNCRNA和mRNA分析的结果表明,有31种不同的DEL调节31种不同的靶基因。有趣的是,四种不同的LNCRNA(TCons_00019467,TCons_00019468,TCons_00019469和TCons_00019471)具有相同的靶基因GB_31006。其他反式- 称为Tcons_00018671的-acting LNCRNA具有七个靶基因(图。5).九次德尔斯展示了一对一的关联,九个参赛。
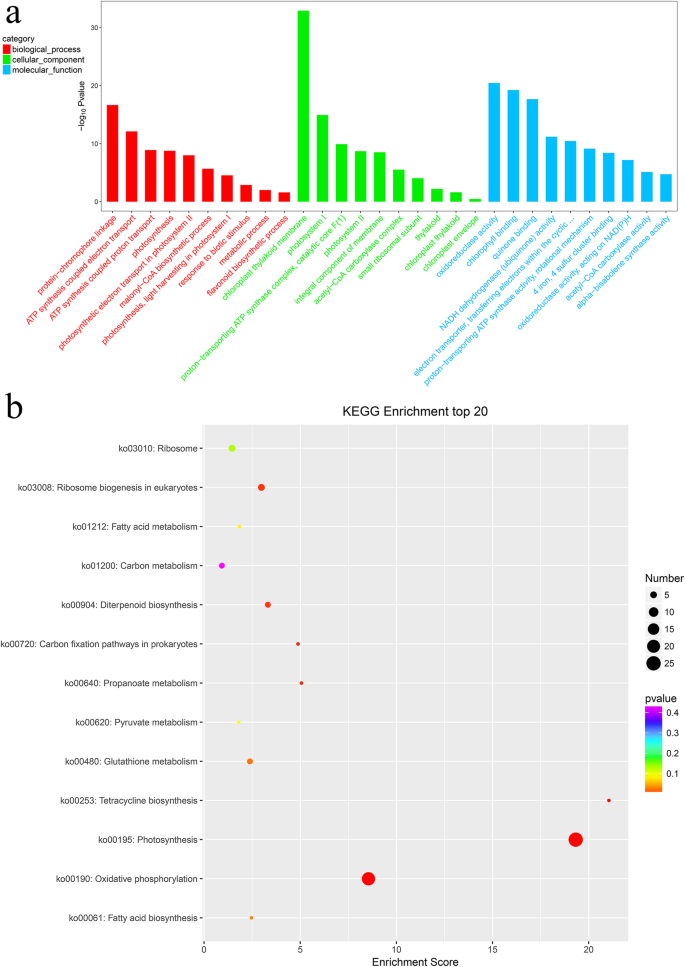
为了进一步探索LNCRNA的潜在生物功能,我们进行了基因本体(GO)注释分析CIS.- 和反式- Lncrnas的点(图。6a). GO分析结果显示,lncRNA靶基因按照生物过程(BP)、细胞成分(CC)和分子功能(MF)进行分类。BP类中富集了蛋白-发色团连接和ATP合成耦合电子传递亚类。CC类中叶绿体类囊体膜亚类富集最多,其次是光系统i。MF类中氧化还原酶活性、叶绿素结合活性和醌结合活性富集。我们还使用京都基因和基因组百科全书(KEGG)路径数据库分析了lncrna的预测靶基因(图)。6b)。最高代表的途径包括光合作用(KO00195)和氧化磷酸化(KO00190)。
LNCRNA和TFS的相关分析
因为TFS在叶子颜色突变基因网络中发挥重要作用,所以通过LNCRNA和TFS的相关性分析,我们鉴定了包括MYB相关的,BHLH,HSF和其他的TFS。为了进一步揭示Dels的潜在功能,我们观察了每个LNCRNA的多对LNCRNA-TF关系。每个LNCRNA-TF关系是富集多个MRNA的结果。结果表明,这些连接构成的整个网络被分成三个集群,包括一个大型网络和两个相对较小的网络(图。7一种)。在本研究中,我们确定TCons_00007638(LNCRNA)与oniva02g03520.1(MYB相关的TF)和其他其他MRNA相互作用。七个DEL,10个MRNA和一个TF具有相对复杂的交互网络(图。7一种)。此外,我们还专注于银杏中LNCRNA针对的TFS。共有8个DEL和68 TFS具有交互网络(图。7b)。Oniva02G03520.1(MYB相关的TF)和29个不同的LNCRNA具有交互网络。ITR_SC000748.1_G00024.1(MYB相关TF)和TCONS_00011938,RRC14701_P1(HSF TF)和TCONS_00002911和SMIL_00011498-RA_SALV(BHLH TF)和TCONS_00012957具有交互网络。
讨论
lncrna在多种生物过程中发挥着重要作用,近年来被广泛研究[12.,15.,28.,29.].然而,lncrna在银杏叶色突变和色素形成的背景下仍然知之甚少。叶色突变是由一系列相互作用的基因和通路网络协调的色素形成的结果。在这里,我们构建了DELs和DEGs的共表达网络,预测了lncrna的靶基因,并在叶色突变叶片中进行了相关功能研究。我们的研究不仅丰富了lncrna的知识,也为lncrna在植物中的潜在功能提供了新的见解。这些RNA-seq数据可能为黄叶银杏的选育和生产提供分子靶点。
转录组分析的生物信息学技术已经迅速改善,并且在植物中已经确定了许多LNCRNA。例如,在挪威云杉中发现了9686年的LNCRNA [30.].几项研究表明,LNCRNA类似于MRNA编码蛋白,但LNCRNA转录物的数量低于mRNA转录物的数量,并且LNCRNA通常存在于细胞核中[31,32].我们的研究证实了Cui等人。[33“发现银杏叶中的LNCrNA表达水平比编码基因的长度越来越短。以前的研究报告了类似的结果[31,32],这个结论在植物中是普遍的[33].这些常见因素可能表明在生长,发展和进化期间LNCRNA的基本调节[28.].此外,银杏lncrna的外显子(多为两个外显子)比编码基因少,这可能是其进化和功能差异的原因。这一结果与被子植物杨树和裸子植物挪威云杉相似[30.,34].LNCRNA通常大于200的核苷酸长度,而在该银杏研究中,只有3%的LNCRNA均为1kb。在玉米中的LNCRNA研究中观察到类似的病症[35].这表明植物中存在少量的长LNCRNA。
RNA不仅在遗传信息的中间载体中播放辅助作用,而且在各种监管职能中发挥作用。LNCRNA基本上是RNA,一种由核苷酸组成的长链,这可以通过各种作用机制影响真核生物的生物活性[5,7].由于LNCRNA的功能是高度复杂和多样的,与可以提供潜在功能信息的mRNA序列不同,LNCRNA的序列序列通常不提供预测LNCRNA功能的信息[9,32].然而,LNCRNA可以调节基因表达CIS.——或者反式- 处理方式[36].通过作用于相邻的靶基因,实现了LNCRNA在基因表达中的调节作用,并且称为LNCRNA的顺式作用过程[37,38,39].转座子可以作为调控相邻基因表达的重要手段CIS.-元素 [40].为了进一步分析LNCRNA函数,我们在100 kB范围内获得了72个靶基因的48个液;因此,这些72个靶基因可能由DEL调节。因为这反式-作用lncrna在独立位点调控基因表达[41在本研究中,31 Dels调节了31种不同的靶基因,这参与了颜料形成过程,并且可能是叶子颜色突变的重要原因。此外,几项研究表明,LNCRNA坐标MIRNA,形成多种前馈通路以调节一系列靶基因[42,43].例如,一些lncrna可以作为mirna的前体[44].有研究提出,lncrna也可能作为miRNA的一级转录本、靶标或靶拟态,为调控miRNA活性提供了一种新的机制[45,46,47].因此,LNCRNA和miRNA前体之间的相关性的鉴定和分析将有助于阐明调节过程[43].这些结果也将有助于探索相应的lncrna的功能[48].我们检测到六个新的LNCRNA作为本研究中鉴定的已知miRNA的前体,这为随后的叶子颜色突变进行了基础。
LNCRNA可以通过各种机制参与基因表达的调节[49,50,51].一些lncrna可以通过与它们的靶标结合或相互作用来调节mrna [28.,52].这可能是直接调节LNCRNA与启动子区或其他的结果CIS.- 其共同抑制蛋白质编码基因的元素[53].为了研究银杏lncrna是否具有与靶序列相互作用的潜力,我们对其进行了GO和KEGG分析CIS.- 和反式- Lncrnas的点。结果表明,叶绿体囊体膜子类别最富集在CC类别中,光合作用途径(KO00195)最富含Kegg途径分析。叶绿体囊体膜亚类别高度富集,这可能导致绿色缺乏叶片颜色或导致异常的叶子颜色[54].叶绿素是与光合作用有关的重要色素,叶子颜色变化与颜料合成密切相关[26.,48].这表明,叶色变化的复杂机制需要一个协调的转录后基因表达调控网络[55].虽然色素合成可能是一种多因子表型性状,但只有少数调控色素合成的途径已被验证[28.,56],而我们对lncRNA在色素合成中的作用的了解非常有限[57].因此,我们建立了大量的共表达模块,以揭示叶子颜色突变或色素合成的调节关系和功能。这些共表达分析暗示了LNCRNA和蛋白质编码的功能相关,特别是对于TFS(MYB相关和BHLH)。lncrnas与编码tfs的无数基因相互作用[43].先前的研究表明,转发LNCrNA Hid1与TF基因PIF 3的染色质缔合,可以在拟南芥中抑制其转录[58].几项研究表明,LNCRNA可以调节TFS的活性[59,60,61].研究表明,颜料合成中涉及的调节因素包括MYB,BHLH和WD40,其中MYB在调节花青素合成方面发挥着最重要的作用,这些作用已被证明是苹果和葡萄种类[62,63].这些结果为进一步研究植物色素的形成提供了有益的资源。
结论
在本研究中,我们通过高通量测序获得了涉及银杏叶色突变的2044个lncrna,其中包括238个del。结果表明,48CIS.-Acting del可能会调节72个目标基因和31反式-Acting del可能调节31种不同的靶基因。叶绿体上囊体膜子类别和光合作用途径(KO00195)最丰富,GO和KEGG分析。此外,32个DEL和49次构成的共存网络,8个DEL和68个TFS具有交互网络。本研究将为后续研究银杏的叶子颜色分子生物学的研究提供依据,并且还将为相关领域的其他植物进行研究。
方法
植物材料和RNA测序
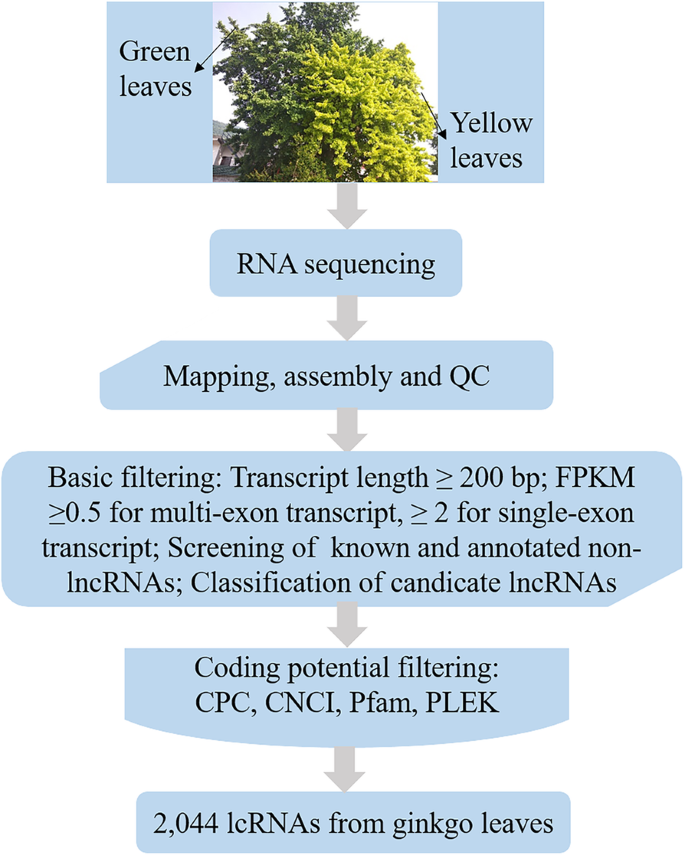
由于Ginkgo被列为红色列表中的“濒临灭绝”,我们首先获得了收集银杏和分支机构的许可。从江西省九江市的约150岁的银杏树收集植物材料(29°49'N,116°40'e)。银杏叶在树的主要分支上表现出GL和YL表型。和yl表型被鉴定为xantha突变体(银杏毕洛巴巴“万年金”由Fulang Cao教授。GL和YL突变体的表型也在附加文件中展出2:我们先前研究的图S1 [27.].此外,在南京林业大学基地的银杏苗圃中嫁接了几种GL和YL平分。这些样品完全膨胀成熟叶(没有害虫和疾病)。每组每组复制对三片叶子进行采样。如前所述,提取并纯化来自这些叶片(GL和Y1)的总RNA [23.]在illumina测序平台(Hiseq™x)中用于参考转录体测序的微小修改(银杏基因组:http://gigadb.org/dataset/100209.,[64])。
识别LNCRNA.
首先,汇集了每个重建的转录物,以产生使用Stringtie软件的转录的转录物的集合[65].然后,我们根据lncRNA的特点,采用严格的四步筛选方法获得候选lncRNA。步骤1:使用Cuffcompare软件将合并的转录本与参考转录本逐一进行比较,以明确剩余转录本的位置。通过筛选候选lncRNA转录本,保留含有“I”、“U”、“X”、“O”的转录本。第二步:筛选并保留长度大于200bp且包含2个或更多外显子的转录本。第三步:对第二步筛选的转录本进行编码能力预测和分析,剔除具有编码潜能的转录本。用于鉴定获得的lncRNA序列的软件包括CPC [66]和cnci [67],以及Pfam [68]和plek数据库[69].步骤4:对于具有已知LNCRNA的物种,第三步中获得的LNCRNA序列与已知的LNCRNA对准,使用BLASTN去除以除去重复序列。组合已知的LNCRNA序列后,进行定量分析。否则,在第三步骤中获得的LNCRNA序列直接用于定量分析。此外,将对每个样品获得的转录物合并并与使用沟槽的已知转录物进行比较。最后,通过使用最广泛使用的编码潜在分析方法进一步筛选上述候选LNCRNA,包括CPC分析,CNCI分析,PFAM蛋白域分析和PLEK分析。获得最终的LNCRNA序列统计(图。8).此外,使用INFERNAL将lncrna与Rfam数据库进行比对,并标注lncrna的家族。利用BLAST将lncrna映射到miRBase中寻找潜在的miRNA前体,选择miRNA前体覆盖率大于90%的lncrna。
表达水平标注和DEL筛选
我们以参考转录本作为文库,通过序列相似性比对的方法确定每个转录本在每个样本中的表达丰度。领结2 (70]和表达分析[71使用过。使用FPKM方法计算转录表达量[72].每个样本LNCRNA的计数数量通过DESEQ软件标准化[73,计算差倍数。读取次数的差异用负二项分布检验。最后,根据不同的多重显著性检验和差异显著性检验结果进行筛选。
del和deg coexpression分析
根据Wu等人的方法进行转录组测序组件和功能注释。(2018)[23.].为了识别DEG,通过DESEQ软件进行统计比较两组不同的组[73].具体地,通过负二项式分布和收缩估计器来测试差异表达,用于分布的方差。错误的发现率被用作阈值p- 用于多次测试以判断基因表达差异的重要性。Pearson相关性测试用于确定DEL和DEG的表达数据之间的相关性。认为具有大于0.8的相关系数和小于或等于0.05的关系对具有共表达关系。Top50用于构建共表达网络。
靶基因预测
因为lncrnas主要有一个CIS.——或者反式- 靶基因上的功能,将LNCRNA分为两种情况以预测靶基因。一方面,在上游和下游100kb中的LNCRNA附近的所有蛋白质编码基因并用LNCRNA显着共同地筛选为靶基因。另一方面,目标基因反式通过表达水平的相关性而不是位置关系来识别出来的LNCRNA。使用Go功能注释这些LNCRNA靶基因(http://geneontology.org/)和kegg(http://www.genome.jp/kegg/)数据库。基于差异表达的共表达分析的结果,选择具有不同染色体的LNCRNA和mRNA作为候选靶来提取候选序列。RNA相互作用软件RISEARP-V2.0用于预测候选LNCRNA和MRNA在核酸水平的结合。根据筛查条件,两种核酸分子之间的碱基之间的碱基的数量不小于10,基础结合的自由能不大于50;筛选的LNCRNA和mRNA可能具有直接调节。
LNCRNA和TFS的相关分析
对每个DEL计算共表达的编码基因,采用超几何分布检验方法计算每个TF条目中差异mRNA富集的显著性。计算结果返回ap- 对富集的重要性。然后,计算了LNCRNA共表达编码基因组和TF组的交叉点。使用超细分布来计算交叉路口的富集程度,并获得与LNCRNA显着相关的TFS,从而鉴定可能与LNCRNA组合起诉角色的TFS。
实时定量PCR验证
我们从转录分析结果中随机选取10个del,通过qRT-PCR进行验证。所有qRT-PCR实验均在ABI ViiA 7 Real-time PCR平台(Applied Biosystems, Carlsbad, CA, USA)上进行。所有反应均为3个重复。PCR程序参照Xu等[74]和甘油醛-3-磷酸脱氢酶基因(正向引物[5'-3']:GGTGCCAAAAAGGTGGTGTCTCAT;反向引物[5'-3']:CAACAACGAACATGGGGAGCAT作为参考基因[23.].所有lncrna引物均采用Oligo v6.0软件设计,列于附加文件中1:表S1。我们将基因的相对表达标准化为2-ΔΔct方法 [75].
数据和材料的可用性
来自Illumina测序的所有原始数据,包括LNCRNA和RNA-SEQ数据,都已在加入号SRP182122下提交到短读取归档数据库。
缩写
- BP:
-
生物过程
- CC:
-
细胞成分
- CNCI:
-
编码 - 非编码索引
- CPC:
-
编码潜在的计算器
- 可见:
-
差异化的MRNA
- 德尔:
-
差异表达的lncrna.
- FPKM:
-
每千碱基每百万次读取的片段
- 银杏:
-
银杏毕洛巴巴l
- GL:
-
正常的绿色叶子
- 走:
-
基因本体论
- 一世:
-
Intronic lncRNA
- Kegg:
-
Kyoto基因和基因组的百科全书
- Lincrna,U:
-
代际lncra.
- lncrana:
-
长非编码RNA
- MF:
-
分子功能
- ncrnas:
-
非编码RNA.
- o:
-
Sense-overlapping lncRNA
- PFAM:
-
蛋白质的家庭
- PLEK:
-
基于改进的K-MER方案的长非分量RNA和Messenger RNA的预测因子
- 存在:
-
定量实时PCR
- RNA-seq:
-
RNA序列
- SRA:
-
短读档案
- TFs:
-
转录因子
- X:
-
反义lncra.
- yl:
-
黄色的叶子
参考
- 1。
Schmitz Su,Grote P,Herrmann BG。长度非划分RNA功能在发育与疾病中的机制。细胞mol寿命。2016; 73:2491-509。
- 2。
Kornienko AE,Guenzl PM,Barlow DP,Pauler FM。长期非编码RNA转录作用的基因调节。BMC BIOL。2013; 11:59。
- 3.
圣劳伦特G,Wahlestedt C,Kapranov P.长时间非编码RNA分类的景观。趋势类型。2015; 31:239-51。
- 4.
王志强,王志强,王志强。非编码RNA对生殖发育的调控作用拟南芥例如开花或不开花。J Plant Res. 2012;
- 5.
朱茹,傅H,吴Y,郑X.LNCRNA的功能及LNCRNA-蛋白质相互作用的方法。科学生中国生活SCI。2013; 56:876-85。
- 6.
GIBB EA,棕色CJ,LAM WL。长期非编码RNA在人癌中的功能作用。莫癌。2011; 10:38。
- 7.
Marchese FP,Raimondi I,Huarte M.长不用RNA功能的多维机制。基因组Biol。2017年; 18:206。
- 8.
MA L,BAJIC VB,张Z.关于长期非编码RNA的分类。RNA Biol。2013; 10:924-33。
- 9.
王克,张清。长度非编码RNA的分子机制。Mol细胞。2011; 43:904-14。
- 10。
张勇,杨丽,陈丽丽。没有尾巴的生命:长非编码rna的新格式。国际生物化学杂志。2014;54:338-49。
- 11.
Okazaki Y,Furuno M,Kasukawa T,Adachi J,Bono H,Kondo S等人。基于函数注释的60,770全长CDNA的小鼠转录组分析。自然。2002; 420:563-73。
- 12.
刘j,jung c,xu J,王H,邓S,伯尔尼德L等。基因组 - 宽分析揭示了长期性非数性RNA的调节拟南芥.植物细胞。2012; 24:4333-45。
- 13.
Lv Y,Liang Z,Ge M,Qi W,张T,Lin F等。玉米氮响应性癌症和内肠长非编码RNA的基因组识别和功能预测(玉米l .)。BMC基因组学。2016;17:350。
- 14.
李丹,邵峰,卢胜萨尔维亚米尔蒂希萨.Planta。2015; 241:1131-43。
- 15.
刘S,Sun Z,徐M.杨树不定根形成和发展中长期非编码RNA的鉴定与表征。indacrops产品。2018; 118:334-46。
- 16.
Huanca-Mamani W,Arias-Carrasco R,Cárdenas-ninasivincha S,Rojas-Herrera M,Sepúlveda-hermosilla G,Caris-Maldonado J,等人。从阿塔卡马沙漠的超干旱Lluteño玉米响应盐和硼胁迫的长期非编码RNA。基因。2018; 9:E170。
- 17.
rinn jl,chang hy。长度非编码RNA的基因组调控。annu rev biochem。2012; 81:145-66。
- 18.
Tang T-H,Polacek N,Zywicki M,Huber H,Brugger K,Garrett R等人。鉴定新型非编码RNA作为Archaeon中的潜在反义调节因子Sulfolobus solfataricus..mol microbiol。2005; 55:469-81。
- 19.
周Z,郑S。银杏演变的缺失链接。自然。2003; 423:821-2。
- 20。
郭继,吴y,王b,鲁y,cao f,王g。施肥对施肥对生长和生理特性的影响银杏毕洛巴巴l .森林。2016;7:293。
- 21。
乳房F,Huang X,Lyles JT,Quave Cl。验证16世纪中药的使用银杏毕洛巴巴作为局部抗菌剂。Microbiol前面。2019;10:775。
- 22。
王濛J, B, G,王Y,唐X,王年代,et al。结合转录组学的代谢组学揭示了苯丙素代谢通量的重定向银杏毕洛巴巴.JAgric Food Chem。2019; 67:3284-91。
- 23。
吴y,guo j,周q,xin y,wang g,xu l-a。de novo转录组分析显示,参与黄酮类生物合成,运输和调控的基因银杏毕洛巴巴.2018; 124:226-35。
- 24。
吴勇,周强,黄胜,王刚,徐兰安。单核苷酸多态性的发展和多样性分析银杏毕洛巴巴基于转录组测序。树木。2019;33:587 - 97。
- 25.
周强,穆科,徐敏,马旭,倪震,王军,等。不同地理居群银杏叶主要次生代谢物浓度的变化森林。2017;8:266。
- 26.
李文祥,杨树波,卢震,何志超,叶永林,赵碧波,等。金叶着色的细胞学、生理学和转录组分析银杏毕洛巴巴L. Hortic Res。2018; 5:18。
- 27.
刘X,yu w,王g,cao f,cai j,王h.对比蛋白质组学和生理学分析揭示了Xantha突变体中叶着色和碳固定的变化机制银杏毕洛巴巴L. Int J Mol Sci。2016; 17:E1794。
- 28.
冯丹,李强,余辉,孔林,杜胜Crassostrea Gigas.以及它们与贝壳色素沉着的关系。Sci众议员2018;8:1436。
- 29.
王X,AI G,张C,Cui L,王J,Li H,等。表达和多样化分析揭示了转产元在起源中起重要作用Lycopersicon番茄中特异性的lncrnas。新植物。2016; 209:1442-55。
- 30。
Nystedt B, Street NR, Wetterbom A, Zuccolo A, Lin Y-C, Scofield DG,等。挪威云杉基因组序列和针叶树基因组进化。大自然。2013;497:579 - 84。
- 31。
Kour S,Rath PC。衰老和年龄相关疾病中的长期非编码RNA。老化res rev. 2016; 26:1-21。
- 32。
长链非编码rna的进化与功能。细胞。2009;136:629-41。
- 33。
崔J,赵杰,赵家,徐H,王L,Jin B.在血管舞蹈阶段从休眠阶段到积极阶段的血管壁过渡期间的细胞学和miRNA表达改变银杏毕洛巴巴l .树。2016;30:2177 - 88。
- 34。
田伙子,宋y,du q,杨x,ci d,chen j等。胃肠杆菌素响应性长期非编码RNA的群体基因组分析杨树.J Exp Bot。2016; 67:2467-82。
- 35。
Li L,Eichten SR,Shimizu R,Petsch K,Yeh C-T,Wu W等人。玉米长期非编码RNA的基因组发现与表征。基因组Biol。2014; 15:R40。
- 36。
FITICA A,Bozzoni I.长期非编码RNA:细胞分化和开发的新玩家。NAT Rev Genet。2014; 15:7-21。
- 37.
Marquardt S,Raitskin O,Wu Z,Liu F,Sun Q,Dean C.剪接反义转录核心对FLC转录的功能后果。Mol细胞。2014; 54:156-65。
- 38.
吴X,shi t,iqbal s,zhang y,liu l,gao z. GAO Z. GAO Z. GEANOMIS-WING CONFIGUR LONG NO.COMING RNA的基因组广泛发现与表征李春万.BMC植物BIOL。2019; 19:64。
- 39.
王磊,夏旭,姜浩,陆志强,崔建军,曹飞,等。新lncrna的全基因组鉴定和特征银杏毕洛巴巴.树木。2018;32:1429-42。
- 40。
Kunarso G,Chia N-Y,Jeyakani J,Hwang C,Lu X,Chan Y-S等人。可转换元素重新加快人胚胎干细胞的核心调节网络。NAT Genet。2010; 42:631-4。
- 41。
李某,yu x,雷n,程z,赵p,他。基因组识别和冷和/或干旱响应LNCRNA的功能预测木薯.SCI批准。2017; 7:45981。
- 42。
Braconi C,Kogure T,Valeri N,Huang N,Nuovo G,Costinean S等人。MicroRNA-29可以调节肝细胞癌中长的非编码RNA基因MEG3的表达。oncogene。2011; 30:4750-6。
- 43。
冯SJ,张XD,刘奇,谭SK,楚SS,蒙杰,等。镉毒性反应中长期非编码RNA的表征芸苔栗鸟.RSC放置2016;6:82157 - 73。
- 44。
Valli A, Todesco M, Mateos I, Puga MI, Rubio-Somoza I,等。靶拟态为调控microRNA活性提供了一种新的机制。Nat麝猫。2007;39:1033-7。
- 45。
Geisler S,Coller J.RNA在意外的地方:长期非编码RNA在不同的细胞环境中起作用。NAT Rev Mol Cell Biol。2013; 14:699-712。
- 46。
张y-c,陈y-q。长时间的RNA:植物开发中的新调节因子。Biochem Biophys Res Communce。2013; 436:111-4。
- 47。
陈米,王C,宝H,陈H,王Y.在氮缺乏下杨树新型LNCRNA的基因组鉴定与表征。Mol Gen Genomics。2016; 291:1663-80。
- 48。
张克,陈德,张特,段A,张j,他C.转录组和功能分析揭示了在海鼠果实成熟期间长期非编码RNA在花青素生物合成中的作用。DNA Res。2018; 25:465-76。
- 49。
阿德尔曼·K,伊根·e更多地利用基因组垃圾。大自然。2017;543:183-5。
- 50。
Kung Jte,Colognori D,Lee JT。长期非编码RNA:过去,现在和未来。遗传学。2013; 193:651-69。
- 51。
太阳M,Kraus WL。从发现起作用:长不用RNA在生理学和疾病中的扩展作用。EndoCr Rev. 2015; 36:25-64。
- 52。
刘家,王H,Chua N-h。长度非编码RNA转录组植物。植物Biotechnol J. 2015; 13:319-28。
- 53。
Deamorges J,Reis Rs,Jacquet P,Sheppard S,Gadekar VP,Hart-Smith G等人。CIS-天然反义RNA的同源感测误差控制。植物理性。2019; 180:305-22。
- 54。
李Y,张Z,王P,王SA,MA L,LI L等。综合转录组分析发现了与叶子颜色相关的新型候选基因Lagerstroemia籼黄叶突变体。基因染色体组。2015;37:851 - 63。
- 55。
Chen L-L,Carmichael GG。解码核长期非编码RNA的功能。CurrOgin Cell Biol。2010; 22:357-64。
- 56。
任浩,王光国,陈丽,姜军,刘丽,李宁,等。山羊皮肤色素沉积早期长链非编码rna的全基因组分析(Capra Hircus.).BMC基因组学。2016; 17:67。
- 57。
KOCH L.筛选LNCRNA功能。NAT Rev Genet。2017年; 18:70。
- 58。
王Y,风扇X,林F, G, Terzaghi W,朱D, et al。拟南芥非编码RNA介导红光对光形态建成的调控。中国科学技术大学学报(自然科学版)2014;111:10359-64。
- 59。
Martianov I,Ramadass A,Barros As,Chow N,Akoulitchev A.非编码干扰转录物的抑制人二羟氢醇还原酶基因。自然。2007; 445:666-70。
- 60.
Shamovsky I,Ivannikov M,Kandel Es,Gershon D,Nudler E.RNA介导对哺乳动物细胞的热休克的反应。自然。2006; 440:556-60。
- 61。
Willingham At,Orth Ap,Batalov S,Peters Ec,Wen BG,AZA-Blanc P等人。探测非编码RNA功能的策略发现了NFAT的阻遏物。科学。2005; 309:1570-3。
- 62。
Chagne D,Lin-Wang K,Espley RV,Volz RK,NM,Rouse S等人古代复制的苹果MYB转录因子负责新的红果肉表型。植物理性。2013; 161:225-39。
- 63。
陈志强,陈志强,陈志强,等。转录因子VvMYB5b参与调控葡萄果实中花青素和原花青素的生物合成。植物杂志。2008;147:2041-53。
- 64。
关鲁,赵y,张h,风扇g,刘x,周w等。生活化石的基因组草案银杏毕洛巴巴.GigaScience。2016; 5:49。
- 65。
Pertea M,Pertea gm,Antonescu Cm,Chang T-C,Mendell JT,Salzberg SL。Stringtie使得能够从RNA-SEQ读取改进转录组的重建。NAT BIOTECHNOL。2015; 33:290-5。
- 66。
康y-j,杨d-c,kong l,hou m,meng y-q,wei l等。CPC2:基于序列固有特征的快速准确的编码电位计算器。核酸RES。2017; 45:W12-6。
- 67。
李洪波,李洪波,李洪波,等。序列比对/映射(SAM)格式和sam工具。移植Proc。2009;19:1653-4。
- 68。
关键词:SNP,突变发现,关联图谱,遗传参数估计生物信息学。2011;27:2987 - 93。
- 69。
Cingolani P,Platts A,Wang LL,Coon M,Nguyen T,Wang L等。用于注释和预测单核苷酸多态性,SNPEFF的效果的程序。飞(奥斯汀)。2012; 6:80-92。
- 70.
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9:357-9。
- 71.
Roberts A,Pachter L.流媒体片段分配,用于测序实验的实时分析。NAT方法。2013; 10:71-3。
- 72.
Roberts A,Trapnell C,Donaghey J,RINN JL,Pachter L.通过校正片段偏压来提高RNA-SEQ表达估计。基因组Biol。2011; 12:R22。
- 73。
Anders S,Huber W.在基因水平的RNA-SEQ数据的差异表达 - DESEQ包。欧洲分子生物学实验室:德国海德堡;2012年。
- 74。
徐明,陈晨,蔡华,吴林。过表达PeHKT1;1提高杨树耐盐性。基因。2018;9:475。
- 75。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25:402-8。
致谢
不适用。
资金
本研究得到了公共福利森林科学研究特别基金(201504105),江苏省农业科技自主创新基金(CX(16)1005),中国国家重点研发方案(2017YFD0600700)),江苏省研究生研究与实践创新计划(KYCX18_0954),江苏高等教育机构的优先学术计划发展(PAPD)。资金机构为研究项目(实验成本和出版费用)提供了财务支持,但资助者并不涉及实验设计,数据分析或稿件的准备。
作者信息
隶属关系
贡献
GW和FC构思和设计了该项目。YW和JG参与了数据分析。yw起草了手稿。TW和GW修改的手稿。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
从江西省九江市的银杏树收集植物材料。国家林业管理银杏工程技术研究中心允许采样。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
吴,Y.,Guo,J.,Wang,T.et al。与叶片颜色突变相关的长非编码RNA的转录分析银杏毕洛巴巴L.BMC植物杂志19,527(2019)。https://do.org/10.1186/s12870-019-2141-z.
已收到:
接受:
发表:
关键字
- 叶片突变
- 差异表达的lncrna.
- 目标基因
- 功能分析