- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
比较代谢组学分析揭示了三种植物中紫杉类和黄酮类化合物的差异GydF4y2Ba水松GydF4y2Ba物种GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba文章编号:GydF4y2Ba529GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
属乔木GydF4y2Ba水松GydF4y2Ba是非常有价值的药用植物,对各种癌症治疗具有多种药理作用。紫杉醇的GydF4y2Ba水松GydF4y2Ba乔木是一种高效、广泛应用的抗癌药物,但其积累的紫杉类和其他活性成分在不同的植物中有很大差异GydF4y2Ba水松GydF4y2Ba物种。在我们的研究中,三种代谢组GydF4y2Ba水松GydF4y2Ba对物种进行了调查。GydF4y2Ba
结果GydF4y2Ba
使用非靶向方法共鉴定了2246个代谢物,归属于各种初级和次级代谢途径。差异累积代谢物分析鉴定为358个GydF4y2Bat .媒体GydF4y2Ba- - - - - - 220GydF4y2Bat . cuspidataGydF4y2Ba,, 169GydF4y2Bat . maireiGydF4y2Ba- 特异性累计代谢物。通过搜索代谢物池,检测到7个MEP途径前体,11个中间体,侧链产品和紫杉醇的侧链产品和紫杉醇本身的衍生物。大多数前体,发起的中间体高度累积GydF4y2Bat . maireiGydF4y2Ba,大多数接近紫杉醇生物合成途径终点的中间产物主要积累于GydF4y2Bat . cuspidataGydF4y2Ba和GydF4y2Bat .媒体GydF4y2Ba.我们的数据表明,紫杉醇在GydF4y2Bat . cuspidataGydF4y2Ba和GydF4y2Bat .媒体GydF4y2Ba相比之下,在GydF4y2Bat . maireiGydF4y2Ba.作为一种重要的活性成分GydF4y2Ba水松GydF4y2Ba树木,大多数黄酮类化合物主要累积在GydF4y2Bat . maireiGydF4y2Ba而不是GydF4y2Bat .媒体GydF4y2Ba和GydF4y2Bat . cuspidataGydF4y2Ba.通过靶向方法确定了几种选定的紫杉类和黄酮类化合物的差异。GydF4y2Ba
结论GydF4y2Ba
系统相关分析确定了一些与紫杉醇生物合成相关的代谢物,表明类黄酮代谢和类星体积累之间存在潜在的负相关关系。研究紫杉类及其他活性成分的变异,将为进一步了解紫杉类的种间差异积累提供依据,并为促进最高产量树种的选育和资源利用提供机遇。GydF4y2Ba
背景GydF4y2Ba
紫杉醇(通用名紫杉醇)是紫杉醇的主要生物活性成分GydF4y2Ba水松GydF4y2Ba广泛用于治疗各种癌症的品种,如卵巢癌、乳腺癌和鳞状癌[GydF4y2Ba1GydF4y2Ba].自1992年批准用于卵巢癌治疗以来,紫杉醇及其衍生物的需求不断增加[GydF4y2Ba2GydF4y2Ba].紫杉醇类化合物含量低、自然资源枯竭和纯化损失率高是制约紫杉醇供应增加的主要因素。因此,提取其类似物和/或衍生物是在工业水平上生产紫杉醇的另一种经济解决方案[GydF4y2Ba3.GydF4y2Ba].GydF4y2Ba
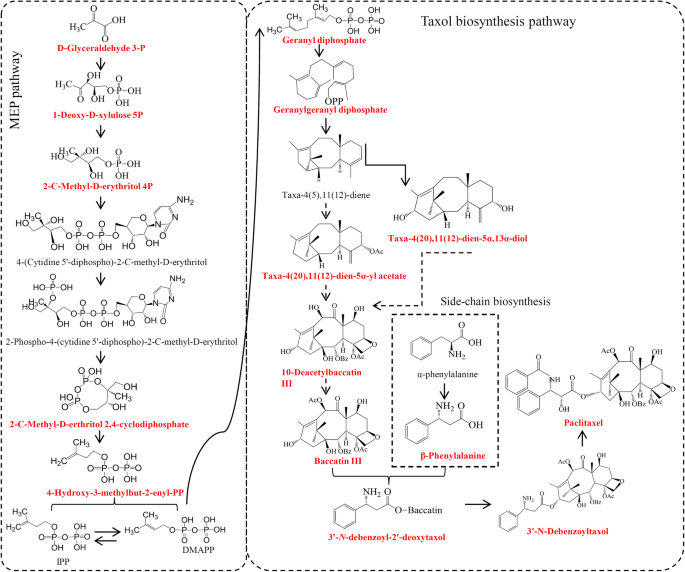
通过增加对紫杉醇生物合成途径的了解,紫杉醇和其他taxoids的生产得以改善,因此该途径成为许多研究的主要对象[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].整个紫杉醇生物合成途径产生了紫杉醇的大量前体,中间体和衍生物[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba].首先,合成了二萜紫杉烷芯香叶基香叶基二磷酸(GGPP)前体GydF4y2Ba5.GydF4y2Ba类异戊二烯前体异戊烯基二磷酸(IPP)和一个单元二甲基烯丙基二磷酸(DMAPP),由质体2- c -甲基- d -赤四醇磷酸(MEP)途径提供[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].关键酶紫杉二烯合成酶(TS)催化GGPP生成紫杉烷骨架taxane taxane -4(5),11(12)-diene [GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba].然后,一系列的羟基化,乙酰化和GydF4y2BaNGydF4y2Ba紫杉烷骨架的-苯甲酰化反应在紫杉醇合成途径中产生了许多中间体。例如,10-去乙酰baccatin-III (10-DAB)的乙酰化产生baccatin III,一种紫杉醇生物合成的高级中间体[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba].将C13侧链的组装附加到Baccatin III(BAC)形成GydF4y2BaNGydF4y2Ba-去苯甲酰-2 ' -脱氧紫杉醇被认为是紫杉醇生物合成途径的最后一步[GydF4y2Ba13.GydF4y2Ba].GydF4y2Ba
除紫杉醇外,该属不同种属中还含有500多种紫杉醇次生代谢产物GydF4y2Ba水松GydF4y2Ba[GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba15.GydF4y2Ba那GydF4y2Ba16.GydF4y2Ba].例如,紫杉醇和三种相关的taxoids, 10-DAB III, BAC和cephalomannine,从针中提取GydF4y2Ba水松cuspidataGydF4y2Ba那GydF4y2BaTaxus chinensis.GydF4y2Ba,GydF4y2Ba水松媒体GydF4y2Ba[GydF4y2Ba17.GydF4y2Ba].在GydF4y2Ba水松maireiGydF4y2Ba,大多数已知的鲍拓也由高效液相色谱 - 串联质谱(HPLC-MS / MS)测定[GydF4y2Ba18.GydF4y2Ba].此外,三种新的紫杉醇类群和三种已知的紫杉醇类群从紫杉醇种子中分离得到GydF4y2Bat . cuspidataGydF4y2Ba[GydF4y2Ba19.GydF4y2Ba].所有GydF4y2Ba水松GydF4y2Ba物种产生紫杉醇;然而,积累的类星体的水平可能有显著差异[GydF4y2Ba20.GydF4y2Ba].一项对类星体浓度的大规模分析表明,没有一个物种的所有代谢物含量最高[GydF4y2Ba21.GydF4y2Ba].GydF4y2Ba
非靶向代谢组为系统分析初级和次级代谢产物以及鉴定植物中潜在的未知化合物提供了良好的机会[GydF4y2Ba22.GydF4y2Ba].在里面GydF4y2Ba水松GydF4y2Ba属,第一个代谢组学分析发表于2003年,分析的代谢物GydF4y2Bat .媒体GydF4y2BaMeJA处理诱导的培养物[GydF4y2Ba23.GydF4y2Ba].采用LC-IT-TOF-MS代谢组学方法,研究了菊科植物培养苗中类生物合成的变化GydF4y2Bat . maireiGydF4y2Ba[GydF4y2Ba24.GydF4y2Ba].最近,一种整合的蛋白质组学/代谢组学方法显示,短期高剂量紫外线a辐射可增加紫杉醇的产量GydF4y2Bat . maireiGydF4y2Ba[GydF4y2Ba25.GydF4y2Ba].GydF4y2Ba
近年来,大规模鉴定代谢产物的技术进展揭示了调节植物代谢的复杂过程[GydF4y2Ba26.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].到目前为止,在GydF4y2Ba水松GydF4y2Ba已经确定了具有不同水平水平的Genus,14种和品种[GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba29.GydF4y2Ba].研究类群和其他代谢物的变异将为我们加速高产物种的培育提供机会。GydF4y2Ba
结果GydF4y2Ba
不同红豆杉属植物代谢组的非目标代谢物分析GydF4y2Ba
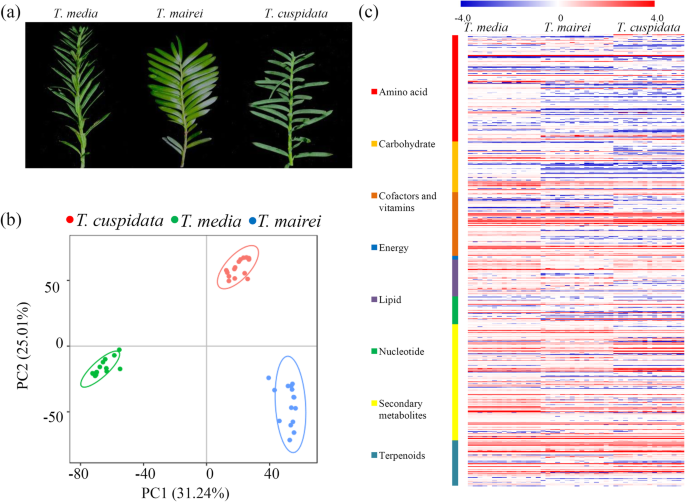
探讨不同植物代谢组的综合变异GydF4y2Ba水松GydF4y2Ba采用非靶向方法(每组15个重复),从8712个离子中鉴定出2246个代谢物,相对标准偏差< 30%(附加文件GydF4y2Ba1GydF4y2Ba).类似于树枝形态的差异,不同的代谢物变异GydF4y2Ba水松GydF4y2Ba还观察了物种(图。GydF4y2Ba1GydF4y2Baa).为质量检查,生成总离子色谱图,表明样品制备符合通用标准(附加文件)GydF4y2Ba2GydF4y2Ba).为了获得代谢变化的概述,进行了PCA, PC1和PC2代谢组分析中解释值的百分比分别为25.01和31.24%。PCA数据显示了三个明显分离的样本组,表明了三种不同物种之间的分离(图。GydF4y2Ba1GydF4y2Bab)。基于其Kegg注释,预计747种代谢物参与各种主要代谢途径,包括氨基酸 - ,碳水化合物,辅因子和维生素,能量,脂质,核苷酸,次级代谢物和萜类相关的途径(图。GydF4y2Ba1GydF4y2BaC和附加文件GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
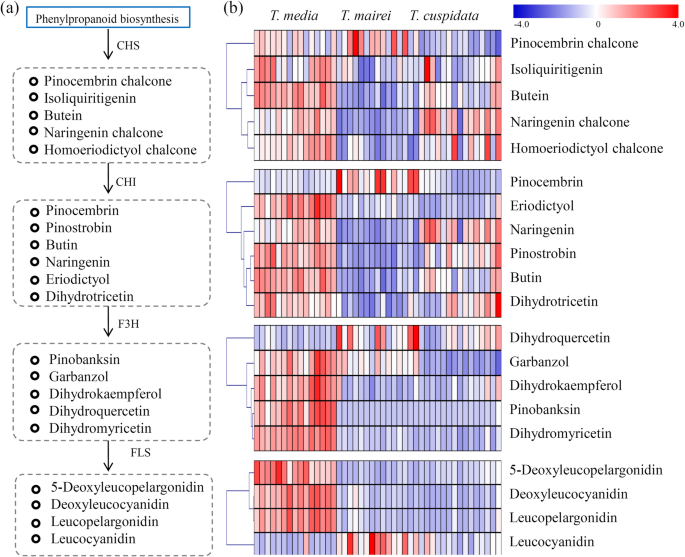
非靶向代谢物分析鉴定了被测试的代谢物GydF4y2Ba水松GydF4y2Ba树木。GydF4y2Ba一种GydF4y2Ba一张照片GydF4y2Bat .媒体GydF4y2Ba那GydF4y2Bat . maireiGydF4y2Ba和GydF4y2Bat . cuspidataGydF4y2Ba在温室条件下。从三个栽培中收获新鲜的树枝GydF4y2Ba水松GydF4y2Ba物种。GydF4y2BaB.GydF4y2Ba三种不同物种样本的主成分分析数据。红点表示样本来自GydF4y2Bat . cuspidataGydF4y2Ba;绿色的点表示样本来自GydF4y2BaT.媒体;GydF4y2Ba蓝色的斑点表示样本来自GydF4y2Bat . maireiGydF4y2Ba.GydF4y2BaCGydF4y2Ba根据京都基因和基因组百科全书路径,在三个代谢组中发现的代谢物的热图GydF4y2Ba水松GydF4y2Ba物种(GydF4y2BaNGydF4y2Ba= 15)。热图比例尺范围为−4 ~ + 4GydF4y2Ba2GydF4y2Ba规模GydF4y2Ba
差异累积代谢物的聚类GydF4y2Ba
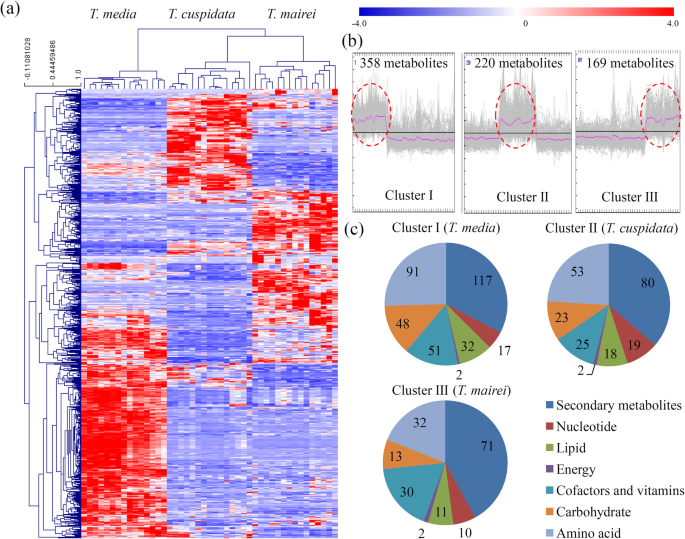
将所有注释的代谢物聚类,以鉴别三者之间的差异累积代谢物(dam)GydF4y2Ba水松GydF4y2Ba物种(图。GydF4y2Ba2GydF4y2Baa).所有的大坝被分成三个组:I, II和III。的GydF4y2Bat .媒体GydF4y2Ba主要积累的代谢物分为簇I(358个代谢物)和簇I(358个代谢物)GydF4y2Bat . cuspidataGydF4y2Ba聚类II(220个代谢物)GydF4y2Bat . maireiGydF4y2Ba主要积累的代谢物被归为聚类III(169个代谢物)(图3)。GydF4y2Ba2GydF4y2Bab)。我们的数据显示,属于“次级代谢物”,“脂质”,“辅助胶囊和维生素”,“碳水化合物”和“氨基酸”的水坝主要累积在GydF4y2Bat .媒体GydF4y2Ba(无花果。GydF4y2Ba2GydF4y2BaC)。群集我(GydF4y2Bat .媒体GydF4y2Ba由117种次级代谢产物、91种氨基酸、51种辅助因子和维生素、48种碳水化合物、32种脂类、17种核苷酸和2种能量相关代谢产物组成;聚类II由80种次级代谢产物、53种氨基酸、25种辅助因子和维生素、23种碳水化合物、18种脂类、19种核苷酸和2种能量相关代谢产物组成;簇III由71种次级代谢物、32种氨基酸、30种辅助因子和维生素、13种碳水化合物、11种脂类、10种核苷酸和2种能量相关代谢物组成(图1)。GydF4y2Ba2GydF4y2BaC)。GydF4y2Ba
为了全面了解这些变化,我们将所有的水坝分为不同的已知代谢途径。总共有32、29和38条主要途径富集GydF4y2Bat . maireiGydF4y2BavsGydF4y2Bat . cuspidataGydF4y2Ba(附加文件GydF4y2Ba4.GydF4y2Ba),GydF4y2Bat .媒体GydF4y2BavsGydF4y2Bat . maireiGydF4y2Ba(附加文件GydF4y2Ba5.GydF4y2Ba),GydF4y2Bat .媒体GydF4y2BavsGydF4y2Bat . cuspidataGydF4y2Ba(附加文件GydF4y2Ba6.GydF4y2Ba)比较。有趣的是,在每次比较中,“二萜生物合成”途径中富集的水坝数量最多。GydF4y2Ba
三种类星体丰度的差异GydF4y2Ba水松GydF4y2Ba物种GydF4y2Ba
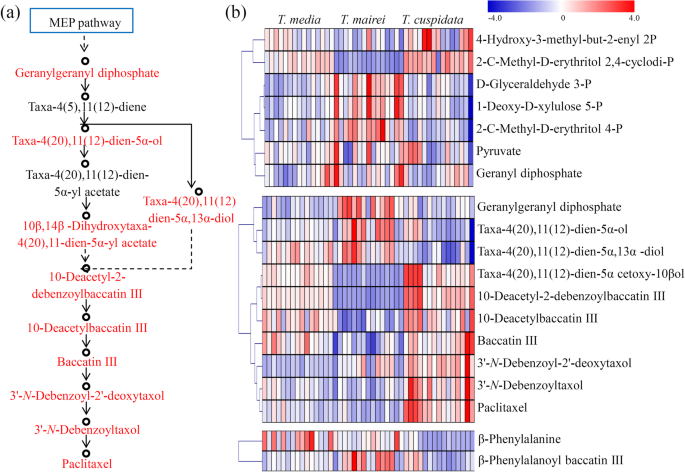
紫杉醇生物合成是一种复杂的代谢途径,涉及许多前体、中间体和衍生物[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].通过搜索代谢产物库,检测到MEP途径的7个前体、9个中间体和衍生物、2个侧链产物和紫杉醇(图)。GydF4y2Ba3.GydF4y2Baa). MEP途径中主要积累了d -甘油醛3-磷酸、1-脱氧-d -木糖5-磷酸、2- c -甲基-d -赤藓糖醇4-磷酸等前体GydF4y2Bat . maireiGydF4y2Ba.2-羟基-3-甲基-丁-2-烯基二磷酸和2- c -甲基- d -赤藓糖醇2,4-环二磷酸两种前体明显富集GydF4y2Bat . cuspidataGydF4y2Ba.中间体及衍生物中,GGPP、Taxa-4(20)、11(12)-dien-5α-ol和Taxa-4(20)、11(12)-dien-5α、13α-diol主要富集在GydF4y2Bat . maireiGydF4y2Ba;Taxa-4(20)、11(12)-dien-5α cetoxy-10β ol、10-Deacetyl-2-debenzoylbaccatin III、10-Deacetylbaccatin III和Baccatin III含量最高GydF4y2Bat . maireiGydF4y2Ba和GydF4y2Bat .媒体GydF4y2Ba;和3 ' -GydF4y2BaNGydF4y2Ba-debenzoyl-2'-脱氧氧吡酚,3'-GydF4y2BaNGydF4y2Ba-去苯甲酰紫杉醇、紫杉醇主要积聚于GydF4y2Bat . cuspidataGydF4y2Ba.对于侧链产物,β-苯丙氨酸高度积累GydF4y2Bat .媒体GydF4y2Baβ-Phenylalanoyl baccatin III积累较多GydF4y2Bat . maireiGydF4y2Ba(无花果。GydF4y2Ba3.GydF4y2Bab)。包括完整的生物合成途径,包括阐释和推定的步骤,总结在图1中。GydF4y2Ba4.GydF4y2Ba.重点介绍了我们研究中确定的所有紫杉烷前体。GydF4y2Ba
三种植物中类黄酮含量的差异GydF4y2Ba水松GydF4y2Ba物种GydF4y2Ba
在类黄酮生物合成途径中,鉴定了查尔酮合成酶(CHS)合成的5个中间产物,查尔酮异构酶(CHI)合成的6个中间产物,黄酮3-羟化酶(F3H)合成的5个中间产物,黄酮醇合成酶(FLS)合成的4个中间产物(图)。GydF4y2Ba5.GydF4y2Ba一种)。对于CHS合成的黄酮类化合物,Pinocembrin Chalcone高度积累GydF4y2Bat . maireiGydF4y2Ba、异甘草素、丁二醇查尔酮主要聚集在GydF4y2Bat .媒体GydF4y2Ba,柚皮素查尔酮在两者中大大积累GydF4y2Bat .媒体GydF4y2Ba和GydF4y2Bat . cuspidataGydF4y2Ba.在chi合成的黄酮类化合物中,只有皮诺曹蛋白高度积累GydF4y2Bat . maireiGydF4y2Ba,ERIODICTYOL和丁丁在很大程度上累积在两者中GydF4y2Bat .媒体GydF4y2Ba,柚皮素,豆素蛋白和二氢素主要累积在两者中GydF4y2Bat .媒体GydF4y2Ba和GydF4y2Bat . cuspidataGydF4y2Ba.f3h合成的黄酮类化合物主要富集于GydF4y2Bat .媒体GydF4y2Ba,但二氢槲皮素除外。fls合成的黄酮类化合物中,5-脱氧白桔梗素、脱氧白桔梗素、白桔梗素积累较多GydF4y2Bat .媒体GydF4y2Ba,而白花青素在GydF4y2Bat . maireiGydF4y2Ba(无花果。GydF4y2Ba5.GydF4y2Bab)。GydF4y2Ba
用有针对性的方法确认紫杉醇及其衍生物的变异GydF4y2Ba
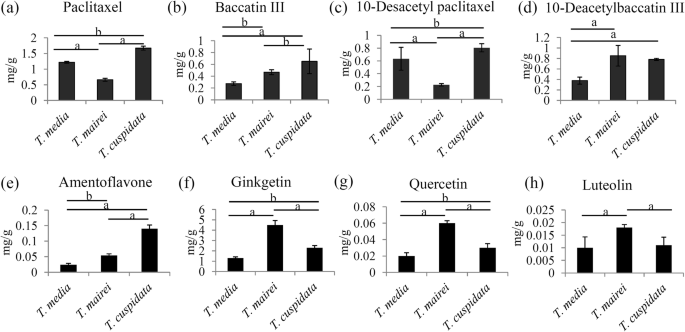
以更准确地确定三者间的类群差异GydF4y2Ba水松GydF4y2Ba采用靶向方法测定紫杉醇、10-DAB III、baccatin III和10-DAP的浓度GydF4y2Ba7.GydF4y2Ba).未确定的代谢组科分析表明GydF4y2Bat . cuspidataGydF4y2Ba和GydF4y2Bat . maireiGydF4y2Ba其中紫杉醇含量最高,紫杉醇含量最低。采用可靠的紫杉醇标准进行直接定量GydF4y2Bat . cuspidataGydF4y2Ba那GydF4y2Bat .媒体GydF4y2Ba,GydF4y2Bat . maireiGydF4y2Ba包含1.67 mg.gGydF4y2Ba- 1GydF4y2Ba1.22 mg.gGydF4y2Ba- 1GydF4y2Ba, 0.66毫克GydF4y2Ba- 1GydF4y2Ba紫杉醇(图。GydF4y2Ba6.GydF4y2Baa).紫杉醇的含量顺序与非靶向代谢组结果吻合较好。其余类群中,baccatin III和10-DAP的含量均以大肠杆菌中最高GydF4y2Bat . cuspidataGydF4y2Ba(0.65 mg.gGydF4y2Ba- 1GydF4y2Ba和0.80 mg.gGydF4y2Ba- 1GydF4y2Ba,分别),10-DAB III水平最高的是在GydF4y2Bat . maireiGydF4y2Ba(0.85 mg.gGydF4y2Ba- 1GydF4y2Ba)(图。GydF4y2Ba6.GydF4y2Ba罪犯)。评估该属不同种间分类水平的变异性GydF4y2Ba水松GydF4y2Ba另一个三个GydF4y2Ba水松GydF4y2Ba物种,包括GydF4y2Bat对GydF4y2Ba那GydF4y2Bat . fuanaGydF4y2Ba和GydF4y2BaT. Yunnanensis.GydF4y2Ba,已收集。该属的类群的一个更详尽的概况已显示在附加文件GydF4y2Ba8.GydF4y2Ba.GydF4y2Ba
三种不同类型紫杉类和黄酮类化合物含量的变化GydF4y2Ba水松GydF4y2Ba物种GydF4y2Ba.GydF4y2Ba紫杉醇的内容(GydF4y2Ba一种GydF4y2Ba)和三种中间体,包括毕读物III(GydF4y2BaB.GydF4y2Ba),10-dap(GydF4y2BaCGydF4y2Ba)和10 dab III(GydF4y2BaD.GydF4y2Ba),采用HPLC-MS/MS法定量。菊苣黄酮的含量(GydF4y2BaE.GydF4y2Ba)、银杏亭(GydF4y2BaFGydF4y2Ba),槲皮素(GydF4y2BaGGydF4y2Ba)和木犀草素(GydF4y2BaHGydF4y2Ba),采用HPLC-MS/MS法定量。一个GydF4y2BaP.GydF4y2Ba值< 0.05认为有统计学意义,用“b”和表示GydF4y2BaP.GydF4y2Ba< 0.01用“a”表示GydF4y2Ba
用有针对性的方法确认黄酮类化合物的变化GydF4y2Ba
更准确地测定三种植物中黄酮类化合物的差异GydF4y2Ba水松GydF4y2Ba物种,靶向方法用于测量Amentoflavone,Ginkgetin,槲皮素和虎蝶的浓度(附加档案GydF4y2Ba9.GydF4y2Ba).我们的数据显示,菊苣黄酮在GydF4y2Bat . cuspidataGydF4y2Ba(0.14毫克GydF4y2Ba- 1GydF4y2Ba),少量累积在GydF4y2Bat .媒体GydF4y2Ba(0.024 mg.gGydF4y2Ba- 1GydF4y2Ba)(图。GydF4y2Ba6.GydF4y2Bae)。有趣的是,Ginkgetin,槲皮素和虎毛素被大大积累GydF4y2Bat . maireiGydF4y2Ba而不是其他两棵红豆杉(图。GydF4y2Ba6.GydF4y2BaF-H)。GydF4y2Ba
系统相关分析确定了一些与紫杉醇生物合成关键代谢物相关的代谢物GydF4y2Ba
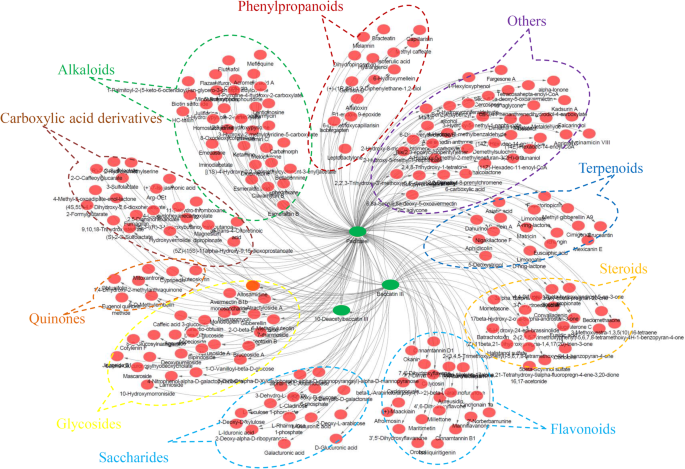
对代谢产物和代谢产物相互作用网络的分析有助于理解紫杉醇生物合成关键代谢产物的功能关系和识别新的化合物。在我们的研究中,构建了一个基于差异积累代谢物的相互作用网络。此外,类紫杉醇相关网络被分为围绕紫杉醇、baccatin III和10-DAB III的三个簇(Additional file)GydF4y2Ba10.GydF4y2Ba).相互作用网络表明,9类代谢物,苯丙醇丙烷,黄酮,生物碱,羧酸衍生物,醌,糖苷,糖苷,类固醇和萜类化合物也可能有助于不同物种的紫杉型积累的变化(图。GydF4y2Ba7.GydF4y2Ba).然而,需要调查这些潜在的新代谢物的相互作用的机制。GydF4y2Ba
讨论GydF4y2Ba
因为GydF4y2Ba水松GydF4y2Ba植物是紫杉醇的主要天然资源,综合植物化学分析GydF4y2Ba水松GydF4y2Ba已经进行了物种[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba].大量的化合物已在各种各样的GydF4y2Ba水松GydF4y2Ba物种(GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].除了紫杉烷二萜,许多其他化合物,包括枞烷,木脂素,聚戊烯醇,酚类化合物和挥发性成分,也被鉴定在小枝GydF4y2Ba水松GydF4y2Ba植物(GydF4y2Ba32.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba].然而,代谢物积累的水平可能在物种之间显着变化。GydF4y2Ba
在植物中,代谢物的积累是一个复杂而重要的性状,主要受遗传和环境因素的影响[GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba36.GydF4y2Ba].通过对特定代谢物的鉴定,我们的结果表明,不同的紫杉醇及其衍生物中不仅存在差异,而且在其前体中也存在差异GydF4y2Ba水松GydF4y2Ba物种(图。GydF4y2Ba3.GydF4y2Ba).二萜类紫杉烷核心由三个单位的IPP和一个单位的二甲基丙烯酸二磷酸二磷酸二磷酸,其被MEP途径供应[GydF4y2Ba8.GydF4y2Ba].有趣的是,紫杉醇生物合成的大多数前体都在GydF4y2Bat . maireiGydF4y2Ba相比之下,在GydF4y2Bat . cuspidataGydF4y2Ba.例如,MEP途径的三个重要中间产物d -甘油醛3P、1-脱氧- d -木糖5P和2- c -甲基- d -赤糖醇4P在MEP中高度积累GydF4y2Bat . maireiGydF4y2Ba,确保了二萜紫杉烷核心关键前体GGPP的生产[GydF4y2Ba8.GydF4y2Ba].在我们的研究中,GGPP在GydF4y2Bat . maireiGydF4y2Ba,表明在GydF4y2Bat . maireiGydF4y2Ba.然而,紫杉醇主要积累在GydF4y2Bat . cuspidataGydF4y2Ba而不是在。而不是GydF4y2Bat . maireiGydF4y2Ba.这表明MEP通路前体在紫杉醇合成中的效率GydF4y2Bat . cuspidataGydF4y2Ba可能非常高。GydF4y2Ba
GGPP环化生成taxa-4(5),11(12)-dien是紫杉烷核上必需的氧化步骤[GydF4y2Ba37.GydF4y2Ba].虽然未检测到其羟基化产物taxa-4(5),11(12)-dien -5α-ol和taxa-4(20),11(12)-dien-5α,13α-diol,但均与GGPP具有相似的积累模式。在紫杉醇生物合成途径中,10-DAB是taxol -4(20),11(12)-dien-5α-ol的下游产物,通过10-deacetylbaccatin III-10- o -acetyltransferase转化为baccatin III [GydF4y2Ba12.GydF4y2Ba].此外,辅酶a依赖的酰基转移发生在紫杉烷核心,产生几个乙酰化中间体,如10-去乙酰基-2-去苯甲酰baccatin III [GydF4y2Ba38.GydF4y2Ba].有趣的是,这些乙酰化产物,taxa-4(20),11(12)-dien-5α-乙酸酯,10-deacetyl-2-debenzoylbaccatin III, 10-DAB和baccatin III在大肠杆菌中大量积累GydF4y2Bat . cuspidataGydF4y2Ba和GydF4y2Bat .媒体GydF4y2Ba.然后,β-苯丙氨酸连接到baccatin III的c13 - o位,生成3 ' -GydF4y2BaNGydF4y2Ba-debenzoyl-2 -deoxytaxol和3 ' -GydF4y2BaNGydF4y2Ba-debenzoyltaxol,这是紫杉醇生物合成的直接上游代谢物[GydF4y2Ba39GydF4y2Ba].在我们的研究中,3 ' -GydF4y2BaNGydF4y2Ba-debenzoyl-2 -deoxytaxol和3 ' -GydF4y2BaNGydF4y2Ba-去苯甲酰紫杉醇在GydF4y2Bat . cuspidataGydF4y2Ba.接近紫杉醇生物合成途径终点的大多数中间产品主要累积GydF4y2Bat . cuspidataGydF4y2Ba,建议对紫杉醇有更高效率的途径GydF4y2Bat . cuspidataGydF4y2Ba和GydF4y2Bat .媒体GydF4y2Ba相比之下,在GydF4y2Bat . maireiGydF4y2Ba.GydF4y2Ba
紫杉醇生物合成途径中涉及的多条吻合途径产生大量的类taxoid衍生物[GydF4y2Ba5.GydF4y2Ba].关闭主要的转移路线的方法,例如导致14β-羟基番斗植物和C9-和C13-醋酸衍生物的途径可以提高紫杉醇产量[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].GydF4y2Ba
除紫杉醇类化合物外,黄酮类化合物、苯丙素类化合物和酚类化合物已在GydF4y2Ba水松GydF4y2Ba物种(GydF4y2Ba16.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba].在我们的研究中,代谢物-代谢物相互作用网络揭示了222个taxoid相关的代谢物,属于10大类。在相互作用网络中共鉴定出21个黄酮类化合物,其中与baccatin iii相关的代谢物3个,与紫杉醇相关的代谢物18个。有趣的是,大多数黄酮类化合物与baccatin III和紫杉醇呈负相关(附加文件GydF4y2Ba10.GydF4y2Ba:表S3),这与来自我们代谢物的数据符合。以前的工作表明,总累积了总黄酮,金蛋白和槲皮素GydF4y2Bat . maireiGydF4y2Ba紫杉醇在GydF4y2Bat .媒体GydF4y2Ba[GydF4y2Ba31.GydF4y2Ba].在超声和水杨酸处理下,紫杉醇生物合成提高,类黄酮含量显著降低[GydF4y2Ba44GydF4y2Ba].这些数据表明紫杉醇的生物合成与类黄酮代谢呈负相关。GydF4y2Ba
许多转录因子(TFs)已被报道参与紫杉醇生物合成和类黄酮生物合成相关基因的转录调控[GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba].在植物中,basic helix-loop-helix (bHLH) TFs被认为参与了类黄酮的生物合成[GydF4y2Ba47GydF4y2Ba].例如,大丽花中的bHLH TF dvvs通过调节查尔酮合成酶1、黄酮3-羟化酶、二氢黄酮醇4-还原酶、花青素合成酶的表达来激活类黄酮合成[GydF4y2Ba48GydF4y2Ba].在GydF4y2Ba水松GydF4y2Ba植物,三种BHLH TFS,TCJAMYC1,TCJAMYC2和TCJAMYC4,负面调节紫杉醇生物合成基因的表达[GydF4y2Ba49GydF4y2Ba].BHLH TFS在黄酮类和紫杉醇生物合成法规中的相反效果可能对PAClitaxel生物合成和黄酮类积累之间的负相关的解释。然而,需要在未来解决与紫杉醇生物合成有关的黄酮类化合物。GydF4y2Ba
除了参与MEP途径的代谢物外,还鉴定出18种紫杉醇生物合成相关的萜类化合物。萜类化合物间的转化和稳态可能在紫杉醇生物合成所需的前体供应中发挥重要作用[GydF4y2Ba8.GydF4y2Ba].由于紫杉醇生物合成的复杂性,需要更多的研究来揭示其他已确认的代谢物的作用。GydF4y2Ba
结论GydF4y2Ba
在我们的研究中,代谢型材表明,代谢物积累的水平可能在物种之间麻痹。鉴定了大量与紫杉醇生物合成相关的潜在代谢物。我们的结果有助于更深入地了解三个杉木三角形差异累计GydF4y2Ba水松GydF4y2Ba物种。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
新鲜的嫩枝样本是从三岁种植的GydF4y2Ba水松GydF4y2Ba树,包括GydF4y2Bat .媒体GydF4y2Ba那GydF4y2Bat . maireiGydF4y2Ba,GydF4y2Bat . cuspidataGydF4y2Ba2015年3月,它在杭州师范大学的温室里生长。生长条件为25±1°C,光照/黑暗周期为12/12 h,相对湿度为60-70%。GydF4y2Ba
代谢物提取GydF4y2Ba
对于代谢物的提取,新鲜枝条样品从不同GydF4y2Ba水松GydF4y2Ba(每只25毫克,GydF4y2BaNGydF4y2Ba= 15)转移到1.5 ml Eppendorf管中,用两个钢球向管中加入800 μL预冷甲醇/水(1:1,v/v)。所有的管被放入预冷却的48口井的管架中,然后使用2010 Geno/Grinder (SPEX SamplePrep, Metuchen, NJ, USA)以1900冲程/分钟的速度研磨2分钟。均质后的样品在0.5 ml预冷的氯仿/甲醇/水(v:v:v, 1:3:1)提取溶剂中提取,在4℃黑暗下旋转15 min,然后在冰上超声5 min。4℃,13,000 g离心15 min,取上清550 μL。抽提物真空干燥,在50%甲醇溶液中重悬。然后在4℃下将制备的提取物加载到2777C超高效液相色谱(UPLC)系统(Waters, Herts, UK)的自动进样器上。GydF4y2Ba
未确定的代谢组分析GydF4y2Ba
使用HPLC-MS / MS系统分析所有样品。首先,使用UPLC系统(Waters,Herts,UK),在100×2.1mm,1.7μm,1.7μm,1.7μm粒度水处理上的分离。柱烘箱在50℃下保持,流速设定为0.4ml / min。流动相由溶剂A(用0.1%甲酸的水)和溶剂B(乙腈,0.1%甲酸)。梯度洗脱条件设定如下:100%A相,0-2分钟;0至100%B,2-11分钟;100%B,11-13分钟;0至100%A,13-15分钟。每个样品的注射体积为10μL。GydF4y2Ba
采用Waters Xevo G2-XS Q-TOF (Waters, Herts, UK)高分辨率MS/MS检测柱中洗脱的代谢物。Q-TOF系统在正离子和负离子两种模式下运行。正离子模式下,毛细管电压为3 kV,采样锥电压为40 V。负离子模式下,毛细管电压为1 kV,采样锥电压为40 V。质心MSE模式获取质谱数据。肿物范围50 ~ 1200 Da,扫描时间0.2 s。MS/MS检测时,所有前体均在20 ~ 40 eV范围内破碎,扫描时间为0.2 s。在采集过程中,每3 s采集一次LE信号,以校准质量精度。为了评价UPLC-MS/MS系统在整个检测过程中的稳定性,每10个样品后混合等体积的每个实验样品制备一个质量控制样品。GydF4y2Ba
非靶向代谢组数据集的生物信息学GydF4y2Ba
使用以下过程处理UPLC-MS / MS的原始数据。对于每个样品,分子特征的基质,例如保留时间和质量 - 电荷比(GydF4y2Bam / zGydF4y2Ba),使用带有默认参数的XCMS软件生成[GydF4y2Ba50GydF4y2Ba].数据归一化到总离子电流,并使用三次重复注射色谱峰的平均面积计算每个特征的相对数量。代谢物的数量是使用一种算法生成的,该算法基于数据集中的共变和共洗脱将质量聚类成光谱。使用在线京都基因和基因组百科全书(KEGG)和HMDB数据库,通过匹配精确的分子质量数据注释代谢物(GydF4y2Bam / zGydF4y2Ba).如果观测值与数据库值之间的质量差小于10ppm,则代谢物将被注释,代谢物的分子式将进一步被同位素分布测量确定和验证。我们还使用了代谢物内部片段谱库来验证代谢物鉴定。峰值强度数据由内部软件MetaX进一步处理。为了质量控制,使用高分辨率ms对误差小于5ppm的预期正离子加合物的前体离子进行识别。原始数据作为附加文件上传GydF4y2Ba11.GydF4y2Ba和额外的文件GydF4y2Ba12.GydF4y2Ba.GydF4y2Ba
K-means集群GydF4y2Ba
clusgap r函数群集包(v.2.0.5)用于确定最佳群集数。随后,使用默认算法的K-means群集用于使用缩放的归一化相对代谢物数据在每个累计的代谢物上使用缩放的归一化相对代谢物数据。使用MEV程序显示聚类结果。GydF4y2Ba
靶向代谢物分析GydF4y2Ba
每个样本的新鲜枝条从三个样本中采集GydF4y2Ba水松GydF4y2Ba40℃干燥3 d,粉末状。采用先前公布的方法的改良版本制备粗提取物[GydF4y2Ba51GydF4y2Ba].简而言之,将每个样品的2.0g粉末与30mL 100%甲醇混合,并将混合物进行超声波60分钟。以5000g离心5分钟后,将上清液通过0.22μm膜过滤器过滤并转移到新管中。GydF4y2Ba
采用HPLC-MS/MS对紫杉醇、BAC、10-DAB III和10-去乙酰紫杉醇(10-DAP) 4种靶向紫杉醇进行定量分析。紫杉醇(≥99%;CAS No. 33069-62-4), baccatin III(≥99%;CAS No. 27548-93-2)和10-DAB III(≥98%;CAS编号32981-86-5)购自阿拉丁生化科技(中国上海)。10-DAP (98%;CAS No. 78432-77-6)来源于江苏紫杉药业股份有限公司。GydF4y2Ba
使用Thermo Dionex UltiMate 3000系列高效液相色谱系统,配备Finnigan TSQ量子发现三重四极杆质谱(Thermo Fisher Scientific, Waltham, MA, USA)检测Taxoids。采用Phenomenex Kinetex C18色谱柱(100 × 4.6 mm, 2.6-μm;Phenomenex, Torrance, CA, USA)。流动相为35%的溶剂A (2mm甲酸铵和0.1%甲酸水溶液)和65%的溶剂B(100%甲醇)。流速为0.2 mL/min,柱温为30℃,进样量为5 μL。HPLC-MS/MS分析的其他详细参数如下:毛细管温度为270℃;离子喷淋电压为3000 V;辅助气和鞘气为NGydF4y2Ba2GydF4y2Ba;碰撞气体为高纯氩气。采用电喷雾正电离模式,采用多反应监测进行测定。的过渡GydF4y2Bam / zGydF4y2Ba用567.2→445.3进行10-DAB III量化GydF4y2Bam / zGydF4y2Ba567.2→385.2和567.2→427.3用于确认。过渡GydF4y2Bam / zGydF4y2Ba分别测定829.4→286.1和829.4→122.0进行baccatin III定量和确证。的过渡GydF4y2Bam / zGydF4y2Ba选择876.4→308.1进行紫杉醇定量GydF4y2Bam / zGydF4y2Ba以876.4→531.2和876.4→591.4进行确认。10-去乙酰紫杉醇定量采用m/z 834.4→308.2的转变。数据采集和处理使用Xcalibur 2.2软件(Thermo Scientific, Waltham, MA, USA)。GydF4y2Ba
采用超高效液相色谱-质谱联用技术(UPLC-MS/MS)对槲皮素、木犀草素、山奈酚、芒托黄酮、银杏素等8种黄酮类化合物进行分离测定[GydF4y2Ba51GydF4y2Ba].GydF4y2Ba
系统相关分析和统计分析GydF4y2Ba
对于非目标代谢组分析,采用Pearson和Spearman相关性、单因素方差分析(ANOVA)和层次聚类。GydF4y2BaP.GydF4y2Ba根据错误发现率调整方差分析的值。使用SIMCA v14.0 (Umetrics, Umea, Sweden)采用pareto scaling method对以均值为中心的数据进行代谢物的主成分分析(PCA)。GydF4y2Ba
目标代谢物的定量结果以至少三次重复±标准误差的平均值表示。采用SPSS 19.0软件(SPSS Inc, Chicago, IL, USA)进行统计分析,并采用方差分析比较类群含量差异。一个GydF4y2BaP.GydF4y2Ba值< 0.05认为有统计学意义。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
在当前研究期间生成和分析的所有数据集都作为稿件作为附加文件上传。GydF4y2Ba
缩写GydF4y2Ba
- 10-DAB III:GydF4y2Ba
-
10-deacetylbaccatin三世GydF4y2Ba
- 10-DAB:GydF4y2Ba
-
10-deacetylbaccatin-IIIGydF4y2Ba
- 方差分析:GydF4y2Ba
-
方差分析GydF4y2Ba
- 大坝:GydF4y2Ba
-
差分累积的代谢物GydF4y2Ba
- DMAPP:GydF4y2Ba
-
Dimethylallyl二磷酸GydF4y2Ba
- GGPP:GydF4y2Ba
-
天竺葵二磷酸二磷酸酯GydF4y2Ba
- HPLC-MS / MS:GydF4y2Ba
-
高效液相色谱-串联质谱GydF4y2Ba
- IPP:GydF4y2Ba
-
Isopentenyl二磷酸GydF4y2Ba
- 是:GydF4y2Ba
-
茉莉酸GydF4y2Ba
- 议员:GydF4y2Ba
-
2-C-甲基-D-赤藓糖醇磷酸盐GydF4y2Ba
- 主成分分析:GydF4y2Ba
-
主成分分析GydF4y2Ba
- TS:GydF4y2Ba
-
Taxadiene合酶GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
摘要:紫杉醇替代来源的研究进展。RSC放置2016;6(54):48800 - 9。GydF4y2Ba
- 2。GydF4y2Ba
索恩伯格CK,沃尔特T,沃克KD。紫杉醇类似物的生物催化:baccatin III转化为GydF4y2BaNGydF4y2Ba-debenzoyl-GydF4y2BaNGydF4y2Ba-(2-呋喃基)紫杉醇及其氨基苯基丙醇辅酶a转移酶的表征。生物化学,2017;56(44):5920 - 30。GydF4y2Ba
- 3.GydF4y2Ba
Onrubia M, Moyano E, Bonfill M, Palazon J, Goossens A, Cusido RM。之间的关系GydF4y2BaTXS.GydF4y2Ba那GydF4y2BaDBATGydF4y2Ba那GydF4y2BaBAPTGydF4y2Ba和GydF4y2BaDBTNBT.GydF4y2Ba紫杉烷在紫杉发育过程中的基因表达与生成GydF4y2Ba水松baccataGydF4y2Baplantlets。植物SCI。2011; 181(3):282-7。GydF4y2Ba
- 4.GydF4y2Ba
Guerra-Bubb J, Croteau R, Williams RM。紫杉醇生物合成的早期阶段:早期途径代谢物的合成和鉴定的临时报告。acta photonica sinica; 2012;29(6): 683-96。GydF4y2Ba
- 5.GydF4y2Ba
紫杉醇生物合成与分子遗传学研究。Phytochem启2006;5(1):75 - 97。GydF4y2Ba
- 6.GydF4y2Ba
凯彻姆RE,堀口T,邱丹,威廉姆斯RM,克罗托RB。管理培养GydF4y2Ba水松GydF4y2Ba具有早期前体的细胞揭示了类毒素生物合成途径的分叉。植物化学。2007;68(3):335 - 41。GydF4y2Ba
- 7.GydF4y2Ba
李春,霍春,张敏,石强。红豆杉的化学性质。GydF4y2BaTaxus chinensis.GydF4y2Bavar。GydF4y2BamaireiGydF4y2Ba.生物化学学报。2008;36(4):266-82。GydF4y2Ba
- 8.GydF4y2Ba
紫杉醇的生物合成研究:紫杉烷碳骨架不是甲valonoid来源。中国科学(d辑:地球科学)1996;93(13):6431-6。GydF4y2Ba
- 9.GydF4y2Ba
4 .王志强,王志强,王志强,等。类异戊二烯合成的MVA和MEP途径的网络分析。植物生物学杂志。2013;64:665-700。GydF4y2Ba
- 10。GydF4y2Ba
Harrison JW,Scrowston RM,Lythgoe B,Harrison JW,Scrowston RM,Lythgoe B.纳税粉。第四部分。纳税素 - 我的宪法。J CHEM SOC C组织。1966年:1933-45。GydF4y2Ba
- 11.GydF4y2Ba
Williams DC, Wildung MR, Jin AQ, Dalal D, Oliver JS, Coates RM,等。紫杉醇(Taxol)生物合成中紫杉醇二烯合酶的“伪成熟”形式的异体表达和表征,以及多步二萜环化反应的潜在中间体和抑制剂的评价。生物化学学报。2000;379(1):137-46。GydF4y2Ba
- 12.GydF4y2Ba
李永华,李永华,朴正忠,林莎,宋s,洪振堂,等。Baccatin III是紫杉醇半合成的前体,可抑制荷瘤小鼠骨髓源性抑制细胞的聚集和抑制活性。Int Immunopharmacol。2014;21(2):487 - 93。GydF4y2Ba
- 13。GydF4y2Ba
Jiménez-Barbero J, Amat-Guerri F, Snyder JP。促进微管稳定的固体、溶液和微管蛋白结合的构象。抗癌药物。2002;2(1):91-122。GydF4y2Ba
- 14.GydF4y2Ba
王艳芳,史庆文,董敏,清田H,顾永昌,丛斌。天然紫杉烷:1828年以来的发展。化学启2011;111(12):7652 - 709。GydF4y2Ba
- 15.GydF4y2Ba
Shi Q,Oritani T,Sugiyama T,Murakami R,Wei H.来自种子的六个新紫杉烷二萜类化合物GydF4y2BaTaxus chinensis.GydF4y2Bavar。GydF4y2BamaireiGydF4y2Ba和GydF4y2Ba云南红豆杉GydF4y2Ba.中国科学(d辑:地球科学)1999;GydF4y2Ba
- 16.GydF4y2Ba
杨玲,郑志松,程飞,阮旭,姜达,潘春成,等。针叶代谢物的季节动态GydF4y2Ba水松wallichianaGydF4y2Bavar。GydF4y2BamaireiGydF4y2Ba.分子。2016; 21(10):1403。GydF4y2Ba
- 17.GydF4y2Ba
祖元,傅莹,李胜,孙锐,李强,施瓦兹。四种主要类星体的快速分离GydF4y2Ba水松GydF4y2Ba通过组合的LLP-SPE-HPLC(PAD)程序。J SEP SCI。2006; 29(9):1237-44。GydF4y2Ba
- 18.GydF4y2Ba
李士,傅y,zu y,sun r,王y,zhang l等。测定紫杉醇和其他六个绳索的测定GydF4y2Ba水松GydF4y2Ba高效液相色谱-串联质谱联用分析。acta Pharm Biomed Anal. 2009;49(1): 81-9。GydF4y2Ba
- 19.GydF4y2Ba
王琳琳,丁丽梅,霍SC,孙丽,孙忠GydF4y2Ba水松cuspidataGydF4y2Ba.J Nat Med。2013; 67(4):827-32。GydF4y2Ba
- 20.GydF4y2Ba
Itokawa H, Lee KH。红豆杉属GydF4y2Ba水松GydF4y2Ba: Taylor & Francis;2003.GydF4y2Ba
- 21.GydF4y2Ba
Poupat C,钩子I,Guitite F,Ahond A,Guenard D,Adeline Mt,等。中性和基本的划分队列的针头GydF4y2Ba水松GydF4y2Ba物种。足底医学。2000;66(6):580 - 4。GydF4y2Ba
- 22.GydF4y2Ba
Lommen A, van der Weg G, van Engelen MC, Bor G, Hoogenboom LA, Nielen MW。污染物分析的非目标代谢组学方法:确定潜在的未知化合物。Acta photonica sinica; 2007;584(1): 43-9。GydF4y2Ba
- 23。GydF4y2Ba
Ketchum RE, Rithner CD, Qiu D, Kim YS, Williams RM, Croteau RB。GydF4y2Ba水松GydF4y2Ba代谢组学:茉莉酸甲酯在红豆杉x培养基细胞培养中优先诱导产生C-13氧化的taxoids。植物化学。2003;62(6):901 - 9。GydF4y2Ba
- 24。GydF4y2Ba
Tanaka K,Li F,Morikawa K,Nobukawa T,Kadota S.培养的生物合成波动分析GydF4y2Ba水松GydF4y2Ba幼苗使用代谢组学方法。植物化学。2011;72(14):1760 - 6。GydF4y2Ba
- 25。GydF4y2Ba
郑华,小松S,朱武,张L,李X,Cui L等。响应和防御机制GydF4y2BaTaxus chinensis.GydF4y2Ba使用比较蛋白质组学和代谢组科分析揭示了UV-A辐射下的叶子。植物和细胞生理学。2016; 57(9):1839-53。GydF4y2Ba
- 26.GydF4y2Ba
金军,张洪,张建军,刘鹏,陈旭,李振等。综合转录组学和代谢组学分析来描述冷应激反应GydF4y2Ba烟草GydF4y2Ba.BMC基因组学。2017;18(1):496。GydF4y2Ba
- 27.GydF4y2Ba
徐强,朱军,赵胜,侯勇,李飞,太勇,等。转录组分析采用单分子直接RNA测序的方法,深入了解二级代谢途径中的基因GydF4y2Ba茶树GydF4y2Ba.植物科学学报2017;8:1205。GydF4y2Ba
- 28.GydF4y2Ba
郝大成,黄斌,杨磊。属植物的系统发育关系GydF4y2Ba水松GydF4y2Ba根据叶绿体基因间间隔和核编码DNA推断。生物医药学报。2008;31(2):260-5。GydF4y2Ba
- 29.GydF4y2Ba
van Rozendaal EL, Lelyveld GP, van Beek TA。不同红豆杉树种和品种的针叶中紫杉醇及相关紫杉醇类的筛选。植物化学,2000;53(3):383 - 9。GydF4y2Ba
- 30.GydF4y2Ba
何华,朴B, Oh IS, Jin YW, Lee EK, Loake GJ。紫杉醇的生物合成、生产及前景展望。生物科技新》。2014;31(3):242 - 5。GydF4y2Ba
- 31.GydF4y2Ba
郝军,郭华,史旭,王永强,万强,宋勇,等。比较蛋白质组分析GydF4y2Ba水松GydF4y2Ba物种(GydF4y2Ba水松×媒体GydF4y2Ba和GydF4y2Ba水松maireiGydF4y2Ba)揭示了与紫杉醇和其他代谢物相关的代谢变化。植物生理学杂志。2017;114(24):6388。GydF4y2Ba
- 32.GydF4y2Ba
沈永昌,陈春宇。紫杉烷二萜GydF4y2Ba水松市长GydF4y2Ba一世。Planta Med。1997年; 63(6):569-70。GydF4y2Ba
- 33.GydF4y2Ba
大月木,宫艾,山口A, Morikawa K,冈野平,等GydF4y2Ba水松GydF4y2Ba云南植物对糖原合成酶激酶3 - β的有效刺激作用及激酶在体外对基本脑蛋白的磷酸化作用。生物医药学报。2012;35(3):385-93。GydF4y2Ba
- 34.GydF4y2Ba
王于J, Y,钱H,赵Y,傅刘B, c . Polyprenols针的GydF4y2BaTaxus chinensis.GydF4y2Bavar。GydF4y2BamaireiGydF4y2Ba.Fitoterapia。2012; 83(5):831-7。GydF4y2Ba
- 35。GydF4y2Ba
唐伟,王志强,王志强,等。利用GC/MS和LC/MS分析遗传、环境和表型对玉米杂交种代谢组的影响中国农业科学。2017;65(25):5215-25。GydF4y2Ba
- 36。GydF4y2Ba
阿凡萨诺R,康塔尔迪F,阿德尔菲MG, D'Amelia V, Diretto G, De Tommasi N,等。块茎马铃薯种的比较代谢产物和基因组分析。植物化学。2017;137:42-51。GydF4y2Ba
- 37。GydF4y2Ba
关键词:紫杉醇,羟基化,紫杉醇生物合成,细胞色素p450化学杂志。1996;3(6):479 - 89。GydF4y2Ba
- 38.GydF4y2Ba
内华达,门格斯图,纳瓦拉内,杜兰特。一个GydF4y2BaNGydF4y2Ba-芳香基转移酶在体外与类似物具有广泛的芳香基CoA特异性GydF4y2BaNGydF4y2Ba-dearoylpaclitaxel。acta Chem . J Am Chem . 2009; 31(16): 5994-6002。GydF4y2Ba
- 39.GydF4y2Ba
紫杉醇生物合成的细胞色素P450加氧酶。Phytochem启2006;5(2 - 3):433 - 44。GydF4y2Ba
- 40.GydF4y2Ba
Alder JD, Jarvis KP, Marsh KC, Klein LL, Clement JJ。两种9-二氢紫杉烷类似物对人和小鼠肿瘤的临床前体内疗效。[J] .中华癌症杂志。1996;73(5):560-4。GydF4y2Ba
- 41.GydF4y2Ba
引用本文Distefano M, Scambia G, Ferlini C, Gaggini C, De Vincenzo R, Riva A, et al.。一类新的紫杉烷(14beta-羟基-10-去乙酰baccatin III衍生物)对多药耐药阳性人类癌细胞的抗增殖活性中华医学杂志。1997;72(5):844-50。GydF4y2Ba
- 42.GydF4y2Ba
布尔加科夫副总裁,Tchernoded GK, Veselova MV, Fedoreyev SA, Muzarok TI, zhuavlev YN。培养细胞产生儿茶素GydF4y2Ba水松cuspidataGydF4y2Ba和GydF4y2Ba水松baccataGydF4y2Ba.Biotechnol。2011;33(9):1879 - 83。GydF4y2Ba
- 43.GydF4y2Ba
Zhang M, Dong Y, Nie L, Lu M, Fu C, Yu L. High-throughput sequencing reveals miRNA effect on primary and secondary production properties in the long- production sub培养GydF4y2Ba水松GydF4y2Ba细胞。前植物SCI。2015; 6:604。GydF4y2Ba
- 44.GydF4y2Ba
超声波增强水杨酸在榛子中诱导的生理效应和紫杉醇的生产(GydF4y2BaCorylus avellanaGydF4y2Bal .)细胞培养。超声医学杂志。2011;37(11):1938-47。GydF4y2Ba
- 45.GydF4y2Ba
匡旭,孙胜,魏军,李勇,孙超GydF4y2Ba水松cuspidataGydF4y2Ba转录组揭示了紫杉醇生物合成的复杂性。植物学报。2019;19(1):210。GydF4y2Ba
- 46.GydF4y2Ba
周涛,罗旭,于超,张超,张玲,宋永波,等。转录组分析提供了三个紫杉醇生物合成相关基因的表达模式和序列相似性GydF4y2Ba水松GydF4y2Ba物种。植物学报。2019;19(1):33。GydF4y2Ba
- 47。GydF4y2Ba
赵林,高玲,王浩,陈旭,王永强,杨辉,等。类黄酮生物合成中的R2R3-MYB、bHLH、WD40及相关转录因子。功能整合基因组学。2013;13(1):75-98。GydF4y2Ba
- 48。GydF4y2Ba
Ohno S, Hosokawa M,星野A, Kitamura Y, Morita Y, Park KI,等。bHLH转录因子dvvs参与大丽花花青素合成的调控(GydF4y2Ba大丽花摘要GydF4y2Ba).中国生物医学工程学报。2011;62(14):5105-16。GydF4y2Ba
- 49。GydF4y2Ba
Lenka SK, Nims NE, Vongpaseuth K, Boshar RA, Roberts SC, Walker EL。紫杉醇生物合成基因的茉莉酸响应性表达GydF4y2Ba水松cuspidataGydF4y2BabHLH转录因子TcJAMYC1、TcJAMYC2和TcJAMYC4对体外培养的细胞具有负调控作用。植物学报。2015;6:115。GydF4y2Ba
- 50.GydF4y2Ba
Smith CA, Want EJ, O’maille G, Abagyan R, Siuzdak G. XCMS:处理质谱数据代谢物分析使用非线性峰比对,匹配和鉴定。肛门化学2006;78(3):779 - 87。GydF4y2Ba
- 51.GydF4y2Ba
于晨,郭华,张勇,宋勇,皮娥,于晨,等。鉴定两种植物类群含量差异的潜在基因GydF4y2Ba水松GydF4y2Ba物种(GydF4y2Ba水松媒体GydF4y2Ba和GydF4y2Ba水松maireiGydF4y2Ba).树杂志。2017;37(12):1659 - 71。GydF4y2Ba
确认GydF4y2Ba
同时感谢中国杭州LC科技有限公司的技术支持。感谢刘开东(岭南师范大学生命科学与技术学院)阅读本手稿。GydF4y2Ba
资金GydF4y2Ba
本研究获得了浙江省自然科学基金资助项目(No. 20141202)。LY19C160001、LY19C200010、LY17C020004;国家自然科学基金项目(31970286和31301053);浙江农林大学亚热带森林培育国家重点实验室开放基金(KF201708);杭州市科技局(20170432B01)。在研究的设计、数据的收集、分析和解释以及手稿的撰写中,资助机构没有任何作用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
CS、EP和BZ对构想做出了重大贡献,参与了手稿的起草,并最终批准了即将出版的版本。TZ, XL, CZ, EP和XX对数据分析的获取做出了重大贡献,参与了手稿的修改,并最终批准了即将出版的版本。CY、ZJ、LZ和HY对数据的分析和解释做出了重大贡献,参与了手稿的修改,并最终批准了该版本的出版。所有作者都已阅读并批准了稿件,并确保是这样。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
该项目使用植物材料,不利用转基因技术。负责的当局GydF4y2Ba水松GydF4y2Ba资源是长白山山,他提供了收集样本的许可GydF4y2Bat . cuspidataGydF4y2Ba,天慕山国家自然保护区,允许收集样本的许可GydF4y2Bat . maireiGydF4y2Ba和GydF4y2Bat对GydF4y2Ba和墨脱国家自然保护区,后者提供了采集样本的许可GydF4y2Bat . fuanaGydF4y2Ba和GydF4y2BaT. Yunnanensis.GydF4y2Ba,用于我们的科学研究。GydF4y2Bat .媒体GydF4y2Ba是购自中国成都武旺农公司的栽培品种,武旺农公司允许我们将幼苗用于科学研究。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表S1。GydF4y2Ba
2246个已鉴定代谢物的详细信息。GydF4y2Ba
附加文件2:图S1。GydF4y2Ba
所有样品的总离子色谱图。GydF4y2Ba
附加文件3:表S2。GydF4y2Ba
747个代谢物的KEGG注释。GydF4y2Ba
附加文件4:图S2。GydF4y2Ba
水坝的识别GydF4y2Bat . maireiGydF4y2BavsGydF4y2Bat . cuspidataGydF4y2Ba比较。该框表示“二萜类生物合成”途径。GydF4y2Ba
附加文件5:图S3。GydF4y2Ba
水坝的识别GydF4y2Bat .媒体GydF4y2Ba和GydF4y2Bat . maireiGydF4y2Ba比较。该框表示“二萜类生物合成”途径。GydF4y2Ba
附加文件6:图S4。GydF4y2Ba
水坝的识别GydF4y2Bat .媒体GydF4y2Ba和GydF4y2Bat . cuspidataGydF4y2Ba比较。该框表示“二萜类生物合成”途径。GydF4y2Ba
附加文件7:图S5。GydF4y2Ba
单个taxoids的色谱图。GydF4y2Ba
附加文件8:图S6。GydF4y2Ba
更详尽的类群简介GydF4y2Ba水松GydF4y2Ba属。GydF4y2Ba
附加文件9:图S7。GydF4y2Ba
各类黄酮的色谱图。GydF4y2Ba
附加文件10:表S3。GydF4y2Ba
与换行货相关网络的重要信息。GydF4y2Ba
附加文件11:GydF4y2Ba
数据集1代谢组输入原始数据GydF4y2Ba
额外的文件12:GydF4y2Ba
数据集2代谢组输入原始数据GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
周涛,罗旭东,张超。GydF4y2Baet al。GydF4y2Ba比较代谢组学分析揭示了三种植物中紫杉类和黄酮类化合物的差异GydF4y2Ba水松GydF4y2Ba物种。GydF4y2BaBMC植物杂志GydF4y2Ba19,GydF4y2Ba529(2019)。https://doi.org/10.1186/s12870-019-2146-7GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-2146-7GydF4y2Ba
关键字GydF4y2Ba
- 代谢物GydF4y2Ba
- 种间差异聚集GydF4y2Ba
- 系统的相关性分析GydF4y2Ba
- TaxoidGydF4y2Ba
- 水松GydF4y2Ba