- 研究文章
- 开放访问
- 出版:
的QTL和eQTL早期表征控制Fusarium Graminearum.武汉1×Nyubai加倍单倍体小麦群体的感染和脱氧雪腐镰刀菌烯醇水平
BMC植物生物学体积19.文章编号:536(2019)
摘要
背景
赤霉病(FHB)是谷类作物的主要疾病,引起真菌病原体Fusarium Graminearum.和相关的物种。用于FHB抗性的繁殖小麦有助于提高产量和粒度,并减少杀菌剂的使用。鉴定在不同小麦基因型中的FHB抗性的基因和标记物仍已被证明是挑战性的。
结果
在这项研究中,早期感染禾谷镰刀菌在一个由中抗小麦基因型武汉1号和Nyubai杂交而来的双单倍体群体中进行了分析。共鉴定出三个数量性状位点(QTL):1AL与脱氧雪腐镰刀菌烯醇含量较低相关,4BS和5A与脱氧雪腐镰刀菌烯醇含量较低相关禾谷镰刀菌接种后2天感染。QTL 1AL和4BS的早期抗性等位基因遗传自武汉1号,5A QTL的早期抗性等位基因遗传自玉白号。CIS.和反式表达QTL(eQTL)用从感染的头部样本RNA-SEQ数据中识别。对于热点反式eQTL在1AL和4BS QTL峰附近进行鉴定。在差异表达基因独联体QTL支持间隔内的EQTL,九个基因具有更高的表达与FHB早期抗性相关,并且四种基因具有更高的表达与FHB早期敏感性相关。
结论
我们通过感染小麦的基因型和基因表达数据的分析禾谷镰刀菌鉴定与FHB初阻力相关联的三个QTL,和连接的基因与eQTL和差异表达模式的那些QTL。这些发现可能为食物及卫生局初阻力小麦育种应用。
背景
就面积而言,小麦是世界上最重要的作物,加拿大是最大的生产国之一,2017年种植了900万公顷,生产了3000万吨粮食[1.].面包异源六倍体小麦(小麦L。)占全球小麦产量的95%以上[2.].赤霉病(FHB)是加拿大小麦和世界其他温带地区的重大疾病,由真菌引起的主要Fusarium Graminearum.施瓦贝.赤霉病导致产量损失和污染内核由单端孢霉菌毒素包括呕吐毒素(DON)及其衍生物[3.].预防该疾病的策略包括培育抗赤霉病的小麦品种、作物轮作和施用杀菌剂[4.,5.].提高对FHB的抗性是主要小麦生产国当前育种计划的一个关键目标。已鉴定出几个FHB抗性和DON减少的数量性状位点(QTL),包括Fhb1在3BS染色体上,Fhb2染色体6BS和Fhb5染色体5AS [6.,7.].对于那些QTL标记被用于开发小麦品种赤霉病在加拿大[耐8.].
此前,通过温室试验和田间试验,对杂交组合武汉1 × Nyubai衍生的双单倍体(DH)群体进行了研究,确定了控制FHB症状的QTL在2DL、3BS和4B染色体上,以及控制DON积累的QTL在2DS和5AS染色体上[9]通过在受控环境中进行感染早期实验,分析感染头部样本的基因表达谱,并使用结合单核苷酸多态性(SNP)和单序列重复序列(SSR)的遗传图谱,我们重新审视了该人群的表型和基因分型标记。我们的分析确定了与DON积累相关的1AL上的一个新QTL,并确认了先前在同一群体中确定的4B和5AS QTL[9]此外,使用RNA-seq数据确定了与FHB水平降低相关的差异表达基因(DEG)和表达QTL(eQTL)热点。
结果
表型的措施,包括对真菌基因转录水平3-磷酸甘油醛脱氢酶(成品-GAPDH)和β微管蛋白(成品-βTUB)和唐浓度揭示了武汉1和纽巴衍生的DH系中的广泛感染水平(附加档案1.).3个表型指标的Spearman系数分别为0.85、0.92和0.93成品-B.TUB vs.DON,成品-GAPDH vs.DON和成品-GAPDH vs。成品-β桶分别)。RNA-seq读取的百分比映射到禾谷镰刀菌基因组(%成品读数)也与上述三种表型指标高度相关(斯皮尔曼的rho系数分别为0.88、0.91和0.93%成品读取与成品-β浴缸,和成品-分别为GAPDH)。
与还原基因连锁的QTL禾谷镰刀菌和DON水平
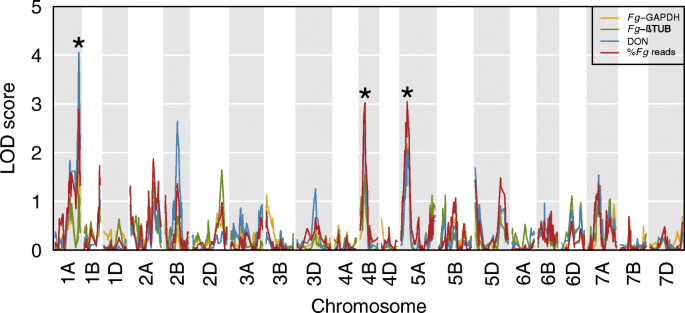
QTL定位采用基因水平禾谷镰刀菌根据上述四项指标估计,2 dpi时的感染率(%)成品读书,成品-GAPDH,成品β tub和DON)(图。1.).共鉴定出3个QTL(P.≤ 0.051000排列):1AL上的一个区域(峰值为151.66 厘米,LOD支持间隔介于147.57和159.79之间 cM)与DON水平相关;染色体4BS上的区域(峰值为30.71 cM,LOD支持间隔介于15.11和34.72之间 cM)和5A(峰值为40.50 厘米,LOD支持间隔在29.76和59.90之间 cM)与禾谷镰刀菌水平(%)成品读取)。
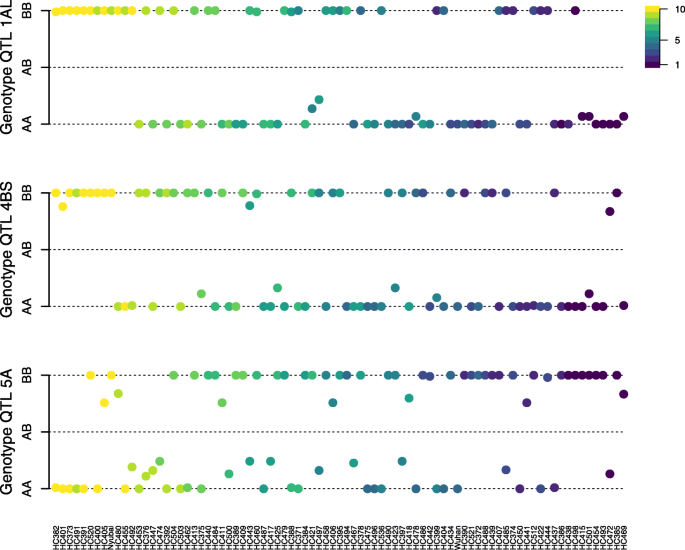
根据表型排序的DH系中QTL 1AL、4BS和5A内基因型调用频率的分析(%)成品读取和DON)(图2.)揭示DH系具有较低的感染水平(深蓝)对QTL 1AL和4BS基因型AA,和上QTL 5A BB基因型,并具有较高的感染的水平,DH系(黄色)具有相反的图案,其表示相关联的等位基因具有降低的感染水平从武汉1 QTL 1AL和4BS继承和从Nyubai继承用于QTL 5A。
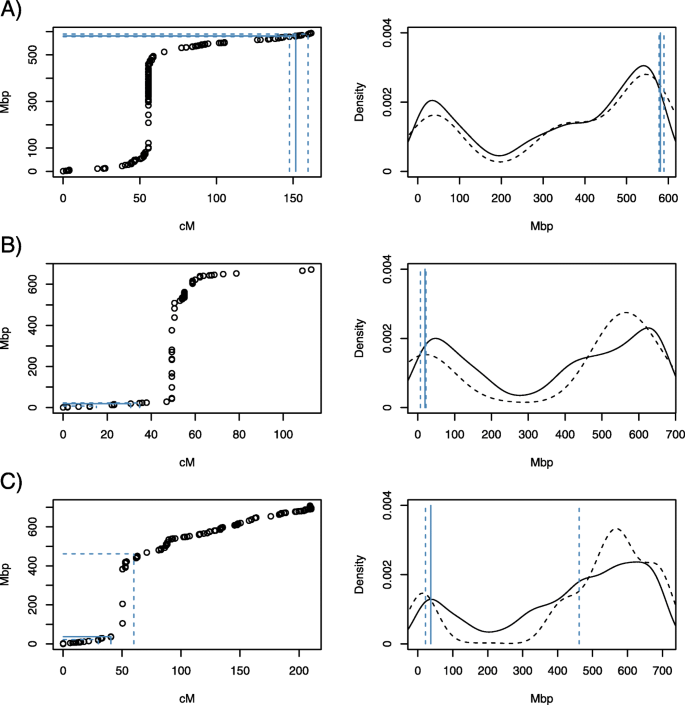
为了映射基因QTL间隔的物理位置,多态型标志的序列都能够抵抗小麦基因组序列进行比[10.]确定了总共6991个标记,具有一致的遗传距离和物理位置(附加文件2.).利用这些数据,将QTL 1AL、4BS和5A分别定位为577.89 ~ 589.41 Mbp、7.03 ~ 22.50 Mbp和21.67 ~ 461.45 Mbp(图1)。3.).着丝粒周围的基因和标记密度降低,着丝粒周围区域重组率降低[11.]这解释了遗传距离和物理位置之间的扭曲。5A的LOD支持区间与着丝粒重叠,因此覆盖了染色体的大部分区域。总的来说,三个QTL区间分别包含178(1AL)、199(4BS)和2205(5A)个基因(附加文件)3.).
eQTL热点的鉴定
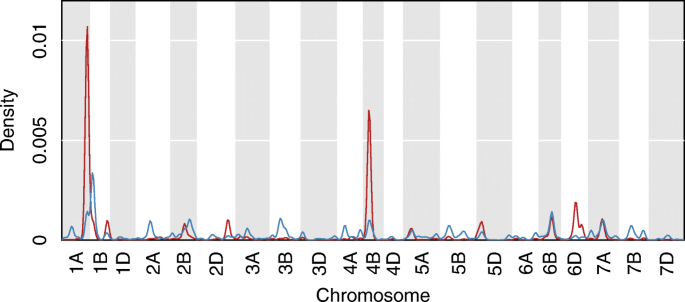
使用RNA-SEQ数据进行表达QTL作图,总共43745 eQTL的(8573独联体和35172年反式)LOD分数高于显著性阈值(P.保留≤0.05,1000个排列,对应于35,106个独特的小麦基因。其中,240独联体eQTL与17401反式eQTL在上述三个QTL区间内(1AL、4BS和5A)(附加文件4.).为了独联体EQTL峰值54在QTL 1AL的LOD支持间隔内,对于QTL 4bs和133的QTL 5a的QTL 1AL和133。为了反式QTL 1AL、4BS和5A分别有10397个、6295个和709个峰在LOD支持区间内。transeQTL hotspots were found within the 1AL (peak at 153.6 cM, interval between 144.79 and 161.42) and 4BS (peak at 30.5 cM, interval between 22.73 and 38. 27) QTL intervals (Fig.4.).
交叉QTL区间内套的DEGS
为了鉴定还用DH系之间观察到的表型差异连接的两个亲本基因型之间DEGS,进行三次分析。First, the group of DH lines with > 90% markers corresponding to Wuhan 1 (AA genotype calls) was compared with the group of DH lines with > 90% markers corresponding to Nyubai (BB genotype calls) for each QTL interval separately. A total of 4150 unique DEGs (absolute log2.FC > =1和调整P.-值<=0.01)在该分析中确定(QTL 1AL为3553个,QTL 4BS为730个,QTL 5A为327个)(附加文件5.).对于第二个分析,我们比较了武汉1,Nyubai RNA-SEQ数据(被感染的头在2 dpi)的和本实验和一个单独的实验[之间的DH品系(HC374)中的一个12.]这些数据显示了两个实验中基因型之间的一致差异基因表达(log2FC)(武汉1号与纽拜、武汉1号与HC374以及纽拜与HC374的Spearman rho系数分别为0.90、0.82和0.89)(补充文件6.).共有6452个DEG差异表达(绝对对数2.FC > =1和调整P.-value<=0.01)7.).对于第三个分析,我们比较两个组之间的表达数据与最极端的表型(每组中DH品系的10%),使用%如所描述的排成品reads和DON水平:感染水平最低的线(HC469、HC385、HC472、HC493、HC454、HC501、HC415、HC498)与感染水平最高的线(HC382、HC401、HC373、HC491、HC391、HC520、HC400、HC405)相比。两组DH线之间共识别出28254个DEG(绝对对数)2.FC > =1和调整P.值<= 0.01)(附加文件8.)定量逆转录聚合酶链反应(RT-qPCR)用于确认所有样本中五个DEG的表达谱,显示RNA seq与RT-qPCR的相关系数在0.78和0.91之间(附加文件9).
在三个QTL间隔内,总共13个基因在基因型之间差异表达,两组父母在两组DH线之间,以及与EQTL相关联独联体(QTL 1AL有8个基因,QTL 4BS有3个基因,QTL 5A有2个基因)1.).9个基因在表达量较低的品系中表达量较高禾谷镰刀菌DON水平被认为与FHB早期抗性相关。其中,1AL QTL区间内的6个基因(Traescs1g426000、Traescs1g426500、Traescs1g432900、Traescs1g433000、Traescs1g439000、Traescs1g439100)和4BS QTL区间内的2个基因(TraesCS4B01G022400、TraesCS4B01G024600)在基因型AA中有较高的表达;而5A QTL区间内的一个基因(TraesCS5A01G114700)在基因型BB中有较高的表达。另一方面,在基因型较高的品系中有较高表达的四个基因禾谷镰刀菌DON水平被认为与FHB早期易感性相关。其中包括1AL QTL区间内的两个基因(TRAESCS1G01G430100,TRAESCS1G01G430200)和4BS QTL区间内的一个基因(TraesCS4B01G016900)在基因型BB中有较高的表达,以及5A QTL区间内的一个基因(TraesCS5A01G196700)在基因型AA中有较高的表达。
讨论
在小麦中已经鉴定出许多抗FHB的QTL,并且分布在所有染色体上[6.,13.,14.].II型抗性(穗内真菌传播)的最佳特征QTL为Fhb1,位于染色体3B的短臂上[15.].的两个候选决定因素Fhb1已经提出了轨迹:成孔毒素样基因[16.和一种富含组氨酸的核钙结合蛋白的变体[17.,18.]在这项研究中,我们分析了两个具有中度抗药性的基因型(武汉1号和Nyubai)的RNA-seq和基因型数据禾谷镰刀菌并从两个亲衍生81个DH系。将样品在2 dpi的,这已被描述为在将真菌从活体营养切换到死体营养和开始产生更高量的DON宿主 - 病原体相互作用的切割位收集,而植物响应由大规模转录重编程19.].我们鉴定了3个感兴趣的QTL,分别是578-589 Mbp处的1AL (DON QTL和eQTL热点),7-23 Mbp处的4BS (%)成品QTL和eQTL热点)和图5A在22-461 Mbp的(%成品QTL)。在之前的一项研究中发现,QTL位于4B和5A染色体的相同区域,在感染后期的相同人群中[9].在其他群体中也发现了对1AL抗性的QTL (wpt - 5577-XBAC213)[20.), 4 bs (Xhbg226-Xgwm149)[21.5a(Xgwm304-Xgwm415)[7.];最近的工作将后者分成了跨越中心的主要QTL映射和位于染色体短臂上的小QTL [22.,23.].QTL ON 4BS(Fhb4)和5AS(Fhb5)都与I型阻力(初始穿透)有关[24.,25.].对于绝大多数FHB抗性QTL的,基因的那些QTL底层有待鉴定和表征。
QTL 1AL的最强候选基因是TraesCS1A01G426000,编码核苷酸结合位点富含亮氨酸重复序列(NBS-LRR)蛋白;该基因在两种基因型之间有很强的差异表达,在最具抗性的品系中表达较高,并具有调节功能,可以解释反式在同一位置检测到eQTL峰值。大多数NBS-LRR蛋白是识别特定病原体分子的细胞质受体,触发导致植物防御反应的信号级联[26.].促进对疾病的抵抗力几个小麦NBS-LRR基因已被映射和育种计划[被用于改善27.].含NBS-LRR的基因在生长过程中的上调禾谷镰刀菌感染也有报道在小麦品种[12.,28.].1AL QTL区间中的其他DEG独联体靠近1AL的eQTL反式eQTL热点包括一个agenet和溴 - 相邻的同源性(BAH)结构域的蛋白(TraesCS1A01G426500)中的Na-易位NADH醌还原酶亚基(TraesCS1A01G432900)和RNA结合蛋白(TraesCS1A01G433000)。Agenet和BAH结构域都被用于组蛋白,染色质重塑和调控基因表达的[识别表观遗传标记的相关29.].很少有含有蛋白质的Agenet / BAH结构域的特征在于植物;然而拟南芥EML1是一种含agenet的蛋白质,是霜霉病种特异性免疫和基础防御所必需的[30.]NADH醌还原酶参与活性氧物种(ROS)的代谢,并可能在植物防御中发挥作用,因为在受真菌病原体感染的植物(包括小麦)中,穿透部位的氧化爆发是一种常见的反应[31.].该rna结合蛋白包含一个透明质酸结合域(HABP4),表明与细胞基质成分相互作用,已知引发植物防御反应[32.]位于1AL区间的两种ATP依赖性锌金属蛋白酶FtsH在易感品系中有较高的表达,并且在两个亲本之间也有差异表达。这些基因在光系统II蛋白D1的转换中起作用,也与活性氧和植物防御有关[33.].
在4BS QTL内的单个基因具有跨所有的比较和高差异表达独联体位于4BS附近的eQTL峰反式eQTL热点。含蛋白质的F-箱/ LRR结构域这个基因(TraesCS4B01G024600)码,一类蛋白质和激素信号传导[降解相关联34.];该基因是4BS QTL的一个很好的候选基因,本文提供的数据表明该基因在小麦对FHB的早期反应中起调节作用。另一个基因型之间以及大多数易感和抗性株系之间的DEG (TraesCS4B01G022400)编码一个含DUF21结构域的蛋白,该结构域存在于金属转运蛋白中;然而,独联体与该基因相对应的eQTL峰值与4BS相对较远反式eQTL热点。仅一个基因(TraesCS4B01G016900)在4BS QTL曾与早期易感性相关更高的表达,编码反转录病毒有关的波尔多蛋白;在这种情况下,也独联体eQTL是从遥远的反式因此,eQTL热点不太可能在小麦对FHB的反应中发挥主要调节功能。
我们的分析没有确定反式eQTL热点与5A QTL相关。该区域的两个基因在基因型之间、大多数耐药和易感DH系之间存在差异表达,并与a独联体eQTL。第一种是NAD依赖性蛋白脱酰酶(TraesCS5A01G114700),在大多数抗性品系中有较高的表达;这个基因与其他基因同源拟南芥蒂利亚纳Sirtuin 2(Sirt2),其与线粒体能量代谢和植物基础防御反应的负调节有关[35.,36.].第二个基因(TraesCS5A01G196700)与易感性有关,编码泛素。泛素化控制植物中不同的细胞过程,包括调节植物防御反应[37.].最近的一项研究Steiner等。[23.], 5A QTL与I型抗性和花药膨出有关。虽然在控制小麦花药挤压的一个5A QTL所覆盖的基因列表中[38.],在这里提出是否DEGS在这一现象中发挥作用尚不清楚。
总之,结果表明,组合QTL一样,eQTL和差异基因表达分析增强的候选基因的用于控制到FHB初阻力在小麦的识别。需要进一步的工作来确认候选,并且可以包括增加标记物的密度在感兴趣的区域,附加十字,以获得携带单个QTL线以促进下游分析,以及遗传操作(例如,基因组编辑[39.])来评估每个个体的基因的作用。
结论
我们已经确定了三个重要的QTL:1AL与DON水平降低相关,而4BS和5A与DON水平降低相关禾谷镰刀菌2 dpi的水平。阻力等位基因是从武汉1的继承1AL和4BS QTL,并从纽约州遗传到5A QTL。transEQTL热点在大致与1AL和4BS染色体臂上的QTL大致相同的位置。鉴定了对应于QTL和EQT1的候选基因,包括QTL 1AL中的NBS-LRR抗病蛋白和QTL 4BS中的F型箱/ LRR蛋白。
方法
植物材料
八十一加倍从十字架武汉1 x忍者的双倍倍数线[9,40]在本研究中使用了两种方法。武汉1号种子从墨西哥国际玉米和小麦改良中心(CIMMYT)获得(加入BW11778),Nyubai种子从美国国家小谷物收藏中心获得(加入PI 382154)。植物生长在控制环境柜中,共有16株 h在20点亮 摄氏度和8度 他16岁时天黑了 摄氏度,直到花期中期。花期中期的花球点接种10 μLα禾谷镰刀菌(DAOM233423,真菌培养物收集,Canada agricultural and agi - food Canada, Ottawa, Canada)大孢子悬液1 × 105.大孢子/毫升使用微管之间的外稃和两个基生小花的每一个完全发展的小穗,在每个处理的头。接种后,植物被转移到25°C的生长室,在那里他们头顶上被喷雾;罐子是随机摆放的。在光照期,每1 h喷雾30 s,持续2 d。以2 dpi采集接种头,每条DH线将5至6个完整头汇集到一个样品中。在霉菌毒素DON的定量检测之前,从每个样品中提取的磨碎组织被冷冻干燥并称重。DON分析使用DON特异性抗体和ELISA分析[41.].报告的DON浓度相当于每个样品两次技术重复的平均值。
RNA提取、测序和反转录定量PCR
使用Illumina HiSeq 2500提取总RNA并进行深对端RNA测序,如[12.].原始数据下加入GSE123548存放在NCBI基因表达综合。如所述进行cDNA和逆转录定量PCR(RT-qPCR的)的合成42.].四个小麦基因用于数据标准化:甘油醛-3-磷酸脱氢酶(GAPDH,TraesCS7A01G313100),吲哚-3乙醛氧化酶(IAAOx,TraesCS2A01G246300),胺氧化酶(AOx,TraesCS2A01G327600)和异质核核糖核蛋白Q(hn-RNP-Q,TraesCS2A01G390200)。对于真菌生物量估计,两个禾谷镰刀菌基因测定:β微管蛋白(FGSG_09530)及GAPDH (FGSG_06257).以前的工作表明,这两个基因的表达与量高度相关禾谷镰刀菌DNA感染植物样品中,是真菌生物的一个很好的估计[43.].所有的引物(附加文件10.),包括针对1A和5A染色体上基因的基因组特异性引物,其设计和合成如[42.].
RNA序列数据分析
国际小麦基因组测序联盟(IWGSC)RefSeq v1.0小麦基因组[44.]和ENSEMBL真菌(释放35)禾谷镰刀菌菌株PH-1基因组[45.]被用于RNA-SEQ数据分析。小麦禾谷镰刀菌基因组和基因注释在读比对之前结合在一起。RNA-seq读取按照中所述进行预处理[12.].使用DESeq2 R包进行差异基因表达分析[46.],使用默认的负二项分布GLM拟合和瓦尔德统计。差异表达的基因使用绝对日志选择2.常设费用 > =1和Benjamini Hochberg调整P.-值<=0.01。相同的程序和参数用于分析不同的数据集[12.来识别双亲之间的差异。
基因分型
基因分型of 81 DH lines was performed using the Illumina wheat 90 K Infinium iSelect SNP array [47.]并结合以往的SSR标记进行基因分型[9,48.]修改后的基因图谱(附加文件11.).总共12325个SNP和SSR标记物保留的遗传图中的结构。共分离标记的垃圾桶,分别使用MSTmap [确定49.].使用最小LOD分数4和最大重组分数(RF)0.25创建连锁群,并使用Kosambi映射函数将重组分数转换为centimorgan(cM)映射距离。
基因型数据分析
对于QTL分析,基因型概率和由海利 - 诺特回归一个基因组扫描,使用R / QTL2执行的处理50.],用四种表型测量(%成品读,浓度,成品-GAPDH和成品-βTUB)。缺失基因型数据使用使用隐马尔可夫模型[计算条件概率估算50.].使用一个的下降值测定LOD支撑间隔[51.].对于eQTL LOD值是使用12325个标记和基因表达数据为110790个小麦基因而计算。对于这种分析方法一样,eQTL被认为是独联体如果相应的基因在同一染色体上且在LOD支持区间内,则反式另外,利用核密度评估eQTL峰的分布[52.,53.] using a chosen bandwidth of 10 cM, and hotspots intervals were defined using peak width at 75% height.
标志物的序列比对
利用BWA-MEM分别对SNP和SSR引物序列与小麦伪分子进行比对[54.]和Bowtie2 [55.].保留了9715个> =95%同源和> =95%查询长度的最佳比对标记。其中,共鉴定出6991个遗传距离和物理位置一致的标记。利用三次平滑样条拟合将标记遗传位置(cM)转换为物理位置(Mbp)。
可用性数据和材料
在这项研究中产生的RNA-seq的数据下加入GSE123548在NCBI基因表达综合可用。分析数据可以作为附加文件这篇文章。
缩写
- %成品读:
-
百分比禾谷镰刀菌读取
- 巴哈:
-
溴相邻同源性
- cM:
-
厘摩(s)
- 度:
-
差异表达基因(S)
- 卫生署:
-
加倍单倍体
- 大学教师:
-
Deoxynivalenol
- DPI:
-
接种后的日子
- eQTL:
-
数量性状基因座的表达
- FHB:
-
赤霉病
- GAPDH:
-
甘油醛3-磷酸脱氢酶
- LOD:
-
赔率的对数
- MBP:
-
兆基对
- NBS-LRR:
-
核苷酸结合位点富含亮氨酸重复序列
- QTL:
-
定量特质基因座
- RNA序列:
-
高通量RNA序列
- 活性氧:
-
活性氧物种
- RT-qPCR:
-
定量逆转录聚合酶链反应
- SNP:
-
单核苷酸多态性
- SSR:
-
单个序列重复
- β桶:
-
β微管蛋白
参考文献
- 1。
FAOSTAT [www.fao.org/faostat].于2019年1月18日查阅。
- 2。
国际小麦基因组测序联合会(IWGSC)。一种基于染色体的六倍体面包小麦序列草案(小麦)基因组。科学。2014; 345(6194):1251788。
- 3.
Foroud NA,查特顿S,里德LM,金顿TK,Tittlemier SA,加拿大谷物作物的GräfenhanT.枯萎病:影响和疾病管理策略。在:未来挑战作物保护,防止病原真菌。纽约,纽约:Springer;2014. p。267-316。
- 4.
白刚,夏尔尔。小麦和大麦枯萎病的防治与抗性。植物病理学杂志2004;42:135-61。
- 5。
Wegulo Sn,Baenziger PS,Nopsa JH,Bockus WW,Hallen-Adams H.富有镰刀尖头的管理麦芽和大麦。作物科。2015; 73:100-7。
- 6。
Buerstmayr H,潘基T,安德森JA。QTL定位和标记辅助选择用于小麦赤霉病电阻:一个评论。植物品种。2009; 128(1):1-26。
- 7.
薛S,徐福,唐M,周Y,李庚,安X,林福,徐H,贾H,张L.精确定位面包小麦(Triticum aestivum L.)抗镰刀菌感染的主要QTL调节性Fhb5.理论应用遗传学.2011;123(6):1055-63。
- 8.
兰德哈瓦HS,阿西男,Pozniak C,克拉克JM,格拉夫RJ,福克斯SL,堪DG,诺克斯RE,德波RM,辛格AK。分子标记在加拿大小麦育种中的应用。植物品种。2013; 132(5):458-71。
- 9
Somers DJ,Fedak G,Savard M.控制春小麦赤霉病抗性和脱氧雪腐镰刀菌烯醇积累的新基因的分子定位。基因组。2003;46(4):555–64.
- 10。
Appels R, Eversole K, Feuillet C, Keller B, Rogers J, Stein N, Pozniak CJ, Choulet F, Distelfeld A, Poland J.使用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361 (6403):eaar7191。
- 11.
吉尔KS。谷物基因组中的基因分布。:谷物基因组学;2004.p . 361 - 85。
- 12.
Pan Y,Liu Z,Rocheleau H,Fauteux F,Wang Y,McCartney C,Ouellet T.转录组动力学与抗性和敏感性的抗性和易感性在四个小麦基因型中。BMC基因组学。2018; 19(1):642。
- 13。
Venske E,多斯桑托斯RS,法里亚斯DDR,罗瑟V,达马亚LC,Pegoraro C,面包小麦枯萎的QTLome赤霉病抗性的哥斯达黎加奥利维拉A. Meta分析:完善当前的难题。前植物SCI。2019; 10:727。
- 14。
斯坦纳B,Buerstmayr男,米歇尔S,Schweiger的W,Lemmens男,Buerstmayr H.繁殖于线选择用于小麦赤霉病抗性的策略和进展。特罗普植物病理学。2017; 42(3):165-74。
- 15.
伯特PA,Somers的DJ,托马斯·,Cloutier联系S,布鲁尔-巴贝尔A.精细定位Fhb1,一个主要的基因控制面包小麦赤霉病电阻(普通小麦)。Al Appl Genet。2006; 112(8):1465至1472年。
- 16。
拉瓦特N,Pumphrey MO,刘S,张X,蒂瓦里VK,安藤K,天雷HN,Bockus WW,Akhunov E,安德森JA。小麦Fhb1编码具有凝集素结构域和嵌合凝集素的孔形成毒素样结构域赋予抗赤霉病。NAT Genet。2016; 48(12):1576至1580年。
- 17。
苏Z,贝尔纳A,天B,陈华,王殊,马H,蔡S,刘d,张d,李涛,等。在TaHRC缺失突变赋予Fhb1抗赤霉病的小麦。NAT Genet。2019; 51(7):1099-105。
- 18
李国周Ĵ,贾H,高ž,范男,罗Y,赵P,薛S,李N,袁媛等。在小麦赋予赤霉病抗性富含组氨酸的钙结合蛋白基因的突变。NAT Genet。2019; 51(7):1106年至1112年。
- 19
小麦对赤霉病菌全球转录反应的时间-过程表达qtl图谱生物技术学报2017;15(11):1453-64。
- 20。
Semagn K,Skinnes H,BjørnstadÅ,Marøy AG,Tarkegne y.控制‘Arina’和NK93604六倍体小麦群体抗镰刀菌性和低脱氧雪腐镰刀菌烯醇含量的数量性状基因座。作物科学。2007;47(1):294–303.
- 21。
薛S,李庚,贾浩,徐福,林福,唐敏,王毅,安X,徐浩,张磊,等.面包小麦(Triticum aestivum L.)抗镰刀菌侵染的主要QTL条件化抗性Fhb4的精细定位.理论应用遗传学.2010;121(1):147-56。
- 22。
Buerstmayr M, Steiner B, Wagner C, Schwarz P, Brugger K, Barabaschi D, Volante A, Vale G, Cattivelli L, Buerstmayr H.高分辨率定位小麦染色体臂5AS抗枯萎病QTL Qfhs.Ifa-5A。生物技术学报2018;16(5):1046-56。
- 23。
Steiner B、Buerstmayr M、Wagner C、Danler A、Eshonkulov B、Ehn M、Buerstmayr H.镰刀菌头疫病抗性QTL Qfhs的精细定位。Ifa-5A识别了两个与花药挤压相关的抗性QTL。Theor Appl Genet.2019;132(7):2039-53。
- 24。
Buerstmayr H,Steiner B,Hartl L,Griesser M,Angerer N,Lengauer D,Miedaner T,Schneider B,Lemmens M. QTLS在春小麦中对镰刀镰刀菌的分子映射。II。抗真菌渗透和传播。Al Appl Genet。2003; 107(3):503-8。
- 25。
林男,薛SL,张ZZ,张CQ,香港ZX,姚GQ,田DG,朱HL,李CJ,曹Y,等人。与在Nanda2419赤霉病抗性相关的QTL X望水人口。II:I型阻力。Al Appl Genet。2006; 112(3):528-35。
- 26。
Eitas TK,Dangl JL。NB-LRR蛋白:对,件,感知,合作伙伴和途径。CurrOp植物BIOL。2010; 13(4):472-7。
- 27。
Marone D,Russo M,LaedòG,De Leonardis A,Mastrangelo A.植物核苷酸结合位点-富含亮氨酸重复序列(NBS-LRR)基因:宿主防御反应的积极监护人.国际分子科学杂志.2013;14(4):7302-26。
- 28。
库格勒KG,Siegwart G,NUSSBAUMER T,Ametz C,Spannagl男,斯坦纳B,Lemmens男,迈耶KF,Buerstmayr H,Schweiger的宽:定量与赤霉病抗性相关的基因共表达网络的性状位点依赖性的分析面包小麦(普通小麦)。BMC基因组学2013; 14(1):728。
- 29。
Maurer Stroh S、Dickens NJ、Hughes Davies L、Kouzarides T、Eisenhaber F、Ponting CP.都铎王朝的“皇室家族”:都铎王朝、植物学家、chromo、PWWP和MBT王朝。趋势生物化学科学。2003;28(2):69–74.
- 30
土屋T,奥伊尔格姆T. EMSY样都需要全RPP7介导的种族特异性免疫和基础防御在拟南芥的基因。Mol植物微生物相互作用。2011; 24(12):1573至1581年。
- 31。
格林希尔茨DL,刘G,Selvaraj G,响应白粉病小麦感染醌还原酶的魏Y.微分调节。Planta。2005 222(5):867-75。
- 32。
宿主源性信号激活植物固有免疫。植物信号学报。2009;4(1):33-4。
- 33。
Gupta SK,Sharma M,Deeba F,Pandey V.活性氧物种在光合磷酸化和D1蛋白损伤中的作用:过去和现在。in:活性氧物种植物;2018年。第165页。
- 34。
植物发育:蛋白质降解的调节。科学。2002;297(5582):793-7。
- 35。
王超,高芳,吴建军,戴建军,魏超,李永华。拟南芥脱乙酰酶AtSRT2通过抑制PAD4、EDS5和SID2的表达调控基础防御。植物生理学报。2010;51(8):1291-9。
- 36。
柯尼格AC, Hartl M, Pham PA, Laxa M, Boersema PJ, Orwat A, Kalitventseva I, Plochinger M, Braun HP, Leister D,等。拟南芥II类sirtuin是一种赖氨酸脱乙酰酶,与线粒体能量代谢相互作用。植物杂志。2014;164(3):1401 - 14所示。
- 37。
Devoto A,Muskett PR,Shirasu K.泛素化在植物抵御病原体的调节中的作用.Curr Opin plant Biol.2003;6(4):307-11。
- 38。
Muqaddasi QH, Reif JC, Röder MS, Basnet BR, Dreisigacker S.农学。2019;9(7):407。
- 39。
Kumar R,Kaur A,Pandey A,Mamrutha HM,Singh GP。基于CRISPR的基因组在小麦中编辑:全面的审查和未来的前景。Mol Biol rep. 2019; 46(3):3557-69。
- 40.
Somers DJ,Thomas J,Depauw R,Fox S,Humphreys G,Fedak G.组装复杂基因型,以抵抗小麦(Triticum aestivum L.)的镰刀菌。Al Appl Genet。2005; 111(8):1623-31。
- 41
Savard Me,Sinha RC,Lloyd Seaman W,Fedak G.接种后麦考毒素的霉菌毒素脱辛苯酚的顺序分布Fusarium Graminearum..植物病理学杂志。2000;22(3):280-5。
- 42
Hu X, Rocheleau H, McCartney C, Biselli C, Bagnaresi P, Balcerzak M, Fedak G, Yan Z, Vale G, Khanizadeh S, et al.;小麦系武汉1号抗枯萎病2DL QTL相关表达基因的鉴定与定位BMC麝猫。2019;20(1):47。
- 43。
Harris LJ,Balcerzak M,Johnston A,Schneiderman D,Ouellet T.小麦、大麦和玉米感染期间禾谷镰刀菌的宿主优先基因表达.真菌生物学.2016;120(1):111-23。
- 44。
Refseq V1.0小麦基因组组装和注释[https://urgi.versailles.inra.fr/download/iwgsc].2017年5月30日查阅。
- 45。
Fusarium Graminearum.str. PH-1基因组组装与注释[ftp://ftp.ensemblgenomes.org/pub/fungi/release-35].2017年5月30日查阅。
- 46。
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。
- 47。
王S,黄d,福雷斯特K,阿伦A,晁S,黄BE,Maccaferri男,Salvi的S,米尔纳SG,使用高密度90 000单核苷酸多态性阵列多倍体基因组小麦多样性的Cattivelli L.表征。植物Biotechnol J. 2014; 12(6):787-96。
- 48。
面包小麦(Triticum aestivum L.)的高密度微卫星共识图。应用计算机学报。2004;109(6):1105-14。
- 49。
吴y,Bhat Pr,Close TJ,Lonardi S.高效准确地施工遗传联系从图形的最小生成树。Plos Genet。2008; 4(10):E1000212。
- 50.
Broman KW,吴H,森S,丘吉尔GA。R / QTL:在实验杂交QTL作图。生物信息学。2003; 19(7):889-90。
- 51.
Manichaikul A,杜普伊斯Ĵ,森S,KW Broman。自举置信区间的数量性状基因座的位置的表现不佳。遗传学。2006; 174(1):481-9。
- 52.
Scott DW.多元密度估计:理论、实践和可视化。新泽西州霍博肯:Wiley;2015。
- 53
西尔弗曼BW。用于统计和数据分析的密度估计。伦敦:查普曼和霍尔;1986.
- 54
Li H:用BWA-MEM对准序列读取,克隆序列和装配体折叠。Arxiv预印迹arxiv:2013年13033997。
- 55
Langmead B,Salzberg SL.《带蝴蝶结的快速间隙读取校准2.Nat方法》2012;9(4):357-9。
致谢
我们要感谢加拿大萨斯卡通国家研究委员会DNA技术部门进行RNA测序,感谢Barbara Blackwell博士和Sally Buffam博士进行DON分析,感谢IWGSC在出版前访问RefSeq v1.0小麦基因组组装和注释。
资金
该项目由加拿大支持远期成长2项目(项目J-000412),并授予TO,国家小麦改良计划(项目基因组学研究和发展倡议(项目J-000008和J-001580):镰刀筛选、遗传学和标记开发)由西方谷物研究基金会和加拿大农业和农产品联合会授予CM,国家研究委员会授予加拿大的加拿大小麦改良项目A1—011652,授予YP。资助机构在研究的设计、收集、分析或解释数据或撰写手稿方面没有发挥作用。
作者信息
隶属关系
贡献
FF进行数据分析,并编制表格和数字。进行实验设计和数据分析。FF和TO起草手稿。YW对eQTL分析做出了贡献。HR进行实验并生成数据。ZL处理RNA-seq数据。YP有助于统计和基因功能分析。GF提供植物材料。CM生成遗传图谱,用于QTL分析。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
道德认可和参与同意
不适用。
同意出版物
不适用。
竞争利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商说明
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
补充信息
附加文件1。
两个亲本和81个DH品系在2 dpi时真菌生物量的估算。A)禾谷镰刀菌读取RNA序列数据。B)通过ELISA测量真菌毒素DON。(C)禾谷镰刀菌使用RT-qPCR测量GAPDH和D)β-微管蛋白RNA水平。
附加文件2。
遗传距离与小麦染色体标记最佳匹配结果的物理位置。与遗传距离和物理位置(6991出9715次命中)之间一致的行为标记以黑色着色。蓝线对应于遗传距离和6991个标记的物理位置之间的三次样条拟合。
附加文件3。
QTL区间内小麦的基因。gene_id, IWGSC RefSeq v1.0基因ID;空空的,染色体;启动,基因起始位置;结束,基因结束位置;链基因的链;的描述中,IWGSC RefSeq中V1.0基因注释。
额外的文件4。
CIS.和反式eQTL与LOD评分大于意义的阈值。类型,独联体或者反式;字符,峰染色体;POS,以cM峰值位置;LOD,LOD得分;ci_lo,单LOD区间下限;ci_hi,单LOD间隔上限;gene_id, IWGSC RefSeq v1.0基因ID;的描述中,IWGSC RefSeq中V1.0基因注释。
额外的文件5。
基因型之间的差异表达基因在三个QTL间隔的限制内。gene_id, IWGSC RefSeq v1.0基因ID;空空的,染色体;AA,在给定QTL区域中具有基因型AA的DH线路标准化计数的平均值;BB,在给定的QTL区域中具有基因型BB的归一计数的平均值;log2FC,log 2倍数变化;padj,调整P.-价值;的描述中,IWGSC RefSeq中V1.0基因注释。
额外的文件6。
武汉1号、乳白和HC374接种后2天差异表达的比较实验1,Pan et al. 2018;实验二,这篇论文。A)武汉1 vs.玉白;B)武汉1 vs HC374;C) Nyubai vs. HC374。红线对应的是两个实验的log2倍变化之间的线性回归。
额外的文件7。
在2 dpi的差异表达武汉1和Nyubai之间的基因。gene_id, IWGSC RefSeq v1.0基因ID;空空的,染色体;武汉1,意味着武汉1标准化计数的;Nyubai,意味着Nyubai标准化计数的;log2FC,log 2倍数变化;padj,调整P.-价值;的描述中,IWGSC RefSeq中V1.0基因注释。
附加文件8。
极端表型DH系之间的差异表达基因。gene_id, IWGSC RefSeq v1.0基因ID;空空的,染色体;低水平的DH线的标准化计数的平均值禾谷镰刀菌还有唐;HF,具有更高浓度的DH线的标准化计数平均值禾谷镰刀菌和DON;log2FC,log2倍变化;padj,调整P.-价值;的描述中,IWGSC RefSeq中V1.0基因注释。
附加文件9。
如通过RT-qPCR为选择的五个小麦基因定量相对表达水平,并与相关RNA-SEQ数据。
附加文件10。
用于RT-qPCR分析的引物。
附加文件11。
遗传图谱(cM)和基因型调用(A:武汉1号;利用12325个多态标记(SSR标记和小麦90k Infinium珠片阵列的SNP标记)对DH群体进行分析。空空的,染色体;厘米,厘摩。
权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
王永强,罗什洛。等等。的QTL和eQTL早期表征控制Fusarium Graminearum.武汉1×Nyubai加倍单倍体小麦群体的感染和脱氧雪腐镰刀菌烯醇水平。BMC植物BIOL.19,536 (2019). https://doi.org/10.1186/s12870-019-2149-4
已收到:
认可的:
发表:
关键字
- 赤霉病
- 数量性状位点(QTL)
- 表达数量性状位点(eQTL)
- 加倍单倍体(DH)
- Fusarium Graminearum.
- 小麦L