抽象的
背景
在番茄栽培,番茄叶霉病是由一种常见的疾病枝孢属fulvum(C. Fulvum.).通过编码比照蛋白,其能够识别由产生相应AVR蛋白质C. Fulvum.,CF基因提供抵抗力C. Fulvum.,不同Cf基因介导的抗性反应模式也不相同。携带Cf的植物-19基因表现出有效的抗性C. Fulvum.在该领域,可用作繁殖中的新型耐药材料。在这项研究中,鉴定与抵抗有关的关键调节基因,并了解携带CF的番茄植物的抵抗响应过程-19,使用RNA测序(RNA-SEQ)来分析抗性植物响应(CGN18423的响应之间的差异(CGN18423,携带CF-19基因)和敏感植物(Moneymaker (MM),携带Cf-0基因)接种后的0,7和20天(DAI)。
结果
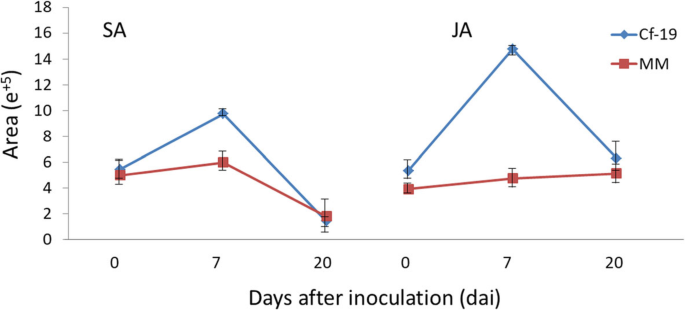
在CGN18423响应过程中特别鉴定了总共418个差异表达基因(DEGS)。基因本体学(GO)分析显示,包括“血浆膜(GO_Component)”,“组氨酸脱羧酶活性(GO_FUCTION)和”羧酸代谢过程(GO_PROCESS)以及其他10种术语的术语显着富集.鉴定了“植物激素信号转导”途径,其在0-7dai比较中的CGN18423独特。此外,从“植物激素信号转导”途径和“植物病原体相互作用”途径筛选了十个关键调节点。激素含量测量显示水杨酸(SA)含量增加和达到7次达,之后在20DAI时死亡并达到CGN18423和MM植物中的最小值。茉莉酸(JA)含量在7次达中增加至非常高的水平,然后在CGN18423中降低到20 dai的几乎初始水平,而在整个过程中略微略微增加,从0到20个达mm。
结论
初始响应是抗性和易感植物之间有很大不同。“植物激素信号转导”途径是Cf的形成有重要-19介导的免疫力。此外,JA和SA在调节CF时发挥作用-19-相关的抗性反应。
背景
番茄(Solanum lycopersicum;番茄叶霉病是一种重要的经济病害,在世界范围内造成相当大的产量损失。这种病是由一种生物营养真菌引起的枝孢属fulvum(C. Fulvum.)[1],它存在许多不同的物理种族并区分迅速。C. Fulvum.抗性基因(Cf基因),提供抗性C. Fulvum.,以野生物种鉴定,随后培育成栽培的番茄。在番茄育种中使用CF基因代表了番茄栽培中叶霉菌病的有效方法[2,3.].
植物进化2种先天免疫机制:PAMP触发免疫(PTI)和效应触发免疫(ETI)4,5].PTI是由模式识别受体(PRR)激活的一种抗性反应,用于识别保守的病原体相关分子模式(PAMPs)。ETI被证明依赖于植物抗性蛋白(R蛋白)直接或间接地识别病原体分泌的蛋白,并激活抑制病原体感染的强抗性反应[6].
番茄和C. Fulvum.对于ETI [的研究模型pathosystems1,7,8].CFS和AVR之间的不同识别机制,包括CF-2 / AVR2 [9]及Cf-9/Avr9 [10.,已经报道过了。许多研究集中在Cf/ avr依赖性防御反应上。Avr4 / Cf-4和Avr9 / Cf-9信号引起相同的光谱响应的基因,而Avr4 / Cf-4-dependent过敏的反应(HR)比Avr9 / Cf-9-dependent人力资源更严重,表明Avr4 / Cf-4 -之间的区别和Avr9 / Cf-9-dependent人力资源最有可能的结果事件上游的防御反应11.,12.].研究表明,在Cf-12年- 介导的电阻响应过程,差异表达基因(DEGS)显着富集在防御信令途径中,例如钙依赖性蛋白激酶(CDPK)途径和茉莉酸(JA)信号通路[13.,并在Cf-10-介导的抗性反应过程中,大多数deg与防御信号通路有关,包括氧化还原过程、氧化还原酶活性和植物激素信号转导[14.].此外,许多转录因子(TF)基因也比照中确定-12年和Cf-10与抵抗相关的DEG,表明TFS在其中发挥着重要作用C. Fulvum.防御反应[2].
CF基因编码受体样蛋白(RLPS),其是包含细胞外富含亮氨酸的重复序列(eLRRs)I型跨膜糖蛋白,跨膜区,和一个短的胞质结构域,其不表现出相似性的已知信号传导结构域[1].通过识别在感染期间分泌到叶子膜质糖中的AVR肽,CF基因产物提供对特定种族的抵抗力C. Fulvum.[1].迄今为止,至少有25种体育比赛C. Fulvum.识别,并且10个效应物(AVR2,Avr4,Avr4E,Avr9,ECP1,ECP2,Ecp4,Ecp5,Ecp6和Ecp7)已被克隆〔15.,16.,17.,18.,19.,20.,21.,22.,23.].二十四个CF基因已被映射到12染色体和6种CF基因(CF-2(Hcr2-2B Hcr2-2C), Cf-5, Cf-4(Hcr9-4D),CF-4E(Hcr9-9B),CF-9(Hcr9-9C),9 DC.(HCR9-M205)[18.,19.,20.,21.,22.,24.]和4 cfecp基因(CF-Ecp1, Cf-Ecp2, Cf-Ecp3和Cf-Ecp5)已经克隆了[2,25.,26.].
Cf -19.基因是一种非常有效的抗性基因,没有感染报告的日期。该基因已被定位于1号染色体的短臂,和一个候选基因,Solyc01g006550.2.1(Cf的等位基因-0),在Cf内进行筛选-4/9基因座作为一种新颖的同源物枝孢属耐药基因Cf-9(Hcr9)[27.].我们以前的研究也表明CF-19在番茄植株上诱导了一个标记的HRC. Fulvum.生理种族1.2.4.5 [28.].在该研究中,我们利用中的cDNA扩增片段长度多态性(cDNA的-AFLP)技术与本体分离分析(BSA)结合以番茄相关到CF基因隔离-19介导的抗性反应。26个差异表达的转录衍生片段(TDFs)在Cf中上调-19-介导的HR过程被分离。Cf的转录谱检测到的大多数基因的表达模式-19介导的防御反应是对CF相似-4-和Cf-9介断的防御反应。SAMDC(TDF35)和eli3.(TDF49)首先在CF中检测到/ Avr相互作用 [28.].由于cDNA-AFLP技术的限制,我们的研究没有获得足够的信息。随着二代测序技术的发展,RNA测序(RNA-seq)已成为分析宿主与病原体相互作用的一种有效方法。RNA-seq技术在植物寄主-病原互作分析中的成功应用-12年或CF.-10)-C. Fulvum.[13.,14.)和番茄苯磺酸苯磺酸镁[29.]交互分析,允许采用可行的方式来研究CF-19介导的耐药反应过程。在本研究中,RNA-SEQ技术将用于分析CF-19介导的耐药反应过程。研究结果将有助于我们进一步了解番茄叶霉病的防御机制,并为寻找防治番茄叶霉病的新途径提供依据。
结果
人工接种
如图所示。1在接种(dai)后7 d, CGN18423 (Cf-19),而易感线摇钱树(MM)的叶片变褪绿和轻微枯萎。在20代,一些显著褪绿斑,被认为是HR的迹象,未观察到对CGN18423植物的叶子,并有大量霉菌生长在MM两侧叶。这些经典的症状表明,我们的人工接种成功,并且在不同时间点收集的植物材料可用于后续分析。
illumina测序,读取映射和鉴定的转录物
在该项目中,使用Illumina Hiseq平台测序18个样本,平均产生4.40 GB。超过97%的读数是Q> 20,其中92%的清洁读数> Q30(附加文件1:表S1)。The data with a quality score > Q30 were used for subsequent analyses. After filtering, an average of 29.32 million clean reads was generated, and at least 85% of these reads were mapped to the tomato reference genome (ftp://ftp.solgenomics.net/tomato_genome/AsseMbly/Build_3.00/);其中,超过83%的清洁读数是独特的映射读数。经转录物重建后,总共35,136个新的转录物,包括已知基因的17,690个未知的剪接事件,1123个新的编码转录物,没有任何已知特征,并获得16,323个长的非编码RNA。
响应度的视角C. Fulvum.接种
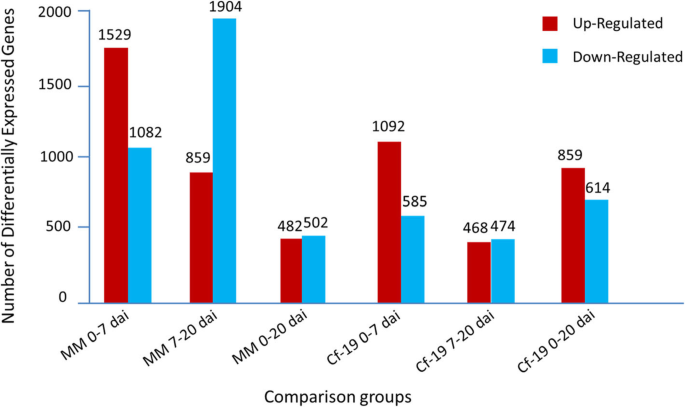
样品之间的差异(图。2)的基础上的基因表达的结果中检测到。在第一阶段期间从0到7戴在两个MM和CGN18423植物中检测到更上调DEGS比下调DEGS。在7〜20戴在第二阶段,在这两个MM和CGN18423植物中检测的上调DEGS比下调DEGS更少。在整个植物病原体相互作用过程中,下调度的视角比在MM上调度的视角更为普遍,而上调度的视角比在CGN18423植物下调度的视角更为普遍。
验证DEG表达模式
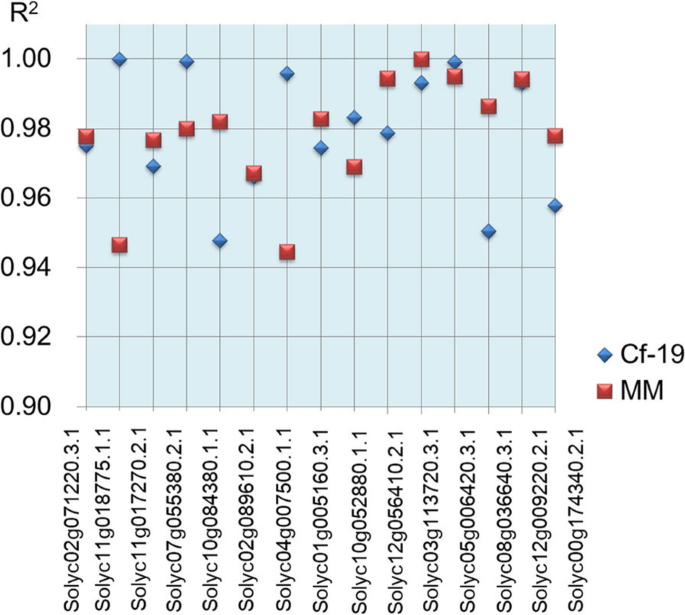
为了验证RNA-seq数据中DEG表达模式的准确性,采用实时定量PCR (quantitative real-time PCR, qRT-PCR)对从DEG中随机选取的15个基因的表达模式进行分析。用于RNA-seq的植物样本包括0、7和20代CGN18423和MM植株的叶片。分别分析了CGN18423(0,7和20 dai)和MM(0,7和20 dai)的表达模式。计算RNA-seq和qRT-PCR结果之间的相关系数,结果显示,两两相关系数(R2值)为0.94和1.0(图之间。3.).这些结果反映了我们的RNA-seq数据的高质量,可以用于后续的分析。
基因本体(GO)富集和京都基因与基因组百科全书(KEGG)通路分析
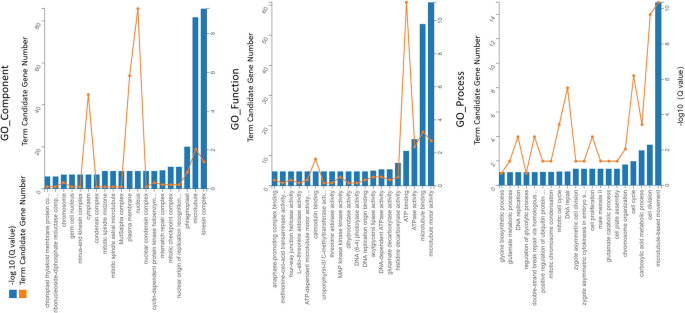
Go分类结果显示在附加文件中3.:图S1。在不同植物的不同阶段的DEGS富集三个本体类别:生物过程,细胞成分和分子功能。与CGN18423相比,MM呈现出更多与几乎所有GO术语相关的基因,除了在7-20 DAI比较中的GO术语“细胞杀戮”之外。与大多数GO术语相关的基因数量在MM植物中植物病原体相互作用的第二阶段增加,降低了CGN18423植物。在CGN18423响应过程中,共鉴定了418次。GO分析显示,GO术语包括“Kinesin Complex(Go_Component)”,“微管电机活动(GO_FUNCTION)”和“基于微管的运动(GO_PROCESS)”以及其他10(Q值<0.05),显着富集(图。4).
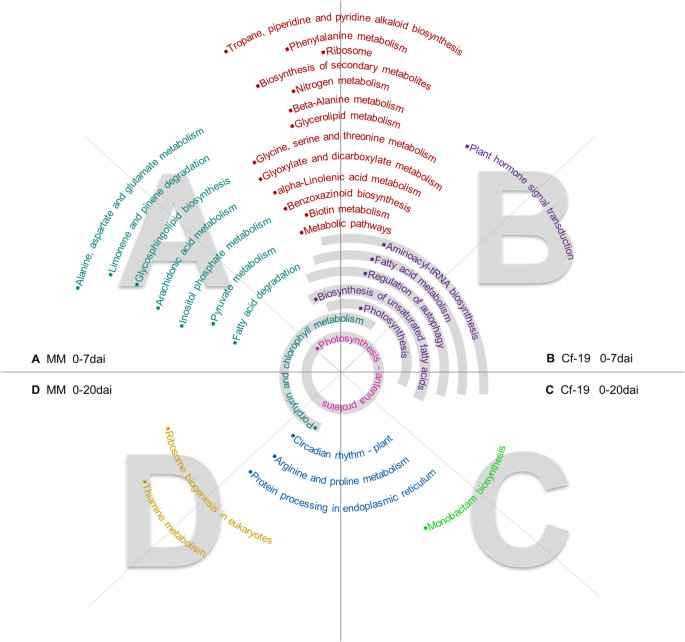
与途径P-Values <0.05被筛选并用于比较分析。如图所示。5,在0-7 DAI比较中检测到更多途径,而不是MM和CGN18423植物中的0-20 DAI比较。在0-7dai比较中MM和CGN18423植物之间常见的二十个途径在MM和CGN18423植物中检测到4种常见的途径在0-20 DAI比较之间。七个和两个途径分别在0-7达达和0-20〜20达比较中毫无独特的途径。两种阶段的CGN18423的样品只有一个独特的途径。“植物激素信号转导”途径在植物对病原体的抗性中起重要作用,对0-7达达比较的CGN18423是独一无二的。
识别来自重要途径的关键调控点
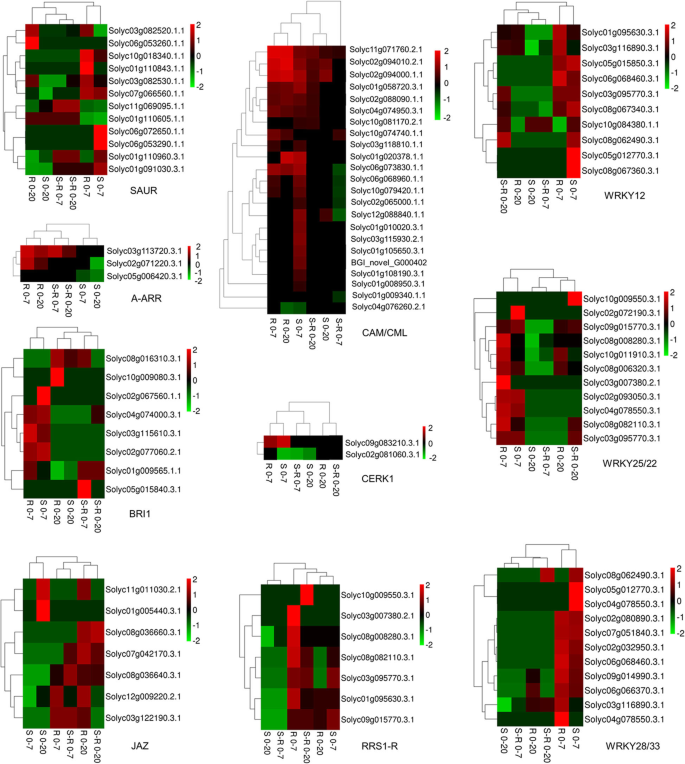
在0-7代比较中,“植物激素信号转导”是CGN18423唯一独特的途径;此外,由于“植物病原互作”是所有植物病原互作研究中的一个重要途径,本节重点讨论这两个途径。在0-7和0-20代比较(垂直比较)中,CGN18423中表达模式上调的基因或在CGN18423植物中与MM植物在相同互作阶段表达模式上调的基因(横向比较)被鉴定为重要的调控点。KEGG分析的通路图(map04075,植物激素信号转导;map04626,植物-病原互作)。如附加文件所示4:图S2,“色氨酸代谢”途径中的“SAUR”,“玉米素生物合成”途径中的“A-ARR”,根据上述抗性相关表达模式,从“植物激素信号转导”途径中鉴定出油菜素内酯生物合成途径中的“bri1”和“α-亚麻酸代谢”途径中的“JAZ”。在“植物病原体相互作用”途径(附加文件5图S3)、“CaMCML”、“WRKY25/22”、“WRKY28/33”、“CERK1”、“RRS1-R”和“WRKY1/2”。
关键监管点基因表达模式分析
在关键调节点的基因表达模式的进一步分析进行。的详细信息的表达示于图。6作为热图。在不同的调节点的基因6组中的比较显示出不同表达模式。大多数基因在表现出显著上调表达模式“R 0-7”,“R 0-20”,“S-R 0-7”和“S-R 0-20”的比较,特别是在“R 0-7”比较。在“植物激素信号转导途径”全部监管点,用“A-ARR”和“JAZ”相关的基因表现出更均匀的基因表达模式聚类结果,这意味着在这两个点的基因的反应模式是的相似(上调或下调),并且所述基因可能具有相似的功能。在“植物病原体相互作用途径”全部监管点的“CAM / CML”是最大的点,包括23度的视角。在这一点上大多数基因的表达模式在敏感和抗性植物两者0-7岱比较和在抗性植物的0-20戴比较被上调。三WRKY相关监管点,其包含在总共24个基因,在“植物病原体相互作用的途径”进行了鉴定。最WRKY基因显示出在0-7岱比较显著上调的表达模式,而相同的基因的上调是在抗性植物比易感植物更显著。
激素测量
的“关键调节点”识别在“植物激素信号转导途径”和基因表达模式的分析的结果表明,“JAZ”是参与电阻响应过程的重要因素。另外,在“JAZ”的变化可能会影响JA和水杨酸(SA)的功能和内容,JA和SA是参与植物免疫非常重要的激素。为了进一步探讨“JAZ”变化背后的相关现象,我们测量SA和JA内容。结果表明,SA和JA内容在不同的植物不同的波动响应于接种(图7).该SA含量增加,在7代,之后将内容死者和20代达到既CGN18423和MM植物最小值达到顶峰。虽然变化模式是抗感植物相似,有更多的SA在抗性植物比易感植物。该JA内容的抗性和易感植物之间显着不同;的JA含量增加至非常高的水平在7戴但随后在CGN18423下降到接近初始水平在20戴,而它继续从0到20戴在MM在整个过程中略微增加。
讨论
在植物与病原互作的早期,基因表达变化最为活跃
在整个植物-病原体相互作用的过程中,在第7天之后C. Fulvum.接种是一个重要的时间点;这一点上,整个交互过程分成两个阶段,早期和晚期阶段,根据坏死的损伤的外观,将其限定为过敏样症状,并根据基因表达的变化的结果[28.].上(不同的时间点之间的相同植物中基因表达的比较)的不同阶段和不同的材料,(在相同的时间点抗性植物和易感植物之间的基因表达的比较)两种比较,垂直比较的和水平比较的基础,进行了。结果表明,在垂直的比较,有在易感植物更DEGS比在早期阶段的抗性的植物,而在易感植物中检测到更少的DEGS比在后期的抗性的植物。基因表达的改变均在抗性植物比较小比易感植物。在水平的比较,所述基因表达模式在既抗性和易感植物的早期阶段和后期阶段之间有很大不同。在一般情况下,许多基因的表达水平在早期阶段发生变化,虽然一些基因的表达水平在后期恢复到初始水平。这些比较结果表明,与易感植物相比,抗性植物的表现得相对稳定的,并且初期表示两者兼容的相互作用和不相容的相互作用非常重要响应进程。类似的结果也报告了另一块CF基因介导的抗性反应[13.,14.和其他植物与病原体的相互作用[29.,30.].
Cf-19介导的抗性是由SA和JA调控
我们测量SA和JA含量在0,7和20代,发现JA含量在7代的抗性植株提高到非常高的水平。这个有趣的现象也报道了比照-10- 介导的电阻响应[14.].在7代和20代抗性植株中,“JAZ”蛋白点基因表达量显著上调。在本研究中发现在7和20 dai表达上调的JAZ基因Solyc12g009220.1也在Cf中表达上调-12年番茄植株后,C. Fulvum.感染 [13.].“JAZ”是我们在本研究中筛选的四个关键调控点之一。JAZs是SCF的直接目标COI1E3泛素连接酶负调控茉莉酸反应的关键转录激活因子MYC2 [31.].JAZ蛋白表达抑制JA的活化,间接促进SA的活化。我们的结果表明JA和SA激素信号通路都参与Cf-19- 在整个防御过程中在调节JA和SA方面发挥了非常重要的作用。
其他重要的激素调节参与CF-19介导的抗性
植物产生各种各样的激素,包括生长素(auxins)、赤霉素(GAs)、脱落酸(ABA)、细胞分裂素(CKs)、SA、乙烯(ET)、JA、油菜素内酯(brassinosteroids)和肽激素。植物受到各种病原体的感染会导致各种植物激素水平的变化[32.,33.].在本研究中,通过对“植物激素信号转导”途径的研究P-value <0.05,为CGN18423在0-7代比较中所特有。在生长素、CK、GA、ABA、ET、BR、JA和SA等8种激素的信号转导通路中检测到DEGs,揭示了一个复杂的信号转导网络。通过对生长素、CK、BR和JA激素信号通路的抗性响应变化模式的比较分析,揭示了4个关键调控点。除上述“JAZ”外,在“植物激素信号转导”途径中还发现了另外三个关键调控点:“色氨酸代谢”途径中的“SAUR”、“玉米素生物合成”途径中的“A-ARR”和“油菜素内酯生物合成”途径中的“BR-INSENSITIVE 1 (bri1)”。这些关键都参与了植物细胞的形态变化,如细胞的增大和分裂。这些结果表明,细胞形态的改变也与防御过程有关。
加利福尼亚州2+信号处理在兼容交互和不兼容交互之间是不同的
钙调素和钙调蛋白 - 样(CML)蛋白两种钙(Ca2+)粘附在CA的蛋白质2+信号的过程。这些蛋白质在植物免疫中发挥重要作用,特别是在抗性反应的早期阶段[34.].在这项研究中,在耐药植物和易感植物之间的0-7 DAI比较中出现了凸轮/ CML基因表达模式中最明显的差异。许多基因的表达水平在易感植物中显着上调,但不在抗性植物中,表明在病原体感染期间的钙信号转导在CGN18423和MM植物之间不同。以前的研究报告,PAMP诱导的钙尖峰与共生期间诱导的钙尖峰不同[35.,36.].我们的结果可能表明,效应诱导的钙尖峰也不同于共生期间诱导的钙尖峰。
PTI参与了番茄携带Cf的抗性反应-19和C. Fulvum.相互作用
植物中微生物识别引发的防御反应有两个层次。第一层是PAMP,它导致PTI [37.].第二级涉及细胞内免疫受体,识别宿主细胞内分泌的病原体毒力效应物,从而诱导ETI [4].Cf/Avr相互作用是ETI研究的一个模型,而许多PTI的重要成分BRI1 deg和CERK1 deg的表达水平[38.,39.,40,在本研究中0-7 dai比较中显著上调。这些deg的表达模式与PTI过程中的表达模式一致[39.,41.].复杂家族的成员腕表的成员涉及调节与植物免疫应答相关的转录重编程。在这项研究中,发现许多WRKY TFS的表达在相互作用的早期阶段非常显着地上调。这些腕表中的一些TFS在PTI过程中发挥重要作用[42.,43.,44.,45.].以上提到的所有PTI相关基因表明,PTI参与了携带Cf的植物的早期反应-19而且感染了C. Fulvum..
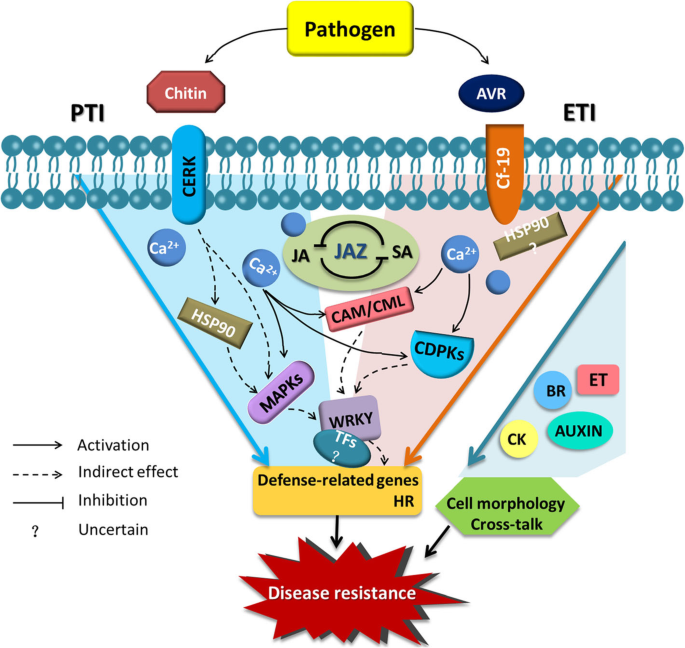
CF的假定模型-19端依赖电阻响应
根据调查结果在本研究中和在植物免疫文献的基础[46.,47.]我们推测了CF的一般过程-19-相关的抗性反应。如图所示。8,当植物携带CF时-19都感染了C. Fulvum.病原体,触发ETI和PTI。ETI被AVR和CF-19蛋白之间的识别引发,并且通过CERK和甲壳素之间的识别引发了PTI。识别之后是CA的涌入2+,其中一些与不同的凸轮/ CML蛋白结合到有源下游信号传导途径。细胞溶质CA的增加2+浓度也可以为CDPK信号成分的激活创造适当的条件。丝裂原活化蛋白激酶(MAPK)模块也可以在上游变化后被激活,包括热休克蛋白90 (HSP90)的激活。许多转录因子,特别是wrky,积累并间接调控防御相关基因的表达。这些变化最终导致了防御相关基因和HR的表达。在整个抗性反应过程中,SA和JA都发挥着重要的调节作用,JAZ是维持这两种激素平衡的关键因素。此外,ck、BRs、生长素和ET通过改变细胞形态或影响激素调控网络中的其他交互作用,在抗性反应中发挥重要作用。
携带Cf的番茄植株抗性反应模型-19而且感染了C. Fulvum..PTI和ETI都参与了阻力响应。由Jaz维护的JA和SA之间的平衡是响应过程中的主要监管因素。PAMP:病原体相关的分子模式;PTI:PAMP触发的免疫力;ETI:效应触发的免疫力;CAM:钙调蛋白;CML:钙调蛋白样;MAPK:丝裂剂激活蛋白激酶;CDPK:钙依赖性蛋白激酶; HSP90: Heat shock protein 90; JA: jasmonic acid; SA: salicylic acid; JAZ: jasmonate ZIM-domain; GA: gibberellin; ABA: abscisic acid; CK: cytokinin; ET: ethylene; BR: brassinosteroid; HR: hypersensitive response
结论
在该研究中,在转录组重建后,总共获得了35,136个新的转录物。DEG分析显示,抗性和易感植物之间的初始反应非常不同,对植物免疫性非常重要。而且,早期的加利福尼亚州2+信令进程是相容的相互作用和不相容的相互作用之间的不同。“植物激素信号转导”途径和“植物病原体相互作用”途径,其中包括十大重点监管点,是比照重要-19介导的电阻响应,尤其是在初始阶段,并且PTI和ETI都涉及阻力响应。最后,Jaz Proteins维持的JA和SA之间的平衡可能在调节CF方面发挥关键作用-19依赖性电阻响应。
方法
植物材料处理
抗性系CGN18423(携带Cf-19基因由蔬菜和鲜花研究所提供,中国农业科学院)和敏感线MM(携带CF-0在东北农业大学园艺实验站栽培。接种CGN18423苗30株和5 ~ 6叶期MM苗30株C. Fulvum.比赛为1.2.3.4。在接种前、接种7代和接种20代分别采集叶片样品。所有叶片样品在提取RNA前立即用液氮冷冻,并保存在−80°C。每个处理准备3个生物重复。
RNA提取和Illumina测序
根据制造商的说明,使用植物RNA迷你试剂盒(沃森,中国)从叶子样本中提取总RNA。提取的总RNA交给华大基因科技(中国深圳)公司进行高通量测序。以下是公司提供的详细实验方法。用寡核苷酸(oligo, dT)从总RNA(经DNase I处理)中分离mRNA样本。利用纯化的mrna构建了18个cDNA文库。然后,根据Illumina协议,使用Illumina HiSeq4000机器对库进行测序[13.,48.].
RNA-SEQ读取和DEG识别的映射
这些数据是由SOAPnuke软件过滤的。去除带有适配器或测序质量小于5的读取[13.,48.].被过滤的读取被映射到番茄(番茄基因组联盟,2012)。基因表达水平通过将读计数归一化到每千碱基转录本(FPKM)的对齐片段来量化[49.,50.].
对转录物(HISAT)的剪接对准分层索引被用来对准末端配对清洁读取到参考基因组[13.,51.].利用noise eq方法结合噪声分布模型来检测DEGs [52.,53.].具有纠正的假发现率(FDR)P值≤0.05,绝对值log2Ratio≥1为阈值,定义显著差异显著度[54.].新颖转录物使用StringTie [重构55].
度的视角的GO富集和KEGG分析
显著丰富的GO术语(P值<0.05)由GOseqř包分析进行鉴定[56.].显著富集KEGG代谢途径通过使用KOBAS(V2.0)的超几何试验检测(http://kobas.cbi.pku.edu.cn/)分析[57.].
QRT-PCR分析
选择十五次Degs进行表达验证。引物(附加文件2:表S2)设计有底漆5.0软件。根据我们之前研究的方法进行QRT-PCR(包括反应混合物和热条件)[27.].反应在iQ5系统(Bio-Rad,美国)上进行。数据通过2——∆∆CT方法 [58.], 和EFα1用于归一化的基因[59].
激素测量
使用Llugany等人的改性方法从叶中提取内源SA和JA。(2013)[60.]和刘等人。(2018)[14.].随后根据制造商的说明(AB Sciex Qtrap 5500,USA),随后使用液相色谱 - 质谱(LC-MS)测量SA和JA浓度。
数据和材料的可用性
所有样本的干净数据已提交至美国国家生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov),以及序列读取存档(SRA)登录号为SRP157120。
缩写
- 阿巴:
-
脱盐酸
- AVR:
-
aairulence基因
- BRI-1:
-
BR-Imsissitive 1
- 生物圈:
-
油菜素内酯
- C. Fulvum.:
-
枝孢属fulvum
- 摄像机:
-
钙调蛋白
- cDNA-AFLP:
-
cDNA扩增的片段长度多态性
- CDPK:
-
Calcium-Dependent蛋白激酶
- CML:
-
Calmodulin-Like
- 戴:
-
接种后的天数
- 可见:
-
差异表达基因
- 等:
-
乙烯
- eti:
-
效应触发的免疫力
- 气体:
-
吉布林斯
- 走:
-
基因本体论
- Hcr2:
-
同系物的枝孢属耐药基因Cf-2
- Hcr9:
-
同系物的枝孢属耐药基因Cf-9
- 人力资源:
-
过敏反应
- JA:
-
茉莉酸
- JAZ:
-
斋月zim-域
- Kegg:
-
Kyoto基因和基因组的百科全书
- LRR:
-
富亮氨酸重复
- PAMP:
-
病原相关分子模式
- PRRs:
-
模式识别受体
- PTI:
-
PAMP-Triggered免疫力
- 存在:
-
定量实时PCR
- R基因:
-
抗性基因
- rlps:
-
受体蛋白
- SA:
-
水杨酸
- tdf:
-
转录物衍生的碎片
- TF:
-
转录因子
- 地图:
-
丝裂原活化蛋白激酶
- HSP90:
-
热休克蛋白90
- 质量控制:
-
质量控制
- RSEM:
-
通过期望最大化的RNA-SEQ
- FPKM:
-
每千票次乘积每千次映射的碎片
- HISAT:
-
转录本拼接对齐的层次索引
- 质:
-
液相色谱-光谱法
- NCBI:
-
国家生物技术信息中心
- SGN:
-
Sol基因组学网络
参考
- 1。
Thomma BP, Van Esse HP, Crous PW, De Wit PJ。黄分枝杆菌(Cladosporium fulvum, syn. Passalora fulva)是一种高度特化的植物病原菌,可作为植物病原菌科功能研究的模型。植物学报。2010;6:379-93。
- 2。
Joosten M, De WP。番茄,枝孢属fulvum互动:一个多功能实验系统研究植物病原体相互作用。Annu Rev phytopathol。1999; 37:335-67。
- 3。
RIVAS S,THOMAS CM。番茄和叶片霉菌病原体之间的分子相互作用枝孢属fulvum.为Phytopathol.2005; 43:395-436。
- 4.
Jones JD, Dangl JL。植物的免疫系统。大自然。2006;444:323-9。
- 5。
德维特PJGM,Mehrabi R,范登伯格HA,Stergiopoulos一真菌的效应蛋白:过去,现在和未来。莫尔植物途径。2009; 10:735-47。
- 6。
Rajamuthiah R,Mylonakis E.效应引发了免疫:细菌效应的激活了美观酶中的先天免疫力。毒力。2014; 5:697-702。
- 7.
KE, Jones JDG。番茄不完全显性Cf基因抗性枝孢属fulvum.莫尔植物微生物。1994年; 7:58-70。
- 8.
Balint-Kurti PJ,Dixon Ms,Jones Da,诺尔科特卡,琼斯JDG。RFLP联系分析CF-4和CF-9.基因抗性枝孢属fulvum在番茄。Theor Appl Genet. 1994; 88:691-700。
- 9。
一种番茄半胱氨酸蛋白酶CF-2- 依赖性疾病抵抗和抑制自组装。科学。2002; 296:744-7。
- 10。
Koomangersmann M,Honee G,Bonnema G,De Wit P. AVR9肽Elicitor的高亲和力结合位点枝孢属fulvum存在于番茄和其他茄科植物的质膜上。植物细胞。1996;8:929-38。
- 11.
洪W,XU YP,Zheng Z,Cao JS,CAI XZ。CDNA-AFLP的比较转录物分析显示了AVR4 / CF-4-和AVR9 / CF-9依赖性防御基因表达的类似模式。莫尔植物途径。2010; 8:515-27。
- 12.
蔡旭,Takken FLW, Joosten MH, Wit PJ。对Avr4和Avr9的特异性识别可导致不同的番茄超敏细胞死亡模式,但防御相关基因表达模式相似。植物学报。2001;2:77-86。
- 13。
薛东,陈旭,张洪,柴旭,蒋建军Cf-12- 介导的阻力响应枝孢属fulvum在番茄。前植物SCI。2017; 7:2012。
- 14。
Liu G, Liu J, Zhang C, You X, Zhao T. Physiological and RNA-seq analyses for response mechanism . acta optica sinica(生物谷bioon.comCf-10以介导性枝孢属fulvum番茄感染。植物mol biol。2018; 19:15。
- 15.
JAL VK,GFJM VDA,德维特PJ。真菌病原体的无毒基因Avr9的克隆和鉴定cDNA的枝孢属fulvum,番茄叶霉的致病因子。植物微生物学报1991;4:52-9。
- 16。
van den ackerveken gf,jal vk,joosten mh,莫斯克jm,普鲁斯特·赫姆,德奇特PJ。真菌番茄病原体的两个推定致病基因的表征枝孢属fulvum.莫尔植物微生物。1993年; 6:210-5。
- 17.
Joosten MH,Cozijnsen TJ,De Wit PJ。通过单一碱基变化在无流动基因中失去的宿主对真菌番茄病原体的抗性。自然。1994年; 367:384-6。
- 18.
Dixon MS, Jones DA, Hatzixanthis K, Ganal MW, Tanksley SD, Jones JD。高分辨率的番茄物理位置地图Cf-2基因。莫尔植物微生物。1995年; 8:200-6。
- 19.
迪克森女士,琼斯大,凯德·杰斯,托马斯·厘米,哈里森克,琼斯JDG。番茄Cf-2疾病性源位管料COMP上升了编码富含亮氨酸的重复蛋白的两种功能基因。细胞。1996年; 84:451-9。
- 20。
迪克森MS,Hatzixanthis K,琼斯DA,哈里森K,琼斯JDG。番茄Cf-5抗病基因和六个同源物显示出富含亮氨酸重复拷贝数明显等位基因变异。植物细胞。1998; 11:1915至1925年。
- 21。
Thomas CM, Jones DA, Parniske M, Harrison K, Balint-Kurti PJ, Hatzixanthis K, Jones JDG。番茄的特性Cf-4抵抗的基因枝孢属fulvum识别确定识别特异性的序列CF-4和CF-9..植物细胞。1997; 9:2209-24。
- 22。
Laugé R, Joosten MH, Haanstra JPW, Goodwin PH, Lindhout P, De Wit PJ。在番茄中成功地找到了一种针对真菌病原体致病因子的抗性基因。美国国家科学学院学报1998;95:9014-8。
- 23。
李思,赵tt,李hj,徐xy,李杰夫。第一份赛赛量2.5和2.4.5枝孢属fulvum(syn。Passalora叶),是中国番茄叶霉病的致病真菌。植物病理学杂志。2015;81(2):162-5。
- 24。
Bakker EG, toomajan C, Kreitman M, Bergelson J.全基因组调查R基因多态性一个rabidopsis..植物细胞。2006; 18:1803-18。
- 25。
Laugé R, Joosten MH, Van Den Ackerveken GF, Van Den Broek HW, De Wit PJ。植物体内产生细胞外p蛋白ecp.1和ecp.2的枝孢属fulvum是毒力因素。莫尔植物微生物。1997年; 10:725-34。
- 26。
Laugé R, Goodwin PH, De Wit PJ, Joosten MH.分泌p蛋白的特异性hr相关识别枝孢属fulvum存在于寄主和非寄主植物中。植物j . 2000; 23(6): 735 - 45。
- 27。
赵T,江j,刘g,他,张H.番茄映射和候选基因筛查枝孢属fulvum耐药基因Cf-19,基于高通量测序技术。BMC植物BIOL。2016; 16:51。
- 28。
赵T,刘G,李S,李江,江J.差异表达的相关基因转录Cf-19- 介导的阻力响应枝孢属fulvum,番茄感染。植物学报(英文版);2015;
- 29.
杨H,赵T,江Ĵ,陈X,的张H.转录组分析钐-介导的过敏反应苯磺酸苯磺酸镁在番茄。前植物SCI。2017; 8:1257。
- 30.
xing m,lv h,ma j,xu d,李h.转录组仿形的抗性尖孢镰刀菌F。sp。康复西班牙人白菜(甘蓝)根。Plos一个。2016; 11:E0148048。
- 31。
Chini A, Fonseca S, Fernández G, Adie B, Chico JM。JAZ家族的阻遏子是茉莉酸信号通路中缺失的一环。大自然。2007;448:666 - 71。
- 32。
Adie BAT, Perez-Perez J, Perez-Perez MM, Godoy M, Sanchez-Serrano JJ。ABA是影响拟南芥ja生物合成和防御激活的重要信号。植物学报2007;19:1665-81。
- 33。
罗伯特 - Seilaniantz A,纳瓦罗L,巴里R,琼斯JD。病理激素失衡。CURR OPIN植物生物学。2007; 10:372-9。
- 34。
王志强,王志强,王志强,等。钙/钙调素对植物免疫功能的影响。BBA-Mol Cell Res. 1833; 2013:1766-71。
- 35。
唐妮阿尔。植物免疫中的钙信号:一个尖锐的问题。新植物。2015; 204:733-5。
- 36。
Morieri G,Martiinez Ea,Jarynowski A,Driguez H,Morris R.与\ R相关的特定于宿主的点数因子,Medicago truncatula根瘤感染不同程度地引起根毛中钙内流和钙尖刺。新植醇。2013;200:656 - 62。
- 37。
阿布拉莫维奇,安德森,马丁。植物天然免疫的细菌诱导与逃避。《细胞生物学》2006;7:601-11。
- 38。
Heese A, Hann DR, Gimenez-Ibanez S, Jones AME, Rathjen JP。类受体激酶SERK3/BAK1是植物先天免疫的中枢调节因子。中国科学院院刊。2007;104:12217-22。
- 39。
Gimenez-Ibanez S,Hann Dr,Ntoukakis V,Petutschnig E,Lipka V. Avrptob靶向Lysm受体激酶Cerk1,以促进植物的细菌毒力。Curr Biol。2009; 19:423-9。
- 40.
宛Ĵ,张X,Neece d,Ramonell KM,克拉夫SA。LysM结构受体样激酶在几丁质信令和在拟南芥真菌抗性中起关键作用。植物细胞。2008; 20:471-81。
- 41。
Wang X ., Kota U ., He K ., Blackburn K ., Li J.。Dev细胞。2008;15:0 - 235。
- 42。
Menke FLH,Kang Hg,Chen Z,Park JM,Kumar D.烟草转录因子Wrky1由地图激酶Sipk磷酸化,并在烟草中介导HR样细胞死亡。莫尔植物微生物。2005; 18:1027-34。
- 43。
Andreason E,Jenkins T,Brodersen P,Thorgrimsen S,Petersen NHT。地图激酶底物MKS1是植物防御反应的调节器。Embo J. 2005; 24:2579-89。
- 44。
关键词:拟南芥,WRKY22转录因子,淹没,免疫植物细胞。2013;25:2699 - 713。
- 45。
Lippok B,Birkenbihl RP,Rivory G,布鲁默Ĵ,Somssic IE。的AtWRKY33编码病原体或PAMP响应WRKY转录因子表达是由含有W箱元素的复合DNA基序调节。莫尔植物微生物。2007; 20:420-9。
- 46。
Cui H,Wang Y,Xue L,Chu J,Yan C.Pseudomonas inringae乳头蛋白AVRB Perturbs通过激活映射激酶4.细胞宿主微生物。2010; 7:164-75。
- 47。
模式触发免疫(PTI)的信号传导机制。摩尔。2015;8:521-39。
- 48。
张W,宋W,张ZQ,王高清,杨MM,GUO RJ,LI ML。转录组分析花绒花绒寄甲(鞘翅目:鞘翅目)利用Illumina HiSeq测序。《公共科学图书馆•综合》。2014;9:e100673。
- 49。
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Pachter L.转录程序组装和RNA-SEQ定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28:511-5。
- 50.
杜威CN,博L. RSEM:从RNA-SEQ数据精确转录定量具有或不具有参照基因组。BMC生物信息学。2011; 12:323。
- 51.
金d,Langmead B,Salzberg SL。HISAT:快速拼接矫正低内存需求。NAT方法。2015; 12:357-60。
- 52.
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:106。
- 53。
Tarazona S,Furió-taríP,Turràd。用噪声仪R / BIOC包的RNA-SEQ中差异表达的数据质量意识分析。核酸RES。2015; 43(21):E140 GKV711。
- 54。
控制错误发现率:一种实用而强大的多重检测方法。[J R Stat Soc B. 1995; 57:289-300 .]
- 55。
Pertea男,Pertea通用,安东内斯库CM,长TC,门德尔JT。Stringtie能够改善转录组的重建从RNA-SEQ读取。NAT BIOTECHNOL。2015; 33:290-5。
- 56。
陈泽忠,薛超,朱松,周帆,凌晓波,刘桂平,陈立波。Go pipe:基于统计的批量匿名序列的基因本体注释。生物化学学报。2005;32:187-91。
- 57。
Kanehisa M, Goto S, Furumichi M, Tanabe M, Hirakawa M. KEGG代表和分析涉及疾病和药物的分子网络。核酸学报2010;38:355-60。
- 58。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25:402-8。
- 59。
Rotenberg D, Thompson TS, German TL, Willis DK。方法对病毒诱导的基因沉默进行有效的实时RT-PCR分析。中华流行病学杂志。2006;138:49-59。
- 60.
陈志强,王志强,王志强,等。镉超富集体中茉莉酸和水杨酸的含量Noccaea(菥)早熟暴露于真菌感染和/或机械应力。植物细胞代表2013; 32:1243-9。
致谢
我们要感谢广州先生在稿件提交期间为他的乐于助人的帮助。
资金
这项工作的设计是由中国农业研究系统的支持(CARS-23-A-16)和中国国家重点R&d项目(2017YFD0101900);Analysis and interpretation of data were funded by the Chinese Postdoctoral Science Foundation (2018 M630333), the Heilongjiang University Innovative Talents Training Plan (UNPYSCT-2018169), and the Science Foundation of Heilongjiang Province (C2017024); Writing the manuscript was funded by and the Outstanding Youth Science Fund of Northeast Agricultural University (17QC07).
作者信息
隶属关系
贡献
TTZ和XXY设计作品并撰写稿件;DYZ、ZYW、YFB、HHY、YX进行了实验;JBJ分析了数据;HZ、QSC、JFL在提交前对作品进行了修改;WHL和ZTZ进行了最终修订。所有作者阅读,审查和批准提交的版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
过滤后测序读数摘要。在表S1中示出了详细信息,包括illumina Q20和Q30质量评分。
附加文件2:表S2。
用于qRT-PCR分析的引物。的用于qRT-PCR的引物的序列显示在表S2。
附加文件3:图S1。
度的视角的GO分类。X轴表示DEGS的数量。Y轴表示的GO术语。0-7戴:0和7之间戴比较;7-20戴:7和20戴之间的比较;0-20戴:0和20之间戴比较;戴根有:接种后天。
附加文件4:图S2。
植物激素信号转导途径的关键调控点。在0-7代和0-20代比较中(垂直比较,显示为4个矩形),或在CGN18423植物中与MM植物相比,在相同交互阶段中表达模式上调的基因的通路调控点(横向比较,显示为三轮)被确定为重要的调控点。黄色圆圈表示垂直比较结果,以及蓝色圆圈代表横向比较结果。
附加文件5:图S3。
在植物病原体相互作用途径关键调控点。在0-7代和0-20代比较中(垂直比较,显示为4个矩形),或在CGN18423植物中与MM植物相比,在相同交互阶段中表达模式上调的基因的通路调控点(横向比较,显示为三轮)被确定为重要的调控点。黄色圆圈表示垂直比较结果,以及蓝色圆圈代表横向比较结果。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
赵涛,刘伟,赵昭。et al。转录组分析揭示了番茄携带Cf的反应过程-19和枝孢属fulvum互动。BMC植物生物学19,572(2019)。https://doi.org/10.1186/s12870-019-2150-y
已收到:
接受:
发表:
关键字
- Cf-19基因
- Solanum lycopersicum
- 枝孢属fulvum
- 番茄叶霉
- RNA-seq的
- 电阻响应