摘要
背景
开花是植物生命周期中的一个关键过程。因此,从营养生长到生殖生长的转变受到内源性和环境信号的复杂调控。大刍草(Teosinte) Branched 1/Cycloidea/ prolifprolifercell Factors (TCP)家族转录因子参与了许多生物学过程,但其在植物开花调控中的作用尚未完全阐明。
结果
我们探讨了拟南芥的作用TCP8在植物发育中,特别是在开花控制中。过度的TCP8在长昼和短昼条件下均显著延迟开花TCP8导致各种生长缺陷。的上调TCP8导致更多的mRNA水平的积累开花位点c(方法),是拟南芥的中心花抑制因子。TCP8以依赖于flc的方式运行,例如TCP8过度表达flc-6功能缺失突变体未能延迟开花。春化处理可逆转花期晚的表型TCP8超表达。
结论
我们的研究结果提供了证据TCP8在开花控制方面又增加了我们对分子基础的认识TCP8函数。
背景
从营养生长到生殖生长的转变是开花植物生命周期中最重要的过程之一。因此,开花受到多种内生线索和环境信号的严格而复杂的调控[1].许多研究使用模型植物拟南芥(答:芥)已鉴定出主要的开花相关基因,这些基因被发现与光周期、春化、赤霉素、衰老、温度和自主途径有关[2,3.,4].例如,中央花抑制因子开花位点c(方法)同时参与春化和自主途径。在春化过程中,FRIGIDA (FRI)被激活方法表情时长时间被冷压抑方法表达式[5,6].在自主路径中,开花控制位点a(葬礼),开花位点pa(平安险),开花位点kh结构域(FLK),开花位点y(财政年度),LUMINIDEPENDENS(LD),开花轨迹(FVE),开花位点d(盛名)抑制方法长日(LD)和短日(SD)条件下的表达式[7,8].MADS-box转录因子FLC直接与花整合子的染色质结合开花位点t(英国《金融时报》),constans过表达抑制因子(SOC1)抑制开花[9,10].方法以剂量依赖的方式聚合来自不同途径的信号,起到中央花抑制因子的作用[11].其表达在转录和转录后水平受到多种调控因子的复杂控制[12,13,14].通过大量的研究,方法基因座不仅展示了花期调控的微妙调控,而且为发现基因表达的表观遗传调控提供了重要平台[14].
大刍草(Teosinte Branched 1/Cycloidea) /增殖细胞因子(TCP)家族成员是植物特异性转录因子,参与许多生物学过程,包括开花[15].拟南芥的TCP该家族由24个基因组成,根据其序列特征可进一步分为I类和II类两个支系[16].在以前的研究中已经报道了这两个类的tcp参与调控开花。例如,TCP15通过直接调控来促进开花SOC1表达式[17],而TCP4通过直接结合到君士坦斯(有限公司)诱导开花的启动子[18,19].几种tcp可以通过蛋白质相互作用与FT相互作用来调控花的转变[20.,21].tcp还通过昼夜节律相关途径影响开花。例如,TCP20和TCP22是正调节生物钟相关1(CCA1),而TCP21抑制CCA1表达式[22,23].尽管如此,TCP-FLC相互作用的分子机制仍有待阐明。
我们之前的工作演示了TCP8,一类tcp的成员,直接绑定到等chorisate合成酶1激活植物免疫反应的启动子[24].此外,TCP8还能结合并激活蛋白的启动子EF-TU受体在植物发病过程中[25].此外,在病原体攻击后,TCP8通过蛋白-蛋白相互作用与PR基因1的NON-EXPRESSER和rps4-RLD1的SUPPRESSOR相互作用[26,27].这些结果清楚地表明TCP8参与了植物-病原菌相互作用。其他研究也表明TCP8可能在植物发育和产量决定过程中发挥作用[28,29,30.,31,32,33],但其调节花期的功能尚不清楚。在这项研究中,我们调查的作用TCP8通过过表达控制开花。我们发现TCP8过表达以flc依赖的方式延迟植物开花。此外,TCP8及其同源物在植物发育中是不可或缺的。
结果
TCP8在植物发育过程中普遍表达吗
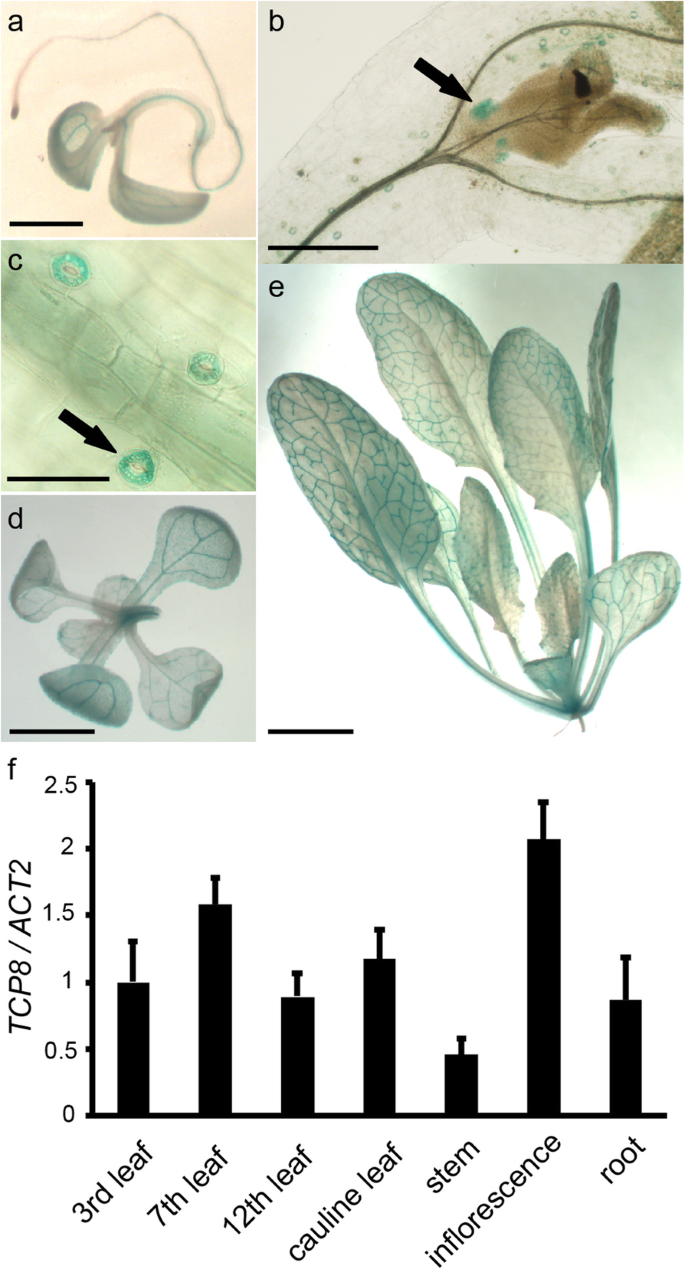
的组织特异性表达模式TCP8在不同的发育阶段,基因的起始密码子上游有一个1.5 kb的启动子区域TCP8被融合在格斯基因和构建物转化为Columbia-0 (Col-0)。几个独立的转基因株系表现出相似的GUS表达模式。TCP8gus信号在转基因植株中普遍存在,在植株发育过程中,gus信号主要在子叶、初生根、下胚轴和莲座叶的维管束中检测到。1a, d, e),相对较高TCP8在叶片原基和气孔保护细胞中均有表达。1B, c,暗示了潜在的作用TCP8在组织起始和气孔功能。然后用实时定量PCR (RT-qPCR)对组织化学GUS染色结果进行验证。一致地,TCP8在莲座叶、茎叶、茎、花序和根等所有组织中均检测到该基因的表达。1f).综上所述,这些结果揭示了TCP8在整个发育过程中,具有潜在的开花功能。
TCP8在LD和SD条件下,过表达均延迟开花
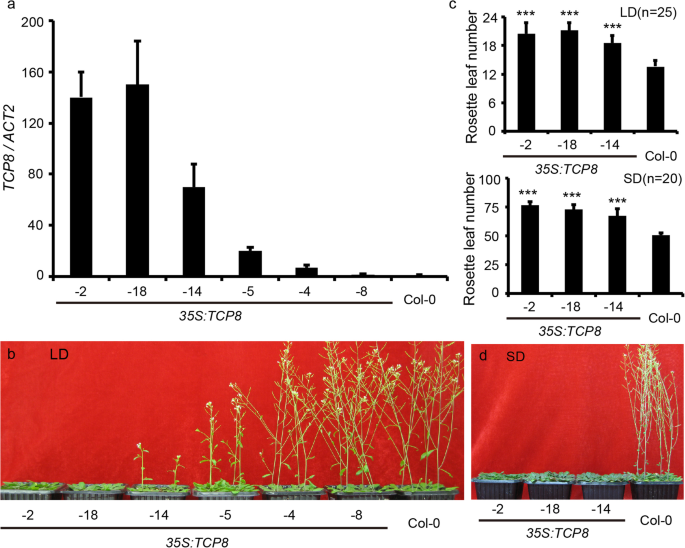
进一步研究的作用TCP8,我们过度表达了TCP8使用本构35S花椰菜花叶病毒启动子(35个年代对Col-0和纯合子T3后代进行分析。的35 s:: TCP8与野生型Col-0相比,长日照条件下植株表现出明显的晚花表型,其延迟程度与Col-0的相对转录水平密切相关TCP8(无花果。2a, b).相似的晚开花表型也被观察到35 s:: TCP8短日(SD)条件下的植物(图;2d).人们普遍认为晚开花植物在开花前通常会产生更多的莲座叶。事实上,TCP8在LD和SD条件下,过表达植株比对照植株产生更多的莲座叶。2c),表明TCP8是一个真正的拟南芥开花调控因子。此外,我们观察到发育迟缓与35 s:: TCP8个体虽最终株高35 s:: TCP8与WT的结果相当(附加文件1:图S1)。
接下来,我们表示TCP8的原生启动子TCP8消除异位表达的影响TCP8在开花。的pTCP8: TCP8植物拟表型35 s:: TCP8通过与WT对照相比显示延迟开花的植物(附加文件)2:图S2),虽然晚开花表型与花期比较不明显35 s:: TCP8个体,可能由于表达水平较低TCP8在它的本土发起人之下。总的来说,这些数据为……的作用提供了证据TCP8调节植物开花。
过度的TCP8让方法信使rna水平
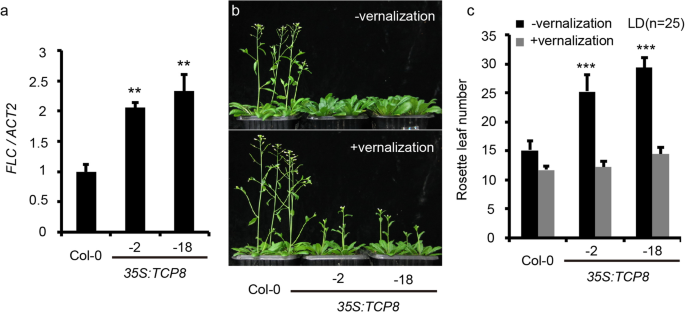
延迟开花的表型35 s:: TCP8植物在LD和SD条件下的作用TCP8在自主路径中。因此,我们检测了方法- - - - - -自主途径中开花的主要抑制因子- - - - - -在35 s:: TCP8行。与我们的假设一致,方法转录水平35 s:: TCP8在早期发育阶段,与WT对照相比,品系增加了两倍以上(图2)。3.a).这个结果表明TCP8可以通过上调调控来控制开花吗方法信使rna水平。
春化已被证明是减少原生植物的有效途径方法因此,我们研究了春化是否可以挽救晚开花表型TCP8超表达植株。正如预期的那样,春化极大地挽救了延迟的开花TCP8过表达植物(图;3.b).我们观察到,在蔷薇叶数上,两组间无明显差异35 s:: TCP8春化组和对照植物(图;3.C),证实了…的潜在作用方法在TCP8介导的开花控制。值得注意的是,发芽后的天数为开花TCP8过表达的植株仍多于WT,可能是由于过表达引起的生长迟缓TCP8超表达(无花果。3.b).即春化特异地挽救了晚花造成的表型TCP8过度表达,但对其生长无阻碍作用。
目的:进一步探讨其分子机制TCP8在控制开花方面,我们测试了TCP8与方法启动子的TCP8-GFP转基因植物[24]使用染色质免疫沉淀(ChIP)试验和体外电泳迁移率转移试验(EMSA)(附加文件3.:图S3)。ChIP试验和EMSA均未检测到TCP8和EMSA之间的相互作用方法启动子,表明TCP8间接调控方法表达式。考虑到Col-0生态型含有星期五-null等位基因,TCP8可能在自主通路中调控FLC上游基因,被认为是协同抑制方法表达式。因此,我们测量的相对表达量葬礼,平安险,FLK,财政年度,LD,FVE,盛名在TCP8过表达苗和观察到的中度降低葬礼,FLK,LD而且盛名表达式(附加文件4:图S4a)。此外,还有一组反义长非编码转录本COOLAIR据报道是为了规范方法表达水平[34].但我们没有检测到明显的变化COOLAIR水平TCP8过表达苗(附加文件4:图S4b)。综合来看,这些分析揭示了TCP8过度表达间接上调方法mRNA水平,可能是通过下调一组自主基因。
FLC是必需的TCP8介导的开花控制
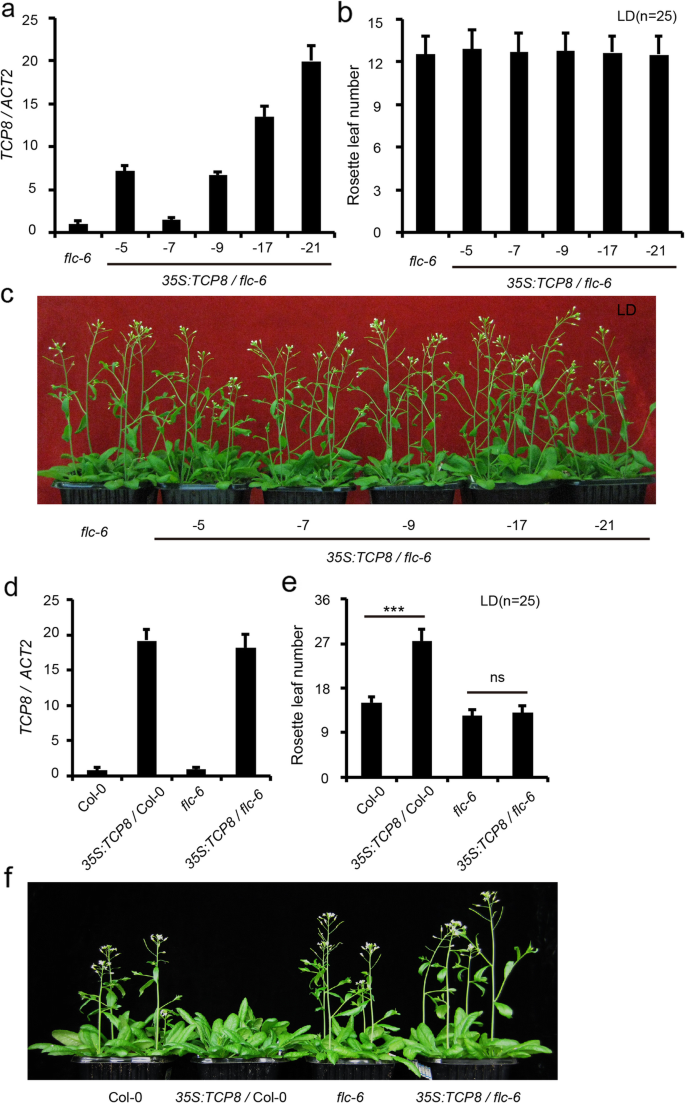
为了验证FLC在tcp8调控开花中的作用,我们进行了过表达TCP8在一个方法丧失的突变,flc-6.TCP8过表达对开花无明显影响flc-6莲座叶数无显著性差异flc-6而且35 s:: TCP8 / flc-6个人-尽管高表达TCP8是在35 s:: TCP8 / flc-6植物(图。4a - c)。然后我们穿过了35 s:: TCP8col0中的转化子flc-6.在F2分离群体中,TCP8超表达在flc-6背景显示开花时间与flc-6,而TCP8超表达在方法WT背景显著延迟开花(图;4D-f),表明一个泛函方法基因是必需的TCP8函数。得到了类似的结果pTCP8: TCP8而且flc-6杂交F2后代(附加文件5:图S5)。因此,方法对于TCP8 -介导开花控制。
方法是TCP8功能调节开花时间所必需的。一个。相对转录水平TCP8在flc-6而且35 s:: TCP8 / flc-6RT-qPCR检测。数据以平均值±标准差表示三个生物重复。ACTIN2用作内源性对照,以使转录水平正常化TCP8.转录水平TCP8在flc-6被任意设置为1。b。莲座叶的数目flc-6而且35 s:: TCP8 / flc-6抽苔前栽植。c。Forty-day-oldflc-6而且35 s:: TCP8 / flc-6在LD条件下生长的植物。d。转录水平TCP8在野生型col0中,35 s:: TCP8,flc-6而且35 s:: TCP8 / flc-6个人。ACTIN2作为数据归一化和转录水平的内源性控制TCP8表示为平均值±标准差三个生物重复。转录水平TCP8在Col-0中被任意设置为1。e。野生型Col-0的莲座叶数,35 s:: TCP8,flc-6而且35 s:: TCP8 / flc-6在螺栓。(学生的t以及,* * *P< 0.001, ns =不显著)。f。40天大的野生型Col-0,35 s:: TCP8,flc-6而且35 s:: TCP8 / flc-6在LD条件下生长的植物
显性抑制TCP8导致各种生长缺陷
一个TCP8插入T-DNA产生的突变体(tcp8-1,CS875709)的作用TCP8在开花。然而,我们在开花和发育中没有观察到明显的缺陷(附加文件6:图S6),这可能是由于TCP家族成员之间的功能冗余,正如之前的研究所提出的[35].为了克服这种冗余,我们将EAR基序融合到TCP8的c端,并在Col-0中过表达TCP8-EAR融合蛋白,以介导显性抑制TCP8(无花果。5一个)。35 s:: TCP8-EAR植物表现出严重的发育缺陷——大多数植物的生长在苗期就停滞了(图2)。5c)幸存者35 s: TCP8-EAR幼苗不能长出正常的叶子(图;5d).同样,我们观察到中等水平的生长缺陷pTCP8: TCP8-EAR幼苗,有深绿色的叶子,低垂的子叶,和较短的主根(图。5e、f);一些pTCP8: TCP8-EAR幼苗可以长出弯曲的真叶,但很少能长到繁殖阶段(图2)。5h).成年植物pTCP8: TCP8-EAR比Col-0小得多,不能长出正常的花序——即pTCP8: TCP8-EAR花被融合,不规则的雌蕊暴露出来(图。5i, j)pTCP8: TCP8-EAR植物也无法生长出有活力的种子。综上所述,这些结果表明TCP8维持正常的植物生长和花卉发育。
转TCP8-EAR植株的表型特征。一个。结构示意图35 s:: TCP8而且pTCP8: TCP8-EAR构造。的打开阅读框TCP8,红框表示由12个氨基酸组成的EAR基序,白框表示的5 '未翻译区TCP8.b。7天大野生型Col-0苗。c。Seven-day-old35 s: TCP8-EAR幼苗。d一个twenty-day-old35 s: TCP8-EAR植物生长在半强度的MS板上。e而且f。Seven-day-oldpTCP8: TCP8-EAR幼苗。g。一个25天的野生型Col-0植物。h。25天大的pTCP8: TCP8-EAR工厂。我。pTCP8: TCP8-EAR处于繁殖阶段的植物。J。的花序pTCP8: TCP8-EAR.比例尺分别为5mm (b-e)、2.5 mm (f)、1cm (g-i)和5mm (j)
讨论
功能冗余通常会阻碍对TCP家族成员的分析[15].例如,TCP8,TCP14,TCP15在调节发育和免疫反应方面的功能冗余[25,26,27,28,30.然而,)TCP8而且TCP15可能在控制开花中发挥不同的作用。过度的TCP15促进了花期的提前和开花tcp15功能缺失突变体开花时间延迟[17].在本研究中tcp8单突变体无明显表型TCP8过表达导致花期延迟(图;2罪犯)。根据以往的研究,TCP15直接被激活SOC1表达式[17], TCP8的上游功能方法(无花果。4),表明TCP8的功能在SOC1.与观察到的免疫反应相反,TCP8而且TCP15在开花调节中可能没有冗余。TCP23在LD条件下,过表达也可延迟开花[36],表明TCP23而且TCP8在开花控制中可能有重叠的功能。为了克服TCP成员之间的功能冗余,在WT Col-0中表达了嵌合的TCP8-EAR蛋白,引入显性蛋白TCP8抑制,这导致各种生长缺陷的转基因植物(图。5).相比之下,TCP14而且TCP15支配性压抑[37,38,39),TCP8-EAR植物表现出更严重的发育缺陷。的普遍表达模式是一致的TCP8在幼苗发育期间(图;1).
TCP8在LD和SD条件下,过表达均能延缓开花TCP8上游功能方法,这表明TCP8可能在自主路径中发挥作用。与这一假设一致,我们发现一些已知的自主通路调控因子的表达水平,包括葬礼,FLK,LD,而且盛名,在TCP8过表达式行(附加文件4:图S4a),表明TCP8可能间接影响方法通过调节这些基因来表达。与这一假设一致,我们未能检测到TCP8与基因启动子之间的直接相互作用方法在EMSA和ChIP试验中。以往的研究表明,自主通路因子主要是调节的方法通过转录后rna处理和表观遗传机制表达[40,41,42].需要进一步的工作来描述TCP8和方法在细节。TCP14和TCP15已被证明与snc1-1的修饰符(MOS1),直接与抑制因子(Suppressor of FRIGIDA 4)相互作用方法[28,43].在这种情况下,TCP8也可以进行调节方法mRNA水平通过与MOS1相互作用。或者,TCP8可能与MOS1竞争TCP14、TCP15之间的相互作用,因为tcp之间普遍存在蛋白-蛋白相互作用[24,35].前期研究表明,ap2结构域转录因子TEMPRANILLO1 (TEM1)和TEM2通过直接转录抑制LD条件下的开花英国《金融时报》[44].此外,TEMs还调控开花,涉及赤霉素水平和miR172,两者都需要在SD条件下协调花的转变[45,46].有趣的是,我们检测到TEM1而且TEM2在TCP8LD条件下的过表达式行(附加文件7:图S7)。检查TCP8和TEMs之间的假定关系可能为它们的功能提供新的线索。
在这项研究中,我们发现TCP8过表达以剂量依赖的方式抑制植物生长(附加文件1:图S1a)。的35 s:: TCP8植株在发育早期表现出生长迟缓,但成年植株建立了与野生型对照相当的正常株高(附加文件)1:图S1b)。TCP8和其他TCP基因参与细胞周期控制,可能是通过调节CYCA1; 1而且CYCA2; 3[28,33,47].因此,生长抑制在35 s:: TCP8可能与细胞周期失调有关。春化处理可以逆转晚花表型,但不能抑制晚花的生长35 s:: TCP8表明TCP8对植物的开花时间和细胞周期具有独立的调控作用,而TCP8相关的细胞周期调控在本研究中对开花的调控作用微不足道。
结论
我们的研究表明TCP8以flc依赖的方式调节植物开花。这项研究的发现扩展了我们在分子基础上的知识安全和,特别是TCP8控制开花时间,为二者相互作用提供依据TCP8而且方法.
方法
植物材料和生长条件
本研究中使用的所有突变体和转基因株系均在拟南芥生态型Col-0背景。T-DNA插入突变体tcp8-1(CS875709)来源于拟南芥生物资源中心(ABRC,https://abrc.osu.edu/),并按先前报导的基因分型[24].对于转基因植物,相应的质粒转化为WT Col-0或flc-6(SALK_041126在添加适量抗生素的半强度Murashige和Skoog (MS)培养基上选择转基因植株。为TCP8利用过表达系、纯合子T3转基因植株进行进一步分析。对于共偏析分析,35 s:: TCP8或pTCP8: TCP8植物与flc-6,对每个群体的F2子代进行基因分型。所有用于基因分型的引物都列在附加文件中8:表S1。
吸收后的种子在4°C的冷室中播种分层3天,打破休眠,然后转移到22±1°C,光照强度约为120 μmol m−2年代−1, LD为16小时光照/8小时暗光周期,SD为8小时光照/16小时暗光周期。在主茎栓紧至2厘米后,计数莲座叶数。春化处理:将吸收后的种子在半强度MS培养基上,在4°C的昏暗光照下生长4周,然后转移到22±1°C的LD条件下生长。
向量构造
上游1582 bp的启动子片段TCP8采用引物pTCP8-1582-S /A PCR扩增翻译起始位点,并通过克隆到pCAMBIA1301 (GeneBank登录号AF234297)载体中Kpn我/Bgl二是双重消化产生的pTCP8::GUS构造(theTCP8启动子驱动的GUS表达构建)。为TCP8的编码序列(CDS)TCP8用引物OE-TCP8-S/A扩增,用囊我/BamHI双消化生成35 s:: TCP8向量。为pTCP8::TCP8载体构建,一个DNA片段包含TCP8利用引物pTCP8-TCP8-S/A从Col-0基因组DNA中扩增出编码区和1582 bp启动子区,并将其克隆到pCAMBIA1301中太平洋标准时间我/Bstp我加倍消化。要构造35个年代::TCP8-EAR用引物EAR- s /A合成了含有EAR基序的DNA片段,并克隆到35 s:: TCP8向量通过Bam你好/太平洋标准时间我加倍消化。要构造pTCP8::TCP8-EAR载体,上游1351 bp的启动子片段TCP8用引物pTCP8-1351-S /A扩增翻译起始位点,并克隆到35个年代::TCP8-EAR向量通过生态RI /囊我加倍消化。用于矢量构造的引物在附加文件中总结8:表S1。
组织化学GUS分析
为了进行GUS活性的组织化学检测,将植物组织浸泡在5-溴-4-氯-3-吲哚基β- d -葡萄糖醛酸(X-Gluc)溶液中(含750 mg ml)−1X-Gluc, 0.2 mM K3.铁(CN)6, 0.2 mM K4铁(CN)6和0.2% Triton X-100, pH = 7.2)在室温下真空15分钟,37℃下孵育过夜。然后用70%乙醇多次清洗样品,直到透明,然后在显微镜下检查。
RNA提取和实时定量PCR
调查的文字记录档案TCP8,收集LD条件下生长40 d的WT Col-0植株的不同组织。用于检测转录水平TCP8在col0和35 s:: TCP8,收集莲座叶。的转录水平检测方法收集在LD条件下生长的10天大的幼苗和自主途径相关基因。用TRIzol试剂(Invitrogen)从Col-0和转基因株系的组织中提取总RNA,用DNase I (TaKaRa)清除基因组DNA。用M-MLV逆转录酶(TaKaRa)从每个样本中提取2微克总RNA进行第一链cDNA合成。
RT-qPCR方法如前所述[48].简而言之,以逆转录cDNA为模板进行RT-qPCR。RT-qPCR反应使用SYBR Green (TaKaRa)在iCycler (Bio-Rad)上按照制造商的说明进行。ACTIN2作为内源性对照,用于规范被测基因的转录水平。试验分为3个独立的生物重复和3个技术重复。数据以均数±标准差(S.D.)表示。星号表示相对于对照的显著差异(*P< 0.05, **P< 0.01, ***P< 0.001,学生t以及)。用于RT-qPCR的引物在附加文件中列出8:表S1。
数据和材料的可用性
本研究生成和分析的数据集可根据合理要求从通讯作者(X. Wang)处获得。
缩写
- 35 s CaMV:
-
35S花椰菜花叶病毒
- CCA1:
-
生物钟相关1
- 芯片:
-
染色质免疫沉淀反应
- 有限公司:
-
君士坦斯
- Col-0:
-
Columbia-0
- EMSA:
-
电泳迁移率漂移测定
- FCA:
-
开花控制位点a
- 方法:
-
开花位点c
- 盛名:
-
开花位点d
- FLK:
-
开花位点kh结构域
- 平安险:
-
开花位点pa
- 星期五:
-
FRIGIDA
- 英国《金融时报》:
-
开花位点t
- FVE:
-
开花轨迹
- 财政年度:
-
开花位点y
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 格斯:
-
β葡萄糖醛酸酶
- LD:
-
LUMINIDEPENDENS
- RT-qPCR:
-
实时定量聚合酶链式反应
- SOC1:
-
constans过表达抑制因子
- TCP:
-
大刍草分枝1 / Cycloidea /增殖细胞因子
- TEM1/2:
-
丹魄1/2
参考文献
- 1.
辛普森GG,迪恩c开花-拟南芥,开花时间的罗塞塔石?科学。2002;296(5566):285 - 9。
- 2.
麦克斯SD。花期调控结果量大。植物学报。2009;12(1):75-80。
- 3.
斯里坎斯A,施密德M.花期的规定:条条大路通罗马。中国生物医学工程学报(自然科学版),2011;
- 4.
李文杰,李志刚,李志刚,等。花期与胁迫耐受性的关系。中国生物医学工程学报,2016;36(1):344 - 344。
- 5.
Michaels SD, Amasino RM。开花基因座C编码一种新的MADS结构域蛋白,该蛋白作为开花的抑制因子。植物细胞学报。1999;11(5):949-56。
- 6.
金德华,Doyle MR, Sung S, Amasino RM。春化:植物在冬天和开花的时间。生物工程学报。2009;25:27 - 27。
- 7.
Simpson GG.自主途径:拟南芥开花时间的表观遗传和转录后基因调控。植物学报,2004;7(5):570-4。
- 8.
程建忠,周一平,吕天祥,谢正大,田策。拟南芥自主开花时间途径研究进展。中国生物工程学报,2017;23(3):477-85。
- 9.
赫利维尔CA,伍德CC,罗伯逊M,詹姆斯·皮科克W,丹尼斯ES。拟南芥FLC蛋白在体内与SOC1和FT染色质直接相互作用,是高分子量蛋白复合物的一部分。植物学报,2006;26(2):344 - 344。
- 10.
Searle I, He Y, Turck F, Vincent C, Fornara F, Krober S, Amasino RA, Coupland G.转录因子FLC通过抑制拟南芥分生组织能力和系统信号通路,对春化的开花响应进行了研究。基因开发,2006;20(7):898-912。
- 11.
开花位点C的教训:保守染色质开关支持发育时间和适应。中国生物医学工程学报,2015;29(4):344 - 344。
- 12.
开花的季节和发育时间。植物学报,2010;36(6):344 - 344。
- 13.
何阳。开花的染色质调控。植物科学进展,2012;17(9):556-62。
- 14.
FLC位点:表观遗传学和适应性发现的平台。细胞发育生物学,2017;33: 555 - 75。
- 15.
尼古拉斯M,古巴P. TCP因素:信号块上的新孩子。植物学报,2016;33:33-41。
- 16.
Martin-Trillo M,古巴P. TCP基因:十年后的家庭快照。植物科学进展,2010;15(1):31-9。
- 17.
卢塞罗LE,马纳维拉PA,格拉德,阿里尔FD,冈萨雷斯DH。I类和II类TCP转录因子在多个水平上调节soc1依赖的开花。植物学报,2017;10(12):1571-4。
- 18.
刘娟,程霞,刘萍,李冬,陈涛,顾晓霞,孙娟。拟南芥microrna319调控的tcp与FBHs和PFT1相互作用,激活CO转录并控制开花时间。公共科学图书馆,2017;13(5):e1006833。
- 19.
Kubota A, Ito S, Shim JS, Johnson RS, Song YH, Breton G, Goralogia GS, Kwon MS, Laboy Cintron D,小山T,等。在拟南芥光周期开花过程中,依赖tcp4的CONSTANS转录诱导需要GIGANTEA。公共科学图书馆,2017;13(6):e1006856。
- 20.
Niwa M, Daimon Y,黑谷KI, Higo A, Pruneda-Paz JL, Breton G, Mitsuda N, Kay SA, Ohme-Takagi M, Endo M,等。BRANCHED1与开花位点T相互作用抑制拟南芥腋生分生组织的花转化。植物学报。2013;25(4):1228-42。
- 21.
何文华,王志强,王志强,等。拟南芥开花位点植物细胞促花活性的研究进展。2014;26(2):552 - 564。
- 22.
摩根富林明。蔡海林,Joanito I,吴玉春,张长武,李永华,王勇,洪继昌,朱景文,徐正大等: LWD-TCP复合物激活拟南芥morning基因CCA1。Nat Commun, 2016;7:13181。
- 23.
普鲁内达-帕兹JL,布雷顿G, Para A,凯SA。一种功能基因组学方法揭示了CHE作为拟南芥生物钟的组成部分。科学。2009;323(5920):1481 - 5。
- 24.
王霞,高洁,朱震,董霞,王霞,任刚,周霞,快波。TCP转录因子在拟南芥等chorismate synthase 1表达的协调调控中起着关键作用。中国植物学报,2015;29(1):344 - 344。
- 25.
Spears BJ, Howton TC, Gao F, Garner CM, Mukhtar MS, Gassmann W.拟南芥TCP转录因子对efr依赖免疫应答的直接调控。分子植物-微生物相互作用,2019;32(2):540-9。
- 26.
Kim SH, Son GH, Bhattacharjee S, Kim HJ, Nam JC, Nguyen PD, Hong JC, Gassmann W.拟南芥免疫适配体SRFR1与TCP转录因子相互作用,冗余参与效应触发免疫。植物学报(自然科学版);2014;26(6):978-89。
- 27.
李敏,陈华,陈杰,常明,Palmer IA, Gassmann W,刘峰,付志强。TCP转录因子与NPR1相互作用,对系统性获得性耐药有冗余贡献。植物科学,2018;9:1153。
- 28.
张楠,王铮,鲍铮,杨玲,吴东,舒欣,华娟。拟南芥MOS1与TCP转录因子密切相关,调控免疫和细胞周期。植物学报,2018;29(3):344 - 344。
- 29.
张刚,赵辉,张超,李霞,吕勇,齐东,崔勇,胡林,王志,梁忠,等。TCP7与多个I类tcp冗余功能,调控拟南芥的内复制。中国生物医学工程学报,2019;29(4):344 - 344。
- 30.
Daviere JM, Wild M, Regnault T, Baumberger N, Eisler H, Genschik P, Achard P。中国生物医学杂志,2014;24(16):1923-8。
- 31.
van Es SW, van der Auweraert EB, Silveira SR, Angenent GC, van Dijk ADJ, Immink RGH。综合表型分析揭示了拟南芥TCP基因在产量决定中的相互作用和功能。植物学报,2019;29(2):344 - 344。
- 32.
Danisman S, van der Wal F, Dhondt S, Waites R, de Folter S, Bimbo A, van Dijk AD, Muino JM, Cutri L, Dornelas MC,等。拟南芥I类和II类TCP转录因子拮抗调控茉莉酸代谢和叶片发育。中国生物医学工程学报,2012;29(4):344 - 344。
- 33.
Aguilar-Martinez JA, Sinha N.拟南芥I类TCP基因AtTCP7、AtTCP8、AtTCP22和AtTCP23在叶片发育中的作用分析。植物科学进展(英文版);
- 34.
吴震,刘峰,杨华,杨华,陈志伟,陈志伟。FLC基因的转录起始和延伸调控。中国科学(d辑),2016,26(1):1 - 7。
- 35.
Danisman S, van Dijk AD, Bimbo A, van der Wal F, Hennig L, de Folter S, Angenent GC, Immink RG。拟南芥TCP转录因子家族功能冗余分析中国机械工程学报,2013;29(3):344 - 344。
- 36.
杨晓明,王晓明,王晓明,等。拟南芥TCP23基因在植物发育过程中的功能研究。植物化学学报。2013;
- 37.
李振宇,李B,董亚武。拟南芥转录因子AtTCP15通过调控关键细胞周期基因的表达来调控核内重复。植物学报。2012;5(1):270-80。
- 38.
乌贝蒂-马纳瑟罗NG,卢塞罗LE,维奥拉IL,贝吉蒂AC,冈萨雷斯DH。I类蛋白AtTCP15通过与受cin样TCP蛋白影响的通路重叠的途径调节植物发育。中国科学(d辑:自然科学),2012;
- 39.
Kieffer M, Master V, Waites R, Davies B. TCP14和TCP15对拟南芥节间长度和叶片形状的影响植物学报,2011;29(1):457 - 457。
- 40.
Baurle I, Dean C.自主途径RRM蛋白和染色质调控因子在拟南芥靶标沉默中的差异相互作用。年代。2008;3 (7):e2733。
- 41.
Baurle I, Smith L, Baulcombe DC, Dean C.开花时间调控因子FCA和FPA在rna介导的染色质沉默中的广泛作用。科学。2007;318(5847):109 - 12所示。
- 42.
田玉凯,郑辉,张峰,王雪林,吉晓荣,徐超,何玉华,丁颖。PRC2招募和H3K27me3在FLC沉积需要COOLAIR的FCA结合。Sci副词.2019;5(4): eaau7246。
- 43.
鲍喆,张宁,华娟。内多倍体化和开花时间受检查点成分MAD1和免疫调节剂MOS1拮抗调控。Nat Commun. 2014;5:5628。
- 44.
Castillejo C, Pelaz S. CONSTANS和TEMPRANILLO活性之间的平衡决定了FT的表达引发开花。动物学报,2008;18(17):1338-43。
- 45.
Aguilar-Jaramillo AE, Marin-Gonzalez E, Matias-Hernandez L, ossnato M, Pelaz S, Suarez-Lopez P. TEMPRANILLO是microRNA miR172的直接抑制因子。植物学报,2019;36(3):344 - 344。
- 46.
拟南芥中TEMPRANILLO基因连接光周期和赤霉素通路以控制开花。《Nat community》,2012;3:808。
- 47.
张涛,曲勇,王宏,王娟,宋安,胡勇,陈松,姜娟,陈峰。菊花TCP-P转录因子CmTCP14的异源表达抑制器官大小和延缓衰老。植物化学学报,2017;
- 48.
于娟,王晓宇,魏qa,快百康。转基因烟草AtNPR1上游对Probenazole处理响应的顺式调控元件的鉴定。中国生物工程学报,2010;36(4):344 - 344。
确认
我们感谢张大兵博士分享的种子flc-6.
资金
广东省自然科学基金(2018A030313966)和深圳市科技创新委员会(JCYJ20170818100038326)资助。资助者在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
XYW, BXM和BKK设计了这项研究。XYW, XTX, XWM, LYZ和JCZ进行实验。XYW, XTX和BKK对数据进行分析。BXM为研究提供了关键试剂和设备。XYW和BKK撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
TCP8过度表达会阻碍植物生长。一个。20天的野生型Col-0和35 s:: TCP8在LD条件下生长的转基因植物。b。60天的野生型Col-0和35 s:: TCP8在LD条件下生长的转基因植物。(LD: 16小时亮/ 8小时暗)。
附加文件2:图S2。
pTCP8::TCP8延迟开花。一个。相对转录水平TCP8在不同的pTCP8: TCP8RT-qPCR检测转基因株系。数据用三个生物重复的平均值±标准差表示。ACTIN2用作内源性对照,以使转录水平正常化TCP8.转录水平TCP8在Col-0中被任意设置为1。b。40天的野生型Col-0和pTCP8: TCP8在LD条件下生长的转基因植物。c。野生型Col-0和Col-0的莲座叶数pTCP8: TCP8栓栓前的植物(学生的t以及:*P< 0.05, **P< 0.01, ***P< 0.001)。
附加文件3:图S3。
TCP8绑定失败方法体外和体内启动子。一个。EMSA检测TCP8绑定到方法启动子片段。的ICS1含有TCP绑定位点的启动子被用作阳性对照。b。TCP8不能共沉淀周围的DNA片段方法染色质免疫沉淀(ChIP)试验中的基因座。的ICS1启动子作为阳性对照。使用18S rRNA基因对每个ChIP样本的定量PCR结果进行归一化。数值为三次定量PCR测量值的平均值±标准差。
附加文件4:图S4。
自主通路基因的检测COOLAIR水平TCP8超表达植株。一个。过度的TCP8下调一组自主通路基因的表达。中自主途径基因的相对转录水平TCP8RT-qPCR检测过表达转基因株系。数据用三个生物重复的平均值±标准差表示。ACTIN2作为内源性对照,用于规范检测到的基因转录水平。Col-0中每个基因的转录水平任意设为1。(学生的t测试:*P< 0.05)b。相对转录水平不同COOLAIR亚型在TCP8RT-qPCR检测过表达转基因株系。数据用三个生物重复的平均值±标准差表示。ACTIN2被用作内源性对照,以正常化不同COOLAIR亚型。转录水平COOLAIR在Col-0中被任意设置为1。
附加文件5:图S5。
的开花表型pTCP8: TCP8而且flc-6杂交F2子代。
附加文件6:图S6。
的开花表型tcp8-1处于LD状态。一个。不同基因型的40日龄植株在LD条件下生长。b。在Col-0和tcp8-1抽苔前栽植。
附加文件7:图S7。
检测TEM1而且TEM2表达水平TCP8过表达植株在LD条件下。不同基因型的40日龄植株在LD条件下生长。相对转录水平TEM1而且TEM2在TCP8RT-qPCR检测过表达转基因株系。数据用三个生物重复的平均值±标准差表示。ACTIN2作为内源性对照,用于规范检测到的基因转录水平。Col-0中每个基因的转录水平任意设为1。(学生的t测试:*P< 0.05)。
附加文件8:表S1。
本文使用的引物。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
王,X,徐,X,莫,X。et al。过度的TCP8通过a延缓拟南芥开花开花位点c端依赖途径。BMC植物生物学19日,534(2019)。https://doi.org/10.1186/s12870-019-2157-4
收到了:
接受:
发表:
关键字
- TCP8
- 开花
- 方法
- 春化处理
- 拟南芥