摘要
背景
褪黑激素(N-乙酰基-5-甲氧基色胺),调节茎和根的生长,缓解环境胁迫。褪黑素和植物激素生长素是色氨酸衍生的化合物。然而,关于褪黑素和生长素是否通过相似或重叠的信号和调节途径起作用,在很大程度上仍然存在争议。
结果
在这里,我们使用启动子激活研究来证明,与生长素(1-萘乙酸,NAA)不同,褪黑素既不会诱导直接重复5dr5表达拟南芥根在正常生长条件下也不抑制诱导替代氧化酶1a AOX1a在抗霉素A处理后的叶片中,这两者都是生长素作用的标志。此外,对褪黑激素或NAA处理的拟南芥进行的比较全球转录组分析显示,差异表达基因的数量和类型存在差异。与溶剂处理对照相比,生长素(4.5 μM)改变了多种基因的表达,而褪黑素(5 μM)对转录组没有显著影响,而褪黑素(100 μM)对转录组的影响不大。有趣的是,暴露于褪黑激素后差异表达的主要基因类别倾向于生物应激防御途径,而与光合作用相关的关键基因则被下调。
结论
综上所述,这些发现表明,虽然褪黑素和生长素都是吲哚类化合物,但它们通过不同的途径来改变大脑中的基因表达拟南芥。此外,褪黑素的作用似乎使拟南芥优先考虑生物应激防御信号而不是生长。这些发现澄清了目前文献中关于褪黑激素和生长素之间关系的困惑,也对利用褪黑激素改善植物保护具有更大的意义。
背景
植物激素被认为是植物整体生长发育的主要决定因素。多种植物激素如生长素、细胞分裂素(CK)、赤霉素(GA)和油菜素内酯(BR)在调节种子和果实发育、茎和根结构等多种发育过程中发挥关键作用[j]。1]。随着正向和反向遗传学的进步,现在人们对这些激素是如何被感知的,以及在它们的信号通路中识别出的关键角色有了很好的了解。为此,植物激素及其信号转导网络已被广泛研究并用于改善可持续农业,如茎伸长、开花时间和氮利用效率等过程[2]。有趣的是,这些对生长调节的影响是由植物激素之间的相互作用信号通路控制的。这种相互作用要么是对抗的,要么是协同的,要么是并行发生的[3.]。例如,玉米种子萌发、茎根生长和籽粒灌浆等过程均受脱落酸(ABA)和乙烯(ET)的拮抗关系控制[j]。4]。此外,生长素和细胞分裂素在根尖分生组织形成过程中表现出拮抗作用,但在茎尖分生组织形成过程中表现出协同作用[5]。
褪黑素(MT)是一种普遍存在于所有生物体内的吲哚类分子。褪黑素与植物的生长发育有关,如叶根器官发生、衰老和开花[6,7,8,9]。此外,褪黑素还可以减轻植物的各种非生物和生物胁迫,如寒冷、干旱、炎热和真菌病原体的感染Diplocarpon马里、生物营养和半生物营养细菌黄oryzae和两DC3000,分别[10,11,12,13,14,15]。迄今为止,褪黑激素被认为是植物中调节生长的次级代谢物,但最近的研究表明,它也有可能成为一种植物激素[16]。为了被认为是潜在的植物激素,候选分子需要表现出某些基本特征。这些知识包括生物合成途径、受体和生理作用。植物褪黑素生物合成途径的研究取得了长足的进展。色氨酸(Trp)为前体,随后与色氨酸脱羧酶(TDC)、色氨酸-5-羟化酶(T5H)、5-羟化酶(5-羟化酶)、5-羟色胺(5-羟色胺)发生4个连续反应N-乙酰转移酶(SNAT)和乙酰5 -羟色胺甲基转移酶(ASMT) [17,18]。这已被提议作为植物的标准生物合成途径,如拟南芥和大米(玉米)然而,在正常生长条件下,在衰老等条件下也存在另一种途径,其中关键酶SNAT和ASMT按顺序开关以产生褪黑激素。这也被认为是最普遍的生物合成途径拟南芥和大米(玉米)与传统路线相比[19]。最近,一种涉及酶的逆向生物合成反应N-乙酰5 -羟色胺去乙酰化酶(ASDAC)在拟南芥而大米中含有褪黑素中间体N-乙酰血清素迅速转化为血清素。这种反应限制了褪黑激素的合成,从而维持了平衡植物生长发育所需的最佳褪黑激素水平[20.]。与其他植物激素一样,褪黑激素在植物中发挥多种生理作用,如调节气孔开闭、光合作用、向性、碳水化合物和氮代谢的变化以及细胞效应,如改变细胞内钙(Ca2 +)含量及膜透性[21,22,23,24]。最近,第一个褪黑激素受体CAND2/PMTR1,一个g蛋白偶联受体被发现拟南芥它被证明可以调节褪黑素介导的气孔关闭[25]。这是长期寻求的,因为植物中褪黑激素受体的缺乏阻碍了对褪黑激素介导的信号传导的充分理解。在没有确定受体的情况下,将褪黑激素视为一种潜在的植物激素也是一个挑战。
最近的研究调查了褪黑素与众所周知的植物激素如水杨酸(SA)、脱落酸(ABA)和乙烯的串扰[j]。26]。特别令人感兴趣的是褪黑激素和被广泛研究的激素生长素之间的比较,因为它们具有共同的生物合成前体色氨酸,这导致了结构上的相似性,例如具有吲哚核。这些相似性导致了一种假设,即褪黑激素也可能具有类似生长素的活性,以浓度依赖的方式调节生长。然而,目前对褪黑素和生长素之间关系的理解仍不清楚。以往利用启动子-报告子结构、基因表达和生理反应的研究既支持也反对生长素和褪黑素之间相似的作用模式或重叠的信号通路。为了支持类似的功能,有报道称褪黑激素在低浓度下刺激植物生长(10)−410米,−7M, 0.01 M)与生长素相似,通过促进多种植物的根生长、侧根和不定根形成[6,27,28]。类似地,在of的词根中芸苔属植物juncea褪黑素处理(0.1 μM)提高了吲哚乙酸(IAA)浓度,促进了根的生长[13,29]。在转基因番茄植株中,过表达羊褪黑素生物合成途径基因,Serotonin-N-acetyltransferase(SNAT),导致IAA水平下降和顶端优势丧失[15,30.]。同样,褪黑素降低了丝兰(YUC)(宇1、宇2、宇5、宇6和TAR2600 μM处理对拟南芥根系生长素合成基因的影响[j]。31]。生长素响应标记系,如直接重复5,DR5,已经被用来研究生长素在许多植物物种中的反应和分布,如拟南芥和大豆[32]。DR5是一种含有生长素响应元件(AuxREs)的合成启动子,被广泛用作内源性生长素分布、信号传导和应答的间接标记物[33,34]。Wang及其同事发现,外源褪黑素在600 μM浓度下对拟南芥根系的抑制作用增强绿色荧光蛋白和格斯的表达DR5行(31]。此外,对10 μM和20 μM褪黑激素处理的2周龄水稻幼苗根系的rna测序分析显示,生长素信号基因的丰度显著增加[35]。与上述研究相反,Kim et al.(2016)报道褪黑激素(10−7打光最后一−4M)在经典的生物测定中刺激玉米的植物反应,这些生物测定专门用于证明生长素的反应,即胚芽鞘的伸长、幼苗根系的抑制和乙烯生物合成基因的诱导;1-氨基环丙烷-1-羧酸(ACC)合酶(36]。对100 pM和1 mM褪黑激素处理的拟南芥植株的基因表达研究表明,除了一个生长素应答基因外,生长素生物合成和相关基因的转录丰度没有变化IAA-amino合成酶,褪黑素治疗后,这种情况增加了[37]。研究表明,褪黑素处理(5、100、450和500 μM)不能诱导生长素应答标记系的表达DR5:格斯在拟南芥苗(38,39]。这些研究的数据指出了植物物种之间和物种内部的对比结果。一个常见的混淆因素,特别是转录组学分析,一直缺乏在相同的实验条件下褪黑激素和生长素治疗之间的直接比较。
褪黑激素和线粒体的相互作用已经在哺乳动物中得到了广泛的研究,但最近才开始在植物中进行研究[40,41]。线粒体是细胞的动力源,通过提供必要的代谢物、酶辅因子和能量(ATP),在植物生长发育中起着关键作用。最近的研究表明,线粒体在细胞信号传导中起着不可或缺的作用。当线粒体功能受到刺激干扰时,就会产生线粒体信号传导或线粒体逆行信号传导,从而导致改变核基因表达的信号传递[42]。这表明线粒体不仅对植物的生长发育至关重要,而且对生物和非生物胁迫的响应也至关重要。因此,线粒体和激素信号通路之间存在相互作用并不奇怪,因为激素与生长和应激防御过程密切相关[43]。一项荟萃分析研究显示,编码线粒体蛋白的核基因对多种激素治疗有反应。线粒体功能的主要调节因子是植物激素生长素、细胞分裂素(CK)、茉莉酸(JA)和水杨酸(SA) [qh]43]。更直接的针对性方法显示了这些激素和线粒体信号之间的相互作用。例如,aba诱导的保护细胞响应干旱胁迫的信号被称为线粒体的丙酮酸载体负调控保护细胞ABA信号传导负调控因子(NRGA1)在拟南芥(44]。水杨酸(SA)处理已被证明能解偶联并抑制线粒体电子传输烟草(45]。长期以来,人们一直假设生长素和线粒体呼吸有联系[46]。此外,多项研究表明生长素反应与线粒体功能之间存在联系[47,48]。编码参与线粒体内膜合成的蛋白的基因突变,如丝化温敏H4 (FTSH4)和PROHIBITIN3,被证明可以抑制生长素的反应[49,50]。此外,生长素被氧化降解ftsh4过氧化氢(H2O2)-调解,建议作为一种策略,将压力防御等过程置于与成长有关的过程之上[51]。抗霉素A是一种线粒体应激的化学刺激物,通过阻断线粒体呼吸链复合体III起作用。抗霉素A还导致生长素(IAA)水平降低,生长素受体和转运体(如生长素外排转运体PIN1/3/4/7 in)表达下调拟南芥(52,53]。此外,该基因突变体的生长素稳态存在缺陷iaa -丙氨酸抗性4 (IAR4)它编码一种假定的线粒体丙酮酸脱氢酶E1 α亚基,表明它在维持生长素稳态中起着不可或缺的作用[54]。
替代氧化酶(AOX)是一种末端氧化酶,是植物线粒体电子传递链的一部分,通过绕过质子泵送复合物III和IV来解耦呼吸,从而减少活性氧(ROS)的过度爆发。这种活性在干旱、低温和细菌感染等压力环境条件下尤其占优势假单胞菌两研究表明AOX转录物和/或蛋白质显著增加[55]。这表明多种途径可以触发AOX,因此它被认为是线粒体逆行信号的标志。虽然一系列植物激素可以触发/诱导AOX,如SA和ET [45,56其他如生长素对AOX的诱导是拮抗的[52]。生长素(4.5 μM NAA)可抑制抗霉素a介导的启动子报告子的诱导替代氧化ase1a (AOX1a::LUC)在拟南芥中[52]。生长素和线粒体逆行信号的拮抗关系在平衡生长和应激反应中起着核心作用。线粒体和叶绿体被假设为褪黑素合成的原始位点。这与内共生理论有关,其中这些细胞器被认为是产生褪黑激素的内共生细菌的后代[57]。最近,在苹果叶片的线粒体和叶绿体中合成褪黑素被报道马吕斯zumi和拟南芥。此外,苹果褪黑素生物合成基因血清素n -乙酰转移酶和乙酰5 -羟色胺o -甲基转移酶在苹果和拟南芥中分别定位于线粒体和叶绿体[41,58]。然而,对于褪黑素如何与线粒体逆行信号传导及其与生长素的关系,人们缺乏了解。因此,替代氧化酶是测试生长素和褪黑素相互作用的理想标记物。
在这项研究中,褪黑激素的效果直接与生长素治疗进行了比较。两种不同的转基因拟南芥系携带对生长素有反应的可诱导启动子-报告子结构,用来比较植物对褪黑素和生长素的反应。直接重复5(绿色荧光蛋白))DR5:绿色荧光蛋白作为生长素反应和替代氧化酶1a(荧光素酶)AOX1a::LUC作为线粒体逆行信号的标记物[52,59]。此外,通过对褪黑素或生长素处理过的拟南芥莲座叶片的全局转录组分析,研究了褪黑素和生长素之间潜在的分子串扰。
结果
褪黑素对DR5:绿色荧光蛋白主根尖表达
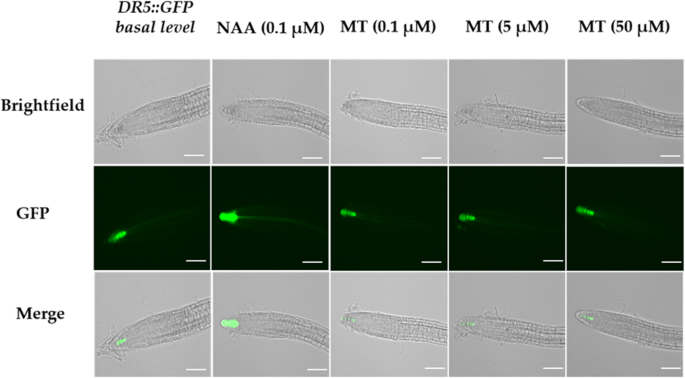
的DR5::绿色荧光蛋白利用生长素反应标记线评估褪黑素(MT)和NAA处理是否具有相似的效果DR55日龄主根尖的交换活性拟南芥幼苗。拟南芥DR5:绿色荧光蛋白根尖在半强度MS培养基或溶剂对照(0.1% v/v乙醇)上生长5天,显示基部GFP荧光DR5在初生根尖小柱细胞中的表达(图2)。1).当根被0.1 μM NAA处理(作为阳性对照)时,与先前研究报道的预期相比,GFP的表达更强烈[32,60]。在生长培养基中添加浓度为0.1、5和50 μM的褪黑素对细胞的表达没有影响DR5::绿色荧光蛋白就位置强度而言,既不增强也不抑制GFP的表达。GFP荧光强度也通过计算积分密度(像素之和)来量化(附加文件)1:图S1)。NAA (0.1 μM)处理增强DR5与溶剂对照(0.1% v/v乙醇)相比,转激活率提高了2.5倍,而褪黑素处理高达50 μM的处理与基础GFP水平表达相似(附加文件)1:图S1)。细胞定位DR5而在根冠小柱处的细胞在不同的处理下是相同的。
褪黑素对AOX1a:卢克抗霉素A处理叶片的表达
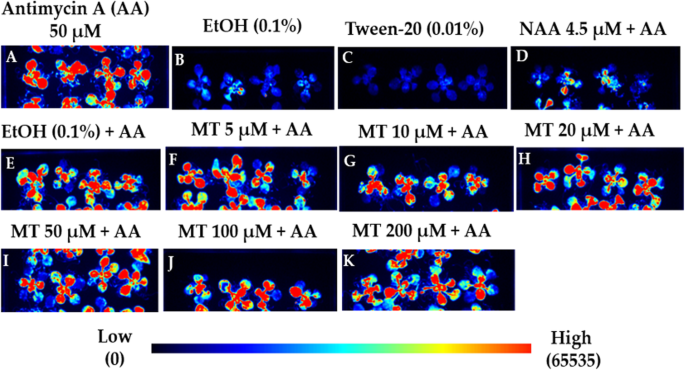
一个拟南芥携带启动子报告子的转基因品系AOX1a:卢克构造(61,62]被用来评估褪黑素是否能像生长素一样负向调节AOX1a50 μM以下抗霉素A喷雾处理。的增强表达AOX1a:卢克经NAA预处理后,抗霉素A诱导的LUC发光量被显著抑制,使LUC发光量降至基础表达水平(图2)。2),如先前报道[52]。褪黑素处理(5 μM, 10 μM, 20 μM, 50 μM, 100 μM和200 μM)的选择是基于先前文献报道的10 - 100 μM对拟南芥基因表达的影响[10,12],并使用近似等摩尔浓度的褪黑激素(5 μM)和NAA (4.5 μM)。褪黑素治疗没有抑制AOX1a与NAA处理相比,抗霉素A处理下的表达。通过综合密度法(ImageJ)对发光强度进行量化,我们发现褪黑素(5 μM、20 μM、50 μM和200 μM)对发光强度没有显著抑制作用AOX1a与溶剂对照(0.1% v/v乙醇)相比的表达(附加文件1:图S2A)。褪黑素(10 μM和100 μM)略有降低AOX1a但表达水平仍显著高于NAA处理(3倍)(附加文件)1:图S2A)。单独褪黑素或NAA处理与纯溶剂对照(0.1% v/v乙醇)无统计学差异(附加文件)1:图S2 B, C)。总的来说,可以得出结论,褪黑素不抑制诱导AOX1a与NAA相反,它抑制了这种诱导。
MT对AOX1a:卢克抗霉素A (anti - ycin A, AA)处理后莲座叶片中报告基因的表达。的生物发光图像AOX1a:卢克报告植株(col0)在含+/ - MT或NAA的培养基上生长3天,喷洒+/ - AA,并观察卢克6 h后在ChemiDoc (BioRad)中的活性。(一)AA喷雾(b溶剂控制(乙醇0.1% v/v)c)喷雾表面活性剂控制(0.01%吐温-20 v/v) (d)添加AA的培养基和喷洒AA的植株(e培养基中添加了溶剂对照剂(0.1%乙醇v/v)用于MT和NAA,植株喷洒了AA (f- - - - - -k) mt补充培养基和喷AA植株。图中显示了在独立的日子进行的三个生物重复的代表性图像,每个重复处理12株植物。所有图像都对应于AOX1a:卢克记者
褪黑素和NAA处理幼苗叶片差异表达基因(DEGs)分析
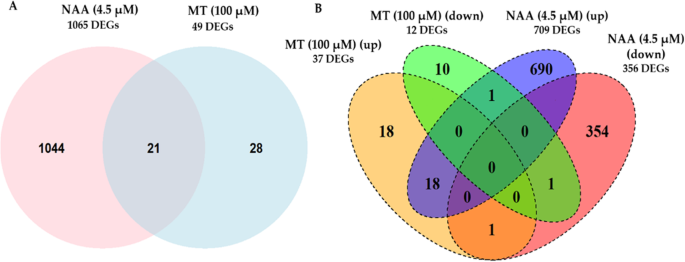
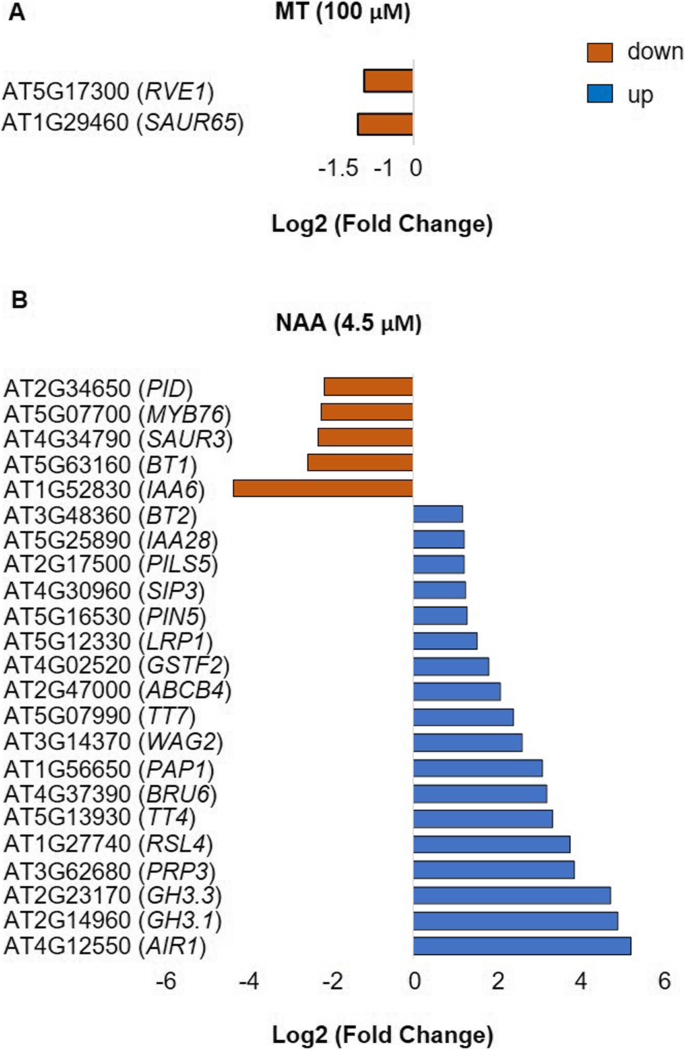
考虑到褪黑激素和NAA对生长素信号通路的不同响应,我们比较了褪黑激素(5 μM或100 μM)或NAA (4.5 μM)对拟南芥幼苗叶片转录组的响应,以进一步了解这些吲哚的作用模式。将褪黑激素(5 μM或100 μM)和NAA (4.5 μM)处理的样品与未处理的溶剂对照(0.1% v/v乙醇)进行比较,得到差异表达基因(DEGs)。FDR的错误发现率< 0.05,log2折叠变化(日志)2FC)≥1.2表示转录本存在显著差异表达。5 μM褪黑素治疗组基因表达差异无统计学意义。然而,与未处理的溶剂对照(0.1% v/v乙醇)相比,褪黑激素(100 μM)和NAA (4.5 μM)处理之间显著表达的基因数量存在显著差异。NAA对基因表达的影响更大,共有1065个基因显著差异表达,而100 μM褪黑素对转录组的影响不大,只有49个基因差异表达(图2)。3.a).在我们的研究中,暴露于NAA(特别是生长素应答基因)或褪黑激素(100 μM)时差异表达的deg与其他已发表的转录组数据集的比较显示,大约有30-40%的重叠[37,63,64]。值得注意的是,我们的研究与以前的转录组研究在使用的生长素类型、浓度、组织、暴露时间和分析的发育阶段方面存在差异1:表S1和表S2)。
两种处理共有21个差异表达基因(DEGs)。为了进一步获得统计信息,在R中使用“dhyper”命令进行了超几何检验,以分析相对于两个基因列表之间的基因组背景的重叠的重要性,从而评估基因列表中deg之间的任何重叠是非随机的可能性[65,66,67]。发现在暴露于褪黑激素和生长素时,deg之间的重叠在a上具有统计学意义p -值为2.2 × 10−17。
在NAA处理下,共有709个基因的转录水平显著丰度增强,356个基因的转录水平显著丰度降低(图2)。3.b).相比之下,褪黑激素(100 μM)处理后,只有37个基因的转录丰度显著增加,12个基因的转录丰度显著降低。其中,褪黑激素唯一改变了28个基因的表达,其中18个基因表达增强,10个基因表达降低(表1)1).相比之下,NAA完全差异表达的基因共有1044个,其中690个基因表达增加,354个基因表达减少。在褪黑素处理的28个deg中,有18个表达增加的基因被注释为防御素或防御素样基因(5个),转录因子(4个)和参与翻译后蛋白修饰的基因(3个),而12个表达减少的基因中的大多数被指定为参与光合作用的基因(6个)(表)1).被生长素完全改变的基因转录水平在附加文件中详细列出2表S4。这些包括其他研究报告的途径,如根发育和生长素信号基因,如运输、生物合成和偶联[63,64,68]。
褪黑激素(100 μM)处理下转录丰度增加的差异表达基因(DEGs)包括两个植物防御素基因AT2G26010(PDF 1.3),AT2G26020(PDF 1.2 b),分别是对照组的25倍和20倍。此外,三个defensin-like(DEFL)基因转录水平也显著提高,即AT3G59930, AT5G33355和AT1G34047分别是对照组的30倍,30倍和29倍。褪黑素(100 μM)处理显著诱导的转录因子基因表达水平AT1G06160(乙烯响应因子AP2/ERF59),AT3G51910(热休克转录因子A7A HSFA7A和AT5G07100(WRKY dna结合蛋白,WRKY26),分别是对照组的5.5倍、2.9倍和2.3倍。有趣的是,在褪黑素处理(100 μM)后表达降低的12个基因中,有7个基因参与光合作用的光依赖反应,如ATCG00330(叶绿体核糖体蛋白S14,RPS14), atcg00020 (光系统II反应中心蛋白A,PSBA),ATCG00340(光系统I, PsaA/PsaB蛋白,PSAB),倍数变化分别为0.3、0.4、0.4和ATCG00490(Ribulose-biphosphate羧化酶,:),与对照组相比,其倍数变化分别为0.4。在褪黑激素改变表达的deg中,有21个基因在褪黑激素(100 μM)和NAA中均有表达。这些共表达基因中有18个丰度增加,主要分类为激酶(3)和脂质代谢过程(3)等,而只有1个AT4G04840(methionine-sulfoxide还原酶,MSRB6褪黑素(100 μM)和NAA处理均显著降低(表2)2).然而,AT5G13170(senescence-associated基因,SAG12)的表达显著增强,而褪黑素(100 μM)处理和AT2G44130(含有F Box蛋白的kelch结构域,KFB39)在褪黑激素(100 μM)处理下表达增强,而在NAA处理下表达降低(图2)。3.b和表2).
基因本体(GO)富集分析
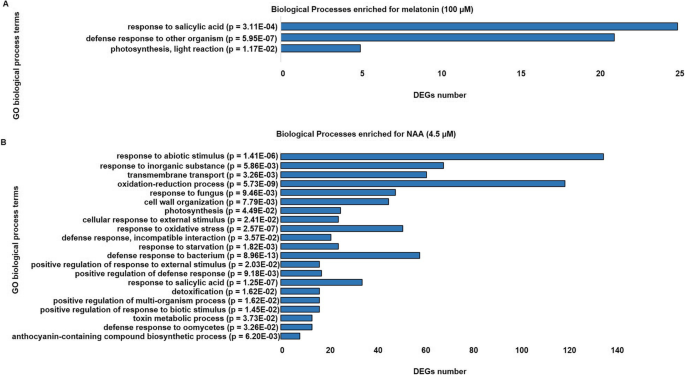
为了进一步了解褪黑激素(100 μM)和NAA表达的deg的功能,我们进行了基因本体(Gene Ontology, GO)功能和富集分析。在NAA处理下富集的deg被分配33个亲本氧化石墨烯项(p< 0.05;Bonferroni纠正)。这些氧化石墨烯术语与生物过程(BP)有关。很明显,NAA处理导致包含多种氧化石墨烯条款的富集,基于更多的deg数量,而褪黑激素处理导致相应deg的三个亲本氧化石墨烯条款的特定富集。其中包括“对水杨酸的反应(GO:0009751)”,“对其他生物的防御反应(GO:0006952)”和“光合作用,光反应(GO:0019864)”(图1)。4).与氧化石墨烯术语“对水杨酸(氧化石墨烯:0009751)的反应”相关的deg包括:AT1G75040(pathogenesis-related蛋白质5,PR5), at1g21250 (壁相关受体激酶1,WAK1),AT1G32960(Subtilisin-like蛋白酶,SBT3.3),AT2G16720(转录因子,MYB7),AT3G50480(rpw8样蛋白).此外,与富集氧化石墨烯相关的一些deg术语“对其他生物的防御反应(GO:0006952)”包括防御素和防御素样基因AT5G25250 (漂浮蛋白样蛋白1,FLOT1),AT1G15520(ABC转运蛋白G家族成员,ABCG40).褪黑激素治疗(100 μM)中DEGs的GO功能注释详见附加文件3.表S5。氧化石墨烯术语分析进一步支持了这一发现,即尽管NAA在转录组中表现出多种反应,但褪黑激素(100 μM)诱导和富集的最突出的基因类别涉及生物应激防御和对激素水杨酸的反应。
与未治疗对照相比,MT或NAA对氧化石墨烯的反应差异。显著富集氧化石墨烯生物工艺条件(一个)对MT (100 μM)和(b) NAA (4.5 μM)与公开数据库中功能注释分类工具(www.geneontology.org) [69)与p-值< 0.05经Fisher精确检验和Bonferroni多重检验校正归类为有统计学显著差异
褪黑素治疗对生长素信号基因表达的影响
差异表达基因(DEGs)响应褪黑激素处理的样品,具有氧化石墨烯注释生长素反应进行了分析。与NAA处理不同,褪黑激素处理(100 μM)对“生长素稳态(GO:0010252)”、“吲哚-3-乙酸合成酶活性(GO:0010279)”、“生长素基端转运(GO:0010540)”、“生长素外排跨膜转运活性(GO:0010329)”、“生长素:质子同体活性(GO:0009672)”、“生长素外排(GO:0010315)”、“生长素内流(GO:0060919)”和“细胞对生长素刺激的反应(GO:0010329)”的基因转录水平没有显著改变。(图0071365)”。5a).然而,AT1G29460(小生长素上调SAUR65与对照组相比,褪黑素显著降低了0.4倍。AT1G29460将氧化石墨烯命名为“对生长素的反应(GO:0009733)”、“生长素极性运输(GO:0060918)”和“生长素激活的信号通路(GO:0009734)”。此外,AT5G17300(myb样转录因子,RVE1褪黑素也显著降低。该基因通过调节依赖于昼夜节律的生长素水平参与下胚轴的生长。它还参与“生长素生物合成过程的调控(GO:0010600)”和“生长素激活的信号通路(GO:0009734)”。5).然而,NAA并没有显著改变这两个基因的表达,但其他生长素信号基因发生了改变(图2)。5综上所述,这进一步表明褪黑激素不影响任何已知的生长素反应基因的表达,除了AT1G29460和AT5G17300有减少表达的趋势。
使用公开可用的基于微阵列的表达数据分析褪黑激素专门和通常调节的deg的表达谱
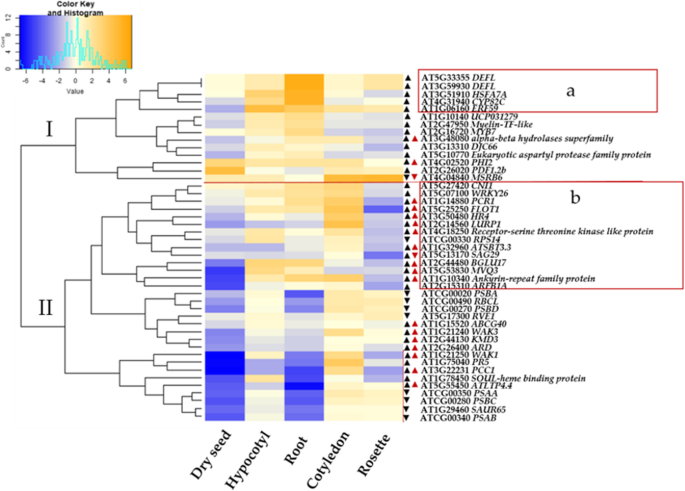
为了进一步了解褪黑激素调节的deg的功能,我们探索了公开可用的拟南芥微阵列数据[70生物分析资源,BAR;https://bar.utoronto.ca。我们专注于选择来自不同器官的微阵列数据,以及对各种生物和非生物胁迫的响应(图2)。6和附加文件1:图S4)。BAR中的数据来源于以前的研究(Schmid et al., 2005;Kilian et al., 2007)。这些基因属于两个簇。AT5G33355(偏转),AT3G59930(偏转),AT3G51910(HSFA),AT1G06160(ERF59),AT4G31940(CYP82C4)是褪黑激素特有的基因,基于它们在根中的高表达,它们的转录水平增加,构成了集群1(a)的一部分(图2)。6).这五个基因中的四个也在莲座中表达,但不像在根和根中表达得那么显著AT3G51910(HSFA)在莲座中丰度减少。有趣的是,14个形成簇的基因在莲座中表达较低(簇2b)。其中包括,At5g27420 (cni1), at5g07100 (wrky26), at1g14880 (pcr1)和AT2G15310 (ARFB1A)。在我们的RNA-Seq数据中,这14个基因中的13个在褪黑激素处理下被高度诱导。褪黑素只改变了其中四个基因的表达水平。在我们的实验中,褪黑激素通过根在生长培养基中施用,并能够诱导莲座基因表达,这表明褪黑激素可能对植物具有全体性作用。
器官中MT或NAA共同调控的DEGs的微阵列表达模式。数据来源于生物分析资源(BAR)。的时代拟南芥植株为7天,子叶(7天),下胚轴(7天),根(17天),莲座(17天)[71]。箭头表示我们的RNA-Seq数据响应褪黑激素(100 μM)(黑色箭头)和/或NAA(红色箭头)的调节趋势(向上或向下)。热图表示与控制相比,log2变换后的信号值的折叠变化的分层聚类。在R(版本3.5.2)的函数' scale '中,所有的值都在分层聚类之前通过z评分方法进行了标准化。色键和直方图表示具有痕量水平的相对表达的尺度。蓝色表示低表达水平,浅色表示中等表达水平,橙色表示最高表达水平。不同的聚类用I和II表示。红框(一个和b)是构成每个星团一部分的deg
讨论
褪黑激素与植物激素生长素(吲哚-3-乙酸,IAA)共享其生物合成前体色氨酸。因此,许多研究都在调查褪黑素是否具有类似生长素的活性。一些报告显示,褪黑素确实以与生长素相似的方式起作用,而其他同样令人信服的报告则反驳了这一观点[23,36]。这使得目前对褪黑素和生长素之间关系的理解变得相当神秘。在目前的研究中,我们确定褪黑激素是否以类似于生长素的方式调节生长素信号通路,以更清楚地了解褪黑激素和生长素之间潜在的相互作用。我们发现褪黑素的作用方式与生长素不同拟南芥并且有自己独立的行动模式。
生长素的分布和感知不受褪黑素的影响
已知在拟南芥生长培养基中添加褪黑素(1、50、100和200 μM)可通过提高锌指转录因子的表达而降低内源性生长素(IAA)水平ZAT6(72]。有趣的是,在同一项研究中,ZAT6与生长素生物合成基因启动子中的TACAAT基序没有直接结合YUC2通过ChIP-PCR分析。基于此,褪黑素也可能与生长素在其信号通路中不共享AuxRE顺式调节元件。我们的结果与之前的类似研究一致,褪黑素处理(5、50、100、450和500 μM)不能影响生长素应答标记系的表达DR5:格斯或DII-VENUS在拟南芥幼苗与生长素(5,10 μM IAA, 5 μM NAA)相比[38,39,73]。
与生长素不同,褪黑素不影响线粒体逆行信号
植物在线粒体功能障碍时抑制生长素信号,将细胞资源从生长(由生长素介导)分配到应激防御反应(由线粒体扰动引起的ROS爆发介导)[74]。我们观察到,与生长素不同,褪黑素不抑制诱导AOX1a:卢克这表明褪黑激素不会负向调节线粒体逆行信号,因此在这一途径中不像生长素那样起作用(图2)。2).此外,褪黑素也没有诱导AOX1a。最近研究表明,在根际施用褪黑素(10 μM)对紫花苜蓿植物叶片抗旱性增强是通过减少H2O2以及(一氧化氮)NO含量调控氧化还原相关抗氧化酶化合物及其转录本。转录水平AOX在干旱胁迫下,褪黑激素不影响线粒体的电子传递链。相反,体内平衡是通过调节参与ROS解毒的其他酶来维持的[75]。因此,褪黑素也没有进一步增强就不足为奇了AOX表达在我们的学习中。AOX已被证明在翻译后水平被某些有机酸和氧化还原相关机制激活[76,77]。TCA(三羧酸循环)的中间体,如2-氧葡萄糖酸酯(2-OGs)可激活AOX [78]。有趣的是,2-ODD(2-氧葡萄糖酸盐依赖双加氧酶)或ros相关反应将褪黑激素转化为其分解产物[79]。因此,褪黑激素可能通过清除ROS或通过其代谢产物如2-羟基褪黑激素和环-3-羟基褪黑激素调节翻译后的AOX。另一种可能性是,褪黑素直接清除线粒体中处于压力下的自由基,非常有效,无需改变AOX基因表达或活性这可以通过线粒体中已经存在的褪黑激素来实现[41]或通过线粒体通道(如ABC寡肽转运体)进入褪黑素,这已在哺乳动物中得到证实[80]。
褪黑素或生长素表达的不同基因数量
虽然之前的研究已经评估了褪黑激素对拟南芥转录组的影响,但在相同的实验条件下,没有报道将褪黑激素与NAA(或生长素)处理的转录组进行直接比较。先前对褪黑激素处理的拟南芥植株(10 μM、50 μM和1 mM)的转录组分析结果显示,[37[202 ~ 426个基因]73]。然而,分析的组织类型、褪黑素暴露的方法和持续时间可能是导致deg实际表达数量差异的原因。褪黑素的作用和浓度在多种植物物种中的组织特异性效应,如拟南芥,贯叶连翘。和Oryza sativa L。已被广泛研究[81,82]。然而,在我们的数据中,褪黑激素处理的deg数量显示约40%与其他报道的研究匹配(即49个基因中,18个基因匹配)(附加文件)1:表S1和表S2)。RNA-Seq数据显示,虽然NAA (4.5 μM)对转录组有很大且多样的影响,但与对照组相比,大约等摩尔浓度的褪黑激素(5 μM)没有导致任何显著的deg。然而,褪黑素(100 μM)的影响不大,49个基因的表达显著改变(图2)。3.).因此,我们将详细讨论褪黑素在100 μM下的作用。
褪黑激素对生物应激防御相关基因表达的影响
褪黑素在增强不同植物物种对多种植物病原体的耐受性方面的作用已在过去几年中得到证实。其中包括半生物营养细菌两,生物营养细菌黄oryzaepv。oryzae以及坏死性卵菌5种(13,14,83,84]。喷施褪黑素(1mm)和转基因过表达褪黑素生物合成基因西瓜植株SNAT对专性生物营养真菌白粉病具有抗性Podosphaera xanthii。这是通过减少菌丝的生长和分生孢子的发育来实现的。对喷施褪黑素(1mm)的西瓜叶片进行转录组学分析,发现与两种植物防御、PAMP和效应触发免疫相关的基因表达发生了变化[j]。85]。褪黑素导致植物先天免疫两PstDC3000通过丝裂原活化蛋白激酶(MAPK)级联在拟南芥中的表达[j]86,87]。
褪黑素可能具有全体性的抗性反应,在我们的实验中,褪黑素通过生长介质施用于根部,观察到对莲座基因表达的影响。事实上,根据公开的微阵列数据,褪黑激素调节的大多数deg在玫瑰丛中表达较低(图2)。5),并在我们的实验中显示出对褪黑素的高诱导。它还表明褪黑素是一种移动信号。最近在西瓜中进行了测试,其中褪黑激素通过长途运输导致耐寒性[88]。此外,当将褪黑素施用于玉米幼苗的根部时,褪黑素已被证明在叶片中积累[89]。褪黑素或5 -羟色胺从无菌根到茎的直接摄取和转运已被证明圣约翰草。褪黑素通过根毛吸收,主要集中在中柱鞘和内胚层组织中,这与生长素在脉管系统中的局部分布不同[90]。
褪黑素治疗完全调节的deg包括发病相关的(AT1G75040 PR5),defensins (AT2G26010 PDF1.3, AT2G26020 PDF1.2b)防御类基因(At3g59930, at5g33355, at1g34047)(表1).褪黑素已被证明在水杨酸上游起作用[15,91]。我们的结果补充了先前的研究,即外源性褪黑素(10 μM)可在30分钟内快速诱导多种致病相关(PR)基因和防御基因(Pr1, pdf1.2, ics1, acs6, gst1, apx1,和VSP1)经SA和乙烯处理后被活化。这导致增强的阻力丁香假单胞菌拟南芥DC3000 [15]。植物防御素是一种抗菌肽,通过与微生物膜相互作用和破坏微生物膜而产生杀微生物活性。92,93]。PDF1.2在受到攻击时表情减少p .两(附加文件中的集群IIA1:图S4A)。事实上,在我们的RNA-Seq数据中,褪黑素处理显示出更高的表达,这进一步揭示了褪黑素在诱导生物防御的防御素中的作用。SA是一种可移动的防御信号分子,可上调多种与防御有关的化合物,如防御素和PR蛋白[94]。因此,褪黑素也可能触发SA以诱导全身获得性抵抗。在我们的数据中,只有一个类似防御的基因,AT5G44973,由生长素独家表达,并显示其表达量下降(另附文件)2:表S4)。与褪黑素不同,生长素已被证明能促进由生物营养细菌引起的疾病p .两在拟南芥中[95]。有趣的是,基础和sa驱动的防御反应的一个组成部分是抑制生长素信号[96]。除了p .两在美国,褪黑激素调节的deg也被证明对多种病原体有反应,如葡萄孢菌和p . 5(无花果。5b).这与先前的研究一致,褪黑激素导致对这些病原体的疾病抗性[84,97]。这支持了褪黑素引发广谱疾病抵抗力的观点。然而,同样重要的是要注意,防御素也会受到环境压力的刺激,如渗透压力和紫外线[98]。此外,许多其他防御相关基因在非生物胁迫下的微阵列数据中表达增强(附加文件)1:图S4B)。在这方面,褪黑激素也可能诱导防御素和其他防御相关基因,从而赋予对非生物应激的耐受性。另一个基因,AT4G31940编码细胞色素P450酶CYP82C4,代表氧化还原活性代谢物黄豆素的关键生物合成酶,褪黑激素强烈诱导(22倍)。它的转录水平在缺铁条件下增加[99]。有趣的是,褪黑素在铁缺乏条件下增强耐受性的作用最近已得到证实[73,One hundred.]。在限铁条件下,黄铁素由根渗出到根际。它通过动员和减少不溶形式的铁,使其易于为植物所利用,在有效的铁获取中起作用。靶向铁稳态是植物与病原体相互作用的有效策略[j]。101,102]。可能是褪黑素引起的AT4G31940CYPB2C4作为微生物防御策略的一部分,通过增强铁获取过程,如局部增加铁水平以激活感染部位的氧化爆发,或通过铁隔离导致铁被微生物剥夺。
褪黑激素改变转录水平的转录因子中,参与生物防御的转录因子有AT1G06160乙烯反应因子AP2 / ERF59,AT3G51910热休克转录因子A7AAT5G07100 WRKY dna结合蛋白26WRKY26。有趣的是,PDF1.2是由AP2/ERF59通过茉莉酸和乙烯之间的串扰转录激活的[103]。此外,属于AP2/ERF基因家族的转录因子直接激活木薯褪黑素生物合成基因的转录,从而增强了木薯的抗病能力、黄(14]。在我们的数据中,所有上述基因的表达水平仅被褪黑激素改变,也在水杨酸的反应中富集。然而,一些转录水平通常被褪黑素和生长素改变的基因也在水杨酸的作用下得到了富集(表2)1).其中包括AT1G21250(壁相关激酶1,WAK1), AT2G14560(对卵霉菌霜霉病的后期上调,LURP1),AT2G16720(Myb结构域蛋白7,MYB7),AT3G50480(RPW8、HR4的同源物和AT1G15520(ABC转运家族,ABCG40)。细胞壁相关激酶1已被证明在水杨酸处理下被诱导并参与植物防御p .两在拟南芥中[64]。AT2G14560响应卵霉菌霜霉病(LURP1)的晚期上调在抵抗致病卵菌的基础防御中起作用,Hyaloperonospora parasitica并且依赖于由抗性(R)蛋白介导的识别[104]。褪黑激素和生长素很可能通过水杨酸调节一些相似的途径来调节某些共同的防御相关过程。在一项研究中,褪黑素与生长素(IAA)之间存在部分串扰,褪黑素在香蕉感染枯萎病(Foc4)后提高了IAA水平[83]。
褪黑素对生长素反应性基因表达特征的影响
的小-auxin-up RNA(阿富汗二月)家族是已知对生长素治疗表现出快速和短暂诱导的三个基因家族之一[105]。已知它们具有不同的表达模式和对生长素的反应。在此基础上,将其划分为两个亚支。SAUR65属于支枝i,哪里都是阿富汗二月基因在生长素(IAA, 5和10 μM)处理下表达增加[63]。SAUR65然而,在我们的实验中,NAA并没有表现出差异表达。这可能是由于生长素的类型、所研究的组织和暴露时间的不同。的确切功能阿富汗二月尚未被广泛探索。然而,一些研究表明阿富汗二月在拟南芥中发挥生长素介导的组织伸长作用,并对水稻中生长素合成和极性生长素运输产生负面影响[106]。生长素可以诱导细胞壁扩张[107]。褪黑素可能会降低一个成员的转录水平阿富汗二月基因家族减少细胞壁扩张以限制病原体入侵的机会。RVE1(AT5G17300)是一种编码myb样转录因子的基因,该转录因子以依赖于昼夜节律的方式调节游离生长素水平,以控制下胚轴的生长[108]。褪黑素在促进罗苹下胚轴生长中的作用已有研究[27]。尽管下胚轴伸长是一种“类似生长素”的效应,但我们的研究结果提示,褪黑激素可能以其自身的机制诱导下胚轴生长。此外,参与生长素运输的基因如PIN-FORMED(销)褪黑素没有改变。生长素运输积极调节植物生长和疾病发展的许多方面[109]。这进一步证实了褪黑素对转录组的影响是直接的,不需要建立局部生长素最大值。我们的结果与最近的一项类似研究一致,褪黑素或血清素治疗(10或50 μM)不影响生长素的运输AUX1-YFP和PIN1/2/4/7-GFP拟南芥标记系。但本实验未采用生长素处理作为对照或直接比较[73]。然而,抑制褪黑激素浓度(600 μM)已被证明可以通过降低生长素极性运输标记系如PIN1/2/4/7-GFP。这表明褪黑素对拟南芥根系生长的抑制作用部分需要生长素的极性转运[31]。有趣的是,褪黑素被证明是横向传播的,而不是以两极的方式在细胞中传播圣约翰草这进一步解释了为什么它不调节生长素极性运输基因[90]。
在另一项研究中,RNA-Seq分析显示褪黑素能够诱导水稻根系中生长素响应及相关基因的表达[35]。同样,褪黑素应用于番茄根部也会导致下胚轴中一氧化氮(NO)介导的生长素相关信号基因的表达增加[110]。虽然褪黑激素的作用可能依赖于物种,但同样重要的是要注意到植物物种之间生长素生物合成途径的特异性存在差异[111]。此外,与小麦、大麦和燕麦等多种单子叶植物中的生长素相比,褪黑素已被证明具有生长素活性[28]。然而,没有报道直接比较单子叶植物和双子叶植物对褪黑素或生长素的反应。因此,在一项研究中,考虑将褪黑激素与生长素进行直接比较是至关重要的,该研究旨在破译两种吲哚在完全相同的实验条件下如何起作用。
褪黑素减少光合基因的表达,使生长和防御之间的转换成为可能
褪黑素治疗只会降低光合作用相关基因的表达,如ATCG00490二磷酸核酮糖羧化酶RBCL, ATCG00270光系统II反应中心蛋白D PSBD和叶绿体核糖体蛋白S14;RPS14(表1;无花果。4).我们的结果与之前关于褪黑素(1mm)处理的拟南芥转录组的发现一致,其中光合作用相关基因倾向于表达减少[37]。一种可能的解释是,在增长和防御之间存在一种权衡。植物防御反应的众多组成部分之一是光合作用的下调,特别是与光反应有关的基因。这样做是为了避免在一般生长过程中产生多余的成本,并谨慎地分配资源以激活植物防御系统[112]。有趣的是,一个由7个光合作用基因组成的基因簇在褪黑激素的作用下表达减少p . 5在公共微阵列数据(集群II b,附加文件1:图S4A)。经SA和细菌肽处理后,转录因子elf18AT4G36990热休克因子蛋白HSF4/TFB1)下调叶绿体蛋白编码基因的表达[113]。TFB1参与侵袭前免疫,因为它已被证明是调节从生长到防御转变的主要分子开关。它也和独联体元TL1富含与植物防御有关的基因的启动子[114,115]。有趣的是,在我们的研究中,褪黑素(100 μM)处理高度诱导的转录因子(17倍)是AT2G47950(髓磷脂转录因子样蛋白1).目前,还没有关于这个基因功能的信息。然而,共表达分析表明AT4G36990热休克因子蛋白HSF4/TFB1)强共表达AT2G47950(116[附加文件1:图5)。髓鞘转录因子样蛋白(AT2G47950)和它的共表达基因AT4G36990 (因此,HSF4(热休克因子样转录因子)可能在调节生长到防御转变方面对协调褪黑激素的反应很重要,并且是进一步研究的有趣候选者。
结论
在这项研究中,我们通过直接比较表明,褪黑激素的行为不像生长素,因为它不会影响生长素特异性基因的表达,从而在拟南芥中发挥其功能。褪黑素对植物转录组的主要作用是系统地影响生物防御信号和应答基因。此外,与生长素不同,褪黑素不影响线粒体中的逆行信号,而是影响与光合作用相关的基因,作为生长和防御之间的权衡。褪黑激素和生长素之间的区别为目前科学文献中关于褪黑素作用的困惑提供了清晰的解释。因此,确定这些基因在褪黑激素介导的生物应激防御中的共同调节机制将是有趣的。本研究结果支持褪黑素在植物防御中的作用,值得进一步研究,以提高农业植物保护水平。
材料与方法
植物材料和化学处理
AOX1a::卢克在拟南芥(Col-0)先前通过融合2Kb的启动子构建AOX1a(加入。AT3G22370)到萤火虫荧光素酶卢克先前研究详细描述的记者[61]。所有种子用氯气气相法灭菌3 h,然后在4℃下浸入0.1%琼脂糖填充的埃彭多夫管中分层2天,使种子同步萌发。分层后的种子直接播种在Gamborg 's B5培养基(G398, PhytoTechnology, Kansas, USA)上,添加3% (w/v)蔗糖和0.75% (w/v)琼脂(pH 5.7),方形板(100 X 100 mm, LabServ)或+/−褪黑素(M5250, Sigma, Castle Hill, NSW)和含有NAA (N0640, Sigma, Castle Hill, NSW)½Murashige和Skoog (MS)培养基(M0404, Sigma, Castle Hill, NSW),然后放置在23°C的受控环境室中。16 h/8 h明暗循环,湿度56%,120 μmol/m2/秒2由冷荧光管提供的光强度。
褪黑素或生长素(NAA)溶解在100%乙醇(v/v)中,得到原始浓度,在培养基中进一步稀释,得到每个实验单独指示的所需最终浓度。在相同乙醇浓度和体积的所有处理中,乙醇作为溶剂的最终浓度为0.1% (v/v),以控制溶剂产生的任何潜在影响。将处理加入到高压灭菌的培养基中(冷却至55°C),并在每个板中加入等量的培养基(50 mL)。antiycin A (A8674, Sigma, Castle Hill NSW)在100%乙醇中溶解,制备原液(50 mM),用高压灭菌的MilliQ水稀释,在0.1%乙醇(v/v)中得到终浓度为50 μM。将d -萤光素(LUCK, GoldBio, St Louis MO)溶解在高压灭菌的MilliQ水中,最终浓度为2.5 mM。褪黑素、抗霉素A和d -荧光素治疗用铝箔包裹,因为它们对光敏感。所有的溶液在实验当天都是新鲜的,用于喷洒的溶液也添加0.01% (v/v) tween-20 (P9416, Sigma, Castle Hill, NSW)作为喷雾表面活性剂。
荧光显微镜
生长素响应标记系(DR5::绿色荧光蛋白测定褪黑素(0 μM(乙醇对照)、0.1 μM、5 μM和50 μM)和NAA (0.1 μM)作为阳性对照的荧光反应。在+/−褪黑素或添加naa的½MS琼脂培养基上垂直生长5天的幼苗,评估主根尖端的GFP荧光。轻轻地将幼苗从琼脂板上拉下来,放在装有100 μL½MS液体培养基的载玻片上。样品用盖片密封,在立式外延荧光显微镜(Olympus BX53, DP80)下快速评估。使用GFP滤波器(单位名称U-FGFP),激发滤波器波长为460-480 (nm),发射滤波器波长为495-540 (nm)。在公开的Java软件ImageJ version 1.52a (https://imagej.nih.gov/ij/).
荧光素酶报告生物发光成像
12天的老AOX1a:卢克将生长在Gamborg’s B5培养基上的幼苗转移到+/−褪黑素(0、5、10、20、50、100和200 μM)或+/−NAA 4.5 μM的培养基上再培养3天。然后,用+/−Antimycin A 50 μM喷15天的植株。在施用抗霉素A 6小时后,用d -荧光素(2.5 mM GoldBio)喷洒植株,并按照前面描述的方法进行30分钟的暗适应[21]。发光测量采用ChemiDoc (Bio-Rad, MP)。在ImageJ中采用积分密度法对发光进行定量。
RNA-isolation
15天的莲座AOX1a:卢克拟南芥幼苗在液氮中快速冷冻和均质。每个处理合并5个单独的莲座,每个处理有3个独立的生物重复。总RNA的提取使用Spectrum™Plant Total RNA试剂盒(Sigma, NSW, Australia),遵循制造商的指导方针。在洗脱之前,根据制造商的说明对提取的总RNA进行柱上DNase I酶切(Sigma, NSW, Australia)。采用Nanodrop™ND-1000 (Analytical Technologies, Australia)分光光度法检测RNA的质量和数量。
rna测序和分析
使用TruSeq链mRNA文库试剂盒(Illumina)按照制造商的方案构建12个RNA文库,每个文库包含3个生物重复,每种处理(0.1%乙醇,4.5 μM NAA, 5 μM褪黑激素和100 μM褪黑激素)。构建的文库使用NextSeq550系统(Illumina)测序,为75 bp单端reads,每个样本平均读取数为2000万。Kallisto程序通过伪比对k-mer长度为31的Araport11模型转录组来确定转录本丰度(转录本每百万(TPM)) [117,118]。对于差异基因表达分析,使用了sleuth程序,该程序利用Wald测试来确定差异基因表达[117]。错误发现率(FDR) < 0.05的基因2至少1.2倍的倍数变化被归类为差异表达。为了进行功能分析,差异表达基因的基因本体(GO)术语富集从公开的数据库(www.geneontology.org),并从TAIR的批量数据检索工具(www.arabidopsis.org).
数据和材料的可用性
用于分层聚类和热图的微阵列表达数据可在生物分析资源,BAR, (https://bar.utoronto.ca)公共数据库。我们研究的RNA-seq数据已存入NCBI的Gene Expression Omnibus (GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/),登录号为GSE134079。支持本文结论的所有其他数据集都包含在本文(及其附加文件)中。
缩写
- AOX:
-
替代氧化酶
- 度:
-
差异表达基因
- DR5:
-
直接重复5
- 舰队指挥官:
-
褶皱变化
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- MT:
-
褪黑激素
- 乙酰天冬氨酸:
-
1-萘乙酸
- RNA-Seq:
-
RNA序列
- 山:
-
水杨酸
参考文献
杨建军,李建军,李建军,等。植物激素对植物生长的调节作用。生物化学学报,2009;5(5):301-7。
温国强,赵艳,阮玉玲。激素对重要农艺性状的控制。植物科学,2018;9:1504。
刘建军,刘建军,刘建军,刘建军。植物激素相互作用:作物育种和管理的创新目标。实验学报,2012;63(9):3499-509。
杨军,张军,刘凯,王铮,刘磊。灌浆期土壤干燥对小麦籽粒脱落酸和乙烯相互作用的响应。中国生物医学工程学报,2006;31(2):393 - 393。
赵忠,苏安生,Ljung K, Dolezal K, Miotk A, Schultheiss SJ,等。芽部干细胞生态位的激素调控。自然。2010;465(7301):1089 - 92。
Hernandez IG, Gomez FJ, Cerutti S, Arana MV, Silva MF。拟南芥褪黑素在低浓度下具有植物生长调节剂的作用,在高浓度下具有保持种子活力的作用。植物生理学报。2015;44(4):991 - 996。
陈晓明,张晓明,张晓明,等。褪黑素对青稞叶片衰老过程中叶绿素降解的保护作用。松果学学报,2009;46(1):58-63。
张宏,王磊,石凯,单东,朱勇,王超,等。在季节性光信号的调控下,低水平褪黑素介导苹果树开花。松果学学报,2019;36(2):851 - 851。
梁东,沈勇,倪忠,王强,雷震,徐宁,等。外源褪黑素通过调节抗氧化能力和类黄酮的生物合成延缓猕猴桃叶片衰老。植物科学,2018;9:426。
Bajwa VS, Shukla MR, Sherif SM, Murch SJ, Saxena PK.褪黑素在缓解冷应激中的作用拟南芥。松果学学报,2014;36(3):368 - 368。
黄斌,陈晔,赵永强,丁宝宝,廖建强,胡超,等。外源褪黑素减轻干旱胁迫下玉米幼苗的氧化损伤和保护光系统II。植物科学,2019;10:677。
石辉,谭德新,Reiter RJ,叶涛,杨峰,陈铮。褪黑素诱导A1类热休克因子(HSFA1s)及其对热耐受性的影响拟南芥。松果学学报,2015;58(3):335 - 342。
尹玲,王鹏,李敏,柯欣,李超,梁东,等。外源性褪黑素马吕斯对马氏病的抗性。松果学学报,2013;34(4):426 - 431。
魏艳,常艳,曾华,刘刚,何超,石华。通过激活褪黑素生物合成基因,RAV转录因子对木薯抗枯萎病至关重要。松果学学报,2018;36(1)。https://doi.org/10.1111/jpi.12454
李海燕,李艳艳,李春华,等。褪黑素在拟南芥和烟草中对病原菌的防御反应。松果学学报,2014;37(3):662 - 668。
褪黑素:一种新的植物激素和/或植物主调控因子?植物科学进展,2019;24(1):38-48。
李海燕,边勇,李凯,李海军,Back K.克隆拟南芥5 -羟色胺N-乙酰转移酶及其与咖啡酸的作用O-甲基转移酶在褪黑激素体外生物合成中的作用,尽管它们的亚细胞定位不同。松果学学报,2014;57(4):418 - 426。
卞勇,李海军,李海燕,Back K.克隆及功能鉴定拟南芥N-acetylserotoninO负责褪黑素合成的甲基转移酶。松果学学报,2016;60(1):65-73。
陈建军,陈建军,陈建军。植物中褪黑素的生物合成:在细胞质或叶绿体中多种途径催化色氨酸生成褪黑素。松果学学报,2016;61(4):426 - 437。
水稻组蛋白去乙酰化酶10和拟南芥组蛋白去乙酰化酶14基因的编码N-乙酰- 5 -羟色胺去乙酰化酶,催化转化N-乙酰- 5 -羟色胺转化为5 -羟色胺,这是植物中褪黑激素生物合成的一种反向反应。松果学学报,2018;36(2)。https://doi.org/10.1111/jpi.12460
石辉,蒋超,叶涛,谭大东,Reiter RJ,张宏,等。比较生理学、代谢组学和转录组学分析揭示了百慕大草提高非生物抗逆性的机制[香附子珀耳斯(左)。]通过外源性褪黑素。实验学报,2015;66(3):681-94。
李超,梁波,常春,魏忠,周生,马峰。外源褪黑素提高油菜钾含量马吕斯在不同的应力条件下。松果学学报,2016;61(2):218-29。
黄春华,王晓明,王晓明,等。植物生长活性、生根能力和向性:褪黑素对植物生长的影响。植物物理学报,2017;39(6)。https://doi.org/10.1007/s11738-017-2428-3
李辉,常军,陈辉,王铮,顾鑫,魏超,等。外源褪黑素通过改善光合作用和氧化还原稳态,赋予西瓜耐盐性。植物科学,2017;8:295。
魏军,李大东,张继日,单超,Rengel Z,宋志斌,等。褪黑激素受体pmtr1介导的信号调节气孔关闭拟南芥。松果学学报,2018;35(2):444 - 444。
Arnao MB, Hernandez-Ruiz J.褪黑素及其与植物激素的关系。人工智能学报,2018;21(2):195-207。
贺建新,张建新,张建新,等。褪黑素对植物生长的影响。足底。2004;220(1):140 - 4。
Hernandez-Ruiz J, Cano A, Arnao MB.褪黑素在一些单子叶植物中起刺激生长的作用。松果学学报,2005;39(2):137 - 142。
陈强,祁文彬,Reiter RJ,魏伟,王博明。外源应用褪黑激素刺激根生长和提高内源吲哚乙酸在黄化幼苗的根芸苔属植物juncea。植物生理学报,2009;32(3):344 - 344。
王磊,赵颖,Reiter RJ,何超,刘刚,雷强,等。过表达羊转基因“Micro-Tom”番茄中褪黑素水平的变化AANAT和绵羊的HIOMT基因。松果学学报,2014;56(2):134 - 134。
王强,安斌,魏勇,瑞特荣军,石华,罗华,等。褪黑素通过抑制植物生长素的合成和植物生长素的极性转运来调节根分生组织拟南芥。植物科学,2016;7:1882。
陈毅,杨志强,李建军,李建军。DR5作为报告系统研究植物生长素的反应杨树。植物学报,2013;32(3):453-63。
刘建军,刘建军,刘建军,等。Aux/IAA蛋白抑制含有天然和高活性合成生长素反应元件的报告基因的表达。植物学报。1997;9(11):1963-71。
李建军,李建军,李建军,等。生长素运输促进拟南芥侧根形成。植物学报。2001;13(4):843-52。
梁超,李安,于宏,李伟,梁超,郭生,等。褪黑素通过调节水稻的生长素反应来调节根系结构。植物科学,2017;8:134。
金敏,徐浩,朴超,朴文杰。经典玉米生长素测定系统中植物褪黑素作用的生长素假说的检验。植物生理学报,2016;19(2):557 - 557。
魏达生,张宁,赵鑫,Ndip G,郭勇,Buck GA,等。拟南芥转录组分析揭示褪黑激素在植物防御系统中的关键作用。科学通报,2014;9(3):93462。
Pelagio-Flores R, Munoz-Parra E, Ortiz-Castro R, Lopez-Bucio j拟南芥根系结构可能独立于生长素信号传导。松果学学报,2012;33(3):779 - 779。
Koyama FC, Carvalho TL, Alves E, da Silva HB, de Azevedo MF, Hemerly AS,等。结构相关的生长素和褪黑素色氨酸衍生物及其作用拟南芥在人类疟疾寄生虫中恶性疟原虫。生物化学学报,2013;36(6):646 - 651。
谭晓东,曼切斯特LC,秦磊,Reiter RJ。褪黑素:涉及线粒体保护和动力学的线粒体靶向分子。国际医学杂志,2016;17(12)。https://doi.org/10.3390/ijms17122124
王磊,冯超,郑旭,郭勇,周峰,单丹,等。植物线粒体合成褪黑素,增强植物对干旱胁迫的耐受性。松果体学报,2017;63(3)。https://doi.org/10.1111/jpi.12429
Ng S, De Clercq I, Van Aken O, Law SR, Ivanova A, Willems P,等。在生长、发育和应激过程中编码线粒体蛋白的核基因的顺行和逆行调控。植物学报,2014;7(7):1075-93。
王晓明,王晓明,王晓明,等。植物生长发育过程中线粒体信号与激素的相互作用。植物细胞环境学报,2016;39(5):1127-39。
李春林,王敏,马晓霞,张伟。线粒体丙酮酸载体NRGA1介导ABA调控保护细胞离子通道和干旱胁迫响应拟南芥。植物学报,2014;7(10):1508-21。
Norman C, Howell KA, Millar AH, Whelan JM, Day DA。水杨酸是线粒体电子传递的解偶联剂和抑制剂。植物生理学报,2004;31(1):492 - 491。
Leonova LA, Gamburg KZ, Vojnikov VK, Varakina NN。生长素在悬浮培养细胞分裂诱导中的呼吸促进作用。[J] .植物学报,2004;4(1):1 - 4。
秦刚,顾华,赵毅,马忠,石刚,杨毅,等。吲哚-3-乙酸羧甲基转移酶调节拟南芥叶的发展。植物学报,2005;17(10):2693-704。
[3]王晓明,王晓明,王晓明,等。植物茎侧器官形态的转录调控研究进展拟南芥。植物学报。2007;19(2):473-84。
Van Aken O, Pecenkova T, Van de Cotte B, de Rycke R, Eeckhout D, Fromm H,等。线粒体i型禁止拟南芥是支持熟练分生系统开发所必需的。植物学报,2007;32(5):559 - 564。
何杰,段勇,华冬,范刚,王磊,刘勇,等。DEXH盒RNA解旋酶介导线粒体活性氧的产生拟南芥介导脱落酸和生长素信号传导之间的串扰。植物学报,2012,24(5):1815-33。
张宁,张海军,赵波,孙qq,曹云云,李锐,等。用RNA-seq方法鉴别褪黑素对黄瓜侧根形成的影响。松果学学报,2014;56(1):39-50。
李建辉,张斌,李建辉,李建辉,等。生长素与线粒体逆行信号调控之间的功能拮抗关系替代Oxidase1a在拟南芥中的表达植物生理学报,2014,31(3):1233 - 1254。
陈建军,陈建军,李建军,等。线粒体扰动对生长素信号传导产生负面影响。植物学报,2014;7(7):1138-50。
陈建军,陈建军,陈建军,陈建军。拟南芥IAR4通过调节生长素稳态调节生长素反应。植物生理学报,2009;30(2):748 - 758。
Vanlerberghe GC。替代氧化酶:在植物非生物和生物胁迫期间维持代谢和信号稳态的线粒体呼吸途径。中国生物医学工程学报,2013;31(4):563 - 567。
李建军,李建军,李建军,等。氧化氮与乙烯在臭氧处理烟草植株中诱导替代性氧化酶的相互作用。植物生理学报,2006;42(2):595-608。
Tan DX, Manchester LC, Liu X, Rosales-Corral SA, Acuna-Castroviejo D, Reiter RJ。线粒体和叶绿体是褪黑素合成的原始位点:一个关于褪黑素在真核生物中的主要功能和进化的假说。松果学学报,2013;33(2):379 - 379。
郑X,谭DX,艾伦AC,左B,赵Y, Reiter RJ, et al。褪黑素的叶绿体生物合成及其在植物抗盐胁迫中的作用。科学通报,2017;7:1236。
Benkova E, Michniewicz M, Sauer M, Teichmann T, Seifertova D, Jurgens G,等。局部外排依赖性生长素梯度是植物器官形成的共同模块。细胞。2003;115(5):591 - 602。
Hayashi K, Nakamura S, Fukunaga S, Nishimura T, Jenness MK, Murphy AS,等。利用荧光生长素类似物在植物中可视化生长素运输位点。中国科学:自然科学版,2014;31(1):1557 - 1562。
吴绍平,王勇,徐磊,等。细胞周期蛋白依赖性激酶E1 (CDKE1)在植物生长和胁迫反应之间提供细胞开关。生物化学学报,2013;28(5):349 - 359。
De Clercq I, Vermeirssen V, Van Aken O, Vandepoele K, Murcha MW, Law SR等。膜结合的NAC转录因子ANAC013在线粒体逆行调节氧化应激反应中起作用拟南芥。植物学报,2013;25(9):3472-90。
Paponov IA, Paponov M, Teale W, Menges M, Chakrabortee S, Murray JA,等。植物生长素反应的综合转录组分析拟南芥。植物学报,2008;1(2):321-37。
Lewis DR, Olex AL, Lundy SR, Turkett WH, Fetrow JS, Muday GK。生长素转录组的动力学分析揭示了调节侧根发育的细胞壁重塑蛋白拟南芥。植物学报,2013,25(9):3329-46。
Fury W, Batliwalla F, Gregersen PK, Li W.顶级基因列表重叠概率、超几何分布和基因选择标准的严格性。中国生物医学工程学报,2006;1:55 - 55。
Walley JW, Kelley DR, Nestorova G, Hirschberg DL, Dehesh K.拟南芥死酶AtCAF1a和AtCAF1b在介导环境胁迫反应中发挥重叠且不同的作用。植物生理学报,2010;32(2):866 - 875。
卢塞博士,威尔逊博士,哈斯威尔博士。RNA测序分析msl2msl3,crl,和ggps1突变表明,质体功能障碍的不同来源不会通过共同的信号通路改变叶片形态。植物科学,2015;6:1148。
Omelyanchuk NA, Wiebe DS, Novikova DD, Levitsky VG, Klimova N, gorellova V,等。生长素以折叠变化特异性的方式调节功能基因群拟南芥的根源。科学通报,2017;7(1):2489。
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM,等。基因本体论:生物学统一的工具。基因本体联盟。植物学报,2000;25(1):25 - 9。
韦泽J,普罗沃特NJ。植物生物学生物分析资源。方法:中华医学杂志。2017;33:119 - 48。
Schmid M, Davison TS, Henz SR, Pape UJ, Demar M, Vingron M,等。的基因表达图谱拟南芥发展。地理学报,2005;37(5):501-6。
石辉,张生,林丹,魏勇,严勇,刘刚,等。拟南芥6的锌指通过INDETERMINATE DOMAIN15和INDOLE-3-ACETIC ACID 17的相互作用参与褪黑素介导的生长素信号传导。松果学学报,2018;35(2):444 - 444。
万杰,张鹏,王锐,孙丽,鞠强,徐杰。褪黑素和血清素在调节小鼠生长和代谢中的比较生理反应和转录组分析拟南芥。植物学报,2018;18(1):362。
张生,吴军,袁东,张东,黄志,肖磊,等。线粒体对生长素稳态的扰动FtSH4基因介导的过氧化物酶积累调控拟南芥体系结构。植物学报,2014;7(5):856-73。
Antoniou C, Chatzimichail G, Xenofontos R, Pavlou JJ, Panagiotou E, Christou A,等。褪黑素系统地改善干旱胁迫引起的损伤紫花苜蓿植物通过调节硝基氧化稳态和脯氨酸代谢。松果学学报,2017;32(4)。https://doi.org/10.1111/jpi.12401
Millar AH, Wiskich JT, Whelan J, Day DA。有机酸活化植物线粒体替代氧化酶的研究。生物化学学报。1993;329(3):259-62。
张建军,张建军,张建军,等。三羧酸循环对氧化酶酶活性的影响。植物生理学报,2018;36(2):1423-32。
Day DA, Whelan J, Millar AH, Siedow JN, Wiskich JT。植物和真菌中选择性氧化酶的调控。植物学报,1995;22(2):497 - 509。
于燕,吕燕,石燕,李涛,陈燕,赵东,等。植物褪黑素及其代谢产物在应激反应中的作用。分子。2018;23(8)。https://doi.org/10.3390/molecules23081887
Reiter RJ, Rosales-Corral S, Tan DX, Jou MJ, Galano A, Xu B.褪黑素作为线粒体靶向抗氧化剂的研究进展。细胞与生命科学,2017;74(21):3863-81。
王晓华。褪黑素在植物体内的表达与功能。植物科学,2016;7:198。
褪黑素:在植物中的发现、含量和作用。生物学报,2014;2014:1 - 11。
魏勇,胡伟,王强,曾宏,李旭,严勇,等。香蕉热休克蛋白90的鉴定、转录及功能分析(穆萨acuminataL.)强调了它们在褪黑素介导的植物对枯萎病的反应中的新作用。松果学学报,2017;32(1)。https://doi.org/10.1111/jpi.12367
刘超,陈磊,赵锐,李锐,张生,于伟,等。褪黑素诱导疾病抵抗葡萄孢菌通过激活茉莉酸信号通路农业食品学报,2019;67(22):6116-24。
杨建军,刘建军,张建军,等。褪黑素在植物寄主抗性和病原菌抑制中的作用。松果学学报,2018;35(3):591 - 591。
李海燕,李海燕。丝裂原活化蛋白激酶途径在植物褪黑激素介导的防御反应中的作用。松果学学报,2016;36(3):327 - 335。
Lee HY, Back k2O2-和no介导的防御信号通过MAPKKK3和ox1 in拟南芥。松果学学报,2017;32(2)。https://doi.org/10.1111/jpi.12379
李辉,常军,郑军,董勇,刘强,杨旭,等。局部应用褪黑素诱导远端器官的耐寒性Citrullus lanatusL.通过长途运输。科学通报,2017;7:40858。
尹耀辉,金敏,朴文杰。褪黑素在玉米根系上的叶面积累(玉米)幼苗。生物分子。2019;9(1)。https://doi.org/10.3390/biom9010026
李建军,李建军,李建军,李建军。植物体内褪黑素和血清素在热胁迫下的分布和吸收。松果学学报,2019;36(1):444 - 444。
李海燕,边勇,谭大东,李志强,李志强。拟南芥5 -羟色胺N-乙酰转移酶敲除突变体植物表现出褪黑素和水杨酸水平降低,导致对无毒病原体的敏感性。松果学学报,2015;58(3):291 - 299。
李建军,李建军,李建军,等。植物抗微生物肽的研究进展。植物科学,2015;6:900。
dratos PM, Payne J, Di Pietro A, Anderson MA, Plummer KM。植物防御素NaD1和NaD2诱导真菌不同的胁迫反应途径。国际医学杂志,2016;17(9)。https://doi.org/10.3390/ijms17091473
kessig DF, Choi HW, Dempsey DA。系统性获得性耐药与水杨酸:过去、现在和未来。植物学报,2018;31(9):871-88。
崔峰,吴松,孙伟,Coaker G, Kunkel B,何鹏,等。的两III型效应物AvrRpt2通过刺激促进病原体的毒力拟南芥生长素/吲哚乙酸蛋白周转。植物生理学报,2013,32(2):1018 - 1029。
Wang D, pajerowka - mukhtar K, Culler AH, Dong X.水杨酸通过抑制植物生长素信号通路抑制病原菌生长。中华生物医学杂志,2007;17(20):1784-90。
张生,郑鑫,Reiter RJ,冯松,王勇,刘生,等。褪黑素通过破坏细胞生长、抗逆性、杀菌剂敏感性和基因表达的稳态来减弱马铃薯晚疫病5种。植物科学,2017;8:1993。
莱FT,安德森MA。防御素——植物先天免疫系统的组成部分。中国生物医学工程学报,2005;6(1):85-101。
李建军,张建军,张建军,张建军,张建军。植物对缺铁反应中氧化还原活性代谢物的生物合成。化学学报,2018;14(5):442-50。
周超,刘志,朱磊,马忠,王军,朱军。外源褪黑素通过增加多胺介导的一氧化氮积累提高植物铁缺乏耐受性。国际医学杂志,2016;17(11)。https://doi.org/10.3390/ijms17111777
李建军,李建军,李建军,李建军,等。细菌微生物相关分子模式(MAMPs)诱导的真菌先天免疫。G3(贝塞斯达)。2016; 6(6): 1585 - 95。
刘建军,刘建军,刘建军,刘建军。铁和免疫力。植物学报,2017;55(5):355 - 75。
prem, Atallah M, Champion A, De Vos M, Pieterse CM, Memelink J. AP2/ERF结构域转录因子ORA59整合茉莉酸和乙烯信号在植物防御中的作用。植物生理学报,2008;47(3):1347 - 1357。
李建平,李建平。卵菌反应基因的研究进展LURP1是防御所必需的吗Hyaloperonospora parasitica在拟南芥。植物科学进展,2009;35(1):1 - 4。
张建军,张建军,张建军,等。生长素基因表达调控因子的研究进展。植物化学学报,2002;49(3):373-85。
康士德,毕彦明,朱涛,罗思杰。SAUR39一个小的生长素上行RNA基因,作为水稻生长素合成和运输的负调控因子。植物生理学报,2009;31(2):691-701。
马吉达M,罗伯特S.生长素在细胞壁扩增中的作用。中华医学杂志,2018;19(4)。https://doi.org/10.3390/ijms19040951
Rawat R, Schwartz J, Jones MA, Sairanen I, Cheng Y, Andersson CR,等。REVEILLE1是一种类似myb的转录因子,整合了生物钟和生长素途径。中国科学:自然科学进展,2009;39(6):893 - 893。
Zazimalova E, Murphy AS, Yang H, Hoyerova K, Hosek P.生长素转运蛋白为何如此之多?寒泉与水生生物学报,2010;2(3):a001552。
文迪,龚波,孙生,刘生,王旭,魏敏,等。褪黑素在植物不定根发育中的促进作用茄属植物lycopersicumL通过调节生长素和一氧化氮信号。植物科学,2016;7:718。
戴维斯PJ。植物激素。Dodrecht:施普林格;2010.1 - 15 p。。
Bilgin DD, Zavala JA, Zhu J, Clough SJ, Ort DR, DeLucia EH。生物胁迫在全球范围内下调光合作用基因。植物学报,2010;33(10):1597-613。
Pajerowska-Mukhtar KM, Wang W, Tada Y, Oka N, Tucker CL, Fonseca JP,等。hsf样转录因子TBF1是植物生长到防御转变的主要分子开关。当代生物学,2012;22(2):103-12。
徐刚,袁敏,艾晨,刘丽,庄娥,Karapetyan S,等。uorf介导的翻译可以实现不需要适应度成本的植物抗病工程。大自然。2017;545(7655):491 - 4。
刘霞,Afrin T, Pajerowska-Mukhtar KM。拟南芥GCN2激酶参与ABA稳态和气孔免疫。公共生物学报。2019;2:302。
刘建军,刘建军,刘建军,等。PlaNet:来自7个物种的植物网络的组合序列和表达比较。植物学报,2011;23(3):895-910。
Bray NL, Pimentel H, Melsted P, Pachter L.近最优概率rna序列定量。生物工程学报,2016;34(5):525-7。
Cheng CY, Krishnakumar V, Chan AP, Thibaud-Nissen F, Schobel S, Town CD. araport:一个完整的重新注释拟南芥参考基因组。植物学报,2017;39(4):789-804。
致谢
我们感谢Anthony R. Gendall博士(澳大利亚拉筹伯大学动植物和土壤科学系系主任)提供的DR5:绿色荧光蛋白和Asha Haslem(澳大利亚拉筹伯大学基因组学平台)在下一代测序方面的出色技术援助。
资金
本研究由拉筹伯大学研究生研究奖学金(LTUPRS),拉筹伯大学全额研究奖学金(LTUFFRS)授予s.f.z和安全食品水与环境(SFWE) -研究重点领域(RFA)项目奖学金(KPlummer SFWE 18)授予k.m.p., a.e.f., f.b.和s.f.z资助。资助人在研究设计中没有作用;数据分析:对数据的收集、分析或解释;在撰写稿件时,还是在决定发表结果时。
作者信息
从属关系
贡献
SFZ, FB, JW, AEF, KMP:对概念化有贡献。SFZ:进行实验;SFZ和OB:对数据管理和统计分析做出贡献;SFZ:形式化分析、可视化、撰写原稿;SFZ、FB、OB、JW、AEF、KMP:审稿编辑;KMP和FB:监督项目,KMP, AEF和FB:获得资金。所有作者都阅读并认可了最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1。
数据说明:图S1:褪黑素对生长素反应标记系DR5::GFP表达的影响拟南芥主要根图S2:褪黑素对生长素反应基因表达的影响AOX1a:卢克在…的莲座叶中拟南芥图S3:野生型种子发育的差异响应AOX1a:卢克(Col-0)趋向褪黑素或生长素表S1。与生长素反应性氧化石墨烯相关的差异表达基因(DEGs)的重叠分析表S2。拟南芥中褪黑素转录组数据与DEGs的重叠分析。表S3。RNA-Seq数据汇总统计胁迫下MT独特或共同调控的deg的微阵列表达模式。
附加文件2:
表S4。与溶剂对照(0.1% v/v乙醇)相比,NAA调节的deg。
附加文件3:
表S5:与溶剂对照(0.1% v/v乙醇)相比,褪黑激素(100 μM)调控的GO功能注释和其他基因细节。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Zia, s.f., Berkowitz, O, Bedon, F。et al。直接比较拟南芥基因表达揭示了对褪黑激素和生长素的不同反应。BMC Plant Biol19日,567(2019)。https://doi.org/10.1186/s12870-019-2158-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2158-3
关键字
- 褪黑激素
- 生长素
- 启动子的激活
- 转录组
- 拟南芥