- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 出版:GydF4y2Ba
宿主茉莉酸途径调节筒筒和寄主植物的转录组变化,毛毛虫在送扁蹄虫的情况下GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba,物品编号:GydF4y2Ba540GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
菟丝子(GydF4y2Ba菟丝子GydF4y2Ba旋花科(Convolvulaceae)的物种是专性无根无叶寄生虫,完全依赖宿主生存。菟丝子自然地将自己嫁接到宿主的茎上,形成血管融合,从中获取营养和水分。此外,菟丝子和它们的宿主还交换各种其他分子,包括蛋白质、mrna和小rna。菟丝子和寄主植物之间的系统信号也很可能通过维管融合在植物间传递,这些系统信号可能对菟丝子和寄主植物的生理机能产生深远的影响。食草性是植物常见的一种生物胁迫。当菟丝子寄生虫被鳞翅目昆虫攻击时,菟丝子如何对毛虫的进食作出反应,以及宿主植物和寄生虫之间是否存在植物间的通信,目前仍然知之甚少。GydF4y2Ba
结果GydF4y2Ba
在这里,野生型(WT)烟草和茉莉酸(JA)生物合成被沉默的烟草品系(AOC RNAi)被用作寄主,菟丝子及其寄主植物对草食的反应通过GydF4y2Baspodoptera lituraGydF4y2BaDodders上的毛毛虫被调查了。结果发现,在毛毛虫攻击后,在AOC-RNAi烟草上生长的DoDders显示出大量较少数量的差异表达基因,尽管烟草植物的基因型没有对模拟的影响GydF4y2Ba美国lituraGydF4y2Ba饲料对菟丝子JA积累的影响。我们进一步证明GydF4y2Ba美国lituraGydF4y2Ba菟丝子上的草食还导致宿主烟草中转录组和防御代谢产物发生巨大变化,从而增强对烟草的抗性GydF4y2Ba美国lituraGydF4y2Ba,而烟草宿主的JA通路对这些系统应答至关重要。GydF4y2Ba
结论GydF4y2Ba
我们的研究结果表明,在毛虫攻击菟丝子期间,宿主植物的JA途径是菟丝子和宿主植物正确转录组反应所必需的。这项研究强调了寄主JA途径在调节菟丝子和寄主之间的植物间系统信号中的重要性。GydF4y2Ba
背景GydF4y2Ba
植物和昆虫共同进化了数亿年。几乎植物的所有部分(叶、根、茎、花和种子)都可能受到昆虫的攻击。咀嚼昆虫,如某些甲虫和毛虫,能迅速清除和消化植物组织。刺吸昆虫用它们的口器撕裂细胞并吸取液体内容物(如蓟马)或直接吸取韧皮部组织的细胞间内容物(如蚜虫和白蝇)。植物装备了复杂的防御系统,通过激活信号网络并随后合成防御化合物来抵御昆虫食草动物[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba2GydF4y2Ba].植物可以识别由昆虫捕食造成的伤害;此外,食草动物相关的激发子,如鳞甲幼虫口腔分泌物(OS)中的脂肪酸氨基酸结合物(FACs),以及刺吸昆虫唾液液中的某些成分,可触发特定的防御反应[GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba4.GydF4y2Ba]加利福尼亚州GydF4y2Ba2+GydF4y2Ba、丝裂原活化蛋白激酶(MAPK)和植物激素信号通路参与后续转录组重构的调控,导致防御代谢物的积累[GydF4y2Ba5.GydF4y2Ba,GydF4y2Ba6.GydF4y2Ba].GydF4y2Ba
茉莉酸(JA)信号通路在调节植物对许多(如果不是全部的话)昆虫食草动物(包括鳞翅目昆虫幼虫)的防御反应中起着核心作用[GydF4y2Ba2GydF4y2Ba]温室和田间研究表明,由于防御代谢产物的减少,JA生物合成或信号传导受损的植物对草食的抗性大大降低。例如,使GydF4y2Ba薏苡仁GydF4y2Ba基因,它编码野生烟草中JA-Ile (ja -异亮氨酸,实际的茉莉酸信号)的受体GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba导致尼古丁、咖啡酰半胱氨酸、二萜苷和胰蛋白酶抑制剂(TPIs)的活性显著降低,并且GydF4y2Ba薏苡仁GydF4y2Ba沉默的植物非常容易受到昆虫食草动物的影响[GydF4y2Ba7.GydF4y2Ba].在拟南芥(GydF4y2Ba拟南芥GydF4y2Ba)、MYC2、MYC3和MYC4是三个基本的螺旋-环-螺旋转录因子,在控制茉莉酸诱导的各种反应中具有加性功能。三突变体GydF4y2Bamyc2 myc3 myc4GydF4y2Ba被发现几乎不含硫代葡萄糖苷(十字花科植物中的抗虫化合物)和多面手的幼虫GydF4y2BaSpodoptera littoralisGydF4y2Ba越来越大GydF4y2Bamyc2 myc3 myc4GydF4y2Ba比野生型(WT)拟南芥[GydF4y2Ba8.GydF4y2Ba].GydF4y2Ba
伤害和食草不仅在受损叶片(局部)中引起防御反应,而且在其他未受损叶片(系统)中也引起防御反应,这表明在受伤或食草受损组织中诱导系统信号,并且该信号可以转移到整个植物的其他部分以激活防御[GydF4y2Ba5.GydF4y2Ba].系统信号传导首先在番茄中发现(GydF4y2Ba番茄茄GydF4y2Ba) [GydF4y2Ba9.GydF4y2Ba]:番茄叶片损伤不仅提高了该局部叶片中蛋白酶抑制剂I (PI I)的活性,而且系统地提高了未损伤叶片中蛋白酶I的活性。PI I是一种抑制昆虫中肠蛋白酶活性的抗消化代谢产物。从那时起,大量的研究工作集中在系统信号的识别和机制的产生,转运,或感知远端叶片。在一项优雅的研究中,Li等人[GydF4y2Ba10GydF4y2Ba]利用番茄JA生物合成突变体和JA信号转导突变体与番茄WT植株交互嫁接,发现长距离信号传递需要JA或JA调控的代谢物。除了JA途径外,电信号、活性氧和谷氨酸受体也参与了受伤或被食草动物诱导后的全身信号传导[GydF4y2Ba11GydF4y2Ba,GydF4y2Ba12GydF4y2Ba,GydF4y2Ba13GydF4y2Ba].GydF4y2Ba
大约1%的开花植物是寄生虫[GydF4y2Ba14GydF4y2Ba].植物寄生虫利用一种特殊的器官吸器附在寄主身上吸取水分和营养,导致寄主植物生长迟缓,有时甚至死亡。一些寄生虫,例如GydF4y2BaOrobancheGydF4y2BaSPP。,GydF4y2Ba斯特里加GydF4y2Ba(均为Orobanchaceae)GydF4y2Ba菟丝子GydF4y2Ba是一种臭名昭著的寄生杂草,在世界许多地区造成农业和园艺的巨大损失[GydF4y2Ba15GydF4y2Ba].属GydF4y2Ba菟丝子GydF4y2Ba约有200种分布于世界各地[GydF4y2Ba16GydF4y2Ba,通常被称为菟丝子。菟丝子没有根和叶,完全依赖寄主植物获取水分和营养。使用RNA-seq方法,Kim等人[GydF4y2Ba17GydF4y2Ba从拟南芥宿主中鉴定出9000多种不同的mrnaGydF4y2Bac . pentagonaGydF4y2Ba超过8000个信使rnaGydF4y2Bac . pentagonaGydF4y2Ba在拟南芥寄主中。小RNA测序也显示76GydF4y2Ba五角定GydF4y2Ba-表达的小rna在拟南芥茎和菟丝子吸器的界面富集,其中一些是作为宿主防御菟丝子寄生虫的抑制子的miRNAs [GydF4y2Ba18GydF4y2Ba].绿色荧光蛋白(GFP)在烟草中的表达(GydF4y2Ba烟草GydF4y2Ba)可在寄生菟丝子中检测到[GydF4y2Ba19GydF4y2Ba]这表明蛋白质也可能在菟丝子和它们的宿主之间流动。GydF4y2Ba
最近,菟丝子被发现能传递食草动物诱导的全身信号。一株菟丝子植物同时寄生两个或多个寄主(GydF4y2Ba五角南极光GydF4y2Ba),其中一个寄主受伤或受到毛虫的捕食,菟丝子在寄主之间传递受伤或毛虫捕食诱导的系统信号,激活未受损植物的系统防御反应,增强它们对鳞翅目幼虫随后侵染的抵抗力[GydF4y2Ba20.GydF4y2Ba].重要的是,将拟南芥WT和拟南芥发送的系统信号进行比较GydF4y2BaDDE2-2GydF4y2Ba突变体(JA生物合成不足)表明JA途径在调节系统信号的产生或传递中起重要作用。同样,采食青桃蚜虫(GydF4y2BaMyzus persicaeGydF4y2Ba)蹒跚而行GydF4y2Ba巨朱蕉GydF4y2Ba导致宿主大豆植株中1000多个基因的上调或下调(GydF4y2Ba大豆GydF4y2Ba),大豆寄主对棉叶虫(CLW,GydF4y2Baspodoptera lituraGydF4y2Ba)及大豆蚜虫(GydF4y2Ba大豆蚜GydF4y2Ba) [GydF4y2Ba21GydF4y2Ba].GydF4y2Ba
一些种类的昆虫以菟丝子植物为食,主要是蚜虫和象鼻虫属GydF4y2BaSmicronyxGydF4y2Ba(鞘翅目,Curculioninae) (GydF4y2Ba22GydF4y2Ba,GydF4y2Ba23GydF4y2Ba]关于菟丝子及其寄主植物对鳞翅目毛虫取食的反应知之甚少GydF4y2Ba五角定GydF4y2Ba烟草交互系统是用于调查是否进食咀嚼对菟丝子寄生昆虫CLW能够激活反应在两种植物寄生系统,和主机之间的交互和菟丝子是否防御卡特彼勒喂养是由主机JA通路。我们发现,尽管寄生于菟丝子的CLW激活了寄生虫的转录组变化,但烟草宿主的转录组重构更强,导致烟草对CLW的抗性增强。重要的是,烟草JA通路不仅在塑造烟草植株的系统反应中起关键作用,而且还影响菟丝子转录组。GydF4y2Ba
结果GydF4y2Ba
菟丝子对CLW摄食的反应GydF4y2Ba
c .定GydF4y2Ba在本研究中使用,因为该物种在烟草上生长良好。我们首先研究了菟丝子在转录组水平上对CLW喂养的反应。除了WT烟草作为宿主外,AOC (GydF4y2Ba联烯氧化物环酶GydF4y2Ba-RNAi转基因烟草系[GydF4y2Ba24GydF4y2Ba],其中JA水平非常低(附加文件GydF4y2Ba1GydF4y2Ba(图S1),也用来确定宿主JA途径对菟丝子对CLW摄食反应的影响(如图S1所示)。GydF4y2Ba1GydF4y2Baa).值得注意的是,尽管宿主JA信号似乎参与了宿主对菟丝子寄生虫的防御[GydF4y2Ba25GydF4y2Ba],我们没有观察到狡猾的琐事GydF4y2Bac .定GydF4y2Ba关于WT和AOC RNAi烟草(附加文件GydF4y2Ba1GydF4y2Ba:图S2)。GydF4y2Ba
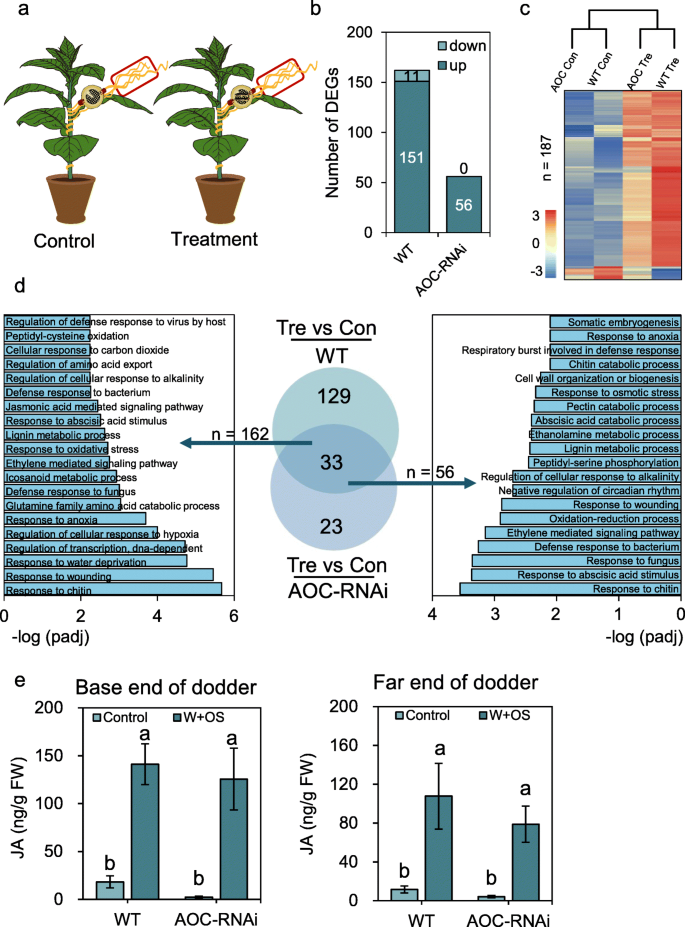
在菟丝子上进行CLW除草后,菟丝子转录组谱和JA水平的变化。GydF4y2Ba一种GydF4y2Ba实验装置的图示。菟丝子在WT和AOC RNAi烟草植株上生长。将空夹笼和夹笼(每个夹笼包含两个CLW幼虫)分别固定在菟丝子上(每个菟丝子一个夹笼),形成对照组和治疗组。12点以后 h、 收集对照组和治疗组的菟丝子进行RNA-seq分析或JA定量。红色框表示采样点。GydF4y2BaB.GydF4y2BaWT和AOC-RNAi烟草上生长的菟丝子中DEGs的数量。GydF4y2BaCGydF4y2BaDodders转录om的热线图和树木分析(Con = Control; Tre =治疗)。GydF4y2BaD.GydF4y2Ba菟丝子DEGs的GO和Venn图分析。GydF4y2BaE.GydF4y2Ba用模拟草食处理后菟丝子中JA含量。用手术刀切断菟丝子茎。将菟丝子茎段连接到宿主(菟丝子的基端),并立即用移液管将CLW OS移到新鲜伤口上;OS也立即应用到分离的菟丝子茎(菟丝子的远端)的伤口上.菟丝子茎1号收获 治疗后h。同时采集未经处理的菟丝子茎段作为对照。数据以平均值±SE表示。不同字母表示统计上的显著差异(GydF4y2BaP.GydF4y2Ba < 0.05,单因素方差分析,然后进行邓肯检验,GydF4y2BaNGydF4y2Ba≥4)GydF4y2Ba
CLW采食菟丝子12 h后采样(每组3个生物重复)。提取的RNA样本用RNA-seq分析(附加文件)GydF4y2Ba2GydF4y2Ba:表S1)。在CLW草食后WT烟草上生长的菟丝子中,我们发现162个差异表达基因(DEGs),其中90%以上(150个)表达上调;相比之下,寄生在AOC-RNAi烟草上的菟丝子仅检测到56个DEGs(图2)。GydF4y2Ba1GydF4y2Bab;额外的文件GydF4y2Ba3.GydF4y2Ba表S2),且均上调(图2)。GydF4y2Ba1GydF4y2Bab) .然后根据菟丝子在不同处理下的所有DEG聚类生成树状图,以描述这些转录组的总体比较图谱(图。GydF4y2Ba1GydF4y2Bac).野生型烟草和AOC-RNAi烟草菟丝子生长的转录组图谱在对照和处理条件下都表现出较高的相似性。接下来,我们用维恩图分析比较菟丝诱导的162和56个DEGs,分别生长在WT和AOC-RNAi烟草上,发现只有33个基因是共同的DEGs(图。GydF4y2Ba1GydF4y2Bad).基因本体论(GO)分析也用于识别从DEGs富集的生物过程。在WT烟草上生长的菟丝子获得的162个DEGs中,“对几丁质的响应”、“对伤害的响应”、“对水分剥夺的响应”、“对茉莉酸刺激的响应”和“茉莉酸介导的信号通路”等术语被富集(图2)。GydF4y2Ba1GydF4y2Bad、 附加文件GydF4y2Ba3.GydF4y2Ba:表S2)。在AOC-RNAi烟草上生长的菟丝子的deg中富集了GO术语“对几丁质的反应”、“对脱落酸刺激的反应”、“乙烯介导的信号通路”、“对伤口的反应”和“对细菌的防御反应”。GydF4y2Ba1GydF4y2Bad、 附加文件GydF4y2Ba3.GydF4y2Ba:表S2)。GydF4y2Ba
这些结果促使我们研究即使在正常条件下,宿主JA通路是否也会影响菟丝子的转录组。引人注目的是,当菟丝子完全未经处理时,我们发现AOC-RNAi上生长的菟丝子和WT烟草之间有351个deg(附加文件)GydF4y2Ba4.GydF4y2Ba:表S3)。这些deg (AOC-RNAi/WT)大部分为负值(351个deg中有286个),表明宿主JA途径对促进许多菟丝基因的基础转录水平是必需的。GO分析表明,“对水分剥夺的响应”、“种子休眠过程”、“质子传递”、“对冷的响应”以及一些与DNA复制相关的过程都被富集(附文件)GydF4y2Ba4.GydF4y2Ba:表S3)。GydF4y2Ba
机械伤害和草食诱导的JA在激活植物防御中起着关键作用[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba2GydF4y2Ba].由于昆虫的取食行为难以控制,因此很难使用实际的昆虫取食来重复诱导短期反应,包括JA反应。因此,我们通过用手术刀切割菟丝子茎,在宿主上留下5厘米长的菟丝子茎段,并将CLW OS应用于新鲜的伤口,模拟菟丝子的CLW食草行为1小时后,收获WT和AOC RNAi烟草上的菟丝子片段,并对JA含量进行量化。我们发现,在模拟CLW除草前后,AOC RNAi烟草上生长的菟丝子中JA的水平往往低于WT烟草上生长的菟丝子,但未检测到统计学差异(图。GydF4y2Ba1GydF4y2Bae).为了排除菟丝子中的JA来自寄主植物的可能性,我们用CLW OS处理未附着在寄主上的菟丝子茎,处理1 h后收获离离点5 cm处的茎。在野生型和AOC-RNAi烟草上生长的菟丝中,损伤和施用OS显著增加了JA水平(图2)。GydF4y2Ba1GydF4y2Bae).因此菟丝子能够合成JA,虽然它只是茎组织,而且宿主JA途径对菟丝子的基础JA和诱导JA没有很强的影响。GydF4y2Ba
综上所述,寄主JA通路在正常和昆虫攻击情况下对菟丝子的转录组有调节作用。GydF4y2Ba
寄主植物对木犀草取食菟丝子的反应GydF4y2Ba
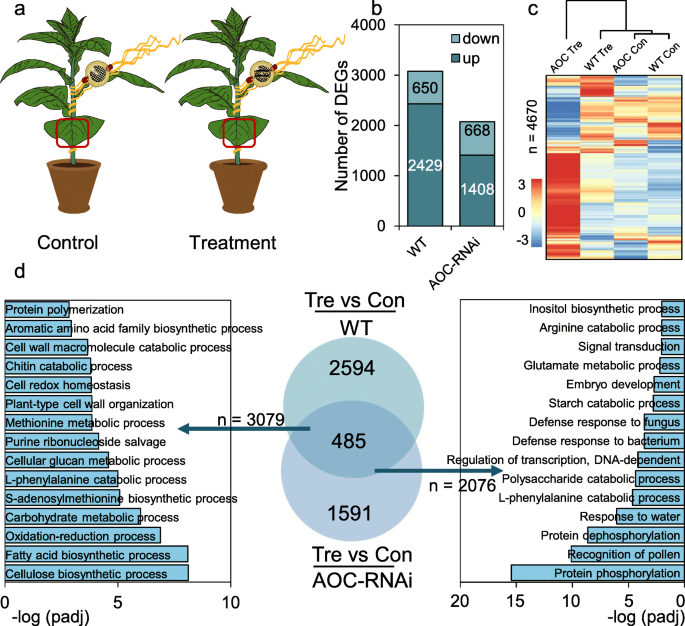
为了确定寄主植物烟草是否也响应以菟丝子为食的CLW,我们检测了烟草寄主的转录组变化(图2)。GydF4y2Ba2GydF4y2Ba一个;额外的文件GydF4y2Ba5.GydF4y2Ba:表S4)。在WT和AOC-RNAi烟草中,饲喂菟丝子12 h的CLW分别上调2429和1408个基因(图2)。GydF4y2Ba2GydF4y2Bab;额外的文件GydF4y2Ba6.GydF4y2Ba:表S5)。在WT和AOC-RNAi宿主中,许多较少的基因(分别为650和668)被下调(图)。GydF4y2Ba2GydF4y2Bab;额外的文件GydF4y2Ba6.GydF4y2Ba:表S5)。树状图分析表明,正常条件下(对照)WT和AOC-RNAi植物具有相对相似的转录组,在各自寄生的dodders上进行草食处理后,WT转录组仍与对照WT和AOC-RNAi植物的转录组分组,而AOC-RNAi转录组与其他植物的转录组距离较远(图2)。GydF4y2Ba2GydF4y2Bac).与WT和AOC-RNAi植物在dodders上食草后转录组之间的巨大差异一致(图2c),维恩图分析表明,从食草处理的WT和AOC-RNAi宿主植物中鉴定的DEGs之间通常只有485个基因受到调控(图2c)。GydF4y2Ba2GydF4y2Bad) GO分析表明“纤维素生物合成过程”、“脂肪酸生物合成过程”、“氧化还原过程”和GydF4y2BaS.GydF4y2Ba-腺苷甲硫氨酸生物合成过程”是WT烟草样品中高度富集的GO术语,而“蛋白质磷酸化”、“蛋白质去磷酸化”、“花粉识别”和“对水的反应”是AOC RNAi样品中高度富集的GO术语(图。GydF4y2Ba2GydF4y2Bad、 附加文件GydF4y2Ba6.GydF4y2Ba:表S5)。因此,对乳丝屑的ClW毛毛虫饲喂宿主植物中的大转录组重新配置,并且适当的宿主转录组变化需要宿主JA途径。GydF4y2Ba
CLW取食菟丝子诱导WT和AOC RNAi烟草寄主植物中的DEGs。GydF4y2Ba一种GydF4y2Ba实验设置说明。菟丝子生长在WT和AOC-RNAi烟草植株上。在菟丝子上固定空夹笼和夹笼(每个夹笼一个),分别构成对照组和处理组。12 h后,收集对照组和处理组WT和AOC-RNAi烟草叶片进行rna测序分析。红框为采样位置。GydF4y2BaB.GydF4y2BaCLW草食处理前后WT和AOC-RNAi烟草寄主中DEGs的数量(Con =对照;混乱关系=治疗)。GydF4y2BaCGydF4y2BaWT和AOC-RNAi烟草转录组的热图和树状图分析。GydF4y2BaD.GydF4y2BaWT和AOC RNAi烟草DEG的GO和Venn图分析(Con = 控制 = (治疗)GydF4y2Ba
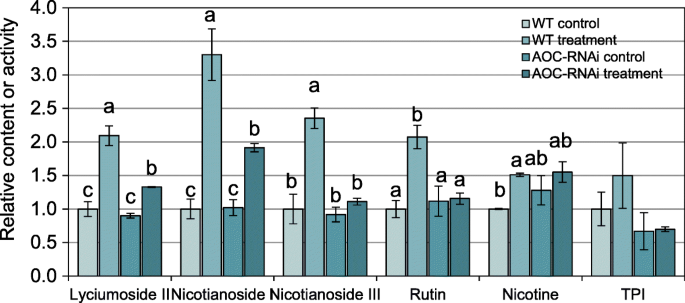
接下来,我们试图确定CLW对菟丝的摄食是否会导致宿主防御代谢物的积累。采食菟丝子60 h后,枸杞苷ІІ、烟酸苷І和烟酸苷Ш(三种抗虫17-羟基香叶醇二萜苷[GydF4y2Ba26GydF4y2Ba])的表达量至少增加了1倍。然而,与WT烟草相比,AOC-RNAi植物中这些代谢物没有被诱导或诱导程度较低(图2)。GydF4y2Ba3.GydF4y2Ba).对芦丁也得到了类似的结果,TPI活性倾向于在WT中被诱导,而在AOC-RNAi烟草中则完全没有(图)。GydF4y2Ba3.GydF4y2Ba)。WT烟草中的尼古丁含量增加了约51%,而AOC RNAi烟草在以寄生菟丝子为食的CLW后未检测到显著变化(图。GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
WT和AOC-RNAi烟草寄主植物的次生代谢产物。实验装置如图所示。GydF4y2Ba1GydF4y2Baa、 菟丝子在WT和AOC RNAi烟草植株上生长。将空的夹笼和夹笼(每个夹笼包含两个CLW幼虫)固定在菟丝子上(每个菟丝子一个夹笼),分别形成对照组和治疗组。48小时后 h、 收集对照组和治疗组的WT和AOC RNAi烟叶,以分析次级代谢产物。不同小写字母表示统计意义(GydF4y2BaNGydF4y2Ba= 5;单因素方差分析与邓肯检验)。误差棒是标准误差GydF4y2Ba
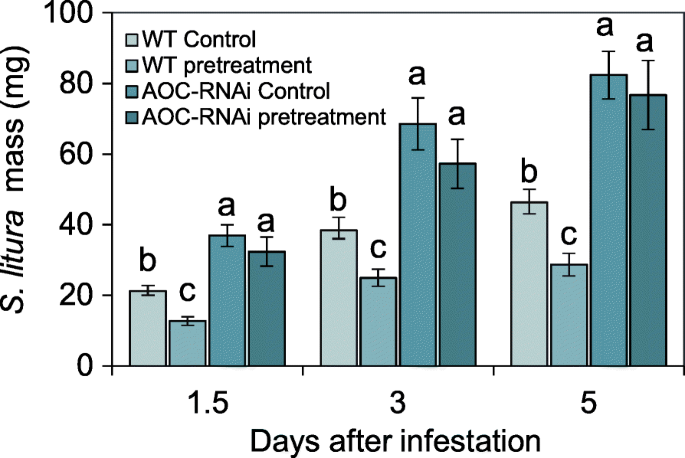
为了研究以菟丝子为食的CLW是否增加了宿主的防御水平,对感染菟丝子的WT和AOC RNAi烟草植物进行了CLW生长试验,这些寄生虫已经用CLW喂养进行了48小时的预处理 我们发现,与对照组喂食烟草的CLW相比,在预处理菟丝子的第1.5天、第3天和第5天,喂食烟草的CLW分别减少了40%、35%和31%(图。GydF4y2Ba4.GydF4y2Ba).相比之下,寄生在AOC-RNAi烟草上的CLWS的质量未被寄生丁氏菌的预处理改变,并且昆虫在AOC-RNAI植物上比WT植物更大(图。GydF4y2Ba4.GydF4y2Ba).我们得出结论,喂养在脱果薄德上的毛毛虫在植物中诱导某些全身信号,以饲养植物,并提高宿主对随后的毛虫攻击,并且需要寄主植物的JA途径来激活防御。GydF4y2Ba
用CLW除草剂预处理菟丝子后,烟草寄主植物对CLW幼虫的抗性。实验装置如图所示。GydF4y2Ba1GydF4y2Ba.菟丝子生长在WT和AOC-RNAi烟草植株上。对寄生于WT烟草的菟丝子进行两种clw处理(预处理)或保持48 h不处理(对照)。48 h后,每根烟株分别投喂一个新的CLW幼虫,分别在第1.5、3和5 d记录幼虫的数量。不同小写字母表示统计显著性(GydF4y2BaNGydF4y2Ba= 15;单因素方差分析与邓肯检验)。误差棒是标准误差GydF4y2Ba
菟丝子对烟草寄主模拟CLW取食的反应GydF4y2Ba
烟草寄主对取食菟丝子的CLW的强烈反应使我们研究了取食烟草寄主的CLW是否也会改变菟丝子的转录组。AOC RNAi烟草植物中的昆虫防御机制受到严重损害,CLW在这些植物上消耗了大量的叶子[GydF4y2Ba24GydF4y2Ba]因此,为了使治疗标准化,在本实验中,我们没有使用真实的CLW喂食来治疗这些植物。相反,烟草植物用连续模拟除草处理:用模式轮伤害WT和AOC RNAi烟草寄主,造成一排伤口,并立即应用CLW OS每2分钟重复一次 另取菟丝子样品2份 h在最后一次模拟除草处理后,用于RNA序列分析(附加文件GydF4y2Ba7.GydF4y2Ba:表S6)。我们发现在WT和AOC-RNAI烟草上生长的淡德寄生虫中只发现了12和7点(附加文件GydF4y2Ba8.GydF4y2Ba:表S7)。这些Deg的数量太小而无法真实;它们最有可能来自RNA-SEQ分析的随机噪声的文物(SEQC MAQC-III Consortium,2014)。因此,德奇德没有响应,或者仅对在转录组水平的宿主植物上模拟的CLW喂养。GydF4y2Ba
为了研究模拟草食处理对寄主烟草和寄主JA途径是否影响菟丝对后续虫害的抗性,WT和AOC-RNAi烟草植株同样采用模拟草食处理(预处理组)或不处理(对照组),48 h后将clw注入寄生于烟草植株的菟丝子植株。与转录组数据一致,我们没有检测到预处理组和对照组clw的质量差异(附加文件)GydF4y2Ba1GydF4y2Ba:图S3)。GydF4y2Ba
讨论GydF4y2Ba
菟丝子是一种形态奇特的寄生植物,既无根也无叶。菟丝子的寄生过程可以看作是一种自然嫁接,菟丝子的木质部和韧皮部分别与寄主植物的木质部和韧皮部融合。菟丝如何适应环境胁迫,以及菟丝和宿主植物在适应胁迫过程中如何通过包括信号分子在内的脉管系统的分子交换相互作用,目前尚不清楚。在本研究中,我们发现以菟丝子为食的CLW不仅激活了菟丝子自身的小范围转录组变化和JA水平的升高,而且还诱导了宿主植物中大量的DEGs和防御代谢物。此外,我们的分析揭示了宿主JA通路对菟丝子对草食性的转录调控有一定的影响,表明在菟丝子对草食性的响应过程中,JA信号在植物间的通讯中发挥了重要作用。GydF4y2Ba
我们发现直接喂食菟丝子会改变菟丝子中162个基因的转录水平(图。GydF4y2Ba1GydF4y2Bab);相比之下,在宿主烟草中发现了超过3000个基因被上调或下调。这与蚜虫以生长在大豆寄主上的菟丝子为食的实验结果是一致的,在菟丝子和大豆中分别有大约170和1000个基因受到差异调节[GydF4y2Ba21GydF4y2Ba].菟丝子很可能能够区分食草动物和两种昆虫食草动物(咀嚼、刺吸),进而产生相应的移动信号。这些信号传递到菟丝的其他部位,也通过吸器-宿主茎连接到达宿主植物的不同部位,在那里它们激活宿主植物中强大的转录组、蛋白质组和代谢重组,增强其对昆虫的防御能力。我们的数据还表明,菟丝来源的系统信号需要宿主JA通路来激活宿主植物的防御,因为对菟丝寄生虫的食草性并没有提高AOC-RNAi宿主的抗性(图)。GydF4y2Ba4.GydF4y2Ba).GydF4y2Ba
CLW食草后,AOC-RNAi植物上的菟丝比WT宿主上的菟丝显示出更少的deg(图)。GydF4y2Ba1GydF4y2BaB,D)和饲养处理还诱导AOC-RNAi和WT宿主植物中不同的转录组变化(图。GydF4y2Ba2GydF4y2Ba)因此,尽管潜在机制尚不清楚,但宿主植物的JA途径影响菟丝子寄生虫对昆虫取食的反应,宿主植物的JA途径可能也对菟丝子衍生的系统信号产生影响(图。GydF4y2Ba4.GydF4y2Ba).我们得出结论,在食草动物取食菟丝子期间,宿主JA途径在菟丝子和宿主之间的通信中起作用。可能来自宿主植物的某些先前未知的JA依赖性移动信号可以转移到菟丝子寄生虫,从而改变菟丝子的防御生理学。支持这一假设,用WT和ms进行接枝实验GydF4y2Baspr-2GydF4y2Ba(一个JA生物合成突变体)番茄植株证明JA通路对产生伤害诱导的移动信号至关重要[GydF4y2Ba10GydF4y2Ba].此外,使用野生烟草GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba,Bozorov等人[GydF4y2Ba27GydF4y2Ba]嫁接了irAOC植物(在JA生物合成基因中沉默GydF4y2Ba联烯氧化物环酶GydF4y2Ba)作为砧木WT接穗;结果表明,用模拟昆虫饲养的iroc砧木在WT接穗中诱导的尼古丁、二萜苷和胰蛋白酶抑制剂的含量低于WT/WT对照接穗。GydF4y2Ba
幼虫或蚜虫取食寄主植物所诱导的系统信号激活菟丝子转录组的微小变化[[GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba21GydF4y2Ba[和本研究],并且一致地,模拟CLW饲喂烟草并没有改变菟丝子对后续CLW攻击的抗性。可以排除宿主产生的系统信号非常微弱的可能性,因为系统信号可以通过菟丝桥并在邻近宿主中触发强大的防御[GydF4y2Ba20.GydF4y2Ba].最近,基因组序列GydF4y2Ba巨朱蕉GydF4y2Ba发现了大量基因的缺失,包括许多对防御昆虫和病原体很重要的基因[GydF4y2Ba28GydF4y2Ba].虽然分析了GydF4y2Bac .定GydF4y2Ba基因组并不关注与防御相关的基因[GydF4y2Ba29GydF4y2Ba]给定之间的密切系统发育关系GydF4y2Ba巨朱蕉GydF4y2Ba和GydF4y2Bac .定GydF4y2Ba[GydF4y2Ba30.GydF4y2Ba,很有可能GydF4y2Bac .定GydF4y2Ba基因组也同样经历了大量防御相关基因的丢失。菟丝子对系统信号的反应不如正常的自养植物,这是合理的,因为这些防御相关基因的缺失。GydF4y2Ba
WT与dna的接枝GydF4y2Baspr-2GydF4y2Ba突变体,缺乏JA,表明JA或JA调控的代谢物是移动信号[GydF4y2Ba10GydF4y2Ba].类似地,在以前的实验中,我们将WT和GydF4y2BaDDE2-2GydF4y2Ba(JA生物合成突变体)拟南芥通过菟丝子桥与烟草结合,发现JA途径对于调节草食诱导的系统信号的产生和/或传递至关重要。然而,JA本身不太可能是移动信号:移动信号的传播速度远远超过JA的累积速度[GydF4y2Ba11GydF4y2Ba,GydF4y2Ba31GydF4y2Ba]此外,这些信号可以诱导系统叶片中MAPK的激活和JA/JA Ile的积累,表明这些信号位于MAPK途径和JA生物合成的上游[GydF4y2Ba11GydF4y2Ba,GydF4y2Ba31GydF4y2Ba,GydF4y2Ba32GydF4y2Ba].在本研究中,我们发现以菟丝为食的CLW导致WT和AOC-RNAi烟草转录组之间存在很大差异(图。GydF4y2Ba2GydF4y2Ba),表明JA途径位于毛毛虫进料引起的全身信号的下游,对系统信号的适当响应非常重要。因此,似乎JA途径在系统信号传导中起着双重作用。据推测,基础JA信号传导活性(在正常条件下)需要维持全身信号的水平/积累,并且在伤口/毛毛虫喂食时,信号是不知何时从局部组织迅速释放,并易于植物的其他部分,它们激活了JA依赖和依赖性的反应。GydF4y2Ba
结论GydF4y2Ba
此前研究发现,蚜虫以菟丝为食也增强了寄主植物的防御能力[GydF4y2Ba21GydF4y2Ba].此外,当不同的宿主植物同时被同一种菟丝连接时,来自一个宿主的毛毛虫取食诱导的系统信号也激活了其他宿主的防御[GydF4y2Ba20.GydF4y2Ba]在这项研究中,我们发现,遭受毛虫取食的菟丝子向寄主植物发送某些系统信号,这些信号能够诱导寄主的转录组调节和防御,使寄主能够更好地免受后续昆虫取食。重要的是,在这一过程中,寄主JA途径起着至关重要的作用虽然菟丝子寄生对寄主植物的生长和发育有强烈的负面影响,但我们的数据进一步强调,菟丝子寄生为寄主提供了一定的生态效益,尽管可能很微妙。GydF4y2Ba
方法GydF4y2Ba
植物材料和昆虫的饲养GydF4y2Ba
所有植物的实验研究都符合国家和机构的指导方针。所有的植物都是在中国科学院昆明植物研究所的温室中种植的。昼夜长度为~ 16 h/8 h,温度维持在~ 25°C(白天)和~ 18°C(夜间)。菟丝子(GydF4y2Ba五角定GydF4y2Ba)种子最初购自昆明某中药店,由云南农业大学郭凤根教授进行物种鉴定。代金券标本GydF4y2Bac .定GydF4y2Ba可在中国科学院昆明植物研究所植物标本室访问(登录号1347916)。获取和使用菟丝子种子无需许可。GydF4y2Ba
烟草种子(GydF4y2Ba烟草GydF4y2BaSamsun是德国马克斯·普朗克化学生态研究所Ian T.Baldwin博士赠送的野生型(WT)和自制的名为AOC RNAi的转基因品系,其中GydF4y2Ba联烯氧化物环酶GydF4y2Ba(GydF4y2Ba重获GydF4y2Ba)基因被RNA干扰(RNAi)沉默(Lu等人,2018),被用作菟丝子的宿主。烟草基因组由两部分组成GydF4y2Ba重获GydF4y2Ba基因,而八GydF4y2Ba重获GydF4y2Ba基因存在于GydF4y2Bac .定GydF4y2Ba登录号见附加文件GydF4y2Ba9.GydF4y2Ba:表S8)。定量实时荧光定量pcr (qRT-PCR)分析表明,该RNAi构建物适用于烟草GydF4y2Ba重获GydF4y2Ba沉默不诱导菟丝子的株间RNAi沉默GydF4y2Ba重获GydF4y2Ba基因,可能是由于基因的同源性差GydF4y2Ba重获GydF4y2Ba烟草和菟丝子之间的基因(附加文件GydF4y2Ba1GydF4y2Ba:图S4)。WT和AOC-RNAi烟草种子在含有Gamborg的B-5基盐混合物(Sigma)的琼脂平板上发芽,然后将幼苗转移到1 L的塑料罐中,其中含有0.9 L的土壤(pinstrup Blond Gold,GydF4y2Bahttp://www.pindstrup.comGydF4y2Ba).菟丝子种子萌发(GydF4y2Ba五角定GydF4y2Ba)跟随李等人[GydF4y2Ba33GydF4y2Ba],然后用5日龄的菟丝幼苗侵染大豆植株(GydF4y2Ba大豆GydF4y2Ba品种华春6号,从当地种子店购买)以形成菟丝子砧木。从生长旺盛的菟丝子砧木上新鲜切下的年轻葡萄藤,约10株 厘米长,用于侵染四周龄烟草植株的茎(一个菟丝子代表一个寄主植株),并进一步允许其生长四周。GydF4y2Ba
棉叶虫的鸡蛋(GydF4y2Baspodoptera lituraGydF4y2Ba, CLW)均购自北京通用电气公司(GydF4y2Bahttps://shop101732681.taobao.comGydF4y2Ba)卵被保存在生长室中(16 26时的光速 摄氏度和8度 22岁时天黑 °C)直到幼虫孵化。CLW新生儿在拟南芥上饲养5天 在他们被用于进一步的实验前几天(CLW),如果他们不是第一次在拟南芥上饲养5年,新生儿在烟草上的死亡率很高 天)。GydF4y2Ba
菟丝子的CLW草食和模拟CLW草食处理GydF4y2Ba
为了评估CLW除草对菟丝子的影响,如上所述培养了菟丝子WT烟草和菟丝子AOC RNAi烟草系统。对于每个菟丝子-寄主相互作用系统,将一个包含两个CLW的夹笼连接到菟丝子植物上。每个夹笼包含10根菟丝子茎,并连接大约3根 离烟草茎厘米;作为对照,空夹笼类似地连接在菟丝子上,但没有昆虫的食草行为(如图所示)。GydF4y2Ba1GydF4y2Baa) 。GydF4y2Ba
为了模拟菟丝子上的CLW食草性,用手术刀从每一宿主植物上切下5根茎,留下5厘米长的茎段附着在宿主上。立即将5 μL的OS移液管移入寄主枝条的新鲜创面,再在离体枝条创面上同样注入5 μL OS。菟丝子茎保留在寄主上,离寄主5 cm处的菟丝子茎在处理1 h后采摘。未处理的菟丝茎段与模拟草食处理的相同位置也在同一时间收获,作为对照。GydF4y2Ba
模拟CLW对烟草的除草处理GydF4y2Ba
菟丝子- wt烟草和菟丝子- aoc - rnai烟草体系的培养方法如下。在烟草植物的模拟CLW食草性治疗,第四茎叶从底部的烟草被滚动模式轮三次受伤两边的midvein方向平行于midvein,生成和每一行的伤口每2 h之前受伤的叶子;术后立即将20 μL CLW口腔分泌物轻轻涂抹于新鲜创面,每行20 μL。GydF4y2Ba
为了收集CLW OS,将CLW幼虫饲养在烟草上,用移液管收集OS并储存在冰上。将操作系统轻轻混合,并立即等分成小体积,然后储存在冰箱中− 80 摄氏度。GydF4y2Ba
CLW生长试验GydF4y2Ba
利用菟丝子寄生的WT和AOC-RNAi烟草植株(各30株)研究菟丝子寄生的CLW是否改变烟草宿主对随后的CLW攻击的抗性。这些植物被均匀地分成两组,对照组和预处理组。两组菟丝子均在每个菟丝子上放置一个空的夹笼(夹笼内约10个菟丝子茎,距离烟草茎约3cm),预处理组每个夹笼内释放2个CLW幼虫。饲喂48 h后,在每个寄主上放置一个新的夹笼,分别记录1.5、3和5 d的幼虫数量。GydF4y2Ba
将60株寄生菟丝的WT和60株AOC-RNAi烟草植株平均分为两组,以确定CLW是否改变菟丝抗性。对两组烟草植株进行伤害模拟CLW食草性处理(如上所述)或不处理,最后一次模拟食草性处理后48 h,将CLW幼虫封闭在夹笼中,对每一株菟丝植株进行寄生。48 h后记录幼虫团数。GydF4y2Ba
总RNA提取,RNA-seq分析,qRT-PCRGydF4y2Ba
每组标本取3个生物重复。用TriZol试剂(Invitrogen公司)提取总RNA。总RNA的浓度用NanoDrop分光光度计(Thermo Scientific)测定,总RNA的完整性用凝胶电泳检测。根据制造商的协议,使用Illumina试剂盒构建烟草叶和菟丝子茎cDNA文库,并在Illumina HiSeq2000平台上进行测序(配对端测序;长度150个基点)。对原始读数进行过滤,以去除含有超过10%的未知碱基(N)的低质量读数。对菟丝和烟草的过滤读数进行对齐GydF4y2Ba五角南极光GydF4y2Ba[GydF4y2Ba28GydF4y2Ba]及GydF4y2Ba烟草GydF4y2Ba(简历。TN90) [GydF4y2Ba34GydF4y2Ba]使用HISAT2独立完成基因组[GydF4y2Ba35GydF4y2Ba](v2.0.5),参数为“-mp 3,1”,实现了94%(菟丝子)和81.3%(烟草)的映射读取平均比率。使用StringTie计算转录物丰度[GydF4y2Ba36GydF4y2Ba) (v1.3.0)。使用Bioconductor DEseq软件包根据总作图计数推断差异基因表达[GydF4y2Ba37GydF4y2Ba,考虑到不同生物实验之间的批效应。差异转录的赋值依赖于概率(p)值和Benjamini-Hochberg错误发现率,前者对应差异基因转录检测,后者用于确定阈值GydF4y2BaP.GydF4y2Ba-应用的阈值为FDR(错误发现率) ≤ 0.05和对数的绝对值GydF4y2Ba2GydF4y2Ba(治疗/控制)≥1。利用基因本体论(GO)对表达基因进行功能分类[GydF4y2Ba38GydF4y2Ba,GydF4y2Ba39GydF4y2Ba].用TopGo分析由DEGs富集的GO术语[GydF4y2Ba40GydF4y2Ba].对于每个差异表达的基因,提供基因ID和GO次数的列表。经典p值<0.01被认为是显着富集的。所有原始RNA-SEQ数据都可以在项目ID PRJNA486679下的NCBI SRA数据库中找到。GydF4y2Ba
每组标本5个生物学重复进行qRT-PCR分析。使用oligo (dT)和Superscript II逆转录酶(ThermoFisher Scientific)将总RNA样本(0.5 μg)反转录为cDNA。qRT-PCR采用CFX Connect实时系统(Bio-Rad),使用iTaqTM Universal SYBR Geen Supermix Kit (Bio-Rad)。对于每个分析,使用特定的cDNA标准品进行一系列稀释,构建线性标准曲线和阈值周期数与log(指定转录水平)曲线;根据标准曲线测定所有未知样本的转录水平。引物序列在附加文件中给出GydF4y2Ba9.GydF4y2Ba:表S8。GydF4y2Ba
次级代谢物的定量GydF4y2Ba
采集烟草组织并在液氮中研磨成细粉末。每个样品约200个 将mg的组织转移到新鲜的1.5%溶液中 mL微导管和1 加入mL提取液(40%甲醇,含0.1%乙酸(v/v)),在旋转10分钟后 分钟后,在4℃下离心混合物 摄氏度和16000度 GydF4y2BaGGydF4y2Ba二十 上清液的最小值(400 μL)转移到新鲜试管中,并在4℃再次离心 摄氏度和16000度 GydF4y2BaGGydF4y2Ba15分钟。采用高效液相色谱-串联质谱(HPLC-MS/MS;岛津LCMS8040系统)遵循以前发布的方法[GydF4y2Ba41GydF4y2Ba].定量烟草叶片中胰蛋白酶蛋白酶抑制剂(TPI)活性的方法,由Van Dam等人描述[GydF4y2Ba42GydF4y2Ba使用了)。GydF4y2Ba
农协的量化GydF4y2Ba
为了测定茉莉酸的含量,在液氮中研磨约100 mg新鲜菟丝茎,在1 mL乙酸乙酯中加入内标(100 ng DGydF4y2Ba6.GydF4y2Ba-ja)被添加到每个样品中。在10分钟的涡旋步骤后,在4℃下以13,000g离心15分钟后,将上清液在30℃下在真空浓缩器(EPPendorf)中蒸发至干。将样品重悬于600μL70%甲醇(v / v)中,并在4℃下再次以13,000g离心15分钟以除去颗粒。在HPLC-MS / MS(Shimadzu LCMS8040系统)上分析上清液,按照预先发布的方法[GydF4y2Ba32GydF4y2Ba].GydF4y2Ba
数据和材料的可用性GydF4y2Ba
支持本文结果的数据集包含在本文及其附加文件中。RNA-seq数据可在NCBI SRA数据库中获得,项目ID为PRJNA486679。GydF4y2Ba
缩写GydF4y2Ba
- AOC:GydF4y2Ba
-
丙二烯氧化物环化酶GydF4y2Ba
- DEGs:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- 流式细胞仪:GydF4y2Ba
-
脂肪酸与氨基酸结合GydF4y2Ba
- 罗斯福:GydF4y2Ba
-
错误发现率GydF4y2Ba
- 绿色荧光蛋白:GydF4y2Ba
-
绿色荧光蛋白GydF4y2Ba
- 是:GydF4y2Ba
-
Jasmonate酸GydF4y2Ba
- MAPK:GydF4y2Ba
-
丝裂原活化蛋白激酶GydF4y2Ba
- 操作系统:GydF4y2Ba
-
口腔分泌物GydF4y2Ba
- π:GydF4y2Ba
-
蛋白酶抑制剂我GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
实时定量PCRGydF4y2Ba
- RNAi:GydF4y2Ba
-
RNA干扰GydF4y2Ba
- TPI:GydF4y2Ba
-
胰蛋白酶蛋白酶抑制剂GydF4y2Ba
- WT:GydF4y2Ba
-
野生型GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
Wu J, Baldwin IT。植物中草食诱导的信号:感知和作用。植物学报。2009;32(9):1161-74。GydF4y2Ba
- 2.GydF4y2Ba
Howe GA,Jander G.植物对昆虫食草动物的免疫力.植物生物学年鉴2008;59:41–66。GydF4y2Ba
- 3.GydF4y2Ba
Bonaventure G, Vandoorn A, Baldwin IT。草食相关诱导子:FAC信号传导和代谢。植物科学进展。2011;16(6):294-9。GydF4y2Ba
- 4.GydF4y2Ba
Will T, Furch AC, Zimmermann,《韧皮部进食昆虫如何面对韧皮部定位防御的挑战》。植物科学学报2013;4:336。GydF4y2Ba
- 5.GydF4y2Ba
Wu J, Baldwin IT。植物对昆虫食草动物攻击反应的新见解。《Annu Rev Genet》2010;44:1-24。GydF4y2Ba
- 6.GydF4y2Ba
Zebelo SA, Maffei ME。早期信号事件在植物-昆虫相互作用中的作用。中国生物医学工程学报。2015;66(2):435-48。GydF4y2Ba
- 7.GydF4y2Ba
这是Paschold A, Halitschke R, BaldwinCo(i)协调防御:NaCOI1介导草食动物诱导的抗性GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba并揭示了食草动物运动在避免防御中的作用。植物杂志2007;51:79-91。GydF4y2Ba
- 8.GydF4y2Ba
Schweizer F、Fernandez Calvo P、Zander M、Diez Diaz M、Fonseca S、Glauser G、Lewsey MG、Ecker JR、Solano R、Reymond P.拟南芥基本螺旋-环-螺旋转录因子MYC2、MYC3和MYC4调节硫代葡萄糖苷生物合成、昆虫表现和摄食行为。植物细胞。2013;25(8):3117-32。GydF4y2Ba
- 9.GydF4y2Ba
Green TR,Ryan CA.《植物叶片中伤口诱导的蛋白酶抑制剂——可能的昆虫防御机制》《科学》1972;175(4023):776-7。GydF4y2Ba
- 10.GydF4y2Ba
李丽丽,李志强,李志强。茉莉酸盐的合成及其在番茄全身创伤反应中的作用。中国科学(d辑:地球科学)2002;99(9):6416-21。GydF4y2Ba
- 11.GydF4y2Ba
Koo Aj,Gao X,Jones Ad,Howe Ga。快速伤口信号激活拟南芥中生物活性茉鲸的全身合成。工厂J. 2009; 59(6):974-86。GydF4y2Ba
- 12.GydF4y2Ba
穆萨维公司、乔文公司、帕斯卡公司、凯伦伯格公司、法默公司。GydF4y2Ba谷氨酸受体样GydF4y2Ba基因介导叶到叶的伤口信号。大自然。2013;500(7463):422 - 6。GydF4y2Ba
- 13.GydF4y2Ba
植物NADPH氧化酶RBOHD介导了植物对不同刺激的快速系统信号传导。Sci信号。2009;2 (84):ra45。GydF4y2Ba
- 14GydF4y2Ba
《植物寄生性的进化》,植物科学趋势杂志,2010;15(4):227-35。GydF4y2Ba
- 15GydF4y2Ba
《寄主植物对寄生杂草的抗性;最新进展和瓶颈》,Curr Opin plant Biol.2010;13(4):478-84。GydF4y2Ba
- 16GydF4y2Ba
基于系统发育学的寄生植物属亚属分类GydF4y2Ba菟丝子GydF4y2Ba(旋花科植物菟丝子)。系统机器人。2015;40(1):269 - 85。GydF4y2Ba
- 17GydF4y2Ba
Kim G,Leblanc ML,WAFULA EK,CW DP,Westwood JH。寄生植物及其宿主之间mRNA的基因组级交换。科学。2014; 345(6198):808-11。GydF4y2Ba
- 18GydF4y2Ba
沙hid S, Kim G, Johnson NR, Wafula E, Wang F, Coruh C, Bernal-Galeano V, Phifer T, CW dP, Westwood JH,等。来自寄生植物的micrornaGydF4y2Ba五角定GydF4y2Ba《自然》杂志,2018;553(7686):82-5。GydF4y2Ba
- 19.GydF4y2Ba
Haupt S,Oparka KJ,Sauer N,Neumann S.均多贩运GydF4y2Ba烟草GydF4y2Ba和全寄生物GydF4y2Ba五角reflexaGydF4y2Ba.中国农业科学。2001;52(354):173-7。GydF4y2Ba
- 20GydF4y2Ba
赫滕豪森C,李杰,庄H,孙H,徐Y,齐J,张J,雷Y,秦Y,孙G,等.茎寄生植物GydF4y2Ba五角南极光GydF4y2Ba菟丝子在植物间传递食草诱导的信号。中国科学(d辑:地球科学)2017;GydF4y2Ba
- 21.GydF4y2Ba
庄H,李J,宋J,赫滕豪森C,舒曼MC,孙G,张C,李J,宋D,吴J.蚜虫(GydF4y2BaMyzus persicaeGydF4y2Ba)以寄生植物菟丝子为食(GydF4y2Ba五角南极光GydF4y2Ba)激活寄生虫和大豆寄主的防御反应。新植醇。2018;218(4):1586 - 96。GydF4y2Ba
- 22.GydF4y2Ba
蚜虫,菟丝子(GydF4y2Ba五角定GydF4y2Ba),以及菟丝子与宿主植物的相互关系。林志刚,王志刚,王志刚。GydF4y2Ba
- 23.GydF4y2Ba
Costea M, Tardif FJ。加拿大杂草生物学133.GydF4y2Ba五角定GydF4y2Ba云克,GydF4y2Bac . gronoviiGydF4y2BaWilld。Schult交货。GydF4y2Bac . umbrosaGydF4y2Ba贝尔,前胡克。,GydF4y2Ba上皮细胞GydF4y2Ba(L.)L.及GydF4y2Bac . epilinumGydF4y2Ba渭河.罐头工业学报.2006;86(1):293-316。GydF4y2Ba
- 24.GydF4y2Ba
陆C,齐J,赫滕豪森C,雷Y,张J,张M,张C,宋J,李J,曹G,等GydF4y2Ba2GydF4y2Ba通过茉莉酸信号通路差异影响烟草和水稻对鳞翅目昆虫幼虫的防御。J Integr Plant Biol.2018;60(5):412-31。GydF4y2Ba
- 25.GydF4y2Ba
JB,麦舍尔,费尔顿GW,德莫拉伊斯CM。寄生的GydF4y2Ba五角pentagonaGydF4y2Ba进而诱导番茄的JA和SA防御途径。植物学报。2010;33(2):290-303。GydF4y2Ba
- 26GydF4y2Ba
Jassbi AR, Gase K, Hettenhausen C, Schmidt A, Baldwin IT。沉默香叶酰香叶酰二磷酸合酶GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba显著削弱对烟草角虫的抗性。植物生理学。2008;146(3):974-86。GydF4y2Ba
- 27GydF4y2Ba
Bozorov TA,Dinh ST,Baldwin IT.JA而非JA Ile是一种细胞非自主信号,可激活JA介导的动物对草食的系统性防御GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba.J Intent Plant Biol。2017; 59(8):552-71。GydF4y2Ba
- 28GydF4y2Ba
孙刚,徐勇,刘华,孙涛,张军,Hettenhausen C C,沈刚,齐军,秦勇,李军,等。寄生植物基因组进化的基础是大规模的基因丢失GydF4y2Ba五角南极光GydF4y2Ba.Nat Commun。2018;9(1):2683。GydF4y2Ba
- 29GydF4y2Ba
Vogel A, Schwacke R, Denton AK, Usadel B, Hollmann J, Fischer K, Bolger A, Schmidt MH, Bolger ME, Gundlach H, et al.;寄生开花植物基因组中的寄生足迹GydF4y2Ba五角定GydF4y2Ba.Nat Commun。2018;9(1):2515。GydF4y2Ba
- 30GydF4y2Ba
Stefanovic S,Kuzmina M,Costea M.内主要谱系的划分GydF4y2Ba菟丝子GydF4y2Ba亚属GydF4y2Ba格拉米GydF4y2Ba(旋花科)利用质体和核DNA序列。acta botanica sinica(云南植物学报);2007;40(4):568-89。GydF4y2Ba
- 31GydF4y2Ba
Hettenhausen C,Heinrich M,Baldwin IT,Wu J.脂肪酸-氨基酸缀合物对于水杨酸诱导的蛋白激酶的系统激活和茉莉酸在细胞中的积累是必不可少的GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba.植物学报。2014;14(1):326。GydF4y2Ba
- 32GydF4y2Ba
Wu J, Hettenhausen C, Meldau S, Baldwin IT。草食动物在受攻击和未受攻击的叶片区域迅速激活MAPK信号,但在叶片之间不激活GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba. 植物细胞。2007;19(3):1096–122.GydF4y2Ba
- 33.GydF4y2Ba
李军,Hettenhausen C,孙刚,庄辉,李建华,吴杰。寄生植物GydF4y2Ba五角南极光GydF4y2Ba对脱落酸诱导的下胚轴伸长和种子萌发抑制高度不敏感。PLoS One.2015;10(8):e0135197。GydF4y2Ba
- 34.GydF4y2Ba
Sierro N,Battey Jn,Ouadi S,Bakaher N,Bovet L,Willig A,Goepfert S,Peitsch MC,Ivanov NV。烟草基因组序列及其与番茄和马铃薯的比较。NAT Communce。2014; 5:3833。GydF4y2Ba
- 35.GydF4y2Ba
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12 (4):357 - 60。GydF4y2Ba
- 36.GydF4y2Ba
Pertea M, Pertea GM, Antonescu CM, Chang TC, Mendell JT, Salzberg SL. StringTie能够从RNA-seq读取改进的转录组重建。生物科技Nat》。2015;33(3):290 - 5。GydF4y2Ba
- 37.GydF4y2Ba
Anders,Huber W.序列计数数据的差异表达分析。基因组生物学。2010;11(10):R106。GydF4y2Ba
- 38GydF4y2Ba
基因本体论C.基因本体论知识库和资源的扩展。核酸Res. 2017。45 (D1): D331-D338。GydF4y2Ba
- 39GydF4y2Ba
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT,等。基因本体论:生物学统一的工具。基因本体论联盟。Nat麝猫。2000;得分上以25 - 9胜过25(1):。GydF4y2Ba
- 40.GydF4y2Ba
Alexa A,Rahnenfuhrer J,Lengauer T.通过解相关GO图结构改进基因表达数据中功能组的评分.生物信息学.2006;22(13):1600-7。GydF4y2Ba
- 41GydF4y2Ba
Heiling S, Schuman MC, Schoettner M, Mukerjee P, Berger B, Schneider B, Jassbi AR, Baldwin IT。茉莉酸和ppHsystemin调控17-羟基香叶醇二萜苷生物合成中的关键丙二酰化步骤,这是一种丰富和有效的直接防御植物性动物GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba.植物细胞。2010;22(1):273 - 92。GydF4y2Ba
- 42GydF4y2Ba
van Dam NM, Horn M, mare M, Baldwin IT。个体发生抑制全身蛋白酶抑制剂反应GydF4y2Ba尼古利亚娜attenuata.GydF4y2Ba.化学学报。2001;27(3):547-68。GydF4y2Ba
致谢GydF4y2Ba
感谢陆成凯博士(中国科学院昆明植物研究所)创造了AOC-RNAi转基因植物。我们也感谢中国科学院昆明植物研究所生物技术实验中心对植物培育的支持。GydF4y2Ba
资金GydF4y2Ba
这项工作得到了国家自然科学基金(U150 2263,31600213, 31800227)和中国科学院国际合作伙伴计划(151853KYSB201700)的支持。所有资助者都支持本研究的设计、数据收集、分析、解释和手稿撰写。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
YQ、JZ和CH种植植物,进行昆虫植食和模拟植食处理。HL、YQ、JZ进行RNA-seq分析。SL和GS分析了JA及其次生代谢产物。YQ、JZ和GC进行了昆虫生长试验和菟丝子生长试验。JW设计并监督项目管理。JW, QY和JZ撰写了手稿。所有作者都对项目构想和数据分析做出了贡献。所有作者都已阅读并批准了手稿的最终版本。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者声明他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商说明GydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
WT和AOC RNAi烟草植株中的JA含量。WT和AOC RNAi烟草感染菟丝子。通过沿中脉(每侧3卷)滚动模式轮6次来损伤烟草叶片。对照组未进行任何处理。这些烟草叶片和茎在1小时内收集 用于JA定量。星号表示对照组和治疗组之间的显著差异,由Student's确定GydF4y2BaT.GydF4y2Ba-试验(GydF4y2BaNGydF4y2Ba= 5;* *,GydF4y2BaP.GydF4y2Ba < 0.01; ***,P.GydF4y2Ba< 0.001)。误差棒是标准误差。GydF4y2Ba图S2GydF4y2Ba: WT和AOC-RNAi烟草植株上菟丝子的长度和鲜干质量。用菟丝子侵染野生型和AOC-RNAi烟草植株。染病4周后,采收菟丝子,测量菟丝子茎长(A)及其鲜干质量(B和C) (GydF4y2BaNGydF4y2Ba= 12;学生的GydF4y2BaT.GydF4y2Ba-误差条为标准误差。未发现统计差异。GydF4y2Ba图S3GydF4y2Ba:前处理组与对照组菟丝子CLWs的质量差异。菟丝子生长在30 WT和30 AOC-RNAi烟草植株上。预处理组将WT和AOC-RNAi烟草植株15株用图案轮伤成6排创面,每排创面间隔2 h,每次创面处理后立即对创面施CLW OS。15株未处理的WT和AOC-RNAi烟草作为对照。末次处理48 h后,将含有1个CLW的夹笼固定在菟丝子上(每个夹笼对应1个菟丝子),48 h后记录虫量。各组间无统计学差异(GydF4y2BaNGydF4y2Ba = 15、 误差条为标准误差。GydF4y2Ba图S4GydF4y2Ba:相对GydF4y2Ba重获GydF4y2Ba菟丝子的表达水平。菟丝子生长在WT和AOC-RNAi烟草植株上。采集菟丝子茎,测定其相对表达量GydF4y2Ba重获GydF4y2Ba基因检测采用qRT-PCR分析。无统计学意义(n = 5、 单因素方差分析(Duncan检验)。误差条是标准误差。GydF4y2Ba
附加文件2:表S1。GydF4y2Ba
用CLW除草处理菟丝子后,菟丝子在WT或AOC RNAi烟草上的转录组学变化。GydF4y2Ba
附加文件3:表S2。GydF4y2Ba
clw处理和对照菟丝子在野生型和AOC-RNAi烟草植株上生长的DEGs及其GOs。GydF4y2Ba
附加文件4:表S3。GydF4y2Ba
在正常条件下,WT和AOC RNAi烟草植株上生长的菟丝子之间的DEG及其GOs。GydF4y2Ba
附加文件5:表S4。GydF4y2Ba
CLW处理菟丝后WT和AOC-RNAi烟草转录组的变化。GydF4y2Ba
附加文件6:表S5。GydF4y2Ba
在菟丝子上CLW取食后,WT和AOC RNAi烟草植株的DEG及其GOs。GydF4y2Ba
附加文件7:表S6。GydF4y2Ba
模拟CLW草食烟草处理WT和AOC-RNAi烟草后菟丝的转录组变化。GydF4y2Ba
附加文件8:表S7。GydF4y2Ba
用模拟的CLW草食植物处理野生型和AOC-RNAi烟草植株后菟丝子的DEGs。GydF4y2Ba
附加文件9:表S8。GydF4y2Ba
用于qRT-PCR的引物。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),允许在任何媒体中不受限制地使用、分发和复制,前提是您对原始作者和来源给予适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域专用豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条中提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
秦勇,张杰,赫滕豪森,C。GydF4y2Baet al。GydF4y2Ba在毛虫取食菟丝子的情况下,宿主茉莉酸途径调节菟丝子和宿主植物的转录组学变化。GydF4y2Ba植物生物学GydF4y2Ba19,GydF4y2Ba540(2019)。https://doi.org/10.1186/s12870-019-2161-8GydF4y2Ba
收到GydF4y2Ba:GydF4y2Ba
接受GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-2161-8GydF4y2Ba
关键字GydF4y2Ba
- 毛毛虫GydF4y2Ba
- 菟丝子GydF4y2Ba
- 防守GydF4y2Ba
- 菟丝子GydF4y2Ba
- 昆虫取食GydF4y2Ba
- 茉莉酸GydF4y2Ba
- 系统的信号GydF4y2Ba
- 烟草GydF4y2Ba
- 转录组GydF4y2Ba