- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
基于高密度SLAF-seq遗传图谱的花生种子重量和大小QTL鉴定(gydF4y2Ba花生gydF4y2BaL.)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba文章编号:gydF4y2Ba537gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
栽培花生是全球增长的一个重要的石油和经济作物。为了满足花生生产的不断增长的需求,每年,基因研究,提高选择效率是必不可少的,包括连锁图谱,全基因组关联分析,膨体分离分析和分子标记辅助选择。扩增片段测序(SLAF-SEQ)特定基因座是用于高密度遗传图谱(HDGM)构造和数量性状基因座(QTL)作图的有力工具。在这项研究中,一个HDGM使用SLAF-SEQ导致鉴定QTL的用于花生种子重量和尺寸构造。gydF4y2Ba
结果gydF4y2Ba
的重组近交系(RIL)群体是从品种“Huayu36”,并与对比种子重量,尺寸和形状的种质线“6-13”之间的交叉前进。Based on the cultivated peanut genome, a HDGM was constructed with 3866 loci consisting of SLAF-seq and simple sequence repeat (SSR) markers distributed on 20 linkage groups (LGs) covering a total map distance of 1266.87 cM. Phenotypic data of four seed related traits were obtained in four environments, which mostly displayed normal distribution with varied levels of correlation. A total of 27 QTLs for 100 seed weight (100SW), seed length (SL), seed width (SW) and length to width ratio (L/W) were identified on 8 chromosomes, with LOD values of 3.16–31.55 and explaining phenotypic variance (PVE) from 0.74 to 83.23%. Two stable QTL regions were identified on chromosomes 2 and 16, and gene content within these regions provided valuable information for further functional analysis of yield component traits.
结论gydF4y2Ba
这项研究是基于使用SLAF-SEQ和SSRS耕地花生基因组中的新HDGM。四个种子相关性状的QTL作图显示在染色体2和16,这不仅有利于精细定位和克隆这些基因,也为与改良的种子重量和尺寸的新花生品种的分子育种提供了机会,两个稳定的QTL区域。gydF4y2Ba
背景gydF4y2Ba
花生(gydF4y2Ba花生gydF4y2Ba(L.)是食用油和蛋白质的重要来源,在100多个国家广泛种植。近年来,全球花生年产量增长迅速,从2007年(3751万吨)到2017年(4710万吨)增产10万吨(gydF4y2Bahttp://faostat.fao.org/gydF4y2Ba),与食物需求的不断增长相平行[gydF4y2Ba1gydF4y2Ba].通过分子育种改善花生产量和优化的现场管理是可持续农业的目标。从遗传学的角度来看,花生产量受到许多农艺性状的影响,例如主干(HMS)的高度,总分支次数(TBN)和豆荚和种子/核特征[gydF4y2Ba2gydF4y2Ba].其中,100粒重(100 SW)、100荚重和脱壳率是籽粒产量的重要组成部分[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].100 SW主要由种子大小决定,该种子大小可以通过种子长度(SL)和种子宽度(SW)测量[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].尽管它们对产量的贡献,SL,SW和宽度比(L / W)的长度是在驯化和繁殖期间进行选择的视觉特征[gydF4y2Ba2gydF4y2Ba].特别是用L/W估计的花生种子的形状(椭圆形或圆形)是决定花生品种在食品加工厂应用的关键因素。在中国,圆形花生被用于制作糖果,而椭圆形花生被用于制作油炸产品。种子相关性状的QTL/基因的鉴定将促进我们对调节产量构成和种子形态的生物学途径的认识。gydF4y2Ba
到目前为止,已经有各种各样的遗传策略来定义与种子性状相关的qtl或基因,包括连锁作图[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],全基因组关联分析[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba]和大量分离分析[gydF4y2Ba7gydF4y2Ba].高密度的遗传图谱(HDGMs)提供的遗传标记连锁的必要信息,并促进QTL发现[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].在过去的十年中,已经基于花生的SSR标记开发了许多遗传图。随着时间的推移,基于SSR的地图具有增加的标记密度和地图覆盖率[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].然而,利用SSR标记进行基因分型是劳动密集型和低通量的。等位SNP标记具有花生基因组发生频率高的优势[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].结合下一代测序(NGS),许多基于SNP的基因分型技术,特别是SLAF-SEQ,已应用于几种物种的HDGM施工和QTL分析,例如芝麻[gydF4y2Ba17gydF4y2Ba],大豆[gydF4y2Ba18gydF4y2Ba),黄瓜gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba)、棉花(gydF4y2Ba21gydF4y2Ba]花生呢[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].本研究基于SNP和SSR标记构建了栽培花生的HDGM。gydF4y2Ba
与水稻种子性状综合研究的比较[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba“油菜籽”[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba在花生中,控制种子重量和大小的生物学途径尚不清楚。截至目前,100粒重、100粒长、100粒宽、100粒长宽比的QTL定位仍在进行中。利用大块分离分析(BSA), Gomez Selvaraj等人[gydF4y2Ba7gydF4y2Ba报道紧密相连的SL和100SW QTL区域中有五个SSR标记。Fonceka等。[gydF4y2Ba28gydF4y2Ba[关键词]花生,荚果大小,种子大小,qtl定位潘迪等人[gydF4y2Ba5gydF4y2Ba]对300个花生基因型进行全基因组关联分析,鉴定出9个与SL相关的位点,3个与SW相关的位点,5个与100SW相关的位点。使用FgydF4y2Ba2gydF4y2Ba黄等人[gydF4y2Ba29gydF4y2Ba]成功映射了SL,SW和100SW的QTL,从1.69到17.88%解释表型方差(PVE)。陈等。[gydF4y2Ba4gydF4y2Ba利用两个FgydF4y2Ba2:3gydF4y2Ba群体和检测到SL和7的10 QTL,PVE分别为20.80和14.43%。陈在al [gydF4y2Ba2gydF4y2Ba].对一个RIL群体进行QTL定位和荟萃分析,共报道了83个与荚果和种子相关性状的QTL。Wang等[gydF4y2Ba8gydF4y2Ba[]从RIL群体中构建了基于slaf的HDGM,发现了豆荚和种子相关性状的两个稳定QTL区域。在两个RIL群体中报道了染色体A05和A07的种子大小QTL [gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
由于花生二倍体祖细胞之间的序列相似性(gydF4y2Ba答:duranensisgydF4y2BaAA;gydF4y2Ba答:ipaensisgydF4y2Ba,Bb)和培养的四倍体花生(AABB),两种花生祖细胞的基因组序列在提供遗传标记的物理位置的信息位置gydF4y2Ba12gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]然而,在新发布的栽培花生基因组组件中发现同源重组[gydF4y2Ba34gydF4y2Ba提示二倍体基因组可能发生QTL定位错误。因此,本文基于栽培花生基因组对QTL区域的物理位置进行了报道[gydF4y2Ba34gydF4y2Ba].为了进一步研究花生籽粒相关性状的基因组区域,我们构建了一个重组自交系(RIL)群体进行QTL定位。以大种子品种“花育36”和小种子品系“6-13”为亲本,通过种子重量、种子大小和形状等表型性状的对比分析,确定了亲本基因型。通过SLAF-seq和SSR分析,为HDGM的构建提供足够的标记。通过对4个环境中4个种子相关性状的QTL定位,发现2号染色体和16号染色体上存在2个稳定的QTL区域,这可能有助于花生种子性状的改良。gydF4y2Ba
结果gydF4y2Ba
父母和残留个体的表型。gydF4y2Ba
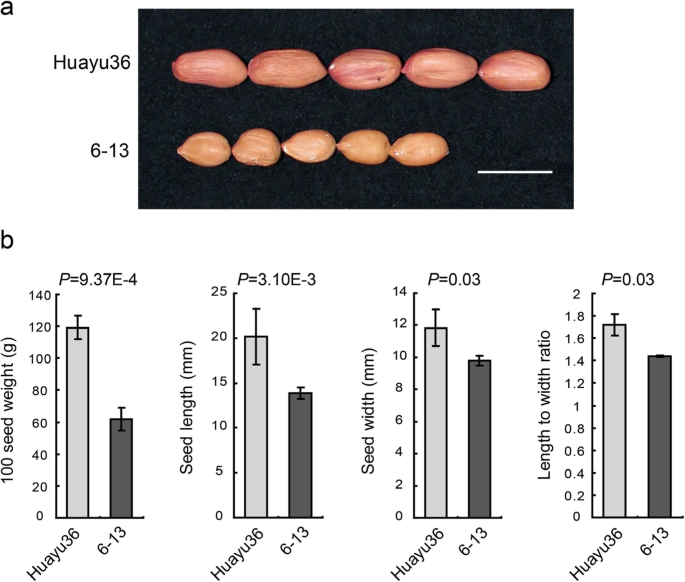
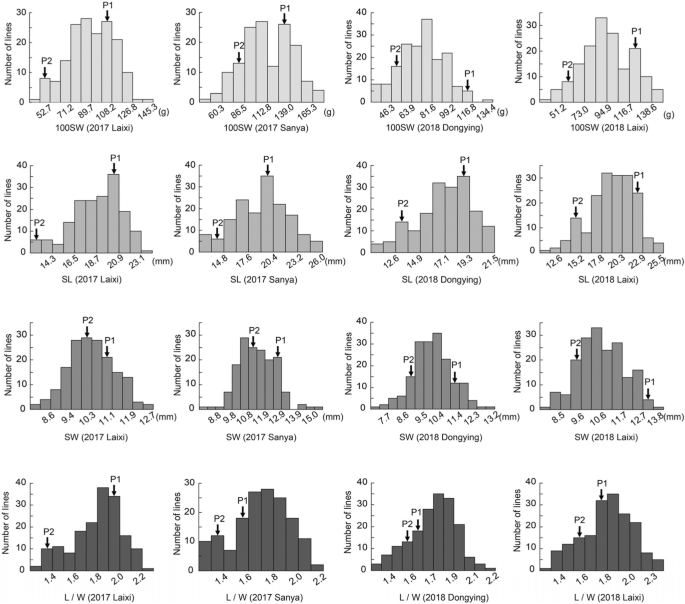
为了鉴定新的QTL /基因调节花生中的种子特征,由“华宇36”和“6-13”之间的交叉产生181个个体组成的RIL种群。母亲父母'huayu36'是一片大种植的品种(图。gydF4y2Ba1gydF4y2Ba), 100SW、SL、SW和L/W分别达到119.30±7.17 g、20.15±3.12 mm、11.83±1.13 mm和1.72±0.10(图1)。gydF4y2Ba1 bgydF4y2Ba).父母父母的6-13'是一种种质系列,种子重量和尺寸明显较小(图。gydF4y2Ba1gydF4y2Ba)“6–13”的相应测量值为61.83 ± 7.28 g、 13.89 ± 0.63 嗯,9点80分 ± 0.30 毫米和1.44毫米 ± 0.03(图。gydF4y2Ba1 bgydF4y2Ba).在四个环境中种植了RIL人口及其父母(Laixi,2017;三亚,2017;东营,2018; Laixi,2018)和四种种子相关性状的表型数据(100sw,sl,sw和l / w)呈现正常分布在人口中(图。gydF4y2Ba2gydF4y2Ba;桌子gydF4y2Ba1gydF4y2Ba).在大多数环境中观察到海侵分离(图。gydF4y2Ba2gydF4y2Ba),表明所测量的性状多基因遗传。ANOVA (analysis of variance) results indicated that the effects of genotypes (G), environments (E), and interaction of G and E (G × E) were all significant for all measured traits except for G × E for SL (Table2gydF4y2Ba).四个种子性状均表现出较高的广义遗传力(gydF4y2BahgydF4y2Ba2gydF4y2Ba),范围从0.77到0.89(表gydF4y2Ba2gydF4y2Ba)这表明遗传因素在控制种子大小和重量方面起着重要作用,但环境因素的影响不容忽视(gydF4y2BargydF4y2Ba= 0.793),以及介于100SW和SW (gydF4y2BargydF4y2Ba= 0.722)。SL和SW之间存在正相关(gydF4y2BargydF4y2Ba = 0.537). L/W was positively correlated with both 100SW (rgydF4y2Ba = 0.435) and SL (rgydF4y2Ba = 0.809), yet no significant correlation was found between with SW and L/W (Table3.gydF4y2Ba).gydF4y2Ba
SLAF测序,SNP和SSR基因分型。gydF4y2Ba
总共327.08 Gb原始测序数据包含1635.75测序后读取得到父母和181瑞来斯线,与48.51米9.70 Gb的数据读取从产妇行是“Huayu36”,并与37.82米7.56 Gb数据读取从父亲的行是“6-13”,分别为(表gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba2gydF4y2Ba:表S5)。GC(鸟嘌呤和胞嘧啶在所有四种碱基中的百分比)含量为37.66%,Q30比率(质量分数为30的碱基,表示99%的置信度)平均为94.66%(其他文件)gydF4y2Ba2gydF4y2Ba:表S5)。剔除低质量reads后,基于Tifrunner参考基因组共挖掘出1614,182个SLAF标签,包含510 204个SNPs,其中来自父母双亲的SLAF分别为733,610和693,570个,测序深度分别为50.91-和52.33倍(表)gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba2gydF4y2Ba:表S6)。在歼SLAFs数gydF4y2Ba6gydF4y2Ba子代为506,417个,平均覆盖率为16.13倍,对应8207,746个读取(附加文件gydF4y2Ba2gydF4y2Ba:表S6)。gydF4y2Ba
SLAF标签共获得510,204个snp,其中12,950个snp被成功编码为多态性,多态性率为2.54%(表2)gydF4y2Ba4gydF4y2Ba).根据基因型编码规则,将多态snp按不同的分离模式进行分组(ef × eg, hk × hk, lm × ll, nn × np, aa×bb, ab×cc, cc × ab, ab×cd)。由于RIL群体来源于两个纯合子基因型之间的杂交,共提取了6124个属于aa×bb模式的snp(附加文件)gydF4y2Ba2gydF4y2Ba:图S1)。筛选低质量snp后,有3829个snp进行连锁分析(见表)gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
高密度遗传图的构建gydF4y2Ba
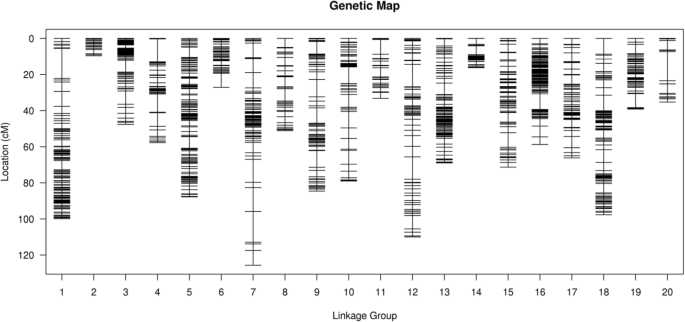
对于HDGM构建,3866个标记(3829个SNP和37个SSR)被分配到20个连锁群(LGs)(图。gydF4y2Ba3.gydF4y2Ba;桌子gydF4y2Ba5gydF4y2Ba).这张地图总共覆盖了1266.87 cM遗传距离范围为9.61-125.63 平均标记间隔为0.33的每个连锁群的cM 厘米(表gydF4y2Ba5gydF4y2Ba).LG 7是最长的一组,距离为125.63 cM有153个位点,而LG 2是最短的群体,跨度为9.61 cM有39个位点。LG 3拥有421个位点,在所有连锁群中最高,而LG 20只有22个位点,在连锁群中最低(表1)gydF4y2Ba5gydF4y2Ba).此外,37个SSRS分布在16 LG上,没有SSR在LG 6,LG 11,LG 12和LG 20上分配SSR(表gydF4y2Ba5gydF4y2Ba).Subsequently, the degree of the map uniformity and inter-marker linkage were evaluated by the percentage of ‘Gaps≤5 cM’, which ranged from 85.71 to 100% with an averaged value of 97.04%. The largest gap existed on LG 7, which was 17.05 cM (Table5gydF4y2Ba).gydF4y2Ba
为了评估HDGM的质量,我们通过比较每个LG标记的遗传位置和物理位置进行共线性分析。尽管LG 8和LG 17上有三个明显的倒线段,但在遗传和基因组位置之间显示出相对较高的共线性(附加文件gydF4y2Ba2gydF4y2Ba:图S2),证实一个良好有序的标记分配。gydF4y2Ba
种子相关性状的QTL鉴定gydF4y2Ba
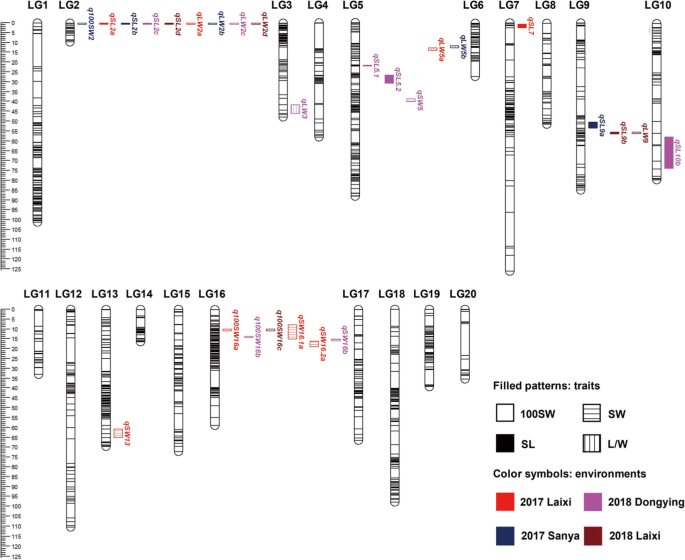
QTL映射导致鉴定所有4种种子相关性状的27 QTL,LOD值为3.16-31.55,并将表型变异(PVE)解释为0.74至83.23%(图。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
对于100SW,在两个染色体区域共检测到4个QTL(图。gydF4y2Ba4gydF4y2Ba),解释表型变异24.69-35.39%(表gydF4y2Ba6gydF4y2Ba).在一个以上的环境中检测一个一致的QTL区域,位于LG 16的标记间隔Marker9375-Marker9395中,跨越2.77 MB,分别在Laixi和Laixi 2018中检测到,分别为29.81和30.47%(表gydF4y2Ba6gydF4y2Ba).虽然gydF4y2BaQ100SW16B.gydF4y2Ba在lg16上,PVE = 35.39%, QTL位置转移到第一个一致区以下。gydF4y2BaQ100SW2.gydF4y2Ba仅在一个环境中鉴定,PVE为24.69%(图。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
对于S1,在LG 2,5,7,9和10上映射了总共10个QTL(图。gydF4y2Ba4gydF4y2Ba).gydF4y2BaQSL2gydF4y2Ba是一个主要一致的QTL区域(Marker938-marker893),LG 2跨越7.06 MB,PVE高达61.47%(表gydF4y2Ba6gydF4y2Ba).该QTL区域在所有四种环境中都已识别。两个主要的QTL(gydF4y2BaqSL5.1gydF4y2Ba和gydF4y2BaqSL5.2gydF4y2Ba)与LG 5紧密相连,并在同一季节鉴定,PVE分别为40.25%和36.91%。另一个QTL,gydF4y2BaQSL9gydF4y2Ba在Sanya_2017和Laixi_2018数据集中,PVE分别为4.05和9.62%(图4)。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).两个都gydF4y2BaqSL7gydF4y2Ba和gydF4y2BaqSL10gydF4y2Ba仅在一个赛季进行了鉴定。除了gydF4y2BaQSL9gydF4y2Ba,来自'huayu36'的所有等位基因增加了种子特征的测量(表gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
对于SW,鉴定出5个QTL,占PVE的12.12–21.58%(图。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).三个主效QTL(gydF4y2BaQSW16.1AgydF4y2Ba,gydF4y2BaQSW16.2AgydF4y2Ba,gydF4y2BaQSW16.gydF4y2Bab)映射在LG 16上(图。gydF4y2Ba4gydF4y2Ba)“Huyu36”等位基因有助于增加SW(表gydF4y2Ba6gydF4y2Ba).gydF4y2Baqsw16.1a.gydF4y2Ba通过(13.68%)gydF4y2BaQSW16.2AgydF4y2Ba(PVE 12.64%)gydF4y2BaqSW16bgydF4y2Ba(PVE 21.58%)在不同的季节鉴定(表格gydF4y2Ba6gydF4y2Ba).的位置gydF4y2BaQSW16.1AgydF4y2Ba和gydF4y2BaQSW16.gydF4y2Bab与100SW检测到的QTL区域重叠。SW的另外两个主要qtl (gydF4y2BaqSW5gydF4y2Ba和gydF4y2BaQSW13.gydF4y2Ba),分别占PVE的15.07和12.12%(表1)gydF4y2Ba6gydF4y2Ba).这些QTL仅在一个环境中检测到。gydF4y2Ba
对于L / W,8个相关的QTL被映射在LGS 2,3,5和9上(图。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).其中,在所有四种环境中检测到LG 2上的一致QTL区域(PVE = 65.77至83.23%),并与SL识别的QTL区域共定。用于增加特质测量的供体等位基因来自“Huayu36”。另一个一致的QTL区域(gydF4y2Baqlw5a.gydF4y2Ba和gydF4y2BaQLW5B.gydF4y2Ba)在LG 5上检测到,分别占PVE的43.66%和45.83%(表1)gydF4y2Ba6gydF4y2Ba).两个小法,gydF4y2BaqLW3gydF4y2Ba(PVE 4.85%)和gydF4y2BaqLW9gydF4y2Ba(PVE 4.47%),其中‘6-13’等位基因与L/W性状有关(表2)gydF4y2Ba5gydF4y2Ba).此外,gydF4y2BaqLW9gydF4y2Ba与被检测区域重叠的gydF4y2BaQSL9B.gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
两个稳定多效QTL区域的功能注释。gydF4y2Ba
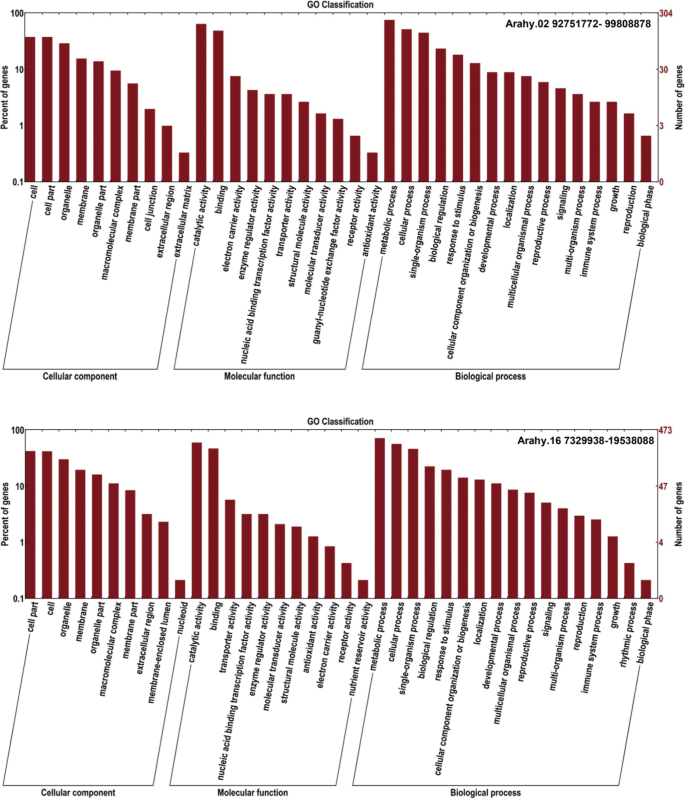
为了揭示基因/遗传途径的潜在调节种子大小,在染色体2和16这两个一致的QTL区域内的基因是从用于注释的Tifrunner参照基因组提取。的first QTL region (defined as the region I) on chromosome 2, with flanking markers Marker938–Marker893, spanned a genomic distance of 7.06 Mb, and contained 514 candidate genes by Nr database (Additional file3.gydF4y2Ba:表S7)。GO注释表明,大多数基因具有特定的功能分配:细胞成分类别中的细胞(114)、细胞部分(114)和细胞器(88);分子功能类别中的催化活性(195)、结合活性(148)和电子载体活性(23);生物过程类别中的代谢过程(230)、细胞过程(157)和单生物体过程(136)(图。gydF4y2Ba5gydF4y2Ba).其他QTL区域(定义为染色体16上的区域II),带有侧翼标记标记物标记9360-MARKER9483覆盖了12.21 MB的基因组距离。在该地区获得总共684个候选基因(附加档案gydF4y2Ba3.gydF4y2Ba:表S8),其中多数词条小区(199),细胞部分(197)和细胞器(142),用于细胞成分类别;催化活性(195),结合(148)和用于分子功能类别转运蛋白活性(27);代谢过程(340),细胞过程(267)和用于生物处理类别(图单生物体处理(218)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
在这两个QTL区域共检测66个SNP(在该区域16个SNP I和区域II 50个SNP),其大多位于间隔区或导致同义突变(附加文件gydF4y2Ba3.gydF4y2Ba:表S9)。已知植物激素如芸苔类化合物(BR)在种子发育中发挥关键作用[gydF4y2Ba35gydF4y2Ba].BR合成和信号转导途径的缺乏导致种子大小和质量的偏离型展览[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].在I区,3个候选基因arahi . t43k8i。1, arahy.T43K8I。2和一个r一个hy.T43K8I.3 were all homologous to the BSU1 (BRI1 suppressor 1) (Additional file2gydF4y2Ba:图S3;额外的文件gydF4y2Ba3.gydF4y2Ba表S7),它被报道在油菜素内酯(BR)信号转导中起作用,并影响植物生长[gydF4y2Ba40.gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].同时,候选基因arahy.BC5R4P。1encoding the putative auxin response factor 2 (ARF2)–like protein was highlighted in the region II (Additional file2gydF4y2Ba:图S3;额外的文件gydF4y2Ba3.gydF4y2Ba:表S8),其同源物在BZR1和BR信号的下游在调节种子大小gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba42.gydF4y2Ba].gydF4y2Ba
讨论gydF4y2Ba
一种基于SLAF的栽培花生HDGM。gydF4y2Ba
在这项研究中,选择具有对比种子特征的两种父母基因型以产生群体群体。使用HDGM检测QTL的RIL线中的高水平表型变异。以前,栽培花生的狭窄遗传基础导致各种形式的分子标记中的多态性极低,这抑制了花生中HDGM的构建[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].SLAF-SEQ策略,轨迹特异性扩增和下一代测序的组合已成功地应用于各种物种的大规模SNP开采中,揭示其成熟管道和HDGM结构中的优势,QTL识别有利的QTL识别[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba].目前,基于SLAF-seq的3个HDGMs已发表在种植花生,所有这些都包括了超过2000个高品质的SNP标记,并导致种植花生的产量和油品质量相关的QTL检测[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].在本研究中,将近4000个标记被放置在连锁图谱上,以便对感兴趣的性状进行精细的遗传作图gydF4y2Ba5gydF4y2Ba).同时,Colinearity分析验证了这张地图的高质量。基于目前的基于SLAF的HDGM基于新出版的四倍体栽培花生基因组(gydF4y2BaA. hypogaea.gydF4y2Ba简历。Tifrunner)gydF4y2Ba34gydF4y2Ba]而不是两个祖传二倍体物种的参考基因组(gydF4y2Ba答:duranensisgydF4y2BaAA;gydF4y2Ba答:ipaensisgydF4y2Ba,bb)[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].虽然二倍体和四倍体物种之间的序列节约是高的,但在形成栽培花生物种的多倍化事件后发生四元素事件和染色体反转[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba].因此,使用培养的花生参考基因组降低了标记位置的错误分配的风险,并改善了QTL /基因鉴定的准确性。gydF4y2Ba
QTL种子重量和大小的识别。gydF4y2Ba
种子重量和大小的复杂遗传基础已经在作物中得到了很好的表征,这些作物是由涉及不同途径的许多基因控制的[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba].然而,花生种子相关性状的遗传机制尚不清楚,需要进一步研究。目前已鉴定出多个种子相关qtl,其PVE和染色体位置不同,来自不同亲本基因型[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].和先前确定的100SW,SL和SW QTL广泛分布于各种LG的,表示这种特质的复杂多基因遗传。类似地,在本研究中,一共有27个QTL 4个种子相关性状的染色体2,3,5,7,9,10,13和16检测到,说明从0.74到83.23%(图的表型变异。gydF4y2Ba4gydF4y2Ba;桌子gydF4y2Ba6gydF4y2Ba).在这些当中,gydF4y2BaqSL2gydF4y2Ba,gydF4y2BaqLW2gydF4y2Ba和gydF4y2BaQ100SW16gydF4y2Ba超过29.81%的PVE在至少三种环境中一致检测到,表明跨环境的遗传效应稳定。在5号染色体和9号染色体上分别有5个和3个qtl覆盖两个基因组区域,其中包含3个转座元件标记(AhTE0523、AhTE0278和AhTE0437),此前与荚大小相关[gydF4y2Ba6gydF4y2Ba]同时,QTL区域覆盖率为29.7% 5号染色体上的Mb与Hake等人检测到的荚重QTL位置一致[gydF4y2Ba54.gydF4y2Ba].gydF4y2Ba
了的gydF4y2BaqSL2gydF4y2Ba和gydF4y2BaqLW2gydF4y2Ba在染色体2上gydF4y2BaQ100SW16gydF4y2Ba和gydF4y2BaQSW16.gydF4y2Ba在16号染色体上,每对性状之间具有高度的正相关,产量相关的QTL对多个性状表现出多效性效应[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba,gydF4y2Ba55.gydF4y2Ba].将这些QTL区域内的遗传标记应用于育种中,可能会优化多个种子相关性状的选择。之前的研究报道了B06上几个与产量相关的qtl [gydF4y2Ba2gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].其中,Wang等人[gydF4y2Ba8gydF4y2Ba]在B06上确定了一个QTL区域,物理覆盖率为119.8 MB-128.8 MB,其与此处报告的QTL区域遥远的(物理覆盖:7.33 MB-21.71 MB和25.49 MB-53.24 MB)。陈等。[gydF4y2Ba2gydF4y2Ba] reported three QTL regions for both 100SW and SW on B06, among which two (physical coverage: 10.6 Mb–21.6 Mb and 12.2 Mb–74.9 Mb) overlapped with our results, suggesting a possibly similar genetic basis within these regions. Fonceka et al. [28gydF4y2Ba]在B06上鉴定了一个标记(TC3H07_B),仅在水分限制条件下与种子重量相关。由于TC3H07_B的物理位置未知,我们无法确定该标记是否位于我们检测到的QTL区域。然而,据我们所知,染色体2上的区域I是新的(图。gydF4y2Ba4gydF4y2Ba),因为还没有关于该染色体的相关QTL的报道。gydF4y2Ba
两个稳定的多效QTL区域的功能注释。gydF4y2Ba
对QTL I和II区域内的514和684个基因进行了功能注释,有助于理解其可能的生物学功能。在I区和II区共检测到66个SNPs,均未导致蛋白编码序列的改变(Additional file)gydF4y2Ba3.gydF4y2Ba:表S9)。标记密度不足限制靶基因的预测。但是,这些SNP可用于设计KASP(基准等位基因特异性聚合酶链反应)标记,用于精细映射和促进分子育种[gydF4y2Ba56.gydF4y2Ba].gydF4y2Ba
以往对其他物种的研究为理解花生种子大小调节的假定机制提供了有用的信息[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba]激素已被广泛证明在种子发育中起作用,其中BR在种子大小调节中起关键作用[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].在I区,有3个基因arahi . t43k8i。1, arahy.T43K8I。2和一个r一个hy.T43K8I.3 encoded proteins homologous to the BSU1 (Additional file2gydF4y2Ba:图S3;额外的文件gydF4y2Ba3.gydF4y2Ba:表S7,S8),精细调整BR响应的关键因素,突变体可以影响器官尺寸和形状[gydF4y2Ba40.gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].Arahy。BC5R4P.1,在区域II被鉴定并且是同源ARF2,将其报告给充当BZR1的目标和负调控种子大小在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba42.gydF4y2Ba].这四个候选基因与其他可能的基因一起值得进一步调查以确定他们在花生种子发育中的作用。gydF4y2Ba
结论gydF4y2Ba
根据已发布的栽培花生基因组,构建了包含3866个SLAF和SSR位点的高密度遗传图谱。结果表明,该图谱具有较高的质量,可用于QTL定位。在4个环境中共鉴定出27个调控种子大小和重量的QTL,包括2个稳定的多效QTL区,其中2号染色体上的QTL是新发现的QTL。这些发现将有助于精细定位和克隆调节产量构成因素和种子形态性状的基因。与这些性状相关的遗传标记可用于花生种子性状改良的分子育种。gydF4y2Ba
方法gydF4y2Ba
植物材料和表型gydF4y2Ba
FgydF4y2Ba2:6–8gydF4y2Ba由‘Huayu36’与‘6-13’杂交获得了181个RIL系群体。本研究使用的植物材料(包括亲本和ril)均为本实验室原创,本实验室对其拥有所有相关权利。所有材料都是按照当地法律在地里种植的。‘Huayu36’品种大种子,种皮浅红色。种质‘6-13’种子小,种皮浅棕色。将RIL群体及其亲本种植于山东省莱西试验田(北纬36.86°,东经120.53°)(2017年和2018年5月种植,9月收获);海南省三亚(北纬18.65°,东经109.80°)(2017年11月种植,2018年3月收获);山东省东营市(北纬37.46°,东经118.49°)(2018年5月种植,9月收获)。田间试验采用随机区组设计,根据之前的研究进行三次重复,并进行了一些修改[gydF4y2Ba57.gydF4y2Ba].对于每种曲线,每个RIL线的10个植物在一排内部生长15cm,在rils之间给出85厘米的间隙。每20排后种植父母线作为对照。标准农业实践用于现场管理。每种植物在成熟度下单独收获,以防止过度成熟的损失。每行中间只有8个植物用于特征测量。测量每株植物的全尺寸豆荚测定的成熟种子,测量每株植物100种子重量,种子长度,种子宽度和长度。通过使用并行规则测量种子长度和种子宽度。种子重量在电线上拍摄。通过将种子长度除以种子宽度来计算宽度比的长度。 The mean values of each measured trait were used for phenotypic characterization. The phenotypic datasets of four seed traits in four environments are shown in an additional supporting file (Additional file1gydF4y2Ba:表S1)。gydF4y2Ba
表型数据的统计分析gydF4y2Ba
平均值和父母每个种子相关性状和各RIL线的标准差进行分析,学生的t检验通过SPSS统计(IBM®SPSS®统计19)进行。人口数据的正常通过柯尔莫哥洛夫 - 斯米尔诺夫检验。根据公式gydF4y2BahgydF4y2Ba2gydF4y2Ba=σ.gydF4y2BaggydF4y2Ba2gydF4y2Ba/(σ.gydF4y2BaggydF4y2Ba2gydF4y2Ba + σgydF4y2Ba通用电气gydF4y2Ba2gydF4y2Ba/ n +σgydF4y2BaegydF4y2Ba2gydF4y2Ba/广义遗传力(gydF4y2BahgydF4y2Ba2gydF4y2Ba),利用QTL IciMapping V4.1 (gydF4y2Bahttp://www.isbreeding.net/software/?Type=detail&id=18gydF4y2Ba).σ.gydF4y2BaggydF4y2Ba2gydF4y2Ba,σgydF4y2BaegydF4y2Ba2gydF4y2Ba,和σ.gydF4y2Ba通用电气gydF4y2Ba2gydF4y2Ba分别为基因型方差(G)、环境方差(E)和基因型与环境交互作用方差(G × E)。利用SPSS统计软件(IBM®SPSS®statistics 19)得到两个性状之间的Pearson相关系数。gydF4y2Ba
DNA提取及SSR标记分析gydF4y2Ba
来自两个亲本和181个RIL系(FgydF4y2Ba2:6gydF4y2Ba),在苗期采集,液氮冷冻,−70℃保存。采用植物基因组DNA试剂盒(天根生物技术北京有限公司)提取总基因组DNA。使用0.8%琼脂糖凝胶电泳和ND-1000分光光度计(NanoDrop, Wilmington, DE, USA)检测DNA的浓度和质量。SSR分析的PCR反应条件为:94℃变性3 min;94°C时1 min, 55°C时30 s, 72°C时90 s,共35个循环;然后在72°C下延长10分钟,4°C保存。PCR产物在6%的PAGE凝胶上分离。37个多态性SSR引物(附加文件gydF4y2Ba1gydF4y2Ba:表S2)被用于基因分型的RIL群体。如先前所述进行基因分型SSR [gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
高通量测序和基因分型gydF4y2Ba
在扫描了花生的参考基因组后gydF4y2BaRSA.gydF4y2Ba我和gydF4y2Ba生态gydF4y2Ba选择RV-HF®(NEB, Ipswich, MA)酶消化基因组DNA。SLAF-library构造的协议已在前面描述[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba58.gydF4y2Ba].根据Biomarker Technologies Corporation (Beijing, China)的Illumina样品制备指南(Illumina, Inc., San Diego, CA),使用Illumina HighSeq 2500平台,将314-414 bp的带有指数和适配器(SLAFs)的DNA片段切除并稀释,进行对端测序。gydF4y2Ba
基于序列相似性丢弃低质量reads(质量评分< 30,出错概率为0.1%),使用BLAT(−tileSize = 10 -stepSize = 5)对SLAF配对端reads进行聚类[gydF4y2Ba58.gydF4y2Ba].具有超过90%同一性的序列在一个SLAF位置分组[gydF4y2Ba59.gydF4y2Ba].本研究将SLAF分为非多态SLAF、多态SLAF和重复SLAF三种类型。利用小等位基因频率(MAF)评估,在每个SLAF中定义等位基因。根据GATK最佳实践(gydF4y2Bahttps://www.broadinstitute.org/gatk/guide/best-practices?bpm=DNAseq#variant-discovery-ovwgydF4y2Ba).多态SNP标记被分类为八个分离模式(AB×CD,EF×例如HK×HK,LM×LL,NN×NP,AA×BB,AB×CC和CC×AB)。通过两个纯合父母之间的交叉获得RIL群体,其基因型AA或BB。因此,拟合AA×BB分离模式的SNP标记用于遗传映射结构。为确保遗传地图的质量,通过以下规则过滤低质量的SNP [gydF4y2Ba22gydF4y2Ba]:父母均≤10倍的排序深度的SNP;完整程度≤70%;奇广场的预期1:1具有高度扭曲的隔离比例(gydF4y2BaχgydF4y2Ba2gydF4y2Ba) 测试;SLAF超过8个SNP。AA和BB代表'6-13'和'Huayu36'的基因型,并且每个RIL线通过高质量标记的相关基因分型结果显示在额外的支持文件中(附加文件gydF4y2Ba1gydF4y2Ba:表S3)。gydF4y2Ba
高密度遗传地图建设gydF4y2Ba
连接地图[gydF4y2Ba60.gydF4y2Ba]标记的物理位置根据cv.基因组序列进行分配[gydF4y2Ba34gydF4y2Ba].高质量的SLAF标记物根据两两修正对数比值(MLOD)评分进行分组。为确保高密度高质量图谱的高效构建,采用High map Strategy对SLAF和SSR标记进行排序,并纠正染色体内的基因分型错误[gydF4y2Ba61.gydF4y2Ba].应用MSTMAP以获得每个组的标记顺序[gydF4y2Ba62.gydF4y2Ba].顺畅算法用于纠错[gydF4y2Ba63.gydF4y2Ba],采用k-最近邻算法对缺失基因型进行归算[gydF4y2Ba64.gydF4y2Ba].应用Kosambi映射功能来估计地图距离[gydF4y2Ba65.gydF4y2Ba].每个LG标志物的遗传位置被显示在一个附加的支撑文件(附加文件gydF4y2Ba1gydF4y2Ba:表S4)。此外,还生成了一幅共线性图来评价地图的质量。连锁群编号对应于Tifrunner参考基因组指定的染色体编号。gydF4y2Ba
QTL映射gydF4y2Ba
的gydF4y2BaRgydF4y2Ba/gydF4y2BaQTL.gydF4y2Ba包(gydF4y2Ba66.gydF4y2Ba使用复合间隔映射方法(CIM)来使用用于检测QTL并确认每个QTL周围的不同标记之间的关系。置换测试重复1000次,LOD分数大于5%的截止值。应用了3.0的odds(LOD)阈值的对数,以在95%的显着性水平下申报QTL的存在。正面和阴性添加剂效应分别代表了有利的等位基因,分别来自'6-13'和'huayu36'。gydF4y2Ba
功能注释gydF4y2Ba
基于栽培花生的基因组序列,选择4个环境共定位qtl置信区间两侧的标记,鉴定候选基因。gydF4y2Bahttps://peanutbase.org/data/public/Arachis_hypogaea/Tifrunner.esm.TVDM/gydF4y2Ba).对于功能诠释,使用BLASTX算法将主要QTL区域内的基因含量与UNIPROT数据库中可用的NR(非REDUNDENT)蛋白序列进行比较。然后搜索相关的命中的各自基因本体(GO)术语gydF4y2Bawww.geneontology.org.gydF4y2Ba[gydF4y2Ba67.gydF4y2Ba].通过BLASTP算法针对拟南芥信息资源获得推定候选基因的同源蛋白质序列(gydF4y2Bahttps://www.arabidopsis.org/index.jspgydF4y2Ba).gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本研究结果的数据集包含在手稿和其他支持文件中。gydF4y2Ba
缩写gydF4y2Ba
- 100年西南:gydF4y2Ba
-
100年种子重量gydF4y2Ba
- 添加:gydF4y2Ba
-
添加效果gydF4y2Ba
- BR:gydF4y2Ba
-
芸苔类固醇gydF4y2Ba
- 置信区间:gydF4y2Ba
-
置信区间gydF4y2Ba
- CIM:gydF4y2Ba
-
复合间隔映射gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- HDGM:gydF4y2Ba
-
高密度遗传图gydF4y2Ba
- L / W:gydF4y2Ba
-
长宽比gydF4y2Ba
- LGs:gydF4y2Ba
-
连杆组gydF4y2Ba
- LOD:gydF4y2Ba
-
赔率的对数gydF4y2Ba
- ngs:gydF4y2Ba
-
下一代测序gydF4y2Ba
- PVE:gydF4y2Ba
-
表型变异解释gydF4y2Ba
- QTL:gydF4y2Ba
-
定量特质基因座gydF4y2Ba
- RIL:gydF4y2Ba
-
重组自交系gydF4y2Ba
- SL:gydF4y2Ba
-
种子长度gydF4y2Ba
- SLAF-Seq:gydF4y2Ba
-
特异性基因座扩增片段测序gydF4y2Ba
- SNP:gydF4y2Ba
-
单核苷酸多态性gydF4y2Ba
- 苏维埃社会主义共和国:gydF4y2Ba
-
简单序列重复gydF4y2Ba
- SW:gydF4y2Ba
-
种子宽度gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
McKenzie FC,Williams J.可持续粮食生产:2050年的限制,挑战和选择。食品Secur。2015; 7:221-33。gydF4y2Ba
- 2.gydF4y2Ba
陈勇,任旭,郑勇,周昕,黄磊,严磊,等。花生(花生)富川大花生和ICG6375 RIL群体产量性状的遗传定位gydF4y2Ba花生gydF4y2Bal .)。摩尔品种。2017;37:17。gydF4y2Ba
- 3.gydF4y2Ba
白泽等,青木等,平川等,Tabata S,渡边等。利用硅多态性分析开发栽培花生的简单重复序列和转座子标记,构建连锁图谱。BMC Plant Biol. 2012;12:80。gydF4y2Ba
- 4.gydF4y2Ba
陈某,娇y,cheng l,huang l,liao b,唐m等。栽培花生植物和核相关性状的定量特性分析(gydF4y2Ba花生gydF4y2Bal .)。BMC麝猫。2016;十七25。gydF4y2Ba
- 5。gydF4y2Ba
Pandey MK, Upadhyaya HD, Rathore A, Vadez V, Sheshshayee MS, sriswatthi M,等。使用来自世界半干旱热带48个国家的300个基因型组成的“参考集”,对花生的50个农艺性状进行全基因组关联研究。《公共科学图书馆•综合》。2014;9:e105228。gydF4y2Ba
- 6。gydF4y2Ba
Hake AA, Shirasawa K, Yadawad A, Nayak SN, Mondal S, Badigannavar AM, et al.;花生独立突变体大群体产量和品质性状转座元件标记的鉴定(gydF4y2Ba花生gydF4y2Bal .)。Euphytica。2017; 213:283。gydF4y2Ba
- 7。gydF4y2Ba
7 . Gomez Selvaraj M, Narayana M, Schubert AM, Ayers JL, Baring MR, burrow MD.栽培花生荚果和籽粒性状的体积分离分析qtl的鉴定。电子学报。2019;12:1-10。gydF4y2Ba
- 8。gydF4y2Ba
王Z,淮d,张Z,郑K,康Y,万L,等人。基于特定长度的扩增片段测序和其在数量性状位点分析对于在栽培花生的产量相关性状的应用的高密度遗传图谱的开发。前植物SCI。2018; 9:827。gydF4y2Ba
- 9。gydF4y2Ba
Petroli CD, Sansaloni CP, Carling J, Steane DA, Vaillancourt RE, Myburg AA,等。基于高密度连锁分析和物理定位的DArT标记的基因组特征gydF4y2Ba桉树gydF4y2Ba基因组。《公共科学图书馆•综合》。2012;7:e44684。gydF4y2Ba
- 10.gydF4y2Ba
Gautami B,Pandey的MK,Vadez V,Nigam的SN,Ratnakumar P,克里希纳穆尔蒂L,等人。数量性状位点分析和建设的共识遗传图谱的基础上种植花生三种重组自交系群体耐旱性状(gydF4y2Ba花生gydF4y2Bal .)。摩尔品种。2012;30:757 - 72。gydF4y2Ba
- 11.gydF4y2Ba
黄磊,任旭,吴斌,李旭,陈伟,周旭,等。花生株高数量性状位点高密度连锁图谱的构建与应用(gydF4y2Ba花生gydF4y2Bal .)。SCI REP。2016; 6:39478。gydF4y2Ba
- 12.gydF4y2Ba
秦华,冯S,陈C,郭毅,克纳普S,库拉,等。栽培花生遗传连锁图谱的构建(gydF4y2Ba花生gydF4y2BaL.)从两个RIL群体构成。Al Appl Genet。2012; 124:653-64。gydF4y2Ba
- 13.gydF4y2Ba
Varshney RK, Bertioli DJ, Moretzsohn MC, Vadez V, Krishnamurthy L, Aruna R等。首个栽培花生ssr遗传连锁图谱(gydF4y2Ba花生gydF4y2Bal .)。Theor Appl Genet. 2009; 118:729-39。gydF4y2Ba
- 14.gydF4y2Ba
王H,Penmetsa RV,袁M,龚L,赵y,guo b等。BAC-END序列衍生SSRS的开发和表征,及其掺入新的栽培花生的新密度遗传图中(gydF4y2Ba花生gydF4y2Bal .)。BMC Plant Biol. 2012;12:10。gydF4y2Ba
- 15.gydF4y2Ba
Clevenger J,Chavarro C,Pearl SA,Ozias-Akins P,Jackson SA。多倍体中的单核苷酸多态性鉴定:综述,例子和建议。莫尔植物。2015; 8:831-46。gydF4y2Ba
- 16。gydF4y2Ba
廖蓓,李国强。从单核苷酸多态性到功能多态性:对生物技术应用的洞察。生物化学学报2010;49:149-58。gydF4y2Ba
- 17。gydF4y2Ba
张Y,王磊,鑫H,李d,马C,丁X,等人。基于由特定长度扩增片段(SLAF)测序大规模标记开发用于芝麻高密度遗传图谱的构建。BMC植物BIOL。2013; 13:141。gydF4y2Ba
- 18。gydF4y2Ba
齐Z,黄L,朱R,鑫d,刘成,韩X等。大豆基于特定长度的高密度遗传学图扩增片段测序。Plos一个。2014; 9:e104871。gydF4y2Ba
- 19。gydF4y2Ba
许X,许R,诸B,于T,曲W,路L,等人。来自特异性长度扩增片段测序(SLAF-SEQ)的黄瓜的高密度遗传图谱。前植物SCI。2014; 5:768。gydF4y2Ba
- 20。gydF4y2Ba
朱力,黄l,陈l,杨杰,吴jn,qu ml,等。黄瓜的高密度遗传联系地图(gydF4y2BaCucumis巨大成功gydF4y2Ba基于黄瓜果实性状的特异性长度扩增片段(SLAF)测序和QTL分析。植物科学学报,2016;gydF4y2Ba
- 21。gydF4y2Ba
张震,尚华,史勇,黄磊,李军,葛强,等。利用特异性位点扩增片段测序(SLAF-seq)构建高密度遗传图谱及其在陆地棉铃重QTL分析中的应用(gydF4y2Bagossypium hirsutumgydF4y2Ba).BMC Plant Biol. 2016;16:79。gydF4y2Ba
- 22。gydF4y2Ba
胡晓华,张淑珍,苗海瑞,崔发方,沈勇,杨文清,等。利用SLAF-seq和SSRs构建花生油酸和亚油酸的高密度遗传图谱及qtl鉴定Sci众议员2018;8:5479。gydF4y2Ba
- 23。gydF4y2Ba
李磊,杨旭,崔胜,等。花生生长习性相关性状高密度遗传图谱的构建及数量性状位点的定位(gydF4y2Ba花生gydF4y2Ba《前端设备科学》2019;10:745。gydF4y2Ba
- 24。gydF4y2Ba
Li Y,Fan C,Xing Y,Jiang Y,Luo L,Sun L等。GS5的自然变化在调节水稻中的晶粒尺寸和产量方面发挥着重要作用。NAT Genet。2011; 43:1266-9。gydF4y2Ba
- 25。gydF4y2Ba
刘升,桐树,萧y,che r,xu f,hu b等人。激活gydF4y2Ba大Grain1gydF4y2Ba通过调节水稻生长素的转运,显著改善水稻的粒级。美国国家科学研究院2015;112:11102-7。gydF4y2Ba
- 26。gydF4y2Ba
李胜,陈丽,张丽,李旭,刘永强,吴振宇,等。BnaC9。SMG7b对每角果的种子数起正调节作用gydF4y2Ba芸苔属植物显著gydF4y2Ba通过调节功能性雌性配子体的形成。植物理性。2015; 169:2744-60。gydF4y2Ba
- 27gydF4y2Ba
刘杰,华伟,胡子阳H,张磊,李乐,等。植物的自然变异gydF4y2BaARF18gydF4y2Ba基因同时影响种子重量和在多倍体油菜籽长角果长度。国家科学院院刊美A. 2015; 112:5123-32。gydF4y2Ba
- 28gydF4y2Ba
fceka D, Tossim HA, Rivallan R, Vignes H, Faye I, Ndoye O,等。花生的驯化和遗留等位基因:种间QTL定位揭示了驯化足迹和育种有用的自然变异。BMC Plant Biol. 2012;12:26。gydF4y2Ba
- 29gydF4y2Ba
黄磊,何洪,陈伟,任旭,陈勇,周旭,等。栽培花生农艺性状及品质相关性状的数量性状位点分析(gydF4y2Ba花生gydF4y2Bal .)。Theor Appl Genet. 2015; 128:1103-15。gydF4y2Ba
- 30.gydF4y2Ba
罗华,郭军,任旭,陈伟,黄磊,周旭,等。花生荚果重量和大小的稳定和主要qtl与A07和A05染色体相关(gydF4y2Ba花生gydF4y2Bal .)。Theor Appl Genet. 2018; 131:267-82。gydF4y2Ba
- 31.gydF4y2Ba
罗清,仁XP,李泽,徐ZJ,李XP,黄L等。主要定量特质基因座的共同定位荚尺寸和重量为3.7厘米间隔培养花生染色体A05(gydF4y2Ba花生gydF4y2Bal .)。BMC基因组学,2017;18:-58。gydF4y2Ba
- 32.gydF4y2Ba
Bertioli DJ, Cannon SB, Froenicke L, Huang G, Farmer AD, Cannon EK等。的基因组序列gydF4y2Baarachis duranensis.gydF4y2Ba和gydF4y2Baarachis ipaensis.gydF4y2Ba是栽培花生的二倍体祖先。Nat麝猫。2016;48:438-46。gydF4y2Ba
- 33.gydF4y2Ba
陈X,李H,Pandey Mk,Yang Q,Wang X,Garg v等。花生A-基因组祖细胞的基因组草案(gydF4y2Baarachis duranensis.gydF4y2Ba)提供进入Geocarpy,油脂合成和过敏原的见解。Proc Natl Acad Sci U S A. 2016; 113:6785-90。gydF4y2Ba
- 34.gydF4y2Ba
Bertioli DJ,詹金斯Ĵ,克莱文杰Ĵ,Dudchenko O,高d,成城G,等人。段异源四倍体花生的基因组序列gydF4y2Ba花生gydF4y2Ba.NAT Genet。2019; 51:877-84。gydF4y2Ba
- 35.gydF4y2Ba
太阳x,shantharaj d,kang x,ni m。转录和荷尔蒙信令控制gydF4y2Ba拟南芥gydF4y2Ba种子发展。CurrOp植物BIOL。2010; 13:611-20。gydF4y2Ba
- 36.gydF4y2Ba
洪志,Ueguchi-Tanaka M, Fujioka S, Takatsuto S, Yoshida S, Hasegawa Y,等。大米gydF4y2Babrassinosteroid-deficient dwarf2gydF4y2Ba突变体,在稻米同源物中有缺陷gydF4y2Ba拟南芥diminuto / dwarf1gydF4y2Ba,由内源性积累的替代生物活性油菜素内固醇(dolichosterone)拯救。植物细胞。2005;17:2243-54。gydF4y2Ba
- 37.gydF4y2Ba
蒋文斌,林文辉。Brassinosteroid功能gydF4y2Ba拟南芥gydF4y2Ba种子发展。植物信号表现。8:10。gydF4y2Ba
- 38.gydF4y2Ba
Morinaka Y,坂本T,犬饲Y,Agetsuma男,北野H,Ashikari M等人。引起的油菜素类固醇不敏感形态学改变增加的生物量和粮食生产大米。植物理性。2006; 141:924-31。gydF4y2Ba
- 39。gydF4y2Ba
Takahashi N,Nakazawa M,Shibata K,Yokota T,Ishikawa A,Suzuki K,等。gydF4y2Bashk1-dgydF4y2Ba,一个矮的拟南芥突变体通过的活化引起gydF4y2BaCYP72C1gydF4y2Ba基因改变了油菜素内酯的水平。植物j . 2005; 42:13-22。gydF4y2Ba
- 40。gydF4y2Ba
金TW,关S,伯林格姆AL,王ZY。所述CDG1激酶在调节油菜素类固醇信号转导从BRI1受体激酶到BSU1磷酸酶和GSK3样激酶BIN2。Mol细胞。2011; 43:561-71。gydF4y2Ba
- 41。gydF4y2Ba
与KELCH-重复结构域莫拉 - 加西亚S,Vert的G,阴Y,卡诺-Delgado的A,畅H,乔瑞J.核蛋白磷酸酶调节到油菜素类固醇响应gydF4y2Ba拟南芥gydF4y2Ba.基因开发。2004; 18:448-60。gydF4y2Ba
- 42。gydF4y2Ba
Schruff MC, Spielman M, Tiwari S, Adams S, Fenby N, Scott RJ。的gydF4y2Ba生长素反应因子2gydF4y2Ba拟南芥的基因连接生长素信号、细胞分裂、种子和其他器官的大小。发展。2006;133:251 - 61。gydF4y2Ba
- 43。gydF4y2Ba
希卢·KW,潜行者HT。花生与野生种的亲缘关系gydF4y2Baarachis.gydF4y2Ba教派。gydF4y2Baarachis.gydF4y2Ba(gydF4y2Ba蝶形花科gydF4y2Ba): rapd的证据。acta botanica sinica(云南植物研究),1995;gydF4y2Ba
- 44。gydF4y2Ba
Tallury SP, Hilu KW, Milla SR, Friend SA, Alsaghir M, Stalker HT等。中的基因关联性gydF4y2Baarachis.gydF4y2Ba部分gydF4y2Baarachis.gydF4y2Ba(Fabaceae):分子和细胞遗传学证据。Al Appl Genet。2005; 111:1229-37。gydF4y2Ba
- 45。gydF4y2Ba
夏C,Chen Ll,Rong Tz,Li R,Xiang Y,Wang P等人。用SLAF-SEQ方法鉴定新的玉米花粉术突变体和关联分析。Euphytica。2015; 202:35-44。gydF4y2Ba
- 46。gydF4y2Ba
Clevenger J,Chu Y,Chavarro C,Agarwal G,Bertioli DJ,Leal Bertioli SCM等。全基因组SNP基因分型解决花生中的选择和四体重组特征。Mol Plant.2017;10:309–22。gydF4y2Ba
- 47。gydF4y2Ba
利尔-Bertioli S,白泽K,埃伯纳西B,Moretzsohn男,Chavarro C,克莱文杰J,等。四体重组是异源四倍体出奇频繁gydF4y2Baarachis.gydF4y2Ba.遗传学。2015; 199:1093-105。gydF4y2Ba
- 48。gydF4y2Ba
Leal-Bertioli Scm,Godoy Ij,Santos JF,Doyle Jj,Guimarãespm,Abernathy Blj,等。在作用中进行分段型外聚倍性:通过多倍体杂交和同源重组增加多样性。我是J机器人。2018; 105:1053-66。gydF4y2Ba
- 49。gydF4y2Ba
Nguepjop JR, Tossim HA, Bell JM, Rami JF, Sharma S, Courtois B,等。花生与新合成的异源四倍体杂交种同源染色体之间基因组交换的证据。植物学报2016;7:1635。gydF4y2Ba
- 50.gydF4y2Ba
Kato S,Sayama T,Fujii K,Yumoto S,Kono Y,Hwang TY,等。一个在多种环境和遗传背景下与大豆种子重量相关的主要且稳定的QTL。Thero Appl Genet.2014;127:1365–74。gydF4y2Ba
- 51.gydF4y2Ba
刘军,陈建军,郑旭,吴芳,林强,衡阳,等。GW5通过油菜素内酯信号通路调控水稻粒宽和粒重。Nat植物。2017;3:17043。gydF4y2Ba
- 52.gydF4y2Ba
王胜,李胜,刘强,张军,王胜,王勇,等。的gydF4y2Baosspl16-gw7.gydF4y2Ba调节模块决定谷物形状,同时提高水稻产量和品质。Nat Genet.2015;47:949–54。gydF4y2Ba
- 53.gydF4y2Ba
谢峰涛,牛勇,张军,卜绍华,张洪辉,耿春平,等。大豆种子大小性状数量性状位点的精细定位。摩尔品种。2014;34:2165 - 78。gydF4y2Ba
- 54.gydF4y2Ba
Hake Aa,Shirasawa K,Yadawad A,Sukruth M,Patil M,Nayak Sn,等。使用基因和非基因转移元素标志物在花生中的重要分类和生产力性状的映射(gydF4y2Ba花生gydF4y2Bal .)。Plos一个。2017; 12:e0186113。gydF4y2Ba
- 55.gydF4y2Ba
Hall MC, Basten CJ, Willis JH。多效性数量性状位点导致了与生活史变异相关性状的群体分化gydF4y2Ba玄参科猴面花gydF4y2Ba.遗传学。2006; 172:1829-44。gydF4y2Ba
- 56.gydF4y2Ba
Agarwal G,Clevenger J,Pandey Mk,Wang H,Shasidhar Y,Chu Y等。高密度遗传图谱使用全基因组重构进行精细测绘和候选基因发现,用于花生抗病抗性。植物Biotechnol J. 2018; 16:1954-67。gydF4y2Ba
- 57.gydF4y2Ba
黄L,他HY,陈WG,任XP,陈YN,周XJ等。栽培花生农艺性状及品质相关性状的数量性状位点分析(gydF4y2Ba花生gydF4y2Bal .)。Theor Appl Genet. 2015; 128:1103-15。gydF4y2Ba
- 58.gydF4y2Ba
肯特WJ。BLAT——类似blast的对准工具。基因组研究》2002;12:656 - 64。gydF4y2Ba
- 59.gydF4y2Ba
太阳x,刘d,张x,李文,刘H,hong w等人。SLAF-SEQ:使用高通量测序的大规模DE Novo SNP发现和基因分型的高效方法。Plos一个。2013; 8:E58700。gydF4y2Ba
- 60.gydF4y2Ba
张继,张q,程t,杨w,潘h,zhong j等。高密度遗传地图建设和识别观赏木质植物中枕头特征的轨迹(gydF4y2Ba李属却已gydF4y2BaSieb。等Zucc)。DNA Res。2015; 22:183-91。gydF4y2Ba
- 61。gydF4y2Ba
刘D,Ma C,Hong W,Huang L,Liu M,Liu H等。高吞吐量测序数据的施工与分析高密度连杆地图。Plos一个。2014; 9:E98855。gydF4y2Ba
- 62。gydF4y2Ba
吴永强,吴永强,吴永强。基于最小生成树的遗传连锁图谱构建。公共科学图书馆麝猫。2008;4:e1000212。gydF4y2Ba
- 63。gydF4y2Ba
Van Os H, Stam P, Visser RG, Van Eck HJ。SMOOTH:一种从高密度遗传连锁数据中成功去除基因分型错误的统计方法。Theor Appl Genet. 2005; 112:187-94。gydF4y2Ba
- 64。gydF4y2Ba
黄X,赵y,魏x,李c,王a,zhao q等。全球稻草种质收集开花时间和粮食产量的基因组关联研究。NAT Genet。2012; 44:32-9。gydF4y2Ba
- 65。gydF4y2Ba
Kosambi DD。从重组值估计地图距离。安参。1994年; 12:172-5。gydF4y2Ba
- 66。gydF4y2Ba
吴海,吴海涛,吴海涛。R/qtl:试验组合的qtl定位。生物信息学。2003;19:889 - 90。gydF4y2Ba
- 67。gydF4y2Ba
Ashburner M,Ball Ca,Blake Ja,Botstein D,Butler H,Cherry JM等。基因本体:生物学统一的工具。NAT Genet。2000; 25:25-9。gydF4y2Ba
致谢gydF4y2Ba
作者对Peggy Ozias-Akins博士的技术建议和语言改进以及实验站人员在现场管理方面的帮助表示衷心的感谢。gydF4y2Ba
资金gydF4y2Ba
山东省农业科学院访问学者项目提供了财务支持;山东省部门科技育种项目(2017LNZ03,2017LZGC003);山东农业科学院成就计划(2015CGPY03);山东农业科学院农业科技创新项目(CXGC2016B02,CXGC2018E21);青岛民生科学与技术项目(19-6-1-61-NSH)。融资机构在研究设计,数据收集,分析和解释方面没有作用,对公共决定,或写作稿件。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
JC和SZ构思了研究,设计了实验,完成了最终的手稿版本。SZ、XH和HM建立RIL群体,分析数据,进行QTL作图并起草手稿。YC, CW, YS对手稿进行了修改,并对实验实施提出了建议。FC, WY, TX, JZ参与表型数据收集,并准备用于SLAF测序的基因组DNA。LZ进行了SSR基因分型。所有的作者阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1gydF4y2Ba
四种环境下四种种子性状的表型数据集。gydF4y2Ba表S2gydF4y2Ba目前HDGM构造中使用的SSR底漆序列。gydF4y2Ba表S3gydF4y2Ba利用SLAF和SSR标记对RIL系进行基因分型。gydF4y2Ba表S4gydF4y2Ba用于HDGM结构的SLAF和SSR标记的遗传位置(XLS 10089 KB)gydF4y2Ba
附加文件2:表S5gydF4y2Ba
家长和RIL群体的SLAF-seq的数据,gydF4y2Ba表S6gydF4y2Ba亲本和RIL群体SLAF和SNP标记综述gydF4y2Ba图S1gydF4y2Ba不同分离模式的snp数量,gydF4y2Ba图S2gydF4y2Ba每个连锁组与Tifrunner参考基因组共线性分析,gydF4y2Ba图S3gydF4y2Ba比较候选基因和同源基因之间的蛋白质序列gydF4y2Ba拟南芥gydF4y2Ba.(XLS 402 KB)gydF4y2Ba
附加文件3:表S7gydF4y2Ba
QTL区域I内的基因含量。gydF4y2Ba表S8gydF4y2BaQTL区域II内的基因含量。gydF4y2Ba表S9gydF4y2Ba位于两个稳定和多效QTL区(XLS 402 kb)的SNPsgydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
张,S.,Hu,X.,Miao,H.gydF4y2Baet al。gydF4y2Ba基于高密度SLAF-seq遗传图谱的花生种子重量和大小QTL鉴定(gydF4y2Ba花生gydF4y2Bal .)。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba537(2019)。https://doi.org/10.1186/s12870-019-2164-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2164-5gydF4y2Ba
关键词gydF4y2Ba
- 花生gydF4y2Ba
- SLAF-seq的gydF4y2Ba
- 高密度遗传图gydF4y2Ba
- QTLgydF4y2Ba
- 种子重量gydF4y2Ba
- 种子大小gydF4y2Ba