摘要
背景
睡莲(Nymphaea.)杂种繁殖,育种者经常遇到不活性的种子,这使得难以转移所需的或靶向基因的不同Nymphaea.种质。结果表明,受精前障碍是导致杂交失败的主要因素Nymphaea..花粉与柱头低亲和性的机制尚不清楚;因此,我们研究了授粉后0、2和6 h柱头转录本和蛋白质组的差异。此外,一些调控基因和功能蛋白可能导致花粉-雌蕊相容性较低Nymphaea.被确定。
结果
对三种比较进行RNA-SEQ(2 Vs 0 HAP,6 Vs 2 HAP,6 Vs 0 HAP),差异表达基因(DEGS)的数量为8789(4680次上调),6401(3020- 分别 - 分别进行)和11,284(6148次上调)。使用无标记分析,75(2 Vs 0 HAP)蛋白质(43升高,32个降低),九(6 vs 2 Hap)蛋白(三个增加,六个减少),90(6 vs 0 Hap)蛋白质(52增加和38降低)定义为差异表达蛋白质(DEPS)。基因本体学(GO)和京都基因组(KEGG)富集分析显示,矿床和DEPS主要涉及细胞壁组织或生物发生,S-腺苷甲基硫氨酸(SAM)代谢,过氧化氢分解和代谢,反应性氧物种(ROS)新陈代谢,次生新陈代谢,次生代谢物生物合成,和苯丙烷化生物合成。
结论
我们的转录组和蛋白质组分析突出了一些特定的基因,包括ROS代谢、黄酮类化合物的生物合成、SAM代谢、细胞壁组织或生物发生和苯丙类生物合成的基因,这些基因值得进一步研究睡莲花粉-柱头相互作用。本研究加强了我们对紫花苜蓿花粉-雌蕊低亲和性机制的认识Nymphaea.在分子水平上,为克服水稻受精前的障碍提供了理论依据Nymphaea.在未来。
背景
睡莲(Nymphaea.)是重要的开花植物,分布于世界各地,从热带地区到温带地区[1].随着中国经济的快速提高和整体生活质量,新的含水百合杂交种具有不同特征的需求正在增加。因此,有必要以优异的观赏特征培育新的含水百合杂交物。然而,在含水百合杂交种的繁殖中,育种者经常遇到不活性的种子,这使得难以转移各种含水百合种质的所需或靶向基因[2那3.].例如,许多育种者希望通过杂交将热带睡莲的彩色花朵转化为耐寒睡莲;然而,具有蓝色花的耐寒睡莲品种尚未开发出来[4].近年来,我们开展了雌性间种间杂交的研究N.'Peter Slocum'和男性n micrantha连续三年,旨在将父本的颜色基因转移到母本。但是我们也没有获得种子,所以我们从植物生殖生物学的角度进行了深入系统的研究,发现杂交组合失败的主要原因是受精前花粉与柱头的相容性较差[3.].因此,在这项研究中,女性'Peter Slocum'和男性之间的间隙交叉n micrantha正在进行中。我们的目的是进一步揭示在先前研究的基础上在分子水平在分子水平之间呈低相容性的原因。
花粉与耻辱之间的低相容性是一种常见的问题,对植物育种的效率和种子或水果的产量产生负面影响[5那6].因此,在过去的几十年中,许多研究人员进行了研究,以调查导致花粉与耻辱之间相容性低的因素[7那8那9那10.].然而,花粉与耻辱之间的低相容性潜在的机制Nymphaea.仍然知之甚少。
随着分子生物学技术的发展,转录组和蛋白质组学技术的应用可能为寻找花粉与柱头低亲和性相关的基因和蛋白质提供新的途径[11.那12.那13.].特别是,转录组测序是识别新转录本和分析基因表达的一种有用方法[14那15].转录组和蛋白质组学分析已被广泛应用于许多植物物种,但有限的转录组和蛋白质组数据存在于水百合中的受精屏障[16那17].为了在基因组水平上了解睡莲花粉-雌蕊低亲和性的机制,采用Illumina配对端测序和授粉后柱头的无标记分析。通过对转录组和蛋白质组的综合分析,可以进一步深入了解睡莲花粉-雌蕊低亲和性的潜在分子机制,为进一步的研究奠定基础。本研究旨在为深入了解睡莲花粉与柱头的低亲和性提供重要的分子数据,并为克服杂交障碍提供重要线索。
结果
在授粉后的耻辱上的花粉萌发
以前的研究表明,花粉在2个HAP开始发芽,并且在6个HAP观察到花粉管的异常生长[3.].花粉管的数量在6和12 HAP不变,表明已经表达了耻辱中的相关基因,并合成了新的蛋白质,而6小时后没有合成新的蛋白质。因此,收集0,2和6个HAP的耻辱。
在'Peter Slocum'× n micrantha杂交时,2 ~ 6 HAP间无花粉管插入柱头组织。此外,柱头和花粉粒表面之间的蜡质积累也很常见。1一种)。在自授粉的“Peter Slocum”中,花粉晶粒的耻辱和表面在6个Hap时显示出蜡(图。1b)。
转录组学分析和蛋白质组学分析综述
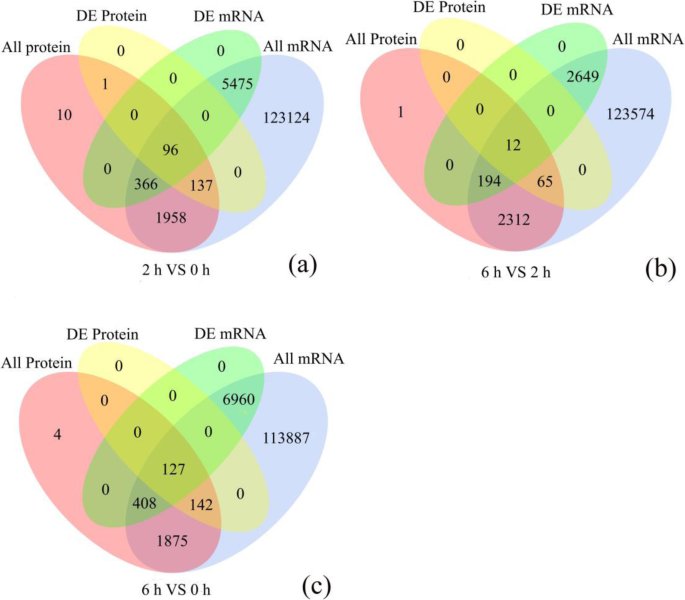
使用每公斤百万(FPKM)的片段,我们探讨了耻辱0,2和6 HAP中的基因表达水平。在三个比较中(2 Vs 0 HAP,6 Vs 2 HAP,6 Vs 0 HAP),DEG的数量为8789(4680次上调),6401(3020个上调),11,284(6148次)(6148分别监管)。DEG的进一步细节在附加文件中呈现1.使用无标签分析,共有3176个蛋白质在1%的错误发现率(FDR)内被鉴定出来(附加文件2).蛋白(2 vs 0 HAP;43个升高,32个降低),9个蛋白(6对2个HAP;3个增加,6个减少),90个蛋白(6个vs 0个HAP;52个增加,38个减少)被定义为dep(附加文件3.).
转录组和蛋白质组数据的比较分析
要识别两种数据集支持的强大途径,我们集成了DEG和DEPS以查找相应的基因和蛋白质,结果列于附加文件中4.dep和deg之间的重叠用维恩图表示。2.具体来说,dep和DEGs之间有相当多的不重叠,这可能是由于蛋白质组检测的相对较低的敏感性。例如,在2和0的HAP比较中,234个差异调节蛋白中,只有96个基因及其对应的蛋白存在差异表达(图2)2一种)。类似地,对于6 Vs 2 Hap和6 Vs 0 Hap比较,分别与相应的Degs相关的DEP的12和127(图。2b,c)。
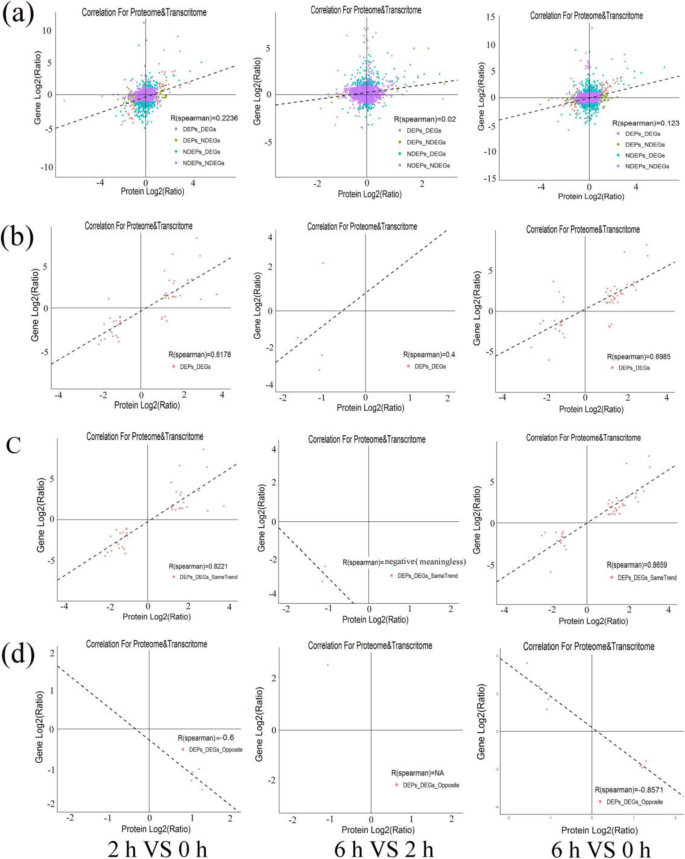
分析了与蛋白质水平和转录水平相关的所有表达数据,并计算了Spearman相关系数。在全球范围内,所有定量蛋白质的相关系数及其相应的基因在2 vs 0 hap,6 vs 2 hap和6 vs 0 hap分别为0.2236,0.02和0.123(图。3.一种)。然而,段落和它们的相应DEP之间存在高的相关性(r= 0.8178, 0.4, 0.6985;无花果。3.b).分析趋势相同或相反的蛋白质及其对应mrna之间的相关性,比较2组与0组、6组与0组之间呈正相关或负相关(图)。3.c和无花果。3.d).然而,我们发现6vs 2hap蛋白与其相应mrna之间的相关性较差,且趋势相同或相反(图)。3.c和无花果。3.d)。在Correlation-DEGs-DEPs (cor-DEGs-DEPs)基因,39(2比0 HAP),三(6 vs 2 HAP)和41 (6 vs 0 HAP)基因有相同的趋势,而五(2比0 HAP),一个(6 vs 2 HAP), 7 (6 vs 0 HAP)基因(附加文件了相反的趋势5).因此,我们建议其中一些Cor-Degs-Deps基因可能在含水百合繁殖期间引起低花粉雌蕊相容性的重要作用。
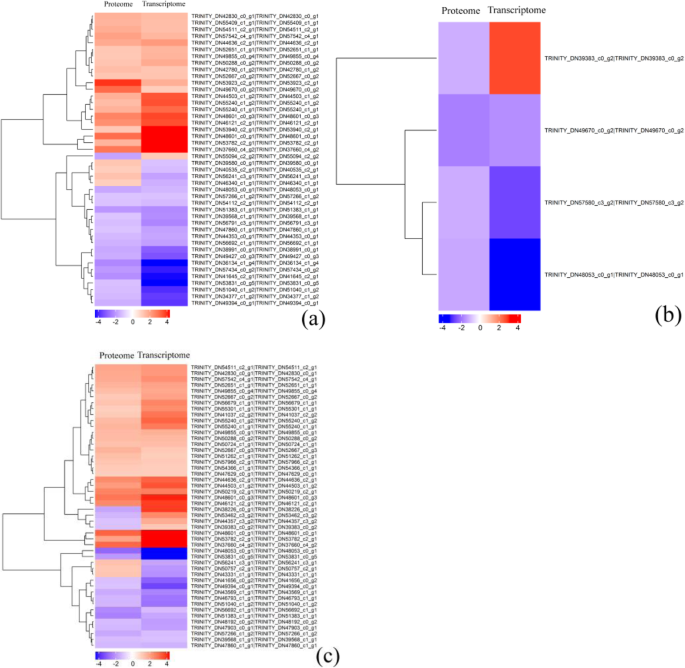
cor-DEGs-DEPs基因表达模式的聚类分析
对DEPs及其相应的DEGs进行聚类分析,可以直观地显示其表达模式,结果如图所示。4.聚类分析表明,44(2比0 HAP),四(6 vs 2 HAP), 48 (6 vs 0 HAP) DEPs与mRNA丰度的变化,39(2比0 HAP),三(6 vs 2 HAP), 41 (6 vs 0 HAP) DEPs与相应的度。然而,5 (2 vs 0 HAP)、1 (6 vs 2 HAP)和7 (6 vs 0 HAP) DEPS的mRNA表达模式与之相反。共25个cor-DEGs-DEPs基因在2 vs 0 HAP和6 vs 0 HAP的表达模式相同;因此,我们推测这些基因可能导致睡莲种间杂交花粉-雌蕊相容性较低。
Cor-Degs-Deps基因的GO和途径富集分析
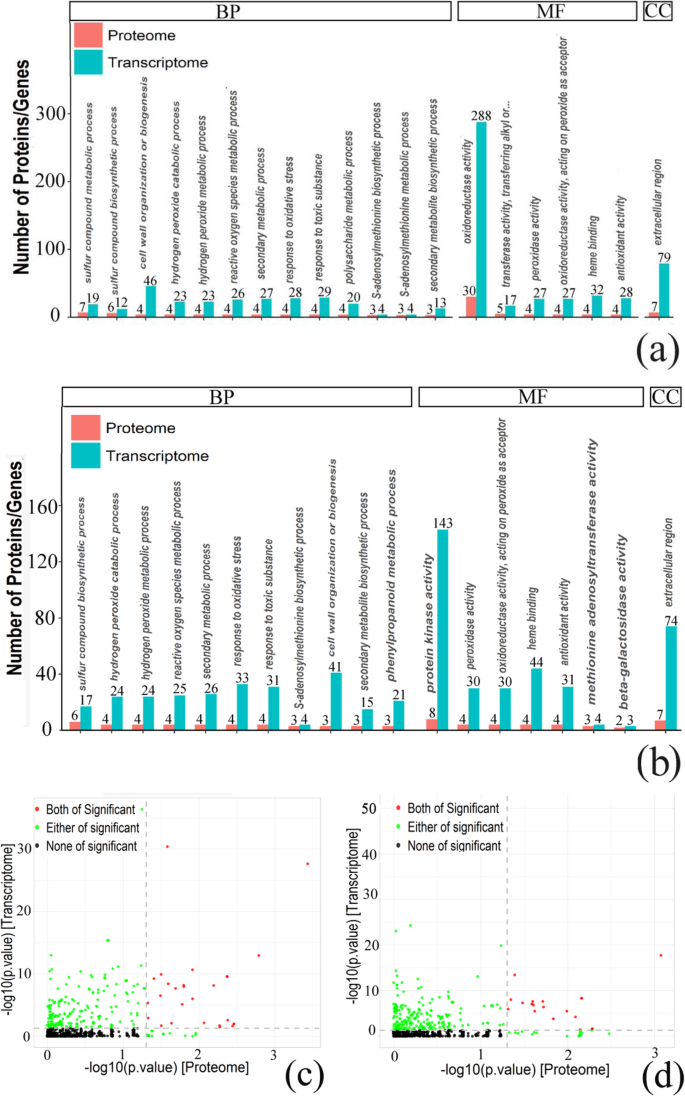
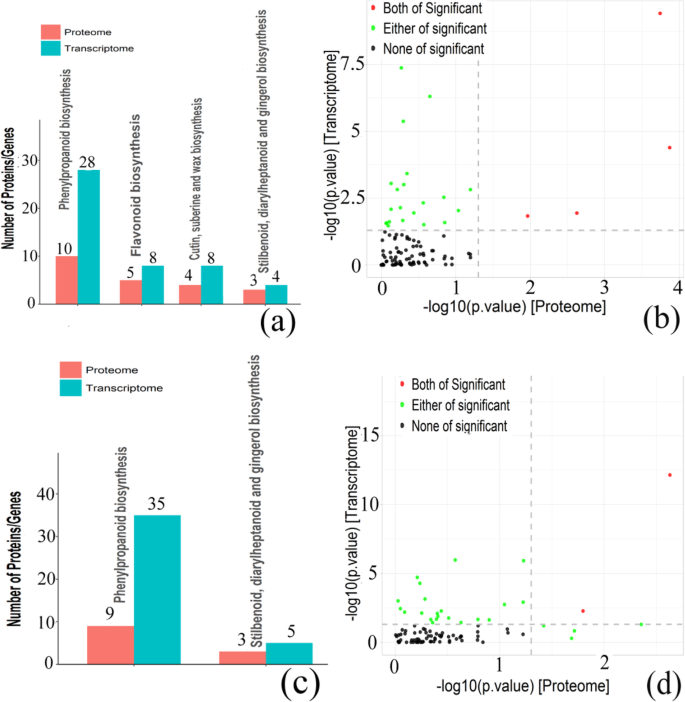
在获得cor-DEGs-DEPs基因在2 vs 0 HAP、6 vs 2 HAP、6 vs 0 HAP下的表达信息后,对这些基因进行GO功能注释分析(表)1;表格2).结果表明,27 (2 vs 0 HAP)、0 (6 vs 2 HAP)、19 (6 vs 0 HAP)氧化石墨烯在mRNA和蛋白水平上均高度富集(图2)。5;额外的文件6).在2 vs 0 HAP和6 vs 0 HAP中,在细胞成分类别中确定的子类别是细胞外区域。在分子功能分类中,以过氧化物酶活性、血红素结合活性、抗氧化活性、以过氧化物为受体作用于过氧化物为受体的氧化还原酶活性最为丰富,分别为2 vs 0和6 vs 0。在2 vs 0和6 vs 0 HAP中鉴定出的最丰富的生物过程类别为细胞壁组织或生物发生、苯丙类代谢过程、硫化合物生物合成过程、过氧化氢分解过程和ROS代谢过程。此外,在6vs 2 HAP的cor-DEGs-DEPs基因中没有显著富集氧化石墨烯。
Kegg途径分析可以帮助我们进一步了解Cor-Degs-Deps基因中涉及的生物化学代谢途径和信号转导途径(图。6;表格1;表格2;额外的文件7).结果表明,在2Vs 0HAP和6 Vs 0 Hap中,在包括苯丙烷化生物合成(KO00940)和斯蒂替肽,二芳基酸和姜黄生物合成(KO00945)的MRNA和蛋白质水平的高度富集。对于2 vs 0 hap,Cutin,Suberin和Wax生物合成(KO00073)和黄酮类生物合成(KO00941)的Cor-Deps-Deps基因在蛋白质组和转录组中是显着的途径。此外,在6 vs 2 hap的Cor-Deps-Deps基因中没有显着富集Kegg途径。
平行反应监测(PRM)分析
选择4个差异表达蛋白(主要与类黄酮生物合成、过氧化物酶活性和苯丙素生物合成相关)进行PRM分析。根据4个目标蛋白对应肽段在0、2、6 HAP柱头肽混合物中的相对表达量,得到目标蛋白的相对表达量差异(表1)3.).详细的蛋白质定量信息和显着的差异分析结果显示在附加文件中8.本分析结果表明,4个靶蛋白在2 vs 0和6 vs 0 HAP的比较中表达量明显上调,而在6 vs 2 HAP的比较中表达量无明显变化。PRM分析结果表明,4个候选蛋白与未标记的结果具有相似的趋势,这支持了蛋白质组学数据的可信度。
讨论
睡莲育种过程中花粉-雌蕊相容性低与活性氧代谢有关
在本研究中,转录组和蛋白质组联合分析表明,在2和0 HAP和6和0 HAP的比较中,柱头上与ROS代谢相关的基因和蛋白表达显著增加,提示ROS可能参与了睡莲授粉后花粉与柱头间相互作用的调控。ROS参与许多花粉相关过程,如绒毡层和花粉发育[18那19那20.],体外花粉萌发[21]、花粉管顶端的生长[22那23那24],花粉管的破裂释放精子[25和自交不亲和性[26].活性氧在花粉管生长中的作用已被证实,但其在花粉萌发早期的作用尚不清楚。柱头上ROS和过氧化氢的生物学功能可能涉及花粉与柱头相互作用中的某些信号交联[27那28].大量实验表明,成熟的花粉粒产生大量的一氧化氮(NO),这抑制了柱头乳头细胞中ROS的产生[27那29那30.].ROS和NO在花粉管生长过程中相互排斥,提示这些信号分子在花粉管生长过程中可能存在协同机制[31];这表明来自花粉的耻辱和否的ROS参与花粉 - 耻辱互动作为信号分子[32].此外,ROS主要由柱头上的过氧化氢组成,柱头具有独特的物理化学性质和在细胞中的稳定性,被认为是最重要的氧化还原信号分子。过氧化氢可以氧化靶蛋白半胱氨酸的硫醇基团,从而改变蛋白质的结构和功能[33].
然而,ROS在授粉后花粉与液百合鲜百合颗粒之间的相互作用的调节机制尚不清楚。我们推断授粉后的低花粉雌蕊相容性是由于耻辱中ROS水平的变化。ROS可以充当信号分子,以氧化下游靶蛋白。氧化靶蛋白不能正常工作,影响耻骨表面上的花粉萌发。因此,耻辱上的ROS的代谢过程可能与花粉与水百合的耻辱之间的相互作用有关。
柱头类黄酮对睡莲花粉-雌蕊低亲和性的影响
类黄酮是维管植物中常见的次生代谢物,可以影响植物的生理、生长和发育[34那35].黄酮类化合物主要参与植物共生、抗病虫害、生长素运输、种子和花粉萌发、根系发育等生理过程。黄酮类化合物是花粉萌发和刺激某些植物花粉管生长所必需的[36那37].利用烟草未成熟花粉离体培养产生的花粉(尼科尼亚塔哈瓦姆和矮牵牛花(矮牵牛织布达)为原料,在萌发培养基中添加黄酮醇(槲皮素、山奈酚、杨梅素)可显著促进花粉萌发频率和离体花粉管生长[36].同样,矮牵牛类黄酮缺乏突变体的花粉不能在柱头上萌发,但外源类黄酮山奈酚的添加可以诱导柱头上花粉萌发。这表明山奈酚可能在花粉萌发中起作用[37].在这项研究中,我们的转录组和蛋白质组分析表明,在0个HAP和2和6 HAP时,在0个HAP和柱塞之间与黄酮类生物合成相关的基因和蛋白质存在显着差异。例如,授粉后Stigmas中的黄酮合成酶的表达和含量低于未加长的柱头,这表明授粉后颗粒上的黄酮含量大大降低。此外,黄酮类化合物可以影响植物生殖和发育过程,并参与花粉与耻辱之间的相互作用[38那39].对水稻柱头的其他转录组学研究表明,水稻柱头上有大量编码黄酮醇的基因表达,这些基因都在水稻柱头上表达,表明黄酮在花粉与柱头的相互作用中发挥着重要作用[38].因此,我们推断黄酮类化合物的生物合成与含水百合繁殖期间的低花粉雌蕊相容性密切相关。
SAM代谢对睡莲花粉-雌蕊低亲和性的影响
SAM参与许多重要的生理过程,如植物中丙基、甲基和硫的转胺作用,是蛋氨酸代谢的主要枢纽[40那41].本研究结果表明,SAM合酶基因在授粉过程中上调。SAM也可用作乙烯和多胺的前体[42].此外,适当浓度的多胺对花粉萌发和花粉管生长也很重要[43].类似地,先前的一项研究表明,乙烯在烟草授粉后花粉管的生长中起着重要作用[44].我们推断通过授粉诱导的S-腺苷聚氨酯合成和代谢相关的基因的上调可促进通过耻辱乳头细胞合成多胺和乙烯,然后调节花粉萌发和花粉管生长。因此,推测SAM的代谢途径参与水百合的花粉和耻辱之间的相互作用,并在花粉 - 耻骨相互作用的调节机制中起着重要作用。
在睡莲育种过程中,细胞壁组织或生物发生与花粉-雌蕊相容性低有关
在花粉和耻骨之间的相互作用期间,通过某些信号激活并释放耻骨乳头细胞中的一些酶。这些酶主要涉及改性细胞壁,例如降解果胶,纤维素和半纤维素的酶[45那46那47].在我们的研究中,转录组和蛋白质组联合分析表明,授粉后2和6 h柱头上发现了许多参与细胞壁组织代谢的DEGs,表明参与细胞壁合成的基因是由授粉诱导的。对许多物种柱头的转录组研究证实,柱头中存在大量细胞壁代谢相关基因[48那49那50,这些基因的产物可能由柱头乳头分泌,帮助花粉管穿透柱头。此外,GO注释显示,参与纤维素水解的内切葡聚糖酶表达显著下调,而参与细胞壁修饰的beta-半乳糖苷酶和木葡聚糖内转葡糖苷酶/水解酶基因表达显著上调。因此,我们推测-半乳糖苷酶可能参与了纤维素的合成和细胞壁的伸长Nymphaea.观念(51],而木葡聚糖内甘油糖苷基酶/水解酶主要涉及细胞壁增强[52].Kegg分析表明,Cutin,Suberin和Wax生物合成中所涉及的基因表达丰度显着增加,这导致Cutin,Suberin和蜡沉积在柱塞细胞的细胞壁上,从而增加了细胞壁强度[53].参与苯丙素生物合成的关键基因的显著上调进一步证实了水莲柱头授粉后细胞壁木质素的积累,因为木质素生物合成与苯丙素生物合成密切相关[54].我们推断Cutin,Suberin和蜡在细胞壁上的积累增强了细胞壁的强度和厚度,从而阻碍了耻骨上的花粉萌发。因此,细胞壁组织或生物发生与低花粉伴随相容性密切相关Nymphaea.物种。
花粉-雌蕊相容性低的其他酶Nymphaea.SPP.
在这项研究中,转录组和蛋白质组的组合分析表明,授粉后过氧化物酶的活性显着增加。过氧化物酶主要去除过氧化物并参与应力反应,养蛋白代谢和信号转导[27].已有研究表明,成熟柱头的过氧化物酶活性显著增加,在柱头发育到对花粉最易接受的时候达到最高,这是野外常用的判断柱头成熟度的方法[49].MC Innis是第一个发现耻骨特异性过氧化物酶的方法,其具有细胞特异性和特异性表达模式,并在耻骨表皮细胞的细胞质和细胞表面中特别表达[27].根据我们的研究结果和之前发表的论文,我们推断在花粉和柱头相互作用的过程中Nymphaea.,过氧化物酶可能直接参与柱头与花粉相互识别的过程,可能引导花粉管。
谷胱甘肽S-转移酶(GST)是一种普遍存在的酶,其调节植物次生代谢,排毒和防御,并在对压力的反应中起重要作用[55].前期对玉米的研究表明,GST在丝-花粉互作和花粉管萌发的早期表达上调[56].GST在本研究中也上调。GST可能参与了花粉与柱头的相互作用Nymphaea.,但其参与机制需要进一步研究。
细胞色素P450具有广泛的催化活性。它主要参与三萜类化合物,生物碱,甾醇,脂肪酸,植物激素,信号分子,苯基丙烷,黄酮类和异黄酮的合成和代谢[57].我们的研究结果表明,细胞色素P450的表达显着增加。我们推导过细胞色素P450参与苯丙醇丙烷和黄酮类生物合成的方法,间接地参与含水百合的花粉 - 耻骨相互作用。
丝裂原激活的蛋白激酶(MAPK)是真核生物中的进化保守的丝氨酸/苏氨酸蛋白激酶。它负责调节细胞之间的信号转导,并扩增来自外部细胞的刺激信号,诱导受体细胞中适当的生理和生化反应[58].在本研究中,我们发现睡莲授粉后柱头上MAPK的表达量显著增加。推测MAPK在睡莲花粉-柱头相互作用中起信号传导作用,并在花粉-雌蕊低亲和性复杂网络的调控中起重要作用。
结论
在本文中,比较了授粉后0,2和6小时颗粒转录物和蛋白质蛋白质的差异,导致某些调节基因和功能蛋白质可能导致含水百合施用预施用障碍。功能分析表明,差异转录物主要涉及细胞壁组织或生物发生,SAM,过氧化氢分解和代谢,ROS代谢,次生代谢,次生代谢物生物合成和苯丙烷化生物合成。我们的转录组和蛋白质组分析突出了一些特定的基因,包括ROS代谢、黄酮类化合物的生物合成、SAM代谢、细胞壁组织或生物发生和苯丙类生物合成的基因,这些基因值得进一步研究睡莲花粉-柱头相互作用。本研究加强了我们对紫花苜蓿花粉-雌蕊低亲和性机制的认识Nymphaea.在分子水平上,为克服水稻受精前的障碍提供了理论依据Nymphaea.在未来。
方法
实验材料
雌性之间的种间杂交N.'Peter Slocum'和男性n micrantha如前一份报告所述进行[3.].自我授粉的“彼得·斯洛克姆”和n micrantha是成功的。另外,“Peter Slocum”的染色体数为84 (2n = 6x)n micrantha染色体数目为56 (2n = 4x) [3.].这些植物生长在中国江苏省镇江市兴乡的池塘里。这些植物采自中国科学院上海辰山植物科学研究中心。
收集0,2和6个HAP的耻辱。每种治疗有三种生物重复。将0 HAP(新鲜雄性母母花粉置于耻骨上)的柱子作为对照,用2和6个Hap的柱塞作为治疗,以动态研究授粉后花粉和柱头之间的相互作用。在收集后,三个样品,0 HAP的柱塞,2个HAP的柱塞和6个HAP的柱塞,在液氮中冷冻并储存在-80℃。
高吞吐量RNA-SEQ和数据处理
根据制造商的协议(Takara Bio Inc.,Otsu,Japan),使用Trizol试剂提取总RNA。使用Agilent 2100 BioAnalyzer(Agilent Technologies,USA)检查总RNA的质量和数量。通过寡聚(DT)磁珠富集mRNA样品,然后在80℃下切成碎片缓冲液的片段。用随机六聚体作为引物合成第一条cDNA。RNase H,DNTPS和DNA聚合酶I用于使用第一链作为模板合成第二链CDNA。在纯化和结束修复后,将适配器序列和双链DNA多A连接到CDNA的末端。选择片段大小并使用Agilent 2100生物分析仪进行质量检测后,通过PCR扩增构建cDNA文库。最后,使用Illumina Hiseq 2500系统来序列序列序列。使用三种生物重复在涉及每个样品的RNA-SEQ实验中,并作为单独的文库测序。
首先使用fastp软件对fasta格式的原始数据(原始读取)进行过滤。在此步骤中,通过删除包含适配器的读、包含ploy-N的读和来自原始数据的低质量读,可以获得干净数据(干净读)。同时计算干净数据的Q20、Q30和GC含量。所有的下游分析都是基于高质量的干净数据。抄本由Trinity (http://trinityrnaseq.github.io)。使用某个重叠长度的清洁读数最初被合并为没有n(称为contigs)的长片段。TGICL软件用于群集相关的Contig,以获取在删除冗余之后无法在两端扩展的未延长的Unigenes(没有n),并且在删除冗余之后获取非冗余的未完成[59].所有unigenes的功能注释使用BLAST搜索(http://blast.ncbi.nlm.nih.gov/Blast.cgi)查询GO、Pfam、KEGG、Nr和Swiss-Prot数据库。
使用三位一体获得的未来用作参考序列,并通过使用RSEM软件中的Bowtie 2的默认参数将每个样品的清洁读数与参考序列进行比较。Bowtie2比较的结果通过RSEM进行统计分析,并进一步获得与每个基因相比每个样品的读数数,并将读数的数量转化为FPKM,然后分析基因表达水平。FPKM(每百万次映射读数的每千碱基碎片)方法消除了基因长度和测序深度对基因表达计算的影响。与FPKM值相比,样品之间的基因表达的差异。通过使用DESEQ封装获得DEGS识别的“基本平均值”值。日志的绝对值2ratio≥1,FDR≤0.01为两样本基因表达差异显著的阈值。
使用BLAST 2 GO程序进行DEGS的功能注释和分类(https://www.blast2go.com/)[60].此外,KEGG通路分析(https://www.genome.jp/kegg/)执行。热图是使用Cluster 3.0和treeview生成的。
标记水百合耻辱蛋白质组的免费分析
蛋白质提取和多肽酶解
使用SDT(4%SDS,100mM DTT,150mM Tris-HCl pH 8.0)方法进行蛋白质提取。用BCA蛋白质测定试剂盒(Bio-rad,USA)量化蛋白质浓度,并将样品储存在-80℃。使用Wisniewski描述的过滤辅助蛋白质组制备程序进行蛋白质消化(每个样品的200μg)[61].将来自每个样品的肽在C18盒上脱盐,通过真空离心浓缩,并以40μl001%(v / v)甲酸重构。
MS / MS蛋白质识别和量化
N对各肽段进行anoLC-MS/MS分析。我们第一次加载肽混合物在反相器列(热费希尔科学好评PepMap100 100μm×2厘米,nanoViper C18)连接到C18-reversed相分析柱(热费希尔科学简单列,75μm内径,长10厘米,3μm, C18-A2)在缓冲甲酸(0.1%),用缓冲液B(0.1%甲酸,84%乙腈)在intelliFlow技术控制的流速为300 nL / min下进行线性梯度分离。
LC-MS / MS分析是在Q辐射质谱仪(Thermo Fisher Scientific)上进行的,与Easy NLC(Proxeon Biosystems,现在Thermo Fisher Scientific)相结合,持续240分钟。在正离子模式下操作质谱仪。通过数据依赖性TOP10方法获得MS数据,并从测量扫描(300-1800m / z)动态地选择最丰富的前体离子,以获得更高的碰撞能量解离(HCD)片段。自动增益控制目标,最大喷射时间和动态排除持续时间设置为1E6分别为50毫秒和60.0秒。测量扫描以200m / z的70,000分辨率获得;将HCD光谱分辨率设定为17,500,在200m / z,归一化碰撞能量为30eV,隔离宽度为2米/ z,填充率为0.1%。
使用MaxQuant1.5.3.17软件进行MS原始文件进行蛋白质识别[62].在这项研究中,我们基于从上述转录组数据库转换的预测蛋白质数据库搜索所获取的MS / MS光谱。最大FDR和最小肽长度分别设定为肽和蛋白的1%和六个氨基酸。如下所述设置其他参数:酶=胰蛋白酶;Max错过了裂解= 2;固定修饰:氨基甲酰基(C);肽质量耐受=±20 ppm;可变改性:氧化(M),乙酰基(蛋白质N-术语)。蛋白质量化由独特的肽和“剃刀”测定[62那63[和标签免费定量计算进行了[64].对于每个片段,肽在基于质量和保留时间(在MaxQuant中设置匹配选项)的不同LC-MS/MS操作中使用2分钟时间窗口进行匹配。
DEPs被分析为显著上调或下调。定量上,以2.0倍的临界值确定上调蛋白和下调蛋白,至少2个重复p- 值<0.05。
生物信息学分析
在无标签分析中,每个样品重复三次。为了研究差异表达蛋白对不同生物过程的影响,我们对GO和KEGG进行了富集分析。Go和KEGG采用Fisher’s exact test进行富集,以整个定量蛋白注释作为背景数据集。Benjamini-Hochberg经过多次试验进行了修改,使其推导出p- 可以调整值[65].只有p值<0.05的通路和功能分类被认为是有意义的。
转录组学和蛋白质组学的相关分析
在比较组中,如果一个基因及其对应的蛋白表达,则认为该基因及其对应的蛋白是相关的。接下来,我们确定了对照组相关基因和蛋白的显著表达。如果一个基因及其相应的蛋白在比较组中显著表达,则将其命名为cor-DEGs-DEPs。然后对corg - degs - deps进行GO和KEGG富集分析,计算Spearman相关系数。
人口、难民和移民事务局分析
针对PRM分析的靶肽的选择
用胰蛋白酶制备无标记分析的9个样品的肽混合物。收集各样品中的等效肽,将2 μg样品通过捕获柱(5 μm- c18, 100 μm × 50 mm)和分析柱(3 μm- c18, 75 μm × 200 mm)引入高效液相色谱系统。然后,用Q-Exactive质谱仪(Thermo Fisher Scientific)对分离的多肽进行分析。使用Maxquant 1.5.3.17软件分析原始文件(missing cleavage = 0, enzyme = trypsin/P)。得分在40以上的肽被认为是目标肽。
靶蛋白的定量PRM分析
我们选择了来自四个DEP的八个靶肽,以进行PRM定量分析。我们将肽保留时间校准混合物添加到肽混合物中并使用标记的肽“TaseFdsaiaqd”K“(大胆”K“为重型同位素标记)作为内标。我们首先将2μg肽混合物用HPLC分离成20个Fmol标记的肽,然后通过Q-辐射质谱仪分析它们。进行了三次重复定量分析,并用天际线3.5.0软件计算原始数据。
数据和材料的可用性
来自三个样品的原始数据已分别提交给国家生物技术信息中心(NCBI),注册编号为PRJNA548276。
缩写
- Cor-Degs-Deps:
-
Correlation-DEGs-DEPs
- 度:
-
差异表达基因
- DEPS:
-
差异表达的蛋白质
- FPKM:
-
碎片每千碱基百万
- 走:
-
基因本体论
- 销售税:
-
谷胱甘肽S-transferase
- 机会:
-
小时后授粉
- KEGG:
-
京都基因和基因组百科全书
- LC-PRM /女士:
-
液相色谱 - 平行反应监测/质谱
- MAPK:
-
增殖蛋白激酶
- ndegs:
-
基因没有显着差异
- NDEPs:
-
蛋白表达无明显差异
- 没有:
-
一氧化氮
- 人口、难民和移民事务局:
-
并行反应监测
- RNA-SEQ:
-
RNA序列
- ROS:
-
反应性氧气
- 山姆:
-
S-腺苷甲硫氨酸代谢
参考文献
- 1。
黄阁,邓议会,李泽,李·林百合。北京:中国林业出版社;2009年。
- 2.
孙cq,ma zh。Sun GS,Dai ZL,Teng NJ,Pan YP。含水百合(Nymphaea SPP)的栽培品种繁殖障碍的细胞机制。Hortic SCI。2015;50:30-35。
- 3.
Sun CQ,Ma Z,张ZC,Sun GS,Dai ZL。影响水百合三种杂交中跨屏障的因素。J AM Soc Hortic SCI。2018; 143(2):1-6。
- 4.
在睡莲属亚属间杂交,培育耐蓝睡莲。Sci Hortic。2010;124:475 - 81。
- 5.
孙春青,陈芳,滕乃杰,刘志林,方文敏,侯小林。影响杂交结实率的因素dendranthema grandiflorum(拉马特)KINAMURA及其野生物种。Euphytica。2010; 171:181-92。
- 6.
滕乃杰,王玉玲,孙长青,方文敏,陈fd。水莲品种杂交繁殖的影响因素。BMC Plant Biol. 2012;12:82。
- 7。
花粉和雌蕊在生殖阶段中的作用。性植物再生2001;14:41-55。
- 8。
Ram SG, Ramakrishnan SH, Thiruvengadam V, Bapu JRK。陆地棉与四种二倍体野生种种间杂交的优先化障碍。植物品种。2008;127:295 - 300。
- 9.
Ram SG,SundaravelPandian K,Kumar M,Vinod Kk,Bapu JRK,Raveendran Ts。花粉 - 裂解物在胞间晶段互相杂交中的相互作用。Euphytica。2006; 152:379-85。
- 10。
Mazzucato A, Olimpieri I, Ciampolini F, Cresti M, Soressi GP。在单性果型番茄突变体中,花粉-雌蕊相互作用缺陷导致种子结实率下降。性植物再生2003;16:157-64。
- 11.
RNA-Seq:转录组学的革命性工具。Nat Rev Genet, 2009; 10:57-63。
- 12.
关键词:褪黑激素,番茄,果实成熟,花青素积累,无标记差异蛋白质组学,差异蛋白质组学中国海洋大学学报(自然科学版)2016;61(2):138-53。
- 13.
Ma Dy,Huang X,Hou JF,Ma Y,Han QX,Hou Gg,Wang Cy,Guo Tc。谷物淀粉蛋白蛋白质组的定量分析显示出两级籽粒发育的两种小麦品种之间代谢的差异。BMC基因组学。2018; 19:768。
- 14.
Rawarison E,Rigault P,Caron S,Poulin Pl,Boyle B,Verta JP,Giguèrei,Bomal C,Bohlmann J,Mackay J.转录组概况在针叶树和PiceagenExpress数据库中,显示基因家族内的多样化模式和血管间的间隙保护。基因表达。BMC基因组学。2012; 13:434。
- 15.
邱志斌,万凌龙,陈涛,万永林,何新强,卢顺峰,王永文,刘建新。杉木形成层活性的调节涉及广泛的转录组重塑。新植醇。2013;199:708-19。
- 16.
Sheoran是,Pedersen EJ,Ross Ar,Sawhney VK。油菜籽(Brassica Napus)花粉萌发过程中蛋白质表达的动态。Planta。2009; 230(4):779-93。
- 17。
关键词:油菜,花粉,自交不亲和反应,柱头蛋白,蛋白质组学,微管动力学细胞蛋白质组学。2011;10(12):111-3。
- 18。
胡丽,梁伟,尹超,崔新,宗杰,王旭,胡杰,张东东。水稻MADS3对花药发育后期ROS稳态的调控。植物细胞。2011;23:515-33。
- 19。
罗丹,徐华,刘震,郭军,李华,陈丽,方超,张强,白明,姚楠。水稻细胞质雄性不育的一个有害线粒体-核相互作用机制。Nat麝猫。2013;45:573-7。
- 20。
谢HT,万泽,李S,张玉,NADPH氧化酶的活性氧量的时尚生产对于拟南芥中的塔皮特编程细胞死亡和花粉发育至关重要。植物细胞。2014; 26:2007-23。
- 21。
Speranza A, Crinelli R, Scoccianti V, Geitmann A.活性氧参与猕猴桃花粉管的形成。植物医学杂志。2012;14:64 - 76。
- 22。
NADPH氧化酶产生的活性氧参与花粉管的生长。新植醇。2007;174:742-51。
- 23。
Kaya H,Nakajima R,Iwano M,Kanaoka MM,Kimura S,Takeda S,Kawarazaki T,Senzaki E,Higashiyama T.Ca2 + -Activated反应性氧气由Arabidopsis RboHH和RBOHJ生产对于适当的花粉管尖头增长至关重要.植物细胞。2014; 26:1069-80。
- 24.
Lassig R,Gutermuth T,BEY TD,KONRAD KR,Romeis T.花粉管NAD(P)H氧化酶作为偏振细胞生长期间抑制生长速率振荡的速度控制。工厂J. 2014; 78:94-106。
- 25.
段琪,Kita D, Johnson EA, Aggarwal M, Gates L, Wu HM,张AY。活性氧介导花粉管破裂释放精子供拟南芥受精。Nat Commun。2014;5:3129。
- 26.
Wilkins Ka,Bancroft J,Bosch M,Ensing J,Smirnoff N,Franklin-Tong Ve。反应性氧物种和一氧化氮在罂粟的自我不相容反应中介导肌动蛋白重组和编程细胞死亡。植物理性。2011; 156:404-16。
- 27.
Mc Innis Sm,emery DC,Porter R,Desikan R,Hancock JT,Hiscock SJ。耻辱过氧化物酶在开花植物中的作用:来自来自Senecio squalidus(菊科)的耻骨特异性过氧化物酶(SSP)的进一步表征的见解。J Exp Bot。2006; 57(8):1835-46。
- 28.
Hiscock SJ, Bright J, Mcinnis SM, Desikan R, Hancock JT。柱头上的信号:ROS和NO在植物细胞信号转导中的潜在新作用。植物信号学报。2007;2(1):23-4。
- 29.
布莱特J,希斯科克SJ,詹姆斯PE,汉考克JT。花粉产生一氧化氮和亚硝酸盐:可能与花粉诱导的过敏反应有关。植物生理生化学报。2009;47(1):49-55。
- 30。
Zafra A,RodríguezgarcíaMi,AlchéJD。花卉发育过程中橄榄繁殖组织中ROS的细胞定位。BMC植物BIOL。2010; 10(1):36。
- 31。
Popescu Sc,Popescu GV,Bachan S,Zhang Z,Seay M,Gerstein M,Snyder M,Dinesh-Kumar S.通过高密度透露钙调素相关蛋白与其目标的差异结合拟南芥蛋白质微阵列。中国科学院院刊2007;104:4730-5。
- 32。
活性氧和一氧化氮的积累和清除与向日葵柱头成熟和花粉-柱头相互作用相关。植物生理学报。2013;35(9):2777-87。
- 33。
田y,粉丝,秦z,lv h,王m,张z,周文,赵n,李x,韩c,丁z,王w,王泽。过氧化氢通过氧化铜唑抗性1转录因子呈染色来调节铜鳞状信号传导。NAT Communce。2018; 9:1063。
- 34。
Winkel-Shirley B. flavonoid生物合成。遗传学,生物化学,细胞生物学和生物技术的彩色模型。植物理性。2001; 126(2):485-93。
- 35。
蔡志强,王志强,王志强,等。苯丙代谢调控基因的全基因组分析杨树.新植物。2006; 172(1):47-62。
- 36.
Ylstra B,Touraev A,Moreno RM,Stögere,范文纳AJ,Vicente O,Mol JN,Hebberle-Bors E.Flavonols刺激烟草花粉的发育,萌发和管生长。植物理性。1992; 100:902-7。
- 37.
Mo Y,Nagel C,Taylor LP。Cholcole合成酶突变体的生化辅作定义了功能性花粉中黄酮的作用。PROC NATL ACAD SCI。1992年; 89:7213-7。
- 38.
李敏,徐伟,杨伟,孔志强,薛玉梅。水稻柱头基因组表达谱分析。植物杂志。2007;144:1797 - 812。
- 39.
张AY, Wu HM, Di Stilio V, Glaven R, Chen C, Wong E, Ogdahl J, Estavillo A. Pollen-pistil interantiongs .张AY, Wu HM, Di Stilio V, Glaven R, Chen C, Wong E, Ogdahl J, Estavillo a尼科尼亚塔哈瓦姆.安机器人。2000;85 (S1): 29-37。
- 40。
沉B,Li C,Tarczynski MC。高自由蛋氨酸和降低木质素含量由突变产生拟南芥s -腺苷- l-蛋氨酸合成酶3基因。植物j . 2002; 29(3): 371 - 80。
- 41。
Martinez-Lópezn,瓦雷拉·雷比姆,ariz u,embade n,Vazquez-chantada M,Fernandez-ramos D,Gomez-Santos L,Lu Sc,Mato JM,Martinez-Chantar ML。S-腺苷甲硫氨酸和增殖:新途径,新目标。Biochem Soc Trans。2008; 36(5):848-52。
- 42。
Roje S. s -腺苷- l-蛋氨酸:超越通用甲基组供体。植物化学。2006;67(15):1686 - 98。
- 43。
研究了温度、多胺及多胺合成抑制剂对紫花苜蓿花粉体外萌发和花粉管生长的影响李春万.Sci Hortic。2004;99(3 - 4):289 - 99。
- 44。
马提尼酒,科蒂C,海克尔SL.乙烯对花粉管生长的响应尼科尼亚塔哈瓦姆花朵。Planta。2002; 214(5):806-12。
- 45。
田GW,陈MH,Zaltsman A,Citovsky V. Pollen特异性果胶甲基酯酶参与花粉管生长。Dev Biol。2006; 294:83-91。
- 46。
金俊,邵绍华,李文华,李文华。植物多半乳糖醛酸酶基因家族扩增和表达差异的模式。基因组医学杂志。2006;9:87。
- 47。
孙达夫,黄阿。玉米花粉外皮木聚糖酶在有性繁殖过程中促进花粉管渗透到丝中。生物化学学报。2007;282:625-36。
- 48.
王志强,王志强拟南芥柱头组织识别柱头特异基因。植物生殖学报2005;18:163-71。
- 49.
Tung CW,Dwyer Kg,Nasrallah Me,Nasrallah JB。基因组 - 基因鉴定拟南芥雌蕊特别沿着花粉管生长的路径。植物杂志。2005;138:977 - 89。
- 50.
Quiapim Ac,Brito MS,Bernardes La,Dasilva I,Malavazi I,De Paoli HC,Molfetta-Machado JB,Giuliatti S,Goldman GH,Goldman MH。分析对尼科尼亚塔哈瓦姆耻辱/风格转录组揭示了湿污染物和干燥柱塞之间的基因表达差异。植物理性。2009; 149:1211-30。
- 51。
Roach MJ, Mokshina NY, Badhan A, Snegireva AV, Hobson N, Deyholos MK, Gorshkova TA。亚麻纤维纤维次生壁的发育需要-半乳糖苷酶。植物杂志。2011;156:1351 - 63。
- 52。
木葡聚糖内转糖基化酶:基因、酶和潜在壁修饰功能的多样性。植物科学进展,1999;4(9):361-6。
- 53。
Huckelhoven R.细胞壁相关的抗病抗性机制。Annu Rev phytopathol。2007; 45:101-27。
- 54。
伯纳德马。阐明软木脂。Can J Bot. 2002; 80:227-40。
- 55。
Dixon DP,Skipsey M,Edwards R.谷胱甘肽转移酶的作用中植物次生新陈代谢。植物化学。2010; 71:338-50。
- 56。
刘洪辉,王丽伟,刘旭,马旭,宁丽华,张辉,崔德志,姜超,陈海波。玉米早期花粉-丝相互作用的蛋白质组学分析。中国农业科学,2010;43(24):5000-8。
- 57。
张志强,王志强,王志强。p450基因的功能基因组学研究。植物学报2003;54:629-67。
- 58。
植物中的M.丝裂原激活蛋白激酶级联:一种新的术语。趋势植物SCI。2002; 7(7):301-8。
- 59。
ertea g,huang x,梁f,安东尼斯库v,苏丹娜r,karamycheva s,lee y,白色j,cheung f,parvizi b,tsai j,quackenbush J.TIGR基因指数聚类工具(TGICL):快速的软件系统大型EST数据集的聚类。生物信息学。2003; 19:651-2。
- 60.
Blast2go:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。
- 61.
王志强,王志强,王志强,等。蛋白质组学分析的通用样品制备方法。Nat方法。2009;6:359 - 62。
- 62.
Cox J,Mann M.Maxquant能够高肽识别率,个性化P.P.B.范围质量精度和蛋白质全组蛋白质量化。NAT BIOTECHNOL。2008; 26(12):1367-72。
- 63。
Hubner NC,Mann M.使用定量Bac interactermics(QUBIC)从蛋白质 - 蛋白质清洁中提取基因函数。方法。2011; 53:453-9。
- 64。
Cox J, Hein MY, Luber CA, Paron I, Nagaraj N, Mann M.通过延迟归一化和最大肽比提取的全蛋白质组精确无标记定量,称为MaxLFQ。细胞蛋白质组学。2014;13(9):2513-26。
- 65。
Futcher B, Latter GI, Monardo P, Mclaughlin CS, Garrels JI。酵母蛋白质组的取样。《细胞生物学》1999;19:7357-68。
确认
不适用。
资金
本研究由国家自然科学基金项目(31701948)资助。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
CQS、FDC、NJT和ZLD设计了实验。CQS、XS和YMY进行了实验。CQS、NJT和ZLD对数据进行了分析。CQS撰写了手稿。所有作者都已阅读并批准了最终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
太阳,CQ。那Chen, FD., Teng, NJ.et al。转录组学和蛋白质组学分析揭示了睡莲杂交中花粉-雌蕊相容性低的机制。BMC植物杂志19,542(2019)。https://doi.org/10.1186/s12870-019-2166-3
已收到:
接受:
发表:
关键字
- Nymphaea.
- 种间生殖障碍
- 转录组
- 蛋白质组学
- Pollen-stigma交互
- 罗斯
- 类黄酮