- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
代谢途径在维持植物初级休眠中的作用gydF4y2BaPinus Koraiensis.gydF4y2Ba种子gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19.gydF4y2Ba文章编号:gydF4y2Ba550gydF4y2Ba(gydF4y2Ba2019年gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
分散后,韩国杉木种子具有原发性休眠,导致种子萌发和幼苗建立差。代谢稳态决定了种子是否是休眠或非休眠的。然而,维持杉木种子的原发性休眠的特定代谢途径很差。gydF4y2Ba
结果gydF4y2Ba
在萌发诱导温度下,对PDRS(初级休眠释放种子)和PDS(初级休眠种子)胚在培养后0、5和11 d进行代谢分析。PDRS胚胎在0 ~ 11天发生较大的代谢开关。90种代谢产物的含量在第0 ~ 5天发生显著变化,其中83%(包括大部分糖、有机酸和氨基酸)增加,反映生物合成代谢过程开始。92种代谢物的含量在第5 ~ 11天发生了显著变化,其中71%(包括大部分有机酸和几乎所有氨基酸)的含量大幅下降。果糖6-磷酸、肌醇-3-磷酸、3-磷酸甘油和d -葡萄糖-6-磷酸含量下降幅度最大,分别降低了409-、75-、58-和41倍,表明糖酵解和三羧酸(TCA)循环明显减缓。PDS胚中大部分代谢物含量也仅在0 ~ 5天呈现较大的变化。虽然64%的代谢物在0 - 5天增加,但与PDRS胚胎相比,其水平仍然较低。此外,大部分代谢物在第5 ~ 11天没有进一步积累。与PDRS胚胎不同的是,PDS胚胎中几乎所有氨基酸在第5 ~ 11天都没有显著下降。主要参与糖酵解和三羧酸循环的代谢物含量没有明显下降,部分中间体含量甚至有所增加。gydF4y2Ba
结论gydF4y2Ba
胚胎生物合成代谢过程减弱,氨基酸利用率低,糖酵解和三羧酸操作率高,维持了初级休眠。gydF4y2Ba
背景gydF4y2Ba
混合阔叶红松(gydF4y2BaPinus Koraiensis.gydF4y2Ba摘要。在过去的一个世纪里,由于大规模的工业毁林,从中国东北到俄罗斯远东地区曾经占主导地位的森林(et Zucc.)正在减少[gydF4y2Ba1gydF4y2Ba那gydF4y2Ba2gydF4y2Ba].MBKPFS具有高植物多样性,并且由于高度复杂的结构而在生态系统服务(例如,水利)中的作用显着,但理解得不好。gydF4y2Ba3.gydF4y2Ba].因此,将降级的森林恢复到森林管理的MBKPF恢复为迫切需要。韩国松树是MBKPFS中的主要树种,但它们的种子在分散后初级休眠,然后在自然条件下的种子分散后在第一夏季进入二次休眠,从而导致种子萌发和幼苗建立差[gydF4y2Ba4.gydF4y2Ba那gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba6.gydF4y2Ba].研究红松种子的主要休眠机制,为MBKPFs的恢复提供依据是十分必要的。gydF4y2Ba
种子休眠定义为当完整的活种子不能在萌芽的有利条件下完成发芽时[gydF4y2Ba7.gydF4y2Ba].随着种子休眠逐渐解除,种子完全萌发的条件范围逐渐扩大[gydF4y2Ba8.gydF4y2Ba].如果不能增加种子完全萌发的环境范围,这些种子就是非休眠的[gydF4y2Ba8.gydF4y2Ba那gydF4y2Ba9.gydF4y2Ba].萌发过程通常包括三相:II代阶段I是种子(吸收)的快速吸收的过程,II期是代谢重新激活的过程(滞后),并且III期是胚胎的某些部分的阶段从种子涂层突出[gydF4y2Ba10.gydF4y2Ba].根据定义,萌发感开始于静止的干燥种子对水分的吸收,终止于胚根的突出和胚轴的伸长[gydF4y2Ba10.gydF4y2Ba].gydF4y2Ba
新陈代谢开始产生能量,并为驱动种子萌发的各种细胞过程构建模块[gydF4y2Ba10.gydF4y2Ba那gydF4y2Ba11.gydF4y2Ba那gydF4y2Ba12.gydF4y2Ba].休眠和非暴力种子之间的差分蛋白质组学分析表明,能量代谢和蛋白质代谢在促进种子萌发中发挥潜在作用。例如,25个蛋白质在休眠和非暴力之间表现出差异累积模式gydF4y2Ba拟南芥gydF4y2Ba吸胀1天后的种子[gydF4y2Ba13.gydF4y2Ba].此外,非休眠种子中8个高丰度蛋白中就有1个与能量代谢有关。90%的下调蛋白处于非休眠状态gydF4y2Ba拟南芥gydF4y2BaABA处理的种子主要参与能量和蛋白质代谢[gydF4y2Ba13.gydF4y2Ba].gydF4y2Ba
代谢途径中的块可以调用种子休眠[gydF4y2Ba14.gydF4y2Ba那gydF4y2Ba15.gydF4y2Ba那gydF4y2Ba16.gydF4y2Ba].代谢组学可以在全球水平上检测各种代谢物的差异积累[gydF4y2Ba17.gydF4y2Ba那gydF4y2Ba18.gydF4y2Ba].信息累积了代谢途径作为许多草本植物种子休眠机制的重要性。例如,蔗糖新陈代谢[gydF4y2Ba18.gydF4y2Ba那gydF4y2Ba19.gydF4y2Ba,能量代谢[gydF4y2Ba20.gydF4y2Ba,脂质代谢[gydF4y2Ba13.gydF4y2Ba]及氨基酸代谢[gydF4y2Ba18.gydF4y2Ba那gydF4y2Ba21gydF4y2Ba在被吸收的休眠种子中受到抑制。gydF4y2Ba
被吸收的休眠种子合成蛋白质的潜力[gydF4y2Ba22gydF4y2Ba那gydF4y2Ba23gydF4y2Ba那gydF4y2Ba24gydF4y2Ba]并产生ATP(三磷酸腺苷)[gydF4y2Ba25gydF4y2Ba在种子转移到萌发条件后,其含量较低。然而,一些研究表明,在被吸收的休眠种子中,糖和氨基酸的生成并不受到抑制gydF4y2Ba云杉glaucagydF4y2Ba[gydF4y2Ba14.gydF4y2Ba),gydF4y2Ba朱兰·瑞典gydF4y2Ba[gydF4y2Ba26gydF4y2Ba]相对于潮湿的冷却种子。在上述研究中,尚未确定在非血型种子的发芽Sensu严格期间发生的代谢变化。因此,维持种子休眠的实际代谢途径可能被遮挡,因为在相同条件下缺乏休眠和非暴力种子之间缺乏比较。gydF4y2Ba
目前关于红松种子休眠代谢机制的研究仅有两篇。据报道,红松种子休眠与还原糖含量较低有关[gydF4y2Ba27gydF4y2Ba].通过比较休眠和非休眠种子在萌发感期的呼吸速率,可以发现低呼吸代谢可能维持红松种子的休眠[gydF4y2Ba28gydF4y2Ba].然而,仍不清楚哪种代谢途径被改变以维持种子休眠。gydF4y2BaPinus Koraiensis.gydF4y2Ba种子种皮厚而硬,种皮总厚度在1.20 ~ 1.30 cm之间[gydF4y2Ba29gydF4y2Ba].种皮致密的石细胞层厚度在0.40 ~ 0.43 cm之间,可见明显增厚的石细胞壁[gydF4y2Ba29gydF4y2Ba].许多种子有厚厚的种皮,可以通过限制胚胎获得氧气、抑制水分吸收、阻止抑制剂从胚胎排出或施加机械抑制来实现休眠[gydF4y2Ba30.gydF4y2Ba].以前的工作表明,呼吸抑制剂如氰化物和丙二酸(抑制末端氧化反应和三羧酸循环)和氟化物(抑制糖酵解)的应用释放了几种物种的种子休眠[gydF4y2Ba30.gydF4y2Ba那gydF4y2Ba31gydF4y2Ba].当休眠向日葵种子在非允许温度下被吸收发芽时,三羧酸循环和糖酵解更活跃[gydF4y2Ba20.gydF4y2Ba].由此可以推断,种皮干扰了气体交换,造成了种子内部的缺氧条件。同时,休眠种子通过糖酵解和三羧酸循环消耗大量氧气。因此,其他有氧过程无法正常进行,导致种子休眠维持。这可能是硬种子保持休眠的一个原因。然而,据我们所知,目前还没有研究证明低氧条件下松树种子的代谢途径,特别是能量代谢与维持初级休眠之间的关系。因此,我们对红松种子某些代谢途径的特定改变是否维持其初级休眠的假设进行了检验。我们的工作目的是通过提供休眠和非休眠种子萌发敏感发生的初级代谢过程的变化的广泛综述,以充分了解红松种子休眠机制。本研究的结论将有助于加深对木本植物种子休眠机制的认识,从而建立一种简单而有效的解除种子休眠的方法。gydF4y2Ba
结果gydF4y2Ba
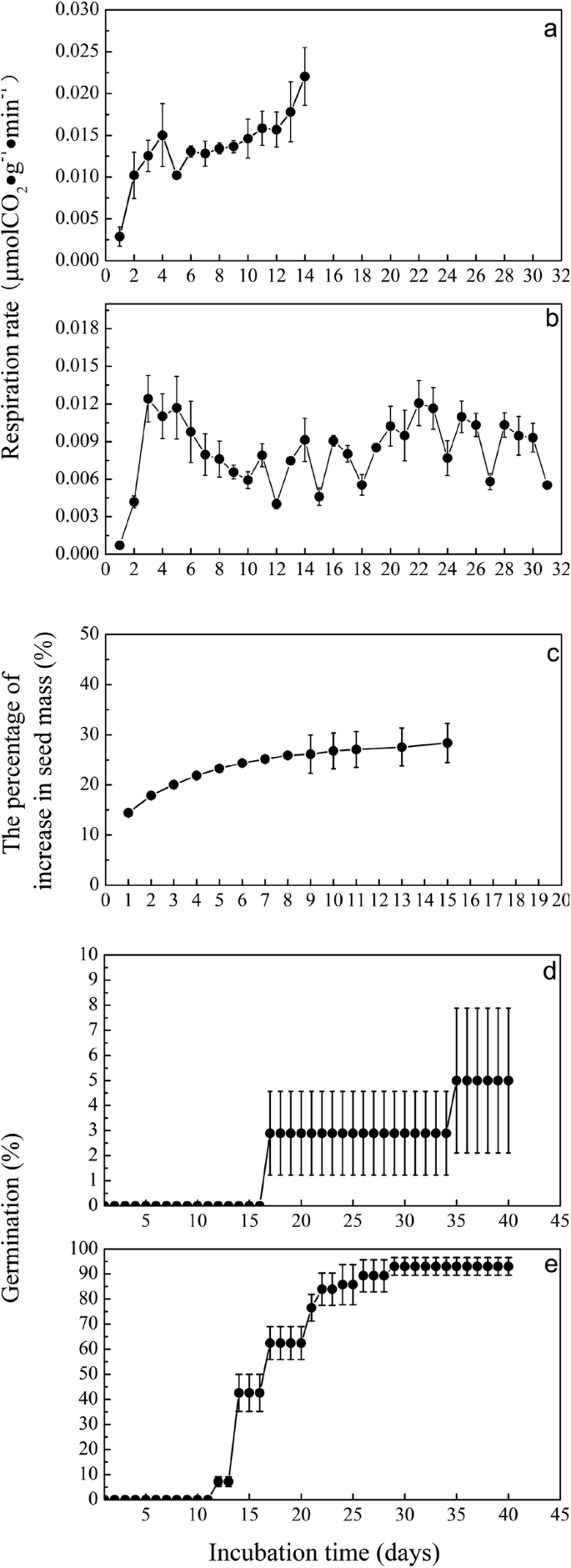
完整种皮与破损种皮呼吸速率的变化gydF4y2Ba
种子涂层破裂后,PDS的呼吸速率显着(gydF4y2BaP.gydF4y2Ba< 0.05)增加至0.012 μmol COgydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba在孵育的第四天与孵育的第一天相比(图。gydF4y2Ba1gydF4y2Ba一种)。此外,从孵育的第六天,呼吸速率不断增加并显着达到(gydF4y2BaP.gydF4y2Ba< 0.05),最大值为0.022 μmol COgydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba),在孵化的第十四天完成发芽。gydF4y2Ba
完整初级休眠种子的呼吸速率显着(gydF4y2BaP.gydF4y2Ba< 0.05)增加至0.012 μmol COgydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba3 d后逐渐降低至0.006 μmol COgydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba孵育10天后(图gydF4y2Ba1gydF4y2Bab)。在潜水期的其余时间期间,呼吸速率在0.004和0.012μmolco之间变化gydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba.gydF4y2Ba
半死症患者数量的变化gydF4y2Ba
PDS的质量迅速显着(gydF4y2BaP.gydF4y2Ba < 0.05) increased 23% on the fourth day of incubation compared with the first day of incubation and then slowly increased, varying between 22 and 28% during the rest of time of incubation period (Fig.1gydF4y2BaC)。gydF4y2Ba
PDRS和PDS的萌发gydF4y2Ba
PDRS的发芽率为93%(图。gydF4y2Ba1gydF4y2Bad),显着高于Pds(5%,gydF4y2BaP.gydF4y2Ba < 0.05) (Fig.1gydF4y2Bae)。gydF4y2Ba
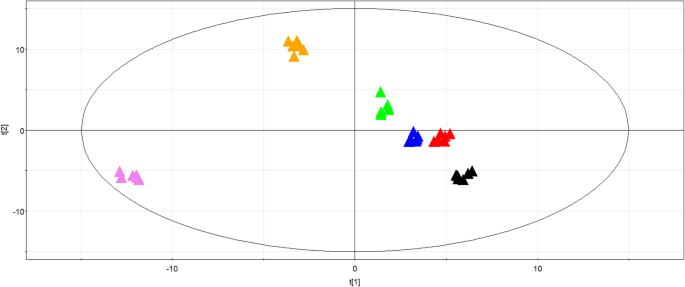
胚胎代谢物的主成分分析gydF4y2Ba
PCA得分图如图1所示。gydF4y2Ba2gydF4y2Ba, 分别。根据PCA分析,PC1(40.6%)和PC2(31.8%)解释了72.4%的总差异(图。gydF4y2Ba2gydF4y2Ba).该模型的参数如下:RgydF4y2Ba2gydF4y2Bax = 0.994,qgydF4y2Ba2gydF4y2Ba = 0.972. A clear formation of six distinct groups (PDRS, PDRS5, PDRS11, PDS, PDS5 and PDS11) was observed in the PCA score plot (Fig.2gydF4y2Ba).PDRS5和PDRS11样品沿着第一主成分与PDR分离。沿着第一主成分的PDRS5和PDRS11组之间发生最大分离。基于第二主成分,将PDS样品清楚地远离PDS5和PDS11样品。PDS5和PDS11样品彼此相对接近。gydF4y2Ba
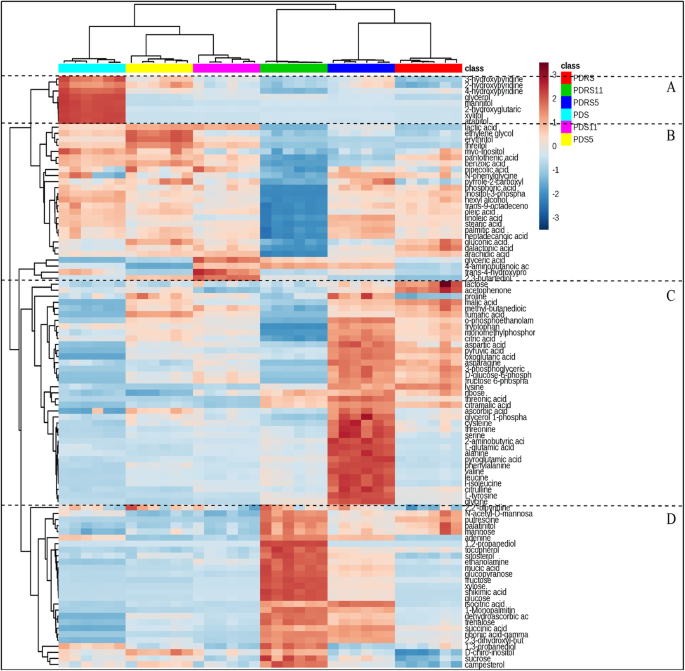
胚胎代谢物的聚类分析gydF4y2Ba
构建鉴定代谢物的HCA,以可视化98个不同成分的聚类(如图所示在热图上,图。gydF4y2Ba3.gydF4y2Ba).差分代谢物之间的Pearson相关系数被认为是可视化代谢物之间距离的公制方法。为了确定差分代谢物之间的关系和趋势,将HCA图分为四组。在A区域中,A(例如甘油,甘露醇,木糖醇和阿拉伯醇和阿拉伯醇和阿拉伯醇)中代谢物的含量是PDS胚胎中最低的。Most of metabolites in group B exhibited the highest contents in the embryos of PDS, PDS5 and PDS11, which mainly contained polyols (e.g., ethylene glycol, erythritol, threitol, myo-inositol, inositol-3-phosphate, hexyl alcohol and 2,3-butanediol) and fatty acids (e.g., trans-9-octadecenoic acid, oleic acid, linoleic acid, stearic acid, palmitic acid, heptadecanoic acid and arachidic acid). A large proportion of amino acids, TCA cycle intermediates (e.g., malic acid, pyruvic acid, citric acid and oxoglutaric acid) and glycolysis cycle intermediates (e.g., D-glucose-6-phosphate, fructose-6-phosphate and 3-phosphoglyceric) clustered in group C. These metabolites had the highest contents in the embryos of PDRS5. The contents of the corresponding metabolites from group D were the highest in the embryos of PDRS11, including monosaccharides (e.g., mannose, trehalose, sucrose, fructose, glucopyranose, glucose and xylose). A relatively small change in the contents of these metabolites clustered in groups C and D were observed between the embryos of PDS, PDS5 and PDS11.
PDR,PDRS5和PDRS11胚胎中代谢物的局部最小二乘判别分析gydF4y2Ba
PDRS5和PDR之间的差异主要由PC1(77.6%)解释(图。gydF4y2Ba4.gydF4y2Ba一种)。r.gydF4y2Ba2gydF4y2Ba和问gydF4y2Ba2gydF4y2BaPLS-DA模型的值分别为0.99和0.98。gydF4y2Ba4.gydF4y2Bad)。在确定的代谢物中,九十种表现出PDRS5和PDRS组之间的显着差异(gydF4y2BaP.gydF4y2Ba< 0.05)。65个代谢产物与VIP > 1显著促进了PDRS5与PDRS的分离(图。gydF4y2Ba4.gydF4y2Ba公元前)。gydF4y2Ba
PDRS5和PDRS胚胎分化代谢产物谱组分1和组分2的PLS-DA评分图(gydF4y2Ba一个gydF4y2Ba)、PDRS11及PDRS5 (gydF4y2BaegydF4y2Ba)、PDS5及PDS (gydF4y2Ba我gydF4y2Ba),PDS11和PDS5(gydF4y2Ba米gydF4y2Ba).组件1和2的代谢物载荷显示,负责PDRS5和PDR之间的差异的主要特征(gydF4y2BabgydF4y2Ba)、PDRS11及PDRS5 (gydF4y2BafgydF4y2Ba)、PDS5及PDS (gydF4y2BajgydF4y2Ba),PDS11和PDS5(gydF4y2BangydF4y2Ba).前40名代谢物的VIP分数图有助于PDRS5和PDR的代谢概况变化(gydF4y2BacgydF4y2Ba)、PDRS11及PDRS5 (gydF4y2BaggydF4y2Ba)、PDS5及PDS (gydF4y2BakgydF4y2Ba),PDS11和PDS5(gydF4y2BaogydF4y2Ba).为PDRS5和PDR的原点分化而构建的PLS-DA组件的10倍交叉验证性能模型(gydF4y2BadgydF4y2Ba)、PDRS11及PDRS5 (gydF4y2BahgydF4y2Ba)、PDS5及PDS (gydF4y2BalgydF4y2Ba),PDS11和PDS5(gydF4y2BapgydF4y2Ba)gydF4y2Ba
组分1(88.6%)的差异解释了PDRS11和PDS5之间的差异(图。gydF4y2Ba4.gydF4y2Bae),具有非常高的精度(100%)(图。gydF4y2Ba4.gydF4y2Bah). 92例在PDRS11和PDRS5组间存在显著差异(gydF4y2BaP.gydF4y2Ba< 0.05)。具有VIP> 1的七十五代谢物显着导致PDRS5分离PDRS11(图。gydF4y2Ba4.gydF4y2Baf, g)。gydF4y2Ba
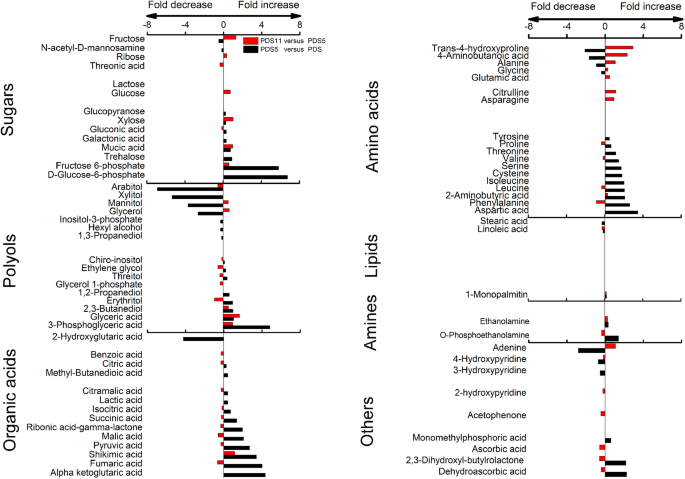
PDRS、PDRS5和PDRS11胚胎重要代谢产物VIP值> 1的Fold changesgydF4y2Ba
VIP > 1代谢产物的83%(包括大部分糖、有机酸和氨基酸)是在0 - 5天积累的(图1)。gydF4y2Ba5.gydF4y2Ba).从第5天到第11天,73%的VIP > 1代谢产物(包括大部分有机酸和氨基酸)显著减少。果糖6-磷酸、肌醇-3-磷酸、3-磷酸甘油和d -葡萄糖-6-磷酸含量降幅最大,分别降低了409-、75-、58-和41倍(图6)。gydF4y2Ba5.gydF4y2Ba).从第0天到第5天,木糖、葡萄糖、葡萄糖、果糖和海藻糖的含量增加了2-6倍,从第5天到第11天,木糖、葡萄糖、葡萄糖、果糖和海藻糖的含量继续增加了1-3倍(图3)。gydF4y2Ba5.gydF4y2Ba).gydF4y2Ba
PDS、PDS5和PDS11胚胎代谢物的偏最小二乘判别分析gydF4y2Ba
数据清楚地分为两组,得到的分数图显示PDS5和PDS之间的强分离(图。gydF4y2Ba4.gydF4y2Ba一世)。七十七种代谢物的含量在PDS5和PDS之间表现出显着差异(gydF4y2BaP.gydF4y2Ba< 0.05)。vip> 1的六十四种代谢物显着导致PDS5从PDS分离(图。gydF4y2Ba4.gydF4y2Baj, k)。模型的灵活性通过解释方差R来评估gydF4y2Ba2gydF4y2Ba= 0.99,预测精度QgydF4y2Ba2gydF4y2Ba = 0.98 (Fig.4.gydF4y2Bal)。gydF4y2Ba
组分1(59.4%)的差异解释了PDS11和PDS5之间的差异(图。gydF4y2Ba4.gydF4y2Bam)。鉴定代谢物的六十八种代谢物的含量表现出PDS11和PDS5之间的显着差异(gydF4y2BaP.gydF4y2Ba< 0.05)。具有VIP> 1的五十二个代谢物显着导致PDS11从PDS5分离(图。gydF4y2Ba4.gydF4y2Ban, o)gydF4y2Ba2gydF4y2Ba和问gydF4y2Ba2gydF4y2Ba得分分别为0.97和0.95。gydF4y2Ba4.gydF4y2Bap)。gydF4y2Ba
PDS、PDS5和PDS11胚胎中重要代谢产物VIP值> 1的Fold changesgydF4y2Ba
VIP > 1代谢产物的70%(含大部分糖、有机酸和氨基酸)含量在第0 ~ 5天积累。d -葡萄糖-6-磷酸、果糖-6-磷酸、3-磷酸甘油酸、右戊二酸和反丁烯二酸的含量变化明显,分别增加了104倍、55倍、30倍、21倍和16倍。gydF4y2Ba6.gydF4y2Ba).使用VIP> 1的这些代谢物的水平从第5天到11日显示相对较小的变化。gydF4y2Ba
PDRS胚胎主要代谢途径改变gydF4y2Ba
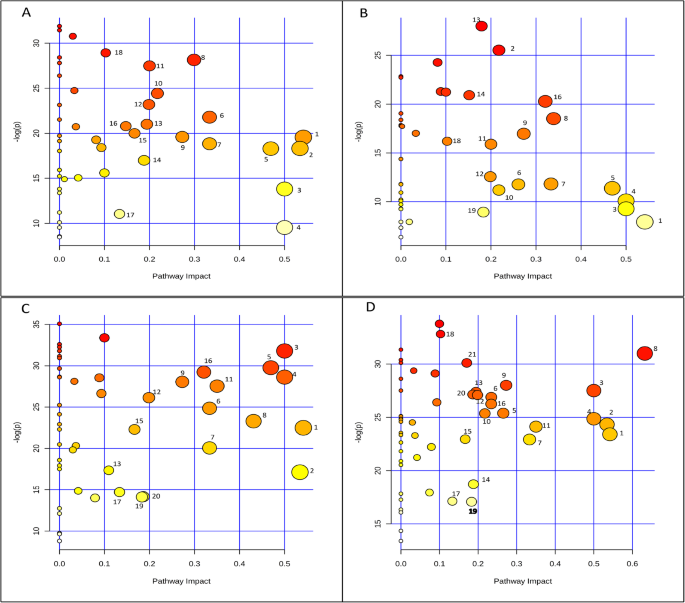
这些位于“代谢组视图”右上角的途径是主要的改变的代谢途径(图2)。gydF4y2Ba7.gydF4y2Ba).0 ~ 5 d,主要代谢途径为氨基酸代谢(甘氨酸、丝氨酸和苏氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢和酪氨酸代谢)、碳水化合物代谢(乙醛酸和二羧酸代谢、丙酮酸代谢、三羧酸循环和糖酵解)、辅助因子和维生素的代谢(泛酸盐和辅酶a的生物合成)和甘油磷脂代谢(图。gydF4y2Ba7.gydF4y2Ba一种)。gydF4y2Ba
胚胎代谢途径改变的代谢组观(gydF4y2Ba一个gydF4y2Ba) PDRS5及PDRS, (gydF4y2BabgydF4y2Ba)PDRS11和PDRS5,(gydF4y2BacgydF4y2Ba) PDS5及PDS, (gydF4y2BadgydF4y2Ba)PDS11和PDS5。PDRS:种子从初级休眠中释放出来;PDRS5,培养5天的种子从初级休眠中释放;PDRS11,孵化11天的种子从初级休眠中释放;PDS:初级休眠种子;PDS5,5天孵化的初级休眠种子和PDS11,11天孵育的初级休眠种子。碳水化合物代谢(5,乙醛酸和二羧酸二羧酸代谢; 6,柠檬酸盐循环; 10,果糖和甘露糖代谢; 12,丙酮酸代谢; 13,糖酵解或葡糖苷生成,18,氨基糖和核苷酸代谢; 14,pentose磷酸盐途径; 19,抗坏血酸和罕见代谢)。氨基酸代谢(1,β-丙氨酸代谢; 2,甘氨酸,丝氨酸和苏氨氨酸代谢; 3,苯丙氨酸代谢; 8,丙氨酸,天冬氨酸和谷氨酸代谢; 9,酪氨酸代谢; 16,精氨酸和脯氨酸代谢; 21,色氨酸代谢; 21,色氨酸代谢).能量代谢(15,甲烷代谢; 17,硫代谢)。 Lipid metabolism (7, Sphingolipid metabolism; 20, Glycerophospholipid metabolism). Metabolisms of cofactors and vitamins (11, Pantothenate and CoA biosynthesis). Biosynthesis of other secondary metbaolites (4, Isoquinoline alkaloid biosynthesis)
从第5至11天开始,主要改变以下代谢途径,包括氨基酸代谢(丙氨酸,天冬氨酸和谷氨酸代谢,β-丙氨酸代谢,甘氨酸,丝氨酸和苏氨酸代谢和精氨酸和脯氨酸代谢),碳水化合物代谢(柠檬酸盐循环,丙酮酸代谢,糖酵解和戊糖磷酸盐途径),脂质代谢(鞘脂代谢)和辅助actors和维生素的代谢(泛酸钠和COA生物合成)(图。gydF4y2Ba7.gydF4y2Bab)。gydF4y2Ba
PDS胚胎主要代谢途径改变gydF4y2Ba
除甘油磷脂代谢外,PDRS胚胎中除甘油磷脂代谢外,其余代谢途径在0 ~ 5天的PDS胚胎中也表现出显著的变化(图3)。gydF4y2Ba7.gydF4y2Bac).此外,戊糖磷酸途径也发生了重大变化。除甘氨酸、丝氨酸、苏氨酸和丙酮酸代谢外,代谢途径在第0 ~ 5天显著改变(图2)。gydF4y2Ba7.gydF4y2Bad)。gydF4y2Ba
PDRS与PDS代谢途径比较分析gydF4y2Ba
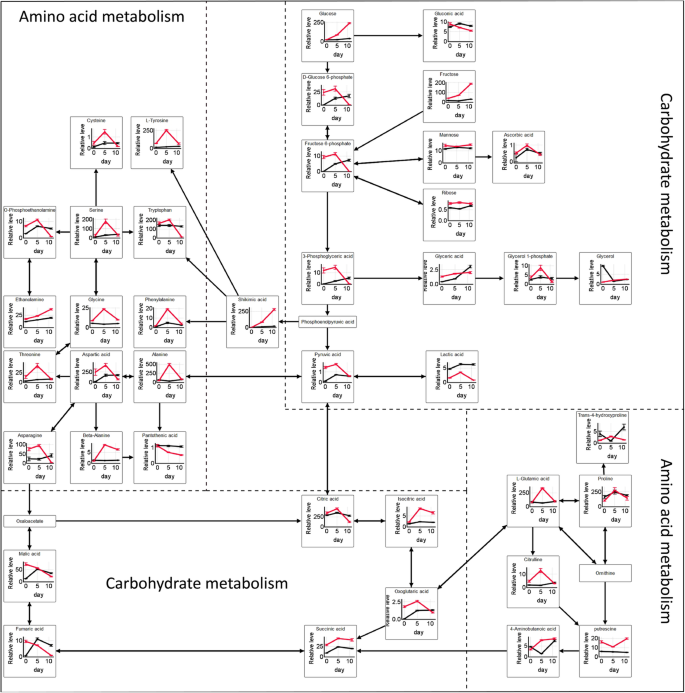
在第0 ~ 5天,PDRS胚胎的碳水化合物代谢和氨基酸代谢活性增加,PDS胚胎的碳水化合物代谢和氨基酸代谢活性增加幅度与PDS相似,但增加幅度较小。gydF4y2Ba8.gydF4y2Ba).从第5至11天开始,PDRS胚胎中碳水化合物代谢和氨基酸代谢的大多数中间体显着降低。相比之下,这些代谢物(包括Pds胚胎中的这些代谢物(包括糖,有机酸和氨基酸)的细微变化。gydF4y2Ba
讨论gydF4y2Ba
0 ~ 5 d, PDRS和PDS胚中76和64%的代谢物含量分别显著增加,说明生物合成代谢过程占优势。主要刺激糖代谢(乙醛酸和二羧酸代谢、三羧酸循环、丙酮酸代谢和糖酵解)和氨基酸代谢(甘氨酸、丝氨酸和苏氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢、酪氨酸代谢)。其他研究也表明,休眠和非休眠种子在吸水24小时后基因上调[gydF4y2Ba32gydF4y2Ba].呼吸和能量产生可以在休眠和非暴力种子中进行[gydF4y2Ba33gydF4y2Ba].代谢途径的激活取决于水进入。在孵育5天后Pds胚胎中大多数代谢物的水平的增加很可能与干燥种子快速初始水吸收有关。还记录了在萌发条件下,韩国杉木种子中的戏剧性水吸收从时钟0到5(图。gydF4y2Ba1gydF4y2BaC)。与PDRS5胚胎相比,PDS5和Pds11胚胎中的碳水化合物代谢途径中间体中间体的水平显着下降,这意味着PDS胚胎中碳水化合物代谢的增加程度较小。减毒的碳水化合物代谢可以与预防储备降解有关。还据报道,在休眠转移后逐渐下降涉及碳水化合物降解的基因的表达逐渐下降gydF4y2Ba大戟属植物esulagydF4y2Ba种子萌发条件21天孵化[gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
发芽需要从头合成蛋白质。然而,种子萌发时游离氨基酸含量过低,无法支持蛋白质的合成[gydF4y2Ba30.gydF4y2Ba因此,储存蛋白质降解到氨基酸中。胚胎中的蛋白质首先降解,然后在局部使用它们的组分[gydF4y2Ba30.gydF4y2Ba].虽然氨基酸代谢的活性在0至5天的PDS和PDR胚胎中增加,但在PDS胚胎中的增加程度较小。因此,与PDRS胚胎相比,在PDS胚胎中,氨基酸生物合成途径是合理的。编码蛋白质降解的基因的表达水平,氨基酸和蛋白质代谢的重要组分的丰度逐渐下降,因为休眠种子的增生时间增加[gydF4y2Ba21gydF4y2Ba那gydF4y2Ba34gydF4y2Ba].相反,一旦种子休眠被释放,氨基酸之间就会发生相互转换。氨基酸的从头合成途径也可以被诱导。gydF4y2Ba
韩国松籽含有大于60%的脂肪,大多数脂肪位于MegagameTophyte [gydF4y2Ba35gydF4y2Ba].脂肪酸的β-氧化需要氧气以产生乙酰基-COA。然后通过乙氧基化循环和葡糖生成将乙酰-COA转化为蔗糖[gydF4y2Ba36gydF4y2Ba].PDRS胚胎的乳酸水平低于5至11天的PDS胚胎中的胚胎,表明PDRS胚胎中氧的量相对较高。然而,在裂解种子涂层之后,与完整的湿润冷却的种子相比,湿冷的种子的呼吸速率较高。可以推断出释放初级休眠的种子中的氧气水平仍然不足。通过缩略糖酵解和TCA循环,可以减少PDR胚胎中的氧气消耗。因此,可以向脂肪酸的β-氧化β-氧化的MegagameTophyte提供更多氧气,导致蔗糖的积累。然后在整个胚胎中运输糖,其中它支持胚胎生长和发育。在0至11天的PDR胚胎中,糖(木糖,葡萄糖,吡喃葡萄糖,海藻糖,果糖和蔗糖)的连续积累也可支持该假设。在gydF4y2Ba松果体lamberdaeagydF4y2Ba种子从初级休眠中释放出来,在萌发过程中蔗糖水平也不断积累[gydF4y2Ba37gydF4y2Ba].渗透活性物质(糖和氨基酸)的积累导致水分吸收的进一步增加[gydF4y2Ba38gydF4y2Ba].大多数糖含量的大幅增加可能会导致种子更快地吸收水分,导致种皮破裂。然而,这一结论还需要其他实验进一步证明。gydF4y2Ba
种皮开裂后,PDS的呼吸速率迅速增加,表明种皮通过限制氧吸收来限制萌发。与PDRS胚胎相比,PDS胚胎维持较高的乳酸水平进一步证明了PDS胚胎中氧气的可用性是有限的。此外,PDS11的碳水化合物代谢(即TCA循环、糖酵解和戊糖磷酸途径)中间体水平显著高于PDRS11。这些数据表明,在PDS胚胎氧气不足时,糖酵解和TCA循环仍以较高的速率发生,消耗大量氧气。因此,PDS巨生植物中氧气的可得性可能会降低,导致脂肪酸β-氧化减慢。在0 ~ 11天,PDS胚胎中只有木糖、葡萄糖和乳糖含量略有增加。此外,PDS胚胎中16种糖中的14种水平显著低于PDRS胚胎。转移后的初级休眠gydF4y2Ba松果体lamberdaeagydF4y2Ba在种子萌发的条件下,蔗糖水平起初升高,随后下降[gydF4y2Ba37gydF4y2Ba].PDS胚胎中的糖含量可能太低,不能引起吸水和种子涂层破裂。因此,维持种子原发性休眠。PD不能与第5至11天(即,减少糖酵解和TCA循环)进行相应的和快速调整,以应对周围的缺氧环境,而PDR也可以。然而,有必要进一步阐明朝鲜杉木种子胚胎和MegameTophyte中的原发性休眠维持和氧气和糖分布之间的关系。gydF4y2Ba
PDRS胚胎中参与丙氨酸、天冬氨酸和谷氨酸代谢、β -丙氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢以及精氨酸和脯氨酸代谢的氨基酸水平在第5 ~ 11天显著降低。新生蛋白合成发生在第II期早期gydF4y2Ba拟南芥gydF4y2Ba种子萌发(gydF4y2Ba39gydF4y2Ba].而PDS胚胎中某些氨基酸在第5天至第11天略有下降,提示蛋白质的从头合成受阻。在被吸收的休眠种子中,与蛋白质合成相关的基因表达水平下降[gydF4y2Ba40gydF4y2Ba].富含休眠种子的基因与抑制翻译能力有关的基因[gydF4y2Ba39gydF4y2Ba那gydF4y2Ba40gydF4y2Ba那gydF4y2Ba41gydF4y2Ba].谷氨酸,天冬氨酸,天冬酰胺和脯氨酸是PDS和PDRS胚胎中的主要氨基酸。这些氨基酸也占主导地位gydF4y2Ba松果体taedagydF4y2Ba和gydF4y2Ba松果体banksianagydF4y2Ba种子(gydF4y2Ba42gydF4y2Ba那gydF4y2Ba43gydF4y2Ba].谷氨酰胺和天冬酰胺具有高的氮/碳比,特别适合N [gydF4y2Ba44gydF4y2Ba,常被用作运输化合物,将氮输送到快速生长的组织中[gydF4y2Ba43gydF4y2Ba那gydF4y2Ba45gydF4y2Ba].天冬酰胺在PDRS胚胎中从5天到11天减少了24倍,但在PDS胚胎中天冬酰胺增加了2倍,表明PDS胚胎对氨基酸的利用可能不那么强烈。多胺(腐胺、亚精胺及精胺)可激活蛋白质合成的发生[gydF4y2Ba24gydF4y2Ba].Putrescine在PDRS胚胎中累积迅速累积,但在第5至11天的PDS胚胎中逐渐下降,这意味着PDS胚胎中蛋白质合成的能力较低。PDRS胚胎中氨基酸代谢的这种变化从0到11天开始遵循类似的模式,如前所述[gydF4y2Ba18.gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
PDRS胚在发芽体的前5 d和后6 d表现出不同的代谢谱。从第0 ~ 5天,PDRS胚胎中有76%的代谢产物快速积累,表明生物合成代谢过程已经启动。然而,从第5天到第11天,67%的代谢物水平大幅下降。特别是,几乎所有的氨基酸和糖酵解和三羧酸循环中间体都表现出相对较大的减少。PDRS胚胎中几乎所有氨基酸的高效利用可能为胚胎生长提供蛋白质。糖酵解和三羧酸循环的减弱可能导致氧消耗减少,导致PDRS胚胎中糖的积累。从第0天到第11天,PDRS胚胎中糖类特别是蔗糖的持续增加证明了这一推测。PDRS胚胎中大部分糖含量的大幅增加可能会导致种子更快地吸收水分,导致种皮破裂。从第0天到第5天,PDS胚胎中64%的代谢物水平增加,并伴随快速吸水。此外,与PDRS相比,这些代谢物的水平在第5 ~ 11天不仅进一步积累,而且降低。 These results indicate that biosynthetic metabolic processes are impeded in the embryos of PDS from days 0 to 5. Unlike PDRS embryos, almost all amino acids in PDS embryos did not exhibit a substantial decrease from days 5 to 11. Also, there was not a major decrease in the levels of metabolites involved mainly in glycolysis and TCA cycle, while some intermediates even increased. The inferences from this study might help in better understanding the seed dormancy mechanisms and establishing a simple and very efficient means to release seed dormancy.
方法gydF4y2Ba
本研究使用了两批种子。采用2013年10月采集的种子进行种皮透气性和透水性测定。通过确定完整的初级休眠种子和有破损种皮的种子之间的呼吸速率的差异,可以确定是否存在气体屏障。通过监测萌发条件下完整的初级休眠种子的质量变化,我们确定种皮是否干扰水分吸收。利用2014年采集的种子进行代谢组学分析。gydF4y2Ba
种子收藏gydF4y2Ba
2013年10月和2014年10月分别在中国科学院清远林CERN(41°51.102′N, 124°54.543′E, 456-1116 m a.s.l)红松人工林采集了30株50岁左右的鲜果。利用脱粒机将裸子球果打开,释放种子。然后,这些新鲜种子在室内晾干,直到种子含水量达到10%左右。种子含水量测定方法:将新鲜种子称重,103℃干燥17 h,再称重。然后将这些新鲜的干种子在−20°C下保存,直到实验结束。gydF4y2Ba
种子涂层渗透性和透气性的测定gydF4y2Ba
2013年10月采集的种子立即用于种皮透气性和透水性的测定。测定了原始休眠种子和种皮破裂种子的呼吸速率。每25粒种子(完整的初级休眠种子或破损的种子)被放入直径9厘米的培养皿中,培养皿中有8层滤纸,用12毫升去离子水浸湿。每个培养皿放置在1.3 L的密封塑料盒中。同时,在烧杯中加入10ml NaOH (1mol LgydF4y2Ba−1gydF4y2Ba)溶液亦放入胶盒内以捕集一氧化碳gydF4y2Ba2gydF4y2Ba.然后将塑料盒在受控生长室(MGC-450HP-2,Bluepard,Shanghai,Shanghai,Shanghai,Shanghai,Shanghai,Shanghai,Shanghai,Shanghai,China)中以25/10℃的亮度调节(14/10h)温育。根据NFSSTC标准选择这种孵育温度gydF4y2Ba松果体gydF4y2Ba[gydF4y2Ba46gydF4y2Ba].光合光子磁通密度约为120μmolmgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba位于培养皿顶部。BaClgydF4y2Ba2gydF4y2Ba(1 mol lgydF4y2Ba−1gydF4y2Ba)用于沉淀COgydF4y2Ba2gydF4y2Ba被烧杯中的NaOH吸收。然后用1mol L滴定烧杯中剩余的NaOHgydF4y2Ba−1gydF4y2BaHCL。滴定期间消耗的HCl体积用于计算CO的金额gydF4y2Ba2gydF4y2Ba种子呼吸作用产生的。在孵育过程中随时加入去离子水,以确保种子呼吸的合适水分条件。每天测定呼吸速率,以μmol CO表示gydF4y2Ba2gydF4y2BaggydF4y2Ba−1gydF4y2Ba min−1gydF4y2Ba.三次重复分别进行种子呼吸。gydF4y2Ba
每25颗完整的休眠干种子被放置在直径9厘米的皮氏培养皿中。用12 ml去离子水浸湿的8层滤纸置于每个培养皿中。3个培养皿作为3个重复。用保鲜膜覆盖培养皿以减少水分流失,然后在萌发条件下培养。每隔24小时,种子从滤纸中取出,吸干,称重至0.1毫克,然后回到培养皿中。种子质量的增加百分率计算公式如下:种子质量增加的百分比=[(在萌发条件下孵化的种子质量-初级休眠的干种子质量)/初级休眠的干种子质量]× 100。gydF4y2Ba
用于代谢组学分析的种子的制备gydF4y2Ba
2014年10月采集的种子分为两部分,其中一部分立即在-20°C下保存,直到检测初级休眠代谢。另一部分种子在11月初进行湿冷处理。湿冷的具体步骤为:在红松人工林中,先将种子用流动水浸泡7天,然后将种子埋于50 cm深的土壤中6个月(2014年11月- 2015年4月)[gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
在潮湿的冷却后,评估湿冷的种子的发芽能力,以确定它们是否已从原发性休眠中释放。本研究中原发性休眠中释放的种子是指用大约6个月的湿润冷却治疗的种子。2015年4月下旬,从-20°C储存条件下除去新鲜的干燥种子。随后用这些种子进行萌发实验,以确定种子是初级休眠状态。本研究中的初级休眠种子是指用大约6个月的储存在-20℃下处理的那些干燥的种子。然后将从原发性休眠和初级休眠种子中释放的种子用于代谢组科分析。gydF4y2Ba
每个发芽试验包括每种种子的三种复制。将这些20种子置于直径为9厘米直径的培养皿中,含有八片滤纸,用去离子水润湿。将去离子水加入到培养皿中,以确保种子萌发所需的适当水分。所有菜肴用塑料薄膜包裹,以减少水分损失,然后在受控生长室(MGC-450HP-2,Bluepard,Shanghai,Bluepard,Bluepard,Shanghai,Bluepard,Support)以减少水分,然后在光/暗(14/10h)中孵育,然后在25/10°C中孵育25/10°C(Mgc-450hp-2,Bluepard,Bluepard,Shanghai,中国)。光合光子磁通密度约为120μmolmgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba位于培养皿顶部。每两天测试萌发6周,当胚根突起大于2mm时被认为完成[gydF4y2Ba47gydF4y2Ba]。在发芽试验结束时,切割未能完成萌发的种子以用四唑鎓法测试种子胚胎活力。gydF4y2Ba
代谢组学分析实验设计gydF4y2Ba
本研究采用PDRS (primary休眠释放种子)和PDS (primary休眠种子)两种种子进行代谢组学分析。将PDRS或PDS置于直径9 cm的培养皿中,用10 ml蒸馏水浸湿8层滤纸进行吸胀,然后在25/10°C交替温度条件下光照/黑暗(14/10 h)保存以诱导萌发。分别在种子萌发后0、5和11 d从种子中取胚(每个重复20个,每个种子类型3个生物重复)。在萌发诱导条件下,PDRS的胚根向种皮伸出,直到吸胀11天。这个阶段对应于发芽感觉(即,没有种子显示在这个阶段发芽)。然而,PDS在这一时期不能萌发,表明初级休眠仍然维持。5天育PDRS、11天育PDRS、5天育PDS、11天育PDS分别简称为PDRS5、PDRS11、PDS5、PDS11。在每个采样时间点,将胚从种子的其余结构中剥离,立即在液体N中冷冻gydF4y2Ba2gydF4y2Ba在液体n中粉碎gydF4y2Ba2gydF4y2Ba,冻干并储存在-20°C直至代谢物分析。gydF4y2Ba
样品制备gydF4y2Ba
将100mg胚粉放入2ml Eppendorf试管中,用1.5 mL 80%甲醇提取。为了充分提取代谢物,首先将样品旋转5分钟,然后在20598 x g离心10分钟。取800 μL上清置于另1.5 mL Eppendorf管中冻干10 h。然后取100 μL甲氧胺溶液(20 mg mLgydF4y2Ba−1gydF4y2Ba用吡啶制备加入Eppendorf管中以溶解干燥的残余物。然后将该溶液样品在37℃下在水浴中孵育90分钟,以进行肟化反应[gydF4y2Ba49gydF4y2Ba那gydF4y2Ba50gydF4y2Ba].随后,在样品中加入80 μL的MSTFA (N-Methy-N-(三甲基硅基)三氟乙酰胺),在37℃水浴中孵育60 min,进行硅化反应[gydF4y2Ba49gydF4y2Ba那gydF4y2Ba50gydF4y2Ba].然后,将200μl上清液移入样品小瓶中并用于GC-MS(气相色谱 - 质谱)分析。gydF4y2Ba
gc - ms分析gydF4y2Ba
本研究采用qp2010气相色谱-质谱联用仪,配备AOC-20i自动进样器(日本岛津)。代谢产物在30 m × 0.25 mm × 0.25 μm DB-5 MS (J&W Scientific, Folsom, CA, USA)柱上进行色谱分离。注入温度设定在300℃。氦被用作载气。载气的恒定流量设定为40厘米秒gydF4y2Ba−1gydF4y2Ba.注射体积为1μL。分流比设定为10:1。为了实现代谢物的电离,使用70eV的电子冲击模型。界面的温度为280℃。离子源的温度设定在230℃。质谱范围范围为33至500米Z.gydF4y2Ba−1gydF4y2Ba.扫描速度为5扫描秒gydF4y2Ba−1gydF4y2Ba.溶剂切割时间为5.7 min。柱温维持在70°C前3分钟,然后以5°C min的速度提高到310°CgydF4y2Ba−1gydF4y2Ba.310°C维持5分钟。gydF4y2Ba
数据处理。gydF4y2Ba
基于混合QC样品的非靶向GC-MS数据建立了伪靶向方法。简单地说,获取的QC数据以netCDF格式导入AMDIS(自动质谱反褶积与识别系统)2.62 (NIST, USA)进行峰反褶积、对齐和检测。在此基础上,利用chromTOF 4.43 (LECO, USA)对待检测化合物的特征离子进行筛选。值得注意的是,三重浓缩QC样品用于定性分析,以覆盖低丰富的化合物。最后,通过计算两个连续峰的保留时间间隔来进行分组。一个选定的离子监测表生成了包含时间范围和待检测化合物的特征离子的多个组的信息。gydF4y2Ba
在数据采集之后,使用GCMS Postrun分析(GCMSSolutions 2.70,Shimadzu Corporation,Japan)将包含保留时间和所有检测到的化合物的特征离子以及内标的定量表作为Excel文件导出为Excel文件。所有检测到的化合物的峰面积被标准化为内标。甲醇溶解的三烷酸(0.4μg/ ml)用作数据标准化的内标。在最终数据矩阵中仅包括所有QC样本中具有小于20%的RSD(相对标准偏差)的检测到的化合物。gydF4y2Ba
统计分析gydF4y2Ba
发芽率定义为完成萌发的种子数/总存活种子数× 100%。采用LSD(最小显著差异)后的单因素方差分析,检验不同培养时间间呼吸速率、种子质量和发芽率的显著差异。代谢产物的增加(减少)比例计算为:增加(减少)代谢产物数量/鉴定代谢产物总数× 100%。采用配对样本t检验,分别测定PDRS5与PDRS、PDRS11与PDRS5、PDS5与PDS、PDS11与PDS5之间代谢物水平的差异。采用simca - p11软件(瑞典),采用主成分分析(PCA)对6个样本(PDS、PDS5、PDS11、PDRS、PDRS5和PDRS11)的系统变化进行了总结。为了可视化差异代谢物的变化模式,我们使用MetaboAnalyst进行HCA (hierarchical cluster analysis)分析。热图基于标准化数据,使用自标度特征进行标准化,使用平均链接算法聚类,使用Pearson相关系数度量距离。然后将热图分为四组,清晰显示六个样本中差异代谢物之间的关系和趋势。然后使用PLS-DA(偏最小二乘判别分析)鉴定四对样品中每对样品的差异表达代谢物。在进行PLS-DA之前,所有代谢物数据都进行了UV(单位-方差)测量。 In UV-scaling, each variable was mean-centered and divided by the standard deviation. A total of four partial least squares discriminant analyses were conducted. Specifically, those differentially expressed metabolites were identified by inspecting loadings plots from PLS-DA. Only those metabolites with VIP (variable importance in the projection) > 1 and significant changes (P.gydF4y2Ba < 0.05) in content were considered to have significant contributions to the classification of each of the four pairs of samples [48gydF4y2Ba那gydF4y2Ba51gydF4y2Ba那gydF4y2Ba52gydF4y2Ba].这四对样本分别为:PDRS5 vs PDRS, PDRS11 vs PDRS5, PDS5 vs PDS, PDS11 vs PDS5。计算4对样品间VIP为> 1的代谢产物的Fold changes。以两组平均值与对数之比计算Fold changegydF4y2Ba2gydF4y2Ba转变。具体来说,它们是通过以下公式计算的:日志计算gydF4y2Ba2gydF4y2Ba(PDRS5 / PDR)gydF4y2Ba、日志gydF4y2Ba2gydF4y2Ba(PDRS11 / PDRS5)gydF4y2Ba、日志gydF4y2Ba2gydF4y2Ba(PDS5 / PDS)gydF4y2Ba和日志gydF4y2Ba2gydF4y2Ba(PDS11 / PDS5)gydF4y2Ba.用metaboAnalyst进行折叠变化的计算。然后将那些具有VIP> 1的代谢物随后进行代谢途径分析,以鉴定和可视化PDRS5与PDRS,PDRS11 VS PDRS5,PDS5 VS PDS和PDS11 VS PDS5之间显着改变的代谢途径。MetaboAnalyst Web工具中的途径富集分析和途径拓扑分析在一起进行了代谢途径分析[gydF4y2Ba53gydF4y2Ba].的gydF4y2BaP.gydF4y2Ba用路径富集分析中“全局测试”算法计算的值来表示富集代谢途径的重要性[gydF4y2Ba54gydF4y2Ba].利用路径拓扑分析中的“relative - between - Centrality”算法计算的影响值来估计代谢路径的相对重要性[gydF4y2Ba53gydF4y2Ba].冲击值阈值设置为0.1以识别最相关的代谢途径[gydF4y2Ba55gydF4y2Ba那gydF4y2Ba56gydF4y2Ba].最后,将代谢途径分析结果(代谢组视图)以图表形式呈现。的gydF4y2BaP.gydF4y2Ba将各代谢途径的值进行对数转换,然后设置为y轴,路径影响值设置为x轴。图中的每个节点代表一个代谢途径。节点颜色表示gydF4y2BaP.gydF4y2Ba,节点半径表示各代谢途径的影响值[gydF4y2Ba54gydF4y2Ba].因此,位于“代谢组视图”右上角的暗红色大圆圈与位于图左侧的黄色小圆圈相比,代表了主要的改变路径。然后使用vted软件可视化显著改变的代谢物的路径图[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
可用性数据和材料gydF4y2Ba
在当前研究中使用和/或分析的数据集可从作者的合理要求(朱焦军,gydF4y2Bajiaojunzhu@iae.ac.cngydF4y2Ba;元的歌,gydF4y2Basongyuan_in2000@yeah.netgydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- AMDIS:gydF4y2Ba
-
自动质谱反褶积与识别系统gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- ATP:gydF4y2Ba
-
腺苷三磷酸gydF4y2Ba
- CAS:gydF4y2Ba
-
中国科学院gydF4y2Ba
- GC-MS:gydF4y2Ba
-
气相色谱分析-质谱法gydF4y2Ba
- HCA:gydF4y2Ba
-
分层集群分析gydF4y2Ba
- LSD:gydF4y2Ba
-
最低的区别gydF4y2Ba
- MBKPFs:gydF4y2Ba
-
古兰经混合阔叶松(gydF4y2BaPinus Koraiensis.gydF4y2Ba摘要。森林调查);MSTFAgydF4y2Ba
(N-Methy-N) - trimethyl-silyl trifluoroacetamidegydF4y2Ba
- PCA:gydF4y2Ba
-
主要成分分析gydF4y2Ba
- PDS:gydF4y2Ba
-
主要休眠种子gydF4y2Ba
- PDS5:gydF4y2Ba
-
5天孵化的初级休眠种子gydF4y2Ba
- PDS11:gydF4y2Ba
-
孵化11天的初级休眠种子gydF4y2Ba
- 一同开展:gydF4y2Ba
-
从初级休眠中释放的种子gydF4y2Ba
- PDRS5:gydF4y2Ba
-
经过5天培养的种子从初级休眠中释放出来gydF4y2Ba
- PDRS11:gydF4y2Ba
-
孵化11天的种子从初级休眠中释放出来gydF4y2Ba
- PLS-DA:gydF4y2Ba
-
偏最小二乘判别分析gydF4y2Ba
- 标准偏差:gydF4y2Ba
-
相对标准偏差gydF4y2Ba
- 柠檬酸:gydF4y2Ba
-
三羧酸周期gydF4y2Ba
- 紫外线:gydF4y2Ba
-
单位方差gydF4y2Ba
- 贵宾:gydF4y2Ba
-
在投影中重要性的变化gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
朱建军,毛振华,胡丽丽,张建新。人为干扰水平对东北山地次生林植物多样性的响应J For Res. 2007; 12:403-16。gydF4y2Ba
- 2.gydF4y2Ba
田y,吴jg,kou xj,王tm,mou p,ge jp。阿穆尔虎种群动态的时空模式和主要原因。生物方向SCI。2009; 17:211-25。gydF4y2Ba
- 3.gydF4y2Ba
王YJ。红松森林。哈尔滨:东北林业大学出版社;1995.gydF4y2Ba
- 4.gydF4y2Ba
李杰,郭QX,李鹏,李鹏河北木潇湘山区硬木森林切割土地的研究。(在中国)。j东北前一个。1995年; 6:38-44。gydF4y2Ba
- 5.gydF4y2Ba
李艳斌,牟鹏,王天明,葛太平。再生潜力评价gydF4y2BaPinus Koraiensis.gydF4y2Ba在中国小兴安岭的松硬木混交林。J For Res. 2012; 23:543-51。gydF4y2Ba
- 6.gydF4y2Ba
宋勇,朱建军,严清良,王光贵。红松种子:在接下来的2年里,将休眠的变化与发芽联系起来。林业。2018;91:98 - 109。gydF4y2Ba
- 7.gydF4y2Ba
Finch-Savage我们,Leubner-Metzger G.种子休眠和萌发的控制。新植物。2006; 171:501-23。gydF4y2Ba
- 8.gydF4y2Ba
Baskin CC, Baskin JM。《种子:生态学、生物地理学与休眠与萌发的进化》第2版。圣地亚哥:学术出版社;2014.gydF4y2Ba
- 9.gydF4y2Ba
Baskin CC,Thompson Km,Baskin J.发芽生态学中的错误以及如何避免它们。种子sci res。2006; 16:165-8。gydF4y2Ba
- 10。gydF4y2Ba
布雷JD。种子萌发和休眠。植物细胞。1997;9:1055 - 66。gydF4y2Ba
- 11.gydF4y2Ba
王志强,王志强,王志强,王志强。种子萌发与活力的关系。植物学报2012;63:507-33。gydF4y2Ba
- 12.gydF4y2Ba
Ribeiro Pr,Willems Laj,Mutimawurugo MC,Fernandez LG,Castro Rdd,Ligterink W,Hilhorst HWM。代谢物分析gydF4y2Ba萝藦gydF4y2Ba不同温度下的萌发为成功育苗提供了新的认识。植物科学。2015;239:180 - 91。gydF4y2Ba
- 13.gydF4y2Ba
Chibani K,Ali-Rachedi S,Job,Job D,Jullien M,Grappin P.拟南芥种子休眠蛋白质组学分析。植物理性。2006; 142:1493-510。gydF4y2Ba
- 14.gydF4y2Ba
Downie B, Bewley JD。白云杉(gydF4y2Ba云杉glaucagydF4y2Ba)种子在萌发时及萌发后。杂志。2000;110:1-12。gydF4y2Ba
- 15.gydF4y2Ba
Fei HM, Ferhatoglu Y, Tsang E, Huang DQ, Cutler AJ。与诱导次生休眠有关的代谢和激素过程gydF4y2Ba芸苔栗鸟gydF4y2Ba种子。植物学。2009;87:585 - 96。gydF4y2Ba
- 16.gydF4y2Ba
苹果种子胚胎休眠的代谢控制:70年的研究。植物学报。2011;33:1-24。gydF4y2Ba
- 17.gydF4y2Ba
代谢组学:系统生物学的整合技术。生物分析法。2010;2:829-36。gydF4y2Ba
- 18.gydF4y2Ba
Das A,Kim DW,Khadka P,Rakwal R,Rohila JS。揭示小麦胚胎中的关键代谢物改变,其源自患有对比休眠状态的新鲜收获和水吸水种子。前植物SCI。2017; 8:1203。gydF4y2Ba
- 19.gydF4y2Ba
Gao F, Jordan MC, Ayele BT.转录程序对普通小麦种子休眠及其成熟后释放的调控(英文)gydF4y2BaTriticum aestivum.gydF4y2BaL.)。植物Biotechnol J. 2012; 10:465-76。gydF4y2Ba
- 20.gydF4y2Ba
夏Q,Maharajah P,Cueff G,Rajjou L,Prodhomme D,Gibon Y,Bailly C,Corbineau F,Meimoun P,El-Maarouf-Bouteau H.整合蛋白质组学和酶促成本将种子代谢的译成种子代谢译成种子休眠温度和酶发芽。植物SCI。2018; 269:118-25。gydF4y2Ba
- 21.gydF4y2Ba
冷分层和外源硝酸盐在过程中会产生类似的功能蛋白组调整gydF4y2Ba拟南芥gydF4y2Ba种子休眠。J Proteome Res. 2012; 11:5418-32。gydF4y2Ba
- 22。gydF4y2Ba
Hance BA, Bevington JM枫树胚分层和休眠释放过程中蛋白质合成的变化(gydF4y2Ba宏碁蔗糖gydF4y2Ba).杂志。1992;86:365 - 71。gydF4y2Ba
- 23。gydF4y2Ba
诺兰·TL,墨菲·杰比。休眠糖松子层积和温育过程中的蛋白质合成和氨肽酶活性。植物生理学杂志,1986;124:1-10。gydF4y2Ba
- 24。gydF4y2Ba
Szczotka Z,PawłowskiT,Krawiarz K.蛋白质和多胺在欧洲山毛榉的休眠期间(gydF4y2BaFagus sylvatica.gydF4y2BaL.)种子。Acta physiol植物。2003; 25:423-35。gydF4y2Ba
- 25.gydF4y2Ba
墨菲jb,nolland tl。对休眠糖杉木种子氧化代谢的温度效应。植物理性。1982; 70:1410-2。gydF4y2Ba
- 26.gydF4y2Ba
Einali AR, Sadeghipour HR摘要湿冷法缓解核桃仁的休眠不依赖于贮藏蛋白的动员。树杂志。2007;27:519-25。gydF4y2Ba
- 27.gydF4y2Ba
辛宏伟,赖丽,赖光辉。种子休眠的生理生化研究gydF4y2BaPinus Koraiensis.gydF4y2Ba-碳水化合物对离体胚萌发的影响及层积过程中种子碳水化合物的变化。(在中国)。禹州大学1991;1:33-7。gydF4y2Ba
- 28.gydF4y2Ba
宋颖,朱俊杰。大田条件下湿冷分层如何影响红松种子的休眠释放(gydF4y2BaPinus Koraiensis.gydF4y2Ba) ?种子科学技术。2016;44:1-16。gydF4y2Ba
- 29.gydF4y2Ba
毛志军,袁学勇,祖永刚,赵国贵。研究了种子的形态特征和种皮显微结构gydF4y2Ba松果体sibiricagydF4y2Ba和gydF4y2BaP rokaiensis.gydF4y2Ba.林业科学,2003;39:155-8。gydF4y2Ba
- 30。gydF4y2Ba
Bewley JD,Bradford K,Hilhorst H,Nonogaki H.种子:发育的生理学,萌发和休眠。纽约:斯普林克;2013年。gydF4y2Ba
- 31.gydF4y2Ba
黄志强,王志强,王志强,等。乙烯信号通路与氰化物对向日葵种子休眠的影响。J Exp Bot. 2008; 59:2241-51。gydF4y2Ba
- 32.gydF4y2Ba
Yazdanpanah F,Hanson J,Hilhorst H,Bentsink L.在吸收休眠和成熟的种子的吸收过程中差异表达基因 - 反向遗传学方法。BMC植物BIOL。2017; 17:151。gydF4y2Ba
- 33.gydF4y2Ba
引用本文Preston J, Tatematsu K, Kanno Y, Hobo T, Kimura M, Jikumaru Y, Yano R, Kamiya Y, Nambara egydF4y2Ba拟南芥gydF4y2Ba种子:休眠种质与非休眠种质的比较研究。acta botanica yunnanica(云南植物研究). 2009;50:1786-800。gydF4y2Ba
- 34。gydF4y2Ba
Chao WS, Doğramaci M, Anderson JV, Foley ME, Horvath DP。叶枝休眠和非休眠种子及冠芽基因表达的相似性和差异性(gydF4y2Ba大戟属植物esulagydF4y2Ba).BMC植物BIOL。2014; 14:216。gydF4y2Ba
- 35。gydF4y2Ba
吴旭,刘勇,龚军,冯超,王旭,李军。植物形态特征及组成的多样性gydF4y2BaPinus Koraiensis.gydF4y2Ba摘要。等Zucc。来自长白Moutain和Xiaoxing'Anling地区的种子[中文]。Chem Ind for Prod。2011; 31:79-82。gydF4y2Ba
- 36。gydF4y2Ba
Eastmond PJ, Germain V, Lange PR, Bryce JH, Smith SM, Graham IA。缺乏乙醛酸循环的油料种子萌发后的生长和脂质分解代谢。美国国家科学学院2000;97:5669-74。gydF4y2Ba
- 37.gydF4y2Ba
Murphy JB, Hammer MF。糖松胚的呼吸作用和可溶性糖代谢。杂志。1988;74:95 - 100。gydF4y2Ba
- 38.gydF4y2Ba
Bove J,Jullien M,格拉普蛋白P.种子萌发研究中的功能基因组学。基因组Biol。2001; 3:1-5。gydF4y2Ba
- 39.gydF4y2Ba
α-鸦胺素对拟南芥种子蛋白质组的影响揭示了种子萌发过程中储存和新合成mrna的独特作用。植物杂志。2004;134:1598 - 613。gydF4y2Ba
- 40.gydF4y2Ba
Cadman CS, Toorop PE, Hilhorst HWM, Finch-Savage WE。拟南芥cvi种子在休眠周期中的基因表达谱表明了一种共同的潜在的休眠控制机制。植物j . 2006; 46:805-22。gydF4y2Ba
- 41.gydF4y2Ba
Bassel Gw,Lan H,Glaab E,Gibbs DJ,Gerjets T,Krasnogor N,Bonner AJ,Holdsworth MJ,Pronte NJ。基因组网络模型捕获种子萌发显示植物细胞相变的协调调节。Proc Natl Acad Sci U S A. 2011; 108:9709-14。gydF4y2Ba
- 42。gydF4y2Ba
ramaiah pk,durzan dj,mia aj。胶林萌发期间过氧化物酶的氨基酸,可溶性蛋白质和同工酶样式。可以j bot。1971; 49:2151-61。gydF4y2Ba
- 43.gydF4y2Ba
JE国王,吉福德DJ。火炬松种子萌发和幼苗早期生长过程中氨基酸的利用(ⅰ。精氨酸和精氨酸酶活性)。植物杂志。1997;113:1125-35。gydF4y2Ba
- 44.gydF4y2Ba
布雷厘米。植物氮素代谢:植物发育过程中氮素的相互转化和转运。纽约:朗文;1983.gydF4y2Ba
- 45.gydF4y2Ba
Avila C,SuárezMF,Gómez-Maldonado J,Francisco M,CánovasFM。苏格兰松树中两种细胞溶质谷氨酰胺合成酶基因的空间和时间表达:针叶树发育早期氮代谢的功能影响。工厂J. 2001; 25:93-102。gydF4y2Ba
- 46。gydF4y2Ba
全国森林种子标准化技术委员会。林木种子检验规程。1999.gydF4y2Ba
- 47。gydF4y2Ba
王志强,王志强,王志强,等。草地苗床条件对黄松种子休眠的影响。J Range management . 2004; 57:661-7。gydF4y2Ba
- 48。gydF4y2Ba
胡赵J, C,曾庆红J,赵Y,张J, Chang Y,李,赵C,陆X,徐g .极性代谢物的研究在烟草使用毛细管electrophoresis-mass光谱法从不同的地理起源。代谢组学。2014;10:805-15。gydF4y2Ba
- 49.gydF4y2Ba
周军,张玲,常勇,陆翔,朱智,徐刚(gydF4y2Ba栽培稻gydF4y2Ba和野生型。acta Proteome Res. 2012; 11:4351-60。gydF4y2Ba
- 50。gydF4y2Ba
关键词:气候因子,气相色谱-质谱,假目标法,烟草,代谢谱蛋白质组学杂志2013;12:5072-83。gydF4y2Ba
- 51。gydF4y2Ba
吴丹,蔡胜,陈敏,叶林,陈振华,张海涛,戴飞,吴福彬,张桂平。野生和栽培大麦对盐胁迫的组织代谢响应。《公共科学图书馆•综合》。2013;8:e55431。gydF4y2Ba
- 52.gydF4y2Ba
任伟,尹杰,高伟,陈胜,段建林,李天军,李娜珍,彭艳艳,尹玉玲.产肠毒素代谢变化的代谢组学研究gydF4y2Ba大肠coli-infectedgydF4y2Ba小猪。rsc adv。2015; 5:59550-5。gydF4y2Ba
- 53.gydF4y2Ba
夏俊,Wishart DS。基于网络的代谢组学工具,用于途径分析和可视化。生物信息学。2010;26:2342-4。gydF4y2Ba
- 54。gydF4y2Ba
山L,Liao F,Jin H,YE FS,Tong PJ,肖LW,周J,吴CL。用气相色谱法与质谱法通过气相色谱法与患者腰椎椎间盘突出症及其中药亚型的血浆代谢剖析。Mol Biol Syst。2014; 10:2965-73。gydF4y2Ba
- 55。gydF4y2Ba
关键词:优plc /ESI-SYNAPT-HDMS结合模式识别代谢途径分析枣苷a对失眠的潜在靶点及干预作用J蛋白质组。2012;75:1411-27。gydF4y2Ba
- 56.gydF4y2Ba
González-Domínguez R, García-Barrera T, Gómez-Ariza JL。用于识别阿尔茨海默病中代谢途径改变的代谢物分析医药生物学报。2015;107:75-81。gydF4y2Ba
- 57.gydF4y2Ba
vant:生物网络背景下的高级数据分析和可视化系统。BMC生物信息学。2006;7:109-21。gydF4y2Ba
确认gydF4y2Ba
我们感谢颜巧玲博士、余立中博士、杨凯博士和高田博士对这项研究提出的宝贵意见和建议。我们也感谢李明才博士、赵艳妮博士和胡春秀博士的技术支持。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金项目(no . 31330016, no . 31830016)资助资助方没有参与研究的实验设计、数据收集、分析和解释,也没有参与手稿的撰写。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
YS和JZ构思设计了实验。对种子进行处理,测定生理指标。YS分析数据并撰写论文。JZ修改了论文。所有的作者阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
宋永杰,朱建军,朱建军,等。植物代谢途径在维持植物初级休眠中的作用gydF4y2BaPinus Koraiensis.gydF4y2Ba种子。gydF4y2BaBMC植物杂志gydF4y2Ba19,gydF4y2Ba550(2019)。https://doi.org/10.1186/s12870-019-2167-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2167-2gydF4y2Ba
关键词gydF4y2Ba
- 红松,初级休眠,萌发,代谢组学gydF4y2Ba