摘要
背景
通过接枝人工合成的嵌合体对于常年木质植物的繁殖是至关重要的。'hongrou huyou'(柑橘changshan-huyou+柑橘unshiu)是一种新的嫁接嵌合体,起源于a柑橘changshan-huyou(“C”)接穗被顶部嫁接到一株蜜橘砧木上(c . unshiu、“O”)。该嵌合体被命名为OCC,因为第1层(L1)的细胞层结构为O, L2和L3的细胞层结构为C。本研究对OCC和两种供体不同组织的初级代谢物、挥发物和类胡萝卜素的分布进行了研究,旨在确定供体与代谢物之间的关系。
结果
代谢物谱的比较显示,代谢物的量和组成在果胶和果汁囊之间不同,以及两种供体中的每一个。没有或存在特异性代谢物(例如类胡萝卜素violaxanthin和β在三种表型上鉴定了每种组织中的挥发性烃天黄素,挥发性烃衍生物柠檬酸柠檬酸和山梨糖)。根据主要成分分析(PCA),总体而言,嵌合果白果胶中的代谢物来自供体C,而钦革果汁中的果汁中的那些来自捐赠O.
结论
系统比较了OCC和两名供体的果皮和果汁囊中初级代谢物、挥发物和类胡萝卜素的分布。不同组织间、OCC与供体间代谢物的含量和组成不同。在OCC的不同组织中观察到明显的供体代谢物遗传模式,且与层起源基本一致;结果表明,嵌合体的果皮来源于C,汁液囊来源于o,为基因型分化、柑橘育种评估和人工嵌合体供体选择提供了潜在的化学标记。
背景
植物嵌合体是由两种以上基因型细胞组成的植物。根据“Tunica-Corpus”理论,双子叶植物的茎尖分生组织(SAM)由最外层的L1、L2和L3三个细胞层组成[1].在柑橘类水果中,汁囊和表皮果皮来源于L1;果皮、种子和果节壁的颜色和香气都是L2发育的;维管束由L3产生;水果的形状由L2和/或L3决定[2].目前已有柑橘嵌合体的发现和鉴定的报道。Zhou等发现不同基因型细胞间的相互作用导致周缘嵌合体果实NFF (L1-L2-L3 = N-F-F)和FNN的DNA突变[2].Wu等人发现嵌合体Ekuliku的果实特征与源供体不一致,嵌合体叶片的横截面结构与两个供体有很大的不同[3.].张和他的同事研究了两种名为“早红”脐橙的柑橘嵌合体[4]和“红肉桃叶”橙[5];两个嵌合体都是由捐赠者的甜橙(素类)和蜜橘。结果表明,嵌合体果实的气孔密度和果肉香气与源供体的气孔密度和果肉香气不一致;嵌合体果实显示了两个供体的共同特征[4,5].由于这些形态和DNA突变水平的变化发生在植物嵌合体中,因此嵌合体中代谢产物在组织和/或细胞相互作用中的积累模式值得进一步研究。
柑桔类水果的营养成分非常珍贵,许多研究已经对柑桔(c . sinensis)、官员(c .试)、柚子(c .茅)和葡萄柚(c .天堂金花蛇)[6,7,8,9].初级代谢物,如糖和有机酸,是一个不同的有机化合物类,对植物生长和内部质量是必不可少的[10].例如,高含量的柠檬酸与高水平的游离氨基酸(特别是脯氨酸)可能是柠檬比其他柑橘保质期长的一个原因[11].挥发物是几种重要的次生代谢物,因其显著的健康促进作用和较高的商品价值而受到广泛关注。d-柠檬烯是柑橘中主要的挥发性物质,特别能预防乳腺癌和直肠癌[12].芳樟醇和乙酸芳樟酯已被用作抗炎剂[13],而吉macrene D的重排最终产生了一些天然化合物[14].类胡萝卜素是柑橘类水果中复杂而丰富的分子[15].一些含类胡萝卜素β-环部分是维生素A的前体,对慢性疾病和癌症预防非常有益[16].柑橘类胡萝卜素的生物合成和调控已被广泛研究[17,18,19,这些报道有助于我们分析嵌合体中类胡萝卜素的表达。
嫁接嵌合体来源于嫁接连接处的不定芽,由两种不同的基因型或不同的物种组成[20.,21,22,23].一种新的嫁接嵌合体“红柔虎有”(柑橘changshan-huyou+c . unshiu)起源于接穗“常山胡柚”(c . changshan-huyou,缩写为“C”)和“Owari”萨摩普通话(c . unshiu,缩写为“O”)。这种嵌合体仍然是黄色的皮肤,类似于C,但获得了在O中观察到的暗橙汁囊(表1,无花果。1).此外,嵌合体通过简单序列重复(SSR)扩增,将两个供体的核、叶绿体和线粒体基因组中的特定DNA带结合在一起。因此,假设嵌合体为OCC,因为L1来源于O,而L2/ L3来源于C(数据未显示)。
在本研究中,在嵌合体和两种供体的果片和果汁囊中研究了初级代谢物,挥发物和类胡萝卜素的谱,分析了嵌合体和每个供体植物之间的代谢物积累的相关性供体植物对不同层的贡献。
结果
OCC及其供体的主要代谢物
如表所示2,在果皮中鉴定出21种初级代谢物。根据统计分析,在这些概要文件中,OCC (OCP)的果皮与C (CP)的果皮相比,与O (OP)的果皮有更多的相似之处。其中,4-aminobutanoic酸、莽草酸和棕榈酸是专门检测(OCP和CP,表明这三个化合物(OCP只由CP。相比之下,山梨糖是特定于OP,没有可检测水平(OCP和CP。(OCP和CP拥有更高浓度的酸和总糖含量低;而OCP中含有中等含量的酒精。总的来说,OCP的总代谢物含量显著低于任何一个供体。
值得注意的是,在OCP中观察到一些特殊的化学特性。3种样品的酸谱中,OCP中氨基甲酸含量最高;除焦糖、果糖和土兰糖外,其余各糖组分含量均最低。
十八种主要物质,列于表中3.在O(OJ),OC(OCJ)和C(CJ)的果汁中检测到检测到。在本研究中,在OCJ和两个捐赠者的果汁囊之间的总原代代谢物中没有发现显着差异。有趣的是,5种代谢物(奎宁酸,木糖,阿拉伯糖,三种糖和Scyllo-intositol)在OCJ和两种供体的果汁囊中显着不同。在三种品种中,ACRJ中的阿拉伯糖和奎宁酸的水平分别是最高和最低的。OCJ的其余3代谢物与两个捐助者的剩余3种代谢物显着不同。此外,OCJ中的8个代谢物轮廓与一个或两个捐助者一致。但是,这些简档实际上与O有更多相似之处;例如,在OCJ和OJ中存在4-氨基丁酸,棕榈酸和酶,但在CJ中不存在。相反,山梨糖仅存在于CJ中,在OCJ和OJ中无法检测到。
有趣的是,3种化合物在OCJ(草酸、山梨糖和鼠李糖)中表现出遗传差异。其中,草酸和鼠李糖仅在OCJ中检测不到,导致OCC与供体之间存在明显差异。然而,在OCJ及其层源供体O中均未检测到山梨糖。
OCC及其供体的挥发性组成
关于三个品种的果皮中挥发性物质,表中列出了36种物质4,包括单萜、倍半萜、醇类、醛类、酚类等。单萜是最丰富的定量谱;d- 二烷酮是占优势化合物,分别占OP,OCP和CP总挥发物的88.65,81.23和80.77%。后d- 二烷烃,三种品种的主要常见化合物是γ.萜品烯,β- 金英和α.- 新尼。
结果表明,OCP与CP的相关性更强烈,而不是与OP相关。首先,根据统计分析,OCP和Cp之间的25个挥发物在没有显着差异,但在OCP和OP之间只有16个挥发物没有显着差异。该发现表明CP在调节OCP中的化学分析中的主导地位,并且OCP中的更多化学性状从CP遗传而不是OP。其次,OCP中的主要挥发物与CP中的主要挥发物完全一致,包括d柠檬烯,γ.萜品烯,germacrene D,β- 金英和α.-蒎烯(从高到低分选),但OP中主要挥发物的相对浓度存在差异(d柠檬烯,γ.萜品烯,β- 金英,α.-Pinene,β-elemene)。这主要是由于在OCP和CP中吉macrene D的含量显著高于OP,强烈说明吉macrene D主要来源于CP, OP对OCP的发展影响较小。第三,值得注意的是2,4-二t-丁基苯酚是真正独特的,仅在OP中未检测到;但同时为OCC和C所有。
此外,OCP中的大部分挥发分要么倾向于一个供体,要么在两个供体之间保持一定程度的平衡。然而,只有(E)-3-己烯-1-醇和3-己烯醛在OCP中明显升高。
在食用果汁囊中,检测到最多19个挥发性化合物(表5).OCJ与OJ在总挥发物和单萜(主要挥发物)中呈高度相关,尤其是在优势物质中;的浓度d-柠檬烯在OJ和OCJ中显著高于CJ,分别占总挥发分的78.07和72.64%,而在CJ中仅占60.03%。除了d-柠檬烯,壬酸甲酯、copaene、辛醛在OJ和OCJ之间也有显著的相似性,我们假设OCJ中的这些化合物在很大程度上都来源于O。
此外,OCJ中还观察到典型的挥发性代谢物。例如,诺卡酮和十五烷酮在OCJ中含量最高。相比之下,γ.OCJ组-萜烯含量明显低于两组。此外,我们特别感兴趣的α.- 仅在OCJ但不在两种供体中检测到的ylangene,并且这种挥发性很少在任何柑橘种类中报道。
OCC及其供体的类胡萝卜素成分
如表所示6,在OCC和两个供体中检测到共有9类胡萝卜素。通常,OCC中的类胡萝卜素的内容物和类型与果皮中的C中的COROTENOIPS非常相似,而它们在果汁囊中的供体之间是中间体。
3种基因型中,果皮和汁囊中供体O的类胡萝卜素含量最高。OCJ中除紫黄质、叶黄素和叶黄素外的类胡萝卜素均与CP显著一致。OCJ中除紫黄质、叶黄素和叶黄素外的类胡萝卜素均介于二者之间。事实上,在OJ和OCJ中检测到的类胡萝卜素都比CJ中检测到的高。果皮和汁囊中α-胡萝卜素的积累明显少于其他类胡萝卜素。
OCC和两种捐赠者的皮肤和果汁囊中的主要成分不同。violaxanthin是皮肤中的主要成分,和β-隐黄质在汁囊中占优势。OCJ中的主要类胡萝卜素,如β-隐黄质、叶绿烯和叶绿烯的变化明显大于OCP,使OCC的肉色与O相近。
分析OCC和两个供体中总类胡萝卜素的相关性,以确定组织着色的来源。由此可见,OCC中类胡萝卜素的积累有明显的供体偏好性,果皮和汁囊中的类胡萝卜素积累也不同7).果皮中OCC的总类胡萝卜素与果皮中C和O的总类胡萝卜素显著相关。果汁囊中,只有OCC与供体O的相关系数显著(0.957)。成熟OCC果皮和汁囊中类胡萝卜素的供体偏置可以部分解释为什么OCC果皮为浅黄色,类似供体C,而汁囊为暗橙色,类似供体O。
对OCC和两名供体的果皮和果汁囊代谢物进行PCA分析
对于这三类代谢物,采用主成分分析(principal component analysis, PCA)对OCC和两个供体的不同组织进行比较。
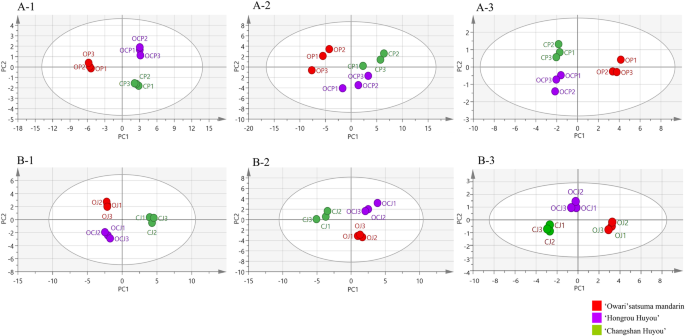
在得分图的PC1方向上,初级代谢物中的供体O和其他基因型(OCC和供体C)有明显区别(图。2-1)、挥发物(无花果。2-2)和类胡萝卜素(图。2A-3),根据果皮。
在果汁囊中,在初级代谢物中,供体C与OCC和供体O有明显的区别(图)。2 b-1)、挥发物(无花果。2 b-2)和类胡萝卜素(图。2 b-3),按PC1方向得分图。然而,在PC1中,OCJ与OJ分离(图。2B-3),表明嵌合体中的类胡萝卜素累积模式的新型谱。
讨论
研究重点是表型,果实品质和基因组组合物[2,3.,4,5对嵌合植物的知识作出了贡献;然而,代谢物在不同基因的细胞中积累的机制仍不清楚。本研究系统地比较了柑桔嵌合体(OCC)及其供体植物的初级代谢物和次级代谢物的分布,为研究嵌合体供体的遗传贡献和遗传模式提供了理论依据。
OCC供体显性代谢物分析
在柑橘嵌合体中,汁囊由L1细胞层发育而来,果皮则来自L2细胞层[1,2].在本研究中,OCC嵌合体中的代谢物更接近果皮中C的代谢物,但更接近果汁囊中O的代谢物,这似乎证实了推测的层起源。类胡萝卜素是柑橘的主要营养成分,其含量和组成因柑橘品种而异[24].一些报道集中在通过类胡萝卜素谱的差异来分化柑橘基因型。例如,32种柑橘类水果被明显地区分开来β-果汁隐黄质含量[16].在此基础上,对25个柑桔基因型进行了分类独联体黄质和β-果汁隐黄质[25].此外,黄质和β利用黄酮和汁囊中的-隐黄质对39种柑橘基因型进行了鉴别[26].根据柑橘中特定类型类胡萝卜素的含量,将其分为三类。蜜橘代表着柑橘品种,蕴藏量丰富β- 两种强剂和果汁囊中的晶状体。橘子在Flavedo和果汁囊中富含紫杉蛋白。Pummelo与橘子和普通话分开,因为它缺乏β-cryptoxanthin和violaxanthin [15].在这项研究中,供体C被记录为柚子、橙子和/或其他柑橘品种的杂交[27,28,29].值得注意的是,C的原代细胞系包括柚子和橘子,其中含有低水平的β玉米黄质。在本研究中β-隐黄质在OCP中的积累量与CP相同,而OCJ的积累量较大β-隐黄质比CJ多。同样,之前对柑橘chimera Ekuliku的一项研究表明,它的汁囊是由L1供体Nankan (c . unshiu),表皮取自L2和L3供体Hamlin (c . sinensis)[3.].同样,叶的形态变化芸苔属植物嵌合体仅由红甘蓝控制,在后期可重现和定向[30.].
代谢物首先在体内生物合成。三个关键基因(CitPds,CitZds和CitCrt)据报道,在类胡萝卜素生物合成途径的上游在细胞杂交中以低水平表达c .试和c .利,其结果是杂种中类胡萝卜素含量较低[31].类似地,“Bonnaza”海军橙(c . sinensis)和粗柠檬(C. jambhiri.)向粗柠檬的表达模式显示出与粗柠檬的表达模式类似的类胡萝卜素含量与粗Lemon(Zeaxanthin e环氧酶基因(Zeaxanthin)和Zeaxanthin ePoxid酶基因(Zeaxanthin的表达模式更相似[32].这些科学家认为,类胡萝卜素基因的表达并不是亲本之间的简单相加效应,而是表明了一定的基因组印记,即多倍体中同源基因的表达倾向于亲本中的一方[31,32].因此,有趣的是,嵌合体OCC的胡萝卜素生成是两组基因不同的细胞的平衡代表。假设在新产生的嵌合体OCC中,来自不同层的同源基因可能在相同的代谢途径中选择性表达,这是因为推测在嫁接过程中诱导了DNA甲基化的变化[33],最后在每个果实组织中生成表达模式的坐标,从而实现两组基因不同的细胞共存。
OCC的特征代谢物分析
然而,OCC中一些代谢物(包括初级代谢物和挥发物)的积累是针对蛋鸡源供体的;一些代谢物与在两个供体中观察到的分布相去甚远(即显著高于或低于两个供体)。这一观察结果类似于两个柑橘杂交品种,在杂交品种的113个挥发性谱中,有56个表现出明显高于或低于亲本[34].本研究中,吉麦克烯D的含量(表5)分别是CJ和OJ的6倍和17倍。阿拉伯糖的含量分别是CJ和OJ的3倍和9倍以上3.),据报道,该概况是膳食纤维的良好来源,可用于果汁生产[35].综上所述,结果表明基因的表达水平发生了改变,可能是由于层移造成的。
有趣的是,一个名为α.-ylangene仅在嵌合体OCC的汁囊中检测到(表1)5).α.-ylangene是一种独特的化合物,很少在任何柑橘的挥发性组分中被报道,是葡萄成熟后期的主要倍半萜[36].类似地,先前的研究报道,除了通过RAPD分析检测到的,除了两个供体植物的特定条带之外,柑橘嵌合体NFF和FNN还具有特异性新条带,表明嵌合体在DNA水平处相互作用[2].因此,推测与细胞间运动有关的基因突变可能与此有关α.-ylangene在嵌合体发展过程中完全在OCC中合成。最近,基因突变被认为影响了植物内转录因子(TFs)的易位和生物活性[37,38].此外,嵌合体中由细胞间转运和基因突变引起的遗传变异也得到了广泛的研究。一种名为“马里”的葡萄周嵌合体是由L2细胞入侵而产生的,它引起了青铜皮肤的自发突变[39].一些研究报告称,葡萄皮诺的浆果颜色变异可以被映射回一个名为“浆果颜色基因座”的单一基因座上的突变,该基因座编码四个串联基因MYB染色体2上的转录因子[40,41,42].费尔南德斯和他的同事们研究了葡萄奇美拉浆果的体重减轻,这是由不寻常的原因造成的VvpIL1、L2或两个细胞层的基因表达,导致后代表型变异(无肉)[43].在桃的突变体中,一个突变的细胞携带一个PRUPE.6G281100等位基因到L2中,导致桃的表型由平变圆[44].
嵌合体代谢物遗传规律的推测
迄今为止,有关植物嵌合体中化合物的遗传模式的知识有限。在嵌合体的人工合成和植物育种中,供体偏倚是一个引人注目的问题。嵌合表型与供体性状之间的关系一直存在争议。似乎砧木供体柑橘可能充当了内层供体(L1),重点是类胡萝卜素合成[4,5,45].因此,嫁接后发现了一些新的“红肉”表型,包括本研究中的OCC。与上述报道一致的是,OCC的果皮和汁囊的颜色与层源供体相似;然而,初级代谢物(如有机酸和糖)和挥发物(如γ.-萜烯)与层间供体部分不同,显示出层间可能的“复合”。最近,小rna和DNA甲基化被认为参与了砧木与接穗的相互作用,以描述嫁接嵌合的遗传变异。例如,研究人员发现一些保守的mirna在移植嵌合体中有差异表达(芸苔属植物juncea+b . oleracea)后代rTTT(嵌合体有性自交)和供体植物TTT (b . juncea),这可能会改变它们的目标基因的表达[30.].此外,在嫁接嵌合体芸苔属植物juncea和b . oleracea,测序分析显示,DNA甲基化影响开花时间和赤霉素反应相关基因表达,并可能导致后代表型变异[6].因此,由于OCC具有更类似于一个供体的代谢物或介于两个供体之间的代谢物,调节代谢物产生、运输和积累相关基因的传递因子可能会受损。
结论
系统地研究和比较了OCC和两种供体果皮和果汁囊中初级代谢物、挥发物和类胡萝卜素的基因表达模式和积累情况。不同基因型和组织间代谢产物的含量和组成存在差异。在3个基因型中鉴定了在某些组织中存在或不存在的代谢物(α-胡萝卜素和叶绿烯)。在OCC的不同组织中观察到明显的供体代谢物遗传模式,表明代谢物汁囊的妄想从L1类似捐赠O和那些皮的嵌合体是类似于L2和L3捐赠者c这些概要文件提供了潜在的化学标记基因型差异和柑橘育种的评估;此外,它们还为人工嵌合过程中供体的选择提供了信息。
方法
植物材料和抽样
OCC是2001年由接穗C和砧木O顶接产生的,最近在浙江省常山县某果园的芽突变调查中发现了OCC。最近,在我们对嵌合体和两位捐献者的形态学和DNA特征的分析中,OCC被鉴定为嫁接嵌合体(未发表数据)。为了商业化生产,将OCC和供体(O和C)分别嫁接在其上枳壳trifoliata2005年,在常规管理下,连续12年保持稳定形态。每个基因型选取3株单株,每株果实成熟期采收10个大小、果皮颜色和位置一致的果实。每一种基因型的果皮(包括表皮、黄皮和反照率)都通过环切法从汁囊中仔细而迅速地分离出来。从一棵树上获得的果皮和汁液囊分别在液氮中混合和研磨成粉末。最后将样品保存在−80℃,以备后续研究。
初级代谢物和挥发性提取
主要和挥发性物质的评估使用的是最初开发的程序的修改[46].为了确定初级内容物,首先使用液氮将0.2g组织研磨成粉末,然后加入2.7ml纯的预冷( - 20℃)甲醇。将这些组分混合,并加入0.3ml核糖醇(0.2g / ml)作为内部标准。该程序后来施加到挥发性样品上。
对于挥发性分析,用真空冷冻干燥器(Labconco Freezoner,USA)冷冻干燥样品,并在液氮中完全研磨。将0.2g粉末样品倒入离心管(2mL体积)中,用500μL双蒸馏水(DDW)和500μlMB(含有0.02μL/ mL甲基甲基甲酸)均化,然后温和摇动.使用超声波浴(FS60,Fisher Scientific,Pittsburgh,PA)在4℃下保持40分钟的样品振动,并在4℃下以12000×g以12000×g离心10分钟。然后将上清液(200μl)转移到另一个管中。最后,用注射器注射1μl样品,并通过0.22μm膜(SCAA-104,Anpel,Shanghai,China)过滤,用于气相色谱 - 质谱(GC-MS)。
初级代谢物和挥发性分析
采用TRACE TR-5质谱柱(30 m × 0.25 mm × 0.25 μm;Thermo Scientific, Bellefonte, PA, USA)。以纯氦为载气,在1.0 ml/min, 50:1和1:1的裂解比下测定样品的果皮(黄嘌呤和反照率)和果汁囊。主成分和挥发性物质的浓度计算为μg/g FW。每个样品重复三次。
公众数据库Massbank (http://www.massbank.jp/)及Metlin (https://metlin.scripps.edu/index.pCF)支持初步代谢物的鉴定;对于其他一些化合物,我们从已发表的文献中获得信息。
类胡萝卜素提取
根据先前描述的方法提取OCC及其供体父母的总类胡萝卜素[47]有一些修改。使用冻干器冻干后,在50mL离心管中均化果汁囊粉(1g)和剥离粉末(0.5-1g)(LabconcoFreezone®)。接下来,加入15mL颜料萃取溶剂(正己烷/丙酮/无水乙醇,2:1:1,含有0.1℃的含量)。将样品进行超声波振动30分钟,并在400℃下以4000×g离心10分钟。将上清液转移到另外50ml离心管中,并使用15mL颜料溶剂萃取沉积物,直至无色。将上清液在50ml分离漏斗中合并,并使用饱和10%NaCl溶液洗涤3次,直至中性,丢弃底层。然后,将上清液分离成10mL离心管,并在真空条件下浓缩。将样品用2ml甲基叔丁基醚(MTBE)和2mL 10%KOH(含0.1℃)重新溶解,并将残余物在氮气下干燥。将样品保持在黑暗中10小时以进行皂化。然后,加入4ml饱和NaCl和2ml MTBE(含0.1℃)以更好地分离层并洗去水,加入5ml NaCl 3次以将溶液洗净中性。 Meanwhile, the supernatant was concentrated by vacuum and was diluted with 0.6–1 ml of MTBE (containing 0.1‰ BHT). The samples were centrifuged at 12000 rpm for 30 min at 4 °C for subsequent analysis.
类胡萝卜素的分析
以A(乙腈/甲醇,3:1,v/v,含0.1‰BHT, 0.05% TEA)和B (100% MTBE,含0.1‰BHT)为流动相的OCPLC为梯度洗脱法测定类胡萝卜素含量。流速固定在1 ml/min。使用以下梯度:0 min, (95:5);0-10分钟,A-B (95:5);10-19分钟,A-B (86:14);19-29分钟,A-B (75:25);29-54分钟,A-B (50:50);54-66分钟,A-B (26:74);67分钟,A-B(95:5)。上述梯度溶剂的体积为20 μl,采用外标法定量。 All carotenoid extraction, saponification and other assays described above were conducted under low light levels or in the dark.
统计分析
每个化合物的浓度用三个重复的平均值±标准差表示。采用SPSS 19.0软件(SPSS Inc., Chicago, IL, USA)进行统计学分析。采用单因素方差分析(ANOVA)计算显著差异,然后在5%水平进行邓肯多范围检验(p< 0.05),品种间用小写字母(a, b, c等)表示。不可检测物质在所有代谢物谱表中用“nd”标记。采用Pearson检验进行相关分析,显著性差异以“**”(p < 0.01). Principal component analysis was carried out by SIMCA 14.1.
数据和材料的可用性
本研究中产生和分析的所有数据均在本文中公布。
缩写
- CJ:
-
'常山Huyou'的果汁囊
- CP:
-
“常山胡柚”的皮
- OCJ:
-
OCC的汁囊
- (OCP):
-
OCC的剥离
- OJ:
-
'Owari'Satsuma普通话的果汁囊
- 人事处:
-
Owari蜜橘皮;
参考
- 1.
周缘嵌合体茎尖分生组织中细胞层的排列对细胞命运的影响。植物j . 1995; 7(2): 193 - 202。
- 2.
周建民,平田毅,刘志刚,等。柑橘嫁接嵌合体不同基因型组织间的相互作用。Euphytica。2002;126(3):355 - 64。
- 3.
吴S,Li Hy,梁Yr,Hirata Y. Chimaeriferus柑橘及其供体植物一种组合的形态和遗传分析。J Fruit Sci。2007; 24(1):1-5。
- 4.
张M,邓XX,秦币,陈克,张海,刘q,胡泽,郭立,宋wh,谭y,廖sc。柑橘新天然蠕虫肚脐睡衣的特征:“枣红”脐橙。J AM SoC Hortic SCI。2007; 132(3):1545-50。
- 5.
张敏,谢泽忠,邓XX,廖士林,宋文华,谭勇。甜橙和蜜橘嫁接嵌合体“红柔桃叶”的特性。中国林业科学。2015;33(3):390-5。
- 6.
李淑娟,王智,丁芳,孙丹,马志超,程玉军,徐军。国庆号苦药的含量变化。1’蜜橘(柑橘unshiuMarc。)连续3个赛季的果实开发期间。食品化学。2014; 145(13):963-9。
- 7.
景磊,雷正涛,张国威,Alan CP, David VH,谢建荣,Xi WP,周志强,Sumner LW。柑橘皮中精油的代谢谱及其分类学意义。代谢组学,2015;11(4):952 - 63。
- 8.
张海平,谢应祥,刘超,陈少林,胡树森,谢泽忠,邓XX,徐军。柑橘不同品种果实挥发性成分的综合比较分析。食品化学。2017;230:316-26。
- 9.
邵青生,刘海波,张艾尔,万云英,胡瑞华,李美美。用TDS-GC-MS分析4种柚子果皮挥发性成分。中国农业科学。2015;94(15):3248-54。
- 10.
类异戊二烯代谢的生物化学和分子生物学。植物杂志。1995;107(1):1 - 6。
- 11.
潘泽,刘q,云z,guan r,zeng wf,xu q,邓xx。番茄红素积累突变体的对比蛋白质组学揭示了氧化应激对甜橙色雌激素的重要作用(素类(L。]等)。蛋白质组学,2009;9(24):5455 - 70。
- 12.
Vigushin DM, Poon GK, Boddy A, English J, Halbert GW, Pagonis C, et al.;第一阶段和药代动力学研究d-柠檬烯在晚期癌症患者中的作用。癌症化学药物。1998;42(2):111-7。
- 13.
香精油中芳樟醇和乙酸芳樟酯成分的抗炎活性。植物学期刊。2002;9(8):721 - 6。
- 14.
Nils B, Konig WA。锗烯D作为倍半萜生物合成前体的作用:酸催化、光化学和热诱导重排的研究。植物化学,2000;55(2):141 - 68。
- 15.
柑橘基因型中类胡萝卜素谱的多样性及其相关基因的表达。Sci繁殖。2016;66:139-47。
- 16.
Goodner KL,Rouseff RL,Hofsommer OCJ。基于类胡萝卜素型谱的多元统计数据,橘子,普通话和杂种分类。JAgric Food Chem。2001; 49(3):1146-50。
- 17.
KATO M,Ikoma Y,Matsumoto H,Sugiura M,Hyodo H,Yano M.在柑橘类果实中成熟过程中胡萝卜素的积累和类胡萝卜素生物合成基因的表达。植物理性。2004; 134(2):824-37。
- 18.
Alquarzar B,罗格里戈MJ,ZacaríasL.类胡萝卜素生物合成及其在柑橘类水果中的调节。sci biotechnol的树。2008A; 2(1):23-5。
- 19.
黄志强,王志强,王志强,等。红肉橙突变体卡拉卡拉果实成熟过程中类胡萝卜素生物合成的调控。植物化学,2008 b, 69(10): 1997 - 2007。
- 20。
WinklerH.ÜBERPFROPFBASTARDEund PflflanlicheChimären。Ber der DTSCH BOT GES。1907; 25:568-76。
- 21。
植物嵌合体。伦敦:梅图恩出版社;1969.
- 22.
Stewart RN, Meyer FG, Dermen H. Camellia+ ' Daisy Eagleson ',嫁接嵌合体山茶花油茶和c . japonia.我是J机器人。1972年; 59:515-24。
- 23.
Jwamasa MNM, Okudal N, Ishiuchi D. in International Citrus Congress, Florida, USA, 71-574 (FL, 1977)。
- 24.
类胡萝卜素:水果中的色素。伦敦:学术;1987.
- 25.
Fanciullino Al,Dhuique-Mayer C,LURO F,Casanova J,Morillon R,Ollitrault P.培养柑橘类胡萝卜素多样性受到遗传因素的影响。JAgric Food Chem。2006; 54:4397-406。
- 26.
松本,Ikoma, Kato, Kuniga, Nakajima N, Yoshida T.柑橘果实中类胡萝卜素的LC-MS定量及柑橘品种间类胡萝卜素季节变化规律的比较。中国农业科学(英文版)。
- 27.
柑橘新品种“金柚”。浙江柑橘。1991;1:5-7。
- 28.
陈立国,胡晓强,赵树清。胡柚起源的分子研究。植物学报;2002;29(3):276-7。
- 29.
陈大成,杨华,郑亚平,陈永林,邱应祥。初步的识别柑橘changshanhuyou分子标记的精英基因型。中华医学会细胞生物学分会。2007;39(6):502-8。
- 30.
李建新,王勇,张丽,刘波,曹丽伟,齐志勇,陈立平。嵌合体后代中的遗传变异和小rna芸苔属植物juncea和芸苔属植物oleracea.acta botanica yunnanica(云南植物研究). 2013;64(16):4851-62。
- 31。
Bassene JB,Froelicher Y,Dhuique-Mayer C,Mouhaya W,Ferrer RM,Ancillo G,Morillon R,Navarro L,Ollitrault P.非添加性表型和转录组遗传在柑橘异常体细胞杂交中c .试和c .利:以果肉类胡萝卜素生物合成途径为例。植物学报2009;28(11):1689-97。
- 32。
郑宝宝,谢泽忠,郭伟伟。柑橘波纳莎脐橙和粗柠檬异源四倍体体细胞杂种果实类胡萝卜素、糖和有机酸的亲本显性遗传。植物学报。2013;40(7):1262-8。
- 33。
曹丽伟,余宁宁,李建新,齐志勇,王东,陈立平。in诱导DNA甲基化的遗传性和可逆性体外之间的嫁接芸苔属植物juncea和b . oleracea.Sci众议员2016;6(1):27233。
- 34.
Rambla JL, Gonzálezmas MC, Pons C, Bernet GP, Asins MJ, Granell A.两个柑橘杂交品种的果实挥发性特征与其亲本存在显著差异。中国农业科学。2014;62(46):11312-22。
- 35.
王磊,徐海根,袁飞,潘启云,范锐,高应祥。五种柑橘膳食纤维的理化特性。农业生物技术。2015;4(2):250-8。
- 36.
科埃略E,西尔维亚先生,德尔加迪略I,科英布拉MA。顶空固相萃取技术应用于挥发性成分的演化葡萄l .简历。巴格的成熟。Acta photonica sinica; 2006;563(1): 204-14。
- 37.
Mezitt LA, Lucas WJ。胞间接合细胞间蛋白质和核酸的运输。acta botanica yunnanica(云南植物研究). 1996;32(1-2):251-73。
- 38.
会议A.花转录因子的细胞-细胞信号和运动叶和无瓣1。科学。2000;289(5480):779 - 81。
- 39.
两个新的葡萄品种,带有浅色浆果的赤霞珠的芽运动,是浆果颜色位点的两个调节基因缺失的结果。植物学报。2006;62(4-5):623-35。
- 40.
王志强,王志强,王志强,等。浆果颜色位点的结构动力学研究进展葡萄l .体细胞变异。中国葡萄酒业;2015;20(3):485-95。
- 41.
Silvia V, Lorena L, Umberto M, Marco S, Riccardo V, Claudio M。中国生物医学工程学报。2012;63(18):6359-69。
- 42.
Azuma A, Udo Y, Sato A, Mitani N, Kuno A, Ban Y, Yakushiji H, Koshita Y, Kobayashi S.颜色位点的单倍型组成是葡萄×labruscana葡萄皮肤颜色变异的主要遗传决定因素。应用计算机学报。2011;122(7):1427-38。
- 43。
葡萄藤无肉浆果(flb)突变体的体细胞嵌合、遗传和基因定位葡萄L)基因组。2006;49(7):721 - 8。
- 44。
López-Girona E,张颖,Eduardo I, Jrh M, Alexiou KG, Arús P, Aranzana MJ。一个影响LRR-RLK基因的缺失与桃的扁平形状性状共分离。Sci众议员2017;7(1):6714 - 25。
- 45。
吴建新,肖海林,肖洪伟,易海林。嫁接'早红'脐橙果实细胞来源鉴定及果实可溶性糖、有机酸和香气分析。植物学报,2014;41(10):1993-2000。
- 46.
刘超,程玉军,张海英,邓新新,陈芳,徐军。野生柑桔挥发性成分的研究进展柑橘nobilisLauriro)皮油。农业食品化学学报,2012;60(10):2617-28。
- 47.
Jayaraj j,Devlin R,Punja Z.胡萝卜植物新型酮核素生产的代谢工程。转基因Res。2008; 17(4):489-501。
确认
不适用。
同意发布
不适用。
资金
该研究得到了浙江省公共项目(LGN18C160005,LGN19C160005)的支持;中国国家自然科学基金(31000897,31301811);浙江省科学技术部(No.2016c02052-1);和中国农业研究系统(CARS-27)的专用基金。资助机构在研究和收集,分析和对数据的诠释和写作稿件的设计中没有发挥任何作用。
作者信息
隶属关系
贡献
MZ和CZ设计了这项工作,并重新修改了手稿。LJ为数据分析贡献并起草了稿件。QW促成了实验材料的收获。KZ进行了实验。FK和JX促成了嵌合厂的维护管理,并提供了财政支持。SZ和GW有助于种植实验材料的管理。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
张敏,荆玲,吴强。et al。嫁接嵌合体“红肉虎有”(柑橘changshan-huyou+柑橘unshiu)和它的两种供体植物。BMC植物杂志19,582(2019)。https://doi.org/10.1186/s12870-019-2173-4
已收到:
接受:
发表:
关键字
- 柑橘类
- 穹状的妄想
- 代谢物
- 挥发物
- 类胡萝卜素