抽象的
背景
了解木质素生物合成和组成对于可持续生物能源和生物材料生产具有核心重要性。属的种类芒草由于其快速增长和适度的营养要求,已成为有前途的生物能源作物。但是,木质素聚合芒草了解甚少。以往研究表明,植物漆酶是一种酚氧化酶,在植物中具有多种功能,其中一种功能是单木质素的聚合。在此,我们将新发现的芒草漆酶MsLAC1作用于细胞壁木质化。重组MsLAC1和拟南芥研究MsLAC1基因在植物体内和体外的功能。
结果
使用全面的分子,生化和组织化学分析,我们表明MSLAC1定位于细胞壁并识别芒草能调节的转录因子MSLAC1.表达。此外,MSLAC1.补充这一点rabidopsis lac4-2 lac17突变体和重组MsLAC1能在体外氧化单酚。转基因拟南芥植物过度表达MSLAC1.MsLAC1的g -木质素含量较高,但重组MsLAC1的g -木质素含量较高。
结论
总之,我们的结果表明MSLAC1.由次级细胞壁MYB转录因子调节,并且参与木质纤维的木质化。本报告识别MSLAC1.作为一个有前景的育种目标芒草用于生物燃料和生物材料应用。
背景
芒草,一间多年生C4草,由于其高生物量产量和对肥农药的低需求而促进了有希望的能量作物[1].与其他物种相比,芒草生物质含有的水分明显更少,产生的灰分也更少,这使得它适合于生物燃料的生产和通过生物转化过程生产有价值的化学品[2].然而,目前芒草生物质用于生物燃料生产的利用很大程度上受到细胞壁对生化转化的抗拒性的限制,而木质素的含量和质量是其中的重要贡献。此外,木质素的消化率降低芒草生物质用作饲料[3.].因此,木质素含量和质量以及纤维素到木质素的比率对利用和降解性具有显着影响芒草生物质(3.,4].因此,对木质素生物合成和沉积的控制因素有了更深入的认识芒草需要改善这种丰富的木质纤维素生物质来源的效用。
木质素是植物次生细胞壁的主要成分之一,主要由单木质素聚合而成p-COURMARYL醇,COIFREYL醇和SINAPEL醇,分别导致H,G和S木质素。木质素生物合成包括三个主要步骤:胞嘧啶中的单醇生物合成,将单醇素转运到细胞壁基质,并聚合到异质,交联木质素聚合物中[5].近期的研究拟南芥已鉴定并表征了对这些步骤的大量酶和转录因子,并且每个酶可以显着影响木质素含量和组合物[6,关于木质素化的知识芒草到目前为止仍然有限。然而,最近完成的转录组分析,基于发展节间芒草lutarioriparius,miscanthus转录组数据库[7),而芒草sinensis草案基因组(芒草sinensisv7.1 DOE-JGI,http://phytozome.jgi.doe.gov/),显示与其他物种在二级细胞壁生物合成机制方面有许多相似之处[8].此外,转录因子MsSND1被证明能够调控次生细胞壁的形成,包括木质素化,类似于它的同源物AtSND1拟南芥[9].这些结果和以往在其他单子叶植物中的研究表明,单子叶植物和双子叶植物之间存在一个部分保守的次级细胞壁生物合成途径[10.,11.,12.,13.];允许研究潜在的瘫痪相关基因芒草利用现有的知识拟南芥和其他植物种类。
在生物合成之后,单甘醇通过过氧化物酶和/或漆酶氧化至单氯化物基团,其在细胞壁中自发地聚合。存在强烈的过氧化物依赖性过氧化物的实验支持[14.]聚合过程中的氧依赖性漆酶[15.,16.,17.,18.].在拟南芥,参与木质素化的漆酶亚型似乎具有冗余功能[19.].具体来说,rabidopsis lac4要么lac17单一突变体只导致木质素含量轻微降低,而LAC4-2 LAC17双突变体茎中的木质素减少了40% [15.].此外,这是lac4 lac11 lac17三突变体的特征是维管束几乎完全没有木质素[19.].虽然已经尝试识别不同漆酶同种型的生理作用[18.,20.]由于冗余和宽的衬底特异性,它仍然难以将特定功能分配给单个漆酶[16.].
在这项研究中,一个芒草LaCaCase同种型密切相关AtLAC17被克隆并命名MSLAC1..MSLAC1.转录物主要表达在伸长的间,与其他二次细胞壁相关基因共享表达模式。进一步的实验表明,启动子MSLAC1.基因是由MSSCM4的目标,推定的正非拟南芥二级壁合成调节器ATMYB58 / 63 [9].MSLAC1蛋白分泌到细胞壁中,重组MSLAC1蛋白能够催化单醇的氧化。MSLAC1.也在功能上补充rabidopsis lac4-2 lac17双突变体,异位表达对木质素化的数量和质量都有影响,且S/G比增加。
结果
漆酶序列的鉴定芒草sinensis转录组
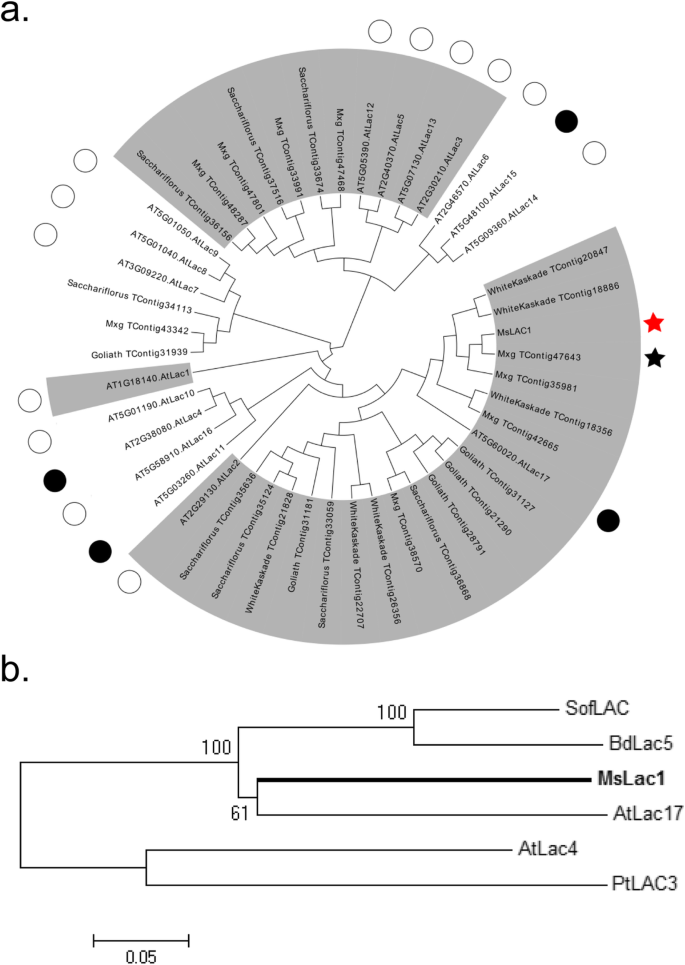
利用已公布的漆酶核苷酸序列拟南芥,高粱, 和毛花瓣,我们对a芒草转录组[7].共鉴定出95个漆酶样contigs,其中28个包含漆酶开放阅读框(ORFs)的完整序列。以往的研究拟南芥建议将LaCase家族分为六个亚组[21.],但单子叶植物的亚群较少。例如,在毛花瓣,系统发育分析显示有四个亚群[22.],甘蔗含有五个亚组[16.].与Dicot物种相比,单像中的漆酶家族似乎更大[16.,22.].用系统发育分析对漆酶contigs进行分类芒草est数据库[7] 反对拟南芥和毛花瓣漆酶分别(无花果。1和附加文件1:图S1)。
不同植物物种漆酶序列的系统发育分析。使用邻近接合方法用Mega 5进行对准。一个所有可用芒草来自不同物种的漆酶序列(例如歌利亚,Saccharifolius.),拟南芥包括漆酶(由圆圈标记)。黑圆圈表示拟南芥参与木质素生物合成的漆酶。基于(Turlapati等,2011)的结果分类不同的漆座亚组,并标记为灰色背景。mxg_tcontig47643(黑星),在亚组1中聚集在一起AtLAC17,用于引物设计以放大开放阅读框架MSLAC1.(红星)。注意MSLAC1.与开放阅读框架密切相关,但不相同mxg_tcontig47643(蛋白水平95%序列一致)。b序列芒草(MSLAC1.),毛花瓣(BDLAC5),糖果(SofLAC),杨树(PTLAC3.),拟南芥(AtLAC4和AtLAC17)包括漆酶
这一分析确认mxg_tcontig47643(图。1)作为相关的ORFAtLAC17,它被认为与木质素化有关[15.].我们克隆了一条漆库编码序列,我们命名MSLAC1.,使用基于的引物mxg_tcontig47643从一个芒草sinensiscDNA制备。与MXG_TContig47643和ATLAC17相比,在蛋白质水平时,MSLAC1的序列同一性为96和68%,分别说明MSLAC1.衍生自没有相同但与之密切相关的基因mxg_tcontig47643.来检验两者之间的关系MSLAC1.先前据报道涉及跛行的其他漆酶,用特征漆酶蛋白进行多序列对齐(图。1b,额外的文件1:图S2),包括那些来自Brachypodium distachyon(BDLAC5,[23.)、甘蔗(SofLAC, [16.]),poplar(ptlac3,[17.)),拟南芥蒂利亚纳(AtLAC4及AtLAC17, [15.])。AtLAC17,其影响愈伤甘油(G)木质素在束间纤维中的沉积[15.,与MsLAC1的序列相似性最高(77%)。MsLAC1包含四个保守的铜结合位点和一个预测的分泌的n端信号肽(附加文件)1:图S2)。非糖基化的MSLAC1的预测分子量和等电点分别为63.0kDa和5.95。然而,由于MSLAC1蛋白质序列含有超过15个推定的N-糖基化位点,因此预期成熟的蛋白质相当大的[24.].
MSLAC1.优选地在紫色组织中表达,包括年轻的间面和叶子护套,并与其他褐化基因共表达
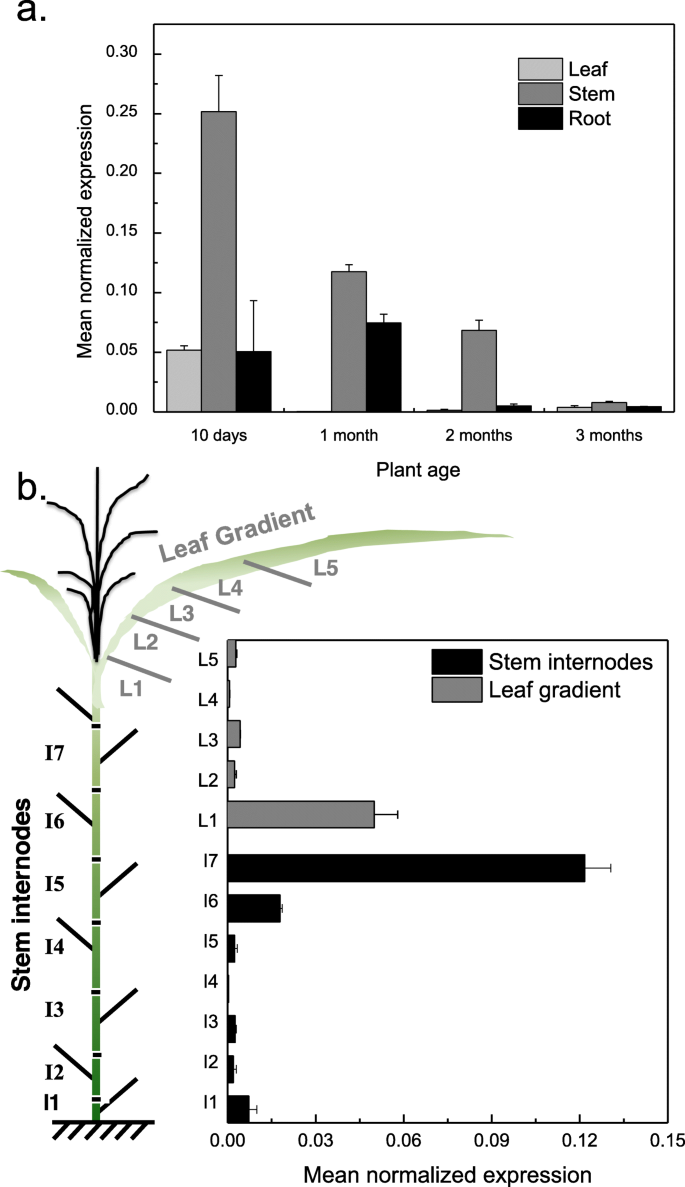
为了探究MsLAC1是否参与了木质素化过程,研究了MsLAC1的相对表达水平MSLAC1.首先由QPCR在不同的器官(叶,茎和根)中,在增加年龄的植物(10天,1个月,2个月和3个月;图。2一种)。尽管MSLAC1.在所有器官中检测到转录物,在茎中检测到最高表达,这通常是高度血气的。一般来说,表达了MSLAC1.随株龄的增加而降低。由于木质化过程在组织成熟的早期就开始了,MSLAC1.随后,沿着茎和叶的发育梯度分别监测转录本。具体地,分析了7个茎节和5个叶片的6个月龄的成熟植株MSLAC1.表达(图。2b)。同意[22.],在最年轻的组织即叶鞘(含生长期)和最年轻的茎节间中表达量最高,而在成熟组织中表达量显著降低。
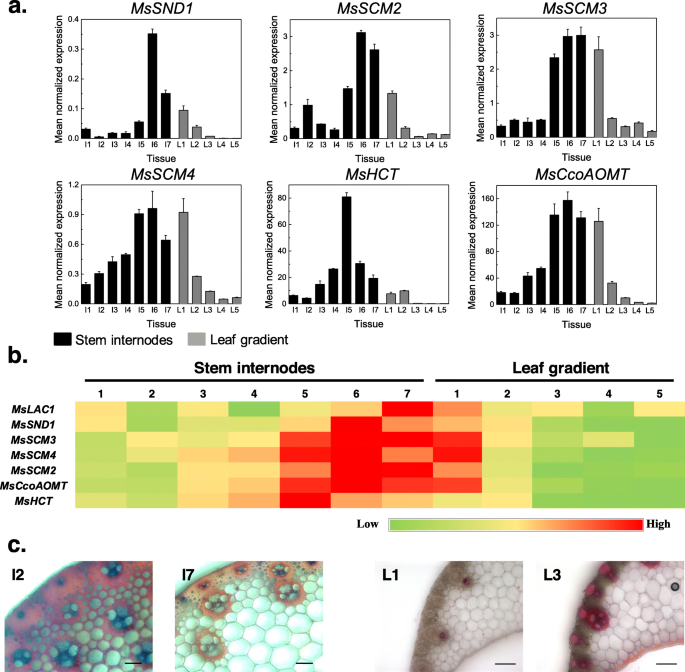
比较表达的MSLAC1.预计涉及血液的基因,进行共表达分析。推定细胞壁相关转录因子的表达MSSND1,MSSCM2,3,和4,和两个可能与木质素生物合成有关的同源基因,msccoaomt.和MsHCT,与MSLAC1.基因表达芒草植物开发梯度[9,25.].通常,与叶相比,所有所选基因显示出茎中较高的表达水平(图。3.a).在叶片梯度上,大多数基因在叶片的第一部分(包括叶鞘)(或第二部分)表达量最高MsHCT)在更成熟的叶片部分中,表达水平急剧下降(图。3.一种;b)。对于所有分析的基因,在三个最小的间区内检测到茎中最高的表达,在老年蛋白染色模式协议中,较老的间区强烈下降(图。3.c)。这些结果在一起与假设一致MSLAC1.参与木质化过程。
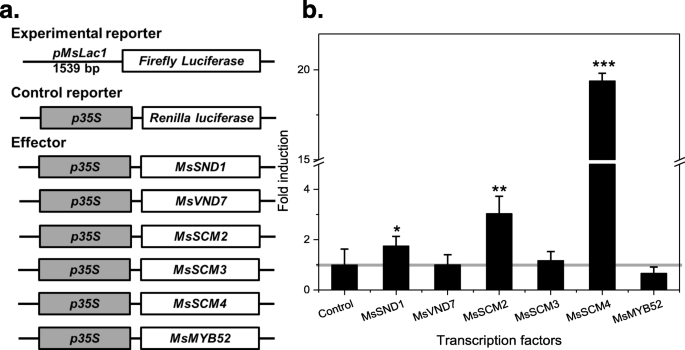
发起人MSLAC1.调控木质素生物合成的转录因子激活了基因
新确定的序列MSLAC1.在部分组装的基因组序列数据库中查询调控5 ' -上游区域芒草sinensis.一个由1539 bp组成的区域MSLAC1.起始密码子与基因组DNA分离。首先使用GenomAtix Matinspector软件使用> 0.85的核心相似性来分析该推定的启动子序列的可能转录因子(TF)结合位点。26.].二次电池壁NAC结合元素(SNBES)和次级壁MYB响应元件(SMRES)是涉及相关的NAC和MYB因子的次壁生物合成调节的重要顺式元素[27.].使用Matinspector软件,在拟议的监管区中确定了16个推定的监管部位,包括三个SNBES和两个SMR。通过复杂的网络控制细胞壁瘫痪的调节,包括许多良好的转录因子,例如良好的转录因子。MYB因素[28.].建立相应的网络芒草,我们已经克隆了MSSND1,MsVND7,MsSCM2、3、4, 和MSMYB52作为推定的正交拟南芥二次壁合成调节器ATSND1,atvnd7.,AtMYB85,AtMYB43,ATMYB58 / 63.和AtMYB52, 分别 [9,29.].我们测试了这些的能力芒草TFs调节MSLAC1.通过量化由此驱动的荧光素酶报告者的活性来表达MSLAC1.共轰击葡萄悬浮培养细胞后启动子(图。4一种)。结果表明了这一点PMSLAC1.被MsSND1、MsSCM2和MsSCM4激活(图;4b)。两个MYB因子导致比MSSND1更强的激活,对于MSSCM4,观察到最高的感应(约20倍)。如前所述拟南芥,AtmyB58和AtmyB63(同源物MSSCM4)充当木质素生物合成基因的直接转录激活剂,是ATSND1的下游靶标[30.].目前的结果表明MSLAC1.可能是芒草次级细胞壁调节转录因子。
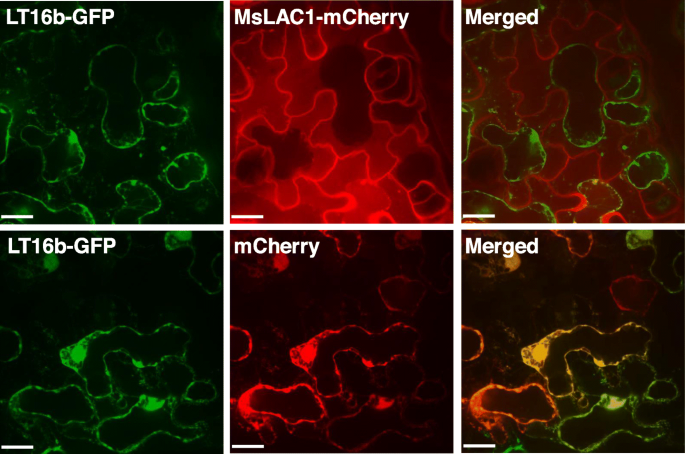
瞬时表达MSLAC1定位到烟草表皮叶细胞的细胞壁
在拟南芥,阿特拉克4,有助于茎木质化[15.],被定位在番荔枝的二级细胞壁中[31.].MsLAC1的亚细胞定位是通过与c端ph稳定的mcherry标记融合在烟草叶片中的瞬时表达来评估的[32.];无花果。5).为了区分血浆膜和细胞壁,血浆膜局部化融合蛋白LTI6B-GFP是共转化的[33.].在质子术后,用胞质溶解液缩回的GFP信号,而MSLAC1-MCHERRY与表皮细胞的细胞壁保持相关,从而表明MSLAC1的定位到电池壁基质(图。5).
MSLAC1在体外氧化单氯霉素
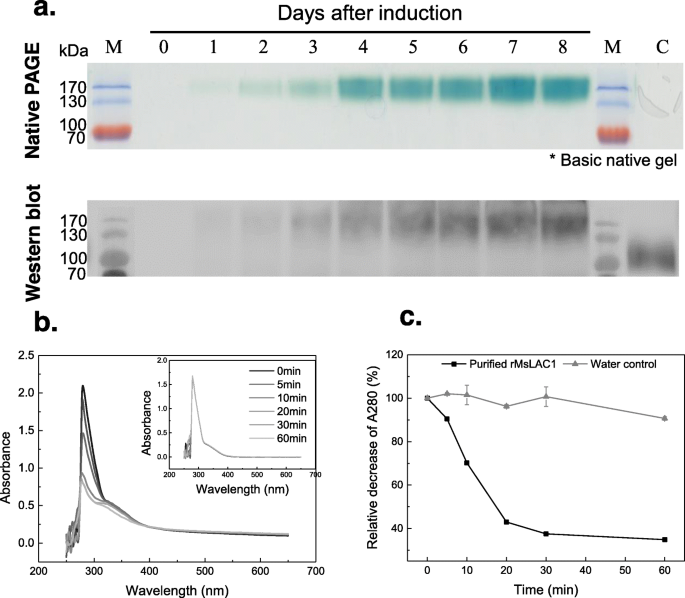
为了确定MSLAC1的酶活性,我们产生重组蛋白毕赤酵母属pastoris.ZyMogram分析显示,单个活动带的时间依赖性增加,在感应表达后8天达到其最大强度(图。6一种)。使用抗Myc抗体的Western印迹分析证实了在〜150kDa(底部面板的信号中具有信号的重组MSLAC1蛋白的增加浓度。6一种)。如上所述,预测MSLAC1蛋白质序列的15个推定的N-糖基化位点。因此,可能由于N-糖基化和可能的,额外的O-糖基化或其他翻译后修改,所以MSLAC1蛋白序列(63kDA)和产生的重组MSLAC1(150kDa)之间计算的分子量和产生的重组MSLAC1(150kDa)之间的显着差异可能是由于N-糖基化。24.,34.,35.].
重组MSLAC1蛋白的表达及纯化重组蛋白氧化醇的氧化。一个该蛋白在P. Pastoris.并用Native PAGE和Western blot进行分析。甲醇诱导后,每隔一天收集培养液样品,离心清除,过滤上清液10 μl,装入。酶谱用10mm ABTS染色。Western blot检测抗myc抗体。PageRular Prestained Protein Ladder, 10-170 kDa。C:发酵液粗提物P. Pastoris.诱导后8天用pPICZαAfeh转化。Sinapyl醇(终浓度1 mM)与0.002 U重组MsLAC1蛋白在pH 3.0的50 mM醋酸缓冲液中孵育。b以指定的时间间隔记录反应混合物的光谱(250nm-650nm)(插入件仅用基板指示控制)。c吸收时间过程在280nm处变化。280nm的初始吸光度为每单独设定为100%,用于计算吸光度降低与纯化的蛋白质和水控制
为了了解重组MSLAC1的催化性能,通过确定不同底物的降低来测量不同单醇的氧化。虽然重组MSLAC1酶能够氧化所有补充的单醇素,但以最高效率氧化SINAPEL醇(图。6).相比之下,用最低效率氧化肉桂醇(附加文件1:图S3)。显然,重组MSLAC1酶的效率与各种衬底上的甲氧基取代基的存在连接。之前的研究还表明,相对于酚OH-基团的邻位中的甲氧基取代基可以通过LACC酶提高聚合速率[36.].这些结果表明,重组MSLAC1可能能够将单醇素氧化成基团,其自发地经历交叉偶联以形成更复杂的聚合物。
Lignin含量和木质素组成的表型互补和恢复rabidopsis lac4-2 lac17MSLAC1双突变体
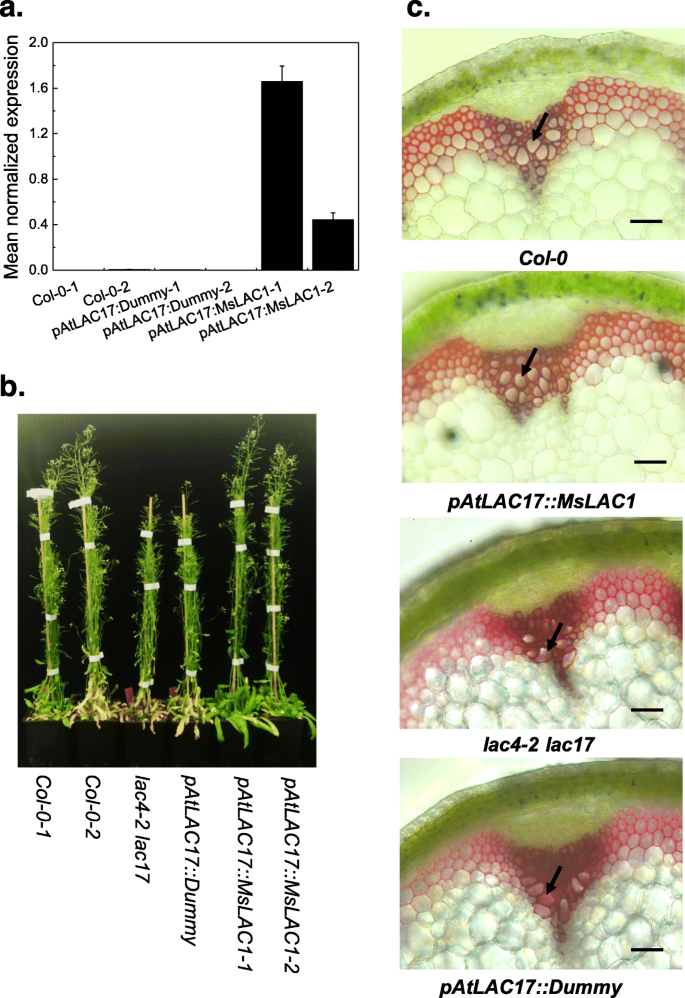
评估MSLAC1是否能够进行木质素聚合在Planta.,几个独立的纯合子系表达MSLAC1.在控制的控制下AtLAC17推动者(Patlac17 :: Mslac1.)或相应的控制构造(dummy)LAC4-2 LAC17生成双突变背景,表达MSLAC1.经qPCR证实(图。7一种)。半侏儒表型LAC4-2 LAC17在恒定光线下的突变体[15.]在两条独立的线上完全逆转Patlac17 :: Mslac1.(图。7b)。此外,使用HCl-氟葡糖醇染色的茎横截面,完全逆转曲线茎的不规则木耳表型LAC4-2 LAC17双突变体在补种系中表现明显Patlac17 :: Mslac1.(图。7c)。
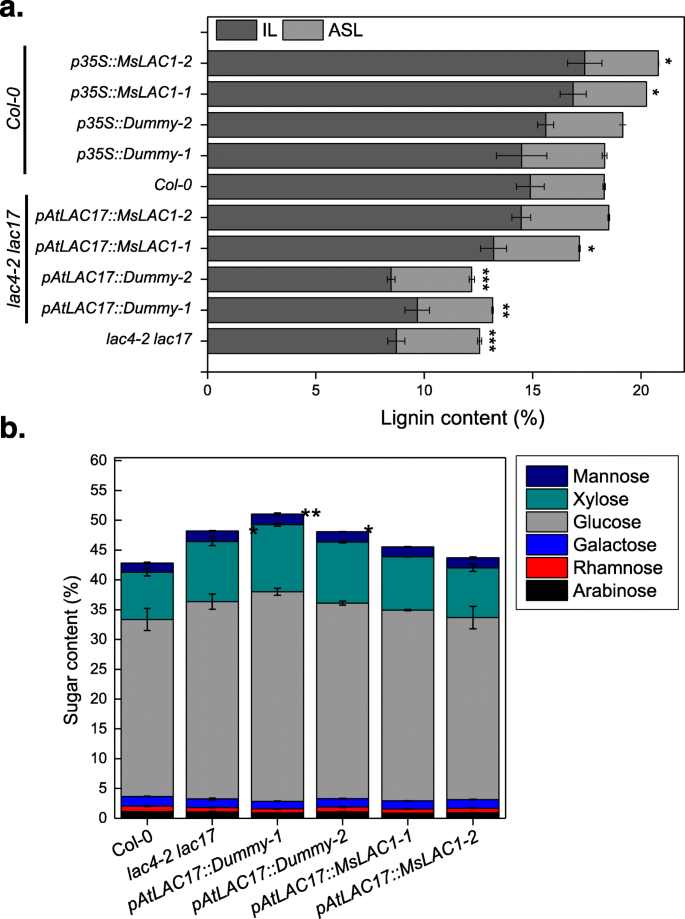
分析木质素含量和组成,干燥茎LAC4-2 LAC17双突变体,MSLAC1.算法的植物,对应的对照进行木质素定量和组成分析(图。8一、表1和2).如前所述,LAC4-2 LAC17与野生型植物相比,双突变体具有较低的木质素含量[15.].在我们的生长条件下,野生型的总克拉森木质素(KL)含量Col-0.可溶性木质素[ASL]为3.4%,不溶性木质素[IL]为14.9%。白细胞介素下降到9%左右LAC4-2 LAC17双突变体,而ASL保持不变。相比之下,表达的负面控制Patlac17 ::假人构造时,显示的ASL和IL水平与LAC4-2 LAC17双突变体。在两个独立Patlac17 :: Mslac1.线,总木质素含量分别恢复到17.2和18.5%(图。8一种)。
的rabidopsis lac4-2 lac17双突变体S/G单分子比也发生了变化,从野生型的0.54增加到双突变体的0.80(表)1).更具体地说,木质素的单酚组成在茎组织LAC4-2 LAC17突变体显示S亚基减少25%,而G亚基的量减少57%(表2).阴性对照(转化为Patlac17 ::假人)表现得像双突变体,同时互补MSLAC1.(Patlac17 :: Mslac1.线)部分恢复了S和G亚基的野生类型水平(表1和2).与木质素修饰相关,观察到的结构碳水化合物增加LAC4-2 LAC17通过互补也逆转双突变体MSLAC1.(图。8综上所述,这些观察清楚地表明,通过表达MSLAC1.在…控制之下AtLAC17启动子的LAC4-2 LAC17突变体不仅恢复了生长相关的表型,而且细胞壁的化学和形态属性也基本恢复了。
在拟南芥,异位表达MSLAC1.促进束间纤维的发育,提高木质素含量,降低S/G比,缩短茎
之前的研究表明,两者都是过度表达AtLAC4要么AtLAC17引起异位木质素化,甚至在初生细胞壁,当外源性单木质素供应时[37.].评价异位表达的影响MSLAC1.关于增长,拟南芥植物表达MSLAC1.在CaMV的控制下35年代启动子在Col-0.背景。MSLAC1.通过QPCR测定转录物水平,选择两条独立线,用于比较分析(附加文件1:图S4)。当植物表达植物时MSLAC1.(P35S :: MSLAC1-1和P35S :: mslac1-2)在恒定光下生长,茎中的木质素含量和组合物受到影响。如图1所示。8A,ASL内容在很大程度上保持不变,但IL内容从14.9%增加Col-0.分别为16.9%和17.4%35S :: Mslac1-1和P35S :: mslac1-2分别(两个负控制线未改变)。值得注意的是,G亚基的数量也增加了P35S :: Mslac1线,降低S / G比(表2).相反,糖含量(即葡萄糖,木糖,甘露糖,半乳糖,鼠李糖和阿拉伯糖)不受异位表达的影响MSLAC1.(附加文件1:图S5)。
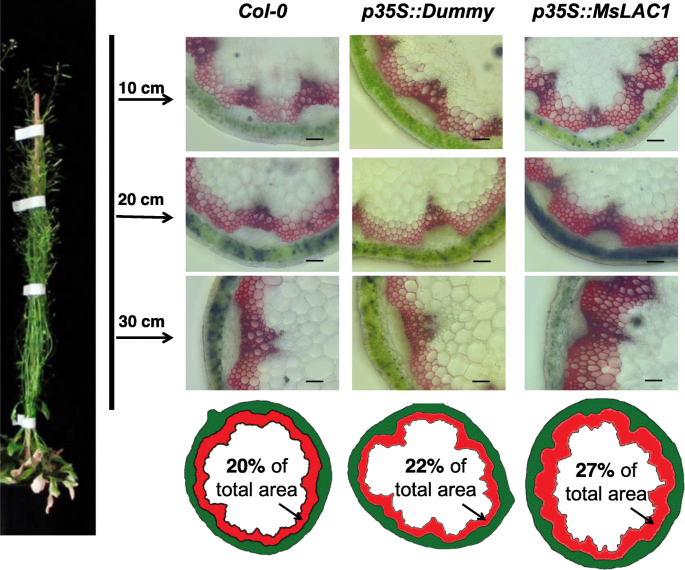
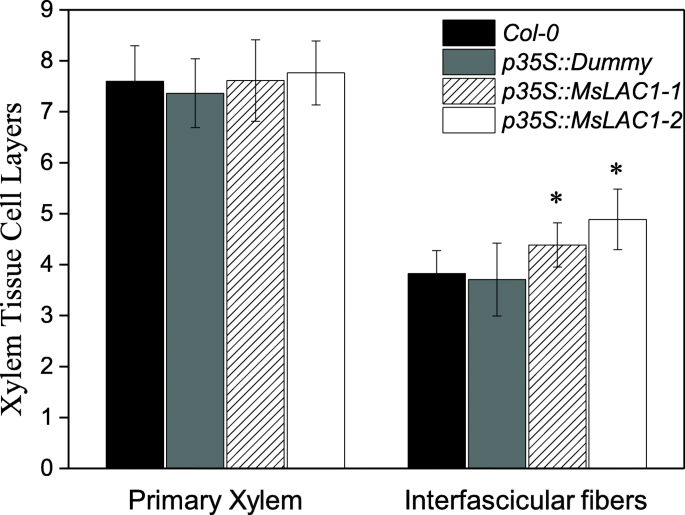
植物生长P35S :: MSLAC1-1和P35S :: mslac1-2在恒定光照下的线与Col-0.野生类型和空的媒介控制线(附加文件1:图S4)。以前的研究表明,增加的瘫痪(通过过度表达的木质素相关的TFS或参与跛行的酶)可以损害植物生长[30.,38.].因此,我们假设诱导木质素含量和组合物的变化P35S :: Mslac1线是观察到的较短花序茎的原因(附加文件1:图S4)。事实上,在成熟P35S :: Mslac1植物(尖端30厘米),组织化学检查表明,距离相应对照的距离氧化纤维区较大的17.4-35.0%(图。9),并伴有束间纤维形成的增强。在WT和对照的横切面上观察到3-4层的束间硬化细胞,而过表达MsLAC1的植物显示出4-6层(图4)。10.).这些结果证实了MSLAC1在血液化和肾外纤维的发育中的预测功能,反过来反而抑制茎生长(附加文件1:图S4)。
讨论
植物漆酶[15.,19.,20.,22.,39.过氧化物酶[14.,31.]是木质素生物合成的关键酶,在木质素单体聚合中发挥着独特的作用。对于一些单子叶植物和双子叶植物,特定的漆酶亚型已被证明有助于单酚聚合,影响木质素含量和木质素组成。目前的研究将这一知识扩展到芒草作为一个重要的生物经济作物,不仅提供了一种特定漆酶亚型MsLAC1的功能分析,还揭示了其对木质素组成的具体影响,即在相对(降低S/G比)和绝对(G含量)两方面选择性地促进G单位向木质素沉积。与Golfier等人之前的工作一致[9和Hu等人[8,我们的数据进一步支持这一观点,即调控次生细胞壁形成和木质素化的分子网络在双子叶和单子叶之间很大程度上是保守的[40].
MsLAC1, a芒草漆套同种型
的芒草漆酶亚型MsLAc1已被鉴定为潜在的单酚聚合关键酶,基于i)其与其他已知参与木质素生物合成的单子叶和双子叶漆酶的紧密序列关系(图1)。1额外的文件1:图S1),ii)其与几种木质素生物合成基因的共表达,包括同源转录因子的基因,在已知瘫痪的组织(幼茎间节间,叶生长区)中(图。2和3.)III)通过调节二次细胞壁和木质素生物合成的转录因子激活其基因的启动子区域(图。4,[9];强烈诱导MSLAC1.由MSSCM4的启动子,对AtmyB58和AtmyB63同源的转录因子,两者都已知诱导表达AtLAC4在拟南芥[30.iv)靶向细胞壁舱(图。5,在离子溶性后在细胞壁中检测到MCHERRY信号),V)其具有氧化单甘油醇的体外能力,优选SINAPEL醇(图。7额外的文件1:图S3)。综上所述,这些结果表明MsLAC1在木质素化过程中具有一定的作用芒草.
在拟南芥,MSLAC1促进凝结性纤维纤维,选择性地促进G亚基的沉积
缺乏可用的芒草漆酶突变体,探讨了MSLAC1的体内功能拟南芥通过互补rabidopsis lac4-2 lac17双突变体,表现出明显的不规则木质部表型[15.].突变体的生长和木质部导管表型的恢复,以及木质素含量和组成的恢复。7和8)确认MSLAC1可以在功能上取代组合活动拟南芥漆酶Atlac4和Atlac17。除了这种观察之外,在35s-启动子的控制下侧不代表表达MSLAC1后的眶纤维纤维化的显着促进(图。8,9和10.额外的文件1:图S4)可能表明加入了更多的G亚基(表1和2)进入肾外纤维的木质素,扩大番木酸区域(图。9)在空间上延长番木池层的数量(图。10.).同样地,先前,Atlac17涉及G子单元的沉积到眶纤维的木质素中[15.].
与MSLAC1相反,来自甘蔗(SOFLAC)的漆酶只能在一个中恢复木质素含量拟南芥lac17突变,但不是木质素组成[16.].因为S/G比lac17重新引入后,突变体恢复到野生类型的正常水平atlac17,已经假设该漆酶优先使用聚合期间G单位[16.].但是,MSLAC1显示了对S单元的强偏好(图。7额外的文件1:图S3)也可以降低S / G比,即从0.78-0.82LAC4-2 LAC17在互补线中突变至0.57-0.62,甚至在根本表达MSLAC1的线中甚至0.4。这些结果表明,木质化部位的基材可用性可能比不同单核苷酸底物的酶亲和力更重要。此外,与过氧化物酶的交叉谈话可能对单烯醇聚合同样重要,并且可能影响最终木质素组合物。有趣的是,在拟南芥,木质素聚合过氧化物酶ATPRX64局部化为中间薄片,而ATLAC4局部局部化在整个次级细胞壁层中[31.],表示空间控制机制。
我们的结果表明MSLAC1的异位表达拟南芥木质素含量增加13.4-16.8%,表明有足够的内源单木质素可用或通过反馈回路上调其生物合成。同样,在异位表达棉花漆酶的杨树茎中,木质素含量增加了20% [41.].注意,由于木质素硫代酸分解是基于β-O-4键的裂解,而β-O-4键主要在次级细胞壁中[42.时,观测到的相对产量增加P35S :: Mslac1线条(表2)意味着将更多的果皮和SINAPEL残基掺入木质素中。
G木质素的增加不会由酶的基材偏好导致,但可能与基板可用性有关
出乎意料的是,重组MsLAC1蛋白的体外酶活性(图。7用SINAPEL醇最高,而互补和异位表达实验表明,在相对和绝对术语(表格)中,辅成和异位表达实验表明G子单元掺入木质素中(表1和2).这一差异表明MsLAC1对单体醇聚合的影响并不仅仅是对sinapyl醇的亲和性的结果。
在拟南芥, LAC4和/或LAC17的中断下调了几个单酚生物合成基因[15.].基于通过代谢物的生物合成和酶活性的反馈调节模型,这也可以影响相应基因的表达[43.], MsLAC1过表达后单体消耗加快,可能导致单ignol底物生物合成增加。另外,细胞壁监测途径也可能影响细胞壁生物合成基因的表达。
考虑到芒草与...相比有类似的木质素生物合成途径拟南芥[8],MSLAC1也可能参与了矛状芒草.因此,改变MSLAC1的表达芒草通过遗传操作可能是一种有吸引力的策略,用于改变木质素组合物,同时限制对总木质素含量的影响,最终可用于生物熟料应用中的各种最终用途[44.].综上所述,虽然MsLAC1表达对G亚基优先加入和总木质素含量总体增加的刺激作用非常显著,但导致这两种现象的确切分子机制尚不清楚。
结论
表达MSLAC1., 一种芒草漆酶亚型基因,受次生细胞壁MYBs调控,参与木质部纤维的木质化。MsLAC1补充了木质化缺陷拟南芥双突变体LAC4-2 LAC17.MSLAC1的异位表达拟南芥尽管在体外偏好于重组MSLAC1蛋白的SINAPEL醇偏好,但促进了宫颈纤维发育,导致较高的木质素含量和基本上增加的G-lignin量。
方法
调用漆胶囊同种型分析芒草转录组
利用来自单子叶和双子叶植物的70多个漆酶蛋白序列,我们利用已发表的tBLASTn进行了局部搜索芒草Barling et al., 2013)。更具体地说,17个漆酶序列来自拟南芥蒂利亚纳(拟南芥信息资源[Tair];http://www.arabidopsis.org),来自25个漆碱序列高粱双色(植物血统;http://www.phytozome.net/sorghum)和29个漆酶序列Brachypodium distachyon(植物基因组与系统生物学;http://pgsb.helmholtz-muenchen.de/plant/brachypodium)被用作疑问。
进一步分析了含有全长蛋白质编码序列的CONTIG。使用Megalign(Dnastar,Madison,Wi)中的Clustalw对齐进行漆酶序列的对准。使用邻近加入方法产生系统发育树(http://www.phylogyy.fr/)引导测试1000重复。基于系统发育和共表达分析,MSLAC1.被选中作为推定AtLAC17ortholog。
鉴定鉴定的漆酶的启动子序列,基因组DNA芒草sinensis(识别号:SIN-13)被测序以生成部分基因组数据库。使用产生的Contig库来通过使用漆酶的5'-末端序列作为查询来搜索通过BLAST搜索的启动子序列,并从数据库中检索相应基因的启动子序列。
植物材料和生长条件
芒草sinensis种子(识别码:sine -13)是鸢尾属莱万多夫斯基(Iris Lewandowski)的礼物,是最初在日本本州收集的植物的后代[45.].如前所述,植物在温室中生长[9].的过表达MSLAC1.在拟南芥哥伦比亚 - 0(Col-0.)植物和补充的线条rabidopsis lac4-2 lac17双突变体(Richard Sibout博士的礼物,捷豹·皮埃尔京州斯特尔博士)在短日条件下在土壤中生长(21°C,8小时光/ 16小时黑暗,110μmolm2s)直到莲座阶段,然后转移到漫长的条件下(21°C,16小时光/ 8h黑色,110μmol/ m2s)在温室里。用于转基因的表型拟南芥在21°C, 60%相对湿度,135 μmol/m的生长室内连续光照下培养2s)。
木质素的组织化学染色
拟南芥花序茎标本包埋在6%琼脂糖中,用剃须刀片手工切割[46.].用HCl-甘油酸染色溶液(绝对乙醇中2%氟葡糖醇染色木质素,在使用前与等体积的HCl混合)。氧化细胞壁中的O-4连接的果皮和SINAPEL醛染色[47.]使用Leica DM IRB倒置显微镜捕获图像。
组织采样,RNA提取和定量RT-PCR
为期10天至3个月芒草分离植物,将不同的组织(叶,茎和根)分离并作为池收集。6个月大的芒草切割茎和显影叶并在它们的节点中解剖,并采样七个间节区和五片。将所有样品在液氮中冷冻。
研磨后,30mg或50毫克组织芒草要么拟南芥分别用于RNA提取,如前所述[9].随后,0.5 μg总RNA被AMV逆转录酶(Roboklon)逆转录[48.].通过定量RT-PCR测定转录本丰度,使用参照基因,如[9].基因特异性引物用于芒草列于其他文件1S2:表。
克隆转录因子和MSLAC1.启动子
按照Gateway®克隆协议(Fisher Scientific),使用入口载体pDONR201进行初始克隆,使用两个不同的目的载体pART7和pLuc分别作为效应质粒和报告质粒,如之前报道的[48.].
转录因子MSSND1和MSSCM2.- - - - - -4以前克隆了[9],并在这项研究中使用。启动子MSLAC1.以及两种额外的转录因子,MsVND7和MSMYB52,被含有网关突出的基因特异性引物克隆(附加文件1:表S1)。根据厂家说明书,通过BP反应将DNA片段克隆到pDONR201中,测序后通过LR反应转移到相应的目的载体中。
通过双荧光素酶测定的启动子激活
确定激活的MSLAC1.通过与木质素生物合成相关的转录因子的启动子,使用葡萄胺使用双荧光素酶测定(vitis Vinifera)悬浮细胞,如前所述[48.].如图1中所示。4,所有转录因子ORF在第7部分的CAMV35S启动子的控制下表达,这些质粒用作效果。在记者质粒中,萤火虫荧光素酶在控制下表达MSLAC1.推动者(PMSLAC1.);因此,荧光的强度明确通过各自的转录因子诱导。然后将记者质粒,效应质粒(和内部对照,见下文)涂覆到金颗粒上并轰击到葡萄悬浮细胞中。在黑暗中培养为期两天的培养后,定量了萤火虫的萤火虫和雷尼霉菌荧光素酶的荧光强度(用于转化效率的内部控制)。每种转染实验的萤火虫和雷农荧光素酶之间的比率对雷尼拉荧光素酶质粒prluc标准化,以表示相对折叠活化PMSLAC1.通过每个转录因子。所有测量重复三次(技术重复),所有实验均独立地进行两次。
瞬时表达中MSLAC1蛋白的亚细胞定位尼古利亚娜·宾夕法尼亚州树叶
确定MSLAC1蛋白的亚细胞定位,农杆菌肿瘤术ASE(PSEE.+)使用Greengate表达载体转化[49.],随后渗入4周龄的叶片尼古利亚娜·宾夕法尼亚州荧光蛋白标记的MSLAC1蛋白瞬时表达的植物。由于预测全长MSLAC1编码序列,因此将MCHerry融合到其C-末端。LT16B-GFP用作血浆膜标记[33.].农杆菌属将含有该标记物的菌株、mCherry标记的MsLAC1和p14沉默抑制剂质粒分散在转化缓冲液(10 mM MgCl)中2,10 mm mes,150μmacetosyringone,pH5.6)到OD600分别为0.4、0.4和0.1,然后等量混合。室温孵育2 h后,用2ml无菌无针注射器将混合菌液共渗到烟叶中。假基因(49.]替换MSLAC1.用作缺乏MSLAC1编码序列的控制构造。3天后收集渗透叶。为了测试MSLAC1是否定位在细胞壁上,叶片在显微镜检查之前在30%蔗糖溶液中孵育2小时,从等离子体膜中的硫氨酸覆盖细胞壁。关于本研究中使用的Greengate构建体的细节呈现在图1的图例中。5.
使用Perkin-Elmer Ultraview Vox旋转盘共聚焦捕获图像,安装在Leica DM16000倒置显微镜上,带有Hamamatsu 9100-02 CCD摄像头。GFP滤波器(激励488nm,发射525nm)用于图像标记标记的构建体。RFP滤波器(激发561nm,发射595-625nm)用于图像MCHerry标记构建体。使用Leica油浸没20×或63×目的成像样品。所有图像都是使用批量图像分析软件(简介)进行处理。
MSLAC1蛋白的异源表达毕赤酵母属pastoris
的毕赤酵母属pastoris含有MYC和他的标签的表达载体PPICZαa用于MSLAC1和CIFEH的异源表达。纯化的PCR产品MSLAC1.载体pPICZαA经酶切eCORI.和XBai.然后使用T4 DNA连接酶(Thermo Fisher Scientific,Catalog Number:EL0014)在4℃下连接到4℃过夜。含有1%酵母提取物,2%蛋白胨和2%葡聚糖的酵母提取物酚醛糖培养基(YPD)用于一般培养物。在含有甘油(BMGY)和甲醇(BMMY)的缓冲复合培养基中培养所选的酵母菌株,用于诱导蛋白质表达。制备态酵母菌株X33细胞,新鲜制备,2μg连接的构建体用于转化。在含有50μg/ ml Zeocin TM的YPD板上选择阳性菌落,然后使用α-因子和3'AXOX1测序引物进行菌落PCR(附加文件1:表S1)。然后筛选菌落在最小甲醇组氨酸培养基上筛选含有Zeocin TM的最小甲醇组氨酸培养基和最小葡萄糖组氨酸介质,用于快速甲醇使用(mut +)表型[34.].
为了检查重组MSLAC1蛋白的表达和分泌,在50mL管(30℃,180rpm)中培养已验证的mut +菌落,并通过离心(5000rpm,5分钟)收获,当培养物到达时一点头6003.0。洗涤粒料并随后在BMMY培养基中重新悬浮(补充0.3mm Cuso4),并稀释至最终OD值600在300ml烧瓶中30mL BMMY培养基中的1.0℃,在相同条件下培养(30°C,180 rpm)。每天加入甲醇(最终浓度:1%,v / v)以保持诱导条件。在诱导开始后,每天通过离心(5000rpm,5分钟)每天收集等分试样。将上清液在4℃(冷室)下透析至pH5.0 20mM乙酸钠缓冲液过夜,并在-80℃下储存以进一步分析。表达重组果实exoOfdrolase(FEH IIA)蛋白的PPICZαAFEH菌株Cichorium intybus在相同的条件下栽培并用作对照。
漆酶活性和蛋白质浓度的测定
用ABTS(2,2-氮杂-BIS3-乙基苯并噻唑啉-6-磺酸)测定漆酶活性作为基质[50.].将样品在pH = 5.0mm HAC / NAAc缓冲液中稀释至180μL并与20μLBES混合。用相同的方式将180μL没有酶的缓冲液与ABT混合并用作对照。在30℃温育3分钟后,测量420nm处的吸光度,并且与对照(Δa)相比的吸光度增加用于计算酶活性:
在哪里,五t, 总容积;n,稀释折叠;V.e、样品体积;ε: ABTS的摩尔消光系数(3.6 × 104 M-1 cm-1);ΔT孵化时间。为了为每个衬底选择合适的波长,我们测量了不同浓度的衬底光谱。计算相关系数后,我们选择了每个底物吸光度最高的波长:联氨酰基醇、对香豆素醇和针叶树醇的吸光度分别为288 nm和296 nm。酶活性单位定义为在30℃下每分钟氧化1 μmol底物的酶量。蛋白浓度通过Bradford检测法测定,该检测法采用基于牛血清白蛋白(0.1-1 mg/mL)的校准曲线,使用Sigma的Bradford试剂(产品编号:B6916)。
重组MsLAC1蛋白酶催化氧化单酚的研究
肉桂醇: 104-54-1),p-香樟醇:36.90-05-9), coniferyl alcohol (CAS No.: 458–35-5), and sinapyl alcohol (CAS No.: 537–33-7) were used as substrates to evaluate the ability of recombinant MsLAC1 protein to oxidize the canonical monolignols. In the assay, 0.02 U enzyme was mixed with 0.5 mM of each substrates [51.].在30℃下以50mM Nao-HaC缓冲液,pH5.0,pH 5.0,在1.5ml反应小瓶中进行反应。监测反应混合物的吸光度在250至650nm之间进行监测[52.].对于SINAPEL醇,分别在反应开始后在5,10,20,30和60分钟中扫描反应混合物,而其他单甘醇反应混合物分别在0.5,1,2,6,12小时的0.5,1,2,6,12小时。通过添加两滴10mm纳米终止反应终止3..以水代替重组MsLAC1蛋白作为对照,在不同的混合物中测定相同的时间。
原生页面,SDS-PAGE和Western Blot分析
将重组蛋白质样品与Roti®-Load1或Roti®-载荷2混合,然后在100℃下孵育5分钟,分别用于SDS-PAGE和Native-Page。使用Bio-rad®的腔室在4.5%堆叠凝胶和12%分离凝胶上进行两种电泳。样品加载,运行条件和ABTS染色程序如前所述[51.].
在SDS-PAGE之后,将蛋白质电插入Immobilon-P PVDF膜(Sigma-Aldrich)上。通过Western印迹分析检测重组MSLAC1蛋白,使用抗Myc(Thermo Fisher Scientific,MA1-980)作为主要抗体,通过使用Supersignal West Dura扩展持续时间基质进行HRP(Thermo Fisher Scientific,Catalog:34075)检测到后与抗小鼠IgG二次抗体孵育(Bio-rad,目录号:172-1011)。
转基因的一代拟南芥行
所有转基因植物系都是使用的农杆菌肿瘤术应变ASE (pSOUP+)使用Greengate结构使用花浸方法进行转换[53.].的rabidopsis lac4-2 lac17双突变体互补Patlac17 :: Mslac1.构建(即,表达MSLAC1.在…控制之下AtLAC17启动子)。此外,MsLAC1在拟南芥Col-0植物,使用P35S :: Mslac1构造。用于过表达式的GreenGate构造在附加文件中描述1:图S4。为了分析互补和异位表达,我们使用纯合子F3植物。
木质素分析
成熟的茎拟南芥晾干,去掉所有的角果和叶子。将大约12厘米长的茎段磨碎,然后用热丙酮在索氏柱中萃取过夜,以去除可溶性化合物。测定酸溶性木质素(ASL)和不溶性木质素(IL)的含量54.].用液相色谱法测定中性细胞壁碳水化合物含量[55.],而硫代酸分解后气相色谱法测定木质素组成,如前所述[56.].所有测量均使用两种独立的转基因含量在技术三倍体中进行。
加入号码
本文的所有序列数据都可以在GenBank下找到以下加入号码。启动子序列:PMSLAC1.(MK310212)。编码序列:MSLAC1.(MK310209),MSSND1(KY930620),MsVND7(MK310211),MSSCM2.(MF996502),MSSCM3.(KY930622),MSSCM4(MF996501),MSMYB52(MK310210)。
数据的统计处理
对所有测量进行了三个独立的实验。SD值表示从平均值计算的标准偏差。进行统计学分析时,采用Student’s t检验,用星号表示显著差异(*,P< 0.05;**,P< 0.01;***,P< 0.001).单向ANOVA随后进行Tukey检验,还用于确定木质素组合物的显着差异。
可用性数据和材料
在该研究期间生成或分析的所有数据都包含在此稿件和附加文件中。
缩写
- ABTS:
-
2,2-氮杂-BIS3-乙基异噻唑啉-6-磺酸
- ASL:
-
酸溶性木质素
- CCoAOMT:
-
咖啡酰基CoA O-甲基转移酶
- 旅客:
-
Guaiacyl.
- H:
-
p- 羟基苯基
- HCT:
-
羟基氨基酰基转移酶
- IL:
-
不溶性木质素
- 吉隆坡:
-
克拉森木质素
- LAC:
-
漆酶
- 插件可以:
-
过氧化物酶
- S:
-
Syringyl
- 供应链管理:
-
二次细胞壁MYB蛋白
- SMRE:
-
次墙MYB响应元件
- SNBE:
-
二次电池壁NAC结合元件
- SND1:
-
二级壁相关NAC结构域蛋白1
- VND7:
-
血管相关NAC-Domain蛋白7
参考文献
- 1。
Lewandowski I,Clifton-Brown JC,Scurlock J,Huisman W. Miscanthus:欧洲经验与新的能源作物。生物量生物能源。2000; 19(4):209-27。
- 2。
芒:一种用于生物燃料和化学品生产的快速生长的作物。生物燃料学报。2012;6(5):580-98。
- 3.
亚当斯J,Winters Al,Hodgson Em,Gallagher Ja。在可变预处理后,哪些细胞壁组分是Miscanthus消化率和转化对乙醇的最佳指标?Biotechnol生物燃料。2018; 11(1):67。
- 4.
Lygin AV, Upton J, Dohleman FG, Juvik J, Zabotina OA, Widholm JM, Lozovaya VV。潜在生物能源作物芒的细胞壁酚和多糖组成。华东桐柏生物能源。2011;3(4):333 - 45。
- 5。
Barros J,Serrani-Yarce JC,Chen F,Baxter D,Venables BJ,Dixon Ra。双官能氨 - 裂解酶在草细胞壁生物合成中的作用。Nat植物。2016; 2:16050。
- 6。
陈志强,陈志强,陈志强,等。拟南芥木质素生物合成干扰的系统生物学研究进展。植物细胞,2012;24(9):3506 - 29。
- 7。
沼泽A,Swaminathan K,Mitros T,詹姆斯BT,Morris J,Ngamboma O,Hall Mc,Kirkpatrick J,Alabady M,Spence Ak。Miscanthus Genus的详细基因表达研究揭示了与春天根茎的再生相关的转录组的变化。BMC基因组学。2013; 14(1):864。
- 8。
胡R,徐Y,于C,他K,唐问,贾C、G,王X, Y,香港周G与次生细胞壁生物合成相关基因的转录组分析在发展中节间的芒草lutarioriparius。Sci代表英国。2017; 7(1): 9034。
- 9。
Golfier P,Volkert C,He F,Rausch T,Wolf S.来自Miscanthus的NAC转录因子的二次细胞壁生物合成调节。植物直接。2017; 1(5):E00024。
- 10。
钟荣荣,叶铮。木质素生物合成的转录调控。植物学报。2009;4(11):1028-34。
- 11.
李p,ponnala l,gandotra n,王l,si y,tausta sl,kebrom th,protart n,patel r,myers cr。玉米叶片转录组的发育动态。NAT Genet。2010; 42(12):1060。
- 12.
Zhong R,Lee C,McCarthy RL,Reeves CK,琼斯,例如,YE Z.米和玉米NAC和MYB转录因子的二次壁生物合成的转录激活。植物细胞生理。2011; 52(10):1856-71。
- 13。
NAC转录因子对单子叶短梗子次生壁合成和细胞死亡的调控。acta botanica yunnanica(云南植物研究). 2013;64(5):1333-43。
- 14。
Shigeto J,Tsutsumi Y. III类过氧化物酶的不同功能和反应。新植物。2016; 209(4):1395-402。
- 15.
Berthet S, Demont-Caulet N, Pollet B, Bidzinski P, Cézard L, Le Bris P, Borrega N, Hervé J, Blondet E, Balzergue S。植物细胞。2011;23(3):1124 - 37。
- 16。
casarino I, Araújo P, Mayer JLS, Vicentini R, Berthet S, Demedts B, Vanholme B, Boerjan W, Mazzafera P.在甘蔗中表达一种新的漆酶SofLAC,可以恢复拟南芥lac17突变体的木质素含量,但不能恢复S: G比值。J Exp Bot. 2013;64(6): 1769-81。
- 17。
Bryan AC,Jawdy S,Gunter L,Gjersing E,Sykes R,Hinchee Ma,Winkeler Ka,Collins Cm,Engle N,Tschaplinski TJ。敲除了漆包套摘要赋予细胞壁化学改变和增加的糖释放。植物Biotechnol J. 2016; 14(10):2010-20。
- 18。
赵海英,李灿,黄s,朴yc,林慧玲,张世忠。在转基因拟南芥中,编码漆酶前体的OsChI1基因的过表达增加了对干旱和盐胁迫的耐受性。基因。2014;552(1):98 - 105。
- 19。
赵Q,Nakashima J,Chen F,Yin Y,Fu C,Yun J,Shao H,Wang X,Wang Z,Dixon Ra。在拟南芥中血管发育期间,对于木质素聚合的过氧化物酶是必要和非冗余的。植物细胞。2013; 25(10):3976-87。
- 20。
梁敏,吴艳艳,蔡晓霞,吴玉梅。AtLAC15基因在拟南芥种子木质素合成和根系伸长中的作用。足底。2006;224(5):1185 - 96。
- 21.
Turlapati PV,Kim K,Davin LB,Lewis Ng。拟南芥的漆酶多尾家族:朝向解决他们基因功能的神秘性。Planta。2011; 233(3):439-70。
- 22.
王Y,Bouchabke-Coussa O,Lebris P,Antelme S,Soulhat C,Gineau E,Dalmais M,Bendahmane A,Morin H,Mouille G. Laccase5是颅烟灰碱队伍的木质化所必需的。植物理性。2015; 168(1):192-204。
- 23.
王家,冯俊,嘉禾,常熟,李思,李玉。利尼斯工程通过Laccase修改:能源植物改进的有希望的领域。Biotechnol生物燃料。2015; 8(1):1。
- 24.
Coll PM,Tabernero C,SantamaríaR,PérezP.来自新分离的木质素碱性底栖酸PM1(CECT 2971)的漆酶I基因的表征和结构分析。Appl Environ Microb。1993年; 59(12):4129-35。
- 25。
王G,Balint-Kurti P. CCOaomt和HCT的玉米同源物,木质素生物合成中的两个关键酶,与NLR RP1蛋白的复合物调节防御反应。植物理性。2016; 171(3):2166-77。
- 26。
Cartharius K, french K, Grote K, Klocke B, Haltmeier M, Klingenhoff A, Frisch M, Bayerlein M, Werner T. MatInspector等:基于转录因子结合位点的启动子分析。生物信息学。2005;21(13):2933 - 42。
- 27。
钟锐,袁勇,叶铮。柳枝稷(Panicum virgatum)中NAC和MYB转录因子的功能分析。《公共科学图书馆•综合》。2015;10 (8):e134611。
- 28。
赵强,Dixon RA。木质素生物合成的转录网络:比我们想象的更复杂?植物科学进展。2011;16(4):227-33。
- 29。
Zhong R,YE Z.转录网络控制次级墙体生物合成的复杂性。植物SCI。2014; 229:193-207。
- 30。
周J,Lee C,Zhong R,Ye Z.MyB58和MyB63是拟南芥中二次细胞壁形成过程中木质素生物合成途径的转录激活因子。植物细胞。2009; 21(1):248-66。
- 31。
李志刚,李志刚,李志刚。拟南芥木质素相关氧化酶在拟南芥次生细胞壁中的分布、迁移和固定性。J Exp Bot. 2018;69(8): 1849-59。
- 32。
荧光融合蛋白在烟草植株中的快速瞬时表达和稳定转化植株的生成。Nat Protoc。2006;1(4):2019。
- 33。
Cutler SR,Ehrhardt DW,Griffitts JS,Somerville Cr。随机GFP :: cDNA融合使得能够以高频率在拟南芥细胞中的可视化。PROC NATL ACAD SCI。2000; 97(7):3718-23。
- 34。
Bronikowski A, Hagedoorn P, Koschorreck K, Urlacher VB。念珠菌漆酶在毕赤酵母中的高水平表达及其在微污染降解中的应用AMB表达。2017;7(1):73。
- 35。
Campos PA, Levin LN, Wirth SA。曲霉BAFC 463耐高温漆酶同工酶的制备、表征及染料脱色能力学生物化学过程。2016;51(7):895 - 903。
- 36。
Ramalingam B,Sana B,Seayad J,Ghadessy FJ,Sullivan MB。对理解二聚体木质素模型化合物的漆酶催化氧化寡聚化合物。rsc adv。2017; 7(20):11951-8。
- 37。
漆酶在原生木质部次生细胞壁结构域的直接木质素化作用。植物杂志。2014;166(2):798 - 807。
- 38。
张文,魏鲁,陈某,江j,李h,黄鹤,杨g,王S,魏h,柳g。桦木(Betula plantyphylla×Betula pendula的功能表征通过过表达和抑制分析。physiol platararum。2015; 154(2):283-96。
- 39。
蔡晓霞,吴玉梅,梁敏,吴玉梅,等。拟南芥漆酶基因家族的突变体鉴定与鉴定。中国生物医学工程学报。2006;57(11):2563-9。
- 40。
Rao X,Dixon Ra。草草中次级细胞壁生物合成转录调节的当前模型。前植物SCI。2018; 9:399。
- 41。
王军,王超,朱敏,于艳,张艳,魏志。棉花漆酶基因转基因杨树植株的筛选及鉴定。植物细胞组织器官培养。2008;93(3):303。
- 42。
Russell WR, Forrester AR, Chesson A, Burkitt MJ。木质素聚合过程中的氧化偶联是由未配对电子在亲本苯丙基中的离域决定的。生物化学学报。1996;332(2):357-66。
- 43。
卧底:代谢物和代谢酶对基因的控制。基因Dev。2016;30(21):2345 - 69。
- 44。
Vanholme R,Morreel K,Darrah C,Oyarce P,Grabber Jh,Ralph J,Boerjan W.生物量作物新果岭的新陈代谢工程。新植物。2012; 196(4):978-1000。
- 45.
Clifton-Brown JC,Lewandowski I.筛选Miscanthus基因型在田间试验中,以优化德国南部的生物质产量和品质。Jagron欧元。2002; 16(2):97-110。
- 46.
Mitra PP,LoquéD。拟南芥的组织化学染色拟南芥二次电池壁元件。J Visual Exp Jove。2014; 87。https://doi.org/10.3791/51381.
- 47.
木质化细胞壁中的Pomar F, Merino F, Barceló AR. o -4连接的针叶树酰基和sinapyl醛是Wiesner(间苯三酚- hcl)反应的主要目标。原生质。2002;220(1 - 2):17-28。
- 48.
Wei H,Dausewein A,Greiner S,Dauchot N,危害K,Rausch T.CI myB17,一种应激诱导的菊苣R2R3-MYB转录因子,激活参与果糖合成和降解的基因的启动子。新植物。2017; 215(1):281-98。
- 49。
一种新颖、高效的植物转基因克隆系统。《公共科学图书馆•综合》。2013;8 (12):e83043。
- 50。
嗜水气单胞菌NIU01漆酶在大肠杆菌中的克隆及外源表达及其生产参数的优化生物工程学报。2013;69(7):2223-35。
- 51。
他f,qin x,张h,杨y,张x,杨y。来自白腐菌Ganoderma sp的漆酶同工酶的表征。EN3和同工酶用于染料脱色的协同作用。J Chem Technol Biot。2015; 90(12):2265-79。
- 52。
Sterjiades R, Dean JF, Eriksson KL.漆酶从枫树(槭假platanus)聚合单木质素。植物杂志。1992;99(3):1162 - 8。
- 53。
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。
- 54。
Cullis IF, Saddler JN, Mansfield SD。初始含水率和切屑大小对软木纤维素生物转化效率的影响。Biotechnol Bioeng。2004;85(4):413 - 21所示。
- 55。
Huntley SK, Ellis D, Gilbert M, Chapple C, Mansfield SD。显著提高了c4h - f5h转化杨树的制浆效率:提高了化学节约,减少了环境毒素。食品化学学报,2003;51(21):6178-83。
- 56。
罗宾逊AR,曼斯菲尔德SD。利用简化的硫代酸分解程序和基于近红外反射率的预测模型快速分析杨树木质素单体组成。植物j . 2009; 58(4): 706 - 14所示。
致谢
感谢Sebastian Sorge求助于共聚焦显微镜,Qi Gao提供数据分析,UBC生物分析工具,用于技术支持,UTE KUSCH和ANJA BAUSEWEIN,用于捐赠Pichia FEH菌株,Richard SIBOUT提供拟南芥突变种子,以及鸢尾的Lewandowski提供芒草种子。
资金
这项工作得到了科学、研究和艺术部Baden-Württemberg (FKZ: 7533-10-5-74)给Thomas Rausch和Sebastian Wolf的资助。Sebastian Wolf实验室的研究得到了德国研究基金会(DFG)通过艾美奖Noether项目(WO 1660/2)的支持。何峰和张万获得了中国国家留学基金委(CSC)和Baden-Württemberg生物经济研究生项目BBW ForWerts(由科学、研究和艺术部Baden-Württemberg资助)的资助。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
FH进行了实验工作;PG、JD和WZ参与了转录因子的克隆;NH进行部分共聚焦显微镜检查;傅里叶变换有助于测定木质素含量和组成;KMN, LS, SM参与了手稿的准备工作;FH、SW和TR共同设计了研究方案。所有作者均已阅读并批准本稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:
桌子。S1。本研究利用引物进行克隆和菌落PCR。桌子。S2。用于实时定量PCR分析的引物。图S1。系统发育树,包括推定的曲囊酶芒草和漆蛋白蛋白来自Brachypodium distachyon.图S2。MsLAC1与其他已知参与木质素化的漆酶蛋白的多序列比对。图S3。含肉桂基反应混合物光谱变化的时间过程p-香豆素醇或松柏醇分别与纯化的rMsLAC1蛋白共孵育。图S4。在漫长的条件下,MSLAC1的异位表达(P35S :: Mslac1)拟南芥生态型Col-0.减少茎生长。图S5。不同的结构糖含量拟南芥MSLAC1异位表达后的线(P35S:MSLAC1.,请参阅图S4).
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
他,F.,Machemer-Noonan,K.,Golfier,P。et al。MsLAC1, a芒草LaCaCase同种型,紫花状和木质素组合物与其体外底物偏好形成对比。BMC植物BIOL.19,552(2019)。https://doi.org/10.1186/s12870-019-2174-3
已收到:
接受:
发表:
关键字
- 芒草
- 拟南芥
- 漆酶
- 木质素
- S / G比
- 肾外纤维
- 木质纤维素生物质