摘要
背景
镰刀菌素头部枯萎病(FHB),主要由小麦赤霉病是小麦生产的主要威胁全球粮食安全。选育稳定、持久的抗病品种是防治该病的最有效途径。赤霉病抗性育种的成功依赖于有效抗性种质的鉴定。为了更好地了解自然群体中FHB抗性的遗传基础,并识别相关分子标记,我们利用高密度小麦90k单核苷酸多态性(SNP)进行了全基因组关联研究(GWAS)。
结果
在2016-2017年(简称2017年)和2017 - 2018年(简称2018年)生长季,对171个小麦品种对沿轴向传播的FHB真菌的抗性(II型抗性)进行了评估。利用Illumina Infinum iSelect 90 K SNP基因分型数据,一项全基因组关联研究(GWAS)确定了26个位点(88个标记-性状关联),解释了6.65-14.18%的表型差异。相关位点分布在除2D、6A、6D和7D外的所有染色体上,在1B、4A、5D和7A染色体上均检测到相关位点。在4AL染色体的同位基因组区发现了II型耐药的新位点(QFhb-4AL, 621.85-622.24 Mb)和第5DL染色体(QFhb-5DL, 546.09-547.27 Mb),基因含量和顺序呈高度共线性。SNP标记wsnp_JD_c4438_5568170而且wsnp_CAP11_c209_198467在本研究中,先前报道的与土壤传播小麦花叶病毒(SBWMV)抗性基因有关的5D基因也与FHB抗性有关。
结论
本研究鉴定的FHB抗性基因座和相关SNP标记对标记辅助选择的FHB抗性育种具有重要价值。
背景
普通小麦(小麦L.)是世界上最重要的谷物之一,是面包、饼干、面条和蛋糕的原料[1].镰刀菌素头部枯萎病(FHB),由镰刀菌素graminearum是小麦中最具破坏性的真菌疾病之一,由于耕作方式和气候变化,其传播程度相当高[2].赤霉病不仅会降低粮食产量和品质,还会导致籽粒过量脱氧雪腐镰刀醇(DON)感染,严重危害人畜健康[3.].中国是世界上小麦产量和消费量最大的地区,赤霉病危害严重,尤其是在长江中下游温暖潮湿的地区。近年来,黄淮小麦主产区赤霉病日趋严重,范围不断扩大[4].
小麦生产者管理和控制赤霉病最有效的方法是选育抗病品种。人们为寻找FHB抗性基因和了解其抗性的遗传机制作出了巨大努力[5,6,7,8,9].FHB抗性的遗传机制是复杂的,环境相互作用的基因型对性状表达有很强的影响[10,11].抵抗f . graminearum(1) I型抗病原菌初侵染,(2)II型抗真菌沿穗部扩散,(3)III型抗籽粒侵染,(4)IV型抗毒素积累,(5)V型耐药[12,13].许多数量性状位点(QTL)已被确定用于小麦多种类型的赤霉病抗性,其影响程度不同[14,15,16,17].主要和稳定的QTL通常在多种环境中具有较大的影响,在实际育种中比次要QTL更有价值。然而,主要和稳定的QTL在FHB抗性中很少见。Fhb1该基因来自中国小麦王水白和苏麦3号,位于染色体3BS上,是FHB抗性的最佳特征位点,作用大,抗性稳定。Fhb1被报道为一种孔隙形成毒素样基因(击球) QTL [18].然而,最近的研究显示,一种富含组氨酸的钙结合蛋白(他的)负责Fhb1电阻(19,20.].本文对这两项研究进行了全面的讨论Fhb1抵抗仍不清楚[21].此外,Fhb1已显示出与不良农艺性状有关,且单一抗性基因已被证明是FHB抗性育种的主要限制,因为它可能无法在严重的FHB流行下提供足够的保护[15,22,23].通过控股公司Fhb1利用MAS将其他主要抗赤霉病QTL导入优良品种中,对选育抗赤霉病的小麦新品种具有重要意义[4,24].扬麦158、扬麦11、扬麦12、扬麦16、扬麦23等在长江中下游地区对赤霉病具有中度抗性的品种已获准释放,成为主要品种[25].大部分洋麦系列品种不携带Fhb1轨迹(26],表明这些品种中可能存在其他FHB抗性基因,更容易应用于育种。因此,发现更多的抗赤霉病种质和新的抗赤霉病基因座对选育抗赤霉病小麦品种至关重要。
基于连锁不平衡(LD)的全基因组关联研究(GWAS)已被广泛应用于发现植物中各种数量性状相关的核苷酸多态性。例如,利用中国西南地区192个面包小麦品种,分别鉴定出57、27、30和34个单核苷酸多态性(SNP)与株高(PH)、籽粒蛋白质含量(GPC)、千粒重(TKW)和十二烷基硫酸钠(SDS)含量的相关性[27].使用SNP-GWAS和单倍型- gwas检测到120个一致位点,其中78个可能是新的[28].最近公布的中国春参考基因组序列[29]为检测与基因组中已知物理位置的连锁标记显著相关的基因并促进分子育种过程提供了一个优秀的平台[30.].在本研究中,我们利用171个普通小麦品种的90 K SNP基因分型和2年的表型数据,对FHB抗性进行了GWAS分析。本研究的目的是利用GWAS鉴定FHB抗性的稳定位点,更好地了解自然群体FHB抗性的遗传基础。
结果
表型变异
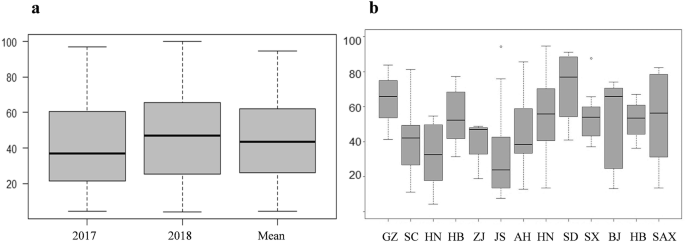
在2017年和2018年的生长季节,GWAS小组观察到症状小穗(PSS)百分比的持续变化,从高抗性(PSS < 25%)到高易感(PSS > 75%)(图2)。1).病害症状在2018年生长季更为严重(图2)。2a).中国不同省份的小麦品种对赤霉病表现出不同的抗性水平(图;2b).湖南和江苏品种对赤霉病的抗性在两个季节均表现出较高水平,山东品种对赤霉病的敏感性最高。
人口结构分析
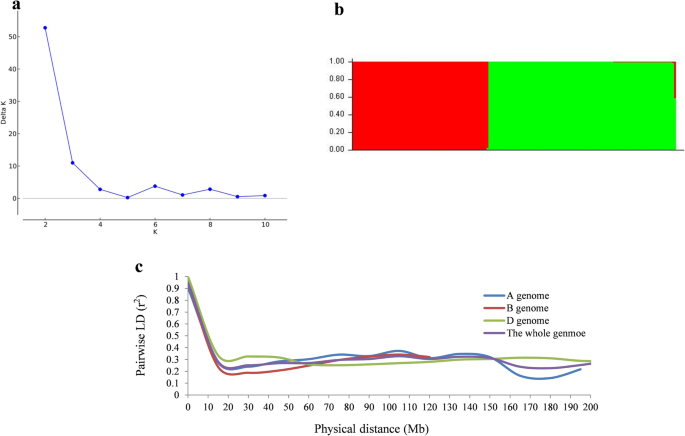
利用分布在21条小麦染色体上的1676个多态性SNP标记,对171个小麦品种的亚群体进行了群体结构分析r2> 0.2。结果表明,该品种可分为2个亚群体(K = 2)。3.a, b).亚群1共99个品种,主要来自安徽、江苏、河南、陕西和湖南;亚组2由72个栽培品种组成1:表S1),主要来自河南、江苏、山东、山西。安徽和湖南小麦品种均聚为1亚群。
连杆不平衡分析
从90 K SNP基因分型阵列中筛选的标记分别用于计算A、B和D亚基因组以及全基因组的LD衰减。38.9%的位点对存在显著的LD (P< 0.001)r2在23556个多态性snp中,多态性为0.281,分布在全基因组水平。B亚基因组含有最多的显著标记(50.0%),其次是A亚基因组(39.7%)和D亚基因组(24.0%)。LD衰变距离在D亚基因组中最高,在B亚基因组中最低。全基因组LD衰变的平均距离为~ 10.5 Mb, A、B和D亚基因组LD衰变的平均距离分别为10、9.5和12 Mb。3.c)。
Marker-trait协会
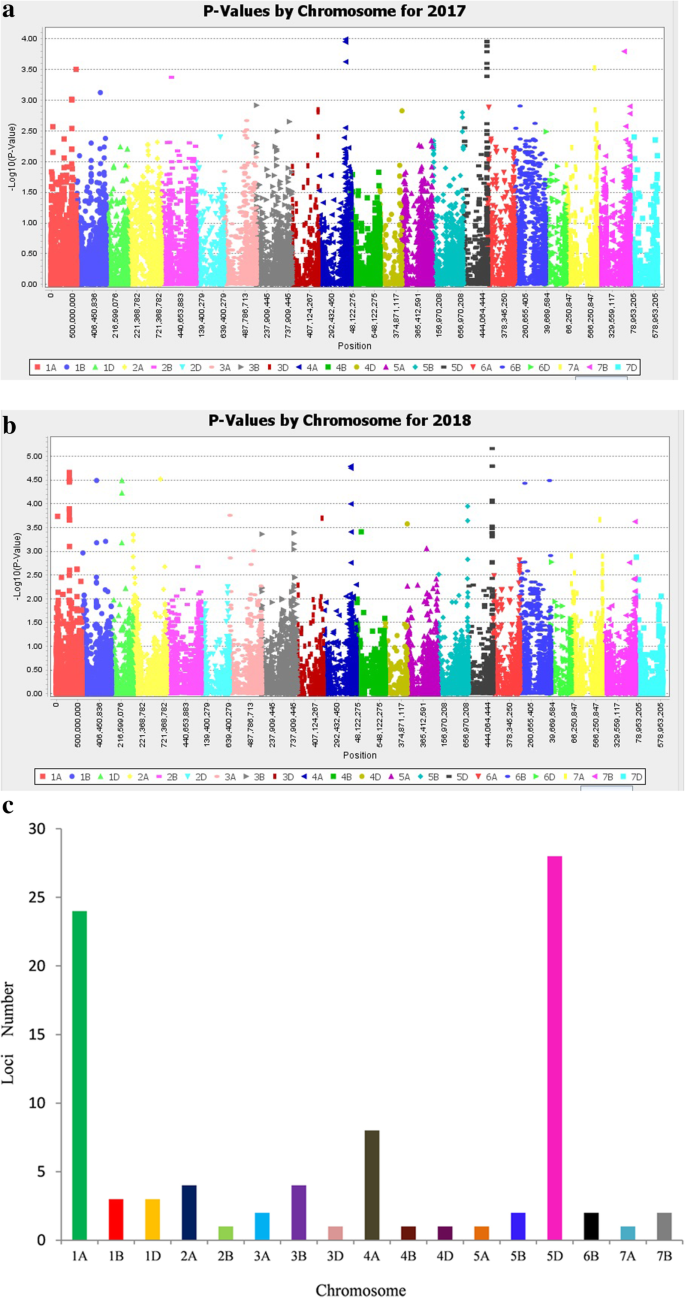
使用2年的PSS数据和23556个筛选标记进行关联分析。共有26个基因座(88个MTAs,P< 10−3),并解释表型差异(R2除2D、6A、6D和7D外,其余所有染色体均鉴定出了6.64-14.18%的基因。4其中,位于a、D、b亚基因组上的显著标记分别为41个、32个和15个(图2)。4c;额外的文件1:表S2)。在1A、1D、1B、2A、3B、4A和5D染色体上发现较多的FHB mta。
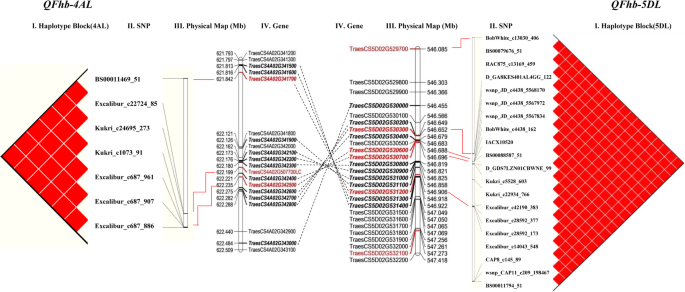
28个位于1B (1), 4A (7), 5D(19)和7A(1)染色体上的mta在两个季节都被一致鉴定出来,可以认为是稳定的QTL(表1)1),单核苷酸多态性基因- 0293 _154位于1B位点的基因解释了6.91-7.18%的表型变异(R2).位于4AL和5DL染色体上的7个和19个snp解释了表型差异(R2),分别为9.36-11.63%和8.11-14.18%。苏格兰民族党BobWhite_c22875_239位于7A位点的基因可解释8.12-8.53%的表型变异(R2).
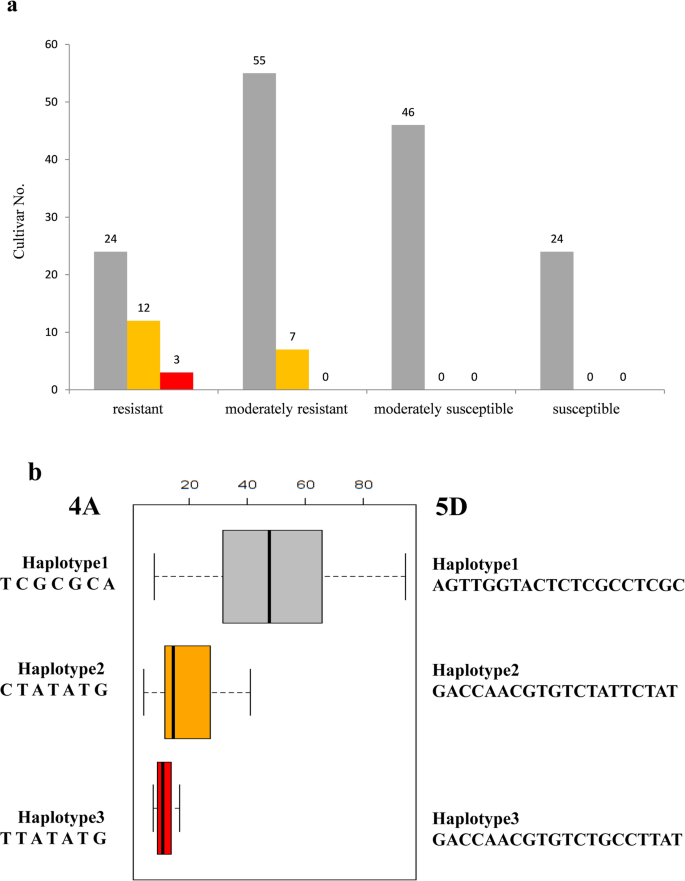
由于小麦的LD水平较高,在染色体4AL上鉴定出SNP簇(QFhb-4AL)由621.85 Mb增至622.24 Mb及5DL (QFhb-5DL)的546.09 Mb至547.27 Mb分别可能代表含有显著FHB相关位点的染色体区域。相关标记的单倍型分析显示了三个单倍型组(图。5a)单倍型1共有149个品种,2年平均PSS为48.92%,其中24个抗性品种,55个中抗性品种,70个易感品种。单倍型2由19个品种组成,2年平均PSS为19.94%,其中12个抗性品种,7个中抗性品种。单倍型3包含3个抗性品种,平均PSS为11.52%。结果表明,单倍型1品种中还存在其他抗性基因(表1)2,额外的文件1:表S3)。有趣的是,每个单倍型所包含的小麦品种具有相同的相关SNPsQFhb-4AL而且QFhb-5DL同时(无花果。5b)。
单倍型分析结果。一个171个不同单倍型品种在4A和5D染色体上平均赤霉病严重程度的频率分布灰色、橙色和红色分别代表单倍型1、单倍型2和单倍型3。x轴显示基于FHB严重程度的1-4分(抗性,0 < PSS≤25%;中等耐腐蚀性,25% < PSS≤50%;中度易感,50% < PSS≤75%和75% < PSS≤100%)。y轴表示不同单倍型的赤霉病严重程度的品种数量(也在柱上编号)。b4A和5D染色体上显著snp的单倍型分析。实心条形图显示每个单倍型的平均FHB严重程度。灰色、橙色和红色分别代表单倍型1、单倍型2和单倍型3。左:小麦系基于4A的显著snp的单倍型;右图:小麦系间基于5D的显著snp单倍型
讨论
GWAS鉴定的FHB耐药位点
QTL的定位镰刀菌素利用不同的测绘群体和测绘平台,已广泛报道了头疫病抗性。从250多个有文献记载的QTL中仅发现了FHB抗性Fhb1-Fhb7已被证明是主要影响qtl。Qfhs.nau-6B(Fhb2),Qfhi.nau-4B(Fhb4),Qfhi.nau-5A(Fhb5)在2.2 cM、0.14 cM和0.09 cM区间内精细映射[16].Fhb1最近已克隆[18,19,20.].在本研究中,两个季节在1B、4A、5D和7A染色体上鉴定出4个位点(28个MTAs)。与苏格兰民族党相比基因- 0293 _154在本研究鉴定的II型赤霉病抗性的1B染色体上,在中国小麦长白种黄房竹的相似物理位置上发现了一个II型抗性的小QTL [31].分别位于4AL和5DL染色体上的两个物理间隔为0.39 Mb和1.18 Mb的位点与II型抗性相关(R2),分别为9.36-11.63%和8.11-14.18%。苏格兰民族党BobWhite_c4438_162本身在5DL上可以解释8.89-14.18%的变异。
欧洲小麦品种4AL染色体抗赤霉病的QTL已被报道。Holzapfel等人[32]从一个法国品种(阿帕奇)的4AL染色体上鉴定出两个FHB抗性QTLxp7452 - 646和一个德国栽培品种(Pirat)与xp7553 - 254. -基于“增大化现实”技术。另一个QTL,QFhs.fal-4AL,已在瑞士冬小麦品种(Arina)的4AL物理位置357.2 Mb上定位[33]。本研究在621.85 Mb ~ 622.24 Mb物理位置的4AL上鉴定的FHB QTL与已有报道的不同,应该是新的FHB抗性位点。从抗fhb小麦品种Chokwang(韩国)中获得了一个II型抗性QTL,并与SSR标记连接Xbarc239[34,35],其物理位置为420.96 Mb。贾等。[36]在第5D染色体上发现了一个QTLXgwm358物理位置为120.61 Mb。由于在546.09 Mb至547.27 Mb物理间隔的5DL染色体上未发现II型抗性的QTL,QFhb-5DL可能是一个新的FHB抗性位点。单核苷酸多态性wsnp_JD_c4438_5568170而且wsnp_CAP11_c209_198467据报道,在5DL的QTL区域与土壤传播小麦花叶病毒(SBWMV)抗性基因密切相关Sbwm1[37].这些snp已被开发成育种友好型竞争等位基因特异性聚合酶链反应(KASP)标记,用于有效区分水稻抗性和敏感等位基因Sbwm1在一个多样化的小麦育种项目中。验证这些KASP标记是否可用于小麦育种中FHB抗性的标记辅助选择将是一个有趣的问题。此外,BobWhite_c22875_239在7AL染色体661.3 Mb处发现与II型耐药相关,这与报道的QTL的近端区域大致相同QFhb.nau-7A源自Wangshuibai [38,39](附加文件1:表S4)。
QFhb-4AL而且QFhb-5DL位于同位基因组区域
我们在4AL和5DL上分别以0.39 Mb和1.18 Mb的物理间隔检测到两个与FHB抗性显著相关的位点。标记的LD和FHB严重程度分析表明,每个单倍型均含有相关SNP的小麦品种QFhb-4AL而且QFhb-5DL同时进行。基因组间隔的基因注释显示4AL和5DL之间有同源基因对。在两个FHB抗性QTL区域中观察到基因顺序和含量高度共线性,即使是通过大片段插入/缺失也存在(附加文件)1表S5;无花果。6).
小麦经历了包括4A、5A和7B染色体易位的结构进化。4AL/5AL易位发生在二倍体水平,两者均存在t . monococcum而且t . aestivum随后在六倍体小麦的四倍体祖先中发生了4AL/7BS易位、周围中心反转(4AS;4AL)和旁中心反转(4AL;4AL) [40].最近,Dvorak等人。[41]通过对野生二聚体小麦和野生二聚体小麦的序列比较,重新评估了小麦染色体4A、5A和7B的进化山羊草属tauschii。他们发现4A假分子的596.20-631.84 Mb基因组区域来源于祖先的5AL,具有嵌套反转,对应于其末端Ae。tauschii手臂5 dl。4AL (621.81-622.49 Mb)和5DL (546.45-546.92 Mb)上的两个FHB相关位点位于序列反转的同向区(无花果。6),提供了该结构重排包含农艺性状重要基因的进一步信息。
对4AL和5DL共联块的假设蛋白进行了预测(表格3.)。两种激酶蛋白,与pti1样酪氨酸蛋白激酶1和假定的受体蛋白激酶ZmPK1同源,被证明与植物抗病相关,在相应的基因组区域被注释(附加文件)1:表S4和表S5)。蛋白激酶(PKs)在调节植物发育和适应不同环境条件的跨膜信号传导中很重要[42].几种激酶蛋白已被报道与植物先天免疫有关。例如,一个激酶和一个假定的START脂质结合域的结合是赋予小麦抗锈病的必要条件Yr36[43].小麦抗条锈病基因Yr15(WTK1) [44]和大麦(大麦芽L.)茎锈病(茎杆f . sp。tritici)抗性基因Rpg1[45]含有一种具有串联激酶结构域的结构。玉米壁相关激酶蛋白(ZmWAK)对玉米黑穗病具有定量抗性[46]和pti1样激酶(ZmPti1A)已知在促进花粉表现和雄性适应性的信号通路中发挥重要作用[47].
激酶蛋白也被发现在f . graminearum。MAP激酶基因(MGV1)f . graminearum是与有性繁殖、植物感染和细胞壁完整性相关的更多发育过程所必需的[48].与哺乳动物同源的糖原合成酶激酶基因GSK3是否有显著的毒力因子Fgk3糖原合成酶激酶在植物的生长、发病机制、分生孢子发生、DON的产生和应激反应中也很重要f . graminearum[49].考虑到激酶蛋白在4AL和5DL上鉴定的FHB抗性合成位点中的潜在重要性,pti1样酪氨酸蛋白激酶1和假定的受体蛋白激酶ZmPK1的小麦同源物可能被认为是FHB抗性的候选者,需要进一步的鉴定。
结论
在本研究中,我们利用小麦90 K SNP法鉴定了26个FHB抗性位点,在两个季节都检测到4个稳定的位点。在4AL和5DL上发现了两个新的FHB抗性位点,这些位点位于同向基因组区域,表明这些区域含有重要的基因,对未来的研究和育种应用具有重要价值。与赤霉病抗性显著相关的SNP标记可作为赤霉病抗性育种相关标记选择的诊断标记。
方法
植物材料
由171个小麦品种组成的联合小组用于SNP基因分型和2年FHB抗性表型分型。其中3个品种来自意大利、墨西哥和日本,168个品种来自中国北方8个冬麦区省份和中国南方9个省份(补充档案)1:表S1)。所有小麦品种均经中国国家基因库、中国农业科学院和江苏省农业科学院批准收集。在江苏省扬州市里下河农业科学研究所万福实验站(海拔8 m,北纬32.24°N,年降水量约1000 mm,生长期为11月初至次年5月)种植5年,每年记录花期。171个小麦品种的最早品种和最晚品种的平均花期相差不超过4.0天。
田间试验设计为随机的完整块,每年重复2次。每个重复分两行播种,每行播种40粒,长度为133 × 25 cm。现场试验符合当地管理规范。
表现型
所有品种分别在2016-2017年(简称2017年)和2017 - 2018年(简称2018年)的生长季节接种f . graminearum菌株(F4, F15, F34和F0609),由江苏省农业科学院陈怀谷教授友好提供,中国南京。抽穗后期接种大孢子悬液(1.0 × 105分生孢子/ml)根据开花时间,在每个穗状花序中间形成单个小花。
每天上午7时至下午6时,每30分钟用雾灌溉5 min,以确保在高湿条件下接种的穗完全感染[50].接种25 d后记录感染小穗数和每个标记小穗的总小穗数。计算症状小穗的平均百分比(PSS)作为FHB严重程度的衡量标准。根据FHB的严重程度,将所有供试品种分为4类:抗性(0 < PSS≤25%)、中度抗性(25% < PSS≤50%)、中度易感(50% < PSS≤75%)和易感(75% < PSS≤100%)[51].
基因分型和SNP呼叫
采用CTAB法从田间生长的未感染植物苗期新鲜叶片中提取基因组DNA [52].利用Illumina SNP基因分型平台和BeadArray Microbead芯片,美国加州大学植物科学系生物技术中心的Illumina 90 K iSelect阵列(含有81587个SNP)对关联定位群体进行基因分型[53].为避免假的标记-性状关联(MTAs),将等位基因频率较小(MAF) < 0.05和缺失数据> 10%的SNP标记从后续分析中排除。SNP标记的物理位置来自国际小麦基因组测序联盟网站(IWGSC)上的中国春季参考基因组序列。http://www.wheatgenome.org/).
人口结构分析与连锁失衡
利用结构2.3.4估计群体结构,1676个多态性SNP标记分布在所有21条小麦染色体上r2< 0.2,基于贝叶斯聚类分析[54].采用外加剂模型进行6组结构试验,K值在1 ~ 11之间,每个试验重复10万次,分别用于老化和MCMC。采用∆K法确定最佳K值[55].linkage disequilibrium (LD) among markers was computed by the full matrix and sliding window options in Tassel v5.0 with the filtered SNP markers. The pairwise LD between the markers was calculated using squared allele frequency correlationsr2,根据Liu等。[56].
FHB抗性的GWAS
利用Tassel v5.0的混合线性模型(MLM)中的亲缘矩阵分析基因型和表型数据之间的关联,以控制背景变异并消除假mta。在MLM分析中,将亲缘矩阵(K矩阵)作为随机影响因素,将亚群体数据(Q矩阵)作为固定影响因素[57].K矩阵和Q矩阵的计算采用Tassel v5.0软件和Structure v2.3.4程序进行。的R2显示由SNP解释的变异被记录下来[58].带调整-log的snp10(P-value)≥3.0被认为与FHB抗性显著相关。同一染色体上一个LD内的显著SNP标记被认为代表一个位点。使用Haploview v.4.2对显著snp进行单倍型分析[59].
候选基因的鉴定
为了识别与重要SNPs相连的候选基因,以染色体名称为前的标记的物理位置被带到Ensembl (https://urgi.versailles.inra.fr/gb2/gbrowse/wheat_survey_sequence_annotation),考虑相同遗传位置的基因。然后探索预测基因和注释的间隔。对于IWGSC注释中无法获得的基因,我们使用Ensembl中的比较基因组学工具评估了相关物种中具有预测功能的同源基因(蛋白质)。当在系综中相关物种的注释基因组中同源基因的相似度小于70%时,其序列为t . aestivum基因使用NCBI和basic local alignment search tool (BLAST)搜索高度相似序列(http://blast.ncbi.nlm.nih.gov/Blast.cgi).
数据和材料的可用性
本研究的表型数据可在附加文件中查阅1:表S1。支持这项研究结果的数据集可以在文章及其附加文件中获得。使用和/或分析的任何其他数据集均可根据要求提供。
缩写
- 唐:
-
Deoxynivalenol
- FHB:
-
镰刀菌素头枯萎
- GPC:
-
籽粒蛋白质含量
- GWAS:
-
全基因组关联研究
- 他:
-
富含组氨酸的钙结合蛋白
- LD:
-
连锁不平衡
- 加:
-
次要等位基因频率
- MAS:
-
分子标记辅助选择
- 传销:
-
混合线性模型
- MTA:
-
Marker-trait协会
- 击球时:
-
成孔毒素样基因
- PH值:
-
株高
- PSS:
-
有症状的小穗的百分比
- QTL:
-
数量性状位点
- R2:
-
表型方差解释
- SDS:
-
十二烷基硫酸钠
- SNP:
-
单核苷酸多态性
- TKW:
-
千粒重
参考文献
- 1.
Curtis T, Halford NG。粮食安全:提高小麦产量的挑战和不损害粮食安全的重要性。中国生物医学工程学报,2014;26(3):354 - 372。
- 2.
Nopsa JFH, Baenziger PS, Eskridge KM, Peiris KHS, Dowell FE, Harris SD, Wegulo SN。在田间条件下,两个不同FHB表型反应的冬小麦品种脱氧雪腐镰刀醇的差异积累。植物病理学杂志。2012;34(3):380-9。
- 3.
王晓明,王晓明,王晓明,王晓明,王晓明。小麦赤霉病抗性的基因组预测方法研究。植物基因组学学报,2012;5(2):51-61。
- 4.
任杰,王震,杜震,车明,张勇,权伟,王勇,姜霞,张震。小麦抗赤霉病主QTL在7DL染色体末端的检测与验证。应用理论。2019;32(1):241-55。
- 5.
白刚,沙尔尔。小麦赤霉病防治展望。植物科学进展,1994;18(8):760-6。
- 6.
白桂平,夏尔吉。小麦和大麦对赤霉病的防治与抗性。植物病理学杂志。2004;42:135-61。
- 7.
布斯特迈尔H,潘T,安德森JA。小麦抗赤霉病QTL定位与标记辅助选择研究进展。植物学报。2009;28(1):1 - 26。
- 8.
杨晓明,王晓明,王晓明,等。小麦赤霉病的研究进展。植物病理学杂志。2013;35(2):149-74。
- 9.
陈燕,王娟,杨楠,文珍,孙霞,柴勇,马忠。小麦微生物菌群通过改变组蛋白乙酰化降低植物病原真菌的毒力。地理学报。2018;9(1):3429。
- 10.
Campbell KA, Lipps PE。资源配置:赤霉病筛选苗圃变异的来源。植物病理学。1998;88(10):1078 - 86。
- 11.
富恩特斯RG,米克尔森HR,布希RH,迪尔-麦基R,埃文斯CK,汤普森WG,威尔斯马JV,谢伟,董y,安德森JA。春小麦抗赤霉病育种的资源配置与品种稳定性。作物科学,2005;45(5):1965-72。
- 12.
梅斯特哈兹A, Bartok T, Mirocha CG, Komoroczy R.小麦抗赤霉病的性质及脱氧雪腐镰刀醇在育种中的作用。植物育种1999;118:97-110。
- 13.
小麦赤霉病抗性的类型和组成。中国植物学报,1995;26(5):366 - 366。
- 14.
Petersen S, Lyerly JH, Maloney PV, Brown-Guedira G, Cowger C, Costa JM, Dong Y, Murphy JP。冬小麦品种NC-Neuse抗赤霉病数量性状位点的定位。作物科学,2016;56(4):1473-83。
- 15.
王晓明,王晓明,王晓明,王晓明。小麦赤霉病抗性的基因分型分析。植物基因组学报,2016;9(1)。https://doi.org/10.3835/plantgenome2015.04.0028。
- 16.
薛贾H,周J,年代,李G,燕H, C,张Y, J,贾L,王X, et al。了解中国小麦长种王水白抗枯萎病的历程。作物学报,2018;6(1):48-59。
- 17.
王晓明,王晓明,王晓明,王晓明,等。小麦品种间群体抗赤霉病抗性qtl分析。前沿植物科学,2016;7:1381。
- 18.
Rawat N, Pumphrey MO, Liu S, Zhang X, Tiwari VK, Ando K, Trick HN, Bockus WW, Akhunov E, Anderson JA,等。小麦Fhb1编码具有凝集素结构域和孔隙形成毒素样结构域的嵌合凝集素,从而对赤霉病具有抗性。中国科学,2016;48(12):1576-80。
- 19.
苏震,Bernardo A,田波,陈红,王松,马红,蔡松,刘东,张东,李涛,等。TaHRC缺失突变使Fhb1对小麦赤霉病具有抗性。植物学报,2019;51(7):1099-105。
- 20.
李G,周J,贾庆林H,高Z,风扇,罗Y,赵P,雪,李N,元Y, et al。小麦中富含组氨酸的钙结合蛋白基因的突变赋予了对赤霉病的抗性。植物学报,2019;51(7):1106-12。
- 21.
Lagudah ES, Krattinger SG。一个新玩家,有助于持久的镰刀抵抗。植物学报,2019;51(7):1070-1。
- 22.
王晓燕,王晓燕,王晓燕,等。病原菌种群遗传、进化潜力及耐受性研究。植物病理学杂志。2002;40:349-79。
- 23.
杨晓明,王晓明,王晓明,等。分子标记辅助选择技术在小麦和大麦抗病育种中的应用。植物病理学。2012;102(6):560 - 6。
- 24.
郝勇,何忠,朱智,武尔夫BBH,何忠。利用小麦Fhb1抗镰刀病的研究。植物科学,2019。https://doi.org/10.1016/j.tplants.2019.10.006。
- 25.
朱智,郝勇,Mergoum M,白g, Humphreys G, Cloutier S,夏欣,何铮。全球北方地区小麦抗赤霉病选育研究:中国、美国和加拿大。2019年作物j。https://doi.org/10.1016/j.cj.2019.06.003。
- 26.
Rasheed A,文伟,高峰,翟硕,金华,刘杰,郭强,张勇,Dreisigacker S,夏霞,等。面包小麦关键经济性状基因KASP分析的开发与验证。应用理论,2016;29(10):1843-60。
- 27.
刘娟,冯斌,徐震,范霞,姜峰,金霞,曹娟,王峰,刘强,杨玲,等。中国西南地区小麦产量与品质性状的全基因组关联研究。生物学报。2017;38(1):11。
- 28.
李峰,文伟,刘杰,张勇,曹松,何忠,Rasheed A,金辉,张超,闫杰,等。基于全基因组关联研究的面包小麦籽粒产量遗传结构。BMC植物生物学,2019;19(1):168。
- 29.
国际小麦基因组测序C,调查员IRp, Appels R, Eversole K, Feuillet C, Keller B, Rogers J, Stein N,调查员Iw-gap, Pozniak CJ,等。利用完全注释的参考基因组改变小麦研究和育种的限制。科学。2018;361(6403)。https://doi.org/10.1126/science.aar7191。
- 30.
Juliana P, Singh RP, Singh PK, Poland JA, Bergstrom GC, Huerta-Espino J, Bhavani S, Crossa J, Sorrells ME。小麦抗叶锈病、条锈病和黑斑病的全基因组关联图谱揭示了潜在的候选基因。理论与应用,2018;31(7):1405-22。
- 31.
李涛,白刚,吴松,谷松。中国小麦长种黄房竹抗赤霉病的数量性状位点分析。Euphytica。2012;185(1):93 - 102。
- 32.
Holzapfel J, Voss HH, Miedaner T, Korzun V, Haberle J, Schweizer G, Mohler V, Zimmermann G, Hartl L. 3个欧洲冬小麦群体对赤霉病抗性的遗传分析。应用理论,2008;117(7):1119-28。
- 33.
Paillard S, Schnurbusch T, Tiwari R, Messmer M, Winzeler M, Keller B, Schachermayr G.瑞士冬小麦抗赤霉病QTL分析(小麦l .)。应用理论,2004;109(2):323-32。
- 34.
Agenbag GM, Pretorius ZA, Boyd LA, Bender CM, MacCormack R, Prins R.小麦品种Kariega成体植株抗条锈病QTL的高分辨率定位及新标记的开发。Mol Breed. 2014;34(4): 2005-20。
- 35.
杨杰,郭柏,葛善尔。小麦品种赤光抗赤霉病的QTL研究。应用理论,2005;111(8):1571-9。
- 36.
贾刚,陈德昌,秦国军,白海华,王旭,王世林,周波,张世生,刘金杰。王水白/Alondra’小麦DH群体对赤霉病反应的qtl分析。Euphytica。2005;146(3):183 - 91。
- 37.
刘珊珊,杨霞,张东,白刚,晁山,Bockus W.通过全基因组关联分析发现了一个抗土传小麦花叶病毒基因的snp。应用理论与实践。2014;27(5):1039-47。
- 38.
安东,郑强,周勇,马平,吕震,李玲,李波,罗强,徐红,徐勇。小麦-黑麦4R染色体易位系抗白粉病的分子细胞遗传学特征。染色体科学,2013;21(4):419-32。
- 39.
Ali F, Muneer M, Xu J, Durrishahwar A, Ur Rahman H, Lu Y, Hassan W, Ullah H, Noor M, Ullah I,等。玉米(Zea mays L.)南方叶枯病(SLB)在寄生线虫(Helminthosporium maydis)条件下理想等位基因的积累。作物学报,2012;6(8):1283-9。
- 40.
Devos KM, Dubcovsky J, Dvorak J, Chinoy CN, Gale MD.小麦染色体4A、5A和7B的结构进化及其对重组的影响。应用理论。1995;91(2):282-8。
- 41.
Dvorak J, Wang L, Zhu T, Jorgensen CM, Luo MC, Deal KR, Gu YQ, Gill BS, Distelfeld A, Devos KM,等。小麦4A、5A和7B染色体进化的重新评价应用物理学报,2018;31(11):2451-62。
- 42.
梁旭,周建民。受体样细胞质激酶:植物受体激酶介导信号转导的中心参与者。植物生物学,2018;69:267-99。
- 43.
傅东,Uauy C, Distelfeld A, Blechl A, Epstein L, Chen X, Sela H, Fahima T, Dubcovsky J.小麦条锈病的温度依赖性抗性激酶- start基因。科学。2009;323(5919):1357 - 60。
- 44.
Klymiuk V, Yaniv E, Huang L, Raats D, Fatiukha A, Chen S, Feng L, Frenkel Z, Krugman T, Lidzbarsky G,等。小麦Yr15抗性基因的克隆揭示了植物串联激酶-假激酶家族。地理学报。2018;9(1):3735。
- 45.
Brueggeman R, Rostoks N, Kudrna D, Kilian A, Han F, Chen J, Druka A, Steffenson B, Kleinhofs A.大麦茎秆抗锈病基因Rpg1是一个与受体激酶同源的新抗病基因。中国科学(d辑),2002;29(3):326 - 326。
- 46.
左伟,晁强,张楠,叶健,谭刚,李斌,邢勇,张斌,刘宏,冯勒卡,等。玉米壁相关激酶对黑穗病具有定量抗性。中国科学,2015;47(2):151-7。
- 47.
Herrmann MM, Pinto S, Kluth J, Wienand U, Lorbiecke R.来自玉米(Zea mays L.)的pti1样激酶ZmPti1a与花粉质膜上的胼胝体共定位,促进雄配子体的竞争优势。BMC植物生物学。2006;6:22。
- 48.
侯震,薛超,彭勇,Katan T, Kistler HC,徐俊杰。小麦赤霉病(Fusarium graminearum)中一个丝裂原活化蛋白激酶基因(MGV1)在雌性育性、异核体形成和植物侵染中是必需的。植物与微生物相互作用。2002;15(11):1119-27。
- 49.
秦J,王G,江C,小徐,王C Fgk3糖原合酶激酶的发展很重要,发病机理,花药对赤霉病和压力反应。科学通报2015;5:8504。
- 50.
易鑫,程杰,蒋震,胡伟,别涛,高东,李东,吴蓉,李勇,陈松,等。利用传统QTL和条件QTL作图分析CIMMYT面包小麦品系C615抗赤霉病的遗传特性。植物科学,2018;9:573。
- 51.
李涛,罗敏,张东,吴东,李玲,白刚。田间2型赤霉病抗性相关有效标记等位基因的研究。育种科学2016;66(3):350-7。
- 52.
Sharp PJ, Chao S, Desai S, Gale MD.一套识别小麦同源染色体臂的RFLP探针的分离、鉴定及其在小麦科的应用。应用理论。1989;78:342-8。
- 53.
Cavanagh CR, Chao S, Wang S, Huang BE, Stephen S, Kiani S, Forrest K, Saintenac C, Brown-Guedira GL, Akhunova A,等。全基因组比较多样性揭示了六倍体小麦地方品种和栽培品种的多种改良选择靶点。中国科学(d辑),2013,26(3):357 - 357。
- 54.
普里查j,斯蒂芬斯M,罗森博格NA,唐纳利P.组织群体的关联映射。胡姆·热内。2000;67:170-81。
- 55.
李志强,李志强,李志强,等。利用软件STRUCTURE检测个体聚类的数量:模拟研究。分子生态学报,2005;14(8):2611-20。
- 56.
刘健,何忠,Rasheed A,文伟,闫娟,张鹏,万勇,张勇,谢超,夏欣。普通小麦黑点反应的全基因组关联定位(小麦l .)。中国生物医学工程学报,2017;17(1):220。
- 57.
Yu J, Pressoir G, Briggs WH, Vroh Bi I, Yamasaki M, Doebley JF, McMullen MD, Gaut BS, Nielsen DM, Holland JB,等。一种用于关联映射的统一混合模型方法,该方法考虑了多个级别的相关性。中国科学。2006;38(2):203-8。
- 58.
白伯利,张哲,张文杰,张文杰,张文杰,张文杰。TASSEL:用于不同样本中复杂性状关联映射的软件。生物信息学。2007;23(19):2633 - 5。
- 59.
巴雷特JC,弗莱B,马勒J,达利MJ。单倍图:LD和单倍型图的分析和可视化。生物信息学。2005;21(2):263 - 5。
致谢
作者非常感谢中国农业科学院深圳农业基因组研究所刘近东博士对这篇手稿的严格审查。
资金
国家自然科学基金项目(31901544)、国家重点研发计划项目(2017YFD0100801;2016YFD0101802),江苏省自然科学基金(BK20171279),中国农业科学研究系统(CARS-03-03B)。每个资助机构根据一份研究提案授予资金。国家重点研发计划项目(2017YFD0100801;2016YFD0101802)协助设计数据的研究和收集、分析、解释,并撰写稿件。其他资金对研究的设计、数据的收集、分析和解释以及手稿的撰写没有影响。
作者信息
从属关系
贡献
WJH进行了实验并撰写了论文。DRG和HYW参与了实地试验,并协助修改了论文。JL、CMZ、JCW、ZNJ、YYL、DSL参加了田间试验。YZ和CBL设计了实验,并协助分析数据和撰写论文。所有作者都阅读了这篇手稿的最终版本并批准了它的出版。
相应的作者
道德声明
伦理批准并同意参与
我们声明,这些实验符合中国的伦理标准和法律,所有小麦品种的采集都符合国家指导方针。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1
在全基因组关联研究(GWAS)中使用的171个小麦品种用于FHB严重程度及其来源,表S2Tassel v5.0在171个小麦品种中鉴定了FHB抗性的标记-性状关联(MTAs),表S3属于不同单倍型及其FHB严重程度的品种,表S4已报道的FHB抗性QTL的物理位置与当前研究相关,表S54A和5D对应切片中存在具有相同功能的FHB抗性相关区域。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
胡伟,高,D,吴,H。et al。全基因组关联作图揭示了共向位点QFhb-4AL而且QFhb-5DL为镰刀菌素普通小麦抗头疫病(小麦l .)。BMC植物生物学20.29日(2020年)。https://doi.org/10.1186/s12870-019-2177-0
收到了:
接受:
发表:
关键字
- 小麦l
- 镰刀菌素头疫病;混合线性模型
- 全基因组关联研究(GWAS)
- 单核苷酸多态性(SNP)