摘要
背景
膜蕨属植物(膜叶科)是一种耐脱水、同叶绿素的附生植物。它们可以在湿润森林的冠层上下环境中定植。薄膜蕨类植物干燥迅速(小时),与DT被子植物相比(天/周)。有人提出,膜蕨类植物的脱水耐受性主要与本构特征有关,而不是脱水过程中的诱导反应。然而,我们假设垂直分布的种间差异可能与脱水或再水化阶段基因表达的不同动态有关。利用人工神经网络对其进行转录组学对比分析Hymenophyllum caudiculatum(仅限于低树冠)和Hymenophyllum dentatum(到达上冠层)在干燥/复水循环。
结果
原始阅读被汇编成69,599份转录本h . dentatum34,726份成绩单h . caudiculatum.少数转录本差异表达(DE)发生显著变化。h . caudiculatumDE基因是h . dentatum脱水过程中基因丰度增减的比例较高。相比之下,基因的丰富性h . dentatum从脱水过渡到补液时明显下降。根据人工神经网络的结果,h . caudiculatum渗透反应增强,苯丙类相关通路增强h . dentatum增强其防御系统的反应和对强光应力的保护。
结论
我们的研究结果进一步揭示了两种薄膜蕨类植物的耐干燥反应机制,以及它们在自然界中所处的微生境与物种特异性反应的关系。
背景
植物进化形成了几种适应机制和适应能力,以承受短期和长期的水分亏缺。然而,除了少数所谓的复活植物外,大多数植物都不能在干燥的环境中存活。1,2].耐干燥性是一种复杂的特性,涉及一系列分子事件的协调,这些分子事件分为构成性和诱导性机制,以保护/修复细胞和组织免受氧化损伤,以及代谢和细胞超微结构的破坏[2,3.].一般来说,复活植物耐干燥的生理和代谢成分类似于干旱胁迫反应和种子成熟的结合过程[4,5];然而,耐旱性背后的分子“开关”和调控途径在很大程度上是未知的[6].复活植物根据其敏感性、反应机制和失水速度可分为两类[7].那些能够在快速失水中存活下来的植物,如苔藓,具有构成性的(预先存在的)形态生理耐旱机制,利用复水后诱导的细胞修复机制,而那些只能在逐渐失水时存活下来的植物则依赖于脱水过程中诱导的细胞保护机制。
令人惊讶的是,复活植物也在潮湿的环境中发现,如热带和温带雨林[8].一个例子是Lindernia brevidens属热带雨林的被子植物[9].膜茶科的附生蕨类植物(蕨类植物)是另一类生活在潮湿生态系统中的复活植物[8].膜茶科的成员被称为膜蕨类植物,因为它们具有单层细胞的膜质叶,通常缺乏角质层,表皮未分化,也没有气孔[10,11].由于它们叶片的特征和反复暴露于快速脱水-再水化事件,这些蕨类植物进化出了一种多水和同叶绿素的策略,最典型的苔藓植物,表现出较高的耐干燥性和快速再水化的能力[10,12,13].
膜茶科是智利温带雨林特有的16种。它们是附生物种多样性的重要组成部分。薄膜蕨类植物可以在其宿主树的大部分垂直层上定居,尽管有报道称其对种内栖息地的要求[11,14,15].例如,Hymenophyllum caudiculatum而且Hymenophyllum pectinatum被限制在宿主主干的较低部分(从地面到垂直高度1米),那里的光可用性非常低(10-100 μmol光子m−2年代−1),且湿度较高。其他物种(例如,h . dentatum,h . plicatum)将它们的垂直分布扩展到10 m以上的高度(PDF最终达到≥1000 μmol光子m−2年代−1) [11,13,15].光照强度(PFD)和水汽压差(VPD)均随寄主植株高度的增加而增加,相对湿度则随寄主植株高度的增加而降低。因此,长到树干顶部的树种容易遭受频繁的干燥和光抑制。从非常隐蔽的、高稳定湿度的环境到沿着宿主树垂直分布的高光、低湿度的广泛的栖息地,提供了一个独特的机会来解决分子和生理机制如何在微生境偏好和耐受干燥能力不同的同属种群中形成的问题。诸如:在脱水过程中,负责保护/修复这些薄膜蕨类植物组织脱水的分子机制是可诱导的吗?还是构成性的(预先存在的),比如那些迅速干燥的苔藓植物?来自弱光、高湿环境的膜蕨物种与来自强光、低湿环境的膜蕨物种之间的基因表达动态是否相似?这些薄膜蕨类植物在干燥-再水化的循环过程中是否会调用类似的基因功能?由于膜状蕨类植物经常快速脱水,有人提出,这些蕨类植物的脱水耐受性主要与本构特征有关,而不是脱水过程中的诱导反应。然而,我们假设垂直分布的种间差异可能与脱水或再水化阶段基因表达的不同动态有关。 Published data partially support this idea [16,17].下一代测序(NGS)工具的进步为揭示与自然约束相关的植物反应控制机制带来了重要优势原位或者在实验条件下。在这里,我们使用Illumina Hi-seq平台上的RNA-seq研究和比较h . caudiculatum而且h . dentatum,两种膜茶科植物沿宿主树垂直微生境偏好对比明显,失水速率不同(图。1).具体来说,我们研究了基因表达的动态和加权基因共表达网络(WGCNA) [18]结合神经人工网络[19,20.,21],以确定与其复活策略下的水状态相关的基因表达动态的共性和差异。
结果
蕨类植物干燥-复水循环过程中相对含水量和最大量子效率的变化
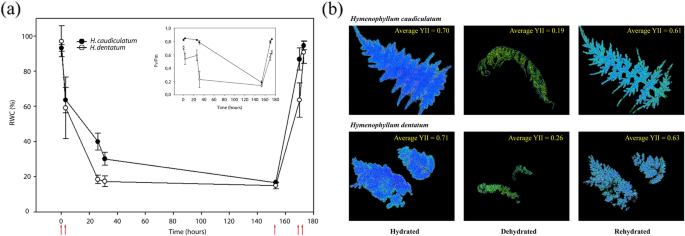
两种薄膜蕨类植物在停止灌溉(开始脱水)后的前三个小时内表现出相似的脱水速率,均达到相对含水量(RWC)的60%左右(图3)。2a).不灌溉3 ~ 25小时,h . dentatum失水速度快于h . caudiculatum, RWC分别达到18%和30%。在脱水过程中,最大量子效率(Fv/Fm)从0.7 in急剧下降到0.2 inh . dentatum但仍然接近0.78英寸h . caudiculatum(无花果。2插入)。在一周不灌溉后,两者的RWC均在11 - 17%之间,Fv/Fm接近0.2(图2)。2a).重新灌溉后,h . caudiculatumFv/Fm的再水化和恢复速度比h . dentatum.然而,两个物种在实验结束时达到了相似的最大光化学效率(Fv/Fm)。光化学效率在整个叶水平的恢复是通过成像荧光确认的(图。2b)。
转录谱和转录本注释
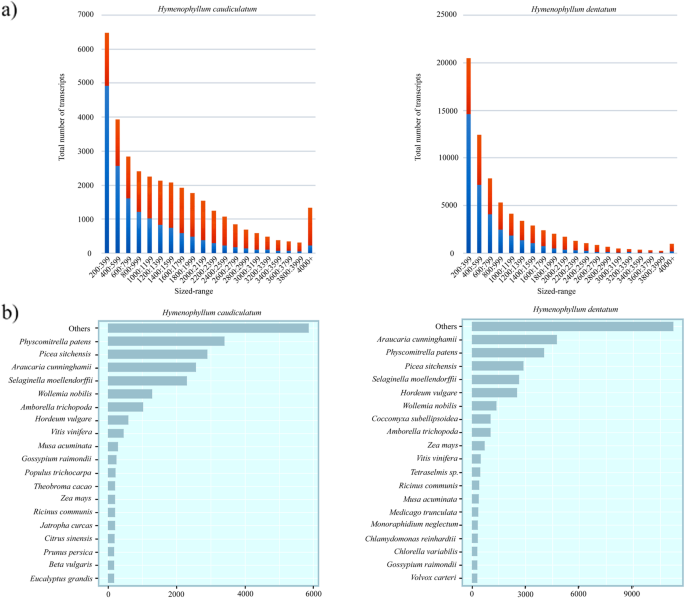
测序得到111,495,169和110,988,488对端reads (101 bp)h . caudiculatum而且h . dentatum,在Illumina HiSeq2000平台上(附加文件1:表S1)。在删除低质量读取和重复读取之后,我们执行了一个新创利用Trinity软件进行转录组组装,使用一组约8500万次读取h . caudiculatum大约8700万阅读量h . dentatum(附加文件1:表S1)。初始装配结果为161,689个contigsh . caudiculatum332,003个contigsh . dentatum,经过改进以删除低支持的转录本。去除估计丰度低于1 FPKM的转录本和序列相似度高于95%的高度相似或冗余转录本。由此产生的转录组由34,726个contigs表示h . caudiculatum还有69,599个contigsh . dentatum(附加文件1:表S2)。尽管在细化过程中转录本的数量显著减少,但约80%和70%的高质量reads被映射到h . caudiculatum而且h . dentatum转录组,分别。
最终的转录组集合与SwissProt数据库进行比对,每个转录组的转录本的比对率约为50%。尽管鉴定率很低,但大多数未知转录本(~ 80%)被发现h . dentatum, ~ 65%h . caudiculatum;额外的文件1:表S3)属于小尺寸转录本(< 1000 bp;见图。3.a).深入了解转录本的顶级爆炸命中的分类分布,揭示了两者h . caudiculatum而且h . dentatum在它们的热门序列中,是否有大量属于苔藓模型的序列Physcomitrella金属盘还有石松Sellaginella moellendorffii(无花果。3.B),这与他们的poikkhydrostrategy和回归进化假说是一致的[22].
微分表达式分析和函数注释
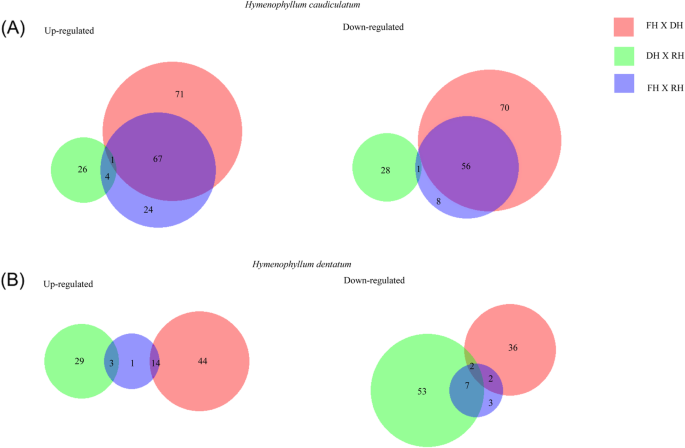
在经过质量筛选和优化后,我们以fold change≥2和FDR < 0.05为cut-off,对注释基因在脱水-复水循环中的表达动态进行了两两比较(附加文件2:数据集S1和S2)。在这两个物种中,很少有转录本表现出显著的差异表达(DE)变化。为h . caudiculatum脱水过程中DE基因数量最多,共有265个,其中大部分[139]的丰度有所增加(图。4).在h . dentatum,增加和减少它们丰度的DE基因数量相似。然而,在不同的水合状态下,从脱水到复水合过渡时,基因丰度显著降低。当比较这两个物种时,h . caudiculatum具有ca. 2倍DE基因h . dentatum两者比例较高时,脱水过程中基因丰度升高或降低(图;4).
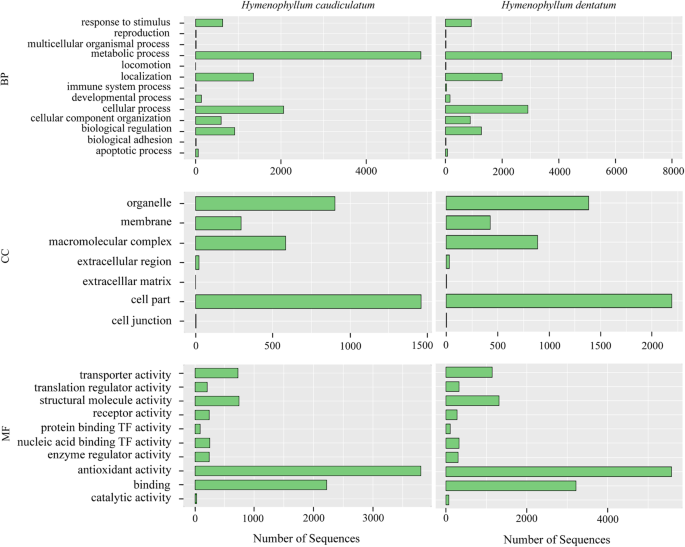
从差异表达的转录本中,我们通过进行基因本体分析(GO)探索了基因产物的功能(详见材料和方法)。这两个物种在每个GO类别的序列中表现出相似的富集模式(图。5).例如,在生物过程类别(BP)中,代谢过程(> 4000序列)和细胞过程(> 2000序列)的序列数量较多。在细胞成分类别(CC)中,细胞器和细胞部分成分序列的富集程度最高(例如,细胞器约1000和1500个序列)h . dentatum而且h . caudiculatum分别)。最后,在分子功能类(MF)中,发现抗氧化活性序列积累最多,其次是结合过程(图2)。5).
在差异表达分析的同时,我们还观察到所有基于FPKM值的高丰度转录本,但其折叠变化值< 2,即本构性高丰度基因在脱水-复水循环中没有明显变化。共102份成绩单h . caudiculatum, 128h . dentatum表明这两种薄膜蕨类植物的耐旱性大致涉及三个主要过程,即平移、光合作用和抗氧化活性(见附加文件)2:数据集S3用于每个物种中高度丰富的本构转录本的详细列表)。
转录本聚类模式和基因共表达网络h . caudiculatum而且h . dentatum通过脱水-再脱水循环
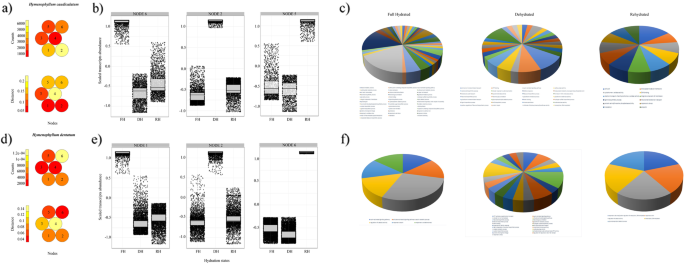
从注释的DE基因中,我们研究了这两种复活膜蕨类植物的基因表达动态,首先确定了在特定水化状态下具有相似积累模式的转录本,其次,研究了与脱水和再水化反应相关的基因相互作用和共表达的复杂性。自组织映射(SOM)将DE基因划分为6个簇(以下称为节点),排列成一个映射(图。6a - c)。SOM的底层拓扑结构显示了跨节点的基因成员的不同积累模式(图2)。6a-c),以及节点内给定水化状态下转录本的显著密度(图。6B-d),在拓扑术语中反映了类似的积累模式。因此,SOM节点6在h . caudiculatum和SOM节点1h . dentatum具有与充分水化状态(FH)相关的显著转录本密度。分别在脱水和再水化条件下,在节点3和节点2观察到转录本的富集h . caudiculatum(无花果。6b),节点2和节点6在h . dentatum(无花果。6d).为了确定基于som的聚类是否产生生物学相关信息,我们确定了这些节点中的氧化石墨烯富集。具体来说,我们发现h . caudiculatum,脱水状态转录本(节点3)在与胁迫信号与响应、光合作用和光系统II的稳定与修复、脂肪酸不饱和、木质素生物合成过程相关的功能类别中富集。接下来,处于复水状态的转录本(节点2)在氧化应激、木质素生物合成过程、光合作用、蛋白质-发色团连接、细胞氧化还原稳态和翻译的响应中富集。另一方面,在h . dentatum,脱水状态(节点2)的功能类别丰富,主要与抗氧化反应相关,如谷胱甘肽代谢过程和ROS解毒系统、干旱响应、转录、翻译调控因子、光系统II稳定、ATP合成和质子转运、光保护和ABA非调控应激反应。在再水化状态下(节点6),转录本富集的功能类别主要与乙烯和脱落酸相关的信号、光合作用、质子转运、胞间连丝介导的细胞间转运、应激反应和有毒物质相关。
自组织图(SOM)的映射质量、聚类结果和转录本的GO富集,这些转录本具有与给定的叶水化状态相关的相似和显著的积累模式h . caudiculatum(得了),h . dentatum(d-f).热图(一个而且d)显示分配给每个SOM节点(编号从1到6)的基因数量(计数)和映射到特定节点的基因的平均欧几里得距离(距离)。所构造的2 × 3六角形拓扑图分布合理,拓扑图间距小,说明了良好的映射过程。具有相似码本向量的节点(即在每个水化状态下相邻的基因模式)彼此更接近。红色表示低计数和距离,而浅黄色表示高计数和距离。从SOM后定义的总共六个节点中,箱线图用于可视化和选择那些描述给定水化状态下差异表达基因最高模式的节点h . caudiculatum(b),h . dentatum(e)(详见“结果”部分)。对于每个箱线图,水平线代表中位数,条形代表缩放基因丰度的最大值和最小值。饼图显示了在各水化状态下具有最高差异表达模式的注释转录本的氧化石墨烯富集项h . caudiculatum(c),h . dentatum(f).箱线图中的X轴标签如下所示。FH =充分水合;DH =脱水;RH =补液
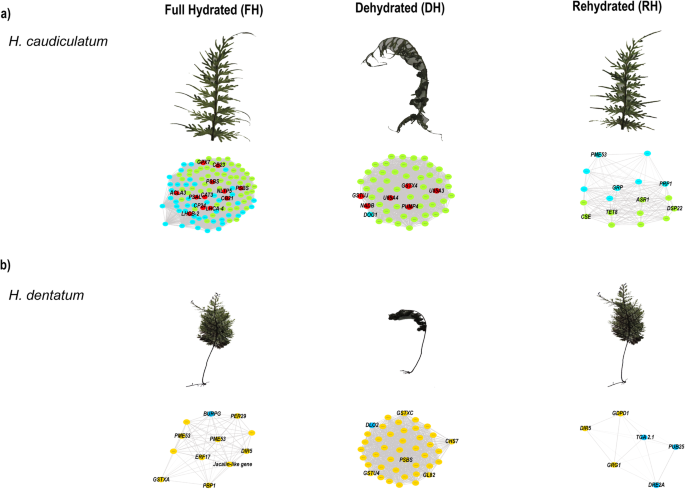
从这些SOM节点(2,3,6英寸H.caudiculatum, 1、2、6英寸h . dentatum),我们仔细回顾了标注的高尺度表达基因,为每个节点构建加权基因共表达网络(图。7;详见材料与方法)。基于快速贪心模块化优化算法寻找群体结构,所有基因共表达网络都有两个模块。从完全水化状态得到的网络h . caudiculatum(节点6,图;7A),并从脱水状态h . dentatum(节点2,图;7B)表现出最高的基因连通性,即基因之间的相互作用(分别为6216和866个连接)。对每种水化状态的合成基因共表达网络的概述h . caudiculatum(无花果。7A)显示,在充分水化时,12个hub基因(> 200个连接)组成了一个连接两个模块的核心网络,参与:抗氧化应激保护系统(GPX7,CAT3);光系统I和II的光收集复合体和反应中心(例如,CB23,CP24,LHCA 4,奇迹2,PSAA,PSBA);脂质代谢及转运(ACLA3,NLTP5).在干燥条件下,形成的网络显示6个枢纽基因(> 100个连接),它们是其中一个模块的一部分。Hub基因参与:细胞壁增强(WUN1);谷胱甘肽代谢(例如,GSTUJ,GSTX4);线粒体解偶联蛋白(PUMP4);糖基化(U85A3);氮气动员(NRTs).在复水状态下,所形成的网络仅包含18个基因,它们之间的连接数相同。这些基因主要代表了两个过程,即细胞壁结构和结构(如:PME53,PRP1,CSE),以及应激反应和信号传导(例如,GRP,ASR1,DSP22,TET8).
(充分水化(FH)、脱水(DH)和再水化(RH)状态的基因共表达网络分析一个)h . caudiculatum和(b)h . dentatum状叶子。用于网络构建的基因分别来自于节点2、3和6h . caudiculatum,节点1、2、6在h . dentatum(见图。6每个网络包括两个模块,用圆圈的颜色表示(绿色和浅蓝色代表h . caudiculatum,黄色和蓝色为h . dentatum).枢纽基因(> 100连接)是红色的。每个模块都包含具有密集连接的转录本,表示预测的相互作用。在给定的水合状态下显示更高连接的那些基因的名称,并在文本上讨论了它们的具体功能
关于h . dentatum,在所有的基因共表达网络中都没有枢纽基因(图2)。7b).在完全水化状态下,该网络包含12个共表达基因,它们之间相等连接。它们被分为不同的功能类别,如植物防御和非生物胁迫抗性(例如,DIR5,ERF17,BURP16)、叶绿体发育(例如:PBP1),以及细胞壁结构和结构(例如,PME53).在干燥条件下,所得到的网络共包含42个共表达基因。其中,我们发现参与类黄酮生物合成的基因(CHSY)、光系统I及II的结构(PSAA,公安局)、压力反应(GL82)、泛素化(UBIQP)、醛酮还原酶(ALKR4)、免疫系统及水杨酸稳态(DLO2)、非共生血红蛋白(子)在多种激素的信号转导通路中起作用,茉莉酸前体(OPR7).最后,在复水状态下,所形成的网络仅包含6个共表达基因。主要参与膜代谢(如:GDPD)、应激反应和信号传导(例如,DIR5,GRG1,DRE2A)和植物免疫(例如,PUB25,TGA2.1),以及糖代谢(GRG1).
讨论
以前的研究表明,从细胞到生态生理的不同尺度上,温带雨林的膜叶科物种如何响应干燥[12,13,15,16,17,23].然而,在膜茶科植物中,干燥反应、生境偏好和基因表达之间的关系在本研究之前从未被研究过。这两个从头组装的转录组(膜茶科的第一个转录组)表现出良好的质量参数,与其他非模式物种转录组相比,可以用相同的Illumina平台测序,并使用相同的标准进行后续的下游组装管道[24,25,26].因此,我们转录组的鲁棒性使我们能够探索差异基因表达,并对比从脱水到复水过渡期间基因高丰度和低丰度的动态模式与构成基因表达,从而有助于全面了解快速脱水-复水过程中涉及的响应机制。在大量基因表达数据集中寻找与生物功能一致的模式一直是一个挑战。尽管探索性统计模型具有不可否认的优势,如层次聚类[27),k -均值聚类[28],由于基于任意统计显著性阈值的人为偏差,这些方法是主观的,并且没有考虑聚类之间的拓扑[29].考虑聚类拓扑的人工神经网络特性19,20.],提供了一个极好的工具来描述跨多个因素的基因表达的聚类模式[19,30.,31].通过基因表达差异分析,我们发现两种蕨类植物在脱水-复水循环过程中的分子响应模式相似。然后,通过将自组织图谱与加权基因共表达网络分析相结合,我们发现了明确的转录物积累模式,并发现了在给定水化状态下共表达的核心基因之间的明确关系。因此,我们能够阐明共享的和物种特有的分子成分,如信号机制和对干燥的反应[6,32],对叶绿体稳态的干扰[33,34],以及光抑制相关应激[35,36,37],与叶片水化状态和微生境谱有关h . caudiculatum而且h . dentatum沿着宿主树的垂直分布占据。
在完全水化状态下,两种物种转录物积累的模式反映了光合作用和呼吸等初级代谢过程的正常功能。脱水后,鉴定的差异表达转录本的聚类模式和丰度,与氧化还原稳态的维持、光合装置的稳定和维持以及叶绿体操作信号的维护相关的共享机制。相反,物种特异性反应与酚类化合物的生物合成途径(如苯丙类代谢)和光抑制相关过程尤其相关。一般的和物种特有的反应都与生理、超微结构和化学变化一致,如这些薄膜蕨类植物的同叶绿素策略[11,13,15,23].
在脱水-再脱水循环过程中转录反应的共享模式
必须指出的是,由于相对较少的转录本表现出差异表达,这两种薄膜蕨类植物的耐干燥反应将主要依赖于构成机制,这已由蛋白质组学分析提出[16].根据我们的研究结果,无论叶片水化状态如何,这两种膜蕨类植物都有大量的转录本参与翻译、光合作用和抗氧化能力。从高度丰富的组成基因的一个有趣的结果是表达胚胎发生后期蛋白质丰富14基因(LEA14),该蛋白被报道为一种不典型的LEA蛋白,定位于细胞质和细胞核,在对抗非生物胁迫,特别是渗透和干旱胁迫中发挥重要作用[38,39].
这两个物种共享的差异基因表达模式(如图2所示)。4)表明在垂直梯度上不考虑生境偏好的响应机制是保守的。因此,在脱水过程中,两个物种都增加了编码基因的丰度Glutathione-S-Transferases(销售税),而销售税补液后的基因。GST酶清除多种有毒化合物(例如,疏水、亲电和细胞毒性底物;参见[40])。当这两种薄膜蕨类植物的叶子变干时,它们必须处理活性氧的细胞毒性作用,这些活性氧与它们所受到的多重同时的胁迫有关,例如水分亏缺和强光胁迫[41].高效的解毒和抗氧化防御系统是抗旱性的关键组成部分[3.,6,36].,Given that GST enzymes inactivates a wide variety of toxic compounds (e.g., hydrophobic, electrophilic and cytotoxic substrates; see [38]),这两种蕨类植物似乎已经进化出一种机制,可以在干燥状态下精细地调整GST反应以抵御氧化损伤。我们在编码铁蛋白的基因中发现了同样的动态,这可能是一种更具体的机制,与上述的GST结合在一起。铁蛋白是一种公认的铁储存蛋白,与植物的ROS代谢有关。具体来说,铁蛋白的合成在转录水平上被细胞铁和H激活2O2以及通过高光强增强ROS解毒酶[42].铁蛋白与ROS代谢相关的证据表明,控制铁蛋白的合成是维持叶片细胞氧化还原状态所必需的。此外,已知铁蛋白结构域是脱水相关蛋白结构的一部分(DRP, [43]),因此除了铁蛋白的抗氧化作用外,这两种膜蕨类植物可能会利用该蛋白来保护膜结构,例如光合作用结构[44].
这两个物种也有共同的基因表达模式,参与控制光系统的结构和功能。在干燥过程中,两种植物都积累了对光系统I和II反应中心组成部分的转录本编码,而对光收集天线和进化氧复合物编码的转录本丰度下降。这种反应与已报道的复活植物模型的反应不同Craterostigma pumilum,在此情况下出现相反的模式[36].一种合理的解释是,由于膜茶科植物的同叶绿素性质,即在干燥时保留叶绿体,这种基因动态将有助于在干燥-再水化的时间推移中对抗严重脱水和太阳斑点间歇出现的高辐照输入的综合影响,以处理活性氧,氧化损伤[45],以及需要尽量减少光捕获和水氧化的可能性,以减少氧化还原反应,但要维持反应中心的库存。
上述复杂机制的协调需要相互交织的信号通路,以对抗与复活策略相关的内部和外部约束的系统反应。转录丰度的增加AAA-ATPase已知参与ROS信号转导的基因,以及信号转导组分的存在,如生长素和钙信号转导、氧脂素代谢、乙烯和ABA响应转录因子,都表明叶绿体是信号的编导者[34].因为这些蕨类植物的叶子从一层到几层不等,而且质体到核的信号传递对于协调和调整细胞对外部和内部线索的反应至关重要[33,46,47],环境扰动对叶绿体内稳态的限制将对整个叶片的形态和功能产生重大影响。叶水状态的波动将启动一个操作信号,改变数千个基因的表达,以调节叶绿体和整个细胞的功能[34].据此,两个物种在干燥过程中都表现出编码AP2/ERF转录因子的转录丰度增加(例如,含有DREB,小块土地,说唱),已知它们参与对环境刺激的反应,特别是氧化还原、渗透和干旱胁迫[33,34].此外,叶绿体和核基因表达的协调可由氧化还原状态介导[48],激活蛋白激酶磷酸化级联和AP2/ERF转录因子。我们的结果与上述机制一致,这是促成两种研究的膜蕨类植物复活策略的关键机制。
在脱水和再水化过程中转录反应的物种特异性模式
本研究最雄心勃勃的目标之一是将这两种薄膜蕨类植物的不同生态位偏好与物种特异性转录反应联系起来,以了解在不同叶片水化状态下可能普遍存在的特定生理条件。总的来说,根据DE分析和水化状态的两两比较(表1)的具体回答h . caudiculatum支持增强的渗透反应和苯丙类相关途径,而在h . dentatum特定的反应表明增强了对氧化损伤和强光应激的保护。另一方面,基因共表达网络分析提供了中心基因的详细相互作用,赋予每个物种特异性反应。调查h . caudiculatum在脱水-再脱水循环过程中,我们观察到的丰度增加DOG1基因在完全水合和再水合时。该基因通过改变赤霉素代谢来控制种子休眠的时间,以响应温度等环境信号[49].考虑到在胚胎发育和成熟过程中,获得耐干燥性是大多数种子存活的关键过程,因此,复活植物使用部分分子成分来控制种子休眠是合乎逻辑的。然而,丰度的变化DOG1基因h . caudiculatum暗示了一种通过诸如DELLAs蛋白等共同中介与ABA和GA平衡相关的诱导机制[50].基于基因共表达网络结果,我们观察到在脱水状态下,核心基因通过NAD代谢和线粒体解耦蛋白减少ROS形成和氧化应激[51,52],而对于复水,所有共表达基因主要涉及细胞壁和蛋白质稳定性[53],膜稳定性和信号通路,以及葡萄糖代谢的重建(图。7一个)。
我们观察到的丰度的增加ELI6编码一种早期光诱导蛋白的基因(表1)h . dentatum当完全水合和再水合时。在脱水反应元件转录因子上观察到相同的模式DRE2A.ELIPs蛋白由光诱导,在强光下作为激发能量的汇。丰富度的增加ELI6而且DRE2A只有在h . dentatum(无花果。7B)是其沿寄主树垂直方向向光照较强、湿度较低的微点分布的响应。其他特异性反应与乙烯和水杨酸驱动的防御反应的激活有关,以及对过氧化氢等特异性ROS的清除。
结论
目前的工作提供了一个更深入的理解的机制,潜在的干旱耐受性反应h . caudiculatum而且h . dentatum.在此,我们破译了这两个物种脱水和再水化过程中的转录动态、基因共表达网络和参与信号和反应机制的关键基因。此外,物种特异性机制的识别有助于解释它们在自然环境中表现出的生态生理特征和微生境偏好。因此,而冠层较低的物种h . caudiculatum似乎增强渗透反应和苯丙类相关途径,上层冠层种h . dentatum增强其防御系统的反应和对强光应力的保护。
最后,需要做更多的工作来了解特定分子(例如rna结合蛋白)的作用和贡献,以及转录后调控,这些分子可能在这些物种在自然环境中遭受水的快速损失和获得时的耐干燥策略中起核心作用。此外,在进化发育生物学方法下的研究将有助于破译和理解与这些复活膜蕨类植物进化的小气候条件相关的生理、发育和形态变异的遗传基础。
方法
植物材料和生长条件
个人的Hymenophyllum caudiculatum(市场)变种产品(K.Presl)和Hymenophyllum dentatum(Cav)(图1)采自智利Los Lagos地区Katalapi Park(″S 41°31′07.5,72°45′2.2″W) Cordillera de Quillaipe。采集地点对应于沿海常绿温带雨林。有关该地点的微气候情况的详情,已于先前发表[11].在春末(南半球11月至12月中旬)收集了覆盖着附生蕨类薄膜的小块树皮或倒下的树木,并将其运送到La Frontera大学带有自动灌溉的荫凉实验苗圃。有关苗圃条件及植物设置的详细说明,可参阅[17].简单地说,在实验开始前,植物在遮荫(25 - 30 μmol光子m - 2 s - 1)下适应苗圃条件,由自动灌溉系统雾化(每天浇水6次,每次2分钟)25天。
值得注意的是,没有必要将标本存放在植物标本室,因为这些标本已经存放在Concepción大学的植物标本室(http://www2.udec.cl/~herbconc/index.htm, Herbario CONC, Departamento de Botánica, Universidad de Concepción, Barrio Universitaro s/n, Casilla 160-C, Concepción,智利。)
实验设计和样品采集
试验设计为南半球晚春(11月- 12月中旬)苗圃条件下的干燥-复水试验h . dentatum而且h . caudiculatum在三种不同的水化状态下进行了研究;完全水合(FH)、脱水(DH)和再水合(RH)(详细见图。2a).在每个水化状态下,我们分别使用附着叶和两组分离叶监测最大量子效率(Fv/Fm)的变化;一个用来测定它们的相对含水量(RWC),另一个用来分离RNA。为了达到完全水化的状态,研究人员在四个小时内对蕨类植物进行了3分钟的灌溉脉冲,每次间隔20分钟;在该水化状态(FH)下,取每株植物的单叶(每种3株,共6株),获得其相对含水量(RWC)。然后,在接下来的7天里,通过调整灌溉设置和监测叶片的RWC和Fv/Fm的变化,蕨类植物进行了脱水-复水过程。在不灌溉的第一天,当叶片达到RWC的60%左右时,进行第一次DH采样(每个物种来自三个不同个体的叶片)。当植物达到等于或低于这些物种报告的临界相对含水量时,就会获得第二个DH样本[11],在第7天达到(图;2a).将两个DH样本合并,以覆盖早期和晚期的干燥调控转录本。最后,在恢复灌溉的情况下进行复水,直到RWC的回收率至少达到90%。在复水(RH)期间,采集了两个样本,一个是在植物恢复RWC的60-70%时采集的,另一个是在RWC的90%左右采集的。为了覆盖早期和晚期的复水化调控转录本,这两个样本都被合并为RH。样品存储在−80°C,直到处理RNA分离,以比较与每种水化状态相关的转录反应,无论是在种内还是种间。
荧光测量
最大量子效率(Fv/Fm)由叶绿素计算一个使用调制荧光计(FMS2, Hansatech, UK)从附着的叶片获得的荧光信号,如先前在[17].简单地说,使用FMS2叶夹小心地覆盖附着的叶片并深色驯化30分钟。在暗驯化后,打开调制光获得F0,然后在~ 3000 μmol m下产生800 mS的饱和脉冲−2年代−1),以获得最大荧光(Fm)。可变荧光(Fv)和Fv/Fm比值根据[54]在环境温度下(约17℃)。数据分析后,检查正态性假设下的方差分析检验P值≤0.05。当数据不满足正态性假设时,我们使用Kruskal-Wallis非参数检验。此外,使用max - imaging PAM (Walz, Effeltrich, Germany)在FH, DH和RH水化条件下,使用分离叶片获得Fv/Fm的荧光图像,以观察两种植物整个叶片水平荧光量子产量(YII)的恢复速率(图2)。2b)。
RNA-seq和新创转录组分析
总RNA使用ulclean™植物RNA分离试剂盒(Mo Bio,卡尔斯巴德,CA,美国),并使用Total RNA I试剂盒(Omega Bio-Tek, Norcross, GA, USA)根据制造商说明进行纯化。RNA分离样品的产量和质量由安捷伦2100生物分析仪确定。RNA用两体积的醋酸酯:乙醇溶液(1:10 v/v)沉淀,并送到韩国Macrogen Inc.进行测序。共有6个样品在Illumina HiSeq 2000平台的单通道中测序。San Diego, CA, USA)获得100 bp成对末端读数。使用NGSQC Toolkit v2.3进行质量筛选后([55),http://www.nipgr.res.in/ngsqctoolkit.html)和Q-score作文(附加文件3.:图S1),我们进行了新创Trinity软件包v2.1.1 [56,57].转录组组装在Centro de Modelación y Computación Científica (CMCC, universversidad de La Frontera)的Troquil Linux集群中进行,使用12个处理器Intel Xeon E5-4640和192 GB共享内存。
使用align_and_estimate_abundance.pl脚本中写入的默认RSEM参数(RSEM = RNA-Seq by Expectation Maximization)将每个样本的Reads映射到相应的最终转录组。所得到的每种蕨类的rsem估计基因丰度被合并到一个矩阵中,并使用Trinity的run_DE_analysis.pl脚本进行分析,该脚本涉及R统计环境中的Bioconductor包edgeR [58,59].具有极低估计计数的转录本(联合组为2),不考虑用于水化状态的edgeR成对比较。为了判断基因表达的显著性,我们使用低于0.05的假发现率值(FDR)和2的最小折叠变化(FC)作为阈值(附加文件)2:数据集S1和S2)。为了量化转录丰度,标准化rsem估计计数用于基于表达模式的聚类组装contigs [29].最后,每个转录组的结果转录本使用BLAST+和1-e的e值过滤器对齐到SwissProt数据库中−10作为阈值[60].使用PANTHER进行功能注释、分类和表达过多或不足的基因组([61),www.pantherdb.org).
自组织地图(SOM)分析
两者的标准化rem估计计数h . caudiculatum而且H dentatum满足上述模型确定的表达式值,用于SOM聚类方法[29].具体来说,只分析了两种膜蕨植物叶片水化状态下表达差异显著的基因。为了只关注基因表达谱,同时避免基因表达量差异带来的偏差,表达值以均值为中心,从变异系数的上50%四分位数中选取,方差用标度函数(R基包[58];)单独用于h . caudiculatum而且h . dentatum.利用R[上的Kohonen包]将两种植物叶片水化状态下的基因聚类为多维的2 × 3六角形SOM。19].在聚类过程中使用了100次训练迭代,alpha学习率从约0.0018下降到0.0010(附加文件)3.:图S2)。在迭代过程之后,最终将基因分配给获胜单元,形成与水化状态相关的基因集群(称为节点)。SOM结果可视化为码本向量饼图,得到每个节点上基因的计数数和平均距离([19],附加文件3.:图S3)。使用R上ggplot2包中的箱形图选项来可视化每个节点中与叶片水化状态相关的基因积累模式。最后,以0.05的错误发现率截断值对每个Node的GO富集项进行分析(附加文件4:数据集S6和S7)。
基因共表达网络分析
为了进一步分析SOM分析得到的基因共表达模式,进一步采用基于基因调控网络(GRN)的方法研究了各蕨类物种的基因表达与叶片水化状态的相互作用。从SOM聚类方法,67和183个注释基因的子集h . dentatum而且h . caudiculatum分别被选中。对于基因的选择,选择了在给定水化状态下具有最高规模积累模式的SOM节点转录本。然后,只选择有GO注释的基因。(附加文件2:数据集S4和S5)。利用这些基因构建加权基因共表达网络,根据[31].简而言之,两个R包的特征,即加权基因共表达分析(WGCNA [18];)及铭文[21],结合起来以可视化基因相互作用。为了利用WGCNA包计算邻接矩阵,使用软性阈值(β)值9来实现无标度拓扑准则。然后,使用图生成器的算法和图包的社区结构函数对网络连通性和模块化进行可视化,同时使用自定义图函数进行网络可视化(可在https://github.com/eostria/Gavel).
序列提交
用于转录组组装和基因表达分析的高质量筛选、条形码排序和修整的短读数据集保存在NCBI序列读取档案(SRA)中,编号为SRR5195043、SRR5272488、SRR5272490、SRR6452149、SRR6452987和SRR6453153。此外,组装的转录组的基因表达谱被存入NCBI基因表达综合数据库(GEO)。如欲保密查阅公共GEO记录,请使用以下连结:https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE140234而且https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE140238.
数据和材料的可用性
本研究中使用的蕨类植物的转录组可在NCBI序列阅读档案(SRA)中获得,编号为SRR5195043、SRR5272488、SRR5272490、SRR6452149、SRR6452987和SRR6453153。基因表达数据集可在https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE140234而且https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE140238.
用于分析和构建基因共表达网络的自定义脚本可在https://github.com/eostria/Gavel.
本研究中产生和分析的所有数据均可在本手稿及其补充信息文件中获得。
缩写
- 英国石油公司:
-
生物过程
- 答:
-
蜂窝组件
- 德:
-
微分表达式
- DH:
-
脱水
- 罗斯福:
-
错误发现率
- FH:
-
完整的水化
- FPKM:
-
每百万读取的外显子模型每千碱基片段数
- 阵线/ Fm:
-
最大量子效率
- 走:
-
基因本体论
- MF:
-
分子功能
- PFD:
-
光子通量密度
- RH:
-
冻干
- ROS:
-
活性氧
- RSEM:
-
RNA-Seq期望最大化
- RWC:
-
相对含水量
- 耶鲁大学管理学院:
-
自组织映射
- WGCNA:
-
加权基因共表达网络分析
参考文献
李志强,李志强。植物耐脱水性的分子生物学基础。植物物理学报。1996;47:377-403。
植物耐干燥性的发现、范围和困惑。植物生态学报2000;151:5-17。
杨晓明,张晓明,张晓明,等。干旱胁迫对植物基因表达的影响。植物细胞环境。2002;25:41 - 51。
Farrant JM, Moore JP。编程耐旱:从植物到种子再到复活植物。中国植物学报,2011;14(4):344 - 344。
王晓明,王晓明,王晓明,王晓明,等。复活植物抗旱性的分子机制研究。中国生物医学工程学报(自然科学版)2012;
来自转录组、蛋白质组和代谢组分析的新见解。前沿植物学报2013;4:1-14。
李志强,李志强,李志强,等。植物干旱性的研究进展。植物生态学报,2000;
天天p MCF。薄膜蕨类植物膜叶对光响应、水分关系和耐干燥性的比较生态生理测定。以及H. tumbrigense (L.) smith。安Bot-London。2003; 91:717-27。
Phillips JR, Fischer E, Baron M, van den Dries N, Facchinelli F, Kutzer M,等。林丹:一种新型耐干燥维管植物,古热带雨林特有。植物J. 2008; 54:938-48。
天天p MCF。来自特立尼达、委内瑞拉和新西兰的一些膜叶蕨科植物的光和干燥反应:在光限制但低蒸发生态位中的水分。安Bot-London。2012; 109:1019-26。
Saldaña AO, Parra MJ, Flores-Bavestrello A, Corcuera LJ, Bravo LA。森林演替状态对温带雨林薄膜蕨类物种微环境条件、多样性和分布的影响植物科学进展。2014;29:253-62。
Flores-Bavestrello A, Król M, Ivanov AG, Hüner NPA, García-Plazaola JI, Corcuera LJ, Bravo LA。来自不同自然环境的两个膜叶科物种在干旱胁迫下表现出同源叶绿素策略。中国生物医学工程学报,2016;
刘志刚,张志刚,张志刚。耐干燥附生蕨类植物光合速率和胁迫挥发性物质排放的变化。植物细胞环境学报,2018;41:1605-17。
Parra MJ, Acuña K, Corcuera LJ, Rodríguez R. Presencia de la familia膜ophyllaceae(蕨类植物)en el Parque Katalapi, Cordillera de Quillaipe, province de Llanquihue。智利Gayana, 2012; 69:384-7。
Parra MJ, Acuña K, Sierra-Almeida A, Sanfuentes C, Saldaña A, Corcuera LJ, Bravo LA。光合光响应可以解释智利南部温带雨林膜茶科物种的垂直分布。科学通报。2015;10:e0145475。
Garcés M, Claverol S, Alvear C, Rabert C, Bravo LA。膜茶科蕨类植物的耐干燥性是由构成性和非诱导性细胞机制介导的。中国生物医学工程学报。2014;337:235-43。
Fallard A, Rabert C, Reyes-Diaz M, Alberdi M, Bravo LA。相容的溶质和代谢物积累并不能解释两种垂直分布差异较大的膜类蕨类植物的部分耐干性。环境实验机器人。2018;150:272-9。
朗菲尔德P,霍瓦特S. WGCNA:加权相关网络分析的R包。生物信息学,2008;9:559-71。
Wehrens R, Buydens LM。R中的自组织和超组织映射:Kohonen包。中国统计杂志。2007;5:1-19。
Kohonen T, Kaski S, Lappalainen H.自适应子空间SOM中各种不变特征滤波器的自组织形成。神经计算。1997;9:1321-44。
复杂网络研究的igraph软件包。电子工程学报,2003,26(1):1 - 9。
Dubuisson JY, Bary S, Ebihara A, Carnero-Diaz E, Boucheron-Dubuisson E, Hennequin S.膜藻科毛虫膜蕨类植物的附生,解剖和退化进化。机械工程学报,2013;
Bravo S, Parra MJ, Castillo R, Sepúlveda F, Turner A, Bertín A,等。在干燥和恢复过程中发生可逆的体内细胞变化:复活膜蕨膜瓣齿状膜瓣的耐干燥性。Gayana Bot. 2016; 73:402-13。
肖敏,张勇,陈霞,李爱杰,巴伯,等。转录组分析基于下一代测序的非模式植物产生特殊的生物技术代谢产物。中国生物工程学报,2013;3(2):332 - 332。
Ranjan A, Townsley BT,一桥Y, Sinha NR, Chitwood DH。杉叶蕨巨细胞的细胞内转录组图谱。PLoS Genet, 2015;11:e1004900。
Ostria-Gallardo E, Ranjan A, Zumstein K, Chitwood DH, Kumar R, Townsley BT,等。转录组分析表明,SQUAMOSA启动子结合蛋白LIKE、NAC和YUCCA基因在温带雨林树的异母细胞发育中起着关键作用Gevuina avellana(Proteaceae)。新植物,2016;210:694-708。
艾森MB,斯佩曼PT,布朗PO, Botstein D.全基因组表达模式的聚类分析和显示。美国国家科学院。1998; 95:14863-8。
张志刚,张志刚,张志刚。基于遗传网络结构的研究进展。纳特·热内,1999;22:281-5。
Chitwood DH, Ranjan A, Martinez CC, Headland LR, Thiem T, Kumar R,等。葡萄叶形和脉型的遗传基础。植物科学学报,2013;
Clark NR, Ma 'ayan A.大型数据集分析的统计方法介绍:主成分分析。科学通报。2011;4:tr3。
Ostria-Gallardo E, Ranjan A, Ichihashi Y, Corcuera LJ, Sinha NR. Gevuina avellana Mol.在不同光照条件下生长能力的基因共表达网络解码。新植物,2018;220:278-87。
他们JM。三种被子植物复活植物抗旱机制的比较。植物生态学报2000;151:29-39。
Gläber C, Haberer G, Finkemeier I, Pfannschmidt T, Kleine T, Leister D,等。拟南芥逆行信号的元分析揭示了复杂细胞信号网络中嵌入的核心基因模块。植物学报。2014;7:1167-90。
陈佳霞,潘淑珊,李立平,麦坤R,柏森BJ。学习叶绿体的语言:逆行信号及其后。植物生物学,2016;67:25-53。
罗德里格斯MA,毛雷尔A,罗德里格斯A,古斯塔夫森JP。拟南芥中谷胱甘肽过氧化物酶基因普遍存在,并通过不同的信号通路受到非生物胁迫的调控。植物J. 2003; 36:602-15。
张志强,张志强,张志强,等。同源叶绿素复活植物脱水过程中光合蛋白水平和组织变化所带来的光保护作用。中国生物医学工程学报,2015;
早见N,酒井Y,木村M,斋藤T,德泽M,内内S,等。拟南芥早期光诱导蛋白2对紫外光B、强光和冷胁迫的响应是由两个元件组成的转录调节单元调控的。植物科学进展。2015;
王敏,李鹏,李超,潘勇,姜霞,朱东,等。SiLEA 14是谷子中一种新型非典型LEA蛋白,具有非生物抗逆性。BMC植物生物学2014;14:290。
马旺加·罗,卢鹏,金基伦古,卢华,王旭,蔡旭,等。陆地棉胚胎发生晚期丰富蛋白家族及其在抗旱性中的作用。BMC Genet 2018;15:6。
马斯卡。谷胱甘肽s -转移酶在植物中的功能与调控。植物物理学报1996;47:127-58。
杨晓明,杨晓明,杨晓明,等。干旱和盐度对活性氧动态平衡的影响。植物细胞环境,2010;33:453-67。
布里亚特JF, Ravet K, Arnaud N, Duc C, Boucherez J, Touraine B,等。对铁蛋白合成和功能的新见解突出了铁稳态和植物氧化应激之间的联系。安Bot-London。2010; 105:811-22。
carenel FC, Gerdol M, Montagner A, Banchi E, De Moro G, Manfrin C,等。通过转录组学方法揭示了胶质Trebouxi gelatinosa光合苔藓耐干燥的新特征。植物分子生物学,2016;91:319-39。
巴特尔斯D,汉克C,施耐德K,米歇尔D, Salamini F.复活植物Craterostigma plantagineum干燥相关elp样基因受光和ABA调控。Embo j . 1992; 11:2771-8。
Müller P,李XP, Niyogi KK。Non-photochemical淬火。这是对多余光能的反应。植物物理学报2001;125:1558-66。
Yamaguchi-Shinozaki K, Shinozaki K.细胞对脱水和冷胁迫的应答和耐受性的转录调节网络。植物学报。2006;57:781-803。
Lepetit B, Dietzel L.在具有“绿色”和“红色”叶绿体的光合真核生物中的光信号。环境科学学报,2015;
Vogel MO, Moore M, König K, Pecher P, Alsharafa K, Lee J, Dietz KJ。在拟南芥中,响应强光的快速逆行信号通路涉及代谢物输出、丝分裂原激活蛋白KINASE6和AP2/ERF转录因子。《植物科学》2014;26:1151-65。
Graeber K, Linkies A, Steinbrechr T, Mummenhoff K, Tarkowská D, tureukova V,等。萌发延迟1介导了一种保守的外衣休眠机制,用于温度和赤霉素依赖的种子萌发控制。中国科学院学报(自然科学版),2014;
Kendall SL, Hellwege A, Marriot P, Whalley C, Graham IA, Penfield S.拟南芥夏季一年生植物诱导休眠需要通过低温和CBF转录因子并行调控DOG1和激素代谢。植物学报。2011;23:2568-80。
李志强,李志强,李志强,等。植物生长发育过程中吡啶核苷酸稳态的研究进展。植物学报。2007;1:194-201。
Vercesi AE, Borecký J, de Godoy MI, Arruda P, Midea-Cuccovia M, Chaimovich H.植物线粒体解偶联蛋白。植物学报。2006;57:383-404。
Giarola V, Krey S, von den Driesch B, Bartels D. plantagineum富含甘氨酸的蛋白CpGRP1与细胞壁相关蛋白激酶1 (CpWAK1)相互作用,并在脱水过程中积累在叶片细胞壁中。新植物,2016;210:535-50。
Van Kooten OV, Snel JFH。叶绿素荧光命名法在植物胁迫生理中的应用。Photosynth res 1990; 25:147-50。
Patel RK, Jain M. NGS QC工具包:用于下一代测序数据质量控制的工具包。科学通报。2012;7:e30619。
葛瑞哲,哈斯,李志刚,李志刚,李志刚,李志刚。来自RNA-Seq数据的全长转录组组装,没有参考基因组。中国生物工程学报,2011;29(4):644 - 52。
李志强,李志强,李志强,等。利用Trinity平台从RNA-seq中重建转录本序列,用于参考生成和分析。Nat协议。2013;8: 1494 - 512。
Robinson MD, Oshlack A. RNA-seq数据差异表达分析的标度归一化方法。中国生物工程学报。2010;11:R25。
R核心团队。(2013)。R:一种用于统计计算的语言和环境,奥地利维也纳。http://www.R-project.org/.
彭塔M, Coggil PC, Eberhardt RY, Mistry J, Tate J, Boursnell C,等。Pfam蛋白家族数据库。核酸测序数据库,2012;40:D290-301。
Mi H, Muruganujan A, Casagrande JT, Thomas PD。利用PANTHER分类系统进行大规模基因功能分析。Nat协议。2013;8:1551 - 66。
Rodríguez R, Alarcón D,埃斯佩霍J. Helechos Nativos del Centro y Sur de Chile。Guía de Campo.第1版。智利:Corporación Chilena de la Madera, Concepción;2009.
致谢
作者感谢卡塔拉皮公园的热情好客和优秀的植物收集研究设施。同时,感谢Charles L. Guy博士的重要修订和英文编辑。
资金
本工作得到FONDECYT 1120964项目、FONDECYT- conicyt博士后项目No 3160446和NEXER项目(NXR17-0002)的支持。资助机构不参与数据的设计、收集、分析和解释,也不参与手稿的撰写。
作者信息
从属关系
贡献
GL, GB, AG和LB构思了这项研究。AG和LB提供了材料。GB。AF和LB协同采样和脱水-复水实验。GB和AF分离出RNA。GL从头组装转录组。GL和EO-G分析转录组数据集。EO-G和IE致力于转录组数据的解释。EO-G生成并分析了聚类和人工网络。EO-G, LB和G.L.撰写了本文,其他作者均有贡献; all authors read, edited, and approved the article.
相应的作者
道德声明
伦理批准并同意参与
植物收集工作由Katalapi公园基金会完成,这是一个非营利性的研究和环境教育机构。基金会主席Luis J. Corcuera博士提供了访问和收集公园植物材料的许可。在收集我们研究中使用的植物材料时,不需要任何其他政府或私人机构的特别许可。根据载于[62].实验设计遵循拉弗朗特拉大学伦理委员会的制度规范。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
表S1。RNA-seq文库测序的统计h . caudiculatum(Hca)和h . dentatum(Hdent)表示它们的每个水合态。统计数字显示总读取次数(不。读取),通过质量控制的高质量阅读(不。总部的命令如下),这些reads被映射到转录组(不。映射的读取)以及它们的映射百分比(映射速度)表S2。的组装统计信息h . caudiculatum而且h . dentatum之前的转录组(生)及经改良后(过滤后的).成绩单总数(不。成绩单)、三位一体组件数目(三一组件),假设的转录组为百万碱基对(转录组的大小)、转录本长度的基本统计数字(平均值,中值,最小值和最大值)和装配质量为N50 (将军)表S3。爆炸结果h . caudiculatum而且h . dentatum针对SwissProt数据库。表中显示了每个序列大小的计数分布(尺寸范围)的爆炸(爆炸袭击)和未命中(不知何时)及累积百分比(暨%)
附加文件2:数据集S1。
叶片水化状态两两比较中DE基因的矩阵h . caudiculatum.列表示序列ID (ID)、折叠变化(log FC)、每百万次计数(log CPM)、显著性(PValue)、错误发现率值(FDR)和每种水化状态的归一化计数(HcaFH)。矩阵,HcaD。矩阵和HcaRH.matrix),数据集S2。叶片水化状态两两比较中DE基因的矩阵h . dentatum.列表示序列ID (ID),折叠变化(log FC),百万次计数(log CPM),显著性(PValue),错误发现率值(FDR),以及每种水化状态(HdFH, HdD和HdRH)的归一化计数,S3数据集。基质显示了叶片水化状态之间无明显变化的高丰度基因h . caudiculatum而且h . dentatum.列显示基因id,转录本id,每个水化状态的计数丰度,UniProt id, Blast查询的相似度百分比,以及蛋白质名称,数据集S4。的节点2、3和6的自组织映射输出矩阵h . caudiculatum,数据集S5。节点1、2和4到6的自组织映射输出矩阵h . dentatum.
附加文件3
:图S1。Illumina Hiseq 100 bp配对端读的质量评分和准确性h . caudiculatum而且h . dentatum经过质量筛选。在直方图上显示值20的质量差的读取被丢弃。所有超过30的读数都表示准确率为99.9%,关于测序仪正确读取的碱基,图S2。的基因平均距离的训练进度h . caudiculatum而且h . dentatum使用自组织地图显示邻域缩小的效果以包括获胜单位,即当数据集中的向量达到最接近的相似性时。图S3。梗茎的编码本向量和h . dentatum显示训练后邻近最大的差异表达基因簇。码本向量表示在图谱构建后与给定状态相关的基因的表达谱
附加文件4:数据集S6。
编译GO富集数据h . caudiculatum,数据集S7。编制了齿状海鳗的氧化石墨烯富集数据。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Ostria-Gallardo, E., Larama, G., Berríos, G。et al。利用两种同源薄膜蕨类植物的自组织图谱进行基因共表达分析,确定了与它们的微生境偏好相关的特定耐干燥机制。BMC植物生物学20.56(2020)。https://doi.org/10.1186/s12870-019-2182-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2182-3
关键字
- 膜蕨科
- Poikilohydric
- Homoiochlorophyllous
- 温带雨林
- RNA-seq转录组
- 神经网络
- 基因co-expression