- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
比较转录组分析表明,一个核心转录网络介导小麦的同核异质雄性不育(gydF4y2Ba小麦gydF4y2Bal .)gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba10gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
细胞质雄性不育在杂种优势利用中起着至关重要的作用,不同类型的细胞质雄性不育往往具有不同的流产机制。因此,了解小麦花药败育的分子机制具有重要意义,但目前尚不清楚。gydF4y2Ba
结果gydF4y2Ba
本研究对5个异核异质雄性不育系及其保持系进行了研究。细胞学分析表明,IAMSLs的流产类型相同,均为典型和持续性流产,关键流产期为双核期。通过转录组测序鉴定出的1281个核心共有差异表达基因与重要流产阶段的维持基因相比,大多数基因参与糖代谢、氧化磷酸化、苯丙烷生物合成和磷脂酰肌醇信号传导,并且在IAMSLs中下调。筛选并鉴定了编码查尔酮-黄酮异构酶、果胶酯酶和葡萄糖焦磷酸化酶的关键候选基因。进一步验证表明,由于这些通路中下调基因的影响,雄性不育花药缺乏糖和能量,ROS积累过多,孢粉素合成受阻,绒毡层降解异常。gydF4y2Ba
结论gydF4y2Ba
通过比较转录组分析,提出并构建了一个有趣的核心转录组介导的小麦雄性不育网络,并推断在重要途径中基因的下调可能最终阻碍IAMSLs花粉外壁的形成。这些研究结果为预测候选基因的功能提供了新的思路,同时对研究结果的综合分析也有助于研究不育小麦的失活互作机制。gydF4y2Ba
背景gydF4y2Ba
以可持续和有效的方式提高作物产量对于满足全球日益增长的粮食需求至关重要。[gydF4y2Ba1gydF4y2Ba].小麦(gydF4y2Ba小麦gydF4y2BalgydF4y2Ba。gydF4y2Ba)是世界上最重要的谷物和饲料作物之一,占人类消耗总能量的20%。然而,小麦育种仍然不发达,目前可利用的多样性只得到了很少的利用[gydF4y2Ba2gydF4y2Ba].杂交小麦育种是一种很有前途的策略,可以最大限度地利用杂种优势提高小麦产量[gydF4y2Ba3.gydF4y2Ba].特别是细胞质雄性不育(CMS)系统是建立在核与细胞质不相容相互作用的基础上的,在许多物种中被广泛用于杂交种子生产。此外,CMS还包括一些作物植物母系遗传不能产生功能性花粉,从而为研究细胞质遗传、生殖生长和花粉发育提供了理想的材料[gydF4y2Ba4gydF4y2Ba].CMS是杂交小麦育种的有力工具,但其导致花粉败育的机制目前尚不清楚。此外,不同种质类型的CMS系往往具有不同的流产机制,因此确定其核心和共同的流产机制尤为重要。在前人的研究中,我们发现了一组理想的同核异质雄性不育系,即K706AgydF4y2Ba山羊草属kotschyigydF4y2Ba细胞质,Va706A与gydF4y2BaAe。vaviloviigydF4y2Ba细胞质,Ju706A与gydF4y2BaAe。juvenalisgydF4y2Ba细胞质,C706A与gydF4y2BaAe。菌gydF4y2BaU706A与gydF4y2BaAe。uniaristatagydF4y2Ba细胞质具有许多优势,可用于杂交小麦生产,可改善小麦品质,易于恢复,增强抗白粉病能力,提高生长潜力[j]。gydF4y2Ba5gydF4y2Ba].因此,对这些IAMSLs花粉败育的细胞学和生理机制进行了研究[gydF4y2Ba6gydF4y2Ba].然而,这5种IAMSLs中与CMS相关的分子机制,特别是其核心分子机制尚不清楚。因此,阐明这些IAMSLs花粉败育的共同分子机制将为杂交小麦育种提供理论依据。gydF4y2Ba
近年来,转录组测序作为研究全球转录网络提供高分辨率数据的有力工具,已被广泛应用于许多作物,如大豆[gydF4y2Ba7gydF4y2Ba],棉花[gydF4y2Ba8gydF4y2Ba]和大米[gydF4y2Ba9gydF4y2Ba].此外,它还被用于研究叶片衰老[gydF4y2Ba10gydF4y2Ba],叶色[gydF4y2Ba11gydF4y2Ba]、生物应激反应[gydF4y2Ba12gydF4y2Ba]和非生物应激反应[gydF4y2Ba13gydF4y2Ba小麦。然而,很少有转录组分析考虑小麦的花粉败育和雄性不育。一般来说,由于线粒体和核基因之间的相互作用,CMS植物可以产生无功能的花药和花粉[gydF4y2Ba14gydF4y2Ba].更具体地说,在植物中,花药和花粉的发育过程非常复杂,涉及许多基因的表达、调节、代谢和活性。如果这些过程紊乱,那么花粉发育受阻,从而导致花粉败育和CMS。在茄子中,1716个与花粉发育相关的基因主要参与雄性不育,包括与氧化还原、碳水化合物和氨基酸代谢以及转录调控相关的基因[gydF4y2Ba15gydF4y2Ba].在卷心菜(gydF4y2Ba芸苔属植物定gydF4y2BalgydF4y2Ba。gydF4y2Ba),许多关键基因也参与花粉和花药的发育,如gydF4y2BaMYB39gydF4y2Ba,gydF4y2BaA6gydF4y2Ba,gydF4y2Ba自动对盘及成交系统gydF4y2Ba,gydF4y2BaMS1gydF4y2Ba,gydF4y2BaTSM1gydF4y2Ba,与绒毡层发育和花粉壁形成有关,这些基因的改变可能是花粉败育和雄性不育的重要原因[gydF4y2Ba16gydF4y2Ba].在植物中,花粉和花粉壁的发育需要淀粉的积累,淀粉在萌发后期作为能量储备。然而,糖代谢和合成的不平衡会严重损害花粉的发育,从而导致雄性不育[gydF4y2Ba17gydF4y2Ba].在大米和gydF4y2Ba拟南芥gydF4y2Ba,参与糖代谢途径的udp -葡萄糖焦磷酸酶1 (UGP1)和udp -葡萄糖焦磷酸酶2 (UGP2)是花粉淀粉积累和胼胝质沉积的必需物质,其抑制导致花粉败育和雄性不育[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].线粒体是呼吸电子传递、活性氧(ROS)生成和ATP合成的重要位点[gydF4y2Ba20.gydF4y2Ba].在真核细胞中,氧化磷酸化被认为是呼吸链电子传递中ATP产生的主要途径。此外,线粒体基因组的重排和重组往往会导致ROS的过量积累和ATP合成的抑制,从而导致CMS [gydF4y2Ba21gydF4y2Ba].在胡椒,开放阅读框架(gydF4y2Ba羊痘疮gydF4y2Ba)线粒体F0 ATP合成酶复合物基因,如gydF4y2Baatp6gydF4y2Ba,通过RNA编辑和northern blot分析,已确定为CMS辣椒的候选品种之一,进一步表明CMS性状与线粒体功能障碍有关[gydF4y2Ba22gydF4y2Ba].既往研究也表明,ROS过多会导致细胞脂质过氧化和氧化损伤、蛋白质和DNA损伤,甚至导致绒毡层程序性细胞死亡(PCD)异常[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].在花粉发育过程中,苯丙氨酸生物合成途径起着至关重要的作用,苯丙氨酸解氨酶和肉桂醇脱氢酶等关键苯丙氨酸酶参与孢子花粉形成,并分泌到花药室中。适当的毡层PCD可以提供足够的孢粉,维持正常的花粉壁发育[gydF4y2Ba25gydF4y2Ba].因此,含有糖代谢途径、氧化磷酸化途径和苯丙素生物合成的基因的正常表达和调控是花粉形成和发育的基础。相反,一旦这些通路受到干扰,CMS就可能被触发。值得注意的是,已经发现了几个在CMS中起重要作用的基因,但这些基因如何介导代谢诱导的雄性不育仍有待阐明,与CMS相关的调控网络在很大程度上是未知的,特别是在小麦中。gydF4y2Ba
本研究以5种IAMSLs及其保持系为研究材料,全面综述了花粉败育的细胞和代谢变化,并通过生物信息学分析和各种实验验证,进一步构建了小麦雄性不育的核心转录调控网络。同时,这些发现也为小麦CMS的核心机制和花粉发育过程提供了新的认识。gydF4y2Ba
结果gydF4y2Ba
IAMSLs形态缺陷及流产期的鉴定gydF4y2Ba
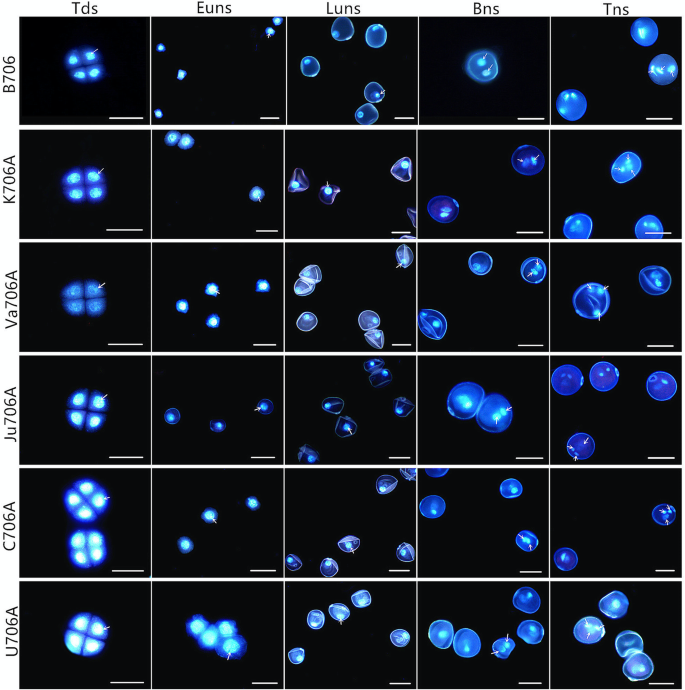
采用体视显微镜和扫描电镜观察了iamsla (K706A、Va706A、Ju706A、C706A和U706A)和B706花药在不同发育阶段的表型特征。与IAMSLs相比,B706的花药在三核期正常开裂,成熟花粉粒脱落,而IAMSLs的花药不开裂。与成熟可育植株不同,IAMSLs的表皮细胞和内表皮乌氏体形状不规则,排列无序(图2)。gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。乌氏小体是由含有孢粉素的前囊泡与绒毡层细胞的质膜融合形成,然后分泌到绒毡层细胞外部。育碧体的主要功能是在绒毡层和花粉之间运输与花粉壁形成有关的物质,因此异常的育碧体可能会影响花粉的发育。此外,我们使用IgydF4y2Ba2gydF4y2Ba- KI染色观察三核期花粉粒,与B706相比,所有IAMSLs的花粉100%不育,花粉败育类型典型,可染色败育(另附文件)gydF4y2Ba1gydF4y2Ba:图S1)。此外,通过4′,6-二氨基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)染色,观察了小孢子和细胞核的生长情况,进一步明确了不育植株的败育关键期。四分体期和早期单核期在各材料间无明显差异。然而,IAMSLs的小孢子呈高度波纹状,在无核期后期开始表现出不育的特征。随后,与B706相比,在双核阶段,IAMSLs的营养核不清晰,小孢子表现出明显的败育特征。到三核期,纺锤形精子核被异常圆形核所取代(图2)。gydF4y2Ba2gydF4y2Ba).因此,我们发现雄性流产的关键时期在IAMSLs中是相同的,根据花粉形态和细胞核特征的明显异常,它似乎发生在双核阶段。结果还表明,5种IAMSLs在三核期之前都是完全不育的。gydF4y2Ba
转录组测序gydF4y2Ba
利用5种IAMSLs和B706的双核期花药的3个生物重复进行深度RNA-seq分析。经过严格的质量过滤,得到122.59 Gb的高质量洁净数据。每个样本中平均质量评分> 30的reads百分比≥78.46%,干净数据的GC%范围为55.12 ~ 59.82%。平均而言,77.68%的clean reads被定位到小麦参考基因组,通过组装这些clean reads,生成了已知基因(占模型基因总数的83.98-86.09%)(附加文件gydF4y2Ba3.gydF4y2Ba表2)。通过对各样品的基因表达分布进行统计分析,结果表明,单个样品中不同表达水平的基因百分比分布是一致的(另附文件)gydF4y2Ba1gydF4y2Ba:图S2)。基于所有样本的FPKM小提琴分析检测到cDNA文库的构建和每个样本的基因表达水平没有偏差(附加文件)gydF4y2Ba1gydF4y2Ba:图S3)。相关热图分析检测到生物重复之间的高相关性,从而表明样品选择过程合理,测序数据可靠(另附文件)gydF4y2Ba1gydF4y2Ba:图S4)。因此,测序数据的质量和准确性足以进行进一步分析。gydF4y2Ba
差异表达基因分析gydF4y2Ba
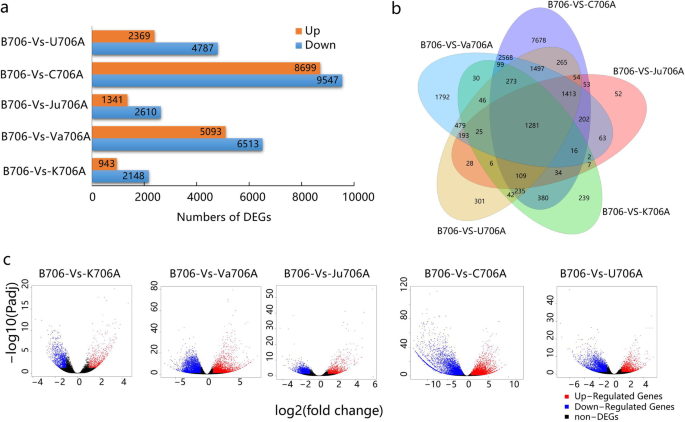
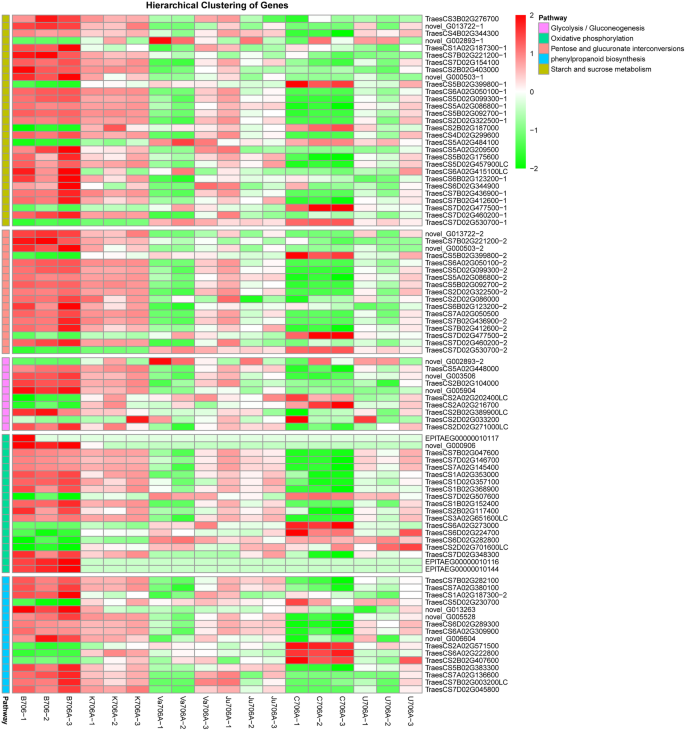
在每个不育系和保持系(B706 vs. K706A、B706 vs. Va706A、B706 vs. C706A、B706 vs. U706A)中,根据设定的标准(FDR < 0.05和|Log2FC| > 1)筛选差异表达基因(DEGs)。与B706相比,K706A鉴定出3091个deg, Va706A鉴定出11606个deg, Ju706A鉴定出3951个deg, C706A鉴定出18246个deg, U706A鉴定出7156个deg。gydF4y2Ba3.gydF4y2Baa).为了探索与CMS流产相关的共同分子机制,我们通过研究5种IAMSLs的共享基因来比较deg。图中的维恩图。gydF4y2Ba3.gydF4y2Bab显示IAMSLs中的deg之间存在大量重叠,其中包含1281个deg的核心集在所有五种IAMSLs中具有相似的不同表达水平(附加文件)gydF4y2Ba4gydF4y2Ba表S3)。有趣的是,这组核心共享的DEGs在每种无菌材料中包括158个上调的DEGs和1123个下调的DEGs,但实际的基因表达水平和DEGs的显著差异是不同的(图2)。gydF4y2Ba3.gydF4y2Bac)。我们还发现,在IAMSLs中,大多数共有的deg都下调了,包括查尔酮合成酶(gydF4y2BaTraesCS5A02G379400gydF4y2Ba,gydF4y2BaTraesCS5B02G383300gydF4y2Ba)、ABC传送器(gydF4y2BaTraesCS7B02G488900, TraesCSU02G106900gydF4y2Ba)和细胞色素P450 (gydF4y2BaTraesCS4A02G358200gydF4y2Ba,gydF4y2BaTraesCS5B02G514200, TraesCS3A02G505000gydF4y2Ba)(附加文件gydF4y2Ba4gydF4y2Ba表S3)。先前的研究表明,这些基因的抑制会影响花粉外壁的形成,从而导致雄性不育[gydF4y2Ba26gydF4y2Ba].因此,有必要分析5个IAMSLs的共有deg,以探索CMS小麦流产的共同原因,因为大多数核心基因组的下调可能与IAMSLs的雄性不育有关。gydF4y2Ba
核心DEGs的功能分类与富集分析gydF4y2Ba
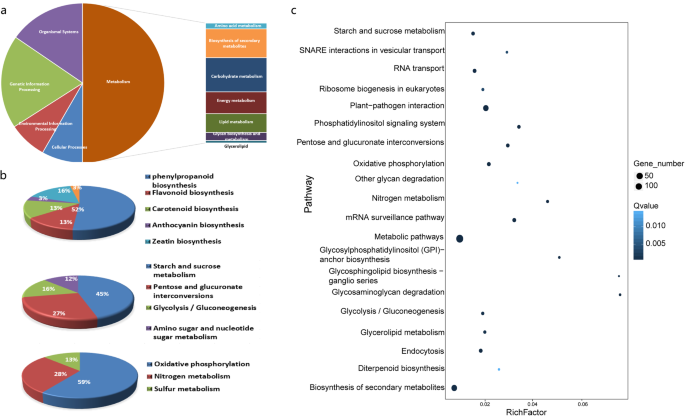
为了进一步明确核心deg的功能,对标注的基因序列进行了KOG分类。总共根据23个KOG类别注释了509个deg,其中“仅用于一般功能预测”的注释最多,为212个。此外,“信号转导机制”由144个deg代表,其次是“转录”,有99个deg(附加文件)gydF4y2Ba1gydF4y2Ba:图5)。因此,我们推测信号转导相关基因的大量改变可能阻碍了细胞内的信号传递,最终导致IAMSLs不育。gydF4y2Ba
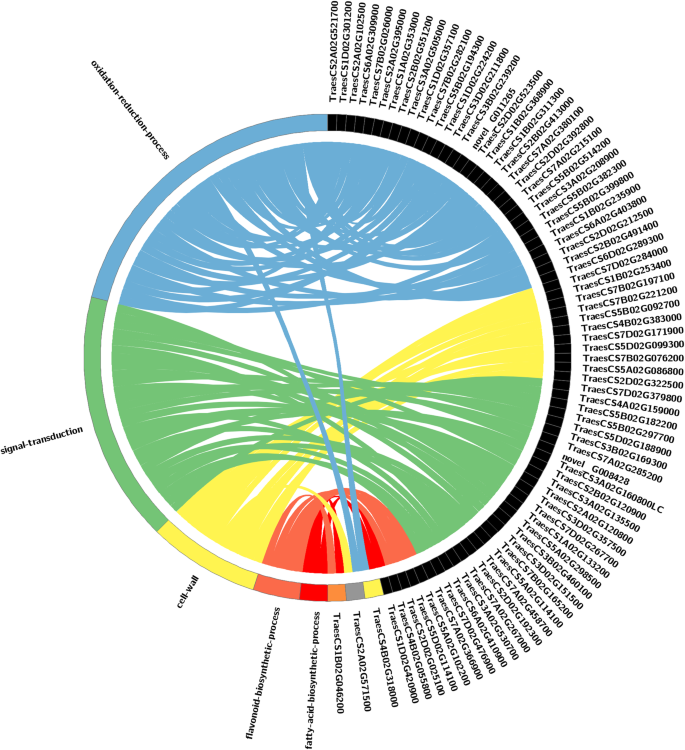
使用GO数据库注释的核心deg从三个本体分为三个主要类别:“生物过程”,“细胞成分”和“分子功能”。根据四个级别的GO分类,核心deg的富集表明44个GO项是显著的(gydF4y2BapgydF4y2Ba< 0.01)(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。此外,三级和四级功能分类表明,“信号转导”、“氧化还原过程”、“类黄酮生物合成过程”、“脂肪酸生物合成过程”和“细胞壁”五个GO术语在5个CMS系共有的deg中占主导地位(附加文件)gydF4y2Ba1gydF4y2Ba:图S7A-C)。基于关联图分析了五个重要GO项与相关deg之间的关系。如图所示。gydF4y2Ba4gydF4y2Ba,一种标记为果胶酯酶的基因(gydF4y2BaTraesCS2A02G571500gydF4y2Ba)与“细胞壁”和“氧化还原过程”有关。事实上,先前的一项研究表明,果胶酯酶与花粉育性、花粉萌发和花药开裂有关gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba27gydF4y2Ba].根据本研究,在IAMSLs花粉败育过程中,被标记为果胶酯酶的13个deg可能控制花粉细胞壁的形成。此外,基因(gydF4y2BaTraesCS1B02G046200gydF4y2Ba)在两个GO术语(“类黄酮生物合成过程”和“脂肪酸生物合成过程”)中包含了查尔酮-黄酮异构酶,从而表明该基因可能在CMS小麦中起着至关重要的作用。这些结果表明,不育小麦的花粉败育可能与细胞壁相关基因的改变有关,从而影响花粉壁的形成和花药开裂,最终导致不育。gydF4y2Ba
进行KEGG富集分析以进一步确定核心deg在特定生物学途径中的功能。经注释的deg被分配到81个KEGG通路,其中“戊糖和葡萄糖酸盐相互转化”、“淀粉和蔗糖代谢”和“糖酵解/糖异生”根据气泡图是极具代表性的。有趣的是,与“信号转导”类别占据主要位置的KOG和GO结果相似,根据KEGG富集分析,“磷脂酰肌醇(PI)信号系统”途径也很重要(图2)。gydF4y2Ba5gydF4y2Baa - c)。许多先前的研究也表明,与磷脂酰肌醇相关的基因和酶对男性不育有调节作用[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].三个层次的KEGG分类还表明,与“其他次生代谢物的生物合成”、“碳水化合物代谢”和“能量代谢”相关的途径与许多deg相关,如“苯丙类生物合成”、“淀粉和蔗糖代谢”、“糖酵解/糖异生”和“氧化磷酸化”(图2)。gydF4y2Ba5gydF4y2Baa - c)。分层聚类分析应用于主要途径的deg(图2)。gydF4y2Ba6gydF4y2Ba).与B706相比,IAMSLs中这些主要通路中的大部分deg均下调。此外,如图1所示。gydF4y2Ba6gydF4y2Ba,一些deg被强烈下调,如编码UTP(葡萄糖-1-磷酸尿苷基转移酶)的基因(gydF4y2BaTraesCS6A02G050100gydF4y2Ba)和推测的果胶酯酶53 (gydF4y2BaTraesCS5A02G086800gydF4y2Ba,gydF4y2BaTraesCS5B02G092700, TraesCS5D02G099300gydF4y2Ba)在“戊糖与葡萄糖酸相互转化”及“淀粉与蔗糖代谢”中,丙酮酸脱羧酶(gydF4y2BaTraesCS2B02G104000gydF4y2Ba)中的“糖酵解/糖异生”及(gydF4y2BaTraesCS2D02G086000gydF4y2Ba)、过氧化物酶(gydF4y2BaTraesCS6A02G309900, TraesCS6D02G289300gydF4y2Ba),而atp6-1 (gydF4y2BaEPlTAEG00000010144gydF4y2Ba和gydF4y2BaEPlTAEG00000010116gydF4y2Ba)在“氧化磷酸化”中,这与代谢调节、花粉发育和能量合成有关。这些基因在IAMSLs中被严重抑制,这表明它们可能与雄性不育有关,从而为研究CMS小麦的雄性不育提供了宝贵的资源。gydF4y2Ba
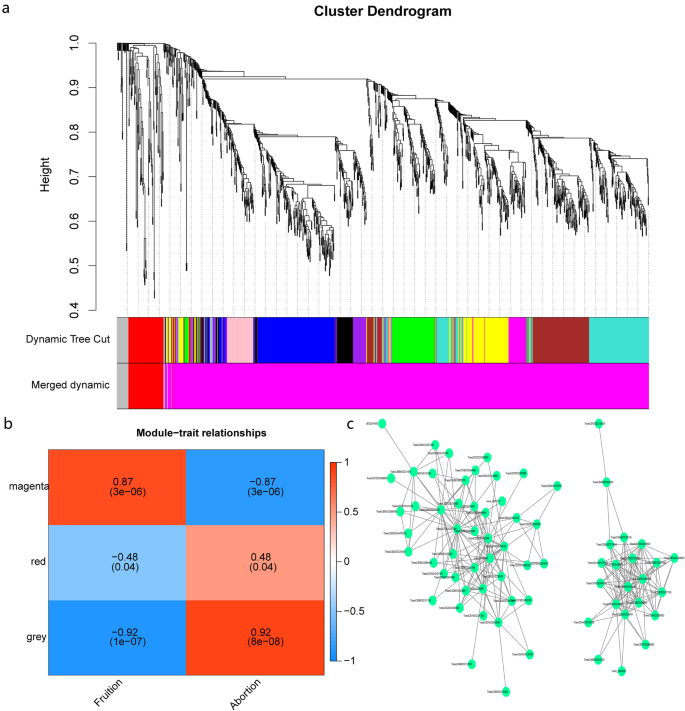
加权基因共表达网络分析鉴定雄性不育相关枢纽基因gydF4y2Ba
利用非冗余核心deg进行加权基因共表达网络分析(WGCNA),进一步阐明5个IAMSLs中与雄性不育相关的基因(图2)。gydF4y2Ba7gydF4y2Baa).以结实率和花粉败育率作为性状数据分析模块-性状关系,结果表明,“品红”模块(gydF4y2BargydF4y2Ba= 0.87,gydF4y2BapgydF4y2Ba= 3e-06)与18个样本的雄性不育性高度相关(图2)。gydF4y2Ba7gydF4y2Bab).此外,为了进一步确定品红模块中的重要通路,我们进行了KEGG富集分析,发现该模块中的基因主要与磷脂酰肌醇(PI)信号系统和三种糖代谢通路(戊糖和葡萄糖酸盐相互转化、淀粉和蔗糖代谢、糖酵解/糖异生)有关(附加文件)gydF4y2Ba1gydF4y2Ba:图S8)。一些枢纽基因在主要途径上的细胞图显示,枢纽基因具有更大的连通性,因此它们可能与雄性不育密切相关(附加文件)gydF4y2Ba1gydF4y2Ba:图S9)。这些中心基因包括二酰基甘油激酶(gydF4y2BaTraesCS7A02G297200gydF4y2Ba,gydF4y2BaTraesCS7D02G291600gydF4y2Ba), UTP—葡萄糖-1-磷酸尿苷基转移酶(gydF4y2BaTraesCS6A02G050100gydF4y2Ba),以及果胶酯酶53 (gydF4y2BaTraesCS5A02G086800gydF4y2Ba,gydF4y2BaTraesCS5B02G092700, TraesCS5D02G099300gydF4y2Ba)(图。gydF4y2Ba7gydF4y2Bac).重要的是,我们发现这些枢纽基因或其同源基因大多与上述候选基因一致。因此,研究结果也证实了这些候选基因对小麦雄性不育的重要作用。gydF4y2Ba
主要代谢途径基因表达改变对花粉发育的影响gydF4y2Ba
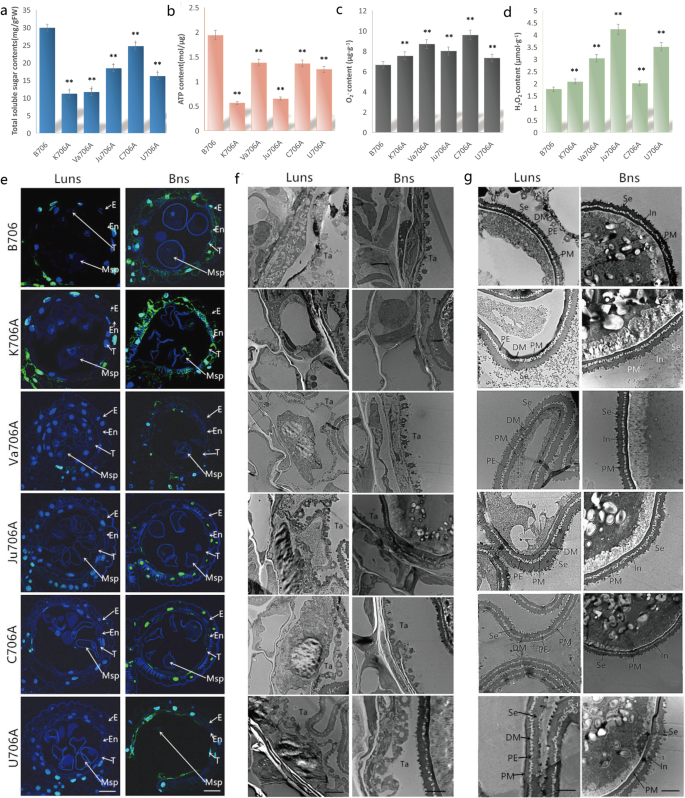
为了验证糖代谢途径中这些基因的下调表达是否会影响花粉生长发育的维持,我们分析了IAMSLs和双核维持者花药中的总可溶性糖含量。与B706相比,5个IAMSLs的花药中可溶性淀粉含量显著降低(图2)。gydF4y2Ba8gydF4y2Baa).因此,我们认为,由于一些参与糖代谢途径的基因受到限制,可溶性淀粉缺乏可能是IAMSLs花粉发育后期花粉败育的主要原因之一。gydF4y2Ba
生理指标定量及组织学分析。gydF4y2Ba一个gydF4y2Ba双核期花药总可溶性糖含量。gydF4y2BabgydF4y2Ba双核时期花药的ATP含量。gydF4y2BacgydF4y2BaOgydF4y2Ba2gydF4y2Ba−gydF4y2Ba内容。gydF4y2BadgydF4y2BaHgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容。学生的gydF4y2Bat -gydF4y2Ba测试*gydF4y2BapgydF4y2Ba< 0.05 **gydF4y2BapgydF4y2Ba< 0.01。每个值代表平均值±SD (gydF4y2BangydF4y2Ba= 3)。gydF4y2BaegydF4y2BaTUNEL法检测花药绒毡层PCD。比例尺代表50 μm。gydF4y2BafgydF4y2Ba绒毡层的透射电子显微照片。比例尺代表2 μm。gydF4y2BaggydF4y2Ba小孢子的透射电子显微照片。比例尺代表2 μm。lun,无核晚期;Bns,双核期;艾凡:表皮;En:内层;T:毯;Tds:四联球菌;Msp:小孢子;助教:tapetosome; PE, primexine; Se, sexine; DM, deposited materials; PM, plasma membrane; In, intine
为了阐明氧化磷酸化通路下调基因对花粉发育的影响,我们采用分光光度法测定了花药中ATP和ROS的含量。我们发现IAMSLs中的ATP含量明显低于B706,但5个IAMSLs中积累了过量的ROS(图2)。gydF4y2Ba8gydF4y2Ba罪犯)。因此,过量的ROS可以抑制与氧化磷酸化过程相关的基因的表达,并导致线粒体中能量不足。gydF4y2Ba
基于上述KEGG和分层聚类分析,我们的研究结果表明,这些DEGs的下调可能限制了苯丙素的生物合成过程。因此,使用流产关键阶段的其他花药切片进行了TUNEL和透射电镜分析。如图所示。gydF4y2Ba8gydF4y2Bae和附加文件gydF4y2Ba1gydF4y2Ba图S9A显示,在单核和双核后期,K706A的绒毡细胞比B706产生更强的tunel阳性信号。但与K706A不同,其他不育系在这两个时期的TUNEL荧光信号均弱于B706。此外,毡层超微结构分析显示,K706A在单核后期,毡层细胞过早凋亡。与K706A相比,在这一阶段,其他IAMSLs的绒毡层细胞比维持系的要大(图2)。gydF4y2Ba8gydF4y2Baf和附加文件gydF4y2Ba1gydF4y2Ba图S10),提示这些绒毡层细胞发生了延迟PCD。我们还观察了花粉发育,以确定孢子花粉的异常形成是否与绒毡层PCD缺陷同步。与B706相反,IAMSLs中孢粉素的异常积累导致无法形成正常的性别(图2)。gydF4y2Ba8gydF4y2Bag).这些观察结果表明,这些与苯丙素生物合成相关的deg的下调可能引发绒毡层PCD异常,从而阻碍花粉发育过程中孢粉素的分泌,导致小麦IAMSLs花粉外壁产生缺陷和雄性不育。这些发现进一步证实了我们对小麦雄性不育的预测,也证明了RNA-Seq结果的可靠性。gydF4y2Ba
实时定量聚合酶链反应验证RNA-seq数据gydF4y2Ba
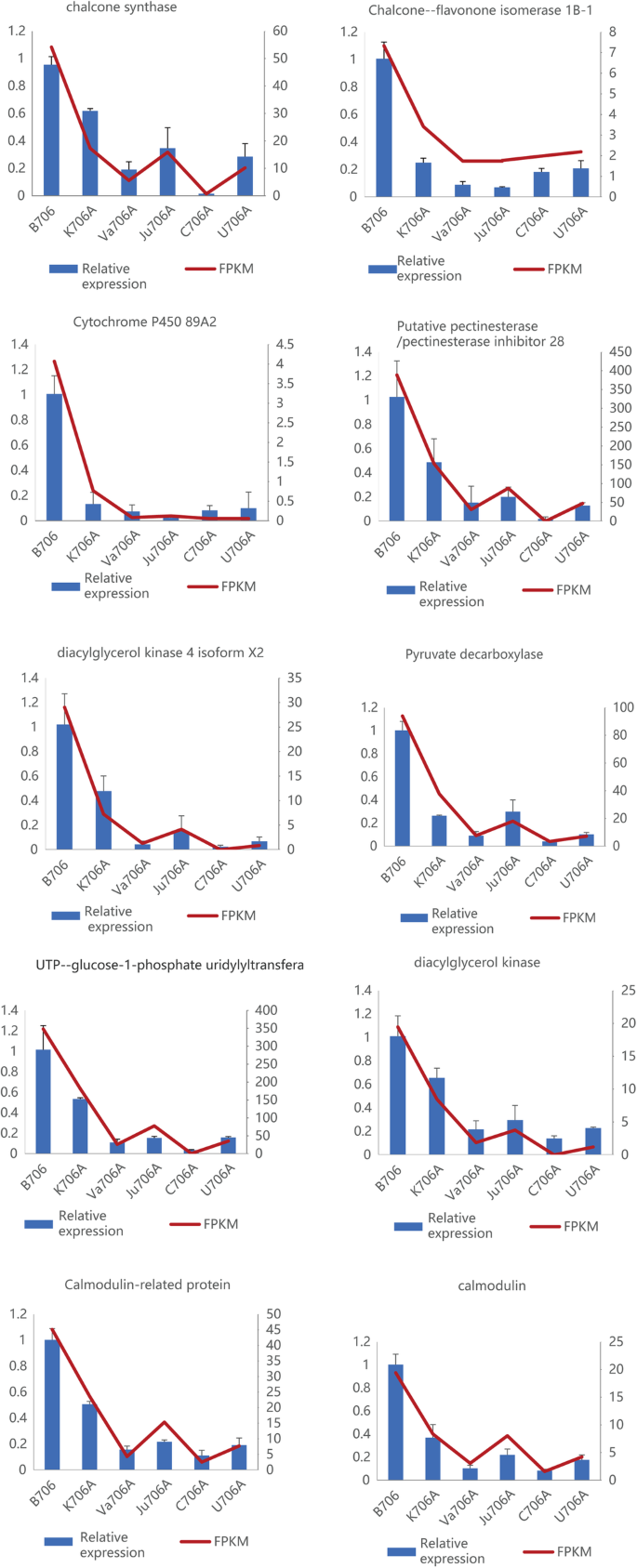
我们通过定量实时聚合酶链反应(RT-qPCR)分析验证了RNA-seq数据的准确性,其中根据它们的功能分类、WGCNA分析和先前的研究结果选择了10个可能与CMS相关的deg。这些候选基因的RT-qPCR表达模式与RNA-seq测定结果一致(图2)。gydF4y2Ba9gydF4y2Ba).此外,线性回归分析发现RT-qPCR和RNA-seq结果呈正相关(附加文件)gydF4y2Ba1gydF4y2Ba:图S11),从而证明本研究的RNA-Seq结果是准确可靠的。gydF4y2Ba
讨论gydF4y2Ba
与CMS相关的糖代谢相关的DEGsgydF4y2Ba
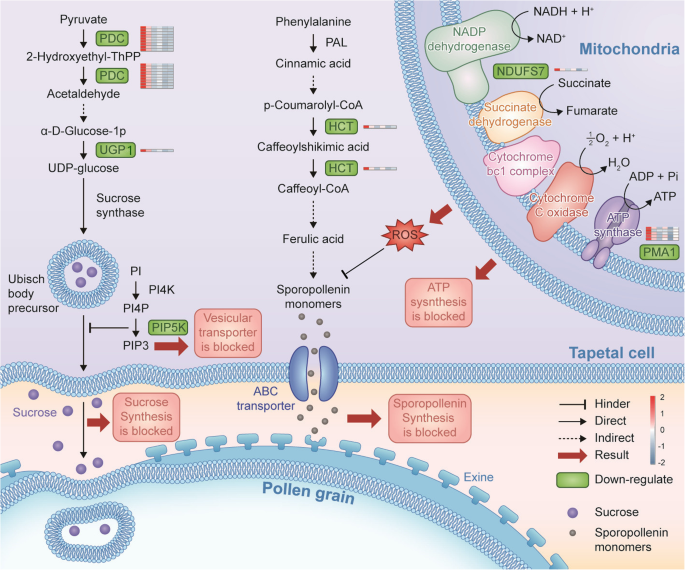
在植物中,蔗糖和淀粉作为能量储备和碳骨架源进行积累,为植物细胞壁和纤维的构建提供基础物质,是花粉和花药发育后期所必需的。戊糖和葡萄糖酸盐的相互转化、淀粉和蔗糖的代谢以及糖酵解/糖异生是花药发育过程中重要的糖代谢途径,糖代谢的破坏会严重损害花粉发育,最终导致雄性不育。一般来说,当淀粉含量低于一定阈值时,花粉会提前成熟[gydF4y2Ba30.gydF4y2Ba].例如,在雄性不育的CMS突变体中,花粉活力的缺乏与淀粉缺乏密切相关[gydF4y2Ba31gydF4y2Ba].Ma等。[gydF4y2Ba32gydF4y2Ba]利用转录组测序技术鉴定了在花药发育过程中富集的1165个基因,其中许多基因与淀粉和蔗糖代谢、戊糖醛酸转化和类黄酮生物合成代谢有关。其他研究表明,糖代谢途径,如戊糖醛酸转化、淀粉和蔗糖代谢、半乳糖代谢等,对棉花的花药发育至关重要。这些调控途径所需的关键基因可能与遗传雄性不育花药发育有关[gydF4y2Ba33gydF4y2Ba].在本研究中,所有IAMSLs中有23个deg下调,其中包括3个重要的糖代谢途径。其中,丙酮酸脱羧酶(pyruvate decarboxylase, PDC)是一种以焦磷酸硫胺素(thiamine pyrophosphate, TPP)为辅酶的羧解酶,广泛存在于植物中。作为发酵途径中的关键酶。丙酮酸通过与丙酮酸脱氢酶竞争,参与植物体内的能量和物质代谢,在根瘤组织发育、休眠芽释放、果实成熟、花粉发育和花粉管萌发等过程中发挥重要作用[j]。gydF4y2Ba34gydF4y2Ba].此外,我们发现编码UTP-葡萄糖-1-磷酸尿苷基转移酶的DEG,如UGP1,在IAMSLs中被强烈下调。植物中的UGPases主要有四个作用:参与蔗糖的合成和代谢,参与植物细胞壁的合成,参与生殖过程[gydF4y2Ba19gydF4y2Ba].因此,在我们的研究中确定的DEG表达模式表明,糖的消耗在花药中加速,蔗糖的运输减少,导致不育。gydF4y2Ba
与CMS相关的PI信号系统中的DEGsgydF4y2Ba
质膜是维持细胞活力的重要结构。PI是细胞膜中主要的磷脂之一,由于其特殊的分子结构,是主要的磷脂信号分子,其中PI信号转导过程具有许多重要作用[gydF4y2Ba35gydF4y2Ba].PI特异性磷脂酶C, PI信号系统中的关键酶,由受体激活。当细胞受到外界因素刺激时,PI 4,5-二磷酸产生信使分子肌醇1,4,5-三磷酸和二酰基甘油,它们调节Ca的浓度gydF4y2Ba2 +gydF4y2Ba和细胞中蛋白激酶C的活性[gydF4y2Ba36gydF4y2Ba].PI信号系统还介导胞外信号的跨膜转导,在调节植物生长发育和对环境刺激的反应中发挥重要作用。花粉发育包括一系列减数分裂和分化过程,包括细胞质成分和内部亚细胞成分的动态变化,以及细胞骨架和液泡的变化。花粉管的生长也依赖于细胞骨架重组和囊泡运输[gydF4y2Ba37gydF4y2Ba].囊泡运输使花粉管能够协调细胞成分与质膜之间的平衡,有效地控制极性生长过程。许多研究表明,PI信号系统的多种组分参与花粉发育过程中的液泡变化和花粉管生长过程中的囊泡运输[gydF4y2Ba38gydF4y2Ba].当这些酶的表达异常时,可能会影响花粉管内的囊泡运输过程,阻止花粉萌发,导致花粉败育。因此,本研究检测到的PI信号系统相关基因下调可能是导致雄性不育的主要原因。gydF4y2Ba
与CMS相关的氧化磷酸化和苯丙类生物合成的deggydF4y2Ba
线粒体是细胞代谢和能量代谢的重要部位[gydF4y2Ba39gydF4y2Ba].在呼吸过程中,线粒体中的各种酶负责能量的分解和释放。此外,呼吸所释放的能量除部分转化为热能外,大部分以ATP的形式储存起来,为生命活动和植物的生长发育提供能量[gydF4y2Ba40gydF4y2Ba].在正常条件下,琥珀酸和NADH等底物通常足以用于呼吸电子传递,但ADP的供应被认为是调节整个呼吸过程的限制因素。因此,当电子传递链受到抑制时,电子将直接与氧分子相互作用产生ROS,而这种过量的ROS将导致绒毡层PCD异常和雄性不育[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].苯丙烷代谢有木质素代谢途径和类黄酮代谢途径两个重要分支。对香豆酸辅酶A (CoA)在羟基肉桂基转移酶(HCT)的作用下进入木质素合成。随后,通过一系列羟基化、甲基化、连锁和还原反应生成11种不同的木质纤维素单体。这些木质纤维素单体在细胞质中合成,然后运输到细胞壁,在那里它们聚合成木质素。对香豆酸辅酶a和丙烷二酰基辅酶a在查尔酮合成酶的作用下进入分支类黄酮合成途径[gydF4y2Ba43gydF4y2Ba].黄酮类化合物是花青素的重要成分,存在于花药的外壁。苯丙氨酸解氨酶、肉桂酸羟化酶等关键苯丙烷代谢酶由绒毡层细胞合成并分泌到花粉外壁,参与发育中的小孢子外腔的苯丙烷代谢,最终形成孢粉列宁[gydF4y2Ba26gydF4y2Ba].因此,在我们的研究中,氧化磷酸化相关基因的上调可能是由于电子传递链上过量的ROS积累的影响,过量的ROS作为分子信号下调苯丙类生物合成基因,从而导致绒层PCD异常。gydF4y2Ba
小麦可能的转录组介导的雄性不育网络gydF4y2Ba
根据先前发表的研究结果,基于1281个deg的推测功能和表达模式的变化,以及本研究中的实验验证,我们提出了一个有趣的转录组介导的小麦雄性不育网络,如图所示。gydF4y2Ba10gydF4y2Ba。该网络具有多种功能成分,包括抑制蔗糖的合成和运输,阻断孢粉素的合成,加速ROS的产生,细胞壁破坏和绒毡层PCD异常。绒毡层由最内层的花药细胞组成,提供蔗糖、蛋白质、脂质和孢粉素,通过其降解和分泌来支持小孢子的生长和发育[gydF4y2Ba44gydF4y2Ba].丙酮酸脱羧酶(Pyruvate decarboxylase, PDC)和UGP参与植物蔗糖合成和糖代谢,对花粉发育和细胞壁形成至关重要[j]。gydF4y2Ba45gydF4y2Ba].如图所示。gydF4y2Ba9gydF4y2Ba与维持基因相比,编码PDC和UGP的基因表达量大幅下调,总可溶性糖含量降低。蔗糖通过囊泡运输从绒毡层转运到小孢子[gydF4y2Ba46gydF4y2Ba].此外,1-PI-4-磷酸5激酶(PIP5K)是囊泡转运的关键酶,参与PI信号系统通路。因此,PIP5K基因的下调会影响蔗糖向小孢子的运输,从而阻碍花粉壁的合成[gydF4y2Ba37gydF4y2Ba].在本研究中,与NADH脱氢酶和ATP合成酶相关的基因在IAMSLs中被大幅下调,这些异常变化导致过量的电子直接与分子氧结合,产生过量的ROS,减少了IAMSLs中ATP的产生。过量的ROS导致膜脂过氧化,严重增加细胞的通透性[gydF4y2Ba20.gydF4y2Ba].HCT参与了苯丙类生物合成途径和孢粉素合成过程[gydF4y2Ba47gydF4y2Ba].hct相关基因的下调和ROS的过度积累可能导致孢粉素合成受阻,从而最终影响小孢子外壁的形成。因此,这些变化的综合作用导致了IAMSLs的花粉败育。gydF4y2Ba
结论gydF4y2Ba
根据我们的研究结果,在关键流产阶段,我们发现IAMSLs中大部分1281个核心共享deg都下调。筛选并鉴定了与雄性不育相关的关键候选基因,包括糖脂转移蛋白、果胶酯酶和udp -葡萄糖焦磷酸化酶。此外,根据我们的生物信息学分析和进一步验证,我们提出了一个有趣的核心转录组介导的小麦雄性不育网络,并推断由于糖、氧化磷酸化、苯丙烷生物合成和磷脂酰肌醇信号通路中的基因下调,花药的糖和能量不足,ROS积累过多。从而引发绒毡层的异常降解和阻断孢粉素的合成。这些结果为CMS中花药流产的代谢途径提供了新的见解。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
本研究使用了5种IAMSLs,分别为K706A和gydF4y2Ba山羊草属kotschyigydF4y2Ba细胞质,Va706A与gydF4y2BaAe。vaviloviigydF4y2Ba细胞质,Ju706A与gydF4y2BaAe。juvenalisgydF4y2Ba细胞质,C706A与gydF4y2BaAe。菌gydF4y2BaU706A与gydF4y2BaAe。uniaristatagydF4y2Ba(所有材料均由西北农林科技大学k型小麦杂交育种课课组开发)。用B706与稳定不育系回交20多次获得不育系。为确认不育性的稳定性,于2015年10月在西北农林科技大学小麦试验田(108°E, 34°15′n)种植了5个IAMSLs。2016年4月,各IAMSL套袋检查,自结率均为零,表明雄性不育性稳定,证实了之前的发现[gydF4y2Ba5gydF4y2Ba].对5个品种及其保持系B706的主要生育期和幼穗分化期进行了记录。根据小孢子发生的进程,将整个花药发育阶段分为5个阶段:四分体期、早期单核期、晚期单核期、双核期和三核期[gydF4y2Ba41gydF4y2Ba].为了确保RNA-seq结果的可靠性,采用随机完全区组设计,进行3次生物重复,每种材料的每个生物重复将50株中长度相同(双核期)的花药分开混合,在液氮中快速冷冻,并在- 80°C保存,直到RNA提取和生理指标验证。此外,还在5个阶段收获了5个IAMSLs及其保持系的花药进行细胞学实验。gydF4y2Ba
IAMSLs及其保持系的表型特征gydF4y2Ba
根据Ba等人的描述,用醋酸品红色染色核和显微镜来鉴定小孢子的发育阶段[gydF4y2Ba48gydF4y2Ba].使用Motic K400立体显微镜(中国香港)拍摄三核花药。成熟花的开裂花药被I染色gydF4y2Ba2gydF4y2Ba-KI用于评估成熟花粉粒的活力[gydF4y2Ba49gydF4y2Ba].在三核时期收集花药和小孢子,然后在2.5%戊二醛中固定,用分级乙醇系列(50%两次,60、70、80、90、95和100%两次)脱水,干燥[gydF4y2Ba50gydF4y2Ba扫描电镜成像(JEOL jsm - 660lv)。采用DAPI染色法对小孢子发育不同阶段的花粉粒和染色体进行形态学观察,用安装在Nikon ECLIPSE E600显微镜(Nikon Corporation, Japan)上的DS-U2高分辨率相机拍摄,并用NIS-Elements软件进行处理。gydF4y2Ba
RNA提取,cDNA文库构建及测序gydF4y2Ba
根据制造商提供的说明,使用RNAiso for Polysaccharide-rich Plant Tissue kit (Takara生物工程(大连)有限公司,中国)从18个样品(每种材料在双核阶段的三个生物复制)中分离总RNA。对于每个RNA样品,使用NanoDrop 2000分光光度计(NanoDrop Technologies Inc., USA)测量其浓度。在使用2100生物分析仪(Agilent Technologies, Santa Clara, CA)测量浓度之前,使用RNase-free琼脂糖凝胶电泳确认RNA的完整性。用5 μg的总RNA和寡核苷酸(dT)附着磁珠富集纯化mRNA,然后将其裂解成短片段。将裂解的mRNA片段作为模板,用随机六聚体和上标体II合成第一链cDNA。用DNA聚合酶I、dNTPs和RNaseH合成第二链cDNA。然后对cDNA片段进行末端修复,然后将聚(A)尾部与连接测序适配器一起添加,并纯化片段,然后用AMPure XP微珠按大小选择片段。随后,采用PCR扩增对纯化的cDNA模板进行富集。最后,使用广州Sagene生物技术有限公司(中国广州)的Illumina HiSeq PE150平台进行Illumina测序。gydF4y2Ba
deg的数据处理和鉴定gydF4y2Ba
为了获得用于序列分析的高质量clean reads(干净数据),将适配器序列、低质量reads(超过50%的全reads中碱基数SQ≤20)和未知碱基超过10%的reads (N个碱基)去除[gydF4y2Ba51gydF4y2Ba].然后将高质量的干净读数映射到核糖体数据库(gydF4y2Baftp://ftp.ncbi.nlm.nih.gov/genbankgydF4y2Ba),并删除映射的读取。接下来,基于小麦参考基因组(IWGSC1.0 + NC_002762.1),gydF4y2Bahttp://plant.ensembl.org/index.htmlgydF4y2Ba),使用HISAT2绘制除rRNA外的所有高质量干净读段(gydF4y2Bahttps://ccb.jhu.edu/software/hisat2/index.shtmlgydF4y2Ba).映射的干净读取用StringTie (gydF4y2Bahttps://ccb.jhu.edu/software/stringtie/index.shtmlgydF4y2Ba) [gydF4y2Ba52gydF4y2Ba].采用RESM (v1.2.31)定量各基因的表达水平,采用DESeq2计算deg;gydF4y2BapgydF4y2Ba-adjust < 0.05 [gydF4y2Ba53gydF4y2Ba].gydF4y2Ba
功能注释和DEG分析gydF4y2Ba
采用BLASTx 2.2.24+软件,结合STRING9.0数据库(gydF4y2Bahttp://string-db.org/gydF4y2Ba),根据KOGs资料库(gydF4y2Baftp://ftp.ncbi.nih.gov/pub/COG/KOG/gydF4y2Ba).(gydF4y2Bahttp://www.geneontology.org/gydF4y2Ba)及KEGG (gydF4y2Bahttp://www.genome.jp/kegg/gydF4y2Ba),使用BLAST2GO (gydF4y2Bahttp://www.blast2go.com/gydF4y2Ba)和BLASTx/BLASTp 2.2.24+。使用Goatools和KOBAS软件使用共享的deg进行GO项和KEGG途径富集分析,其中阈值是正确的gydF4y2BaPgydF4y2Ba-value≤0.05 [gydF4y2Ba54gydF4y2Ba].使用Circos 0.69版本可视化了关键GO术语与相关deg之间的关系[gydF4y2Ba55gydF4y2Ba].热图采用R中的Ggplot绘制。gydF4y2Ba
共表达网络构建gydF4y2Ba
通过使用R包中的WGCNA对共享deg进行WGCNA,推断出与不育有强烈关联的共表达基因模块[gydF4y2Ba56gydF4y2Ba].根据基因对之间的成对Pearson相关系数得到邻接矩阵。WGCNA网络的构建和模块测试采用无符号型拓扑重叠矩阵,其幂β为13,分支合并切割高度为0.25。计算模块特征基因(给定模块的第一主成分)并用于评估模块与不育性的相关性。根据KEGG通路富集分析,利用Cytoscape 3.1.1可视化关键模块和deg,绘制相互作用网络图[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
糖、ATP和活性氧(ROS)含量gydF4y2Ba
在双核阶段收集每种材料的花药(0.2 g),测定可溶性糖(蔗糖、果糖和葡萄糖)和ATP的含量。用紫外分光光度计(Philes,南京,中国)在620 nm和700 nm处测定总糖含量和ATP含量。gydF4y2Bahttp://www.philes.cn/gydF4y2Ba可溶性糖检测试剂盒和ATP检测试剂盒(Comin,苏州,中国);gydF4y2Bahttp://www.cominbio.com/gydF4y2Ba),根据试剂盒附带的说明分别进行。总糖含量(mg ggydF4y2Ba−1gydF4y2Ba)和ATP含量(μmol g)gydF4y2Ba−1gydF4y2Ba)根据说明书提供的公式计算。超氧阴离子(O)的速率gydF4y2Ba2gydF4y2Ba−gydF4y2Ba)生产和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba用0.5 g IAMSLs和B706花药测定含量,如前所述[gydF4y2Ba58gydF4y2Ba].所有生理指标均以3个生物重复为基础进行测定。gydF4y2Ba
TUNEL分析gydF4y2Ba
花药石蜡切片(6 μm)用分级乙醇串联脱水,20 μ L培养gydF4y2Ba−1gydF4y2Ba蛋白酶K(罗氏)浸泡10分钟,然后用磷酸盐缓冲盐水洗涤15分钟。根据制造商的说明,使用原位细胞死亡检测试剂盒(POD, Roche)进行TUNEL检测。然后用荧光共聚焦扫描显微镜(Nikon, Tokyo, Japan)观察切片。分别在450 nm和515 nm、358nm和461 nm激发和发射波长处分析绿色TUNEL荧光信号和蓝色DAPI荧光。采用IPP 6.0软件统计关键阶段tunel阳性核/总核比。gydF4y2Ba
透射电镜观察gydF4y2Ba
为了获得超薄切片,将单核后期和双核后期的花药在4℃、2.5%戊二醛中固定24 h以上。用磷酸缓冲液(0.1 mol L)洗涤后gydF4y2Ba−1gydF4y2Ba(pH 7.2),将花药固定在1%四氧化锇中,用乙醇系列(50%两次,60、70、80、90、95和100%两次)脱水。花药用UC6超微组(Leica)制备,用0.2%柠檬酸铅染色。gydF4y2Ba44gydF4y2Ba].用透射电镜(Hitachi, H-7650, Japan)观察绒毡层和小孢子的超微结构[gydF4y2Ba59gydF4y2Ba].使用CellSens Entry软件计算每个切片的绒毡层面积。gydF4y2Ba
定量RT-PCR (RT-qPCR)验证gydF4y2Ba
采用转录第一链cDNA合成试剂盒(Transcriptor First Strand cDNA synthesis Kit, Roche, Germany),从每种材料中提取5 μg总RNA合成第一链cDNA。的gydF4y2BaTaActingydF4y2Ba基因作为RT-qPCR的内参基因[gydF4y2Ba60gydF4y2Ba].所选候选基因的引物和gydF4y2BaTaActingydF4y2Ba使用Primer Premier 5.0对基因进行设计,并在附加文件中列出gydF4y2Ba2gydF4y2Ba表S1。反应采用2x RealStar SYBR混合液(含ROX II;GenStar,中国)在QuantStudio™7 Flex Real-Time PCR System (Applied Biosystems, USA)中按照以下程序:95°C 10 min,然后在95°C 15 s和60°C 1 min下进行40个循环。RT-qPCR一式三次(技术重复),每种材料有3个生物重复,利用2gydF4y2Ba——ΔΔCtgydF4y2Ba方法(gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
生理指标测量结果采用单因素方差分析进行统计分析。采用Duncan检验评估IAMSLs与B706之间表达水平的显著差异(*)gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01)。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的所有数据集都包含在本文(及其附加文件)中。本研究的原始数据已存入中国科学院北京基因组研究所大数据中心(Nucleic Acids Res 2019)基因组序列档案(Genomics, Proteomics & Bioinformatics 2017),检索号为CRA002161、CRA002161,网址为gydF4y2Bahttps://bigd.big.ac.cn/gsa/browse/CRA002161gydF4y2Ba。gydF4y2Ba
缩写gydF4y2Ba
- bn:gydF4y2Ba
-
有双细胞核的阶段gydF4y2Ba
- CMS:gydF4y2Ba
-
细胞质雄性不育gydF4y2Ba
- 辅酶a:gydF4y2Ba
-
对香豆酸辅酶AgydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-diamidino-2-phenylindolegydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 恩:gydF4y2Ba
-
早期无核阶段gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万次读取所映射的外显子模型的每千碱基片段gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论;gydF4y2Ba
- HCT:gydF4y2Ba
-
羟基肉桂基转移酶gydF4y2Ba
- 我gydF4y2Ba2gydF4y2Ba吻:gydF4y2Ba
-
iodine-potassium碘化gydF4y2Ba
- IAMSLs:gydF4y2Ba
-
同核异质雄性不育系gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因与基因组百科全书gydF4y2Ba
- KOG:gydF4y2Ba
-
真核同源基团gydF4y2Ba
- lun:gydF4y2Ba
-
无核期晚期gydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
细胞程序性死亡gydF4y2Ba
- PDC:gydF4y2Ba
-
丙酮酸脱羧酶gydF4y2Ba
- PI:gydF4y2Ba
-
磷脂酰肌醇gydF4y2Ba
- PIP5K:gydF4y2Ba
-
1-PI-4-phosphate 5-kinasegydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- 扫描电镜:gydF4y2Ba
-
扫描电子显微镜gydF4y2Ba
- Tds:gydF4y2Ba
-
四联球菌gydF4y2Ba
- 透射电镜:gydF4y2Ba
-
透射电子显微镜gydF4y2Ba
- Tns:gydF4y2Ba
-
三环的阶段gydF4y2Ba
- 泛太平洋伙伴关系:gydF4y2Ba
-
硫胺素焦磷酸gydF4y2Ba
- TUNEL:gydF4y2Ba
-
末端脱氧核苷酸转移酶介导的dUTP镍端标记gydF4y2Ba
- Uby:gydF4y2Ba
-
Ubisch身体gydF4y2Ba
- UGP1:gydF4y2Ba
-
葡萄糖-1-磷酸尿苷基转移酶gydF4y2Ba
- UGP2:gydF4y2Ba
-
葡萄糖-1-磷酸尿苷基转移酶gydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达网络分析gydF4y2Ba
参考文献gydF4y2Ba
Longin CFH, Reif JC。小麦遗传资源开发利用的再设计。植物科学进展,2014;19(10):631-6。gydF4y2Ba
Reynolds M, Bonnett D, Chapman SC, Furbank RT, Manes Y, Mather DE等。提高小麦产量的潜力。1 .联盟方法和育种策略概述。实验学报,2011;62(2):439-52。gydF4y2Ba
Longin CFH, Muhleisen J, Maurer HP, Zhang HL, Gowda M, Reif JC。自交杂交种的杂交育种。理论与应用,2012,25(6):1087-96。gydF4y2Ba
Martin AC, Castillo A, Atienza SG, Rodriguez-Suarez C.硬粒小麦细胞质雄性不育(CMS)系统。动物学报,2018;38(7):9。gydF4y2Ba
姚明,叶杰,杨志,段勇,孟玲,严鹏,等。五种小麦细胞质雄性不育系的败育特征及育性恢复。作物学报,2015,35(12):1676-84。gydF4y2Ba
石霞,胡刚,孟玲,齐铮,宋霞。5种小麦细胞质雄性不育系败育过程中活性氧代谢保护酶活性的研究。J Trit农作物。2014; 34(12): 1656 - 60。gydF4y2Ba
李建军,韩胜,丁晓玲,何婷婷,戴建勇,杨斯平,等。大豆细胞质雄性不育系NJCMS1A与其保持系NJCMS1B的转录组比较分析gydF4y2Ba大豆gydF4y2Ba(l)稳定)。科学通报,2015;10(5):18。gydF4y2Ba
杨玲,吴彦良,张敏,张建峰,Stewart JM,邢长忠,等。CMS-D8棉细胞质雄性不育系和保持系的转录组学、细胞学和生化分析。植物化学学报,2018;37(6):537 - 551。gydF4y2Ba
陈玲,沙希德·MQ,吴建伟,陈志祥,王磊,刘晓东。细胞学和转录组学分析揭示了与花粉败育相关的减数分裂和糖代谢基因的突变表达。中国生物医学工程学报,2018;29(6):1409 - 1409。gydF4y2Ba
张强,夏超,张立林,董超,刘鑫,孔晓燕。普通小麦叶片早衰突变体(gydF4y2Ba小麦gydF4y2Bal .)。中华医学杂志,2018;19(3):18。gydF4y2Ba
吴海燕,石蓉蓉,安晓燕,刘超,傅海峰,曹林,等。普通小麦黄叶色候选基因(gydF4y2Ba小麦gydF4y2BaL.)和主要相关代谢途径根据转录组分析。中华医学杂志,2018;19(6):26。gydF4y2Ba
莫慧珍P, See PT, Moffat CS。小麦棕斑病侵染过程中小麦和病原菌转录组的研究。BMC Res笔记。2018; 11(1): 907。gydF4y2Ba
胡海燕,何军,赵建军,欧小强,李宏,茹志刚。小麦幼苗根系低pH胁迫响应转录组(gydF4y2Ba小麦gydF4y2Bal .)。基因工程学报,2018;40(11):1199-211。gydF4y2Ba
丁斌,郝敏,梅东,曲再满,桑生,王华,等。三种细胞质雄性不育系统的转录组和激素比较gydF4y2Ba芸苔属植物显著gydF4y2Ba。中华医学杂志,2018;19(12):4022。gydF4y2Ba
杨艳,鲍生,周霞,刘健,庄勇。茄子雄性不育相关关键基因和途径的比较转录组分析。植物学报,2018;18(1):209。gydF4y2Ba
陈刚,叶晓,张生,朱生,袁磊,侯军,等。芜菁可育花蕾与不育花蕾转录组比较分析gydF4y2Ba芸苔属植物定gydF4y2Bal .)。生物医学工程学报,2018;19(1):908。gydF4y2Ba
引用本文:Datta R, Chamusco KC, Chourey PS.玉米花粉成熟过程中淀粉生物合成与基因表达模式改变相关。植物生理学报,2002;30(4):444 - 444。gydF4y2Ba
陈锐,赵旭,邵志,魏志,王勇,朱磊,等。水稻udp -葡萄糖焦磷酸化酶1是花粉胼胝质沉积所必需的,它的共抑制导致了一种新型的热敏性雄性不育。植物学报。2007;19(3):847-61。gydF4y2Ba
朴智宇,石津津,徐边,等。在植物的营养和生殖阶段,udp -葡萄糖焦磷酸化酶是限速的gydF4y2Ba拟南芥gydF4y2Ba。植物生理学报,2010;51(6):981-96。gydF4y2Ba
马丽娟,马丽娟。线粒体功能与精子质量的关系。繁殖。2013;146 (5):r163 - 74。gydF4y2Ba
季建军,黄伟,李大伟,尹永勇,柴卫文,龚志华。一个与cms相关的基因Psi - atp6-2,可导致线粒体F1Fo-ATP合成酶的ATP水解活性增加,并诱导辣椒雄性不育(gydF4y2Ba甜椒gydF4y2Bal .)。植物化学通报,2014,32(4):888-99。gydF4y2Ba
金德华,金伯德。辣椒雄性可育系和不育系线粒体atp6基因区域的组织(gydF4y2Ba甜椒gydF4y2Bal .)。当代医学,2006;49(1):59-67。gydF4y2Ba
刘忠,石鑫,李生,胡刚,张磊,宋鑫。小麦绒带延迟程序性细胞死亡(PCD)和氧化应激诱导的单叶麦穗细胞质雄性不育。中国生物医学工程学报,2018;19(6):917 - 918。gydF4y2Ba
刘忠,石霞,李松,张丽,宋霞。氧化应激和细胞程序性死亡与小麦花粉败育的关系。植物科学,2018;9:595。gydF4y2Ba
vizkay - barrena G, Wilson ZA。拟南芥绒毡层PCD和花粉壁发育的改变gydF4y2Bams1gydF4y2Ba突变体。[J] .中国生物医学工程学报,2006;37(6):591 - 591。gydF4y2Ba
杨树生,田田,山石辉。查尔酮合成酶在花药中表达的抑制作用gydF4y2Ba萝卜gydF4y2Ba与小姑雄不育细胞质。生物医学工程学报。2008;31(4):483- 498。gydF4y2Ba
王志强,王志强。果胶甲基酯酶和果胶动力学研究进展。植物学报。2005;17(12):3219-26。gydF4y2Ba
张敏,宋鑫,吕凯,姚勇,龚铮,郑晨。油松雌不育系胚珠败育的差异蛋白质组学分析。植物科学,2017;26:31 - 49。gydF4y2Ba
王云峰,李志,潘晓伟,李云云,王国光,关亚,等。遗传狗尾草SiRLK35基因的克隆及功能分析。2017;39(5):413-22。gydF4y2Ba
钟鹏,肖海红,陈海军,常武武,王士杰。温度对水稻蔗糖转运蛋白4基因表达的影响gydF4y2BaOsSUT4,gydF4y2Ba在萌发的胚胎和成熟的花粉中。植物物理学报,2014,36(1):217-29。gydF4y2Ba
引用本文:Datta R, Chamusco KC, Chourey PS.玉米花粉成熟过程中淀粉生物合成与基因表达模式改变相关。植物生理学报,2002;30(4):444 - 444。gydF4y2Ba
马建辉,魏海龙,宋明志,庞云云,刘健,王磊,等。转录组分析表明,类黄酮和抗坏血酸-谷胱甘肽循环在陆地棉花药发育过程中起重要作用。科学通报,2012;7(11):11。gydF4y2Ba
魏敏,宋明忠,范世林,于淑霞。利用数字基因表达谱分析遗传雄性不育棉和野生型棉花药发育过程中差异表达基因的转录组学分析。BMC Genomics. 2013;14:16。gydF4y2Ba
Gass N, Glagotskaia T, Mellema S, Stuurman J, Barone M, Mandel T,等。丙酮酸脱羧酶为矮牵牛花粉管的生长提供了竞争优势。植物学报,2005;17(8):2355-68。gydF4y2Ba
Munnik T, Vermeer JEM。植物渗透胁迫诱导的磷酸肌醇和磷酸肌醇信号传导。植物细胞环境学报,2010;33(4):655-69。gydF4y2Ba
Francis CM, Knighten JM, Taylor MS.肌醇三磷酸动力学是冠状动脉内皮内生理钙信号的基础。中国生物医学工程学报,2018;32(1):2。gydF4y2Ba
李毅,金伊斯,崔毅,黄毅,Staiger CJ, Chung YY,等。拟南芥磷脂酰肌醇3-激酶在花粉发育中起重要作用。植物生理学报,2008;47(4):1886 - 1897。gydF4y2Ba
王晓明,王晓明。磷酸肌苷类化合物的研究进展。生物化学学报。2007;581(11):2105-11。gydF4y2Ba
miller AH, Whelan J, Soole KL, Day DA。植物线粒体呼吸作用的组织与调控。植物学报,2011;32(2):559 - 564。gydF4y2Ba
李建平,李建平。植物线粒体逆行调控的研究进展。线粒体。2007;7(3):177 - 94。gydF4y2Ba
王松,张刚,宋强,张勇,李志,郭健,等。化学杂交剂SQ-1诱导小麦绒毡层和小孢子发育异常。科学通报,2015;10(3):e0119557。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物叶片抗氧化剂和活性氧对细胞程序性死亡的调控作用。足底。2017;246(1):133 - 47岁。gydF4y2Ba
李建军,李建军,李建军,等。在拟南芥肉桂醇脱氢酶突变体中操纵愈创木酰基和丁香基单体生物合成导致非典型木质素生物合成和细胞壁结构改变。植物学报,2015;27(8):2195-209。gydF4y2Ba
张东,刘东,吕旭,王勇,荀志,刘志,等。半胱氨酸蛋白酶CEP1是参与绒毡层程序性细胞死亡的关键执行者,调控拟南芥花粉的发育。植物学报,2014,26(7):2939-61。gydF4y2Ba
Benini S, Toccafondi M, Rejzek M, Musiani F, Wagstaff BA, Wuerges J,等。淀粉欧文菌葡萄糖-1-磷酸尿苷基转移酶:活性、结构和底物特异性。生物化学学报。2017;1865(11):1348-57。gydF4y2Ba
王美梅,宋玉玲,张淑霞,赵晓玲,王建伟,牛宁,等。化学杂交剂SQ-1诱导小麦生理雄性不育时SKP1基因的表达分析(gydF4y2Ba小麦gydF4y2Bal .)。谷物研究,2015;43(2):204-12。gydF4y2Ba
李惠林,刘云云,Douglas CJ。糖基转移酶在花粉壁初胺形成和外壁形成中的作用。植物生理学报,2017;43(1):357 - 357。gydF4y2Ba
巴群思,张国光,王建军,车海霞,刘洪辉,牛宁,马世生,王建伟。小麦活性氧代谢与化学诱导雄性不育的关系(gydF4y2Ba小麦gydF4y2Bal .)。植物学报,2013;93(4):675-81。gydF4y2Ba
于军,韩军,金玉军,宋敏,杨震,何勇,等。两种水稻受体样激酶在温度变化下维持雄性的生育能力。科学通报,2017;35(6):1227 - 1232。gydF4y2Ba
杨云云,董超,于建勇,石磊,童国宝,李志斌,等。半胱氨酸蛋白酶51 (CP51)是一种花药特异性的半胱氨酸蛋白酶基因,在拟南芥花粉外壁形成中起重要作用。植物学报,2014;19(2):383-97。gydF4y2Ba
吴健,张敏,张斌,张欣,郭磊,齐涛,等。陆地棉CMS-D2及其保持系和恢复系全基因组比较转录组分析。生物医学工程学报,2017;18(1):454。gydF4y2Ba
王晓明,王晓明,王晓明,等。转录本组装和RNA-Seq定量揭示了细胞分化过程中无注释转录本和同工异构体转换。生物工程学报,2010;28(5):511-5。gydF4y2Ba
Trapnell C, Hendrickson DG, Sauvageau M, Goff L, Rinn JL, Pachter L.基于RNA-seq的基因调控差异分析。生物工程学报,2013;31(1):46-53。gydF4y2Ba
刘海,谭明,于海,李丽,周峰,杨敏,等。芝麻显性基因雄性不育系可育和不育花蕾的转录组比较分析(gydF4y2Ba胡麻属indicumgydF4y2Bal .)。植物学报,2016;16(1):250。gydF4y2Ba
牛鑫,关玉英,陈世克,李华华。碱基螺旋-环螺旋转录因子的全基因组分析gydF4y2BaBrachypodium distachyongydF4y2Ba。生物医学工程学报,2017;18(1):61gydF4y2Ba
胡建辉,陈国良,张海燕,钱强,丁勇。水稻异质雄性不育系转录本比较分析揭示花粉发育相关基因表达改变(gydF4y2Ba栽培稻gydF4y2Bal .)。植物学报,2016;16(1):175。gydF4y2Ba
白松,孙勇,钱敏,杨峰,倪军,陶荣,等。套袋处理红沙梨果皮转录组分析揭示了光响应途径在花青素积累中的作用。科学通报,2017;7(1):63。gydF4y2Ba
王松,张刚,张勇,宋强,陈志,王杰,等。线粒体蛋白质组学的比较研究揭示了小麦雄性不育的一个密切的蛋白质网络。J Exp Bot。gydF4y2Ba
谢海涛,万志强,李生,张勇。NADPH氧化酶时空生成活性氧对拟南芥绒毡层程序性细胞死亡和花粉发育至关重要。植物细胞,2014;26(5):2007-23。gydF4y2Ba
Rivera L, Lopez-Patino MA, Milton DL, Nieto TP, Farto R.有效的qPCR方法定量毒力基因的表达gydF4y2Ba沙门氏菌气单胞菌gydF4y2Ba。中华微生物学杂志,2015;18(4):792-802。gydF4y2Ba
饶旭,赖东,黄霞。一种实时定量聚合酶链反应数据分析新方法。计算机工程学报,2013;20(9):703-11。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Duncan E. Jackson博士对这篇文章的英文编辑。在此,我们非常感谢北京igeneCode生物科技有限公司对我们部分数据分析的帮助。gydF4y2Ba
资金gydF4y2Ba
高通量测序、编辑出版费用由国家自然科学基金(31771874)资助。资助机构没有参与研究的实验设计、数据收集、分析和解释,也没有参与撰写论文。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
XS, LZ和ZL构思和设计了这项研究。ZL进行了实验,分析了数据,并在所有作者的贡献下撰写了文章。XS, SL, WL和QL对这份手稿进行了修改和润色。所有作者已阅读并同意稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究不包含任何需要伦理同意或批准的研究。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1gydF4y2Ba
:gydF4y2Ba图S1。gydF4y2Ba雄蕊与雌蕊的比较gydF4y2Ba2gydF4y2Ba三核期IAMSLs和B706的-KI染色。A、G、B706;B和H, K706A;C和I, Va706A;D、J, Ju706A;E和K, C706A, F和L, U706A。A到F:花药。G到L:小孢子由IgydF4y2Ba2gydF4y2Baki染色。比例尺代表0.5毫米。gydF4y2Ba图S2。gydF4y2Ba不同表达水平基因数量及百分比分析。将基因表达的FPKM值分为0~1、1~5、5~30和30以上4个等级,并统计每个等级中基因的数量和百分比。gydF4y2Ba图S3。gydF4y2BaFPKM小提琴分布分析。横轴表示不同样本,纵轴表示对应样本FPKM。gydF4y2Ba图S4。gydF4y2Ba生物重复间的相关分析。横轴和纵轴表示每个样本。颜色表示相关系数,颜色越红,相关性越高,颜色越白,相关性越低。gydF4y2Ba图S5。gydF4y2Ba真核生物同源群(KOG)分类簇直方图。横坐标为基因数量,纵坐标为每个KOG分类内容。gydF4y2Ba图S6。gydF4y2Ba核心差异表达基因的GO注释分类。gydF4y2Ba图S7。gydF4y2Ba核心差异表达基因的GO富集分析。(A)细胞组分GO分类富集分析;(B)分子功能GO类富集分析;(C)生物过程GO类富集分析。gydF4y2Ba图S8。gydF4y2Ba品红模块中DEGs中KEGG富集的气泡图。gydF4y2Ba图S9。gydF4y2Ba洋红色模块中共表达基因的细胞景观表示。gydF4y2Ba图S10。gydF4y2Ba绒毡层细胞的截面积(A)和关键阶段TUNEL阳性细胞核/总细胞核比例(B)。gydF4y2Ba图S11。gydF4y2BaRT-qPCR与RNA-seq折叠变化数据的系数分析。RT-qPCR显示相对转录水平的数据为三个重复的平均值。通过RNA-seq (x轴)和RT-qPCR (y轴)的log2表达率生成散点图。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
用于RT-qPCR的序列特异性引物。gydF4y2Ba
附加文件3:表S2。gydF4y2Ba
测序结果的总结和评价。gydF4y2Ba
附加文件4:表S3。gydF4y2Ba
1281个核心基因的注释和FPKM。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘忠,李,S,李,W。gydF4y2Baet al。gydF4y2Ba比较转录组分析表明,一个核心转录网络介导小麦的同核异质雄性不育(gydF4y2Ba小麦gydF4y2Bal .)。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba10(2020)。https://doi.org/10.1186/s12870-019-2196-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2196-xgydF4y2Ba
关键字gydF4y2Ba
- 同核异质雄性不育gydF4y2Ba
- 花粉堕胎gydF4y2Ba
- Transcriptome-mediated网络gydF4y2Ba
- 转录组测序gydF4y2Ba
- 小麦gydF4y2Ba