摘要
背景
种子萌发对作物的生长发育至关重要,并最终影响作物的收成。种植植酸含量低、种子出苗率高的大豆比较困难。虽然额外的管理和选择可以克服phytate还原,种子萌发的机制仍不清楚。
结果
对两种低植酸(LPA)大豆突变体TW-1- m和TW-1进行了蛋白质组学比较分析GmMIPS1基因。tw1种子的田间出苗率明显低于tw1 - m种子。两个突变体在三个阶段共鉴定了282个差异积累蛋白(DAPs)。其中,下降累积80例,上升累积202例。生物信息学分析表明,鉴定出的蛋白与氧化还原、刺激和胁迫反应、休眠和萌发过程以及催化活性等功能有关。KEGG分析表明,这些DAPs主要参与能量代谢和抗应激通路。通过对2个LPA突变体3个萌发阶段DAPs和差异表达基因(DEGs)的联合分析,鉴定出30个具有不同模式的共享DAPs/DEGs,包括植物种子蛋白、β -淀粉酶、蛋白质二硫醚异构酶、抗病蛋白、焦磷酸果糖6-磷酸1-磷酸转移酶、半胱氨酸蛋白酶抑制剂、非特异性脂质转移蛋白、磷酸烯醇丙酮酸羧化酶和酰基辅酶A氧化酶。
结论
LPA大豆突变体种子萌发是一个非常复杂的过程。TW-1- m和TW-1表现出许多参与种子萌发的DAPs。这些蛋白质积累的差异可能导致两种突变体种子出苗率的差异。TW-1-M种子的高发芽率可能与活性氧相关基因和植物激素相关基因有关。这些结果将有助于我们进一步探索LPA作物的萌发机制。
背景
大豆具有丰富的蛋白质、油脂和卵磷脂、异黄酮、皂素等功能物质,是世界上最重要的经济作物之一。1].然而,大豆种子由于蛋白质和油脂含量高,在萌发和发育阶段容易受到内部损伤。因此,为了获得满意的产量,必须种植高出苗率的种子。在种子萌发和发育的不利环境条件下(如干旱、冰冻和盐胁迫),可显著降低种子的萌发率、活力和出苗率[1,2,3.,4]或随种子化学成分(例如植酸含量及脂肪酸组成)的变化而变化[5,6,7].因此,在改良种子生态和营养性状时应充分考虑种子萌发性状。有很多研究主要关注外部环境的破坏[2,3.,4].然而,根据营养和抗营养因子的变化来研究种子的内部损伤却很少被关注[5,7].
这有利于降低种子植酸含量,从而改善作物种子营养性状,降低水体磷含量。因此,需要在种子发育过程中产生phytate合成中断的作物[8,9,10].在过去的三十年中,许多低植酸作物通过使用不同的技术被开发出来。与野生型相比,这些作物的植酸含量均显著降低。不幸的是,其中一些也表现出种子萌发能力的下降,如大豆和水稻[5,7,11,12].这一不利性状阻碍了这些低植酸种质资源在作物育种中的应用。因此,改善低植酸作物品系的萌发特性仍有许多工作要做。我们开发了一种低植酸(LPA)大豆突变体Gm-lpa-TW-1 (TW-1),该突变体具有2 bp的缺失GmMIP1基因。tw1突变体田间出苗率较低,种子贮藏期间发芽率下降较快[13].tw1与其他商品大豆品种的杂交后代也表现出较低的种子出苗率。F1种子正常出苗。F2个人和F3.- f5不同品种的种子发芽率或多或少受到植酸含量的影响,其影响程度取决于不同的遗传背景(数据未显示)。利用哪些品种改善tw1种子大田出苗率性状,目前难以预测。幸运的是,我们发现一个自然突变系Gm-lpa-TW-1-M (TW-1- m)的田间出苗率高于其他tw1系。TW-1和TW-1- m的植酸含量分别为9.5和10.5 mg/g,远低于其亲本台湾-75 (14.5 mg/g)。虽然TW-1- m突变体和TW-1突变体的测序分析显示突变位点相同GmMIPS1TW-1-M的种子萌发能力显著增强,出苗率高,但两者的遗传背景非常相似。TW-1-M与其他商品大豆品种的后代也有正常的种子出苗率。因此,这一高发芽率LPA大豆新品系的形成机制值得深入研究。
大规模的基因表达分析为研究环境和遗传因素对种子萌发的影响提供了新的思路。对tw1 - m和tw1种子萌发时的转录本进行比较分析[14].在这两种突变体的每个阶段都鉴定出大约3900-9200个差异表达基因(DEGs) [14].TW-1- m和TW-1表达上调和下调的基因数量相当。与TW-1相比,TW-1- m突变体在乙烯合成方面的基因表达水平较低,而在种子萌发过程中的胁迫反应、能量代谢、抗氧化和赤霉素生物合成等方面的基因表达水平较高。TW-1-M具有较高的萌发率,这可能与抗氧化相关基因和激素相关基因的表达多样性有关[14].
提高LPA种子萌发需要基因表达的修饰,而编码的蛋白质需要通过蛋白质组学来决定基因的功能。几种蛋白质组学方法拓宽了探索种子萌发过程调控机制的知识[15,16].然而,目前关于LPA大豆萌发率低的蛋白质组学机制还知之甚少。在对大豆LPA性状进行遗传分析研究种子萌发的同时,蛋白质组学方法可以进一步揭示大豆LPA性状在蛋白质水平上的特征。因此,本研究旨在评估大量的蛋白质信息,并对差异积累的蛋白质和差异表达的基因进行联合分析。目的是研究LPA大豆种子萌发,并鉴定与种子萌发相关的候选基因。本研究采用等压标签相对和绝对定量(isobaric tag for relative and absolute quantification, iTRAQ)技术对两个LPA大豆突变体种子在不同萌发阶段的蛋白质组进行了研究。
结果
两个LPA突变体的种子萌发
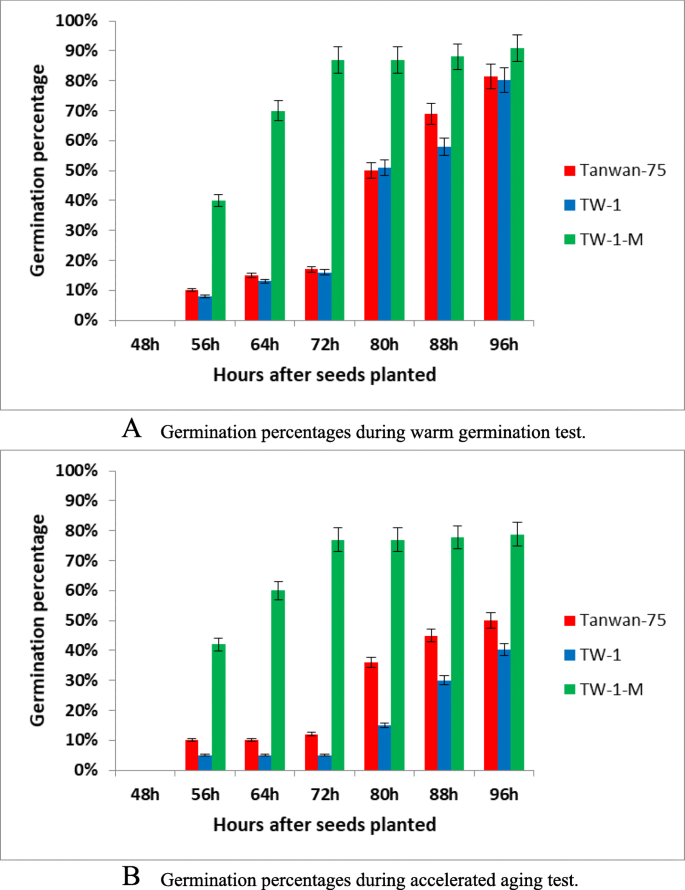
对TW-1- m、TW-1和台湾-75亲本的种子进行了加速老化和温萌发两种处理。通过测定种子发芽率和发芽率,分析种子发芽率。加速老化处理和温发芽处理的发芽率差异显著。TW-1- m在72 h左右发芽率最高,TW-1在96 h左右发芽率最高。台湾-75和TW-1在两种处理下的萌发速度相当。
在温萌发试验中,TW-1和台湾-75的发芽率相近,约为80%,但TW-1- m的发芽率约为90%,高于TW-1和台湾-75(图1- 75)。1a).在加速老化试验中,TW-1和台湾-75的发芽率分别为40和50%,但TW-1- m的发芽率较好,约为78%(图1- m)。1b).因此TW-1- m的种子萌发率显著优于台湾-75和TW-1。与TW-1相比,TW-1- m突变体具有更好的贮藏稳定性和萌发特性。TW-1- m、TW-1和Taiwan-75的现场出现也证实了这一结果(数据未显示)。
蛋白质序列覆盖,蛋白质鉴定和数据分析
利用基于itraq的定量蛋白质组学方法,对种子萌发过程中的蛋白质积累进行了高通量蛋白质组学分析。TW-1-M-1、TW-1-1、TW-1-M-2、TW-1-2、TW-1-M-3和TW-1-3每批样品分析,3个重复。在iTRAQ实验中,平均产生了320,584个频谱,其中94,932个频谱与已知频谱相匹配。3个批次的光谱鉴别率分别为27.65、32.39和28.57%。3批样品的平均肽段鉴定值为10146。在这三批中,包含至少两种独特多肽的鉴定蛋白数量分别为1205、1297和12341).3个批次检测到的蛋白数量分别为1694、1788和1803,共检测到877个蛋白(附加文件2:图S1)。
由iTRAQ鉴定dap
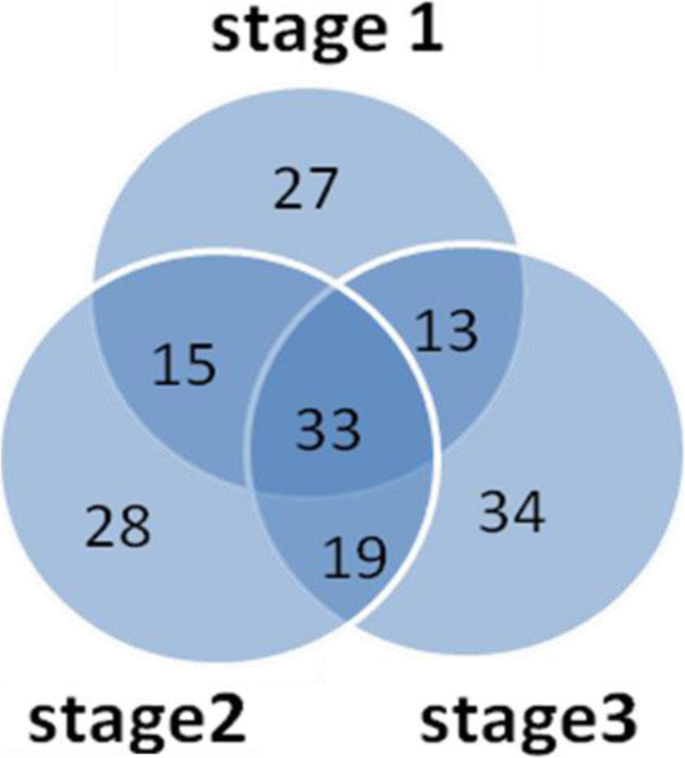
为了鉴定种子萌发过程中的差异积累蛋白(DAPs),我们对tw1 - m和tw1在每个阶段的iTRAQ数据进行了两两比较。为了分析累积蛋白差异的显著性,采用了两个标准:fold change > 1.2和P值< 0.05。结果发现,两个突变体在每个阶段共鉴定出282个DAPs。在TW-1-M-1和TW-1-1之间(TW-1-M-1 vs TW-1-1),有66个蛋白下降,22个蛋白上升。与TW-1-M-2相比,TW-1-2有64个蛋白下降,31个蛋白上升(TW-1-M-2 vs. TW-1-2)。在TW-1-3和TW-1-M-3之间,有72个蛋白下降,27个蛋白上升(TW-1-M-3 vs. TW-1-3)。在三个不同的萌发阶段中,下降积累的蛋白质数量始终多于上升积累的蛋白质数量,并且随着萌发阶段的深度,DAPs总数呈上升趋势(表3)2).此外,我们还对三个不同萌发阶段的DAPs进行了两两比较,在整个萌发过程中共有33个DAPs,在三个萌发阶段分别有27、28、34个特定DAPs(图2)。2).
对iTRAQ鉴定的DAPs进行生物信息学分析
在本研究中,大部分来自三个不同阶段的DAPs可分为三类:生物过程、细胞成分和分子功能。在生物学过程中,DAPs主要包括代谢过程、对刺激的反应过程、细胞过程和发育过程[14].在细胞成分方面,大部分DAPs涉及细胞、细胞部分和细胞器等类别。在分子功能方面,DAP的主要分类是催化活性、结合活性和养分库活性。在TW-1-M-3和TW-1-3数据库中出现了抗氧化活性的新类别,营养库活性类别中的5个蛋白质均有积累。所有这些类别包含了超过10%的累积蛋白质(附加文件2:图S2)。
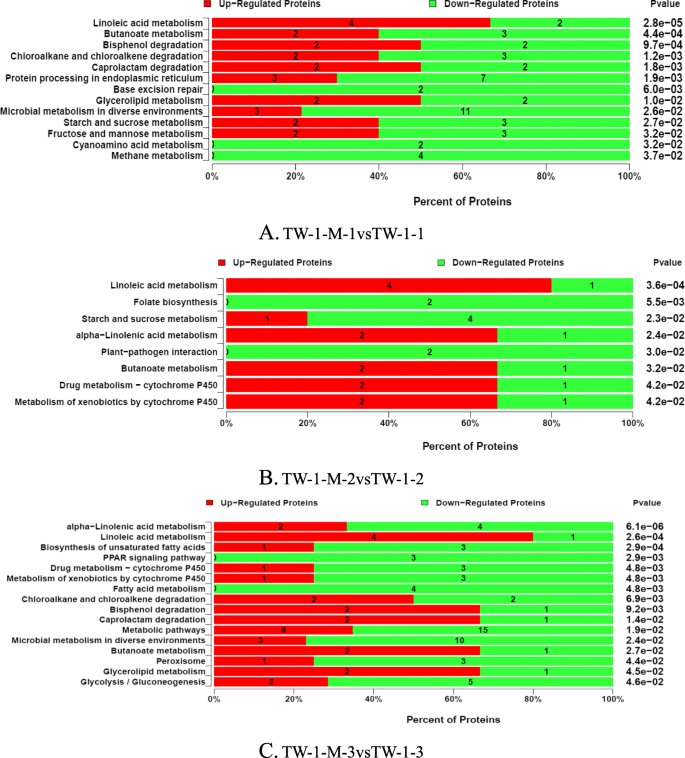
通过KEGG通路分析来阐明DAP的生物学功能。84个通路的DAPs在TW-1-M-1和TW-1-1阶段被发现。蛋白质数量最多的主要无方向调控途径为代谢途径(22个)、微生物在不同环境下的代谢途径(14个)、次生代谢物的生物合成(11个)和内质网蛋白质加工(10个)、糖酵解/糖异生(7个)、亚油酸代谢(6个)、丁酸代谢(5个)、氯烷烃和氯烯烃降解(5个)、淀粉和蔗糖代谢(5种蛋白质),果糖和甘露糖代谢(5种蛋白质)。在TW-1-M-2和TW-1-2阶段有61个通路导致差异。其中,代谢途径(20种)、微生物在不同环境下的代谢途径(10种)、次生代谢物的生物合成途径(8种)、内质网蛋白质加工途径(6种)、亚油酸代谢途径(5种)、淀粉和蔗糖代谢途径(5种)、糖酵解/糖异生途径(5种)的蛋白质数量最多。TW-1-M-3与TW-1-3的比较涉及到77个途径,其中蛋白质数量最多的途径为代谢途径(23个)、不同环境下微生物代谢途径(13个)、次生代谢物生物合成途径(13个)、糖酵解/糖异生途径(7个)、α -亚麻酸代谢途径(6个)、内质网蛋白质加工途径(6个)和亚油酸代谢途径(5个)(补充文件)1).KEGG结果表明,大部分DAPs参与了不同环境和能量代谢(包括碳水化合物、蛋白质和脂肪)途径的响应。
GO和途径富集分析
在这项研究中,GO术语被定义为显著丰富的P-值< 0.05则可分为生物过程、细胞成分和分子功能三个领域。在TW-1-M-1和TW-1-1数据库中,生物过程中富集最多的GO项为氧化还原(17个DAPs)、细胞对刺激和胁迫的反应(26个DAPs)和对脱落酸刺激的反应(7个DAPs),这些DAPs应该与种子萌发过程有关。TW-1-M-2和TW-1-2数据库中与种子萌发相关的GO项分别为冻结响应(7个DAPs)、水分响应(7个DAPs)、种子萌发(6个DAPs)、种子休眠(3个DAPs)和休眠过程(2个DAPs)。这些围棋术语属于生物过程范畴。在分子功能类别中,水解酶活性(19个DAPs)和催化活性(44个DAPs)是富集的GO项,可能与种子萌发有关。在具有生物过程的TW-1-M-3和TW-1-3中,富集的GO项分别为胁迫反应(40个DAPs)、温度刺激反应(22个DAPs)、生物刺激反应(18个DAPs)、寒冷反应(15个DAPs)和防御反应(15个DAPs)。在分子功能类别中,氧化还原酶活性(20 DAPs)是富集GO项。在整个萌发过程中,第3阶段参与萌发的DAPs最多,第2阶段以催化酶DAPs最多。这些生物学过程可能与种子萌发特性密切相关。(附加文件2).
同时对KEGG通路进行富集分析,并将通路定义为显著的DAPsP值< 0.05。亚油酸代谢是主要富集途径,其中含有6种DAPs。TW-1-M-1与TW-1-1阶段还存在丁酸代谢(5 DAPs)、双酚降解(4 DAPs)、淀粉和蔗糖代谢(5 DAPs)、果糖和甘露糖代谢(5 DAPs)。TW-1-M-2与TW-1-2之间存在亚油酸代谢、淀粉和蔗糖代谢、植物-病原菌互作和细胞色素P450通路。这些途径中含有26个与种子萌发有关的DAPs。在TW-1-M-3和TW-1-3数据库中,亚油酸代谢也是主要富集途径。与上述两个阶段相比,发现了一些新的途径,如甘油脂代谢、PPAR信号通路和糖酵解/糖异生。在这一阶段共发现了93个DAPs,这些DAPs可能与种子萌发有关(图1)。3.额外的文件3.).
DAPs和DEGs的联合分析
转录组学和蛋白质组学的结合为研究环境和遗传对种子萌发的影响提供了新的思路。因此,我们进一步研究了三个阶段(TW-1-M-1 vs TW-1-1, TW-1-M-2 vs TW-1-2, TW-1-M-3 vs TW-1-3) mRNA与蛋白谱的相关性。在蛋白质和mRNA水平上相关的基因数在三个阶段分别为9、8和13。这些deg和dap根据其在两个层次上的变化模式可分为三个集群。聚类I的蛋白质和基因模式也呈现相同趋势(3个DEGs/DAPs);Cluster II,基因变化与蛋白质水平相反(8 DEGs/DAPs);Cluster III,基因水平保持不变,蛋白水平发生显著变化(19个DAPs)(附加文件4).在每个阶段,只有一个基因与其蛋白质呈现相同的上调/下调趋势,它们是Glyma04g215900而且Glyma01g095000;第三期(TW-1-M-3 vs. TW-1-3)在蛋白和mRNA水平上相关基因最多。
这里有两个基因(Glyma01G119600而且Glyma01G095000)在所有三个阶段均被确定。根据Glyma01G119600基因中,RNA水平上调,蛋白水平下降。该基因被注释为一个小的亲水性植物种子蛋白,在功能上分为刺激应答和信号应答两类。另一个基因(Glyma01G095000)时,蛋白质水平在各阶段均呈上升积累趋势,而mRNA水平仅在第3阶段上调。这两种蛋白在萌发环境中表现出不同的调控机制。
在这两个阶段分别发现了6个基因。这些基因与碳水化合物代谢和应激反应有关。基因(Glyma06G301500在蛋白质水平上,与淀粉和蔗糖代谢相关的蛋白质在第一个阶段显著升高,而在第二个阶段显著降低。然而,它的RNA水平在两个阶段都下调。基因(LOC100800863)与果糖和甘露糖代谢相关的蛋白质水平在第2和第3阶段显著升高,但其RNA水平均下调。抗病基因(Glyma06G319700)在蛋白质水平上均有下降积累。相反,RNA水平在这两个阶段均上调。基因(Glyma06G114800在蛋白质水平上,与胁迫相关的蛋白质在第一个阶段呈显著的上升积累,而在第三个阶段呈显著的下降积累。
第一阶段有3个特异基因,主要与碳水化合物和蛋白质的合成代谢有关,在蛋白质水平上均呈下调积累,在RNA水平上均呈上调。在第二阶段发现了2个特异的基因,在响应刺激时进行功能分类,蛋白质水平下降。只有一种特殊基因(Glyma06G312800)在蛋白质水平上呈上升积累趋势。
总的来说,这些基因都与能量代谢或应激反应有关。然而,与蛋白质组数据中的蛋白质相比,这些转录组数据中的大部分基因表现出不同的调控水平和调控方向。mRNA和蛋白质积累谱之间的相关性可能是由于mRNA和蛋白质水平的差异调节。
酶活性分析
为了解TW-1和TW-1- m发芽种子的酶活性,对β -淀粉酶、磷酸烯醇丙酮酸羧化酶和蔗糖合酶的活性进行了分析。结果显示,TW-1-M-1的β -淀粉酶活性比TW-1-1高3.2倍,比TW-1-M-2和TW-1-2高5.6倍(图1-1)。4).TW-1-M-3和TW-1-3的β -淀粉酶活性都很低。与TW-1相比,TW-1- m第2、3期蔗糖合酶活性较低。两种突变体在第一阶段均未检测到蔗糖合酶活性。TW-1-3中磷酸烯醇化丙酮酸羧化酶活性最高。所有这些结果都与iTRAQ结果相关。
讨论
提高LPA作物种子萌发率在作物育种中具有重要意义。种子萌发是大量基因相互作用的结果,这些基因的表达模式是基因预先设定的,但可受环境影响而改变[14,17].
TW-1- m与TW-1的蛋白质组学分析
最近的蛋白质组学成果拓宽了种子萌发过程中生化和分子机制的知识[18,19].虽然许多广泛的研究都集中在大豆萌发性状上[7,11,12,20.],低植酸大豆萌发的分子机制仍有待进一步研究。为解释LPA种子萌发的分子机制,采用基于itraq的策略对萌发率差异显著的两个LPA大豆品系进行了蛋白质组学分析。结果表明,2个突变体在3个阶段共鉴定出282个DAPs,其中降累积的为80个,上升累积的为202个。分析表明,这些DAPs主要注释于生物和非生物胁迫和能量代谢过程官能团。KEGG分析表明,这些DAPs主要参与碳水化合物(蔗糖和脂肪酸)、能量代谢和抗应激途径。这些结果在一定程度上与之前关于其他植物的报告相一致,比如小麦[15)、大米(21,豌豆[22]及拟南芥[23].这些结果表明,植物激素和活性氧相关基因可能在种子萌发过程中起关键作用。
DAPs参与蛋白质的生物合成和代谢
高等植物种子萌发过程是一个复杂的过程,涉及种子吸胀、种子萌发和种子生长三个方面。这一过程所需的初始营养物质由种子中的储备物质转化而来[24].蛋白质和脂肪是大豆萌发过程中的主要贮藏物质。在我们的研究中,10个DAPs被标注为萌发期内质网蛋白加工的KEGG通路。在这些蛋白质中,一个大豆种子成熟蛋白cDNAGmPM31编码一类低分子量热休克蛋白。的GmPM31蛋白质可能是种子成熟特异性的,并编码定位于细胞质中的蛋白质[25],在TW-1-M-1中积累。
蛋白质二硫化物异构酶(PDI)编码真核生物内质网中的一种酶,并在新生蛋白质的内质膜氧化折叠中发挥主要作用,提供二硫化物键[26].GmPDIL (Glyma06G114800)在TW-1-1中积累,而其他GmPDI (Glyma04G215900)在TW-1-M-1中积累,表明其在蛋白质的构象稳定性和功能方面起着独立的作用。此外,这些蛋白质的差异积累可能与盐胁迫下种子萌发的活性机制有关[26,27].
氰氨基酸代谢途径包含两种DAPs,其中一种是丝氨酸羟甲基转移酶(Glyma05G152100),在TW-1-M-1呈下降累积。丝氨酸羟甲基转移酶(SHMT,EC 2.1.2.1)是一种普遍存在的酶,对所有生物的细胞一碳代谢必不可少,催化丝氨酸和甘氨酸的可逆转化。因此,它们为一系列生物合成过程提供了一个碳单元,如蛋氨酸、胸苷酸和嘌呤的合成[28,29,30.,31].
DAPs参与脂类生物合成和代谢
成熟大豆种子粗脂肪含量高达20%,主要为种子萌发提供能量[32].亚油酸代谢途径是大豆种子萌发期最常见的代谢途径。tw1 - m中脂氧合酶是最常见、最清晰的蛋白质,能催化多不饱和脂肪酸的双氧,且在萌发阶段脂氧合酶的含量一直在增加。之前的研究表明OsLOX2过表达水稻种子经过老化处理后发芽率较低,但在正常条件下发芽较快[33].此外,脂氧合酶的高活性可以为种子萌发提供更多的能量。此外,TW-1-M-3中磷酸烯醇化丙酮酸羧化酶(phosphoenololpyruvate carboxylase)有下降积累,此前有报道称该酶参与油脂的合成和代谢[34].
DAPs参与碳水化合物代谢
虽然大豆种子中的碳水化合物含量远低于蛋白质和粗脂肪,但由于其分子结构简单,在代谢中更容易被利用[5,7].在种子萌发和幼苗生长初期,支持这些生物过程的能量主要来自种子本身的碳储备,而这些碳储备的主要形式是蔗糖和果糖[35].本研究中含有DAPs的途径大多与能量和碳水化合物代谢有关,如淀粉和蔗糖代谢途径、果糖和甘露糖代谢途径、糖酵解/糖异生途径等。联合分析还表明,一些共享的DEGs/DAPs与碳水化合物代谢相关的途径相关。这些蛋白质可能提供能量、转译信号或参与抗氧化过程。在种子萌发过程中,碳水化合物代谢的增强会加速储备水解并影响蛋白质的生物合成[36,37].
许多DAPs与碳水化合物代谢相关,如α -1,4葡聚糖磷酸化酶(代表了一种可用于合成直链长达80个或更多残基的可靠系统,同时保持对链长度的控制)[38,葡萄糖-6-磷酸异构酶(催化葡萄糖-6-磷酸和果糖-6-磷酸的可逆异构化,该反应也立即先于植物蔗糖的生物合成)[39],焦磷酸盐-果糖6-磷酸1-磷酸转移酶(催化果糖-6-磷酸和果糖-1,6-二磷酸之间的可逆相互转化,这是调节主要碳水化合物代谢通量向糖酵解或糖异生的限速步骤)[40],蔗糖合酶(催化依赖udp的蔗糖裂解成udp -葡萄糖和果糖)[41]和-淀粉酶(在聚葡聚糖链的非还原性末端切割α-1,4糖苷键以产生麦芽糖)[42]。这些上调/下调的基因对种子萌发过程有一定的贡献。这些LPA突变体的转录谱分析还表明,一些高表达和富集的基因与碳水化合物的生物合成和代谢途径相关[14].结果表明,LPA大豆突变体的萌发特性与碳水化合物代谢密切相关。这些发现与其他植物的结果一致[43,44].此外,我们发现这些DAPs在高发芽率的TW-1-M中没有特殊的调控趋势,这意味着每个蛋白对种子萌发过程的调控方式是独立的。
DAPs对压力的反应
在过氧化物酶体萌发末期的KEGG通路上标注了4个DAPs (TW-1-M-3 vs. TW-1-3)。其中2个蛋白被标注为茉莉酸(jasmonic acid, JA)生物合成所需的过氧化物酶体3-酮acy1- coa。这两种蛋白在TW-1-M-3中均呈下降积累。之前的研究表明,JA的合成对于抵抗雄性生殖功能和咀嚼昆虫是必不可少的,因此不同类型的生物胁迫可能通过不同的酶途径诱导JA的合成[45].
TW-1-M-1的半胱氨酸蛋白酶抑制剂(CPI)蛋白水平显著下降。研究表明,参与植物对环境胁迫反应的cpi表现出不同的表达模式[46].例如,的表达式AtCYS6,由萌发抑制植物激素ABA诱导,抑制半胱氨酸蛋白酶活性,调节种子萌发和幼苗生长[47].研究还表明半胱氨酸抑制素可能是植物发育过程中对寒冷和干旱胁迫的响应[48,49].
非特异性脂质转移蛋白(NsLTP)促进脂肪酸、磷脂和类固醇在膜间运输的作用在TW-1-M-3中下降。研究表明,辣椒的过度表达CALTP1基因增强了拟南芥对NaCl和干旱胁迫的耐受性[50].另一项研究表明OsLTPL36可能在调节种子发育和萌发中起重要作用[51].
我们还发现了许多标记为未表征蛋白质的DAPs。它们的功能大多可以分为对刺激的反应。结果表明,两种LPA突变体的萌发过程与生物胁迫或非生物胁迫诱导的某些过程相似。具有高发芽率的TW-1-M突变体可能有更多的调控机制来应对大豆种子中phytate水平的降低。
DAPs对活性氧和植物激素的响应
TW-1- m和TW-1的比较转录本分析表明,活性氧物种相关基因和植物激素相关基因的表达多样性可能是TW-1- m成功萌发的重要原因[14].在我们的研究中,DAPs也被确定与活性氧和植物激素有关。
一些DAPs被确定能够维持氧化平衡并减少对多种细胞成分的氧化损伤,如dna、蛋白质和脂质[52,53].在这些DAPs中,发现了3种蛋白质,包括酰基辅酶A氧化酶、过氧化物酶-3-酮酰基辅酶A硫代酶和谷胱甘肽-s转移酶。这些酶在脂质转运和代谢中都起着非常重要的作用。此外,TW-1中积累较多的抗坏血酸过氧化物酶在萌发早期具有调节氧化状态,维持种子活力的作用[54].在TW-1和TW-1- m中发现的积累趋势不同的细胞色素P450家族是一个介导多种氧化反应的大群体[55].鉴定出一些与黄酮类代谢相关的DAPs,如异黄酮还原酶。这些蛋白参与大豆异黄酮的生物合成,异黄酮被认为是大豆种子中的抗氧化化合物。
种子萌发受内在和环境信号的控制,主要受植物激素的调控,如赤霉素(GA)和脱落酸(ABA) [16].但本研究未发现与GA和乙烯相关的DAPs。这可能与大规模蛋白质组分析的检测极限有关。我们发现了三种参与ABA代谢和信号转导的DAPs,如AtCYS6这在DAPs对压力的反应中也被检测到。这3种蛋白在TW-1- m中的积累水平低于TW-1,这可能是TW-1- m萌发率高的原因。这一发现与转录分析结果一致[14].
DAP/DEG的联合分析
将来自转录组数据的DEGs和来自蛋白质组数据的DAPs对三个不同阶段的样本进行组合,以更好地了解差异。由于转录组和蛋白质组数据均来自同一样本,因此应减少mrna -蛋白相关性上的分歧。在转录谱分析中,涉及抗胁迫过程和能量代谢的定量蛋白以及许多与非生物和生物胁迫相关的DEGs被探索得最多。然而,他们的监管方向几乎相反。此外,一些基因的mRNA和蛋白变化甚至不相关。因此,蛋白质的积累可能依赖于生物系统中的多种代谢和调节途径[56].
通过对DAPs和DEGs的联合分析,在2个LPA大豆突变体的3个萌发阶段共鉴定出30个表达模式不同的DAPs/DEGs。虽然在mRNA和蛋白质水平上相关的基因数量有限,但我们仍然对那些具有共同方向的mRNA和蛋白质感兴趣。结果显示,3种mrna /蛋白呈方向相关,8种mrna /蛋白呈负相关。基因组和蛋白质组的调控机制非常复杂,mRNA水平的转换和稳定对mRNA翻译成蛋白质非常重要[57,58].例如,基因(Glyma01G119600)是一个小的亲水性植物种子蛋白,其mRNA水平升高,而蛋白质水平降低,这表明可能是蛋白质降解增加导致了诱导转录。未来的研究旨在从RNA和蛋白质水平对这些特定基因进行研究,将进一步深入了解LPA作物的萌发过程。
结论
该蛋白积累谱将为研究LPA突变体的萌发机制提供重要的贡献。在这两个突变体的三个阶段中,发现了282个DAPs。其中,下降累积80个,上升累积202个。生物信息学分析表明,鉴定出的蛋白与氧化还原、刺激和胁迫反应、休眠和萌发过程以及催化活性等功能有关。KEGG分析表明,这些DAPs主要与能量代谢(如碳水化合物代谢和脂肪代谢)和抗应激途径有关。此外,通过对2个LPA大豆突变体3个萌发阶段不同表达模式的DAPs和DEGs的联合分析,鉴定出30个共有的DAPs/DEGs。这些蛋白包括植物种子蛋白、β -淀粉酶、蛋白质二硫醚异构酶、抗病蛋白、焦磷酸果糖6-磷酸1-磷酸转移酶、半胱氨酸蛋白酶抑制剂、非特异性脂质转移蛋白、磷酸烯醇丙酮酸羧化酶和酰基辅酶A氧化酶。TW-1- m和TW-1具有多个参与种子萌发的DAPs。这些蛋白质的差异积累对LPA突变体的萌发特性有很大的贡献。活性氧相关蛋白和植物激素相关蛋白积累的多样性可能是TW-1-M种子成功萌发的重要原因。 These findings would help us further explore the mechanisms of seed germination in LPA crops.
方法
植物材料
将本实验室培育的大豆LPA突变体Gm-lpa-TW-1- m (TW-1- m)和Gm-lpa-TW-1 (TW-1)进行种植,测定大豆LPA蛋白积累量。TW-1是利用商业品种台湾-75的γ辐照产生的。TW-1- m从TW-1突变体中筛选得到。TW-1- m和TW-1均有2 bp的缺失GmMIPS1基因突变位点相同,植酸含量水平相当。种子样本于2016年在中国杭州的研究领域采集。
为了更好地了解和比较TW-1- m和TW-1突变体在种子萌发时的积累差异,我们选取了3个个体阶段进行进一步分析,分别为:1)浸渍24 h左右的种子吸收期,命名为TW-1- m -1和TW-1-1, 2)浸渍30 h左右的种子吸胀至胚根出的代谢再激活期,命名为TW-1- m -2和TW-1-2,3)萌发1 mm长主根,对应种子浸泡36 h左右,命名为TW-1-M-3和TW-1-3 [14].为了尽量减少环境影响,在每个阶段收集三组平行样品,用于提取蛋白质进行生物重复。
发芽试验
为了评价这两种LPA品系萌发能力的差异,按照Yuan等人的方法,分别进行了温萌发和加速老化两种不同处理的萌发实验[13].每个处理中,两个LPA突变体(TW-1- m和TW-1)及其野生型亲本(taiwan -75)各100粒种子,3个重复。
蛋白质制备
用研钵和研杵将约0.5 g冷冻种子样品在液氮中磨成粉末。用200 μl溶出缓冲液(50 mM三乙基碳酸氢铵(TEAB), 8 M尿素,pH为8)悬浮细粉。用超声波破碎15 min, 4℃,12000 r/min离心10 min。上清液与含10 mM二硫苏糖醇(DTT)的冰冷丙酮800 μl, 4℃混合2 h。4°C, 12000 r/min离心10 min。蛋白沉淀用冷丙酮洗涤3次,离心真空蒸发30min。干燥后的沉淀用100 μl溶解缓冲液溶解。使用BCA蛋白测定试剂盒(Thermo Scientific, USA)测定总蛋白浓度。每种蛋白样品各取100微克,用溶出缓冲液溶解至总积100 μl,然后用50 mM NH稀释500 μl4HCO3..还原烷基化后,加入2 μg胰蛋白酶,37℃孵育消化过夜。加入三氟乙酸(FA)至终浓度0.1%,停止消化。在美国Phenomenex公司的Strata-X C18柱上纯化多肽,离心真空蒸发干燥。干燥后的多肽用20 μl 0.5 M TEAB重新溶解,用iTRAQ Reagent-8PLEX Multiplex kit (AB Sciex, UK)进行标记。TW-1-1、TW-1-2、TW-1-3、TW-1-M-1、TW-1-M-2和TW-1-M-3的样品分别标记为113-tag、114-tag、115-tag、116-tag、117-tag和118-tag。接下来,使用Durashell C18 (5 um, 100 a, 4.6 × 250 mm)的高效液相色谱系统(Thermo DINOEX Ultimate 3000 BioRS)对标记的样品进行分馏。最后采集12个馏分。
质/ MS分析
将TW-1-1、TW-1-2、TW-1-3、TW-1-M-1、TW-1-M-2和TW-1-M-3标记样品等量混合,采用DINOEX Ultimate 3000 BioRS高效液相色谱体系(Thermo Scientific, USA)在Durashell C18色谱柱(4.6 × 250 mm, 5 μM, 100 a)上进行分馏分。数据在TripleTOF 5600 plus系统(AB SCIEX, UK)上收集,采用2 - 30%的90分钟梯度,缓冲液a (0.1% (v/v)甲酸,5% (v/v)乙腈)和缓冲液B (0.1% (v/v)甲酸,95% (v/v)乙腈)。母离子扫描范围为350-1500 m/z,扫描时间为250 ms,在50-2000 m/z范围内收集20个电荷态为2-5的最强烈母离子的ms / ms谱,扫描时间为100 ms。TW-1-1, TW-1-2, TW-1-3, TW-1-M-1, TW-1-M样品−2和TW-1-M-3为3个重复,6个样品的每个重复为一批运行(LC-BIO TECH,杭州,中国)。
数据解释,差异累积蛋白(DAPs)分析
用ProteinPilot软件v4.5检索MS/MS原始数据,参数如下:iTRAQ定量;胰蛋白酶消化;碘乙酰胺修饰半胱氨酸;背景校正和偏差校正检查;生物修饰作为ID焦点;Uniprot大豆作为数据库。采用PSPEP (Proteomics System Performance Evaluation Pipeline Software,集成于ProteinPilot Software)算法,采用诱饵数据库自动搜索策略计算假发现率(FDR)。未使用评分超过1.3(置信水平> 95%)且至少有一个独特的肽被考虑进行进一步分析。对于归一化后的蛋白质丰度比,aP-值小于0.05,以1.2倍变化为阈值比较显著变化。e值设置为小于1e-5。为GO词匹配选择每个查询的最佳命中。GO项匹配使用blast2go v4.5 pipeline5进行。利用COG (Clusters of Orthologous Groups, COG)来注释基因功能。我们还进行了超几何测试,分析GO富集和KEGG通路富集。
DEGs和DAPs的联合分析
从转录组数据集收集登录号,然后与注释的iTRAQ数据库进行比较,以联合分析DAPs和DEGs [59].转录组测序结果用于编码序列。然后,从蛋白质组学数据集的登录号也被用来搜索相同的编码序列数据库。最后得到dpa和DEGs的联合数据集。我们设置∣足球俱乐部∣> 1.2,P< 0.05和∣足球俱乐部∣> 2, P < 0.05为提取DEGs和DAPs子集的阈值。
酶活性分析
分别用β -淀粉酶(AMS)检测试剂盒、磷酸烯醇式丙酮酸羧化酶(PEPC)检测试剂盒和蔗糖合酶检测试剂盒(中国南京建成)检测β -淀粉酶、磷酸烯醇式丙酮酸羧化酶和蔗糖合酶活性。检测方法按照各自的规程,在3个生物重复的试剂盒中进行。每个生物重复设3个技术重复。
数据和材料的可用性
质谱蛋白质组学数据已存放在ProteomeXchange财团(http://proteomecentral.proteomexchange.org)通过iProX合作伙伴库[60],并使用数据集标识符PXD012808。
参考文献
- 1.
田晓山,中崎T,石川G, Yagasaki K, Yamada N, Hirota N, Hirata K, Yoshikawa T, Saito H, Teraishi M, Okumoto Y, Tsukiyama T, Tanisaka T. QTL分析)稳定)。植物科学。2009;176(4):514 - 21所示。
- 2.
干旱胁迫下大豆根系(包括下胚轴)的蛋白质组学分析。蛋白质组学。2016;144:39-50。
- 3.
田欣,刘勇,黄智,段辉,童军,何旭,顾伟,马慧,肖玲。耐冷性与敏感性春大豆品种幼苗叶片蛋白质组学比较分析。Mol Biol rep 2015;42(3): 581-601。
- 4.
余伯杰,于伯杰。慢生根瘤菌接种甘氨酸max和甘氨酸大豆幼苗根系盐胁迫响应机制的蛋白质组学研究植物生长规律。2017;37(1):1 - 12。
- 5.
Spear JD, Fehr WR。低植酸大豆系出苗的遗传改良。作物科学。2007;47(4):1354 - 60。
- 6.
孙强,王建华,孙伯强。种子活力生理与遗传机制研究进展。中国农业科学。2007;6(9):1060-6。
- 7.
刘志强,刘志强,刘志强。种子源效应对植酸盐和棉子糖含量降低大豆品种田间出苗的影响。作物科学。2003;43(4):1336 - 9。
- 8.
杨佳,杨志强,杨志强,杨志强。种子磷和植酸的遗传育种。植物生理学报。2001;15(4):491 - 496。
- 9.
夏普利·安,Chapra SC, Wedepohl R, Sims JT, Daniel TC, Reddy KR.保护地表水的农业磷管理:问题和选择。环境科学学报。2008;23(3):437-51。
- 10.
5 .种子植酸与总磷工程的研究方法与挑战。植物科学。2009;177(4):281 - 96。
- 11.
刘志强,刘志强,刘志强,等。低植酸磷大豆系的农艺性状和种子性状。作物科学。2005;45(2):593 - 8。
- 12.
黄晓明,刘志强。4个独立的低植酸突变对大麦农艺性能的影响。作物科学。2006;46(3):1318 - 22所示。
- 13.
袁凤军,赵海军,任晓林,朱淑玲,付晓军,舒启勇。大豆中两个新的低植酸突变(Glycine max L. Merr.)的产生和特征。浙江大学学报(自然科学版)2007;15(7):945-57。
- 14.
袁富杰,于晓明,董德凯,杨庆华,付晓军,朱淑玲,朱德华。两种大豆低植酸突变体种子萌发相关差异表达基因的全基因组转录分析植物学报,2017;17(1):16。
- 15.
何明,朱超,董凯,张涛,程志伟,李jr,颜永明。胚胎和胚乳的比较蛋白质组分析揭示了参与小麦种子萌发的中枢差异表达蛋白。植物学报,2015;15(1):97。
- 16.
Holdsworth MJ, Bentsink L, Soppe WJJ。调控拟南芥种子成熟、后熟、休眠和萌发的分子网络。新植醇。2010;179(1):33-54。
- 17.
Wilman V, Campbell EE, Potts AJ, Cowling RM。萌发要求与环境条件的不匹配:亚热带旱生灌丛冠层物种的生态位保守性。植物学报。2014;92(1):1 - 6。
- 18.
邓志勇,龚成成,王涛。利用蛋白质组学研究水稻种子发育。蛋白质组学,2013;13(12 - 13):1784 - 800。
- 19.
陈宝成、林永盛、刘世安经济作物蛋白质组学研究综述。蛋白质组学。2017;169:176 - 88。
- 20.
王曼丽,夏娥,王曼丽,陈培,安永强。不同油脂成分和含量大豆系转录本多态性的鉴定与表征BMC基因组学。2014;15:299 - 315。
- 21.
何丹,韩超,杨萍,等。发芽水稻基因表达谱的变化。中国生物医学工程学报。2011;33(3):335 - 335。
- 22.
Kranner I, Roach T, Beckett RP, Whitaker C, Minibayeva FV。豌豆种子萌发和幼苗早期生长过程中活性氧的细胞外产物。植物生理学报。2010;32(3):393 - 393。
- 23.
肖伟,刘超,侯昕,于洪。拟南芥tr1和TFL1基因调控种子萌发的负反馈环调控ABA信号。植物细胞。2010;22:1733-48。
- 24.
黄晓明,李志刚。绿豆种子萌发过程中子叶差异蛋白的蛋白质组学研究。植物学报。2012;34(6):2379-91。
- 25.
周泰,林泰,邢永昌。大豆种子成熟蛋白cDNA GmPM31 (Accession No. 1)AF117885)编码I类低分子量热休克蛋白。(pgr99 - 177)。植物杂志。1999;121(4):1383。
- 26.
黄晓燕,黄晓燕,黄晓燕,等。大豆内质网膜结合蛋白二硫醚异构酶家族蛋白GmPDIL7的鉴定与鉴定。2月j . 2017; 284(3): 414 - 28。
- 27.
王XX,李勇,唐景文,欧阳斌斌,朱DJ,徐志明。盐胁迫下燕麦种子萌发过程蛋白质分析。Acta Agriculturae Boreali-Sinica。2015; 30:48-53。
- 28.
丝氨酸羟甲基转移酶。生物化学。1982;53:83-112。
- 29.
马修斯RG,德拉蒙德JT。为生物甲基化提供一个碳单元:丝氨酸羟甲基转移酶、亚甲基四氢叶酸还原酶和亚甲基四氢叶酸-同型半胱氨酸甲基转移酶的机理研究。化学启1990;90(7):1275 - 90。
- 30.
杨志强,刘志强。甘氨酸脱羧的基因调控。中国地质大学学报(自然科学版)2003;
- 31.
Schirch V, Szebenyi DM.丝氨酸羟甲基转移酶再访。中国生物医学杂志2005;9(5):482-7。
- 32.
郭丽,霍GC。发芽大豆的生化特性及营养变化。粮油科技。2002;10:8-10。
- 33.
黄建新,蔡明华,龙启洲,刘丽丽,林启宇,江玲,陈世盛,万金明。水稻I型脂氧合酶OsLOX2对种子萌发和寿命具有相反的作用。转基因研究》2014;23(4):643 - 55。
- 34.
王福林,吴桂,郎春霞,刘若然。异聚乙酰辅酶A羧化酶(ACCase)基因转化对油菜籽粒含油量的影响。Fenzi Zhiwu Yuzhong. 2017; 15:920-7。
- 35.
周文贵,陈峰,赵世强,杨长青,孟yjj,帅华伟,罗晓峰,戴雅娟,尹慧,杜建华,刘杰,范国强,刘文贵,杨文英,舒凯。DA-6通过介导脂肪酸代谢和糖代谢促进衰老大豆种子萌发和成苗。中国生物医学工程学报2019;70:101-14。
- 36.
金晓林,杨荣强,郭丽萍,王晓坤,颜晓坤,顾志贤。柠檬酸钠、乙酸钠和酒石酸钠处理低植酸绿豆芽的iTRAQ分析。食品化学。2017;218:285 - 93。
- 37.
李志强,李志强,李志强,等。碳水化合物储量与种子发育研究进展。植物天线转换开关。2018;31:263 - 90。
- 38.
尼尔·ECO,战地文学士。利用糖苷磷酸化酶进行酶促合成。Carbohydr杂志2015;403:23-37。
- 39.
黄晓燕,李晓燕。玉米中葡萄糖-g-磷酸异构酶的厌氧诱导cDNA的克隆和特性分析。植物杂志。1995;108:1295-6。
- 40.
段娥,王云华,刘丽丽,朱太平,钟美玲,张慧,李顺丰,丁宝霞,张欣,郭晓平,姜玲,万金明。焦磷酸盐:果糖-6-磷酸1-磷酸转移酶(PFP)调节水稻灌浆过程中的碳代谢。Plant Cell rep 2016; 35:1321-31。
- 41.
刘志强,刘志强,刘志强,刘志强。植物生理与发育研究进展。桑德兰:Sinauer Associates;2014.
- 42.
刘志强,刘志强,刘志强,刘志强。陆生植物β -淀粉酶基因家族功能复杂性的进化研究。BMC Evol Biol. 2019; 19:66-78。
- 43.
Silva AT, Ligterink W, Hilhorst HWM。代谢物分析和相关基因表达揭示了拟南芥种子到幼苗转化过程中的两种代谢转移。植物化学学报,2017;
- 44.
梅梅,陆晓军,张晓林,刘gl,孙晓明。三叶白玉兰种子萌发过程中碳水化合物的变化及相关差异蛋白的筛选。2017;31:63-75。
- 45.
Schilmiller AL, Koo AJK, Howe GA。酰基辅酶a氧化酶在茉莉酸生物合成和作用中的功能多样化。植物杂志。2007;143(2):812 - 24。
- 46.
张欣,刘松,高野涛。拟南芥两种半胱氨酸蛋白酶抑制剂AtCYSa和AtCYSb对盐、干旱、氧化和耐寒性的影响。植物化学学报。2008;24(3):393 - 393。
- 47.
黄济,洪jk, JE JH, Lee KO, Kim DY, Lee SY, Lim CO. .拟南芥植物胱抑素亚型AtCYS6对种子萌发和幼苗生长的调控。植物学报,2009;28(4):323 - 329。
- 48.
Diop NN, Kidric M, Repellin A, Gareil M, D 'Arcy-Lameta A, Pham Thi AT, Zuily-Fodil Y.干旱胁迫对豇豆多菌毒素的诱导作用Walp)。树叶。2月。2004;577(3):545 - 50。
- 49.
马松诺A,康达明P,威斯涅夫斯基JP,泽维M,罗戈斯基总理。玉米半胱氨酸抑制素对发育信号、冷胁迫和干旱的响应。生物物理学报。2005;1729(3):186-99。
- 50.
Sarowar S, Kim YJ, Kim KD, Hwang BK, Ok SH, Shin JS。脂质转运蛋白(LTP)基因的过表达增强了烟草对植物病原的抗性,并在烟草的长距离系统信号转导中发挥作用。植物学报2009;28(3):419 - 427。
- 51.
王旭,周伟,卢智,欧阳东德,CS O,姚金龙。水稻种子的脂质转运蛋白OsLTPL36是水稻种子发育和品质所必需的。植物科学。2015;239:200-8。
- 52.
海滨蒿种子衰老过程中parhey S, Naithani SC, Keshavkant S. ROS的产生与脂质分解代谢。植物生理化学。2012;57:261-7。
- 53.
陈强,杨玲,阿末P,万欣,胡欣,等。抗逆性茶叶种子干燥过程中氧化还原状态变化的组学分析。足底。2011;233:583 - 92。
- 54.
陈C, Letnik I, Hacham Y, Dobrev P, Ben-Daniel BH, Vankova R, Amir R, Miller G.抗坏酸过氧化物酶6对拟南芥种子干燥和萌发具有保护作用,并介导ROS、ABA和生长素之间的相互作用。植物杂志。2014;166:370 - 83。
- 55.
陈浩,王富伟,董远扬,王宁,孙亚萍,李学勇,刘玲,范晓东,尹海林,井远扬,张学勇,李丽丽,陈刚,李海燕。大豆种子发育过程中脂质合成相关差异表达基因的序列挖掘和转录分析。植物医学杂志。2012;12:122-36。
- 56.
Esteve C, D’amato A, Marina ML, García MC, Righetti PG.利用组合肽配体库对香蕉(Musa spp.)果实蛋白质组学的深入分析。电泳。2013;34(2):207 - 14所示。
- 57.
植物中rna -蛋白质相互作用的全基因组分析。方法中国生物医学杂志2009;53:13 - 37。
- 58.
刘曾J,刘Y,刘W X,刘F,黄P,朱P,陈J,施M,郭F,程P,曾庆红J,廖Y,龚J,张H,王D,郭,熊X集成的转录组、蛋白质组和代谢数据揭示了生物碱的生物合成在Macleaya cordata和Macleaya microcarpa。《公共科学图书馆•综合》。2013;8 (1):e53409。
- 59.
基因表达:转录组到蛋白质组,再回到基因组。《科学通报》。2011;12(8):518。
- 60.
马军,陈涛,吴顺丰,杨春春,白茂忠,舒克贤,李坤林,张国强,金智,何fc, Hermjakob H,朱永平。iProX:整合的蛋白质组资源。中国生物医学工程学报2019;47:D1211-7。
确认
不适用。
资金
本研究由国家重点研发计划(No. 2017YFD0101505)和浙江省农作物育种科技重大专项(No. 2016C02050-10)资助。资助机构支持这项研究、数据分析和手稿的撰写。
作者信息
从属关系
贡献
XY进行统计分析并撰写稿件。HJ参与了数据分析,并帮助起草了稿件。XF参与了突变体的种植和材料收集。QY进行了种子萌发试验。FY设计了研究并起草了手稿。所有作者已阅读并批准本手稿。
相应的作者
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
额外的文件1。
这三个阶段蛋白质数量最多的主要调控途径(无方向)。
额外的文件2。
三个阶段的富集GO项。
额外的文件3。
三个阶段的KEGG通路富集。
额外的文件4。
mRNA与蛋白质在这三个阶段的相关性。
附加文件5:图S1。
维恩图显示了三个批次中确定的蛋白质重叠。
附加文件6:图S2。
种子萌发期DAPs的功能分类。答:DAPs的功能分类在TW-1-M-1和TW-1-1之间。B: DAPs在TW-1-M-2和TW-1-2之间的功能分类。C: DAPs在TW-1-M-3和TW-1-3之间的功能分类。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
余旭,金华,付旭。et al。大豆低植酸突变体的定量蛋白质组学分析BMC植物杂志19,569(2019)。https://doi.org/10.1186/s12870-019-2201-4
收到了:
接受:
发表:
关键字
- 大豆
- 低植酸
- 领域出现
- 发芽
- 蛋白质组学