摘要
背景
锌(Zn)缺乏是影响水稻产量的最普遍的土壤制约因素之一,但调控锌缺乏反应的分子机制仍然有限。本研究旨在通过整合Illumina高通量小RNA测序和转录组测序,综合分析水稻幼苗缺锌和补锌下的miRNA和mRNA表达谱,了解水稻缺锌反应的分子机制。
结果
所述转录组测序鉴定了被差异在缺锌水稻幼苗的芽和根中表达的基因360和Zn补给后回收其中97。总共68种miRNA被鉴定为下缺锌和/或Zn补给被差异表达。miRNAome所述的集成分析和转录组数据表明,12组差异表达的基因是10 Zn的响应的miRNA如miR171g-5P,miR397b-5P,miR398a-5P和miR528-5p潜在靶基因。被选择用于通过定量RT-PCR验证某些miRNA基因和差异表达的基因,它们的表达均类似于测序结果的。
结论
这些结果提供深入了解在锌缺乏响应miRNA介导的调控途径,并为水稻缺锌宽容的遗传改良提供候选基因。
背景
锌是一种重要的微量营养素,对植物和动物中的许多酶和调节蛋白起催化、调节或结构辅助因子的作用[1].植物中常见的含锌蛋白包括碳酸酐酶、醇脱氢酶、铜/锌超氧化物歧化酶等酶,以及大量的含锌手指结构域蛋白,它们的功能是转录调控[1,2].缺锌(-Zn)是在可耕地中一个严重的农业问题全世界由于由因素如高pH,长时间驱,低氧化还原电位,和碳酸氢根的高含量,有机物和磷[引起的Zn的低可用性3.].土壤和植物缺乏锌也会导致人类营养不良,因为人们摄入的食物中含有低浓度的锌和其他微量营养素[4].据估计,人口的三分之一,特别是儿童和女性患有Zn缺乏症相关的健康问题[5].因此,研究植物对锌缺乏的反应和耐受机制,有助于培育锌利用效率、锌浓度和锌缺乏耐受性提高的作物[4,6,7,8].
大米(奥雅萨苜蓿)是第二大种植的作物,是世界上30亿人的主要主食。然而,缺锌正成为影响水稻产量的最普遍的土壤制约因素之一[9,10.].已经提出了很多效果来阐明与Zn缺乏症响应和植物耐受相关的生理生化机制[11.,12.,13.].这些机制包括通过调整根系结构,释放植物细胞和有机酸来增加根吸收的Zn可用性,以及形成丛枝菌根共生的形成[6,14.,15.];扩大树冠根的生长量[16.];转运蛋白如Zrt,IRT相关蛋白质(拉链),金属耐受蛋白和重金属耐受家庭蛋白质中的转运蛋白(Zn摄取和易位)[17.,18,19,20.,21];调节需要锌酶的表达[2,13.].最近,转录组学分析鉴定了植物中的锌响应基因[22,23,24].据报道,在Zn缺乏症下,Zn高效水稻品种中调节的四种基因是赋予Zn效率的候选基因[22].发现大量Zn缺乏响应基因与大豆中的钙,糖和荷尔蒙信号相关[23].虽然有些已经取得了进展,基础缺锌的反应和耐受性的分子调控机制仍然是有限的。
微RNA(miRNA)是内源性小的非编码RNA,其在尺寸上20至24个核苷酸,并用一个发夹二级结构从单链RNA前体产生的[25].已知,它们在与目标基因序列互补的基础上,直接靶向mRNA切割、翻译抑制和DNA甲基化。在植物中,mirna主要引导mRNA的切割,在调控生长发育和各种环境胁迫反应中发挥重要作用[26,27,28,29,30.,31,32].例如,miR156通过靶向SPL转录因子基因参与调控水稻的粒级大小、穗分枝、冠根发育和开花时间[27,33,34];MiR164调节横向根部发育,叶片衰老,籽粒产量和干旱胁迫耐受性[35,36,37].MiRNA还调节对多种营养剥夺胁迫的植物反应,并参与营养稳态调节[38,39,40].例如,miR399、miR827和miR778是由磷酸盐缺乏引起的,并通过调节泛素结合E2酶参与调节磷酸盐稳态PHO2,环型泛素E3连接酶国民组蛋白H3赖氨酸9 (H3K9)甲基转移酶Suvh6.分别为(40,41,42,43];miR397、miR398、miR408和miR857通过控制含铜蛋白的表达参与Cu稳态调控[39,44].通过使用miRNA微阵列,鉴定了八个miRNA家族,响应于Zn缺乏症高粱二色的,以及两个Cu/Zn超氧化物歧化酶基因SbCSD1和SbCSD2分别被miR398和miR528靶向[2].然而,据我们所知,目前还没有关于mirna是否以及如何调节水稻缺锌反应的报道。在本研究中,我们通过整合水稻幼苗的miRNAome和转录组分析来研究水稻锌缺乏的分子机制。通过对这些不同数据集的综合分析,确定了水稻缺锌情况下可能存在的miRNA-mRNA相互作用。
结果
通过RNA测序对锌缺乏和锌补充反应的转录组分析
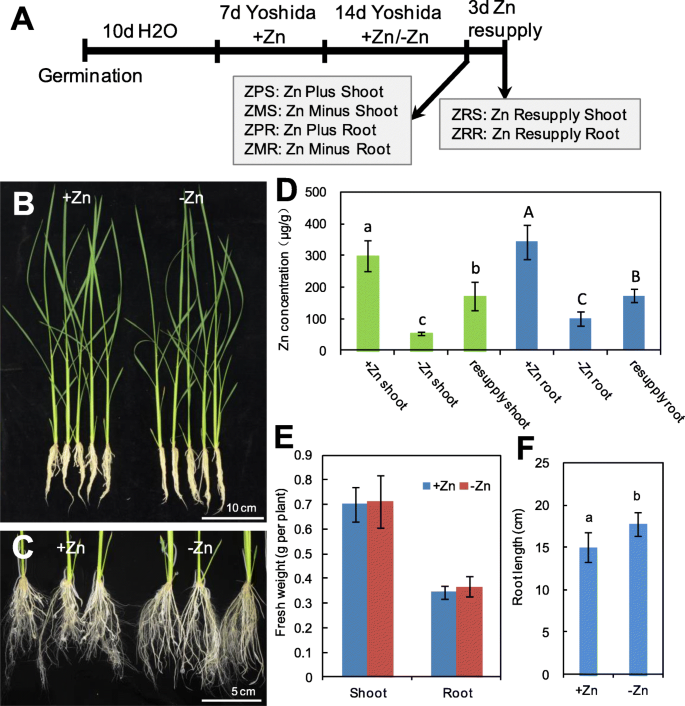
在经历Zn缺乏后14天后,芽和根部的Zn浓度显着降低,并且在Zn再补给3天后,Zn缺陷幼苗的射击和根中的Zn浓度明显增加(图。1A,B-D)。在Zn缺乏下,在芽和根生物质中没有观察到显着差异(图。1e).与观察到的表型一致高粱[2],缺锌显著增加了主根长度(图。1c, f)。这些结果表明,对-Zn和Zn再补给表现出生理适应反应。
然后,我们通过RNA测序分析了水稻幼苗和根系对-Zn和Zn补给响应的整体转录组谱。研究锌胁迫下锌响应基因或miRNAs的恢复情况。通过Illumina的深度测序,剔除低质量reads后,每个文库共获得286 - 5520万条可靠的clean reads,每个文库中的大部分clean reads(86.8-97.3%)可以被定位到水稻参考基因组(https://rapdb.dna.affrc.go.jp/)(额外的文件1:表S2)。Pearson每个样本的三个生物重复的相关性(R值)约为90%,表明复制的高可靠性(附加文件2:图S1)。映射转录物的丰度在FPKM方面进行测定,并且所有这些样品中检测到总共34716的基因位点的(附加文件1:表S3)。
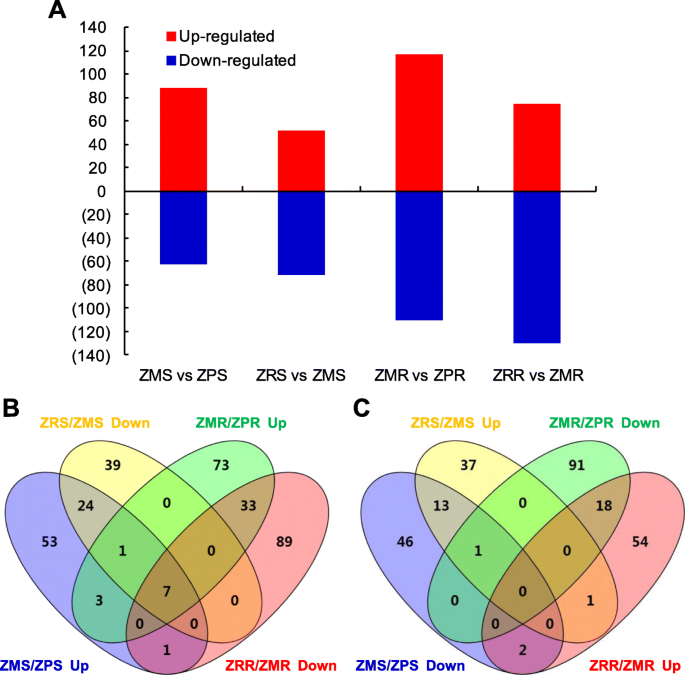
Differential expression analysis (fold change ≥2 and FDR ≤ 0.05) showed that a total of 151, 227, 123, and 205 genes were differentially expressed in Zn-deficient shoots (ZMS/ZPS), Zn-deficient roots (ZMR/ZPR), Zn-resupply shoots (ZRS/ZMS) and Zn-resupply roots (ZRR/ZMR), respectively (Fig.2一个;额外的文件1:表S4-S7)。维恩图分析表明,通过枝条和(或)根系补锌,共恢复了97个锌缺乏应答基因(图2)。2b和c),表明这些基因的表达水平与生长培养基中Zn的水平存在因果关系。在枝条中89个上调基因和62个下调基因(ZMS/ZPS上调和下调)中,再锌处理后恢复的基因分别为32个(36.0%)和14个(22.6%)(ZRS/ZMS下调和上调)1).间的117上调和110下调根基因(ZMR / ZPR向上和向下),40(34.2%)和18(16.4%)基因的Zn补给处理(ZRR / ZMR向下和向上)后回收,(表2).七个基因(Os10g0328600,Os04g0280500,Os04g0561500,OS06G0566201,Os06g0566300,Os08g0207500, 和Os07g0232800)一般通过根和地上补锌来恢复;其中3个编码锌转运体(OsZIP4, OsZIP8和OsZIP10)。氧化石墨烯富集分析(FDR < 0.05)表明,锌离子跨膜转运蛋白(GO:0071577)和锌离子跨膜转运蛋白活性(GO:0005385)显著富集于缺锌上调和zn补充下调的茎和根中。而苏氨酸合成酶活性(GO:0004795)和甲基硫腺苷生物合成l -蛋氨酸过程(GO:0019509)分别显著富集于缺锌下调的茎和根的DEGs中1:表S8)。
水稻对缺锌和补锌反应的miRNA谱分析
测序结果显示,18个文库各获得8.8 ~ 1530万个原始reads,剔除低质量、垃圾和adaptor reads、repeat、Rfam RNA和mRNA序列后,这些文库中38.3 ~ 56.0%的reads为有效reads(附加文件)1:表S9)。大小分布分析显示,6个样本的小rna主要富集在21- 24 nt的序列中,24 nt是最主要的片段(附加文件)1:表S10;额外的文件2:图S2),与之前的研究同时发生[45].对每个样品的3个生物重复进行Pearson相关分析,发现相关系数在0.80 ~ 0.99之间2:图S3),表示复制的高可靠性。搜索清洁读数被从MiRBase的水稻和其他植物物种的MiRNA进行搜索,并且从所有样品中鉴定了共有498种已知/保守的miRNA。对MiRBase无法映射到miRNA预测的读数。除去不符合植物miRNA标准的小RNA(例如,长度<20或> 24,在样品中没有读取的发夹结构),获得了最终的370个新的miRNA基因(附加文件1:表S11)。
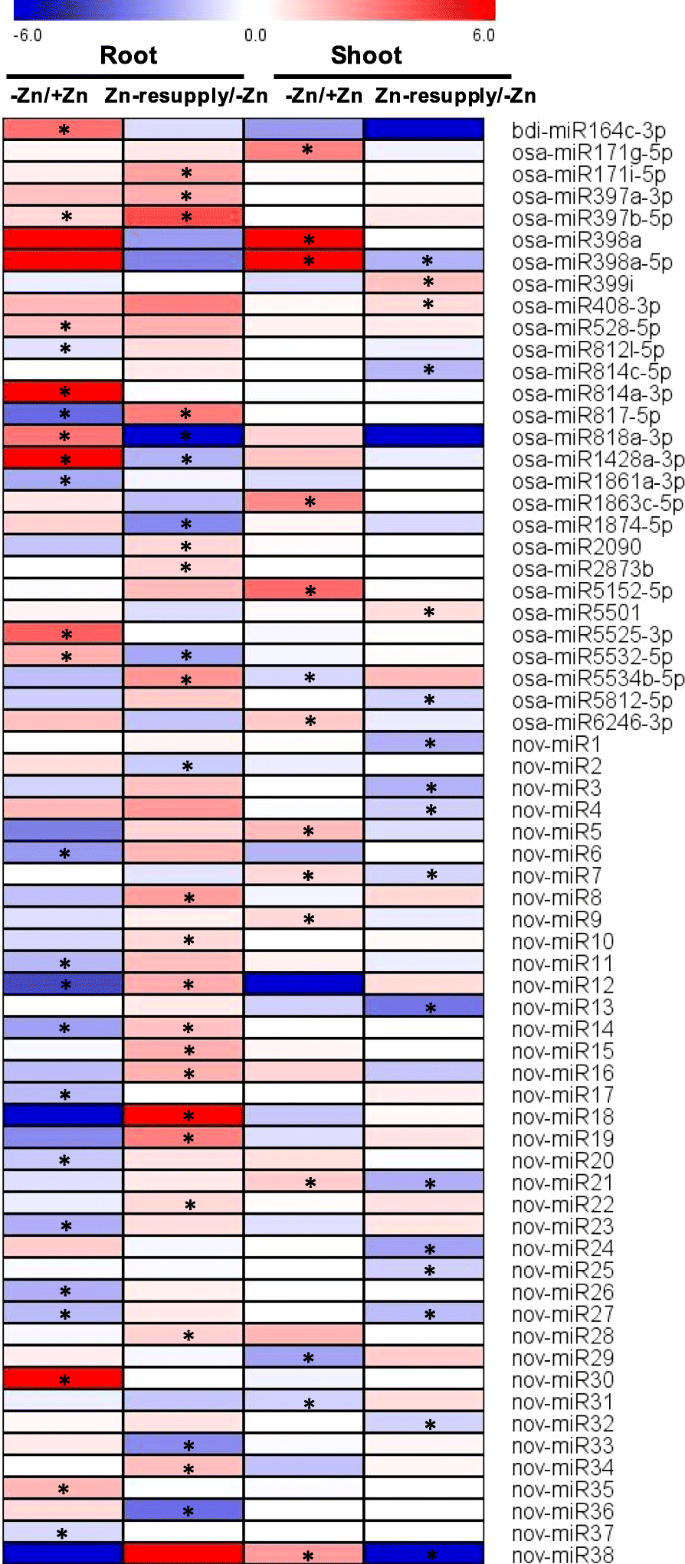
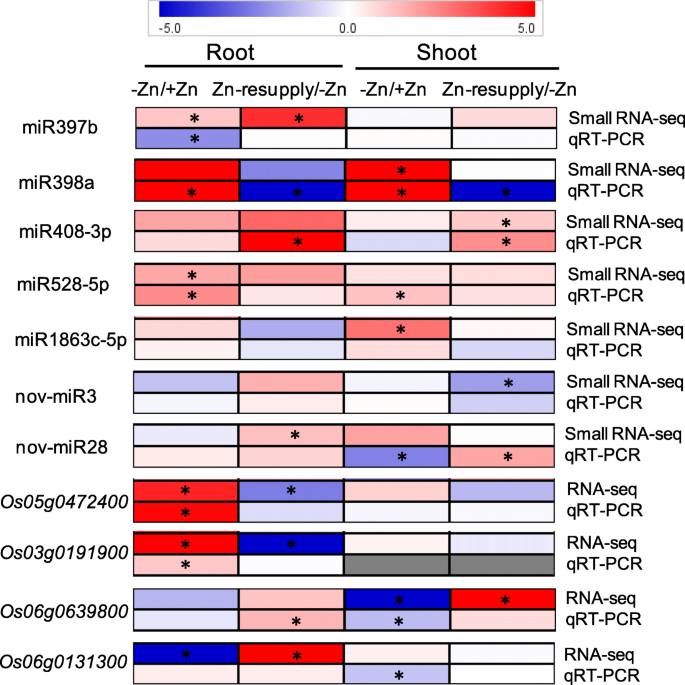
在缺锌(枝条ZMS/ZPS和根系ZMR/ZPR)和补锌(枝条ZRS/ZMS和根系ZRR/ZMR)条件下,共发现68个mirna(包括38个新mirna)差异表达;缺锌情况下差异表达38个mirna,补锌情况下差异表达44个mirna;14种mirna通常对锌缺乏和锌补充有反应(附加文件)1:表S12;无花果。3.;额外的文件2中:图S4和S5)。通过在分别芽和根,锌缺乏这些锌响应miRNA的,12和11分别为上调;图2和12,通过分别在枝条和根,锌缺乏(附加文件下调2:图S4)。然而,这些mirna中没有一个对茎和根的缺锌都有响应,这表明在缺锌的茎和根中有不同的mirna介导的调控网络。在枝条和根系中分别发现17和27个mirna对锌的再供给有响应。有趣的是,有4个和7个锌缺乏反应的mirna分别可以通过在茎和根中补充锌得到恢复(附加文件2:图S4)。例如,osa-miR398a-5p、11 - mir7、11 - mir21和11 - mir38受缺锌诱导,但受补锌抑制;osaas - mir818a -3p、osaas - mir1428a -3p和osaas - mir5532 -5p在根中受锌缺乏性诱导而受锌再供给的抑制(图2)。3.).两种mirna在缺锌和补锌条件下表达模式相似;miR397b-5p是由根系缺锌和补锌诱导产生的,而11 - mir27分别是由根系缺锌和补锌诱导产生的(图2)。3.),提示这些mirna在缺锌和再供给下的复杂调控。
鉴定Zn响应MiRNA的潜在靶基因
为了了解这些锌缺乏和/或锌再供给反应mirna的潜在生物学功能,使用在线工具psRNATarget预测mirna靶向基因[46].共鉴定了这68个锌反应mirna的799个潜在靶基因(附加文件)1:表向)。4种zn应答mirna (miR398, miR408, miR528, miR397)的至少19个靶基因已经通过RNA连接酶介导的cDNA末端快速扩增(RLM 5’-RACE)、降解组测序和遗传分析等实验验证(表1)3.)[47,48,49];其中大多数是含Cu的蛋白质,参与Cu稳态,反应性氧物种(ROS)稳态,光合作用和胁迫耐受性[49,50,51,52,53,54,55,56,57,58].
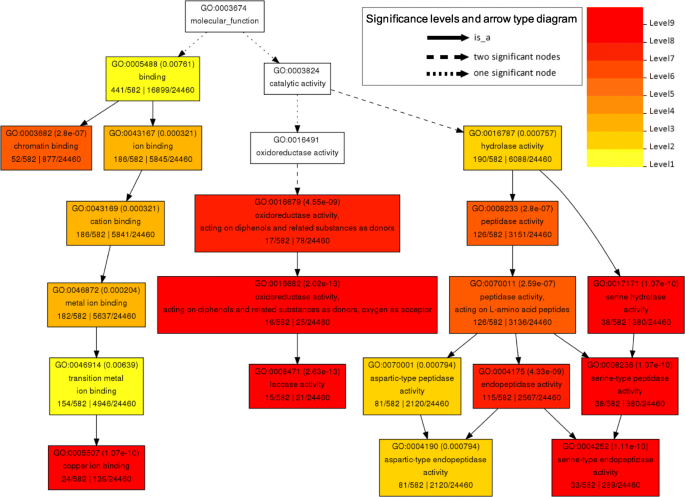
为了进一步阐明预测的靶基因在缺锌反应中的潜在生物学功能,我们进行了氧化石墨烯富集分析。生物过程组有26项氧化石墨烯,分子功能组有19项氧化石墨烯,细胞组分组有18项氧化石墨烯显著富集(FDR < 0.05)(图2)。4;额外的文件2:图S6和S7)。在富集的分子功能中,最重要的GO术语是氧化还原酶活性(GO:0016682),漆酶活性(GO:0008471),丝氨酸型肽酶活性(GO:0008236),Cu离子结合(GO:0005507)和丝氨酸水解酶活性(GO:0017171)(图。4).中富集的生物过程中,最富集的GO术语是木质素代谢过程(GO:0009808),苯丙分解代谢过程(GO:0009808),蜂窝氨基酸衍生物分解代谢过程(GO:0042219),次生代谢过程(GO:0019748)和蛋白水解(GO:0006508)(附加文件2:图S6)。在细胞组分组中,质外体(GO:0048046)、染色质(GO:0000785)和光合膜(GO:0034357)的表达量最大2:图S7)。
基因本体(GO)在Zn剥夺和/或Zn补充下差异表达的miRNA的潜在靶基因中的超人级分子函数的级分子函数表示。在Agrigo上使用单一浓缩分析(SEA)工具生成GO表示(http://bioinfo.cau.edu.cn/agrigo/) (Fisher检验,P < 0.05, FDR < 0.05)。括号中的数字表示FDR值
miRNAome和转录组的整合分析
由于mirna通过靶基因切割负调控靶mrna的表达,mirna的表达模式通常与靶基因的表达模式呈负相关。通过整合转录组和miRNAome数据,我们预测了-Zn和/或Zn再供给下的12个deg被10个响应-Zn和/或Zn再供给的mirna(包括4个已知和6个新mirna)靶向(表)4).作为与相应的miRNA相比,这表明此类miRNA对它们的潜在靶基因负调控的潜在目标DEGS的一半显示出缺锌或Zn补给不同的响应。由锌补给例如,miR397b-5P上调,而它的潜在靶基因OsLAC11(Os03g0273200)和OsLAC29(Os12g0258700)通过-Zn上调或Zn再供给下调;osa-miR398a-5p在缺锌时表达上调,是其潜在的靶基因OS07G0213800.明显下调;NOV-MIR4由锌补给下调,而其潜在的靶基因Os01g0358700是差异;11 - mir6因缺锌而下调,可能是靶基因Os04g0623901是差异;11 - mir23因缺锌而下调,而11 - mir23是其潜在的靶基因Os01g0923900锌的补充降低了锌的含量。然而,有一半的潜在靶基因表现出与mirna相似的表达模式(表1)4).这可能是由以下原因造成的:这些基因是mirna的非真实靶基因;潜在靶基因调控复杂;潜在的靶基因是由翻译抑制而不是转录裂解调控的。
通过QRT-PCR确认miraome和转录组结果
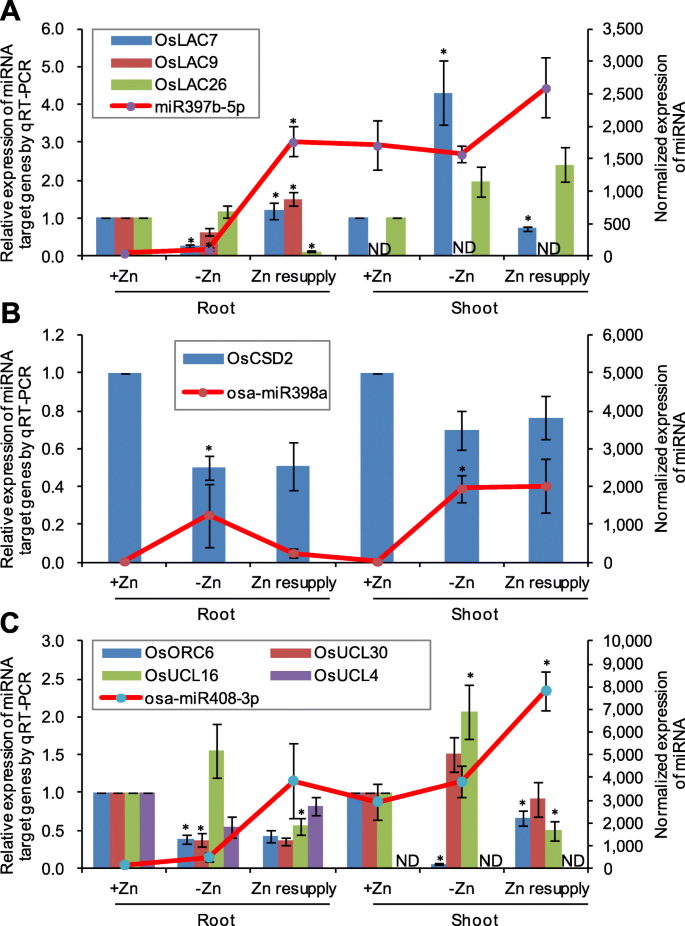
为验证小RNA测序结果,随机选取7个zn响应mirna进行qRT-PCR表达验证。初级miRNAs (Primary miRNAs, pri-miRNAs)是由植物中的MIR基因通过聚合酶II转录而成,具有特征性的发夹结构,可用于指示成熟miRNAs的表达水平[59].在这里,我们根据相应的miRNA基因序列,使用基因特异性引物分析这些miRNA的初级转录本。pri- mirna的表达与成熟mirna的小RNA测序结果基本一致。例如,pri-miR398a在锌缺乏时上调,在锌补充时下调;Zn再供给上调pri-miR408;pri-miR528因缺锌而上调(图。5).而pri-miR397b和pri- 11 - mir28则受到锌缺乏的抑制,这与成熟miR397b和11 - mir28的表达不一致,说明这些pri- mirna与成熟mirna在锌缺乏下的反应不同。为了确认RNA测序结果,四个锌响应基因(Os05g0472400,OS03G0191900.,Os06g0639800, 和OS06G0131300.通过QRT-PCR随机选择并研究。在Zn缺乏和恢复下这些基因的表达模式类似于RNA-SEQ的结果,除外OS06G0131300.(无花果。5).显著的表达变化OS06G0131300.qRT-PCR无法观察到缺锌和恢复情况,但通过qRT-PCR观察到枝条缺锌抑制了其表达。的表达水平OS03G0191900.而qRT-PCR检测不到,这与RNA-seq检测到的茎中FPKM值较低是一致的(图2)。5).这些结果表明,小RNA测序和基因测序在这项研究中得到的数据是可靠的。
我们还通过QRT-PCR分析了Zn响应MiRNA的几种潜在靶基因的表达。miR397b-5p的潜在靶基因显示对Zn缺乏的差异反应;OsLAC7(Os01g0850550)和OsLAC9(Os01g0850800)通过缺锌在根,这是违反miR397b-5P的表达抑制;OsLAC7被Zn缺乏诱导并在射击中抑制zn(图。6一个)。OsCDS2miR398a是miR398a的潜在靶基因,根部缺锌对其表达有抑制作用,这与miR398a的表达相反(图。6b). miR408-3p的潜在靶点对锌缺乏和锌补充也表现出不同的反应,表明它们在锌缺乏反应中的作用不同。OSUCL16.(Os06g0218600)因缺锌而上调,再锌而下调;OsUCL30(Os08g0482700)因根系缺锌而下调;OsORC6(Os07g0628600)在根和地上部均因缺锌而下调(图;6c)。
讨论
锌缺乏和锌回收反应中二氢基因的鉴定
在这项研究中,共发现总共569个基因座对Zn缺乏和/或Zn补充的响应;它们的360对Zn缺乏的根和/或芽缺乏症,并且它们的316次响应于根和/或芽中的Zn补充(图。2).通过与早期研究比较[24据报道,49个次数对Zn缺陷和/或Zn补充(附加文件)响应1:表S14系列)。其中5个常见的deg是假定的锌转运体,3个常见的deg是金属硫蛋白样蛋白,涉及锌稳态[7,60].此外,发现97只可通过射击和/或根的Zn再补散治疗恢复(表)1和2),表明他们对Zn缺乏的特定反应。这些可富集蜂窝代谢过程,初级代谢过程和生物合成过程(附加文件)2:图S8),表明这些过程受Zn缺陷的影响,可以通过Zn再补给恢复。四只数(Os03g0108300,OS10G0528400.,OS12G0570700.,Os12g0571000)也被报道通过锌补给回收[24].
预计12次次数靶向10个Zn响应的miRNA,其中一半显示Zn缺乏下的miRNA和/或Zn补充的差异表达(表4),提示mirna与其潜在靶基因之间的相互作用。然而,这并不排除zn应答mirna的其他潜在靶基因的响应性。qRT-PCR结果显示,miR397b、miR408和miR398a的几个潜在靶基因也被锌缺乏和/或锌补充诱导或抑制(表)3.,无花果。5b).本研究中可能受锌反应mirna调控的DEGs数量远低于我们的预期。其中一个可能的原因是,用于定义DEGs的公认标准可能会遗漏一些mirna与其潜在靶基因之间的相互作用,通过降低阈值可能会发现更多的相互作用对。
mirna可能参与水稻缺锌反应的调控
mirna已经被证明参与了营养胁迫反应的信号传导和调控,如氮缺乏、磷酸盐缺乏、硫酸盐剥夺和铜缺乏[38,39,40,61,62].在本研究中,我们分析了锌缺乏和锌补充下的miRNA表达谱,发现68个miRNA对锌缺乏和/或锌补充有响应(图2)。3.).一些miRNA家族也被发现对锌缺乏有反应高粱二色的,如mir171,mir398,mir399,mir408和mir528 [2,表明它们在植物对缺锌反应中的保守作用。
在Zn响应的miRNA中,其中38个(56%)是新的miRNA。大多数这些新颖的miRNA(36/38)由单个轨迹编码(附加文件1表S12),表明它们的近期进化起源。大多数的新miRNAs(30/38)包含一个相反的链(miRNA*),可以被小RNA测序检测到,大多数的新miRNAs(28/38)是24 nt长(附加文件1:表S12;额外的文件2:图S5)。在水稻中,部分pri-miRNAs可分别被Dicer-like 1 (DCL1)和DCL3加工成规范miRNAs (21 nt)和长miRNAs (24 nt) [63,64].将24nt长miRNA分类为效应器argonaute 4(前4),并通过碱基与靶基因衍生的转录物进行直接DNA甲基化[26,63].DNA甲基化调节基因表达并抑制转座元件的转录和运动。一些关键营养应激反应基因的表达已经建议可以通过DNA甲基化特定营养胁迫条件下调节[65].在本研究中,许多锌应答的新型miRNAs(20/38)因锌缺乏而下调,或因锌再供给而上调(图。3.).这些锌反应的新mirna的潜在靶基因编码各种蛋白质,如转录因子、转运蛋白、蛋白激酶、含锌蛋白和氧化还原酶(附加文件1:表向)。无论是这些最近演化的和可能的特异性Zn响应性新的miRNA与水稻中的淹没和低Zn条件的适应相关,也参与Zn缺乏反应的表观遗传调节,应得到进一步的研究。
mirna在植物Cu-Zn相互作用中的潜在作用
在本研究发现的锌应答miRNA中,一些miRNA家族之前被证实对铜缺乏有响应,如miR397、miR398和miR408,这些miRNA家族都是由铜缺乏诱导的,其靶基因编码各种含铜蛋白[39].在水稻中,已经验证了19个Cu/ zn响应mirna的潜在靶基因,其中大多数编码含Cu蛋白,如csd、漆酶、植物花青素样蛋白和uclacyanin样蛋白(见表)3.).在Cu离子结合和漆酶活性的GO术语中显着富集Zn响应MiRNA的潜在靶基因(图。4).这些结果表明miRNA参与在植物中Cu和Zn营养之间的相互作用中。
研究表明,Cu和Zn可以通过多种方式相互作用:Cu竞争抑制Zn吸收,Zn强烈抑制Cu吸收,Cu影响Zn在植物体内的再分配[66,67].发现Cu和Iron(Fe)的上游被米幼苗的Zn缺乏增加[68].在本研究中,我们发现miR398和miR528是由缺锌引起的。miR398和miR528的诱导可抑制含锌靶基因的表达CSDS [2,50],可被铁超氧化物歧化酶和锰超氧化物歧化酶功能替代,从而进一步允许有限的锌分配到其他必需的含锌蛋白,以适应低锌环境。mirna介导的Zn稳态调控可能与之前报道的Cu稳态调控类似[69,70].有趣的是,另两种铜响应mirna, miR397和miR408被锌再供给诱导(图)。3.).这两种mirna的诱导可能是Zn补给的直接作用,也可能是Zn补给诱导拮抗Cu营养的间接作用。miR397b和miR408的主要转录本被锌缺乏所抑制(图。5).miR397b和miR408的抑制是否与缺锌诱导的植物组织铜积累有关,值得进一步研究。
mirna介导的氧化应激对锌缺乏的反应
锌缺乏可干扰膜结合的NADPH氧化酶产生ROS,进而通过过量的ROS对关键细胞化合物造成氧化损伤,这是锌缺乏下影响植物生长的主要因素[11.].有报道称,缺锌会导致叶片和根系的细胞损伤,保持较高的ROS防御水平与减少水稻叶片的细胞损伤有关[2,71,72].在本研究中,氧化还原酶活性的氧化石墨烯项显著富集于锌反应miRNAs的潜在靶基因中(图。4).据报道,miR398通过沉默的表达参与了氧化应激反应的调控CSD1和CSD2在拟南芥[73].在这里,MiR398被射击缺乏诱导。miR398的诱导可以抑制其靶基因的表达(csd,Sodx.,冲洗液),进而促进ROS的积累。miR398也被其他胁迫诱导,如盐、热和稻瘟病菌感染Magnaporthe oryzae[29,52].miR398的诱导已经建议需要为在拟南芥耐热和耐稻瘟病水稻[51,52].另一种锌应答miRNA, miR528也被报道参与调节ROS积累[55,56].其中miR528的靶基因的,CSD4(Os08g0561700)可能参与活性氧清除。另一个miR528的靶基因,OS06G0567900.,编码L-抗坏血酸氧化酶(AO),通过氧化质外体l -抗坏血酸来调节质外体的氧化还原状态,从而参与产生ROS [56].过表达osa-miR528可降低匍匐bentgrass的AO活性,增加ROS清除,进一步提高植物对盐和氮缺乏胁迫的耐受性[55].在本研究中,miR528被锌缺乏诱导,提示其在锌胁迫下平衡ROS积累和清除的作用。
结论
本研究首次尝试整合整体miRNA和mRNA表达谱,以识别水稻锌缺乏和恢复的调控miRNA/target模块。一组68个mirna,包括38个新mirna和5个铜响应mirna被鉴定为差异表达。至少有12个锌敏感mirna的靶基因被锌缺乏和锌恢复改变。发现97个锌缺乏应答基因通过锌补给得到了恢复。这项对水稻miRNAome和转录组在锌缺乏和恢复反应中的整体分析确定了候选mirna和基因,可以进一步表征,以增加我们对锌缺乏反应的分子机制的理解。所鉴定的差异表达miRNA/target模块和基因也可以作为基因工程方法提高锌缺乏性的候选基因。
方法
植物材料及生长条件
稻子(奥雅萨苜蓿l . ssp。粳稻的履历。Nipponbare),表面用10% (v/v) H消毒2O220分钟并用无菌水冲洗[74].然后将种子转移到浮在无菌水上的苗盘中发芽。幼苗在无菌水中生长10天后,转移到装有2.5 L吉田溶液的塑料容器中[75].在营养溶液中生长后(ZnSO为1.5μm4)处理1周后,采用统一苗进行缺锌(−Zn)处理。对于-Zn处理,没有ZnSO4加入到营养溶液中。每2天补充新鲜的营养溶液,将pH调节至5.6。植物在受控条件下在生长室中生长。光强度约为180μmolm−2 s−1在26°C/24°C条件下,日/夜循环16 h/8 h。相对湿度为50%。在缺锌处理2周后采集水稻幼苗的根和芽。补充锌处理时,将缺锌幼苗转移到含1.5 μM ZnSO的正常营养液中4for 3 days. After Zn-resupply treatment, roots and shoots were collected for analyses at the same time point as collecting the Zn-deficient samples (4 hours after illumination).
锌含量测定
如先前所描述,分析Zn的含量[23,76].采集植物组织,置于80°C烘箱中干燥3天。取根前用去离子水冲洗三次。将干燥的根或芽磨碎,约0.10 g样品用于分析。经HNO消化3./ HClO4(4:1,v / v)在180℃下4小时,将溶液用1%HNO稀释五次3.,然后用电感耦合等离子体质谱(Perkin-Elmer NexION 300X, Waltham, MA)测定锌的浓度。
cDNA文库构建及RNA测序
采用缺锌和补锌处理采集水稻幼苗和根系。采集三株水稻幼苗,并将其混合作为一个样本。18个样品(锌加苗,ZPS;锌减去芽,ZMS;Zn +根,ZPR;Zn -根号,ZMR;锌补枝,ZRS;采得补锌根ZRR,每根3个生物复制),用于RNA文库构建和测序。使用Trizol试剂(Invitrogen, CA, USA)提取总RNA,使用Bioanalyzer 2100和RNA 6000 Nano LabChip Kit (Agilent, CA, USA)进行数量和质量分析。所有RNA样本的RIN值(RNA完整性数)均在8.0以上。 Ten μg of total RNA of each sample was subjected to isolate Poly (A) mRNA with poly-T oligo-attached magnetic beads (Invitrogen, Carlsbad, CA). After purification, the mRNA is fragmented into small pieces using divalent cations under elevated temperature. The cleaved RNA fragments were reverse-transcribed to create cDNA libraries according to the instructions of the mRNA-Seq sample preparation kit (Illumina, San Diego, USA). The average insert size of the paired-end libraries was 300 ± 50 bp. The paired-end sequencing was performed on an Illumina Hiseq4000 at the LC-BIO (Hangzhou, China). The RNA-seq datasets of this study were deposited in NCBI’s Gene Expression Omnibus and are accessible through GEO accession number GSE130980 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE130980).
RNA-seq序列的定位和差异表达基因的鉴定
Illumina分析管道(Fastq格式)生成的读取的初始基础调用和质量过滤使用自定义Perl脚本和Illumina管道的默认参数(http://www.illumina.com).使用FastQC软件包中的FASTX-toolkit对质量差的碱基进行额外过滤(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).水稻参考基因组(版本IRGSP-1.0) (https://rapdb.dna.affrc.go.jp/)被Bowtie2索引,以方便读取映射。读取映射使用Tophat软件(版本2.1.1)包执行[77].TOPHAT允许每次读取的多个对齐(最多40)和最多在将读取映射到参考基因组时的两个不匹配。首先使用索引直接映射到基因组的读取,并使用未映射的读取来识别新颖的剪接事件。通过使用归一化RNA-SEQ片段计数来处理对齐的读取文件以测量转录物的相对丰度。根据每百万映射的读数(FPKM)每千碱基的片段测量估计的基因丰度。使用袖口(2.1.1版)鉴定了两种处理之间的次数。只有LOG2折叠变化≥1或≤ - 1的基因,以及调整的P-value (FDR≤0.05)被认为是显著的deg。基于每个样本的标准化mrna计数,使用R Stats包(版本3.5.0)计算Pearson相关性并绘制。
功能注释和基因本体(GO)富集
基因本体论(GO)术语注释缺锌反应基因和mirna的潜在靶基因[78并将其分为分子功能、细胞成分和生物过程三类。采用单一富集分析工具在AgriGo (http://bioinfo.cau.edu.cn/agrigo/)[79].类别(http://geneontology.org/)调整后的p值≤0.05被认为是显着富集的。
施工小RNA文库和测序
共收获18个样本(ZPS、ZMS、ZPR、ZMR、ZRS、ZRR,每个生物复制3个),用于小RNA文库构建和测序。使用Trizol试剂(Invitrogen, Carlsbad, CA)从样品中提取总rna。根据TruSeq small RNA Sample Prep Kits (Illumina, San Diego, USA)的说明书,使用约1.0 μg总RNA制备小RNA库。Illumina Hiseq2500测序仪在中国杭州的LC-BIO进行了长度约50 bp的单端测序。本研究的小RNA测序数据存储在NCBI的基因表达综合数据库中,可通过GEO登录号GSE131003 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE131003).
mirna的鉴定及其靶基因的预测
原始读段上的内部程序ACGT101-MIR(LC科学,休斯敦,得克萨斯州,美国),除去接头序列,低复杂度序列,垃圾读取,重复序列,并读取匹配常见的非编码进行存放在数据库RFAM RNA家族(的tRNA,rRNA基因,的snoRNA和snRNA启动)(http://www.sanger.ac.uk/software/rfam.).随后,用20-24个核苷酸(nt)的长度独特序列通过BLAST(2.6.0版本)来识别已知的miRNA和新颖3p-和5p-衍生的miRNA映射到的miRBase 22.0米的miRNA前体。在两个3'和5'端,并且用于对准所述miRNA序列中的一个错配核苷酸长度变化被允许。映射到水稻独特序列在成熟前体的miRNA被鉴定为已知的miRNA。映射到已知的水稻miRNA前体发夹的相对臂的独特的序列被认为是新颖5p-或3p-衍生的miRNA的候选者。剩余的序列映射到其它植物物种的miRNA前体中的miRBase 22.0(http://www.mirbase.org/)通过BLAST(2.6.0版),并将映射的前miRNA与水稻基因组进一步对齐以确定其基因组位置。剩余的未映射的序列与水稻基因组进一步对准,并使用RNAFOLD软件收集具有长度120nt的侧翼序列(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi).新型miRNA预测和表征的标准基于先前的研究[80].
The abundance of each miRNA were normalized to the expression of tags per million (TPM) following the formula: normalized expression = actual miRNA count/total count of clean reads*106.为了识别锌缺乏或锌再供给反应的mirna,只有log2倍变化≥1或≤−1和ap-value≤0.05为差异显著的mirna。为了预测锌响应mirna的潜在靶基因,psRNATarget(植物小RNA靶分析服务器)(http://plantgrn.noble.org/psRNATarget/)(V2,2017释放)是基于miRNA的序列和它们的靶基因[之间的不完善互补采用46].
定量rt - pcr分析
定量RT-PCR (qRT-PCR)在MyiQ Single Color Real-time PCR系统(Bio-Rad)上进行,如前所述[81].如前所述进行原发性miRNA(PRI-miRNA)的QRT-PCR分析[59,82].茎环序列用于引物设计,如果没有找到令人满意的引物,则在每侧的侧翼基因组序列100bp延长茎环序列以进行底漆设计。相对表达水平被标准化为两个内部对照基因的OsACTIN1(Os03g0718100),OsUBQ2(OS02G0161900.)using the Pfaffl method (Ratio = (E目标)∆CT目标(对照试样)/(E裁判)∆CT裁判(对照试样))[83].所有引物的计算效率(E)均在1.8 ~ 2.2之间。引物的序列列在附加文件中1S1:表。
数据和材料的可用性
在本研究中使用的数据集可从通讯作者在合理的要求。
缩写
- AGO4:
-
Argonaute 4
- AO:
-
L-ascorbate氧化酶
- bZIP:
-
基本亮氨酸拉链
- 孔:
-
铜伴侣超氧化物歧化酶
- CSD:
-
铜/锌超氧化物歧化酶
- 铜:
-
铜
- DCL1:
-
Dicer-like 1
- 度:
-
差异表达基因
- 菲:
-
铁
- FPKM:
-
每百万每成绩单的碱基片段短片段
- GA:
-
赤霉素
- 走:
-
基因本体论
- H3K9:
-
组蛋白H3赖氨酸9
- miRNA:
-
微
- NAS:
-
尼古拉胺合成酶
- 存在:
-
定量RT-PCR
- 那么使用RLM 5 '运动中:
-
RNA连接酶介导的5'CDNA的快速扩增
- ROS:
-
活性氧
- SODX:
-
超氧化物dismutaseX
- TF:
-
转录因子
- ZDRE:
-
缺锌响应元件
- ZIFL:
-
Zinc-induced主持人
- 压缩:
-
ZRT,IRT-相关蛋白
- 锌:
-
锌
参考文献
- 1。
罗德利Mr,White PJ,Hammond JP,Zelko I,Lux A.植物中的锌。新植物。2007; 173(4):677-702。
- 2.
李y,张y,shi d,liu x,qin j,ge q,xu l,pan x,li w,zhu y等。锌稳态的空间 - 时间分析揭示了高粱双子急性锌缺乏症的响应机制。新植物。2013; 200(4):1102-15。
- 3.
ascacay b.与农作物和人类缺乏症相关的土壤因素。环保机械健康。2009; 31(5):537-48。
- 4.
谷物锌的富集:农艺或遗传生物强化?土壤植物。2008;302(1 - 2):1。
- 5.
Brown KH, Rivera JA, Bhutta Z, Gibson RS, King JC, Lonnerdal B, Ruel MT, Sandtrom B, Wasantwisut E, Hotz C.国际锌营养咨询集团(IZiNCG)技术文件#1。人群缺锌风险评估及其控制方案。食品营养学报。2004;25(1增刊2):S99-203。
- 6.
玫瑰TJ,IMPA SM,玫瑰MT,Pariasca-田中Ĵ,森A,雅S,约翰逊Beebout SE,Wissuwa M.加强水稻磷和锌采集效率:根性状的严格审查和它们在水稻育种潜在效用.Ann Bot。2012; 112:331-45。
- 7.
辛克莱SA,陆生植物的克莱默U.锌稳态网络。生物化学与生物物理学ACTA(BBA) - 分子细胞RES。2012; 1823(9):1553至1567年。
- 8.
Ishimaru Y,Bashir K,Nishizawa NK。Zn吸收和水稻易位。米。2011; 4(1):21-7。
- 9.
白色JG, Zasoski RJ。土壤微量元素的映射。农田作物学报1999;60(1):11-26。
- 10。
李志强,李志强,李志强,等。水稻锌缺乏抗性的遗传分析。应用电子学报。2017;130(9):1903-14。
- 11.
锌在保护植物细胞免受活性氧伤害中的作用。新植醇。2000;146(2):185 - 205。
- 12.
Impa SM, Johnson-Beebout SE。通过土壤化学与植物生理研究相结合,缓解水稻缺锌,实现水稻籽粒高锌。土壤植物。2012;361(1):3-41。
- 13.
王玉华,王玉华,王玉华,王玉华。锌效率与小麦需要锌酶的表达和活性增强有关。植物杂志。2003;131(2):595。
- 14.
Cavagnaro T.丛枝菌根在低土锌浓度下改善植物锌营养中的作用 - 综述。植物土壤。2008; 304(1-2):315-25。
- 15.
Widodo B, Broadley MR, Rose T, Frei M, Pariasca-Tanaka J, Yoshihashi T, Thomson M, Hammond JP, Aprile A, Close TJ,等。耐锌性差异较大的两个水稻系对缺锌的反应取决于根系生长维持和有机酸渗出率,而不是锌转运体活性。新植醇。2010;186(2):400 - 14所示。
- 16.
水稻对锌缺乏土壤的耐受性的基因型差异:根际变化的重要证据。植物科学学报2015;6:1160。
- 17.
石丸Y,增田H,铃木男,巴希尔K,高桥男,中西H,森S,西泽NK。OsZIP4锌转运赋予紊乱锌的分布在水稻的表达。J Exp Bot。2007; 58(11):2909-15。
- 18.
Olsen Li,Hansen Th,Larue C,Osterberg JT,Hoffmann Rd,Liesche J,Kramer U,Scleble S,Cadarsi S,Samson Va等。母植物介导的锌进入显影种子。Nat植物。2016; 2(5):16036。
- 19.
蔡华,黄胜,车健,山继宁,马建峰。液泡体定位转运体OsHMA3在维持水稻锌稳态中起重要作用。[J] .中国生物医学工程学报。2019;70(10):2717-25。
- 20。
Sasaki A, Yamaji N, mitani -上野N, Kashino M, Ma JF。一个节点定位的转运体OsZIP3负责锌在水稻发育组织中的优先分配。植物j . 2015; 84(2): 374 - 84。
- 21。
Sinclair SA, Senger T, Talke IN, Cobbett CS, Haydon MJ, Kramer U.系统性上调MTP2-和hma2介导的锌分配对局部锌缺乏反应的补充。植物细胞。2018;30(10):2463 - 79。
- 22。
南大AK,普霍尔V,基于下缺锌稻冠组织的转录组分析应激反应和耐受性的Wissuwa M.模式。J Exp Bot。2017; 68(7):1715至1729年。
- 23。
张新民,张新民,张新民,朱玉梅。大豆叶片和根系对缺锌胁迫的转录组分析。杂志。2019;167:330-51。
- 24。
水稻缺锌反应的形态生理和转录组分析功能整合基因组学。2017;17(5):565-81。
- 25。
Bartel DP。microrna:基因组学、生物起源、机制和功能。细胞。2004;116(2):281 - 97。
- 26。
宋晓霞,李艳,曹晓霞,齐玉英。microrna在植物与环境相互作用中的调控作用。植物生物学年鉴2019;70:489-525。
- 27。
唐建军,朱建军。微rna在作物改良中的应用。Nat植物。2017;3(7):17077。
- 28。
李树华,张晓霞,余斌,等。植物小rna在植物发育和胁迫反应中的作用。植物j . 2017; 90(4): 654 - 70。
- 29.
朱建平,朱建军。mirna和sirna在植物胁迫响应中的作用。Acta botanica yunnanica(云南植物研究),2012;
- 30.
高胜,杨玲,曾华强,周志生,杨志明,李辉,孙东,谢芳,张斌。棉花miRNA参与调控植物对盐胁迫的响应。Sci众议员2016;6:19736。
- 31。
陈明,邵超,王华,等。植物microrna调控活性的动态研究。植物杂志。2011;157(4):1583 - 95。
- 32。
陈志强,胡丽丽,韩宁,胡建军,杨勇,向涛,张欣,王磊。一种mir393抗性运输抑制剂反应蛋白1 (mTIR1)的过表达通过增加渗透调节和Na+的去除增强拟南芥的耐盐性。植物生理学报。2015;56(1):73-83。
- 33。
邵勇,周洪志,吴勇,张华,林军,姜旭,何强,朱军,李勇,余辉,等。OsSPL3是一个sbp结构域蛋白,调控水稻冠根的发育。植物细胞。2019;31(6):1257 - 75。
- 34。
宏y,杰克逊S.花卉诱导和花卉形成 - MiRNA的作用和潜在应用。植物Biotechnol J. 2015; 13(3):282-92。
- 35。
关键词:水稻,mir164, NAC基因,抗旱性[J] .机器人。2014;65(8):2119-35 .]
- 36.
关键词:拟南芥,miR164,年龄依赖性细胞死亡,三叉前导调控科学。2009;323(5917):1053 - 7。
- 37.
姜东,陈伟,董军,李军,杨飞,吴志,周华,王伟,庄超。抗mir164b基因OsNAC2的过表达对水稻植株结构和产量的影响。J Exp Bot. 2018;69(7): 1533-43。
- 38.
曾H,王G,胡X,王H,杜L,朱Y. micrornas在植物反应对养分应力的作用。植物土壤。2014; 374:1005-21。
- 39.
铜microrna。新植醇。2017;213(3):1030 - 5。
- 40.
刘雅婷,林文耀,黄tk,邱天俊。microrna介导的磷酸盐转运体运动监测。植物学报,2014;19(10):647-55。
- 41.
王磊,曾慧卿,宋健,冯淑娟。Yang ZM: miRNA778和SUVH6参与拟南芥磷酸盐稳态。植物科学。2015;238:273 - 85。
- 42.
胡斌,朱超,李飞,唐建军,王勇,林安,刘磊,车瑞,楚昌。叶尖坏死因子1在水稻多重磷饥饿反应的调控中起关键作用。植物杂志。2011;156(3):1101 - 15所示。
- 43。
林文耀,黄tk,邱天俊。氮限制适应是microRNA827的一个靶点,介导了质膜定位的磷酸盐转运体的降解,以维持拟南芥的磷酸盐稳态。植物细胞。2013;25(10):4061 - 74。
- 44。
Zhang H, Zhao X, Li J, Cai H, Deng XW, Li L. MicroRNA408在HY5-SPL7基因网络中介导对光和铜的协调响应。植物细胞。2014;26(12):4933 - 53。
- 45。
郑DH,朴s,翟J, Gurazada SG, De Paoli E, Meyers BC, Green PJ。水稻小RNA的大量分析:调控的microrna和不同靶标RNA切割变异的机制含义。植物细胞。2011;23(12):4185 - 207。
- 46。
戴旭,赵PX。psRNATarget:植物小RNA目标分析服务器。核酸Res. 2011;39(Web Server issue): W155-9。
- 47。
李宇飞,郑勇,Addo-Quaye C,张磊,Saini A, Jagadeeswaran G, Axtell MJ,张伟,Sunkar R.水稻microRNA靶标的转录组全域鉴定。植物j . 2010; 62(5): 742 - 59。
- 48。
周敏,顾丽,李鹏,宋晓霞,魏玲,陈志,曹昕。水稻内源小RNA靶标的降解组测序。籼稻)。医学杂志。2010;5(1):67 - 90。
- 49。
Pan J,Huang D,Guo Z,Kuang Z,Zhang H,Xie X,Ma Z,Gao S,Lerdau Mt,Chu C等。MicroRNA408的过度表达增强了不同植物中的光合作用,生长和种子产量。J Intent Plant Biol。2018; 60(4):323-40。
- 50.
Lu Y,Feng Z,Bian L,谢H.梁J:非生物和生物应激的反应稻米调控取决于CSD1和CSD2表达。Funct植物Biol。2011; 38(1):44。
- 51.
张陆关Q, X,曾庆红H, Y,朱j .热应力诱导miR398触发监管循环拟南芥的耐热性是至关重要的。植物j . 2013; 74(5): 840 - 51。
- 52。
李勇,曹新林,朱勇,杨晓明,张南南,肖征镒,王辉,赵建华,张丽,李国宝,等。Osa-miR398b通过多种超氧化物歧化酶提高H2O2产量和水稻抗病能力。新植醇。2019;222(3):1507 - 22所示。
- 53。
马C,毕S. LERS一个:miR408参与了拟南芥非生物胁迫应答。植物杂志2015; 84(1):169-87。
- 54。
张吉,俞y,冯yz,周yf,张f,杨yw,雷米克,张y,陈yq。MiR408通过植物苷蛋白调节谷物产量和光合作用。植物理性。2017年; 175(3):1175-85。
- 55。
关键词:水稻,MicroRNA528,组成型表达,盐胁迫,氮素饥饿植物杂志。2015;169(1):576 - 93。
- 56。
吴军,杨锐,杨志,姚胜,赵胜,王勇,李鹏,宋鑫,金磊,周涛,等。水稻活性氧积累与microRNA528抗病毒防御Nat植物。2017;3:16203。
- 57。
张永超,于勇,王春宇,李志勇,刘强,徐静,廖建勇,王新军,曲丽华,陈飞,等。过表达microRNA OsmiR397通过增加水稻粒级和促进穗分枝来提高水稻产量。生物科技Nat》。2013;31(9):848 - 52。
- 58。
薛超,姚建林,秦明明,张明明,Allan AC,王德峰,吴军。PbrmiR397a对梨石细胞发育过程中木质素化的调控。植物生态学报;2019;17(1):103-17。
- 59。
Pant BD, Musialak-Lange M, Nuc P, May P, Buhtz A, Kehr J, Walther D, Scheible WR。通过综合实时聚合酶链反应分析和小RNA测序鉴定营养响应的拟南芥和菜籽microrna。植物杂志。2009;150(3):1541 - 55。
- 60.
OsZIP5是水稻质膜锌转运体。acta botanica sinica(云南植物学报),2010;47(4):457 - 461。
- 61.
梁光国,杨芳,于东。MicroRNA395介导拟南芥硫酸盐积累和分配的调控。植物j . 2010; 62(6): 1046 - 57。
- 62.
鲁YB,YP琪,杨LT,郭P,李源,陈联寿。硼缺乏响应的microRNA及其脐橙树叶目标。BMC植物BIOL。2015; 15:271。
- 63.
吴丽,周华,张强,张军,倪飞,刘超,齐亚丽。microRNA途径介导的DNA甲基化。38摩尔细胞。2010;(3):465 - 75。
- 64.
Cuperus JT,Fahlgren N,卡林顿JC。进化与miRNA基因的功能多样化。植物细胞。2011; 23(2):431-42。
- 65.
Secco D,Whelan J,Rouached H,Hister R.营养应激诱导的染色质植物的变化。CurrOp植物BIOL。2017; 39:1-7。
- 66.
王志强,王志强,王志强,等。锌在植物营养中的作用。植物营养学报。中国农业科学,2013;3(2):374-91。
- 67。
Kausar Ma,Chaudhry FM,Rashid A,Latif A,Alam Sm。微量营养素可用性来自钙质土壤的谷物。植物土壤。1976; 45(2):397-410。
- 68。
董C,何F,Berkowitz O,Liu J,Cao P,Tang M,Shi H,Wang W,Li Q,Shen Z等。替代剪接在维持水稻中的矿物营养稳态(Oryza Sativa)中起着重要作用。植物细胞。2018; 30(10):2267-85。
- 69。
王志强,王志强,王志强,等。微rna对拟南芥铜离子稳态的调控。中国生物化学杂志。2007;82(22):16369-78。
- 70.
微rna介导的拟南芥铜蛋白表达的系统性下调。[J] .中国生物医学工程学报,2017;
- 71.
弗雷男,王Y,伊斯梅尔AM,Wissuwa M.生化因素赋予拍耐受性水稻氧化应激的低锌土壤中生长。Funct植物Biol。2010; 37(1):74-84。
- 72.
Lee JS, Wissuwa M, Zamora OB, Ismail AM。缺锌胁迫下水稻基因型根系损伤的生化指标植物学报2017;130(6):1071-7。
- 73.
Sunkar R,Kapoor A,Zhu JK。拟南芥中两种Cu / Zn超氧化物歧化酶基因的前剖视诱导是通过MiR398的下调介导的介导,并且对于氧化应激耐受性重要。植物细胞。2006; 18(8):2051-65。
- 74.
曾总部,刘克,kinoshita t,张rp,zhu yy,沉qr,xu gh。通过铵营养刺激磷吸收涉及水稻根中的血浆膜H + ATP酶。植物土壤。2012; 357(1-2):205-14。
- 75.
Yoshida S,Forno da,公鸡jh。水稻生理研究实验室手册。马尼拉:国际大米研究所;1971年。
- 76。
刘奇,冯SJ,张宝,王MQ,Cao HW,Rono JK,Chen X,Yang ZM。OSZIP1用作金属流出转运器,限制水稻中的过量锌,铜和镉积累。BMC植物BIOL。2019; 19(1):283。
- 77。
Trapnell C,Pachter L,Salzberg SL。Tophat:发现带RNA-SEQ的接头连接点。生物信息学。2009; 25(9):1105-11。
- 78。
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT,等。基因本体论:生物学统一的工具。中华医学杂志。2000;25(1):25 - 9。
- 79。
杜Z,周X,Ling Y,Zhang Z,Su Z. Agrigo:农业社区的GO分析工具包。核酸RES。2010; 38(Web服务器问题):W64-70。
- 80.
Axtell MJ, Meyers BC。回顾大数据时代植物MicroRNA标注标准植物细胞。2018;30(2):272 - 84。
- 81.
曾H,张艳,张X,皮E,在大豆基因组EF-hand蛋白质的朱Y.分析表明它们在环境和营养应激信号可能发挥的作用。前植物SCI。2017; 8(877):877。
- 82.
曾慧卿,朱媛媛,黄树清,杨志明。大豆(Glycine max L.)缺磷反应mirna和顺式元件的分析。植物生理学报。2010;167(15):1289-97。
- 83.
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸学报2001;29(9):e45。
致谢
我们感谢Jin Xu博士(西双版纳热带植物园,中国科学院)为此手稿的批判性阅读。
资金
这项工作得到了中国浙江省自然科学基金(No.Ly20C150002)和中国国家自然科学基金(No.31471937和31800201号)的支持。该资助者在研究设计,数据分析和解释以及稿件写作中没有作用,但只提供财政支持。
作者信息
隶属关系
贡献
赫兹。和Y.Z.构思了研究并设计了实验。H.Z.,X.Z.和M.D。执行了实验。赫兹。和Y.Z.分析了数据并写了稿件。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
用于定量RT-PCR分析的引物。表S2。18个文库的RNA测序结果摘要。表S3。Zn剥夺下ZN剥夺和Zn补给下水稻芽和根样品的RNA-SEQ分析。表S4。水稻幼苗缺锌14 d反应的差异表达位点列表表S5。水稻根系对缺锌14 d反应的差异表达位点列表表S6。响应于锌补给的3 d水稻枝条中差异表达的基因座的列表。表S7。响应于3 d Zn在稻根中补给的差异表达的基因座列表。表S8。在由Zn剥夺和/或Zn补充中调节的DEGS中的超代表的GO术语表示。表S9。18个文库小RNA测序数据综述表S10。本研究中总rna和唯一rna的计数和长度分布。表S11。总结本研究中检测到的已知和预测的mirna。表S12。响应于锌剥夺14 d和/或在根和枝条的Zn的补给3 d差异表达的miRNA。表S13。锌响应miRNA的潜在靶基因。表S14。本研究和早期研究中发现的常见deg。
附加文件2:图S1。
的枝条和根样品的下控制RNA测序,缺锌和Zn补给条件3次生物学重复Pearson相关(R值)。锌加拍,ZPS;锌减去芽,ZMS;Zn +根,ZPR;Zn -根号,ZMR;锌补枝,ZRS;锌再补给根,ZRR。图S2。6个样本小RNA测序数据中小RNA的长度分布。每条杠表示三个生物重复的平均值±SD。图S3。的枝条和根样品进行小RNA的高通量下控制测序,缺锌和Zn补给条件3次生物学重复Pearson相关(R值)。图S4。表达锌缺乏和锌再补给反应mirna重叠的维恩图(a,已知和新的mirna;b,新miRNAs)的根和芽。图S5。预测了本研究中鉴定的38个锌响应的新型mirna的二级结构。红线表示在锌缺乏和/或锌再供给下发现差异表达的成熟miRNA序列。蓝线表示小RNA测序检测到的miRNA*序列。如果没有蓝线表示小RNA测序未检测到miRNA*序列。图S6。基因本体论(Gene ontology, GO)表示缺锌和/或锌再供给下差异表达mirna的潜在靶基因中生物过程中过度表达的GO项。在Agrigo上使用单一浓缩分析(SEA)工具生成GO表示(http://bioinfo.cau.edu.cn/agrigo/)(费雪的测试,P< 0.05, fdr < 0.05)。括号中的数字表示FDR值。图S7。基因本体(GO)在Zn缺乏和/或Zn补充下差异表达的miRNA的潜在靶基因中的潜在靶基因潜在靶基因的过度持续的GO术语表示。在Agrigo上使用单一浓缩分析(SEA)工具生成GO表示(http://bioinfo.cau.edu.cn/agrigo/) (Fisher检验,P < 0.05, FDR < 0.05)。括号中的数字表示FDR值。图S8。基因本体论(Gene ontology, GO)表示根和芽中锌补充回收的DEGs生物过程中过度表达的GO项。在Agrigo上使用单一浓缩分析(SEA)工具生成GO表示(http://bioinfo.cau.edu.cn/agrigo/) (Fisher检验,P < 0.05, FDR < 0.05)。括号中的数字表示FDR值。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
曾,H.,张,X.,丁,M。et al。miRNAome和转录组的综合分析揭示了水稻幼苗锌缺乏反应。BMC植物杂志19,585(2019)。https://doi.org/10.1186/s12870-019-2203-2
已收到:
接受:
发表:
关键字
- 大米(奥雅萨苜蓿)
- 缺锌
- 微
- 转录组
- 铜
- 氧化应激