- 研究文章
- 开放获取
- 发布:
转录组分析Pueraria candollei.var。mirifica.在异黄酮和Miroestrol的生物合成中的基因发现
BMC植物生物学体积19, 文章编号:581(2019)
抽象的
背景
Pueraria candollei.var。mirifica.作为传统上使用的泰国药用植物作为一种恢复活力的草药,被称为富植物雌激素的丰富来源,包括异黄酮和高度雌激素的雌激素和脱氧性雌激素。虽然这些活性成分p . candolleivar。mirifica.人们知道它们的生物合成基因已经有一段时间了,但关于它们的生物合成基因的实际知识仍然未知。
结果
重新考虑了微雌醇的生物合成,并提出了从大豆黄酮类异黄酮入手的最合理的生物合成机制。使用联合转录组进行从头转录组分析p . candolleivar。mirifica.幼叶,成熟叶,结节状皮层和皮层切除的结节的组织。共组装了166,923个contigs,用于蛋白质数据库的功能注释,并作为一个文库,用于鉴定可能参与异黄酮类化合物和微雌醇生物合成的基因。从4个不同的文库中筛选出21个差异表达的基因,分别参与这些生物合成途径,并通过实时定量逆转录聚合酶链反应验证它们各自的表达。值得注意的是,LC-MS/MS生成的异黄酮和微雌醇谱与四种组织中异黄酮生物合成基因的表达水平呈正相关。此外,我们还鉴定出R2R3 MYB转录因子可能参与调控黄酮类化合物的生物合成p . candolleivar。mirifica..为了确认关键异黄酮生物合成基因的功能,p . candolleivar。mirifica.在我们文库中鉴定的异黄酮合酶与拟南芥MYB12转录因子(在MYB12)烟草benthamiana叶子。值得注意的是,这些蛋白的联合表达导致了异黄酮染料木素的生产。
结论
我们的结果提供了令人信服的证据,表明转录组和代谢组的整合是鉴定生物合成基因和转录因子的有力工具,可能参与了异黄酮和微雌醇的生物合成p . candolleivar。mirifica..
背景
白人krua(Pueraria candollei.var。mirifica.,以后简称为p . mirifica,见附加文件1:图S1),已广泛用于泰国传统医学作为一种恢复活力的草药,因为其许多植物发酵成分[1].植物雌激素是植物源化合物,在结构或功能上模仿哺乳动物雌激素,它们已被用于治疗不同形式的癌症、心脏病、更年期症状和骨质疏松症[2].考虑到植物雌激素对人体健康的许多影响,p . mirifica可能是治疗各种疾病和开发新型药物的有前途的候选药物。
植物雌激素有三种主要类型p . mirifica:异黄酮,Coumestans和Chromenes [3.,4,5].异黄酮是一种重要的植物雌激素,通过苯丙素途径生物合成,主要存在于豆科植物中[6].七种异黄酮已经在p . mirifica块茎:葛根素、大豆黄酮、生黄素、大豆黄酮、染料木素、瓜胡林和米力霉素[3.,5].在这个植物的块茎中也发生的四个库玛斯坦是Coumestro,Mirificoumestan,Mirificoumestan水合物和米什莫斯坦[7].铬化的化学结构由于其低毒性和广泛的药理学应用作为抗癌,抗微生物和抗炎剂而受到相当大的关注[8].米罗雌酚及其前体脱氧米罗雌酚通常以非常低的水平积累[9,然而,这些化合物是结节皮质的主要色素p . mirifica[10],这两种化合物都表现出相当高的雌激素活性[11].由于两种染色体尚未在其他植物物种中报道,它们的生物合成可能是独一无二的p . mirifica.有趣的是,虽然Miroestrol差不多六十年前已经确定了它的生物合成途径和所涉及的酶仍然未知。
在植物雌激素的生物合成方面,异黄酮和类黄酮的早期合成步骤大致相似,从苯丙氨酸解氨酶开始,从第一个底物苯丙氨酸中去除酰胺,生成肉桂酸,再由肉桂酸4-羟化酶羟基化生成肉桂酸p-coumarate。然后酶4-香豆素-CoA连接酶然后激活p通过结合辅酶a (coA),随后,查尔酮合酶(CHS)结合p-coumaroyl-coa至三分类的丙隆-coa形成骨骨骨骼。Cholcode可以通过Chalcone异构酶转化为黄烷酮。LialIritigenin是一种用于类黄酮和异戊类化途径的底物。异丙鲸州通常通过芳基迁移在公认的类黄酮生物合成途径内由普通的中间体(Liquiritigenin或Naringenin)合成,该芳基迁移由异黄酮合成酶(IFS)催化。该途径导致形成中间产物,2-羟基异氟苯胺,然后通过2-羟基异戊酮脱水酶催化脱酐,然后通过催化脱水至Daidzeinin(图。1)[12].CHS和IFS已经在p . mirifica几年前[13,14,但其酶学功能尚未阐明。Udomsuk等人[15建议由于其相似的骨干结构,Miroestrol生物合成可以共用具有异黄酮生物合成的常见途径。到目前为止,已经报道了没有参与Miroestrol生物合成中的生物合成基因或酶,因此还核查负责调节这些生物合成基因表达的转录因子。据报道,V-MYEL骨髓丝溶病病毒癌症病毒癌症是最大的植物转录因子家族的病毒性癌症同源物转录因子(MYB TFS)具有调节植物中苯丙烷衍生的化合物的合成的关键功能[16].这些蛋白质引起了对植物中植物雌激素生物合成的大量兴趣。
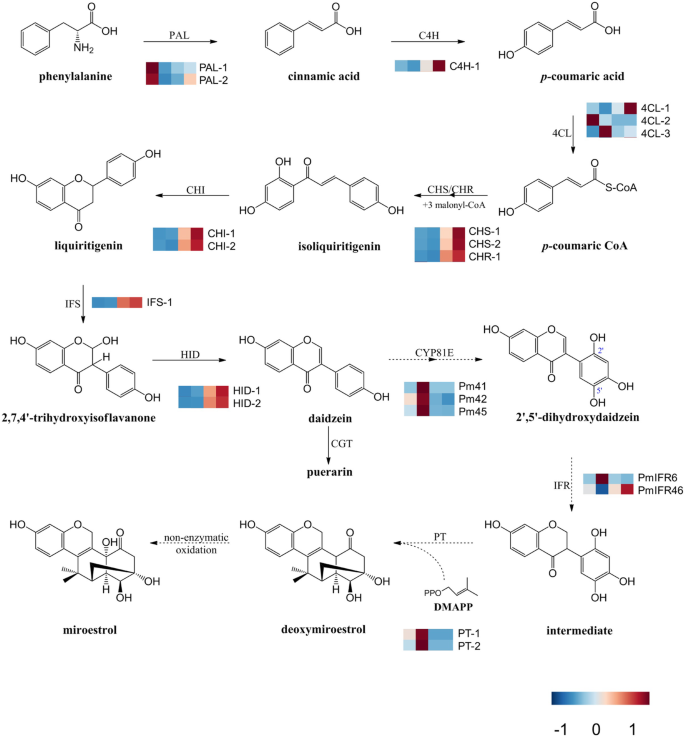
提出微雌酚的生物合成途径p . mirifica。每个基因名称后面的热图显示了基因在幼叶、成熟叶、无皮块茎和胚层中的相对差异表达p . mirifica,分别。酶缩写:朋友;苯丙氨酸ammonia-lyase, C4H;肉桂酸4-monooxygenase 4 cl;CHS Coumarate-CoA连接酶;查耳酮合酶,气;查耳酮异构酶,IFS;2-hydroxyisoflavone合成酶,藏;2-hydroxyisoflavone脱水酶,资本利得税;C糖基转移酶,CYP81E;细胞色素P450亚家族81E, IFR;异黄酮还原酶,葡文;Prenyltransferase。虽然组装的unigenes是假设的候选基因,一个比较转录组分析使用p .兜水母目这是一种很有前途的方法来研究和识别参与高度复杂的生物合成小雌酚的物种特异性和进化保守途径
不同植物高通量测序产生的转录组是鉴定不同次级代谢产物生物合成相关基因的潜在来源。的转录组葛根,一个与之密切相关的物种p . mirifica已发布以前[17,18].尽管这两种植物产生相似类型的异黄酮,但只有微量雌二醇在p mirifica.在上述研究中,p .兜水母目鉴定了编码核心异黄酮生物合成酶的基因,并检测了其在不同组织中的表达水平。
在目前的研究中,我们高吞吐量测序p . mirifica为了产生幼叶、成熟叶、切除皮层的块茎和结节状皮层的转录组库,我们重新组装转录组来表征微雌酚的生物合成途径。此外,还鉴定出参与异黄酮生物合成的MYB转录因子。这种利用转录组学和代谢组学的综合方法为预测和鉴定可能涉及的生物合成基因和转录因子提供了新的见解p . mirifica异黄酮和微雌酚的生物合成途径。
结果
从头转录组组装p . mirifica
获得不同组织中表达基因的核苷酸序列p . mirifica,我们从包括幼叶、成熟叶、切除皮层的块茎和结节状皮层的组织中构建了cDNA文库。2广告)。使用Illumina Hiseq 2000平台处理图书馆,产生约8.2g碱基对,总共7,386,137,640核苷酸(NT)。DE Novo组件导致166,923个葡萄片(62,567,517 nt)和104,283个unigenes(81,810,584nt),平均鳞片和unigenes的平均长度/ n50分别为375/734 nt和785/1558 nt。为了评估转录组数据的完整性,我们与eudicot谱系的2121单拷贝外翻相比进行了Busco分析。De Novo转录组组件完成为87.4,缺少6.9%的葡萄片,缺失5.7%的转录组(附加文件7:表S1)。此外,这里生产的组件与其他豆科植物的组件进行了比较(在表中总结)1).
蛋白质的功能注释与分类
组装转录本的功能注释提供了一个有机体内潜在的代谢功能和生物过程的见解。的功能注释p . mirifica根据各种公共数据库中提供的信息,根据蛋白质或转录本的相似度组装转录本。功能注释的统计在附加文件中进行了总结8:表S2。对齐的unigenes使用国家生物技术信息中心(NCBI)非冗余蛋白质数据库显示出显着的同源性。基于爆炸相似性分布,超过68%的未成年人表现出大于80%的相似之处。顶部受到的物种分布分析显示爆炸点击的unigenes与爆炸点击分享高序列相似之处大豆(85.3%),Medicago truncatula(6.2%)和葡萄(1.6%)。
同源组的聚类表明了各基因在细胞水平上的功能分类。总共有1091个unigenes被预测参与次级代谢产物的生物合成(附加文件)2:图S2)。基因本体论(Gene ontology, GO)是对标准化基因功能进行分类的一种方法,对生物体内的基因功能和基因产物进行注释具有重要意义。氧化石墨烯基于三个主要的依赖因素类别:生物过程、分子功能和细胞成分。37058个unigenes生成了相应的GO术语,可进一步分为56个子类:23个与生物过程有关的类,17个与细胞成分有关的类,16个与分子功能有关的类。额外的文件3.:图S3显示了与细胞组分和代谢过程相关的大量转录物。剩下的67,225 unigenes没有产生爆炸点击。这些未经发布的unigenes可以是无表征的基因或组装序列,其太短而不能产生击中。
京都基因和基因组百科全书(KEGG)是一个全面的数据库,用于识别生物途径和基因产品的功能注释。基于通路的注释有助于对生物体中活跃的不同代谢过程进行概述,并有助于提高我们对unigenes生物学功能的理解。所有unigenes均通过KEGG途径进行分析e-value截止值< 10−5.我们获得了33,317个unigenes,其中3997个与次级代谢物生物合成和8103次有关的一般代谢途径。前五个排名途径是植物激素信号转导(2061 unigenes),内吞作用(1254个unigenes),RNA运输(1232个unigenes),甘油磷脂代谢(1131 unegenes)和嘌呤代谢(1113 unigenes)。关于豆类植物积累官能类黄酮类化合物的关键能力,在附加档案中显示了476种黄酮化生物合成的未成语和167个异戊类生物合成的未成语4:图S4。这些功能注释用于鉴定与异黄酮生物合成相关的基因p . mirifica.
提出了微雌酚的生物合成途径,异黄酮类化合物相关转录本的差异积累和微雌酚的生物合成
miroestrog生物合成潜在地分享异链类生物合成的途径[15].我们推测大豆苷元是一种常见的异黄酮苷元,在b环的2 '和3 '碳上至少被两种细胞色素P450酶羟化,生成2 ',5 ' -二羟基大豆苷元;这些酶可能是CYP81E亚家族的成员,该亚家族以异黄酮为底物[22,23,24,25].然后,通过异黄酮还原酶减少2',5'-二羟基霉菌素,随后将使用戊基转移酶使用二甲基丙烯酸二磷酸酯作为共氧化族脱氧化物,以产生脱氧氧化卵体和Miroestrol(图。1).
基于在中发现的每个UNIGENE的功能诠释p . mirifica通过转录组组装和系统发育分析,共预测了14个可能参与异黄酮生物合成的基因:2个朋友基因(编码苯丙氨酸解氨酶),1C4H基因(编码肉桂酸4-羟化酶),三个4CL.基因(编码4-香豆酸-辅酶a连接酶),二CHS基因(编码查尔酮合酶),1空空的基因(编码Chalcone还原酶),两个气基因(编码查尔酮异构酶),1ifs.基因(编码IFS)隐藏基因(编码2-羟基异氟硅烷酮脱水酶)。此外,在我们提出的miroestrol生物合成途径中,共鉴定了七种推定基因:三个CYP81E基因,两IFR.基因(编码异黄酮还原酶)和两个PT基因(编码prenyltransferase)。研究这些基因在四种组织中的表达水平p . mirifica,从使用NextSeq500平台生成的RNA测序数据计算每千逐百万的转录物。基于我们所提出的Miroestrol生物合成途径,将差异表达基因(差异阈值Q = 0.9)的分析被视为热图(图。1).它们的序列和RPKM值显示在附加文件中9:表S3。此外,从转录组数据中系统发育学鉴定了总共16个可能参与该途径的udp -糖基转移酶编码基因。他们的四种组织类型的差异在附加文件中以热图的形式显示5:图S5。
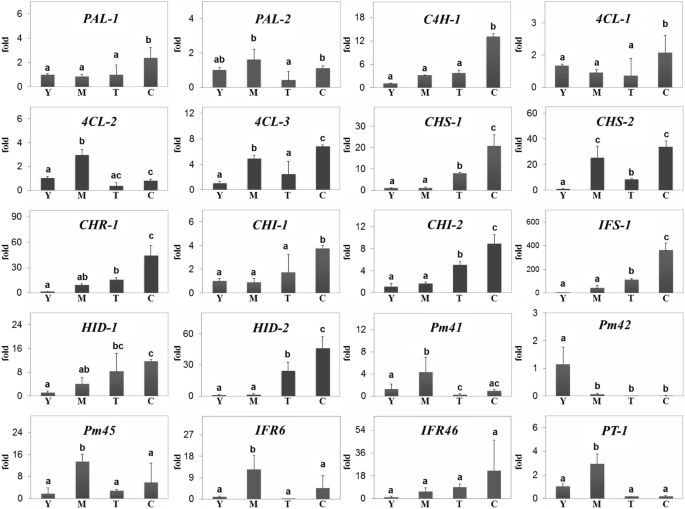
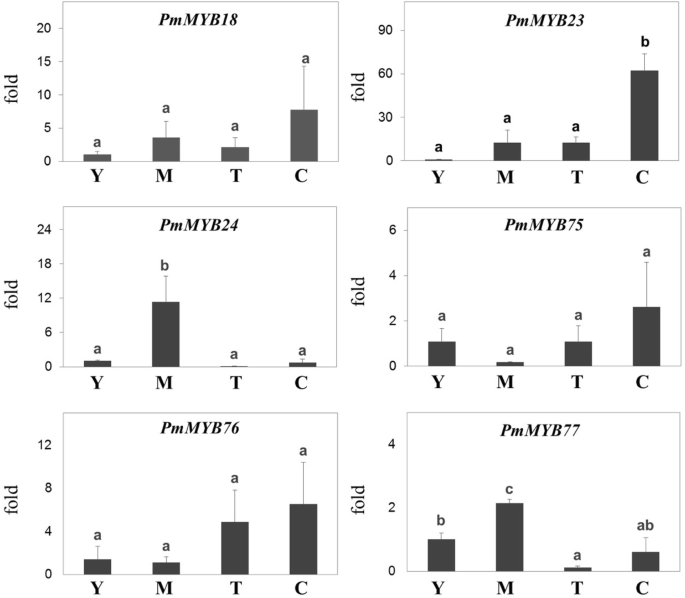
为了验证RNA测序得到的DEG分析结果,我们根据候选基因在四种组织类型中的表达水平,采用实时定量逆转录聚合酶链反应(qRT-PCR)对候选基因进行分析。如预期的那样,所选unigenes的表达水平与RNA测序所鉴定的DEGs呈正相关(图)。3.).事实上,与幼叶、成熟叶和切除皮质的块茎相比,大多数异黄酮生物合成基因在块茎皮质中高度表达;然而,点CYP81ES,点国际财务报告准则,点Pt高于成熟的叶子表达而不是在其他组织中。
候选人的相对表达涉及异黄酮生物合成的四种组织p . mirifica中存在。组织缩写:Y;年轻的叶子,M;成熟叶、T;cortex-excised块茎,C;结节性皮质。基因缩写:朋友;苯丙氨酸ammonia-lyase, C4H;肉桂酸4-monooxygenase 4 cl;CHS Coumarate-CoA连接酶; Chalcone synthase, CHI; Chalcone isomerase, IFS; 2-hydroxyisoflavone synthase, HID. Significantly different expression levels of putative genes (ANOVA, post-hoc Duncan test,P < 0.05) have different lowercase letters
植物雌激素和注释的成分p . mirifica
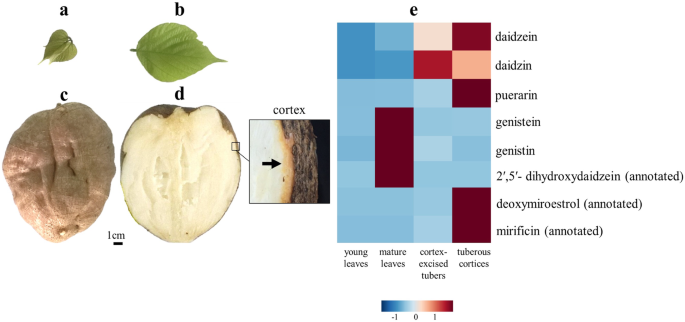
高效液相色谱(HPLC) -串联质谱(MS)是一种具有高选择性和高灵敏度的强大工具。共鉴定出7种植物雌激素p . mirifica根据保留时间和质谱碎片模式与标准化合物进行比较。这些植物雌激素包括大豆黄酮、大豆黄酮、染料木素、染料木素、2 ' -羟基大豆黄酮、3 ' -羟基大豆黄酮和葛根素(表)2).由于缺乏标准化合物,致力学,2',5'-二羟基霉素,脱氧性罗瑞罗和Miroestrol,基于质量准确性范围和MS分段模式在Metin Metabolomics数据库上进行的MIROSICATIONS [26/和与已发布数据的比较[27].主要植物雌激素的相对丰度发现在幼叶,成熟叶,皮质切除的块茎,和结节皮质p . mirifica为图中的热图。2e.与其他组织相比,成熟叶片中积累较多的是染料木素(Genistein)、染料木素(genistin)和注释2 '、5 ' -二羟基大豆苷元(dihydroxydaidzein),而结节皮质中积累较多的是大豆苷元(daidzein)、葛根素(puerarin)、甲基咪唑霉素(mirrificin)和脱氧甲基雌二醇(deoxymiro雌二醇)。尽管在任何组织中均未检测到米罗雌酚,但其前体(注释的脱氧米罗雌酚)仅在组织中观察到p . mirifica结节性皮质,这是Miroestrol的主要累积部位[10].
异黄酮生产n benthamiana叶子过度表达p . mirifica异黄酮合成酶
最近,n benthamiana已被用于识别多个植物基因的瞬时表达,以确认基因功能[28].证明我们的转录组文库含有候选基因p . mirifica植物雌激素生物合成,我们克隆了p . mirifica异黄酮合成酶(PmIFS的瞬态(共)表达式进行了函数表征n benthamiana不产生任何异黄酮。5周龄时绿色荧光蛋白的瞬时表达n benthamiana叶片为阴性对照。Co-expression的PmIFS和拟南芥MYB12转录因子(AtMYB12),调节剂增强代谢通量的黄酮类生物合成[29,产生了两个新的主峰,被确定为染料木素(附加文件6:图S6),说明PmIFS参与异黄酮的生物合成。
参与异黄酮生物合成的MYB转录因子的鉴定
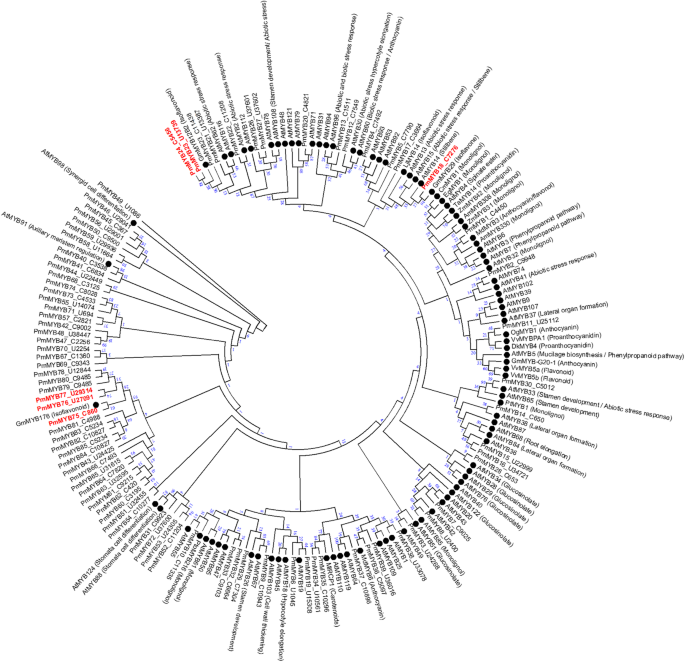
我们确定了在编码MYB转录因子的推定基因p . mirifica转录组。所有推定p . mirificaMYB转录因子(PmMYB)与其他植物已知的MYB转录因子进行了比对拟南芥,大豆和其他物种,并根据这种排列产生系统发育树(图。4).基于这些分析,我们发现了6种可能参与调控异黄酮生物合成的候选pmmyb。PmMYB18与GmMYB29密切相关ifs.和CHS在大豆[30.].PMMYB23和PMMYB24与GMMYB12B2聚集,调节表达CHS在大豆[31,32].PmMYB75、PmMYB76、PmMYB77与GmMYB176聚类,GmMYB176也参与了控制CHS大豆中异黄酮的表达和合成[33,34].此外,还PMMYB24和PmMYB77在成熟叶片中表达量高,而PMMYB18,PMMYB23,PmMYB75,PmMYB76在结节皮质中高表达(图。5).
讨论
从头转录组组装是一种不需要全基因组测序就能收集遗传资源综合信息的有效方法。此外,这项技术有助于发现新的基因、分子标记和组织特异性表达模式。在缺乏全面的基因组数据的情况下p . mirifica,用RNA测序法探索p . mirifica转录组。虽然Illumina HiSeq平台在大规模转录组学研究中比其他方法有很多优势,但输出数据需要更多的时间进行处理和分析。因此,Illumina NextSeq平台被设计为一种更快、更容易操作的台式设备,以减少成本和数据处理时间。这两个平台的总体错误率(< 1%)具有可比性[35].在这里,我们使用Illumina Hiseq 2000平台来生产来自四种组织的转录组文库,以及illumina nextseq 500平台,以确定由四种组织产生的每个转录组文库中的基因表达模式p . mirifica.BUSCO分析证实94.3%的完整和片段序列包含在组装中(附加文件7表S1),表明我们的从头转录组组装涵盖了绝大多数同源基因。我们从HiSeq平台上生成的从头转录组组装中生成了大量的unigenes数据集。unigenes的平均GC含量为44.56%。在真核生物中,GC含量平均约为20-60% [36].观察到的p . mirificaGC含量在这个范围内,但虽然略高于那些p .兜水母目(39.9%) (17] 和Medicago truncatula(40%) (37),但类似于大豆(43%) (37].此外,大多数注释的unigenes产生匹配大豆蛋白质数据库,表明在这两个物种中保守各自的功能。虽然p .兜水母目被认为是密切相关的p . mirifica,只有0.12%的注释的unigenes匹配p . mirifica.这是由于全长度序列的数量有限p .兜水母目在蛋白质数据库中可用,目前可用p .兜水母目NCBI参考转录组是原始测序数据[17,18].此外,Gene或蛋白质名称,COG的描述以及可能的代谢途径也是注释的。值得注意的是,在从NextSeq平台数据生成的四个库中找到了从HiSeQ平台数据生成的所有候选基因。四种组织的相应表达水平p . mirifica可用于减少进一步功能表征的候选项的数量。
异黄酮是一种类黄酮,几乎只在豆科植物中产生[6].在p . mirifica在转录组数据集中,鉴定了21个可能参与异黄酮生物合成的基因。经qRT-PCR验证,这些unigenes的DEG值在结节皮质中表达水平高于其他三种组织。因此,几乎所有的异黄酮,如葛根素和大豆苷,也表现出最高的积累在结节皮质。当比较p . mirifica和p .兜水母目,各组织的基因表达和异黄酮积累谱相似[17,18,除了缺乏之外ifs.叶片中的表达和异黄酮积累p .兜水母目[17].这一观察结果表明,这两个密切相关的物种在不同的地区有不同的进化模式(p .兜水母目在温带地区p . mirifica在热带地区)。它可能是p . mirifica已经进化了一种机制,将叶片和米拉雌卷中的异黄酮在茎秆皮质中作为防御手段中的一种防御。评估我们的转录组数据是否包含候选基因,我们克隆点IFS进n benthamiana,不天然产生异黄酮类化合物,用于瞬时共表达点假设和在MyB12,黄酮类生物合成的激活剂[29].这导致染料木素和染料木素的积累(附加文件6:图S6)。的证明在足底的函数点IFS表明,我们的转录组库适用于鉴定其他参与小雌酚生物合成的基因。尽管在以前的研究中,初步提出了一种生物合成途径的米罗雌酚[15]迄今为止,Miroestrol生物合成所需的基因仍然是未知的。在此,重新考虑miroestrol的生物合成途径,提出了最合理的机制(图。1).在我们的转录组数据中,我们还鉴定了7个推测的基因,它们编码3种生物合成酶,参与我们提出的微雌酚生物合成途径。据报道,与皮质切除的结节相比,结节皮质中脱氧甲基雌二醇和甲基雌二醇的积累量更高p . mirifica[10].同样,我们在结节皮质中特异性检测到脱氧甲酚p . mirifica;然而,未检测到米罗雌酚。在储存和提取过程中,在高温或酸性或碱性溶液中,小雌酚可以非酶转化为脱氧小雌酚[38,39].在我们的实验中,p . mirifica采集组织并在液氮中迅速冷冻,以防止脱氧甲基雌二醇转化为甲基雌二醇。此外,在任何组织中均未检测到拟合成的中间体2 ' -羟基大豆苷元和3 ' -羟基大豆苷元。我们假设一个有组织的多酶簇,被称为代谢,可能参与了小雌酚的生物合成,并对那些隐蔽的生物合成中间体的缺乏负责。事实上,越来越多的研究将生物合成途径的组织描述为代谢产物。特别是,最近的一项研究表明,大豆植物中IFS和查尔酮还原酶之间的代谢复合物中有高效和特异性的底物转化[40].另外,已经示出了在没有不稳定的中间体泄漏的情况下形成弥扑蛋白沟槽衬底的形成[41].
关于可能参与微雌酚生物合成的基因p . mirifica,我们发现了CYP81E,IFR.,PT这些基因在成熟叶片中高度表达,而不是小雌酚和脱氧小雌酚的积累位点。也许这些中间产物或脱氧雌二醇最初是在成熟的叶子中合成的,然后转化为一种可溶性的苷,这种苷很容易通过器官运输,然后主要储存在结节皮质中。事实上,米罗雌酚的糖基化形式已经在p . mirifica块茎(42].这些转运的实例也是在烟草中已知的,其中尼古丁从根部输送到叶片的生物合成位点。次级代谢物在植物细胞之间通过二级转运蛋白倾斜,然后在适当的组织或器官中累积[43].然而,脱氧甲酚中间体的转运机制尚不清楚,有待进一步研究。然而,生物合成基因的全面功能表征和任何中间体的同位素标记都需要验证这一假设。另外,我们也不排除在结节皮质中生物合成脱氧甲基雌二醇和中间体的可能性,因为相应的生物合成基因在结节皮质中的表达低于成熟叶。这些低表达水平的推定小雌酚生物合成基因可能是低积累水平的脱氧小雌酚和小雌酚的部分原因。此外,我们在结节皮质中发现相当高的葛根素。因为葛根素、脱氧甲基雌二醇和甲基雌二醇共享一个早期的生物合成途径(图。1),大豆苷元可能主要转入葛根素的生物合成途径,产生较低水平的大豆苷元用于微雌酚的生物合成。此外,我们系统发育学上共鉴定了5个推定基因,注释为C-glycosyl转移酶,在生产8-中起着关键作用C-Glycosylation [44在葛根素生物合成途径中的作用。其中一个推测的基因CL7002与之前鉴定的基因有92.32%的相似性P. lobata C.糖基转移酶(CGT43)。与其他组织相比,这些推测的基因在结节皮质中高度表达(附加文件5:图S5)。此外,一些糖基转移酶已被证明可以形成代谢复合物,促进生物活性化合物的高效生产[45,46,47].这些观察结果对利用大豆苷元生产葛根素具有重要意义。抑制点CGT可能是一种提高块茎中微雌酚产量的替代策略。
增强异黄酮的产生的不同策略及其有价值的衍生物是操纵转录因子调节。在该研究中,我们鉴定了MyB TF,其通常用作各种植物次级代谢产物的转录活化剂或阻遏物,包括异氟类异戊类药物。氨基酸对准和表达模式是用于确定单个MYB TFS的功能的信息。六个候选MyB(在图1中的系统发育树中以红色表示。4)是由于它们与参与异黄酮生物合成基因调控的MYB转录因子的系统发育聚类而提出的。有趣的是,其中4个转录因子基因在结节皮质中高度表达,异黄酮的累积量最高(图2)。5).此外,其中两个转录因子,点myb18和点MYB75与那些作为查尔酮还原酶和IFS转录激活剂的MYBs共享一个分支,并增加异黄酮的产生[30.,34].因此,这两种MYB是进一步的功能表征的重要候选者,并且点MYB转录因子可能与异黄酮的生物合成和微雌醇的生产调控有关。
结论
我们鉴定了编码在异链类和Miroestro的生物合成中的关键酶或转录因子的几种候选基因。转录组织和代谢组学的整合分析表明基因表达和代谢物谱之间的复杂性跨组织,表明皮质块茎组织是异链类生物合成的主要部位。需要对参与miroestrol生物合成的候选基因的进一步分子和生化研究是鉴定这些候选基因的功能。
方法
植物原料,化学品和试剂
大约两岁的叶子和块茎p . mirifica品种SARDI190(无花果。2a)从a中获得p . mirifica泰国Nakhonpathom Kamphaeng Saen校区Kasetsart大学的农场(14°1′n, 99°58′e)。这个物种被证实是p . mirifica通过与代金券标本编号的比较。BCU010250和BCU011045保存在泰国朱拉隆功大学理学院植物系Kasin Suvatabhandhu教授标本室。研究p . mirifica已被泰国传统和替代医学部,公共卫生部,泰国(DTAM1-2 / 2561)批准。种子n benthamiana在无菌土壤培养室内,25°C, 16/8 h光照/黑暗循环下萌发。在发芽5天后,n benthamiana幼苗在收获前每周浇水两次。2 ' -羟基大豆苷元标准化合物[22]和3 ' -羟基大豆苷元[22]来自日本尼河大学的Tomoyoshi Akashi博士获得。大德尼林和吉素因是从Calbiochem(Merck,德国),而Daidzin,Genistin和葛根素购自Sigma-Aldrich(美国)。所有其他化学品都是商业上可获得的分析试剂级产品。
结合RNA的从头转录组组装的构建p . mirifica使用Illumina Hiseq 2000
使用Rneasy Plant Mini Kit (Qiagen, USA)从幼叶、成熟叶、皮层切除的块茎和结节状皮层中分离总RNA,使用Rnase-free Dnase Set (Qiagen, USA)去除柱上DNA。RNA质量通过琼脂糖凝胶电泳检测,数量通过生物光谱仪(德国埃彭多夫)测定。所有四种组织类型的高质量RNA均汇集在一起,并由Illumina Hiseq 2000在香港华大基因进行测序。原始读取使用华大基因的内部软件filter fq进行过滤,以产生干净的配对读取和非配对读取。然后使用Trinity软件组装Contigs和unigenes [48].我们使用了针对eudicotyledons_odb10数据集的BUSCO (Benchmarking Single-Copy Universal Orthologs) 3.0.2版本分析[49,50]评估完整性。在NCBI序列读取存档中沉积了原始的转录组数据(登录号:SRR6917866)。
四种组织的基因表达水平分析p . mirifica使用illumina nextseq500生成
使用三种生物重复从每个组织类型中提取总RNA。基于分光光度法,每组组织类型以相等的量型合并重复的高质量RNA等分试样。然后使用Illumina NextSeq500平台进行四个RNA池进行成对序列测序。Contigs使用Trinity软件组装[48].为了估计基因表达水平,我们绘制了所有reads的图谱fastq格式化到Contigs并计算每百万映射读取值的成绩单的每千级读数。用于识别DEG的非参数方法用于产生与SoftaWre CoketQ-SIM的四个独立的成对样本比较[51].原始转录组数据保存在NCBI序列读取档案中(登录号分别为SRR10177497、SRR10177499、SRR10177500和SRR10177498,这些序列分别来自幼叶、成熟叶、切除皮层的块茎和结节状皮层)。
装配序列的功能注释
首先将组装序列与NCBI非冗余蛋白质数据库进行比较(https://www.ncbi.nlm.nih.gov/refseq/), Swiss-Prot (https://www.ebi.ac.uk/uniprot),基因和基因组的京都百科全书(Kegg;http://www.kegg.jp/kegg/),和彻底组织群(COG;e值< 1E5;https://www.ncbi.nlm.nih.gov/COG/)通过Blastx和核苷酸数据库NT(e值< 1E5;https://www.ncbi.nlm.nih.gov/nucleotide/使用BLASTn)。然后统计每个数据库中注释的unigenes的数量。将Unigenes映射到COG数据库中,预测其潜在功能,并进行统计分析。BLAST2GO软件v2.5.0 [52]用于使用默认设置基于BLAST结果分配GO类别。使用WegoS软件可视化所有Unigene Go功能类别和不同物种中基因功能的分布[53].
系统发育分析
利用Expasy翻译工具将所有推测的基因翻译为氨基酸序列(http://web.expasy.org/translate/).利用BioEdit软件对所有可能涉及类异黄酮和色素合成的基因的全长序列进行了比对(http://www.mbio.ncsu.edu/bioedit/bioedit.html.).我们使用MEGA7软件对100个bootstrap复制应用了最大似然法[54]产生系统发育树。
qRT-PCR检测候选基因表达
qRT-PCR检测候选基因的转录水平。使用从四种组织类型中分离的总RNA(图。2a-d),用RevertAid第一链cDNA Synthesis Kit (Thermo Fisher, USA)合成单链cDNA。执行中存在使用等量的模板DNA在CFX96 TouchTM实时PCR检测系统与iTaq普遍SYBR绿色Supermix(美国Biorad)和在下列条件:95°C 8分钟紧随其后40 95°C的周期10年代,60°C 15 s, 72°C 30年代。用于扩增候选基因序列的特异性引物见附加文件10:表S4。这p . mirifica编码EF1α的UNIGENE被扩增为内部控制。每次反应使用三种生物重复进行。计算叶片和结节根中表达的候选基因的相对表达比并标准化为同一样品中的参考基因(EF1α)转录水平[55].
代谢物提取从p . mirifica样本
p . mirifica样品被冷冻,磨成细粉,并冻干过夜。30毫克干粉溶解在500 μL甲醇(85%)中提取代谢物,使用混合器MM400(德国Retsch), 25 Hz剧烈摇动7分钟。粗代谢物提取物通过带有0.2 μm Supor®膜(Pall, USA)的Acrodisc®注射器过滤器过滤,并在−20°C下保存,直至分析。
HPLC四极杆飞行时间质谱分析植物雌激素(HPLC- qtof -MS/MS)
HPLC-QTOF-MS/MS分析使用Agilent HPLC 1260系列设备与QTOF 6540 UHD precision - mass系统(Agilent Technologies, Germany)进行。样品溶液采用Luna C18色谱柱(2)150 × 4.6 mm, 5 μm (Phenomenex, USA)进行分离。溶剂流速为0.5 mL/min,进样量为5 μL。二元梯度洗脱体系以水为溶剂A和乙腈为溶剂B,溶剂均含0.1%甲酸(v/v)。线性梯度洗脱为5 - 95%溶剂B在35分钟后运行5分钟。柱温设置为40℃。负ESI源的条件为:干燥气体(N2)流速10 L/min,干燥气体温度350°C,雾化器30 psig,碎片设置为100 V,毛细管电压3500 V,扫描光谱从m / z.100 - 1500。在碰撞能量分别为10、20和40 V时设置自动MS/MS进行破碎。所有数据分析使用Agilent MassHunter定性分析软件B06.0 (Agilent Technologies, USA)进行。
分子克隆及瞬时表达点假设和在myb12 in.n benthamiana
编码异黄酮合酶的基因(点IFS;NCBI序列登录号为MK524721)p . mirificacDNA使用以下特异性引物:正向5 ' -ATGTTGCTGGAACTTGCAATTG-3 ',反向5 ' -TCAAGAAGGAGGTTTAGATGC-3 '。拟南芥MYB12 (在MYB12;(登录号NM130314),扩增该基因的全长序列拟南芥cDNA使用以下基因特异性引物:正向5 ' - ATGGGAAGAGCGCCATGT-3 '和反向5 ' - TCATGACAGAAGCCAAGCG-3 '。PCR进行使用50μL反应卷和Phusion®高频高保真DNA聚合酶(热费希尔科学、芬兰)与下面的热循环协议:98°C, 1分钟之后,35周期98°C的10年代,60°C 30年代,72°C 1分钟,最后在72°C扩展步骤5分钟。琼脂糖凝胶电泳显示PCR产物。将目标大小的扩增子连接到pJET1.2载体(Fermentas, USA)中进行测序。这些基因随后被亚克隆到pDONOR207和pEAQ-HT-DEST1 [56,分别使用网关克隆系统,根据制造商的说明(Invitrogen,美国)。重组pEAQ-HT-DEST1载体携带PmIFSpEAQ-HT-DEST1带菌者在MYB12被电转化为农杆菌肿瘤术LBA4404。对阳性克隆进行菌落PCR。在补充有100μg/ ml利福平,50μg/ ml kanamycin和100μg/ ml链霉素的5ml YEB培养基中,在5ml YEB培养基中生长每种转化体的单个菌落(在28℃下旋转)。然后使用灭菌的蒸馏水洗涤培养物三次。将所得颗粒置于重悬浮溶液中(10mM MgCl2, 10 mM meses - k, 100 μM acettosyringone, pH 5.6)。这农杆菌属溶液被调整为A600大约0.4并在室温下放置在渗透前2-3小时。这农杆菌属溶液从大约四周龄的第3和第4叶(从茎尖处)渗入n benthamiana植物。经过五天后,使用液氮快速冷冻渗透叶,随后研磨成粉末。然后将粉末冻干,然后在室温下真空储存。将三十毫克粉末溶于500μl的85%甲醇,通过在25Hz的混合器轧机MM400(RetSch,德国)剧烈摇动7分钟,通过剧烈振动提取代谢物。将粗提取物通过Acrodisc®注射器过滤器过滤,具有0.2μmsupor®膜(Pall,USA)。
数据和材料的可用性
在本研究中使用和/或分析的数据集可从通讯作者在合理要求。
缩写
- 4 cl:
-
4-coumarate辅酶a连接酶
- Busco:
-
基准单拷贝通用Orthologs
- C:
-
结节性皮质
- C4H:
-
肉桂酸4-hydroxylase
- 资本利得:
-
C糖基转移酶
- 气:
-
Chalcone异构酶
- 装备:
-
Chalcone还原酶
- CHS:
-
查耳酮合酶
- 齿轮:
-
同源群的簇
- CYP81E:
-
细胞色素p450亚家族81e
- 度:
-
差异表达基因
- DMAPP:
-
Dimethylallyl焦磷酸
- EF1α:
-
伸长因子1
- GFP:
-
绿色荧光蛋白
- 走:
-
基因本体论
- 藏:
-
2-hydroxyisoflavanone脱水酶
- HPLC-QTOF-MS / MS:
-
高效液相色谱四极杆飞行时间串联质谱
- 仪表:
-
异黄酮还原酶
- 假设:
-
异黄酮合成酶
- Kegg:
-
京都基因和基因组百科全书
- M:
-
成熟的叶子
- MYB TF:
-
V-MYB myeloblastosis病毒性癌基因同源物转录因子
- NR:
-
NCBI非冗余蛋白数据库
- 朋友:
-
苯丙氨酸氨裂解酶
- PT:
-
Prenyltransferase
- RPKM:
-
读取每千碱基的转录每百万映射读取
- SRA:
-
顺序读取存档
- T:
-
Cortex-excised块茎
- Y:
-
年轻的叶子
参考文献
- 1.
从泰国草药中提取植物雌激素的医学应用国内外葛根mirifica.医学。2012;6(1):8至21。
- 2.
奥索斯基,肯纳利EJ。植物雌激素:研究现状综述。Phytother杂志2003;17(8):845 - 69。
- 3.
英汉姆JL, Tahara S, Dziedzic SZ。对…的化学研究国内外葛根mirifica的根源。中国科学(d辑):地球科学(英文版);
- 4.
Cherdshewasart W,Subtang S,Dahlan W.主要异黄酮含量的植物雌超富含草药国内外葛根mirifica和。。比较葛根.acta Pharm Biomed Anal. 2007;43(2): 428-34。
- 5.
Cherdshewasart W, Sriwatcharakul S.主要异黄酮含量的1年栽培植物雌激素丰富的草本植物,国内外葛根mirifica.生物技术与生物化学。2007;71(10):2527-33。
- 6.
维奇数控。豆科异黄酮。中国科学(d辑:地球科学)2013;30(7):988-1027。
- 7.
英汉姆JL, Tahara S, Dziedzic SZ。来自根源的Coumestans国内外葛根mirifica.自然科学学报1988;43(1-2):5-10。
- 8。
染色质结构多样化的生物学意义。Eur J Med Chem. 2016; 123:487-507。
- 9。
Jones HE, Pope GS。一种分离米罗雌酚的方法国内外葛根mirifica.J内切蛋白。1961; 22(3):303-12。
- 10.
Yusakul G,Putapun W,Udomsin O,Juengwatanatrakul T,ChaiChantipyuth C.两种品种化学成分的比较分析Pueraria candollei..Fitoterapia。2011;82(2):203 - 7。
- 11.
Cain JC。miroestrol:来自植物的雌激素国内外葛根mirifica.大自然。1960;188:774-7。
- 12.
王磊,刘春杰,王磊。植物防御机制的基因组学研究进展。植物学报。2002;3(5):371-90。
- 13.
陈志强,陈志强,陈志强。大豆异黄酮合酶基因的分子特征Pueraria candollei.var。mirifica..农业科学2012;7(32):4489-98。
- 14.
王志强,王志强,王志强,等。查尔酮合成酶基因的克隆与鉴定Pueraria candollei.var。mirifica..药用植物学报2012;6(42):5469-79。
- 15.
黄志强,王志强,王志强,等。黄志强愈伤组织和悬浮培养细胞中微雌酚、脱氧微雌酚和异黄酮的积累Pueraria candollei.var。mirifica..植物生理学报。2011;34(3):1093-100。
- 16.
刘建军,刘建军,刘建军。MYB转录因子对植物苯丙氨酸代谢的调控作用[J]。摩尔。2015;8(5):689 - 708。
- 17.
Han R, Takahashi H, Nakamura M, Yoshimoto N, Suzuki H, Shibata D, Yamazaki M, Saito K.转录组景观葛根证明了植物化学研究的潜力。前植物SCI。2015; 6:426。
- 18.
Wang X, Li S, Li J, Li C, Zhang Y. De novo转录组测序葛根鉴定与异黄酮生物合成有关的推测基因。植物学报2015;34(5):733-43。
- 19。
庞涛,叶春艳,夏旭,尹伟。荒漠灌木的De novo测序及转录组分析。Ammopipthus蒙古斯在使用Illumina/Solexa进行冷驯化时。BMC基因组学。2013;14(1):488。
- 20.
Huang J,Guo X,Hao X,张W,陈S,黄R,Gresshoff PM,Zheng Y. de Novo测序与树苗种子转录组的序号Millettia pinnata用于基因发现和SSR标记开发。摩尔品种。2016;36(6):75。
- 21.
刘Z,陈T,MA L,Zhao Z,Zhao PX,南Z,王Y.使用Illumina平台的全局转录组测序和AutotetroTaploid Alfalfa中EST-SSR标记的开发。Plos一个。2013; 8(12):E83549。
- 22.
Akashi T, Aoki T. Ayabe S-i: CYP81E1,甘草细胞色素P450 cDNA (甘草echinata,编码异黄酮2 ' -羟化酶。生物化学学报。1998;251(1):67-70。
- 23.
刘cj,huhman d,sumner lw,dixon ra。细胞色素P450 81E酶的异黄酮的细胞羟基化羟基化Medicago truncatula.植物j . 2003;(4): 471 - 84。
- 24.
鹰嘴豆8种细胞色素P450 cdna的克隆与鉴定中投arietinumL.)细胞悬浮培养。植物SCI。2000; 155(1):101-8。
- 25。
黄志刚,黄志刚,黄志刚:豆科植物中异黄酮通路的诱导Lotus对虾:参与植物抗毒素生物合成的酶的分子特征。植物科学。2000;160(1):37-47。
- 26。
gujas C,门的内哥罗-伯克JR, Domingo-Almenara X, Palermo A, Warth B, Hermann G, Koellensperger G, Huan T, Uritboonthai W, Aisporna AE,等。一个识别已知和未知的技术平台。肛门化学2018;90(5):3156 - 64。
- 27。
Lee Jh,Kim Jy,Cho S-H,Jeong Jh,Cho S,Park HJ,Baek Sy。测定miroestrol和Isomiroestro国内外葛根mirifica通过LC-MS-MS和LC-Q-Orbitrap /MS对膳食补充剂的研究。色谱学报。2017;55(3):214-21。
- 28。
Sainsbury F, Lomonossoff GP。合成生物学在植物中的瞬时表达。植物学报。2014;19:1-7。
- 29。
Pandey A,Misra P,Khan Mohd P,Swarnkar G,Tewari Mahesh C,Bhambhani S,Trivedi R,Chattopadhyay N,Trivedi Prabodh K.拟南芥转录因子,AtmyB12和大豆异黄酮合成酶,GMIFS1,烟草中的基因组导致增强异黄酮的生物合成和黄酮醇,导致骨质保护活性。植物Biotechnol J. 2013; 12(1):69-80。
- 30.
王春娥,杨伟,田智,程辉等: r2r3型MYB转录因子GmMYB29调控大豆异黄酮的生物合成。公共科学图书馆麝猫。2017;13 (5):e1006770。
- 31.
陈丽丽,陈丽丽,陈丽丽,陈丽丽。大豆CHS7和CHS8基因的差异表达。足底。2010;231(3):741 - 53年。
- 32.
李X-W,李J-W,翟Y, Y,赵X,张H-J,苏L-T,王氏qy公司Y,王。在转基因拟南芥中,一种R2R3-MYB转录因子GmMYB12B2影响编码关键酶的类黄酮生物合成基因的表达水平。基因。2013;532(1):72 - 9。
- 33.
Yi J,Derynck Mr,Li X,Telmer P,Marsolais F,Dhaubhadel S.一种单重复MyB转录因子,GMMYB176调节CHS8基因表达,并影响大豆中的异戊类化生物合成。工厂J.2010; 62(6):1019-34。
- 34.
yu o,shi j,heserg ao,maxwell ca,mcgonigle b,奥德尔jt。代谢工程在大豆种子中增加异黄酮生物合成。植物化学。2003; 63(7):753-63。
- 35.
Reuter Jason A,Spacek DV,Snyder Michael P.高通量测序技术。Mol细胞。2015; 58(4):586-97。
- 36.
李志强,李志强,李志强,等。种子植物核苷景观的结构与进化。植物细胞,2012;24(4):1379 - 97。
- 37.
田爱刚,王健,崔鹏,韩永军,徐辉,丛丽娟,黄晓刚,王小龙,焦永忠,王宝军,等。利用表达序列标签分析大豆基因组特征。中国科学(d辑:地球科学)2004;108(5):903-13。
- 38.
Chansakaow S, Ishikawa T, Sekine K, Okada M, Higuchi Y, Kudo M, Chaichantipyuth C. Isoflavonoids from国内外葛根mirifica和雌激素活性。足底医学。2000;66(06):572 - 5。
- 39.
铬的稳定性:白果柑中最有效的雌激素化合物Pueraria candollei.var.mirifica.粗提物。功能性食品杂志2015;19:269-77。
- 40。
Mamamea R,Waki T,Kawai Y,Takahashi S,Nakayama T. Chalcone还原酶参与大豆异黄酮代谢酮:GMCHR5的鉴定,与2-羟基异戊酮合成酶相互作用。工厂J. 2018; 96(1):56-74。
- 41。
Laursen T,MøllerBL,Bassard J-E。由动态代谢介导的专业代谢的可塑性。趋势植物SCI。2015; 20(1):20-32。
- 42。
方M-H, Lee D-G, Baek Y-S, Cho J-G, Han M-W, Choi K-S, Chung D-K, Ko S-K, Oh C-H, Cho S-Y等。一种新的微雌酚苷国内外葛根mirifica.Chem Nat compound . 2013;49:443。
- 43.
Yazaki K,Sugiyama A,Morita M,Shitan N.二次运输作为植物次生代谢物的高效膜运输机制。Phytochem Rev. 2008; 7(3):513-24。
- 44.
王旭,李超,周超,李军,张勇C-糖基化对葛根素生物合成的影响葛根.植物j . 2017; 90(3): 535 - 46所示。
- 45.
Nielsen KA, Tattersall DB, Jones PR, Møller BL. dhurrin生物合成的代谢形成。植物化学,2008;69(1):88 - 98。
- 46.
jørgensenk,拉斯穆森v,morant m,nielsen啊,bjarnholt n,zagrobelny m,bak s,møllerbl。植物天然产物生物合成中的代谢物形成和代谢窜。CurrOp植物BIOL。2005; 8(3):280-91。
- 47.
Laursen T, Borch J, Knudsen C, Bavishi K, Torta F, Martens HJ, Silvestro D, Hatzakis NS, Wenk MR, daffn TR,等。在高粱中产生防御化合物杜林的动态代谢特征。科学。2016;354(6314):890。
- 48.
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J, Couger MB, Eccles D, Li B, Lieber M, et al.;利用trinity平台从RNA-seq中重建从头转录本序列,进行参考文献的生成和分析。Nat Protoc。2013;8(8):1494 - 512。
- 49。
Simão FA, Waterhouse RM, Ioannidis P, Kriventseva EV, Zdobnov EM. BUSCO:用单拷贝同源性评估基因组组装和注释完整性。生物信息学,2015,31(19):3210 - 2。
- 50.
Waterhouse RM, Seppey M, Simão FA, Manni M, Ioannidis P, Klioutchnikov G, Kriventseva EV, Zdobnov EM. BUSCO从质量评估到基因预测和系统基因组学的应用。生物医学进展。2017;35(3):543-8。
- 51.
Tarazona S, García-Alcalde F, Dopazo J, Ferrer A, Conesa A. RNA-seq的差异表达:一个深度问题。基因组研究》2011;21(12):2213 - 23所示。
- 52.
Götzs,García-gómezJM,Terol J,Williams Td,Nagaraj Sh,Nueda MJ,Robles M,TalónM,Dopazo J,Conesa A.高吞吐功能注释和使用Blast2Go套件的数据挖掘。核酸RES。2008; 36(10):3420-35。
- 53.
叶建军,方磊,郑华,张勇,陈建军,张震,王军,李胜,李锐,Bolund L .,等。WEGO:一个用于绘制GO注释的网络工具。核酸学报2006;34:W293-7。
- 54.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 55.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据−ΔΔCT方法。方法。2001;25(4):402 - 8。
- 56.
Sainsbury F, Thuenemann EC, Lomonossoff GP。pEAQ:植物中异种蛋白快速快速的通用表达载体。植物生态学报;2009;7(7):682-93。
致谢
我们要感谢Tomoyoshi Akashi博士(日本大学,日本)提供标准化合物。我们感谢George Lomonossoff博士(英国约翰英纳斯中心)和Plant Bioscience Limited(英国)提供的pEAQ载体。HS感谢斯特拉斯堡大学植物园Frédéric Tournay的园艺工作和照顾植物。
资金
作者感谢朱拉隆功大学提供的研究经费(CU-56-508-HR和GRU 6101133003-1)。N.S.获得了朱拉隆功大学博士奖学金100周年基金的学生奖学金,朱拉隆功大学研究生院的研究生海外研究体验奖学金,以及泰国国家研究委员会2018财年博士研究生论文资助。这项研究还得到了朱拉隆功大学天然产物生物技术研究单位、朱拉隆功学术发展进入第二个世纪项目、法泰高等教育和研究合作项目以及法国PHC项目SIAM2014-2015的部分支持。HS和WD感谢法国外交部、法国校园和法国驻曼谷大使馆的支持来自植物的生物活性天然产物项目(项目n°31827 tj)。资助机构没有参与研究的设计和收集、数据分析、数据解释和手稿的编写。
作者信息
从属关系
贡献
NS设计并完成了实验,包括数据分析,并撰写了手稿。KT、PP、JZ、HS、KK、SS分析了数据。SW提供了材料和分析工具。SS, SV, HS, MY, KS和WD构思和设计了研究并修改了手稿。所有作者阅读并批准了手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
大约三岁的整株植物p . mirifica.(酒吧= 5厘米)
附加文件2:图S2。
对所有组装的单基因进行同源群(COG)功能分类p . mirifica.垂直坐标是COG的函数类,水平坐标是unigenes的数量。
附加文件3:图S3。
基因本体论(GO)注释所有组装的unigenesp . mirifica.这56个子类分别属于三个主要领域:生物过程、细胞成分和分子功能。GO类别是使用WEGO软件创建的。
附加文件4:图S4。
Kegg途径浓缩分析组装的unigenesp . mirifica.一个19个代谢途径类别的unigenes的数量。b萜类和多酮类及其他次级代谢物的21个代谢亚类。
附加文件5:图S5。
差异表达基因(DEGs)预测为udp -糖基转移酶,可能参与了异黄酮生物合成途径的四种组织p . mirifica.
附加文件6:图S6。
IN瞬时过表达的引燃结核剂([M-H] = 269,RT = 18.78)的注释结核剂([M-H] = 269,RT = 18.78)的离子提取物n benthamiana(一个),p . mirifica异黄酮合成酶(点瞬时表达为n benthamiana(b), 和p . mirifica异黄酮合成酶(点IFS)和拟南芥MYB12转录因子瞬时共同表达n benthamiana(c),采用HPLC-QTOF-MS/MS阴性模式检测。
附加文件7:表S1。
的总结p . mirifica转录组组件。
附加文件8:表S2。
注释的统计数据。
附加文件9:表S3。
涉及异黄酮和微雌醇生物合成的生物合成基因和转录因子的四个组织的核苷酸序列和表达谱。
附加文件10:表S4。
QRT-PCR验证的DNA引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
sununtichaikamolkul, N., Tantisuwanichkul, K., Prombutara, P.et al。转录组分析Pueraria candollei.var。mirifica.对于异黄酮和Miroestrol生物合成中的基因发现。BMC植物杂志19,581(2019)。https://doi.org/10.1186/s12870-019-2205-0
收到了:
接受:
发表:
关键字
- Pueraria candollei.var。mirifica.
- 白色Kwao Krua
- Miroestrol.
- 异黄酮
- 转录组