- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
水稻耐除草剂内生细菌作为水稻不健康种子育性恢复和病害抑制的生物保护剂gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba580gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
水稻脏穗病(DPD)是由几种真菌引起的病害,是水稻种子损伤和退化的主要原因。含有DPD的不健康水稻种子是病原体的强大储存库,不能用作种料,因为它们可以在稻田中传播疾病,导致水稻产量和质量的严重损失。在本研究中,我们旨在寻找商业栽培水稻植株的有益内生菌,并将其作为生物刺激素用于种子生物刺素,以恢复不健康水稻种子的育性和抑制病害。gydF4y2Ba
结果gydF4y2Ba
在施用除草剂的稻田中,从水稻植株中分离出43株内生细菌。本属内生植物的五种分离物gydF4y2Ba芽孢杆菌gydF4y2BaDPD对真菌病原体表现出优异的抗真菌活性。根据发芽试验,与未处理或氢化处理的健康和不健康种子相比,用细菌悬浮液浸泡9或12小时的方法对不健康水稻种子进行生物消毒是最优的,其疾病发病率最低,发芽幼苗的茎和根长度更长。通过盆栽试验评价了种子生物膜处理的影响,与未处理的健康种子和化学杀菌剂处理的不健康种子相比,生物膜处理的种子产生的水稻植株的健康水稻产量百分比没有显著差异。gydF4y2Ba
结论gydF4y2Ba
利用耐除草剂内生细菌对不健康水稻种子进行生物涂膜,可以恢复种子的育性,保护新生水稻植株的全生命周期免受真菌害虫的侵害。根据我们的研究结果,种子生物涂层是一种直接的方法,农民可以应用它来恢复不健康的水稻种子库存,这使他们能够在水稻商业生产中降低成本和农用化学品的使用,并在可持续农业中推广绿色技术。gydF4y2Ba
背景gydF4y2Ba
泰国茉莉花米(gydF4y2Ba栽培稻gydF4y2Bal .简历。KDML105)是泰国重要的商业作物,最近出口价值上升到1225美元gydF4y2Ba−1gydF4y2Ba[gydF4y2Ba1gydF4y2Ba].米粒的质量是决定米粒产品商业价值的关键因素。一些高质量、看起来健康的水稻种子被保存下来,用作后续栽培的种料。有异常变化或病变而不健康的水稻种子被分类出来,根据其质量,这些不健康的种子可能被用作动物饲料或被销毁。不健康水稻种子的物理表现是脏穗病(DPD)或籽粒变色的症状,是由几种植物病原真菌引起的水稻种子的典型病害[gydF4y2Ba2gydF4y2Ba].因此,不健康的水稻种子被认为是植物病原体的有效储存库,不能用作种子库,因为它们可以在稻田中传播疾病,导致水稻产量和品质的严重损失。gydF4y2Ba
由于病原体是非特异性的,且生理症状发生在收获阶段成熟的稻粒上,因此很难在早期发现和预防DPD。当水稻生产过程中发生DPD时,往往已来不及恢复水稻产量的质量。看似健康的水稻种子储存不当也会引起DPD,因为水稻种子表面栖息着100多种真菌,其中许多是水稻的常见病原体[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].2013年,泰国的大量水稻产量在储存期间受到真菌害虫的入侵[gydF4y2Ba5gydF4y2Ba],而这些水稻种子大多有DPD症状。这种损害不仅对该国的农业经济产生不利影响,而且对农民的利润也产生不利影响。预防DPD发生的一种策略是采用优质种料进行水稻栽培。在水稻栽培中使用种子前,为了保持种子的质量,通常要进行种子处理。gydF4y2Ba
虽然市场上有许多种子处理方法[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],大多数都是为了保持种子的健康,并保护它们在储存期间不受害虫的侵袭。不幸的是,当在水稻种子上发现一点点DPD的迹象时,它们就被当作不健康的种子,成为农业废弃物。回收这些不健康的水稻种子,作为质量可接受的种子库存,将是一种具有挑战性的增值方式,并进一步降低水稻种植成本。迄今为止,不健康水稻种子恢复育性和抑制病害的最佳处理方法仍不清楚。用农药对这些不健康的种子进行化学处理可能是一种快速抑制疾病的方法。然而,使用经过农药处理的种子进行种植可能会导致一些环境问题,因为农药残留可能危及有益的植物相关微生物,并在农业生态系统中持续存在或积聚到生态食物网中[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].此外,受农药污染的作物会降低其质量,并对消费者的健康产生不利影响[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
种子生物涂膜可作为促进可持续农业的种子处理绿色技术战略,以减少作物生产中农用化学品的使用[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].这种生物技术利用具有植物生长促进(PGP)潜力的有益微生物,只需将种子饱和到活性微生物悬浮液中进行最佳持续时间,然后在用作种料之前监测种子水分。该方法允许微生物细胞在种子的外部定植,在那里微生物利用谷物的营养渗出物进行增殖和生物防治剂的生物合成,以保护种子免受害虫的侵害,从而发生协同作用[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].许多PGP细菌已被用作生物涂料的生物活性剂[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].这些细菌通常是从植物相关来源中分离出来的,如生活在植物根际的PGP根杆菌。将PGP细菌用于生物膜的另一个技术优势是其生长速度快,易于作为微生物悬浮液进行采集和制备。顺便说一下,种子生物喷涂对不健康水稻种子的修复效率还有待研究。gydF4y2Ba
可以想象,水稻生产中的许多步骤都需要有益的植物-微生物相互作用来促进水稻植株的生长和生产力。许多研究表明,几种水稻内生细菌是很有前途的水稻生长促进剂[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].这些内生菌生活在水稻内部,不形成任何病害。此外,它们既可以促进水稻生长,也可以在水稻生长和生产的整个过程中保护水稻免受入侵植物病原体的侵害。然而,在商业水稻种植中,为了保持水稻高产,很难避免使用农药[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].例如,在稻田中,杂草是不受欢迎的,因为它们与水稻植物竞争,通过窃取土壤养分和水分[gydF4y2Ba20.gydF4y2Ba].杂草也可能是害虫和植物病原体的储存库,损害水稻植株和产量[gydF4y2Ba21gydF4y2Ba].因此,在稻田中经常使用除草剂来阻止杂草的生长。因此,具有抗除草剂能力的内生PGP细菌有可能成为理想的生物涂膜剂。gydF4y2Ba
在本研究中,我们的目标是开发一种简单的利用水稻植物内生PGP细菌对不健康水稻种子进行生物防护的方案。对贮藏稻种库DPD的毒力水平进行了分类。DPD严重的水稻种子可作为真菌病原菌的分离来源。在施用不同除草剂的田间种植的水稻被用来分离耐除草剂的内生细菌。对分离得到的内生菌进行抑菌活性筛选。利用最好的抗真菌细菌对不健康的水稻种子进行生物涂膜,并对其在水稻种子育性恢复和疾病抑制方面的有效性进行了评估。评价从水稻萌发到收获进行。gydF4y2Ba
结果gydF4y2Ba
DPD的真菌病原体gydF4y2Ba
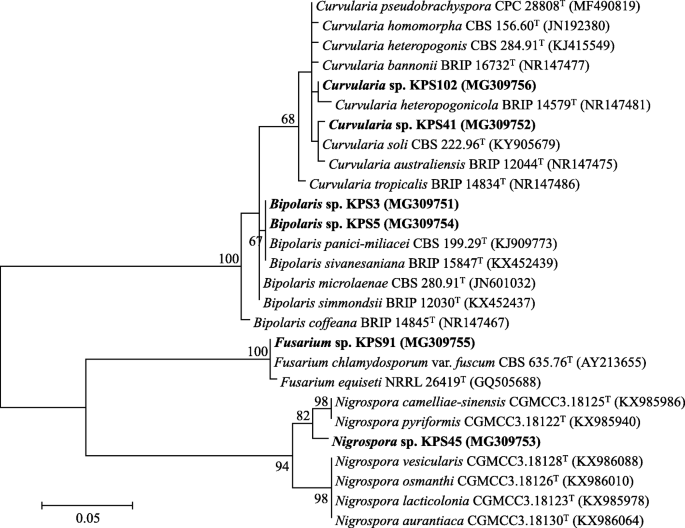
从水稻种子中分离到62种具有DPD的真菌,其中6种具有毒力(表2)gydF4y2Ba1gydF4y2Ba).这些病原真菌被鉴定为该属的成员gydF4y2BaBipolarisgydF4y2Ba,gydF4y2BaCurvulariagydF4y2Ba,gydF4y2Ba穗gydF4y2Ba,gydF4y2Ba镰刀菌素gydF4y2Ba,其ITS基因序列与公共数据库中可用的ITS基因序列相似97-100%gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2Ba1gydF4y2Ba).2个分离株(KPS3和KPS5)属于该属gydF4y2BaBipolarisgydF4y2Ba,两者都与gydF4y2BaBipolaris panici-miliaceigydF4y2Ba哥伦比亚广播公司(CBS) 199.29gydF4y2BaTgydF4y2Ba基因序列相似性100%支持。另外两个分离株KPS41和KPS102属于该属gydF4y2BaCurvulariagydF4y2Ba,每一个都与gydF4y2BaCurvularia独奏曲gydF4y2Ba哥伦比亚广播公司(CBS) 222.96gydF4y2BaTgydF4y2Ba而且gydF4y2BaCurvularia pseudobrachysporagydF4y2BaCPC28808gydF4y2BaTgydF4y2Ba基因序列相似性分别为99%和97%。gydF4y2Ba
水稻耐除草剂内生细菌及其抗真菌活性gydF4y2Ba
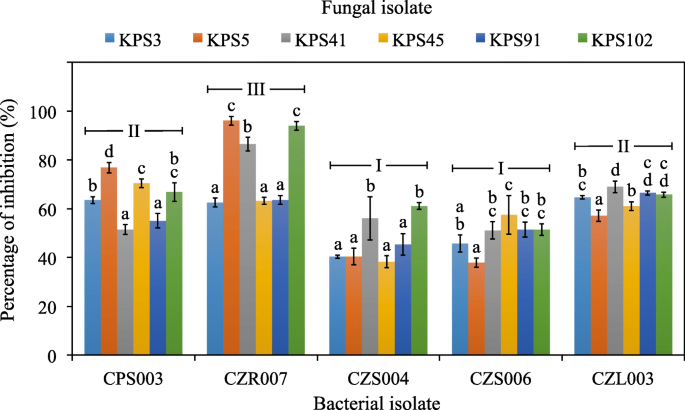
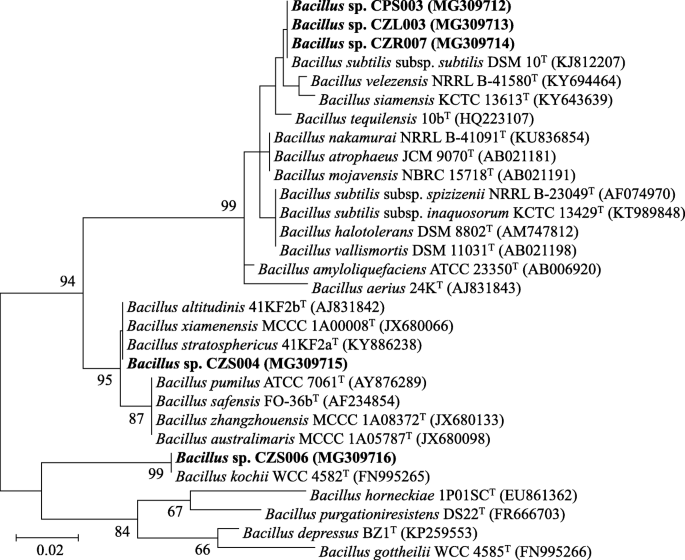
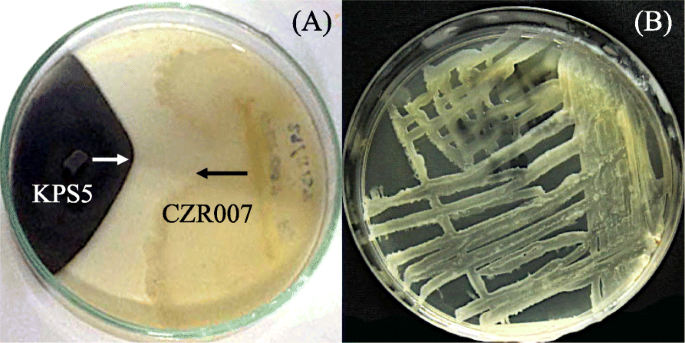
从生长在除草剂处理稻田的不同水稻品种内部分离出43种耐除草剂细菌(表2)gydF4y2Ba2gydF4y2Ba).gydF4y2Bao .漂白亚麻纤维卷gydF4y2Bal . var。gydF4y2Ba籼稻gydF4y2Ba简历。RD41含有最多的细菌(13个分离株),而其他来源,gydF4y2Bao .漂白亚麻纤维卷gydF4y2Bal . var。gydF4y2Ba籼稻gydF4y2Ba简历。Pathumthani 1生长在不同的田地位置,用不同的除草剂处理,每个结果是10个细菌分离物。任何水稻品种的根组织都有相对较多的细菌(4-7个分离株)。所有细菌都对一组引起水稻种子DPD的毒力真菌进行了抗真菌活性测试,其中5种显示出优异的抗真菌活性(图2)。gydF4y2Ba2gydF4y2Ba).这些细菌被鉴定为该属的成员gydF4y2Ba芽孢杆菌gydF4y2Ba与公共数据库中可用的16S rRNA基因序列相比,其相似性为99-100%(表2)gydF4y2Ba3.gydF4y2Ba和无花果。gydF4y2Ba3.gydF4y2Ba).三个分离株(CPS003、CZR007和CZL003)与之亲缘关系密切gydF4y2Ba枯草芽孢杆菌gydF4y2Ba无性系种群。gydF4y2Ba细小gydF4y2BaDSM 10gydF4y2BaTgydF4y2Ba基因序列相似性99%。另外两个分离株(CZS004和CZS006)与之亲缘关系密切gydF4y2Ba芽孢杆菌altiludinisgydF4y2Ba41 kf2bgydF4y2BaTgydF4y2Ba而且gydF4y2Ba芽孢杆菌kochiigydF4y2BaWCC4582gydF4y2BaTgydF4y2Ba基因序列相似性分别为100和99%。gydF4y2Ba芽孢杆菌gydF4y2Basp. CZR007的抗真菌活性最高(接近100%)gydF4y2BaBipolarisgydF4y2Basp. KPS5和gydF4y2BaCurvulariagydF4y2Basp. KPS102(图;gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
水稻不健康种田生物灌浆后的育性和品质gydF4y2Ba
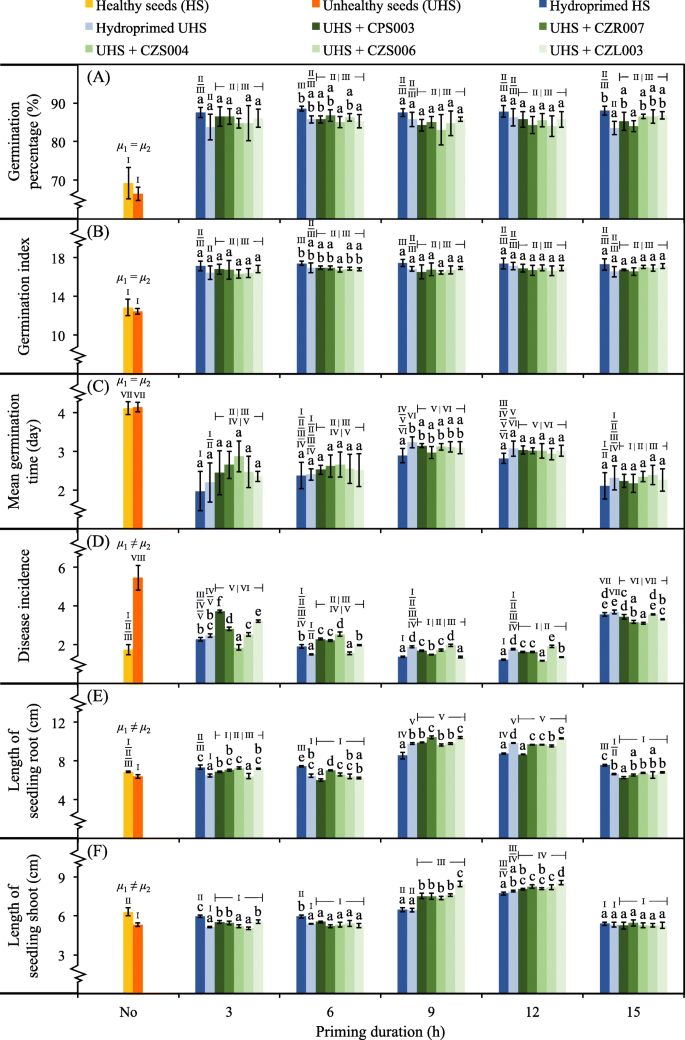
以发芽率(GP)、萌发指数(GI)、平均萌发时间(MGT)、病害发生率(DI)、幼苗根、芽长为指标,主要在萌发期和幼苗生长期对所选细菌对不健康水稻种子的生物冲洗潜力进行评价(图2)。gydF4y2Ba5gydF4y2Ba).未处理的健康种子和不健康种子的gp没有统计学差异,与任何底色种子(~ 85-90%)相比,gp显著降低(~ 65-70%)(图。gydF4y2Ba5gydF4y2Ba一)。各引物种子的gp值之间无显著差异。而不健康种子加氢3和15 h的GPs值略低。GI也表现出类似的结果趋势,而任何种子启动3小时显示出略微较低的GI(图。gydF4y2Ba5gydF4y2Ba- b)。未处理的健康种子和不健康种子的MGTs最慢(~ 4天),而任何启动3和15小时的种子都表现得稍快(图2)。gydF4y2Ba5gydF4y2Ba- c)。未处理的不健康种子DI最高。gydF4y2Ba5gydF4y2Ba- d)。在所有启动种子中,启动6、9和12 h时DI相对较低。幼苗根部的长度(图;gydF4y2Ba5gydF4y2Ba-e)和芽(图。gydF4y2Ba5gydF4y2Ba-f)在不健康种子生物清洗9和12 h时,时间最长。这些结果表明,不健康水稻种子生物漆处理的最佳启动时间为9或12 h。gydF4y2Ba
种子生物涂层对种子萌发和幼苗生长的影响。发芽率(gydF4y2Ba一个gydF4y2Ba),发芽指数(gydF4y2BabgydF4y2Ba),平均发芽时间(gydF4y2BacgydF4y2Ba)、发病率(gydF4y2BadgydF4y2Ba),以及幼苗根部的长度(gydF4y2BaegydF4y2Ba)和芽(gydF4y2BafgydF4y2Ba)为评价因素。采用5个菌株(CPS003、CZR007、CZS004、CZS006和CZL003)进行种子生物涂层。对生物底漆处理的不健康种子(UHS)进行了测试,并与未处理(No)或氢化底漆处理的健康种子(HS)和UHS对照进行了比较。误差条是每次试验100粒种子,共4次重复的平均值±SDs。HS (gydF4y2BaμgydF4y2Ba1)及大学保健处(gydF4y2BaμgydF4y2Ba2)不进行底漆处理,采用独立样品gydF4y2BatgydF4y2Ba以及在gydF4y2BaPgydF4y2Ba= 0.05。采用单因素方差分析(one-way ANOVA)与Tukey事后检验(post - hoc test)比较均数的统计学差异gydF4y2BaPgydF4y2Ba≤0.05用小写字母表示每种类型的引物种子(在同一引物时间内),并用罗马数字表示任何测试和对照之间的比较。来自任何生物涂层种子的数据都是作为平均值计算的,不管测试的细菌是什么gydF4y2Ba
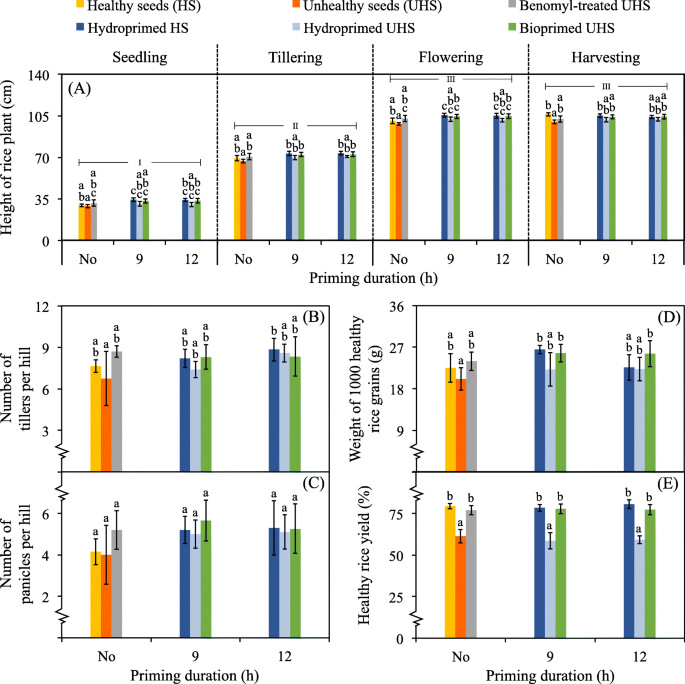
对于盆栽实验,由于不健康水稻种子与不同选择的细菌启动的平均结果没有显著差异,因此,我们将所有数据汇总在一起,并作为一个全球平均值报告(图2)。gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).在水稻的每个栽培阶段,水稻植株的高度从苗期到花期急剧增加,并在此停止(图2)。gydF4y2Ba6gydF4y2Ba一)。各种子所生水稻株高无显著差异。此外,任何种子产生的水稻植株每山的分蘖和穗数也没有显著差异(图2)。gydF4y2Ba6gydF4y2Ba-b和-c)。对于1000粒健康米粒的重量,也观察到了类似的结果趋势(图2)。gydF4y2Ba6gydF4y2Ba- d)。然而,健康水稻产量的百分比没有显著差异,当这些产量来自未经处理或氢化处理的健康种子和化学杀菌剂处理或生物涂膜的不健康种子时(图2)。gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba- e)。此外,未经处理或氢化处理的不健康种子产生的水稻产量最低。gydF4y2Ba
盆栽试验中种子生物涂膜对植物生长发育的影响。试验进行了4个月,分为水稻育苗(0-14天)、分蘖(30-60天)、花期(75-100天)和收获期(120天)。水稻植株的高度(gydF4y2Ba一个gydF4y2Ba)在每个阶段进行测量。在收获阶段,分蘖数(gydF4y2BabgydF4y2Ba)和圆锥花序(gydF4y2BacgydF4y2Ba),相当于1000粒健康米粒的重量(gydF4y2BadgydF4y2Ba),以及健康稻米产量百分比(gydF4y2BaegydF4y2Ba)被量化。这些试验是用任何选定的细菌对不健康种子(UHS)进行生物涂膜后产生的水稻植株,而那些从未经处理(No)或氢化处理的健康种子(HS)和UHS加上苯胺处理的UHS中产生的水稻植株为对照。不同菌株的检测结果无显著差异。因此,我们将来自生物膜检测的所有数据的全球平均值计算为一。误差条是指至少20个重复测量值的平均值±SDs。采用单因素方差分析(one-way ANOVA)与Tukey事后检验(post - hoc test)比较均数的统计学差异gydF4y2BaPgydF4y2Ba≤0.05用小写字母表示任何试验和对照(在同一启动持续时间内),用罗马数字表示不同阶段的均值比较(gydF4y2Ba一个gydF4y2Ba)gydF4y2Ba
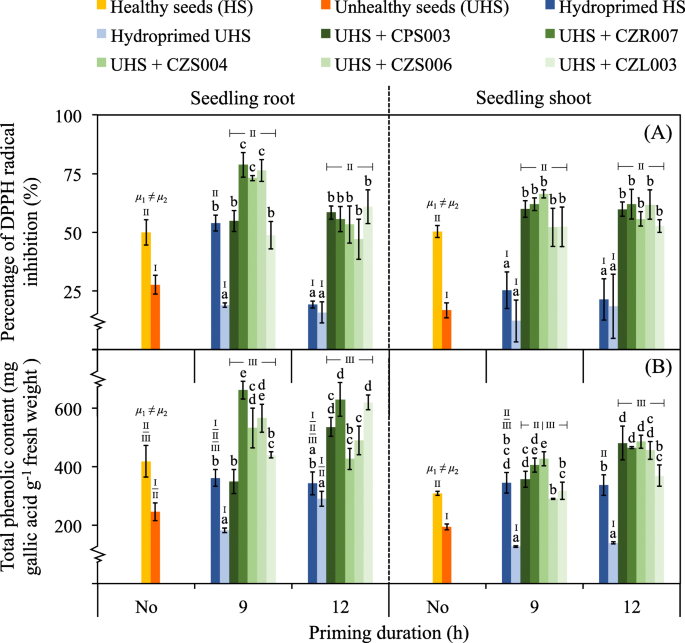
作为水稻幼苗健康指标的抗氧化活性(DPPH自由基抑制率%)和总酚含量如图所示。gydF4y2Ba8gydF4y2Ba.经氢化处理12 h的健康种子和未经氢化处理或任何氢化处理的不健康种子的幼苗根系抗氧化活性显著低于其他条件(图2)。gydF4y2Ba8gydF4y2Ba一)。在幼苗的嫩枝中也观察到类似的结果,但9 h氢化处理后幼苗的嫩枝抗氧化活性下降。幼苗根和芽中总酚含量与抗氧化活性的结果相似(图2)。gydF4y2Ba8gydF4y2Ba- b)。采用肠杆菌重复基因间一致聚合酶链反应(ERIC-PCR)指纹图谱数据进行验证gydF4y2Ba在足底gydF4y2Ba图中显示了种子生物涂膜后所选细菌的定植。gydF4y2Ba9gydF4y2Ba.从不健康种子生物涂层中分离出的水稻幼苗菌落,其指纹数据与种子生物涂层中所选细菌的指纹数据具有100%的相似性。gydF4y2Ba
种子生物涂膜对水稻幼苗抗氧化剂和总酚含量的影响。DPPH自由基抑制率与抗氧化活性相关(gydF4y2Ba一个gydF4y2Ba)和总酚含量(gydF4y2BabgydF4y2Ba)在14天大的幼苗的根和芽中进行测量。采用5个菌株(CPS003、CZR007、CZS004、CZS006和CZL003)进行种子生物涂层。对生物涂层的不健康种子(UHS)进行了测试,并与未处理(No)或氢化处理的健康种子(HS)和UHS的对照进行了比较。误差条是指至少三个重复测量值的平均值±SDs。HS (gydF4y2BaμgydF4y2Ba1)及大学保健处(gydF4y2BaμgydF4y2Ba2)不进行底漆处理,采用独立样品gydF4y2BatgydF4y2Ba以及在gydF4y2BaPgydF4y2Ba= 0.05。采用单因素方差分析(one-way ANOVA)与Tukey事后检验(post - hoc test)比较均数的统计学差异gydF4y2BaPgydF4y2Ba≤0.05用小写字母表示每种类型的引物种子(在同一引物时间内),并用罗马数字表示任何测试和对照之间的比较。来自任何生物涂层种子的数据都是作为平均值计算的,不管测试的细菌是什么gydF4y2Ba
在足底gydF4y2Ba生物涂层细菌定植。从任何用于种子生物涂层的细菌分离物的无菌培养中获得的ERIC-PCR DNA指纹(gydF4y2Ba一个gydF4y2Ba)为标准,而以细菌分离物CPS003 (gydF4y2BabgydF4y2Ba), czr007 (gydF4y2BacgydF4y2Ba), czs004 (gydF4y2BadgydF4y2Ba), czs006 (gydF4y2BaegydF4y2Ba),或CZL003 (gydF4y2BafgydF4y2Ba).指纹背后的密码是指幼苗组织的来源(根或茎),其次是从这些来源分离出的菌落的顺序和种子生物印迹中启动的时间gydF4y2Ba
讨论gydF4y2Ba
稻田是各种微生物的巨大游乐场,这些微小的微生物对水稻作物发挥着重要的作用,或有利或不利的影响。水田发生植物病害时,病害易扩散,难治理。DPD是水稻种子的一种常见病害,可能发生在水稻的生产阶段,但更常发生在收获后的贮藏阶段。这种疾病的病原体是不同的真菌,但通常是属的成员gydF4y2Ba链格孢属gydF4y2Ba,gydF4y2BaBipolarisgydF4y2Ba,gydF4y2Ba尾孢属gydF4y2Ba,gydF4y2BaCurvulariagydF4y2Ba,gydF4y2Ba镰刀菌素gydF4y2Ba,gydF4y2BaSarocladiumgydF4y2Ba[gydF4y2Ba2gydF4y2Ba].根据我们的研究,真菌,gydF4y2Ba穗gydF4y2Ba首次被发现为DPD潜在病原体之一。所有病原体都通过引起籽粒变色从而破坏整个籽粒组织来损害水稻种子。gydF4y2Ba
水稻的植物组织为多种微生物提供了独特的生态位,其中一些是潜在的PGP细菌[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].我们从水稻中分离出的对DPD病原真菌具有良好抗真菌活性的细菌内生菌均属于该属,这并不奇怪gydF4y2Ba芽孢杆菌gydF4y2Ba.许多研究表明,杆菌是水稻中最著名的PGP细菌之一[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].杆菌在水稻种植中的PGP作用是多种多样的,可以作为自由生活的重氮营养物向水稻提供氮,可以作为抗菌物质的生产者抑制害虫入侵,也可以作为水稻作物中的矿物质调节剂等。我们的杆菌抗真菌的不同潜力可能是由于它们的系统类型差异以及不同的真菌病原体所测试的结果。据报道,不同的杆菌具有不同的脂肽基因,这些脂肽基因与抗菌活性有关,所生产的脂肽抗生素可能是surfactin、iturin和fengycin家族的脂肽抗生素[gydF4y2Ba23gydF4y2Ba].此外,所有分离的芽孢杆菌都能耐受几种除草剂,这可能是在商业水稻种植中最大限度地减少除草剂处理对水稻生长的副作用的附加特性。gydF4y2Ba
用所选细菌对不健康的水稻种子进行生物喷淋后,喷淋时间以9或12 h为最佳,且病害发病率最低,水稻幼苗生根发芽时间较长。在种子启动技术中,合适的启动时间是一个关键因素,它影响着各种植物种子的萌发行为和幼苗活力,如斑豆[gydF4y2Ba24gydF4y2Ba]和面包小麦[gydF4y2Ba25gydF4y2Ba].谢等。[gydF4y2Ba26gydF4y2Ba]发现9311水稻品种的种子浸泡在gydF4y2Ba枯草芽孢杆菌gydF4y2BaOKB105处理2 h可使水稻苗苗长增加25.2%。另一项研究用gydF4y2Ba枯草芽孢杆菌gydF4y2BaCIM和皮摩尔芦丁对水稻幼苗根、芽的生长发育也有促进作用[gydF4y2Ba27gydF4y2Ba].我们还发现,对不健康的水稻种子进行加氢启动处理可以促进水稻萌发和幼苗生长阶段的发育。这一发现与一项揭示水稻种子加氢启动可以加速出苗和提高水稻幼苗活力的研究相一致[gydF4y2Ba28gydF4y2Ba].然而,盆栽实验结果表明,不健康水稻种子的生物底漆在抑制DPD方面比氢化底漆提供了更显著的支持,从而获得了更好的水稻产量。这一发现将是用于种子生物涂层的细菌所提供的PGP益处的一个明显结果。gydF4y2Ba
抗氧化剂和酚类化合物是水稻重要的生物活性植物化学物质,它们反映了水稻的营养品质,并在植物与微生物的相互作用中发挥作用[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].我们的研究表明,无论启动时间的不同,大多数用于不健康水稻种子生物启动的分离杆菌都能在统计学上增加水稻幼苗中这两种植物化学物质的含量。这一发现是一个例子机制,如何这种生物涂层杆菌可以免疫水稻植物。辛格等人。[gydF4y2Ba27gydF4y2Ba]发现水稻种子的生物涂层与gydF4y2Ba枯草芽孢杆菌gydF4y2BaCIM不仅能促进水稻幼苗生长,还能促进水稻幼苗光合色素(叶绿素和类胡萝卜素)以及酚类和类黄酮含量的积累。另一项研究报告了拮抗gydF4y2Ba芽孢杆菌gydF4y2Ba对水培和土壤条件下水稻叶片和根系中抗氧化酶(如过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶)活性提高了4倍[gydF4y2Ba30.gydF4y2Ba].此外,这些抗氧化物质被认为是诱导水稻系统抗性的激发子,因为它们的功能与抑制水稻病害高度相关[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
有效地gydF4y2Ba在足底gydF4y2Ba有益微生物的定殖是延长其支持寄主植物生长发育的生物活性功能的主要原因[gydF4y2Ba13gydF4y2Ba].内生细菌进入水稻内部的机制与植物病原菌的机制相似,发芽胚根和根裂等一些进入途径有助于细菌的根定殖[gydF4y2Ba13gydF4y2Ba].在水稻种子萌发过程中,还发现有生物膜gydF4y2Ba枯草芽孢杆菌gydF4y2BaOKB105,该细菌150多个基因转录水平明显改变[gydF4y2Ba26gydF4y2Ba].例如,参与代谢、营养转运和应激反应的基因(例如,gydF4y2BaaraAgydF4y2Ba,gydF4y2BaywkAgydF4y2Ba,gydF4y2BayflsgydF4y2Ba,gydF4y2BamtlAgydF4y2Ba,gydF4y2BaydgGgydF4y2Ba等)上调,而gydF4y2BacheVgydF4y2Ba,gydF4y2BafliLgydF4y2Ba,gydF4y2BaspmAgydF4y2Ba而且gydF4y2Ba图阿gydF4y2Ba趋化性、运动性、产孢和四酸生物合成相关基因下调[gydF4y2Ba26gydF4y2Ba].本研究采用ERIC-PCR DNA指纹技术证实,所有用于种子生物漆的分离杆菌都能在水稻幼苗内部延长寿命。因此,在盆栽试验中,用耐除草剂内生细菌生物涂层的不健康水稻种子制成的种料提高水稻产量,可能是水稻植株与生物涂层细菌长期协同作用的结果。gydF4y2Ba
结论gydF4y2Ba
用耐除草剂水稻内生细菌对不健康水稻种子进行生物涂膜,可以抑制水稻种子的DPD。生物刷膜细菌与水稻种子的协同作用优化了后续栽培水稻的生长发育,从而获得了可接受的水稻产量质量。因此,种子生物漆将是一种很有前途的方法,用于恢复不健康的水稻种子,作为水稻种子库,这为绿色技术在水稻可持续农业中的应用奠定了基础。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
本研究中使用的任何植物材料都由策展人Tanawat Chaowasku识别,并作为标本馆公开存放于清迈大学理学院生物学系CMUB标本馆,供进一步参考,而他们的标本凭证编号由CMUB发起,在本文的其他地方进行了说明。gydF4y2Ba
泰国茉莉花米(gydF4y2Bao .漂白亚麻纤维卷gydF4y2Bal .简历。KDML105)种子(CMUB39907)收获后在泰国素潘武里省Si Prachan地区的粮仓中未经任何处理保存4-5个月。这些种子是由当地农民商业化生产的,其中一些被作为种子储存起来,以供后续种植。这些种子是在所有者的许可和指导下(不需要许可证)从粮仓收集的,它们表现出明显的或没有DPD症状。我们将这些种子DPD的毒力程度分为A级(健康):无疾病症状,B级(不健康):20-30%可见症状,C级(患病):50-100%种子严重受损。该种子是植物病原真菌的分离来源,并用于生物喷涂实验。gydF4y2Ba
两个水稻品种:gydF4y2Ba栽培稻gydF4y2Bal . var。gydF4y2Ba籼稻gydF4y2Ba简历。Pathumthani 1 (CMUB39903 - CMUB39905)和gydF4y2Ba栽培稻gydF4y2Bal . var。gydF4y2Ba籼稻gydF4y2Ba简历。RD41 (CMUB39906)由当地农民在不同的田间地点进行商业种植,并施用不同的除草剂进行处理gydF4y2Ba2gydF4y2Ba).这些田间种植的水稻植株是在所有者的许可和指导下(不需要许可证)从田里连根拔起的。农民们还热心地提供了除草剂处理和稻龄等信息。在转移到实验室之前,这些水稻被装入塑料袋并保存在冰箱中。在自来水下冲洗几次后,它们被分为根、茎和叶。将任何植物材料的表面浸泡在70% (v/v)乙醇中1分钟,2% (v/v) NaOCl中2分钟,95% (v/v)乙醇中30秒,30% (v/v) H中gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba1分钟。将清洗后的植物材料用无菌蒸馏水冲洗四次,去除消毒液残留,并作为耐除草剂内生细菌的分离源。gydF4y2Ba
植物病原真菌的分离及其致病性试验gydF4y2Ba
病害水稻种子(C级)是引起DPD的真菌病原体的分离来源。这些种子在自来水下清洗多次,表面用1% (w/v) NaOCl消毒10分钟,最后用无菌蒸馏水清洗。将10颗清洗干净的种子粘贴在马铃薯葡萄糖琼脂(PDA)培养基上(Difco, USA),在22°C下孵育5-8天。将出现的真菌菌落在新的PDA培养基上传代培养,直到变成无菌培养,然后在20% (v/v)甘油中保存,以便保存和进一步研究。gydF4y2Ba
根据Koch的假设,在健康水稻种子(A级)的萌发和幼苗生长阶段,对分离的真菌进行了体外致病性测试。简单地说,这些种子的表面使用之前提到的相同的方案进行了消毒。为了进行萌发试验,将5颗清洗干净的种子粘贴在蒸压种植纸上,用10 mL无菌蒸馏水作为对照或每个真菌分离物制成的菌丝悬液接种,然后在30℃下孵育。以30℃PDA培养基上生长7 d的真菌生物量为原料制备菌丝悬浮液。生物质在无菌蒸馏水的存在下,使用无菌研钵和研杵进行研磨。将菌丝悬浮液的终浓度调整为10gydF4y2Ba4gydF4y2Ba繁殖体毫升gydF4y2Ba−1gydF4y2Ba血细胞计数器。gydF4y2Ba
在幼苗生长期试验中,将清洗干净的水稻种子放置在潮湿的蒸压种植纸上,在30°C下发芽5天。将产生的幼苗无菌转移到试管中的水琼脂培养基上进一步生长,其中接种1ml无菌蒸馏水(对照)或每个菌丝悬液,并在25°C的潮湿室中培养。以每天观察到的种子发芽率和幼苗健康状况为指标,确定各分离真菌的致病性水平(弱、中、毒)。gydF4y2Ba
水稻耐除草剂内生细菌的分离及其抗真菌作用gydF4y2Ba
在无菌蒸馏水(1ml)的存在下,使用无菌研钵和研杵,从田间种植中制备的水稻植物材料进行研磨。将100 μL的地面植物悬浮液涂抹在Luria-Bertani (LB)琼脂培养基(Himedia, India)上,并添加一组用于水稻田间种植的除草剂(表2)gydF4y2Ba2gydF4y2Ba).此外,从前面所述的每种植物材料表面灭菌的最后一步获得的洗涤液(100 μL)被涂抹在琼脂培养基上,并作为对照进行验证gydF4y2Ba在足底gydF4y2Ba细菌的起源分离。植物材料和对照各4个琼脂板,在30°C下孵育2天。将可见的菌落传代到新的琼脂培养基上,直到变成无菌培养,然后在20% (v/v)的甘油中保存,以便保存和进一步研究。gydF4y2Ba
在PDA培养基上采用双培养法测定各分离菌对一组具有DPD强致病性的真菌分离株的抑菌活性。简单地说,在距离平板边缘2厘米的PDA培养基上,将一个菌落(先前在30°C的LB琼脂培养基上生长的2天培养物)划出5厘米长的条纹。在细菌条纹的对面,真菌菌丝体作为一个直径5.5毫米的圆盘(之前在30°C PDA培养基上生长的5天培养物)接种在距离平板边缘2厘米的地方。所有检测板均孵育于30℃,每天检测真菌菌落半径生长情况。在没有试验细菌的情况下,真菌生长作为对照。用式(i)计算抑制率,其中gydF4y2BadgydF4y2Ba控制gydF4y2Ba对照和对照中真菌菌落的平均大小(ø in mm)是否为gydF4y2BadgydF4y2Ba分析gydF4y2Ba在双重培养实验中。gydF4y2Ba\ (\ % \ mathrm{抑制}= \压裂{d_ {\ mathrm{控制}}- {d} _ {\ mathrm{化验}}}{d_ {\ mathrm{控制}}}\乘以100 \)gydF4y2Ba(我)。gydF4y2Ba
分离微生物的鉴定和分类gydF4y2Ba
利用其内部转录间隔区(ITS)基因序列数据,在属类水平上鉴定出具有DPD毒力的分离真菌。每个真菌在30°C的PDA培养基上生长7天,将真菌生物量刮除并悬浮在无菌蒸馏水中。通过12100离心收集生物量gydF4y2BaggydF4y2Ba使用Plant Genomic DNA Mini Kit (Geneaid Biotech Ltd., Taiwan)进行DNA提取,提取时间为5分钟,按照制造商的说明进行。以提取的DNA为模板,PCR扩增真菌ITS1-5.8S rDNA - ITS2-26S rDNA区gydF4y2BaTaqgydF4y2BaDNA聚合酶和标准gydF4y2BaTaqgydF4y2BaBuffer来自New England BioLabs,美国。PCR (25 μL)中含有2.5 μL的10×标准品gydF4y2BaTaqgydF4y2Ba反应缓冲液,0.5 μL 10mm dNTPs, 0.125 μLgydF4y2BaTaqgydF4y2BaDNA聚合酶,每个10 μM引物0.5 μL (ITS1: 5 ' TTTCCGTAGGTGAACCTGC 3 '和ITS4: 5 ' TCCTCCGCTTATTGATATGC 3 ' [gydF4y2Ba33gydF4y2Ba]), 0.1 μL模板DNA,用无核酸酶水调节体积。PCR采用热循环仪进行,条件如下:94℃初始变性5 min, 94℃变性1.5 min循环30次,52℃退火2 min, 72℃延伸1 min, 72℃终延伸5 min。gydF4y2Ba
利用16S rRNA基因序列数据,在通用水平上鉴定出具有良好抗真菌活性的分离细菌。每个细菌在50 mL LB肉汤中培养,在250转/分,30°C震动培养2天。在12000离心收集细菌生物量gydF4y2BaggydF4y2Ba5分钟,作为模板DNA扩增16S rRNA基因序列。除了引物为fD1 5 ' AGAGTTTGATCCTGGCTCAG 3 '和rP2 5 ' ACGGCTACCTTGTTACGACTT 3 '外,采用上述相同的PCR组合[gydF4y2Ba34gydF4y2Ba].PCR采用热循环仪进行,条件如下:95℃预变性5 min, 94℃变性1 min循环30次,55℃退火1 min, 72℃延伸1.5 min, 72℃终延伸10 min。gydF4y2Ba
所有PCR产物均通过新加坡1st BASE提供的服务进行测序以检索其核苷酸序列数据。获得的基因序列用BioEdit (gydF4y2Bawww.mbio.ncsu.edu/BioEdit/bioedit.htmlgydF4y2Ba),并与GenBank的公共核苷酸数据库(gydF4y2Bahttps://blast.ncbi.nlm.nih.gov/Blast.cgigydF4y2Ba)及MycoBank (gydF4y2Bahttp://www.mycobank.orggydF4y2Ba)获取真菌ITS序列,或与EZBioCloud (gydF4y2Bawww.ezbiocloud.netgydF4y2Ba)为细菌16S rRNA基因序列。收集高度相关的核苷酸序列,与MUSCLE比对,用于构建MEGA7的系统进化树(gydF4y2Bawww.megasoftware.netgydF4y2Ba).gydF4y2Ba
种子biopriminggydF4y2Ba
利用Singh等人所描述的改进方案,对水稻种子进行生物拟合的方法得以实现。[gydF4y2Ba27gydF4y2Ba]和Sivakumar等人[gydF4y2Ba35gydF4y2Ba].简单地说,不健康的水稻种子(B级)被用于生物涂层,将它们浸泡在分离出的具有优异抗真菌活性的细菌的水悬浮液中。每个细菌先在30°C LB肉汤中培养,以250转/分钟的转速摇晃2天,在9660离心收集其生物量gydF4y2BaggydF4y2Ba5分钟。将细菌生物量洗涤两次,重新悬浮,并在600 nm波长下使用无菌蒸馏水将其光密度(吸光度)调整为0.2,对应于10gydF4y2Ba8gydF4y2Ba将种子在每种细菌悬液中浸泡3、6、9、12和15小时,目的是在生物涂层中找到OPD。所有浸泡过的种子在25°C下风干,直到水分含量与启动前相同(~ 12%),由RICETER F-514(日本Kett Electric Laboratory)水稻水分计监测,以避免不同启动时间对种子水分变化的影响。同时,建立了一组对照来评估种子生物底漆的能力,即未处理或氢化底漆的健康种子和不健康种子。对于种子加氢引液,采用与生物引液相同的方法进行,但仅使用无菌蒸馏水(无细菌细胞)。此外,在盆栽实验中,不健康种子与1.3% (w/w)苯酰(Sims Agrow Cheme,泰国)混合作为化学杀菌剂处理对照。任何经过处理和未经处理的水稻种子在4°C下保存6个月,然后再用于进一步评估。gydF4y2Ba
水稻作物全生命周期的生物涂装后评价gydF4y2Ba
评价了种子生物涂膜对不健康水稻种子的育性恢复和疾病抑制的影响,从种子萌发到收获水稻产量。GP、GI、MGT、DI和幼苗根、芽长度是种子萌发期和幼苗生长阶段的评价因子,也是生物印迹中OPD的分配标准。在允许种子发芽后,这些参数通过国际种子测试协会手册中描述的标准纸间发芽测试进行量化[gydF4y2Ba36gydF4y2Ba].在这些测量中使用了之前制备的未经处理、氢化或生物膜处理的健康和不健康水稻种子,这些种子进行了四次重复(每次100粒种子),并在25°C的塑料袋中孵育,以防止湿度损失。gydF4y2Ba
记录孵育第3天第一次计数和第7天最后一次计数的发芽种子,并计算GP [gydF4y2Ba36gydF4y2Ba].GI的计算公式为(gydF4y2Ba2gydF4y2Ba)在官方种子分析师协会手册中所述[gydF4y2Ba37gydF4y2Ba],其中gydF4y2BaGgydF4y2BaxgydF4y2Ba发芽种子的数量是每天计算的吗gydF4y2BaxgydF4y2Ba.gydF4y2Ba
方程(gydF4y2Ba3gydF4y2Ba) [gydF4y2Ba38gydF4y2Ba]来计算MGT,其中gydF4y2BangydF4y2Ba每天发芽的种子有多少gydF4y2BadgydF4y2Ba而且gydF4y2BadgydF4y2Ba就是从发芽开始算起的天数。gydF4y2Ba
在水稻种子发芽后第7天,采用Mew和Misra的籽粒变色标准测定DI评分[gydF4y2Ba39gydF4y2Ba) = 0,发病率没有< = 3 = 1 1%,1 - 5%,6 - 25% = 5,26 - 50% = 7,和51 - 100% = 9。基于此评分,DI计算公式为(gydF4y2Ba4gydF4y2Ba),其中gydF4y2BaNgydF4y2Ba3.gydF4y2Ba,gydF4y2BaNgydF4y2Ba5gydF4y2Ba,gydF4y2BaNgydF4y2Ba7gydF4y2Ba,gydF4y2BaNgydF4y2Ba9gydF4y2Ba分别是3、5、7、9分的幼苗数和gydF4y2BaNgydF4y2BatgydF4y2Ba为得分苗的总数。gydF4y2Ba
用任何处理过的和对照的种子长出的14天大的水稻幼苗测量了幼苗的根和芽的长度。gydF4y2Ba
通过盆栽试验,评价种子生物涂膜对水稻种植和水稻产量质量的影响。在可控温室条件下,采用完全随机区组设计,每组5个重复(每个重复4盆)。每个容器(ø = 8英寸,高= 25厘米)按4/1/1 (w/w/w)的比例装入2公斤椰浆和牛粪均质的农业土壤。土壤类型为黏性壤土,以比重计法鉴定[gydF4y2Ba40gydF4y2Ba].从未处理或处理过的种子中长出的14天大的水稻幼苗,用与前面讨论的相同的方法制备。在每个花盆的中心至少种植三棵幼苗,并让其生长5天,此时只留下生长最好的幼苗。为了模拟商品稻栽培的田间条件,每盆分别施氮磷钾(N46-P0-K0)肥30 g(种植后20天)和60 g N16-P16-K16(种植后45天)两次。每种肥料的田间浓度分别为30和60 kg hagydF4y2Ba−1gydF4y2Ba分别为N46-P0-K0和N16-P16-K16。在水稻植株生长10天和25天时,分别在植株周围的土壤上喷洒了2次除草剂。所用除草剂为0.64 mL LgydF4y2Ba−1gydF4y2Ba氯马松加1.44 mL LgydF4y2Ba−1gydF4y2Ba第一次用丙腈0.276 mL LgydF4y2Ba−1gydF4y2Ba第二次注射非诺异丙醚。水稻种植后的生长阶段包括苗期(0-14天)、分蘖期(30-60天)、开花期(75-100天)和收获期(120天)。测定水稻生长健康指标,包括水稻各生育期株高、每山分蘖数、穗数、1000粒健康粒重、收获期健康粒产量百分比等,用于确定种子生物喷施的效益。gydF4y2Ba
幼苗植物化学成分分析gydF4y2Ba
作为健康指标,两种植物化学物质,即抗氧化剂和总酚含量在水稻幼苗的根和芽中,采用改良比色法,由Sadh等描述。[gydF4y2Ba41gydF4y2Ba].使用之前制备的未经处理、氢化或生物膜处理的健康和不健康水稻种子培育出14天龄的幼苗。采用改良的DPPH自由基清除法测定抗氧化活性。简单地说,用2 mL 95% (v/v)乙醇提取500 mg幼苗的芽或根,并在9660下用冷离心(4°C)沉淀混合物gydF4y2BaggydF4y2Ba20分钟。将得到的上清液或提取溶剂作为对照(0.5 mL)与3 mL 60 M DPPH涡旋混合,在25°C黑暗中孵育30分钟。517 nm处的吸光度(AgydF4y2Ba517gydF4y2Ba),用分光光度计测定其抗氧化活性,用DPPH自由基抑制率测定其抗氧化活性,采用修正方程(gydF4y2BavgydF4y2Ba).gydF4y2Ba
为了定量总酚含量,用2.5 mL 95% (v/v)乙醇混合提取50 mg幼苗的嫩枝或根,在0°C下孵育48-72 h。使用匀浆器将提取物混合,并在9660下通过冷离心(4°C)沉淀gydF4y2BaggydF4y2Ba10分钟。将得到的上清液或提取溶剂作为对照(1 mL)与2.5 mL 95% (v/v)乙醇、5 mL无菌蒸馏水和0.5 mL 50% (v/v)福林- ciocalteu试剂进行涡流混合,在25°C下放置5 min。在混合物中加入1ml 5% (v/v) NagydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba25°C在黑暗中培养1小时。用分光光度计测定所制混合物在725 nm处的吸光度,并将吸光度值与已知没食子酸浓度的标准曲线相对应,计算出每g鲜重植物材料mg没食子酸中总酚含量。gydF4y2Ba
确认gydF4y2Ba在足底gydF4y2Ba耐除草剂内生细菌的定植gydF4y2Ba
PGP细菌在水稻内部定殖的能力是一个很有前途的特性,这些细菌可以有利于水稻生长发育的整个生命周期。ERIC-PCR [gydF4y2Ba42gydF4y2Ba的研究是为了确认gydF4y2Ba在足底gydF4y2Ba为种子生物涂层选择的细菌定植。简单地说,如前所述,制备了从生物膜种子中生长的14天大的水稻幼苗的表面消毒的根和芽。将清洗过的植物材料(1克)在无菌蒸馏水(9毫升)中研磨,使用无菌研钵和研杵。将植物悬浮液(1 mL)连续稀释10倍,部分稀释液100 μL (10gydF4y2Ba3.gydF4y2Ba-10年gydF4y2Ba5gydF4y2Ba)涂抹在添加了一组用于细菌分离的除草剂的LB琼脂培养基上。实验分三次进行,随机收集生长中的菌落作为ERIC-PCR的模板DNA,选择用于种子生物涂膜的细菌的无菌培养作为对照。一对引物[gydF4y2Ba43gydF4y2BaERIC-PCR采用ERICIR (5 ' -ATGTAAGCTCCTGGGGATTCAC-3 ')和ERIC2 (5 ' -AAGTAAGTGACTGGGGTGAGCG-3 '),其中其他PCR组成与前文相同。ERIC-PCR采用热循环仪进行,条件如下:95℃预变性5 min, 94℃变性1 min,循环30次,52℃退火1 min, 72℃延伸1 min, 72℃终延伸10 min。采用1.5% (w/v)琼脂糖凝胶电泳,在100 v条件下电泳3 h, PCR产物为10 μL。用0.5 g mL染色后,使用gel Doc™XR+ gel文档系统(Biorad, USA)对凝胶上的DNA指纹进行观察和成像gydF4y2Ba−1gydF4y2Ba溴化乙锭。利用PAST 3.20版本对不同菌落和对照的指纹进行聚类,并分析其相似性百分比(gydF4y2Bahttps://folk.uio.no/ohammer/past/gydF4y2Ba) [gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
使用独立样本对从任何测量中获得的平均值和标准偏差(SDs)进行比较gydF4y2BatgydF4y2Ba-测试或方差分析(ANOVA)与Tukey的事后测试,所有可用的SPSS 25.0版(SPSS,芝加哥IL,美国)软件包。统计结果及意义(gydF4y2BaPgydF4y2Ba)水平(gydF4y2BaPgydF4y2Ba≤0.05)将在本文的其他地方讨论。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中产生的所有数据都包含在这篇发表的文章中。从本研究分离的微生物中获得的核苷酸序列可在GenBank (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/genbank/gydF4y2Ba),并附有注册编号;真菌分离株MG309751-MG309756gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2Ba1gydF4y2Ba)和MG309712-MG309716对细菌分离株(表gydF4y2Ba3.gydF4y2Ba和无花果。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- 迪:gydF4y2Ba
-
疾病的发病率gydF4y2Ba
- 背景:gydF4y2Ba
-
脱氧核糖核酸gydF4y2Ba
- 公司:gydF4y2Ba
-
脏穗病gydF4y2Ba
- DPPH:gydF4y2Ba
-
Diphenyl-1-PicrylhydrazylgydF4y2Ba
- ERIC-PCR:gydF4y2Ba
-
肠杆菌重复基因间一致性pcrgydF4y2Ba
- GI:gydF4y2Ba
-
发芽指数gydF4y2Ba
- 医生:gydF4y2Ba
-
发芽率gydF4y2Ba
- 其:gydF4y2Ba
-
内部转录间隔gydF4y2Ba
- 磅:gydF4y2Ba
-
Luria-BertanigydF4y2Ba
- 本:gydF4y2Ba
-
平均发芽时间gydF4y2Ba
- 门诊部当:gydF4y2Ba
-
最佳启动时间gydF4y2Ba
- 聚合酶链反应:gydF4y2Ba
-
聚合酶链反应gydF4y2Ba
- PDA:gydF4y2Ba
-
马铃薯葡萄糖琼脂gydF4y2Ba
- PGP:gydF4y2Ba
-
促进植物生长gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
泰国农业经济办公室。gydF4y2Bahttp://www.oae.go.th/view/1/Information/gydF4y2Baen - us(2018)。2018年9月1日访问。gydF4y2Ba
- 2.gydF4y2Ba
可湿性颗粒及鲜培养的效果gydF4y2Ba木霉属asperellumgydF4y2Ba生物防治产品在促进和减少水稻脏穗生长中的应用。农业资源,2016;50:243-9。gydF4y2Ba
- 3.gydF4y2Ba
李志强,李志强,李志强,等。储藏水稻籽粒真菌菌群及其化学防治。中国植物科学,2011;21:193-6。gydF4y2Ba
- 4.gydF4y2Ba
高希,李志强,陈志强,陈志强,等。不同谷物作物种子间真菌菌群及其管理研究进展。中国生物医学工程学报,2018;gydF4y2Ba
- 5.gydF4y2Ba
泰国失败的大米计划造成了堆积如山的谷物。2013gydF4y2Bahttps://www.smh.com.au/world/thailands-failed-rice-scheme-creates-moulding%2D%2D-mountains-of-grain-20130724-2qjdy.htmlgydF4y2Ba.2018年9月1日访问。gydF4y2Ba
- 6.gydF4y2Ba
Naveenkumar R, Muthukumar A, Sangeetha G, Mohanapriya R.开发用于水稻主要种传病害管理的环保型生物杀菌剂,并评估其物理稳定性和贮藏寿命。中国生物医学杂志,2017;34:214 - 25。gydF4y2Ba
- 7.gydF4y2Ba
唐涛,刘旭,王鹏,付伟,马敏。噻虫嗪种子处理对水稻蓟马的防治作用(gydF4y2BaChloethrips oryzaegydF4y2Ba)及其对水稻生长和产量的影响(gydF4y2Ba栽培稻gydF4y2Ba).作物学报,2017;98:136-42。gydF4y2Ba
- 8.gydF4y2Ba
彭丽丽,杨建平,杨建平,杨建平。水稻中农药残留的分析方法。化学学报。2011;30:270-91。gydF4y2Ba
- 9.gydF4y2Ba
卡瓦略FP。农业、农药、粮食安全和食品安全。环境科学学报。2006;9:685-92。gydF4y2Ba
- 10.gydF4y2Ba
王永强,王永强,王永强。有机食品中农药残留的风险分析。化学卫生杂志2006;13:12-9。gydF4y2Ba
- 11.gydF4y2Ba
Begum MM, sarariah M, Puteh AB, Zainal Abidin MA, Rahman MA, Siddiqui Y.生物启动种子的田间抑制性能gydF4y2Ba炭疽菌truncatumgydF4y2Ba引起大豆潮气和苗木倒伏。生物控制,2010;53:18-23。gydF4y2Ba
- 12.gydF4y2Ba
Paparella S, Araújo SS, Rossi G, Wijayasinghe M, Carbonera D, Balestrazzi A.种子启动:技术现状和新视角。植物细胞,2015;34:1281-93。gydF4y2Ba
- 13.gydF4y2Ba
王志强,王志强,王志强,等。促进植物生长的种子生物涂层研究进展。微生物学杂志,2016;92:1-14。gydF4y2Ba
- 14.gydF4y2Ba
Wright B, Rowse HR, Whipps JM。鼓式打浆过程中有益微生物对种子的应用。生物防治科学,2003;13:599-614。gydF4y2Ba
- 15.gydF4y2Ba
Mano H, Morisaki H.水稻内生细菌。微生物与环境。2008;23:109-17。gydF4y2Ba
- 16.gydF4y2Ba
Rangjaroen C, sunthong R, Rerkasem B, Teaumroong N, Noisangiam R, Lumyong S.未开发的内生定植和植物生长促进潜力gydF4y2BaNovosphingobiumgydF4y2Ba优化水稻栽培。微生物与环境,2017;32:84-7。gydF4y2Ba
- 17.gydF4y2Ba
Nakaew N, Sungthong R.种子植物化学物质塑造可培养的放线菌栖息植物内部泰国色素水稻的群落结构。Microbiologyopen。2018;7:e591。gydF4y2Ba
- 18.gydF4y2Ba
纪实,马古鲁拉尼,春生昌。促进水稻内生重氮营养细菌的分离与鉴定。微生物学决议2014;169:83-98。gydF4y2Ba
- 19.gydF4y2Ba
Benyamin L, Buyung H, Siti H, Erna S, Laily IW, Kartika K, Lindi L, Yunin Y, Mei M.印度尼西亚河岸湿地水稻生产的农民实践和制约因素。中国生物医学工程学报,2018;gydF4y2Ba
- 20.gydF4y2Ba
细谷K,杉山S-I。日本北部无投入稻田杂草群落及其对水稻产量的负面影响生物农业。2017;33:215-24。gydF4y2Ba
- 21.gydF4y2Ba
威斯勒G,诺里斯RF。杂草与栽培植物之间的相互作用与植物病原体的管理有关。植物科学学报,2009;43(3):344 - 344。gydF4y2Ba
- 22.gydF4y2Ba
Kakar KU, Nawaz Z, Cui Z, Almoneafy AA, Ullah R, Shu QY。Rhizosphere-associatedgydF4y2Ba产碱杆菌属gydF4y2Ba而且gydF4y2Ba芽孢杆菌gydF4y2Ba诱导水稻抗稻瘟病和纹枯病、促进植物生长和提高水稻矿物质含量的品系。应用微生物学杂志,2017;124:779-96。gydF4y2Ba
- 23.gydF4y2Ba
Saechow S, Thammasittirong A, Kittakoop P, Prachya S, Thammasittirong SNR。对水稻脏穗真菌病原菌的拮抗活性及植株促生长活性gydF4y2Ba芽孢杆菌amyloliquefaciensgydF4y2BaBAS23。中国生物工程学报。2018;28:1527-35。gydF4y2Ba
- 24.gydF4y2Ba
贾西米-戈雷扎尼,查达杜兹-吉迪A, Nasrollahzadeh S, Moghaddam .水启动时间对斑豆幼苗活力和产量的影响(gydF4y2Ba菜豆gydF4y2Bal .)品种。Not Bot Hort Agrobot Cluj. 2010; 38:109-13。gydF4y2Ba
- 25.gydF4y2Ba
李志刚,李志刚,李志刚,等。种子启动时间和温度对面包小麦种子萌发行为的影响(gydF4y2Ba小麦gydF4y2Bal .)。中国农业生物学杂志,2010;5:1-6。gydF4y2Ba
- 26.gydF4y2Ba
谢松,吴红,陈琳,臧红,谢艳,高旭gydF4y2Ba枯草芽孢杆菌gydF4y2BaOKB105对水稻幼苗的响应。微生物学杂志,2015;15:1-14。gydF4y2Ba
- 27.gydF4y2Ba
辛格A,古普塔R,潘dey R.皮摩尔芦丁对水稻根际的促进作用gydF4y2Ba枯草芽孢杆菌gydF4y2BaCIM定殖与植物生长。PLoS One. 2016;11:e0146013。gydF4y2Ba
- 28.gydF4y2Ba
松岛K-I,坂神J-I。不同土壤水分条件下种子加氢对水稻出苗期萌发及幼苗活力的影响。植物科学学报,2013;4:489 - 497。gydF4y2Ba
- 29.gydF4y2Ba
水稻抗氧化剂:酚酸、类黄酮、花青素、原花青素、生育酚、生育三烯醇、γ-谷维素和植酸。食品科学,2014;2:75-104。gydF4y2Ba
- 30.gydF4y2Ba
雷斯A,贾宾Z,沙伊尔F,哈菲兹FY,哈桑MN。gydF4y2Ba芽孢杆菌gydF4y2Ba水稻抗氧化防御酶活性是一种生物防治剂gydF4y2BaPyricularia oryzaegydF4y2Ba.PLoS One, 2017; 12:1-17。gydF4y2Ba
- 31.gydF4y2Ba
Filippi MCC, Da Silva GB, Silva- lobo VL, Côrtes MVC, Moraes AJG, Prabhu AS。叶风(gydF4y2BaMagnaporthe oryzaegydF4y2Ba)对巴西好氧水稻生长的抑制和促进作用。生物控制,2011;58:160-6。gydF4y2Ba
- 32.gydF4y2Ba
贾思敏,马志强,马志强,马志强,等。接种菌对水稻细菌性叶枯病生长的促进和抑制作用。PLoS One, 2016;11:e0160688。gydF4y2Ba
- 33.gydF4y2Ba
White T, Bruns T, Lee S, Taylor J.真菌核糖体RNA基因扩增和直接测序的系统发育。圣地亚哥:学术出版社;1990.gydF4y2Ba
- 34.gydF4y2Ba
韦斯堡工作组,谷仓SM,佩尔蒂埃DA,莱恩DJ。16S核糖体DNA扩增用于系统发育研究。中华微生物学杂志,2001;gydF4y2Ba
- 35.gydF4y2Ba
李志强,李志强,李志强,等。水稻种子生物膜的研究进展gydF4y2Ba磷细菌gydF4y2Ba增强发芽和活力。选用。2017;54:346-9。gydF4y2Ba
- 36.gydF4y2Ba
国际种子检测协会(ISTA)。苗木评价手册。瑞士:ISTA;2003.gydF4y2Ba
- 37.gydF4y2Ba
官方种子分析师协会(AOSA):种子活力测试手册。林肯,NE。,U.S.A.: AOSA; 1983.
- 38.gydF4y2Ba
埃利斯RH,罗伯茨EH。正统种子老化和存活的定量研究。种子科学,1981;9:373-409。gydF4y2Ba
- 39.gydF4y2Ba
Mew TW, Misra JK。水稻种子健康检验手册。菲律宾:国际水稻研究所;2004.gydF4y2Ba
- 40.gydF4y2Ba
琼斯简森-巴顿。进行土壤试验和植物分析的实验室指南。伦敦:CRC出版社;2001.gydF4y2Ba
- 41.gydF4y2Ba
Sadh PK,撒哈拉P, Duhan S, Duhan JS。酚类化合物的生物富集与抗氧化活性的结合gydF4y2Ba栽培稻gydF4y2Ba而且gydF4y2Ba扁豆紫色gydF4y2Ba用GRAS丝状真菌发酵。生态学报,2017;(3):347 - 52。gydF4y2Ba
- 42.gydF4y2Ba
尚宽永华,杨建峰,林海春,邵木芳。PCR-RFLP、核型和ERIC-PCR分型的比较gydF4y2Ba炭疽杆菌gydF4y2Ba而且gydF4y2Ba蜡样芽胞杆菌gydF4y2Ba菌株。应用微生物学杂志,2000;89:452-62。gydF4y2Ba
- 43.gydF4y2Ba
李志强,李志强,李志强,等。细菌中重复DNA序列的分布及其在细菌基因组指纹识别中的应用。核酸决议1991;19:6823-31。gydF4y2Ba
- 44.gydF4y2Ba
Hammer Ø, Harper DAT, Ryan PD。过去:用于教育和数据分析的古生物统计软件包。4.古生物电子2001;gydF4y2Bahttp://palaeo-electronica.org/2001_1/past/issue1_01.htmgydF4y2Ba.2018年9月1日访问。gydF4y2Ba
确认gydF4y2Ba
我们非常感谢Pairot Kaewmak先生(苏潘武里省的一名农民)的好意,允许我们在这项研究中使用他的水稻种子。作者还感谢其他当地农民允许我们收集田间种植的水稻幼苗,为我们提供了分离内生细菌的来源,并真诚地向我们提供了他们水稻种植中使用的除草剂的信息。gydF4y2Ba
资金gydF4y2Ba
CR由Phranakhon Rajabhat大学支持。CR和SL得到泰国研究基金的资助(扶轮基金会奖助金:RTA5880006)。WTS和RS得到了英国工程和物理科学研究委员会的资助(EPSRC资助:EP/K038885/1)。资助者没有在这项研究的设计和执行、数据的分析和解释以及撰写手稿中发挥作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
CR策划并完成实验,并准备了手稿。SL和WTS对工作和结果解释提出了建议。RS监督工作,编写和编辑手稿。所有作者均已阅读并批准稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
C.朗加罗恩,S.鲁明,w .斯隆gydF4y2Baet al。gydF4y2Ba水稻耐除草剂内生细菌作为水稻不健康种子育性恢复和病害抑制的生物保护剂。gydF4y2BaBMC植物生物学gydF4y2Ba19日,gydF4y2Ba580(2019)。https://doi.org/10.1186/s12870-019-2206-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2206-zgydF4y2Ba
关键字gydF4y2Ba
- 细菌内生菌gydF4y2Ba
- 植物病原真菌gydF4y2Ba
- 脏穗病gydF4y2Ba
- 大米gydF4y2Ba
- 种子的股票gydF4y2Ba
- 种子biopriminggydF4y2Ba
- 耐除草剂的细菌gydF4y2Ba