摘要
背景
由真菌引起的镰刀菌头疫病(FHB)镰刀菌素graminearum条纹锈蚀和条纹锈蚀造成的柄锈菌striiformisf . sp。tritici是影响全球小麦生产的毁灭性疾病。使用抗病基因和品种是减少使用杀菌剂来防治这些疾病的最有效手段。大被(2n= 6x= 42, StStStStHH)是一种潜在的小麦抗条锈病种质。
结果
在这里,我们报道了两种小麦的发育和特性- e。被来自普通小麦后代的系大肠被混合动力车。细胞学研究表明,K15-1192-2和K15-1194-2在减数分裂时的平均染色体构型为2n我= 42 = 0.86 + 17.46 II(环)+ 3.11 II(杆)和2n我= 42 = 2.45 + 14.17二世(环)+ 5.50 II(杆)+ 0.07 III,分别。基因组、荧光原位杂交、核型分析和简单序列重复标记表明,K15-1192-2是一个小麦基因大肠被3 d / ?双端染色体易位线。K15-1194-2号线被确认藏有一双7DS/?StL罗伯逊易位和一个3D/?St双端易位染色体。利用特异表达序列标记- ssr标记进一步分析证实了小麦-大肠被易位涉及到两条细胞系的3St染色质。此外,与小麦亲本川农16相比,K15-1192-2和K15-1194-2对中国流行的FHB和条锈病表现出较高的抗性。
结论
因此,本研究确定了染色体3St大肠被含有抗小麦赤霉病和条锈病的高抗性基因,且3St基因的染色质完全渗入到小麦染色体中,表明利用这些易位系作为小麦抗病品种选育和外源基因挖掘的新材料是可行的。
背景
赤霉病(Fusarium head blight, FHB),主要由子囊菌真菌引起镰刀菌素graminearum施瓦贝[telomorph,赤霉菌属菌(等)。是小麦的一种重要病害。小麦世界性的[1,2]。由于镰刀菌损坏的籽粒和霉菌毒素污染(主要是脱氧雪腐镰刀菌醇),威胁粮食和饲料安全,因此,口蹄疫造成重大产量损失,并降低粮食质量和功能[3.,4]。培育抗抗性品种通常被认为是控制食虫病最有效和最环保的策略[5]。迄今为止,在50个小麦品种的21个染色体上,已经报道了100多个独特的数量性状位点[j]。6,7]。此外,只有少数正式指定的抗fhb基因来自小麦的野生近缘种,如Fhb3来自Leymus racemosus,Fhb6来自大tsukushiensis,Fhb7来自Thinopyrum ponticum[8,9,10]。因此,更多新的抗性来源的发现、开发和鉴定将为育种者提供更广泛的种质选择[7,10]。
条锈,由柄锈菌striiformis即。f . sp。tritici埃里克。(太平洋标准时间),对世界许多地区的小麦生产是一种毁灭性的疾病[11]。新的抗病基因和品种是减少用于防治这种疾病的杀菌剂用量的最有效手段[12]。目前正式指定的有81家,临时指定的有67家(年)基因和超过330个qtl分布在普通小麦及其近缘品种中[13,14]。然而,大多数耐药基因(如Yr1-4,Yr6-10,Yr17,Yr20-22,Yr24-29,Yr43)对新出现的毒条纹锈病V26/Gui22及其变种无效[15,16]。普通小麦的野生近缘种含有大量具有可用于小麦改良的理想性状的基因[17]。例如,23个正式指定的基因来自三级基因库中的野生小麦相关物种,包括Secale cereale,Dasypyrum仁,Thinopyrum媒介,Th。ponticum,还有几个山羊草属物种(13,18]。因此,在适应种质中鉴定新的抗性来源是实现持久和广谱抗性的重要和长期目标。
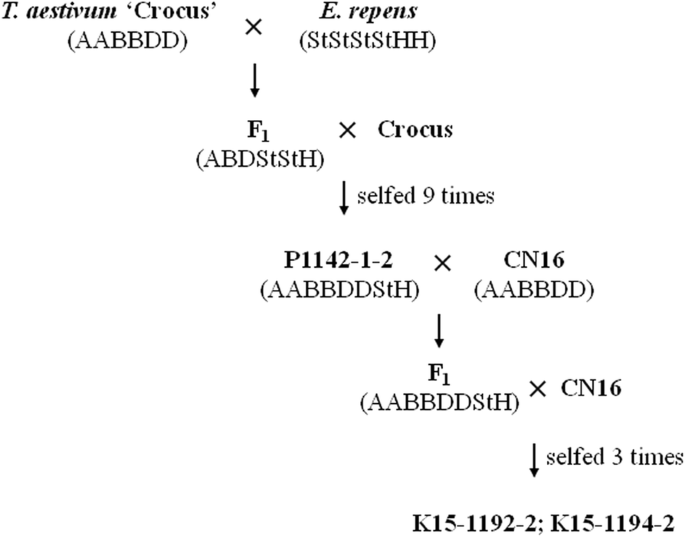
作为小麦的重要野生近亲,大被(l)古尔德(syn。Agropyron被(l)p波伏娃Elytrigia被(l)Deskv。比如涅夫斯基,还有小麦属植物被L.]具有StStStStHH基因组,在世界范围内分布广泛[19]。它是小麦改良的一个有价值的品种,因为它耐各种土壤类型、重金属和冷胁迫[20.]。迄今为止,关于其抗病性的报道很少。Zeng等。[21]开发了八种小麦-大肠被染色体数目从42到56的渗入系。与对照品种相比,这些品系对赤霉病具有抗性t . aestivum“罗布林”和“番红花”。由此得出结论,这些品系携带fhb抗性基因大肠被.从…转移可取的特征大肠被在中国四川盆地的小麦品种中,我们通过小麦杂交和回交获得了许多子代大肠被P1142-1-2线n= 56)与本地小麦品种。本研究是为了开发和鉴定小麦大肠被易位系采用基因组原位杂交(GISH)、荧光原位杂交(FISH)和分子标记。此外,还评价了它们对小麦赤霉病、条锈病抗性和农艺性状的影响。
结果
衍生系减数分裂行为
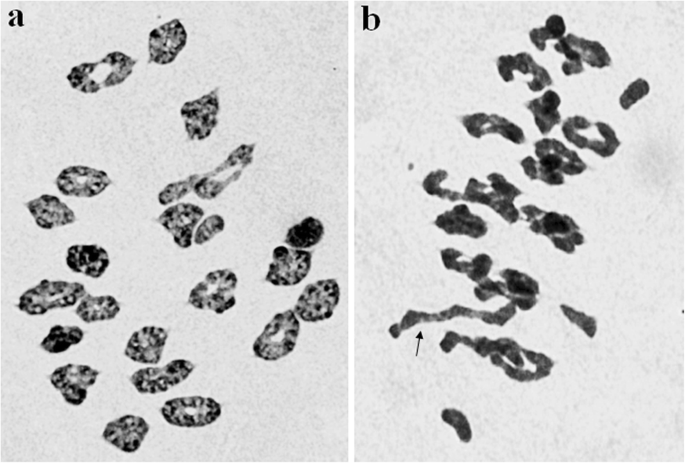
K15-1192-2的pmc在减数分裂中期I染色体配对率很高,平均染色体构型为0.86个单价+ 17.46个环二价+ 3.11个杆二价,每株约50个pmc(图)。1a).品系K15-1194-2的平均减数分裂构型为2n我= 42 = 2.45 + 14.17二世(环)+ 5.50 II(杆)+ 0.07 III / PMC(无花果。1b).后期I和II未见滞后染色体或桥。
GISH和FISH分析
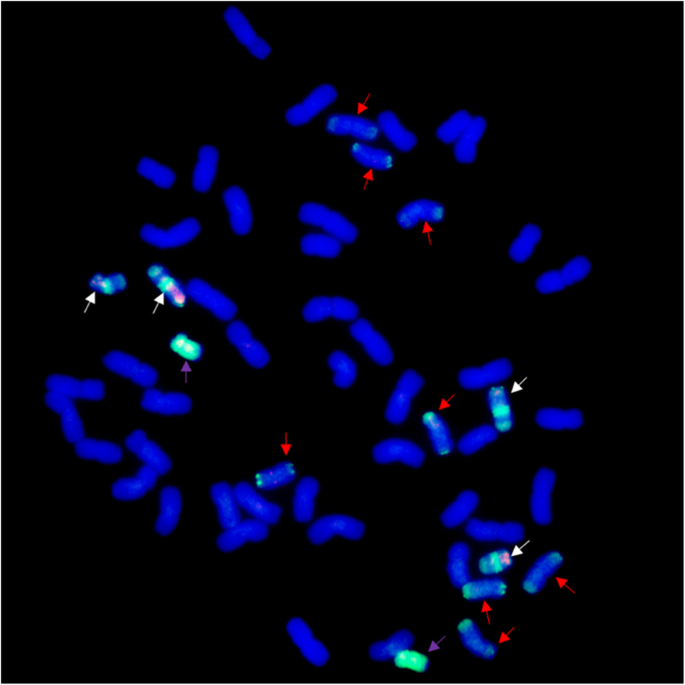
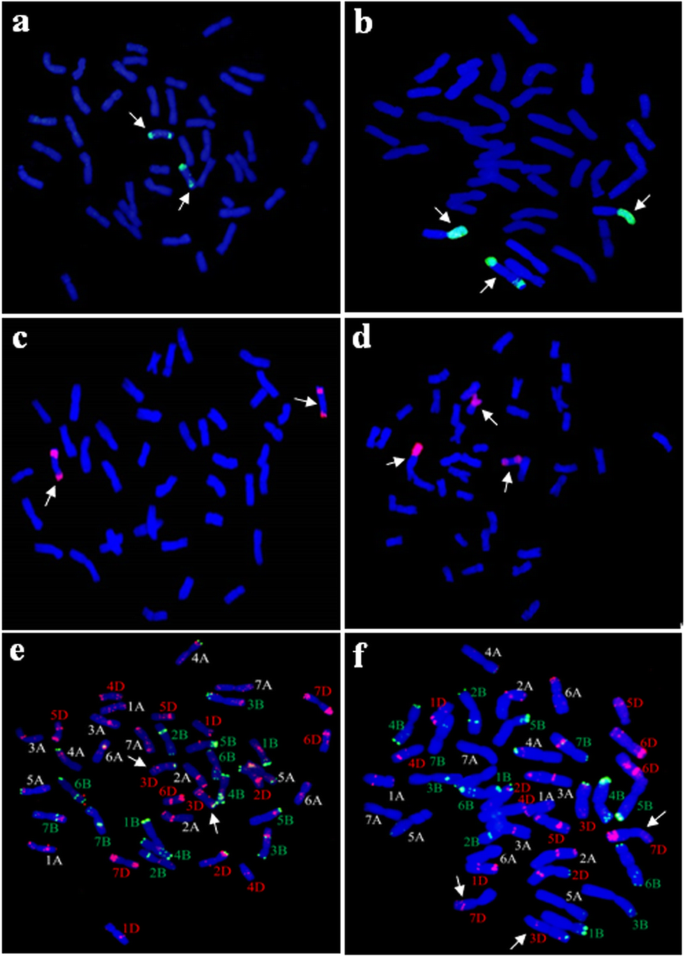
P1142-1-2同时探测Pse。strigosa(St基因组)和h . bogdanii(H基因组)DNA显示小麦完整的42条染色体,2条St基因组染色体,4条具有小麦、H和St基因组大片段的染色体,加上8条具有双St基因组末端易位的小麦染色体(图2)。2).当大肠被以总基因组DNA为探针,J-11基因组DNA为块,观察到40条小麦染色体加2条小麦染色体大肠被K15-1192-2双端易位染色体(图2)3.a). K15-1194-2n= 42)被发现有一对小麦大肠被罗伯逊易位和一条双端易位染色体(图2)。3.b).为了进一步确定参与易位的外来染色体的身份,还使用了的总基因组DNA进行了GISHh . bogdanii和Pse。strigosa作为探针。然而,h . bogdanii两系未检出染色质。因此,小麦大肠被易位涉及St基因组,由于信号出现在易位的两条染色体上(图2)。3.c, d)。
为了进一步确定参与易位的小麦染色体的身份,使用pSc119.2和pTa535探针对易位进行了FISH检测。我们发现,系K15-1192-2的双端易位片段位于小麦染色体3DS和3DL上(图2)。3.e). K15-1194-2线被鉴定为藏有一对7DS/?StL罗伯逊易位和一个3D/?St双端易位染色体(图。3.f)。
分子标记分析
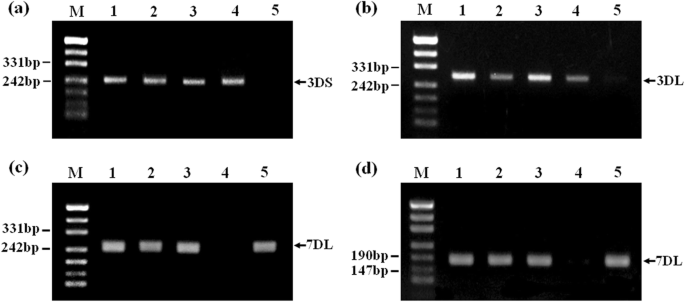
扩增产物为小麦染色体末端区3ds和3DL-SSR特异标记(即Xcfd64和Xcfd211)在K15-1194-2、P1142-1-2、CS和CN16中观察到。相比之下,这两种引物没有产生K15-1192-2的扩增子(图2)。4a, b)。SSR分析也表明,两对引物(Xwmc14和Xbarc111),在K15-1192-2、P1142-1-2、CS和CN16中获得了预期大小的条带,但在K15-1194-2中没有(图2)。4c, d)。
Kong等。[22]开发了特异性的第1St-7St染色体分子标记Roegneria ciliaris根据小麦的est。利用这些EST-SSR标记,我们证明了该标记在美国东部时间3 - 147特异于3St染色体(ESTs编号:BF293133)扩增的共同带(760bp)大肠被, P1142-1-2, K15-1192-2和K15-1194-2,但该波段在CS和CN16中未被放大(图16)。5a).相比之下,第1、2St、4St、5St、6St和7St染色体特异的EST-SSR标记扩增的特异带在两者之间未检测到大肠被或P1142-1-2和K15-1192-2、K15-1194-2(图2)5b).这些结果证实,参与这两个易位的外源染色质来自于3St染色体大肠被.
K15-1192-2和K15-1194-2的形貌
K15-1192-2和K15-1194-2在亲本CN16和P1142-1-2之间表现出稳定的形态特征(表1)1).平均株高显著高于CN16和P1142-1-2。两系分蘖数均显著大于CN16,与P1142-1-2相近。K15-1194-2的平均穗长显著大于P1142-1-2、CN16和K15-1192-2。K15-1192-2和K15-1194-2的千粒重显著高于P1142-1-2,但低于CN16。K15-1192-2、K15-1194-2、CN16和P1142-1-2的每穗颖花数差异不显著。
FHB抗性评估
在受控环境室内对K15-1192-2、K15-1194-2、P1142-1-2、CN16和SY95-71进行FHB抗性评价。易感对照系SY95-71和亲本CN16、P1142-1-2的平均侵染小花率分别为93.3%、58.8%和7.7%。相比之下,K15-1194-2和K15-1192-2是抗性的。6),平均感染率分别为7.1和8.3%,与P1142-1-2相似。
条纹防锈
在成株期,CN16和SY95-71三个重复株系的每个植株都对一种混合的太平洋标准时间CYR-32、CYR-33、CYR-34和V26/ Gui22-14均为感染型4。相比之下,P1142-1-2、K15-1192-2和K15-1194-2对这些小种具有高度抗性,均表现为侵染型0;(无花果。7).苗期条锈病评价表明,P1142-1-2、K15-1192-2和K15-1194-2具有较强的抗性太平洋标准时间种族CYR-34。相比之下,SY95-71、亲本CN16和Crocus是高度易感的(图2)。8).
讨论
小麦与野生近缘种间的大多数易位基因型山羊草属,Secale,大麦,Thinopyrum,Agropyron,Dasypyrum,Leymus,新已在现时的小麦育种计划中成功生产[23,24,25]。大L. sensu lato对多种生物和非生物胁迫具有抗性或耐受性,是增加普通小麦遗传多样性的重要野生基因库[j]。26,27]。小麦的生产大补偿外源染色体的易位是基因转移的第一步大为了繁殖的目的,种小麦。到目前为止,从大小麦品种已被培育,包括大肠trachaycaulus,大肠ciliaris,大肠tsukushiense[9,26,27,28]。大交叉大肠被普通小麦始于20世纪80年代[29]。Zeng等。[21]发展并鉴定了八种普通小麦- e。被公元前1F9在这些系中发现了大量的易位染色体。在这些行中,P1142-1-2 (2n= 56)包含42条小麦染色体和14条涉及W-St-H和St-H易位的易位染色体,被认为是重要的育种潜力材料[21]。结果表明,P1142-1-2包含完整的42条小麦染色体,2条St基因组染色体,4条具有小麦、H和St基因组大片段的染色体,以及8条具有双St基因组末端易位的小麦染色体。从…转移可取的特征大肠被在四川盆地小麦品种中,我们将P1142-1-2与CN16杂交1与CN16回交。从P1142-1-2/2*CN16 BC中鉴定出纯合易位系K15-1192-2和K15-1194-21F3.后代。体细胞中期染色体的GISH和FISH分析证实了小麦染色体的存在大肠被3 d / ?St双端易位和7DS/?分别是罗伯逊易位。Fedak等。[30.]表明P1142-3-15也有42条染色体,其中一对染色体在两条3D臂上都表现出末端易位。然而,它是从普通小麦藏红花/大肠被/ / F磨粉9后代。此外,K15-1192-2系平均有20.57个二价和0.86个单价,而P1142-3-15系的单价发生率较低,为0.34个[21]。耐药菌株K15-1192-2感染率为8.3%,而P1142-3-15感染率为11.46% [21]。因此,K15-1192-2和P1142-3-15是不同的易位系,尽管它们在两个3D臂上都有末端易位。我们进一步证实,小麦大肠被K15-1192-2和K15-1194-2的易位涉及使用st特异性EST-SSR标记的3St染色质,这与Kong等人的扩增结果一致。22]。这些结果,连同高细胞学稳定性的两个系,表明从3St转移的染色质大肠被弥补了小麦染色质的缺失。这些品系为外源基因的导入提供了合适的桥梁育种材料,从而提高小麦的抗病性。
几十年来,小麦对赤霉病的抗性一直是小麦育种工作的主要焦点,并依赖于多种种质资源[31]。目前小麦育种项目中使用的FHB抗性来源可以追溯到有限的亲本,包括苏麦3号及其衍生物、王水白和武汉1号[6]。因此,不断需要评估和鉴定外来种质和小麦的新抗性来源[9]。Liu等。[32]表明Roegneria ciliaris,Roegneria kamoji,l . racemosus对FHB有很高的抵抗力。Fu等。[33发现了一个FHB抗性基因位于染色体7E上Th。elongatum,但由于连杆阻力,没有使用。Fhb3来源于一个四倍体小麦亲缘种,l . racemosus,并以补偿型罗伯逊易位T7AL的形式转移到小麦中。7 # 1 s lr (8]。蔡农等。[9成功地映射并转移了Fhb6从大肠tsukushiensis为小麦。郭等。[10[7]发展和表征了次级ds2L易位系缩短Th。ponticum段携带Fhb7.FHB耐药性也被记录在山羊草属tauschii,大肠trachaycaulus,大肠被,r . ciliaris,Th。junceum,小麦属植物monococcum,小麦属植物timopheevii,小麦属植物carthlicum,小麦属植物玛莎[22,27,30.,31,34]。最近,Fedak等人。[30.结果表明,小麦对赤霉病的抗性是由小麦提供的大肠被染色体长臂上的易位。Zeng等。[21报道说,八粒小麦大肠被渗入系对FHB表现出高水平的抗性,P1142-1-2 (2)n= 56),感染率为11.35%。目前,中国四川盆地的大部分小麦品种和育种品系对赤霉病易感。为了提供新的抗赤霉病资源,并将新基因转移到四川小麦品种上,我们开发并鉴定了两种小麦新品种大肠被纯合易位系(2)n= 42)来自P1142-1-2/2*CN16代。与亲本CN16的感染率(58.8%)相比,K15-1192-2(8.3%)和K15-1194-2(7.1%)对FHB具有较高的抗性。因此,这些新的易位系可能为培育抗fhb小麦品种提供有价值的种质资源。
新的条锈病种CYR34对所有先前确定的有效太平洋标准时间并已在商业品种中部署,以对抗中国的优势菌种[15]。很少有基因对CYR34有效,包括Yr5,−15,−16,−18的原始来源Yr11,−12,−13,−14[35]。这种病原菌对中国四川盆地的小麦生产构成严重威胁,并可能对其他地区造成威胁。15]。有必要加快有效抗条锈病基因的鉴定和利用,培育具有持久抗性的小麦新品种。16]。小麦的野生近缘种提供了丰富多样的抗性资源Yr15,−24/26,−35,−36,−53,−64,−65从四倍体小麦,Yr9从美国cereale,Yr8,−17,−28,−37,−38,−40,−42,−48,−70从山羊草属物种,Yr50从Th。媒介[18]。在本研究中,K15-1192-2和K15-1194-2来源于P1142-1-2/2*CN16 BC1F3.他们的后代对流行的汉语有很强的抵抗力太平洋标准时间苗期和成株期的小种。亲本P1142-1-2对所有被试小种均有抗性,而CN16易感。P1142-1-2源自十字形' Crocus ' /大肠被/ /“番红花”(21]。抗条锈病调查显示,‘番红花’对条锈病易感,P1142-1-2的抗性来源于大肠被.因此,该家系提供了唯一的证据,证明K15-1192-2和K15-1194-2携带来自水稻3St染色体的抗条锈病基因大肠被.据我们所知,这是第一次成功转移一种新的高水平的条锈病抗性基因大肠被这涉及到St基因组。小麦新品系为提高四川盆地所有流行的条锈病的抗性提供了新的资源。
结论
综上所述,我们培育并鉴定了两种小麦- e。被通过GISH、FISH、SSR和EST-SSR标记检测3St染色体易位系。与小麦亲本相比,这些易位系对中国流行的FHB和条锈病病原体表现出较高的抗性。我们的研究已经确定染色体3St大肠被含有抗小麦赤霉病和条锈病的高抗性基因,且3St基因的染色质完全渗入到小麦染色体中,表明利用这些易位系作为小麦抗病品种选育和外源基因挖掘的新材料是可行的。
方法
植物材料
小麦-大肠被P1142-1-2线n= 8x= 56),具有耐寒、耐多种土壤类型、耐重金属的特点,以及对赤霉病和锈病的优异抗性,最初是从藏红花/杂交品种中开发和鉴定出来的大肠被/ /公元前磨粉1F9加拿大渥太华东部谷物和油籽研究中心的后代[21]。摘要川农16 (CN16)是西南地区小麦育种中较为理想的循环亲本,具有较好的农艺性状;然而,它易受条锈病、白粉病和FHB [24]。生产小麦——大肠被导数线,我们将P1142-1-2与CN16相交,F1与CN16回交。然后从BC中选择种子1F1植物体积庞大,并发展到公元前1F3.单种子遗传。经过2年的观察,从76株P1142-1-2/2*CN16 BC中分离到2株抗条锈病和赤霉病的衍生品系K15-1192-2和K15-1194-21F3.子代系(图2)9).以小麦系SY95-71和番红花为敏感对照,进行病害反应试验。以小麦品种中国春(CS)为阳性对照进行分子标记分析。以J-11小麦品种作为阻断DNA的来源大肠被加入PI229925,大麦bogdanii(2n= 2x= 14, HH)加入Y1819Pseudoroegneria strigosa产品编号:W6-14049n= 2x= 14, StSt)作为GISH分析探针DNA的来源。凭证标本保存于中国四川农业大学小麦研究所植物标本室。
减数分裂分析
减数分裂的分析遵循Kang等人描述的程序。[36]。每株植物至少有50个花粉母细胞。使用Olympus BX-63显微镜(Olympus, Tokyo, Japan)的DP-70 CCD相机拍摄图像。
GISH和FISH分析
根尖用Komuro等人的方法处理和消化。37],然后按照Han等人的描述制作GISH玻片。[38]。从鲜叶中提取基因组dna大肠被,h . bogdanii,Pse。strigosa用十六烷基三甲基溴化铵法测定小麦品种J-11 [39]。大肠被,h . bogdanii,Pse。strigosadna分别用荧光素-12- dutp(绿色)和Texas red -12- dutp(红色)通过缺口翻译法(Thermo Fisher Scientific, Eugene, OR, USA)独立标记,然后用作杂交探针。根据Han等进行GISH分析。[40用探针DNA与阻断剂DNA的比例为1:150。每片载10 μL含有2x SSC(柠檬酸盐钠)、10%葡聚糖硫酸盐、10 ng/μL标记探针DNA和阻断DNA的杂交液,85℃加热变性5 min, 37℃孵育8 h,室温下用2x SSC洗涤。最后,用4,6-二氨基-2-苯基吲哚溶液(Vector Laboratories, Burlingame, CA, USA)对染色体进行反染色。GISH图像由DP-70 CCD相机拍摄,使用Olympus BX-63显微镜。
GISH载玻片用70% (v/v)乙醇洗涤5分钟,用2倍SSC在60°C下洗涤30分钟,ddH2O(双倍蒸馏水)浸泡10分钟,100% (v/v)乙醇浸泡5分钟。随后使用FISH分析鉴定了K15-1192-2和K15-1194-2系的组成,使用pSc119.2和pTa535作为探针[37,41]。FISH是根据Han等人进行的。[38]。FISH信号在荧光显微镜(Olympus BX63)下显示,DP-70 CCD相机捕获图像,并用Adobe Photoshop软件进行分析。
分子标记分析
小麦d基因组染色体的特异SSR引物[j]42]用于测定小麦K15-1192-2和K15-1194-2的染色质。所表达的序列标签- ssr (EST-SSR)引物对分布在小麦7个同源类群中。22]被用来鉴定这两种细胞系的外来染色质。所有引物均由中国成都的TSINGKE公司合成,具体情况见表2.CS、P1142-1-2和CN16作为对照。按照前面的描述进行PCR扩增[22,42]。
农艺性状评价
在四川温江,通过3个重复,对K15-1192-2和K15-1194-2及其亲本的株高、分蘖数、穗长、穗粒数、穗粒数、千粒重和结实率7个形态性状进行了评价。具体方法采用Kang等人的方法。[24]。使用SAS 8.2系统(SAS Institute Inc., Cary, NC, USA)测定性状的显著差异。
FHB耐药性评估
植物接种试验参照Qi等的方法进行。43]。在花中期,用10 μ l / 1000的溶液点接种一个中心小穗的两个小花f . graminearum蒸馏水中的分生孢子。接种后的穗用塑料薄膜包裹48 h保持湿度。小麦植株在25°C的受控环境室中培养。接种后21天评估头疫病症状,每次处理5-10株。
条纹防锈筛分
以K15-1192-2、K15-1194-2、P1142-1-2、CN16和SY95-71为研究对象,评价了成虫对太平洋标准时间用涂片法田间试验了CYR-32、CYR-33、CYR-34和V26/ Gui22-14。44在中国四川成都的2017-2018生长季种植。评价依据Kang等[24重复三次。每个复制,每系20粒均匀种植,每行2.0 m,间隔0.3 m。以K15-1192-2、K15-1194-2、P1142-1-2、CN16、番红花和SY95-71为研究对象,评价其苗期反应太平洋标准时间生长室下的CYR-34小种。按照Li等人的描述对植株进行接种和评价。[qh]45]。以小麦品系SY95-71为感病对照。根据Li等人的描述,确定了条锈病感染类型(IT)。[45]。
数据和材料的可用性
本研究过程中产生和分析的数据集可应通讯作者的合理要求提供。
缩写
- CN16:
-
Chuannong16
- EST-SSR:
-
表达序列标签-简单序列重复
- FHB:
-
赤霉病
- 鱼:
-
荧光原位杂交
- 吉斯”:
-
基因组原位杂交
- 聚合酶链反应:
-
聚合酶链反应
- 私营军事公司:
-
花粉母细胞
- 太平洋标准时间:
-
柄锈菌striiformisf . sp。tritici
- SSRs:
-
简单序列重复
参考文献
- 1.
白刚,Shaner G.小麦和大麦赤霉病的防治及抗性研究。植物学报。2004;42(2):135 - 61。
- 2.
Mansfield J, Genin S, Magori S, Citovsky V, Sriariyanum M, Ronald P, Dow M, Verdier V, Beer SV, Machado MA, Toth I, Salmond G, Foster GD。植物分子病理学十大植物病原菌。植物病理学杂志,2012;13(3):614 - 629。
- 3.
黄志强,黄志强。细胞毒性研究镰刀菌素用MTT生物测定法测定哺乳动物细胞培养物中的真菌毒素。食品化学。2005;43:755-64。
- 4.
Pestka JJ。脱氧雪腐镰刀菌醇:作用机制、人体暴露和毒理学相关性。中华毒物学杂志,2010;34(4):663 - 79。
- 5.
苏志强,金世杰,张德东,白海光。诊断标记物的开发和验证Fhb1是小麦抗赤霉病的主要QTL。理论与应用,2018;31(1):2371 - 80。
- 6.
Buerstmayr H, Ban T, Anderson JA。小麦赤霉病抗性QTL定位与标记辅助选择研究进展植物学报。2009;28(1):1 - 26。
- 7.
张安,杨文伟,李旭,孙建忠。小麦赤霉病防治研究现状与展望。Hereditas(北京)。2018; 40:858 - 73。
- 8.
祁立林,彭福瑞MQ, Friebe B,陈PD, Gill BS。小麦抗赤霉病Fhb3基因外源渗入的分子细胞遗传学特征理论与应用,2008;(1):1155 - 1156。
- 9.
蔡农JC, Bockus WW,冯毅,陈鹏,祁林,Sehgal SK, Danilova TV, Koo D-H, Friebe B, Gill BS。染色体工程,定位和转移对枯萎病的抗性大tsukushiensis为小麦。理论与应用,2015;128:1019-27。
- 10.
郭军,张晓玲,侯玉玲,蔡建军,佘小荣,周涛,徐洪华,欧文文,王宏伟,李亚峰,韩凤飞,王海虹,孔立荣。主要FHB抗性基因的高密度定位Fhb7来自Thinopyrum ponticum它和Fhb1通过标记辅助选择。理论与应用,2015;128:2301-16。
- 11.
条状锈病的全球现状:历史和当前威胁的回顾。Euphytica。2011;179:129-41。
- 12.
陈XM。高温成株抗性是持续控制条锈病的关键。植物科学学报,2013;4(4):608。
- 13.
李建军,李建军,李建军,李建军。小麦基因符号目录:2017增刊。https://shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2017.pdf.2018年8月4日访问。
- 14.
王晓明,王晓明,王晓明,等。小麦条锈病抗性基因的分子定位Yr81在一种普通小麦地方品种Aus27430中。植物病,2019。https://doi.org/10.1094/PDIS-%2006-18-1055-RE.
- 15.
韩杰,王清良,陈晓明,曾庆东,吴建华,薛文华,张刚,黄磊,康志生。新兴Yr26-致命的种族柄锈菌striiformisf。tritici正在威胁中国四川盆地的小麦生产。植物学报,2015;99:754-60。
- 16.
马军,秦宁宁,蔡斌,陈根根,丁培培,张宏,杨春春,黄磊,穆勇,唐惠萍,刘永勇,王继杰,齐鹏飞,姜秋涛,郑玉玲,刘继杰,兰晓军,魏彦明。冬小麦品系20828 1BL全期抗条锈病新主QTL的鉴定与验证理论与应用,2019;32(2):1363 - 73。
- 17.
马立军,马立军,马立军,马立军。〇小麦的发展Lophopyrum elongatum盐胁迫下增强钠“排斥性”的重组系。理论与应用,2009;119:1313-23。
- 18.
郑国光,李云峰,陆磊,刘铮,张超,敖德华,李立荣,张云云,刘睿,罗鹏平,吴勇,雷震年小麦抗条锈病基因的标记辅助检测。Euphytica。2017;213:50。
- 19.
Mahelka V, Kopecky D.异源六倍体草科基因捕获Eymus被(l)Gould(禾本科,小麦科),ITS, GBSSI和分子细胞遗传学证明。中华生物医学工程学报,2010;27(2):369 - 369。
- 20.
Brej T.重金属耐受性Aropyron被(l)p . Bauv。下西里西亚莱格尼察铜冶炼厂地区的人口。社会科学学报。1998;67:325-33。
- 21.
曾军,曹伟,胡萍,杨勇,薛国光,池东,Fedak G.小麦分子细胞遗传学分析大被抗赤霉病渗入系。基因组。2013;56:75 - 82。
- 22.
孔琳,宋小燕,肖军,孙海军,戴克林,兰彩霞,辛格普文,袁彩霞,张思忠,辛格瑞,王海燕,王晓霞。开发并鉴定了一整套小麦- - - - - -Roegneria ciliaris二体附加线。理论与应用,2018;31:1793 - 806。
- 23.
Falke KC, Sušić Z, Wilde P, Wortmann H, Möhring J, Piepho HP, Geiger HH, Miedaner T.以伊朗系为供体的黑麦渗交系的标记辅助回交性能。理论与应用,2009;(1):1225 - 1238。
- 24.
康海燕,张志军,徐丽丽,祁文伟,唐勇,王辉,朱伟,李元达,曾军,王勇,范翔,沙琳,张hq,周永华。小麦的特性新huashanica小段易位线,每穗粒数增加,抗条锈病。基因组。2016;59:221-9。
- 25.
Cseh A, Yang CY, Hubbart-Edwards S, Scholefield D, Ashling SS, Burridge AJ, Wilkinson PA, King IP, King J, Grewal S.一种基于外显子组的SNP标记集的开发和验证,用于鉴定St, Jr和Jvs的基因组Thinopyrym媒介以小麦为背景。理论与应用,2019;32(2):1555 - 70。
- 26.
蒋军,陈佩德,陈文杰,王文杰。Alloplasmic小麦-大ciliaris染色体附加线。基因组。1993;36:327-33。
- 27.
蒋杰,莫里斯KLD,吉尔BS。渐渗现象的大trachaycaulus染色质变成普通小麦。染色体研究。1994;2:3-13。
- 28.
王绍林,齐立林,陈佩东,刘东杰,Friebe B, Gill BS。小麦的分子细胞遗传学鉴定大tsukushiense渐渗现象。Euphytica。1999;107:217-24。
- 29.
李建军,李建军,李建军。细胞减数分裂研究小麦×Elytrigia被混合动力车。基因组。1986;28:430-2。
- 30.
Fedak G,曹文武,Wolfe D, Chi D,薛安大被渗入面包小麦。中国生物医学工程学报,2017;31(1):391 - 391。
- 31.
Brisco EI, Brown LK, Olson EL。抗枯萎病的研究山羊草属tauschii.遗传资源学报,2017;64:2049-58。
- 32.
刘大杰,翁玉青,陈鹏鹏。抗痂性转移RoegneriaC. Koch (Agropyron)种变成小麦。第二届植物染色体工程国际学术研讨会论文集。G金柏。密苏里大学,哥伦比亚,密苏里州。p . 166 - 176。
- 33.
傅松,吕忠,齐波,郭欣,李军,刘波,韩峰。小麦分子细胞遗传学特征Thinopyrum elongatum具有抗小麦赤霉病新来源的添加、替代和易位系。基因工程学报,2012;39(3):1093 - 1093。
- 34.
McArthur RI,朱鑫,Oliver RE, Klindworth DL,徐世生,Stack rww,王荣荣,蔡祥Thinopyrum junceum和大rectisetus染色体赋予小麦抗病能力Thinopyrum和大小麦中的染色体。染色体学报,2012;20(2):699 - 715。
- 35.
吴健,王强,徐磊,陈鑫,李波,穆健,曾强,黄磊,韩东,康忠。结合单核苷酸多态性基因分型阵列和大量分离分析定位小麦品系03031-1-5H62成株抗条锈病基因。植物病理学。2017;108:103-13。
- 36.
康海燕,黄军,朱伟,李元达,刁德辉,唐丽,王勇,徐丽丽,曾杰,范晓,沙林,张hq,郑玉玲,周永华。小麦、黑麦和黑麦三属杂交后代的细胞遗传学行为新huashanica.中国生物医学工程学报,2016;48(1):444 - 444。
- 37.
高小浩,远藤R,石田K,加藤a .小麦不同重复DNA序列的基因组和染色体分布模式原位杂交过程。基因组。2013;56:131-7。
- 38.
韩峰,兰文杰,李文杰,等。玉米着丝粒失活频率的变化及其对双中心染色体稳定性的影响。科学通报,2006;30(3):388 - 388。
- 39.
Allen GC, Flores-Vergara MA, Krasynanski S, Kumar S, Thompson WF。使用十六烷基三甲基溴化铵快速从植物组织中分离DNA的改进方案。自然科学学报,2006;1:2320-5。
- 40.
韩峰,高志,李建军。失活着丝粒的再激活揭示了玉米着丝粒规格的表观遗传和结构成分。植物学报。2009;21(1):229 - 229。
- 41.
McIntyre C, Pereira S, Moran L, appeels R. NewSecale cereale用于小麦黑麦染色体片段检测的DNA衍生物。基因组。1990;33:635-40。
- 42.
samers DJ, Isaac P, Edwards K.一种普通小麦高密度微卫星共识图(小麦l .)。理论与应用。2004;109:1105-14。
- 43.
齐鹏飞,张永忠,刘超,陈强,郭志荣,王勇,徐炳军,蒋玉峰,郑涛,龚鑫,罗超,吴伟,孔磊,邓明,马军,兰晓军,蒋秋涛,魏彦明,王小杰,郑玉玲FgNahG阐明了水杨酸对小麦(小麦)抗枯萎病。毒素。2019;12。
- 44.
卡特,陈晓明,加兰-坎贝尔K,基德威尔KK。成虫高温抗条锈病QTL鉴定(柄锈菌striiformisf . sp。tritici)在春小麦(小麦L.)品种“露易丝”。理论与应用,2009;119:1119-28。
- 45.
李元达,张建伟,刘海军,谭宝文,朱伟,徐丽丽,王勇,曾军,樊晓,沙琳,张海清,马军,陈根,周永华,康海燕。小麦四倍体性状Thinopyrum elongatum对1E(1D)代换系K17-841-1进行细胞学和表型分析,并建立分子标记。生物医学工程学报,2019;20:963。
致谢
我们感谢加拿大渥太华东部谷物和油籽研究中心的George Fedak博士提供本研究中使用的P1142-1-2材料。同时,我们也要感谢中国甘肃省农业科学院植物保护研究所的贾启志教授,感谢他为我们提供了这种真菌的孢子太平洋标准时间比赛。
资金
国家自然科学基金项目(No. 31771781, 31971883)、国家重点研发计划项目(No. 2016YFD0102000和2017YFD0100905)、四川省科技局资助。资助机构没有参与研究的设计、数据收集、数据解释或撰写手稿。
作者信息
从属关系
贡献
HYK和YHZ构思和设计了这项研究。BRG, WZ, SYL, YQW, LH, PFQ进行实验。XF、LNS和HQZ对数据进行分析。LLX, YW和JZ对结果进行了解释,并参与了稿件的编写。BRG、GYC和HYK起草了该工作并对其进行了实质性修改。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
龚斌,朱伟,李,邵。et al。小麦的分子细胞遗传学特征大被抗枯萎病和条锈病的染色体易位系。BMC Plant Biol19日,590(2019)。https://doi.org/10.1186/s12870-019-2208-x
收到了:
接受:
发表:
关键字
- 染色体易位线
- 大被
- 赤霉病(FHB)
- 条锈病