- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
一氧化氮诱发gydF4y2BaAtAO3gydF4y2Ba差异调节植物防御和耐旱性gydF4y2Ba拟南芥gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba602gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植物暴露于不同的环境伤害会引起细胞氧化还原色调的显著变化,部分原因是促进活性氮的产生。一氧化氮(NO)是一种小的气态双原子分子,以其在压力下的信号传递作用而闻名。在本研究中,我们重点研究了ABA代谢相关基因,这些基因在NO供体反应中表现出差异表达gydF4y2Ba年代gydF4y2Ba亚硝基的- - - - - -gydF4y2BalgydF4y2Ba-半胱氨酸(CySNO)的转录组分析。gydF4y2Ba
结果gydF4y2Ba
对cysno诱导的aba相关基因进行鉴定并进一步鉴定。生物过程的基因本体术语表明,大多数基因与蛋白质磷酸化有关。启动子分析表明有几种gydF4y2Ba独联体gydF4y2Ba-调控元件在生物和/或非生物胁迫条件下被激活。ABA生物合成基因gydF4y2BaAtAO3gydF4y2Ba选择使用功能基因组学进行验证。功能缺失突变体gydF4y2Baatao3gydF4y2Ba发现对氧化应激和亚硝化应激有不同的调节作用。进一步调查,以确定的作用gydF4y2BaAtAO3gydF4y2Ba在植物防御中提示植物基底防御负调控gydF4y2BaRgydF4y2Ba-gene-mediated阻力。的gydF4y2Baatao3gydF4y2Ba植物对毒力表现出抗性gydF4y2Ba两gydF4y2Bapv。gydF4y2Ba番茄gydF4y2Ba应变DC3000 (gydF4y2Ba太平洋标准时间gydF4y2BaDC3000),并逐渐增加gydF4y2BaPR1gydF4y2Ba基因的表达。同样的,gydF4y2Baatao3gydF4y2Ba胁迫下植物的超敏反应(HR)增加gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba).的gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba突变体表现为易感表型gydF4y2BaPR1gydF4y2Ba记录积累。耐旱试验表明gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba缺乏aba的突变体表现出早期枯萎,随后植株死亡。气孔结构研究表明gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba干旱胁迫7 d后气孔仍不能关闭。此外,与野生型(WT)植物相比,它们的ABA含量降低,电解质泄漏增加。定量聚合酶链反应分析表明,ABA生物合成基因表达下调,而大部分干旱相关基因表达上调gydF4y2Baatao3gydF4y2Ba小于WT。gydF4y2Ba
结论gydF4y2Ba
AtAO3gydF4y2Ba负调控病原体诱导的水杨酸途径,尽管它是耐旱性所必需的,尽管ABA的产生并不完全依赖于此gydF4y2BaAtAO3gydF4y2Ba与干旱相关的基因gydF4y2BaDREB2gydF4y2Ba而且gydF4y2BaABI2gydF4y2Ba与ABA含量无关,对干旱有响应。gydF4y2Ba
背景gydF4y2Ba
一氧化氮(NO)是一种小的气态分子,被认为是动植物体内最好的信号分子,被评为“年度分子”gydF4y2Ba科学gydF4y2Ba1992年[gydF4y2Ba1gydF4y2Ba].许多研究都集中在探索它在不同生命过程中的作用。虽然人们对动物细胞中NO的来源和产生已经有了很好的了解,但在高等植物中,特别是通过氧化途径产生NO还不确定[gydF4y2Ba2gydF4y2Ba],科学家们一直试图在高等植物中找到一种合适的NO合成酶。NO正在成为多种植物过程的关键调节因子,如生长、发育、气孔调节、衰老、防御和环境相互作用[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
与经典的信号转导不同,NO及其称为活性氮的化学衍生物(RNS)通过与不同蛋白质中的特定靶标发生化学反应而起作用[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba年代gydF4y2Ba-亚硝半胱氨酸(CySNO)和gydF4y2Ba年代gydF4y2Ba-亚硝基谷胱甘肽(GSNO)被认为是两个关键的NO供体,因为它们在水溶液中自发分解释放NO [gydF4y2Ba5gydF4y2Ba].CySNO具有通过特异性渗透植物细胞的能力gydF4y2BalgydF4y2Ba型氨基酸转运蛋白[gydF4y2Ba6gydF4y2Ba,在那里它可以经受gydF4y2Ba年代gydF4y2Ba-亚硝化,一种翻译后修饰,其中NO部分共价附着在溶剂暴露的半胱氨酸残基上形成gydF4y2Ba年代gydF4y2Ba-nitrosothiols (sno)。当NO过量时,SNO可使NO附着在谷胱甘肽上形成相对稳定的NO流动库GSNO [gydF4y2Ba7gydF4y2Ba].因此,gydF4y2Ba年代gydF4y2Ba-亚硝化作用被认为是转移NO生物活性的最相关机制,从而改变蛋白质功能[gydF4y2Ba8gydF4y2Ba].许多蛋白质已经被报道过gydF4y2Ba年代gydF4y2Ba-亚硝基化,尽管该名单正在不断增加[gydF4y2Ba9gydF4y2Ba].其中包括拟南芥水杨酸(SA)结合蛋白3 [gydF4y2Ba10gydF4y2Ba],发病相关基因-1的非表达子[gydF4y2Ba11gydF4y2Ba],生长素受体转运抑制剂response-1 [gydF4y2Ba12gydF4y2Ba].类似地,许多蛋白质通过gydF4y2Ba年代gydF4y2Ba-亚硝化反应对非生物应激,如AHb1参与缺氧;Rubisco调节低温胁迫;GAPDH对盐胁迫的响应;高光条件下APX、GR和GAPDH的响应;CAT和GOX对镉胁迫的响应(综述于[gydF4y2Ba13gydF4y2Ba])。细胞SNO水平由一种关键酶GSNO还原酶(GSNOR)调节,突变会导致生长和植物防御受损[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
干旱胁迫是影响世界范围内植物生长和生产力的主要环境因子。缺水所造成的损害甚至比其他环境因素所造成的损害加起来还要大[gydF4y2Ba15gydF4y2Ba].干旱条件会导致明显的表型变化,如梢和根的生长减少,茎的直径减小,破坏了植物与水的关系,降低了水分利用效率[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].还研究了NO在干旱胁迫调节中的作用[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].据报道,NO通过增强几种植物的抗氧化系统、脯氨酸和渗透液代谢,在抗旱性中发挥关键作用[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].NO还可能通过各种信号级联(包括丝裂原活化蛋白激酶(MAPK)等),通过aba介导的气孔反应限制水分损失,间接帮助抗旱性的提高。[gydF4y2Ba22gydF4y2Ba].NO还在分子水平上通过DNA甲基化等途径在抗旱性中发挥多维度作用。同样,NO也调控了若干干旱胁迫响应基因的表达,包括转录因子(TFs)和抗氧化相关基因[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].最近在一项基于RNA-seq的转录组学研究中,[gydF4y2Ba25gydF4y2Ba我们报道了几个干旱相关基因在1 mM CySNO (NO供体)的反应中表现出差异表达。同样,干旱胁迫诱导的几种tf也对NO有反应。例如,NAC19 TF显示出超过150倍的CySNO变化[gydF4y2Ba26gydF4y2Ba];据报道,这种TF是由干旱、高盐度和ABA诱导的[gydF4y2Ba27gydF4y2Ba].同样,MYB和WRKY TF家族的几个成员也被报道在NO反应中受到不同的调控[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
脱落酸(ABA),通常被称为“应激激素”,是参与调节植物水分状态和气孔运动的关键激素。ABA的生物合成涉及两个主要基因玉米黄质环氧氧化酶[gydF4y2Ba28gydF4y2Ba]和9-顺式类环氧素双加氧酶[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].然而,包括脱落酸醛被基因家族的醛氧化酶(AO)氧化在内的最后一步在ABA合成中起着关键作用。ao至少由四个基因组成(gydF4y2BaAAO1, AAO2, AAO3, AAO4gydF4y2Ba) [gydF4y2Ba31gydF4y2Ba];在这些基因中,gydF4y2BaAAO3gydF4y2Ba编码AOδ,对脱落醛有很高的特异性[gydF4y2Ba32gydF4y2Ba].还研究了NO与ABA的相互作用;在耐旱条件下,NO诱导ABA的产生,进而调控气孔响应[gydF4y2Ba33gydF4y2Ba].这已被进一步证实使用反向遗传学方法,其中no缺乏双突变体gydF4y2Bania1nia2gydF4y2Ba[硝酸还原酶(NR) KO突变]不能响应ABA关闭气孔,提示ABA诱导气孔关闭需要NO [gydF4y2Ba34gydF4y2Ba].另一种涉及NO介导的气孔关闭的机制表明,干旱诱导的ABA生成激活NADPH氧化酶、RBOHD和RBOHF(呼吸突发氧化酶同源物D和F),从而产生超氧化物破裂,导致NR的NO生成激活,进而激活丝裂原激活蛋白激酶(MAPK)信号级联,从而驱动气孔关闭[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
此前,我们通过进行RNA-seq-based转录组分析,报道了数千个对NO供体CySNO有反应的基因[gydF4y2Ba25gydF4y2Ba].在本研究中,我们重点研究了cysno诱导的ABA生物合成和信号相关基因。通过在体和硅相结合的方法,我们证实了no诱导的ABA基因的调节作用gydF4y2BaAtAO3gydF4y2Ba)用于植物防御和干旱调节。gydF4y2Ba
结果gydF4y2Ba
aba相关基因的鉴定与鉴定gydF4y2Ba
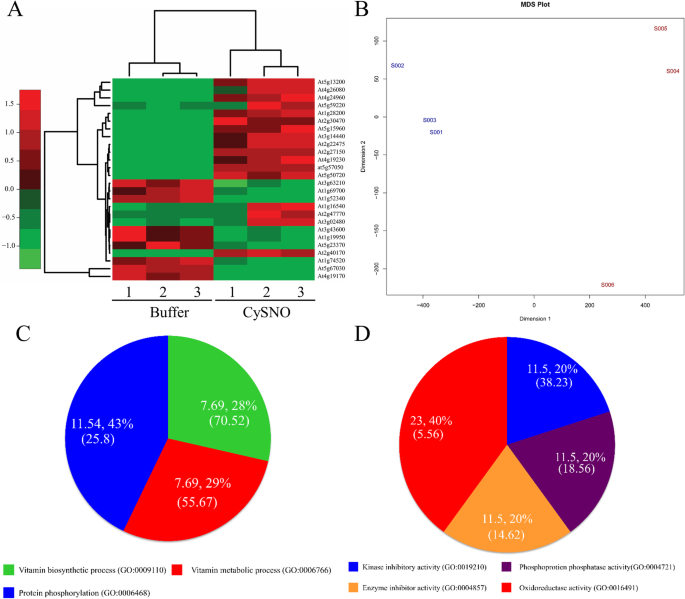
在基于rna序列的转录组中,共发现26个参与ABA代谢的deg(17个上调,9个下调)对CySNO有反应。所有基因的表达量都有至少2倍的变化。详细的列表随着折叠变化和gydF4y2BapgydF4y2Ba-value在附加文件中提供gydF4y2Ba1gydF4y2Ba.在上调的deg中,有最高的折叠变化记录gydF4y2BaKin1gydF4y2Ba(At5g15960),作为一种抗冻蛋白;根据TAIR的描述,低温、ABA和脱水胁迫诱导了该基因的转录积累。同样,在下调的DEGs中,最高的折叠变化被记录下来gydF4y2BaAtHVA22HgydF4y2Ba(At1g19950),是aba应答基因。生成了热图来显示表达模式,以及树状图来显示cysno诱导的ABA代谢相关基因的层次聚类(图2)。gydF4y2Ba1gydF4y2Baa). MDS图显示数据中的离散度,显示对照样品的离散度较低,而cysno处理样品的离散度略高(图2)。gydF4y2Ba1gydF4y2Bab).我们进一步分析了所有cysno诱导的GO生物过程和分子功能方面的aba相关基因,鉴定其折叠富集,了解其假定功能。我们发现,在生物过程的GO术语中,相对于所研究的基因总数,约11.54%的基因对蛋白质磷酸化进行了注释,富集量为25.8倍(图5)。gydF4y2Ba1gydF4y2Bac).生物过程GO项中FE的丰度最高(70.52 FE)的是维生素生物合成过程。同样,在分子过程的GO术语中,与氧化还原酶活性相关的基因数量最多(23.40%),而激酶抑制活性的基因数量最多(38.23%)(图2)。gydF4y2Ba1gydF4y2Bad)。gydF4y2Ba
启动子分析的存在gydF4y2Ba独联体gydF4y2Ba监管元素gydF4y2Ba
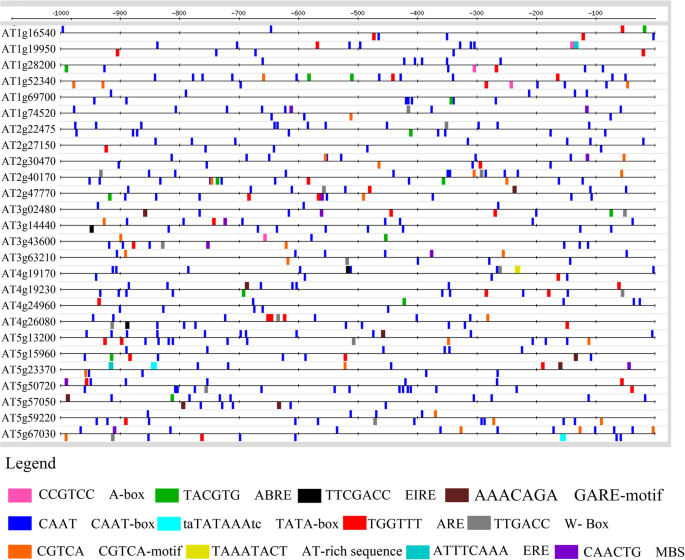
ABA主要与非生物胁迫条件有关;然而,生物和非生物胁迫之间存在着显著的串扰。曹等人[gydF4y2Ba35gydF4y2Ba]报道了ABA不仅在介导非生物胁迫反应中起重要作用,而且在植物防御反应中起关键作用。因此,我们打算分析cysno诱导的aba相关基因的启动子区域。许多gydF4y2Ba独联体gydF4y2Ba-调控元件存在于不同基因的启动子中。为了方便起见,我们选择了在所有基因中都存在的12个元素,它们与生物和非生物胁迫都有关;我们用RSAT对它们进行了测绘。其中包括在100%的序列中发现的CAAT-box;ABRE,在50%的序列中发现;和GARE,在23%的序列中发现。WRKY转录因子结合位点(W-box)在53.84%的序列中被发现,其频率位居第二gydF4y2Ba独联体gydF4y2Ba-在CAAT-box后面找到元素。另一个基序CGTCA在50%的序列中被发现,而MBS在26.9%的序列中被发现(图2)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
cysno诱导ABA代谢相关基因的启动子分析。转录起始位点上游1 Kb的no诱导aba相关基因启动子序列从TAIR (gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba)并用CARE进行分析识别gydF4y2Ba独联体gydF4y2Ba-在各自启动子中存在的调控元件。选择gydF4y2Ba独联体gydF4y2Ba-然后使用RSAT (gydF4y2Bahttp://rsat.eead.csic.es/plants/index.phpgydF4y2Ba).gydF4y2Ba
在氧化和亚硝化胁迫条件下,AtAO3对根和茎长有差异调节作用gydF4y2Ba
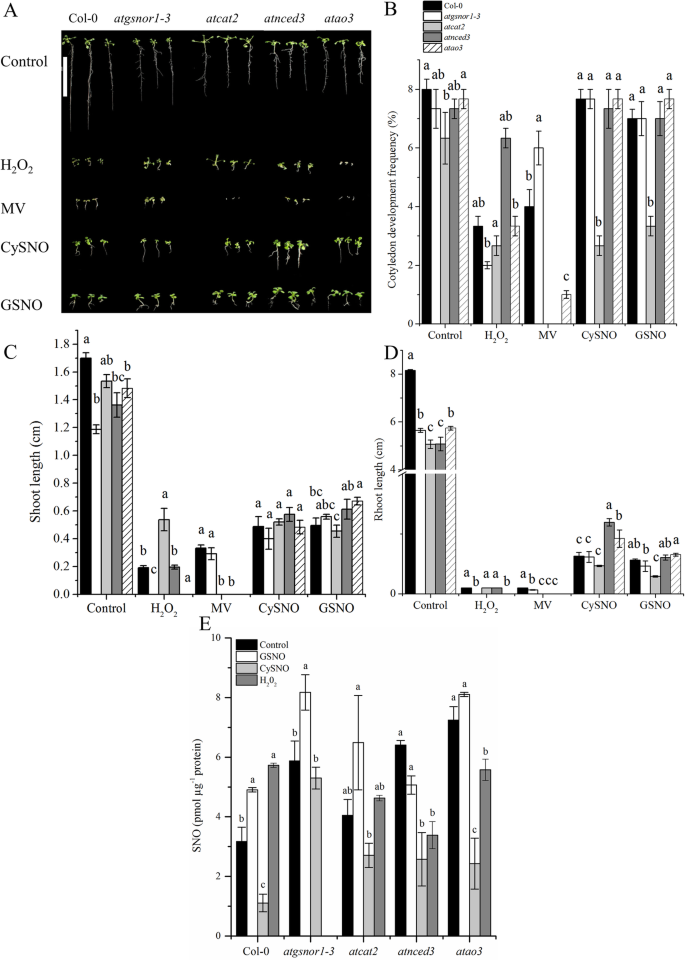
在本研究中,我们主要研究乙醛氧化酶(gydF4y2BaAOgydF4y2Ba)在ABA合成中起关键作用。在gydF4y2BaAOgydF4y2Ba家族的基因,gydF4y2BaAtAO2gydF4y2Ba而且gydF4y2BaAtAO3gydF4y2Ba对NO有不同的反应。如引言部分所述,AtAO3编码AOδ,对脱落醛具有很高的特异性[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].因此,我们使用gydF4y2BaAtAO3gydF4y2Ba敲除(KO)突变体进行下游分析。的可能作用gydF4y2BaAtAO3gydF4y2Ba通过分析WT和功能丧失突变体的CDF、茎长和根长等生长参数,确定其对植物生长发育的影响gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3。gydF4y2Ba的gydF4y2Baatgsnor1-3gydF4y2Ba缺乏AtGSNOR1和gydF4y2Baatcat2gydF4y2Ba由于AtCATALASE2在植物生长和防御中已确立的作用,它们被用作对照植物[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].不同基因型在控制和不同胁迫条件下的表型可以在(图;gydF4y2Ba3.gydF4y2Baa).我们的结果表明,的CDF没有显著差异gydF4y2Baatao3gydF4y2Ba与野生型(WT)相比,在控制和亚硝化胁迫条件下(图。gydF4y2Ba3.gydF4y2Bab).相反,在甲基暴力介导的氧化应激下,gydF4y2Baatao3gydF4y2Ba显示CDF显著降低(图;gydF4y2Ba3.gydF4y2Bab)。gydF4y2Baatgsnor1-3gydF4y2Ba与WT相比,突变体CDF增加(图2)。gydF4y2Ba3.gydF4y2Bab).同样,在亚硝化胁迫下,gydF4y2Baatao3gydF4y2Ba显示出供体依赖反应。在cysno诱导的亚硝化胁迫下,两者之间没有显著差异gydF4y2Baatao3gydF4y2Ba和WT;相比之下,gsno介导的亚硝化胁迫导致茎长显著延长gydF4y2Baatao3gydF4y2Ba与WT相比(图;gydF4y2Ba3.gydF4y2Bac).的根长度gydF4y2Baatao3gydF4y2Ba在控制和氧化应激条件下减少,而在亚硝化应激下增加(图2)。gydF4y2Ba3.gydF4y2Bad)。因此,gydF4y2BaAtAO3gydF4y2Ba在控制和氧化应激条件下,对根长有正调控作用,而在亚硝化应激条件下,对根长有负调控作用。gydF4y2Ba
AtAO3gydF4y2Ba在氧化和亚硝化胁迫条件下,茎长和根长有差异调节。gydF4y2Ba一个gydF4y2Ba所示基因型的表型。gydF4y2BabgydF4y2Ba控制1周后子叶发育频率,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba以及mv介导的氧化应激和CysNO-和gsno介导的亚硝化应激条件。gydF4y2BacgydF4y2Ba苗长和gydF4y2BadgydF4y2Ba在控制、氧化和亚硝化胁迫条件下指示基因型的根长。所有数据点为3个重复的平均值,每个重复至少包含5个植物。为了更清晰,A的背景被改变了。D中的y轴被中断,以便更好地表示较小的值。A中的白色比例尺等于4厘米。显著差异用不同字母表示,表示平均值之间的差异gydF4y2BapgydF4y2Ba≤0.05 (dmrt)。实验重复了两次,得到了相似的结果。gydF4y2Ba
我们进一步试图确定总的细胞SNO水平,这被认为是包括gydF4y2Ba年代gydF4y2Ba-亚硝化蛋白和低分子量SNOs,包括GSNO [gydF4y2Ba38gydF4y2Ba].虽然还没有开发出测量GSNO水平的可靠方法,但已经确定的是,在生物系统中,GSNO水平与总SNO水平是一致的[gydF4y2Ba39gydF4y2Ba].为方便起见,我们选择了仅暴露于CySNO、GSNO和H的植物gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba分别为亚硝化和氧化应激的代表。我们的结果表明,在控制条件下gydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baatao3gydF4y2Ba显着增加(gydF4y2BapgydF4y2Ba与WT相比,细胞SNO水平≤0.05)gydF4y2Baatcat2gydF4y2Ba显示出与WT相似的SNO水平(图;gydF4y2Ba3.gydF4y2Bae). gsno介导的亚硝化应激后,细胞SNO水平在gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatao3gydF4y2Ba显著高于(gydF4y2BapgydF4y2Ba≤0.05,gydF4y2BapgydF4y2Ba分别≤0.01)。gydF4y2Ba3.gydF4y2Bae).在突变系中,gydF4y2Baatcat2gydF4y2Ba而且gydF4y2Baatnced3,gydF4y2BaSNO水平变化不显著。同样,CySNO处理的植株在野生型中SNO含量降低,而在野生型中SNO含量增加gydF4y2Baatgsnor1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba.细胞SNO水平gydF4y2Baatcat2gydF4y2Ba,gydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baatao3gydF4y2Ba在CySNO介导的亚硝化胁迫条件下,两者基本相似。gydF4y2Ba3.gydF4y2Bae).相反,在H之后gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba与WT相比,几乎所有基因型的细胞SNO水平都降低了(图2)。gydF4y2Ba3.gydF4y2Bae)。gydF4y2Ba
AtAO3负向调控植物基底防御gydF4y2Ba
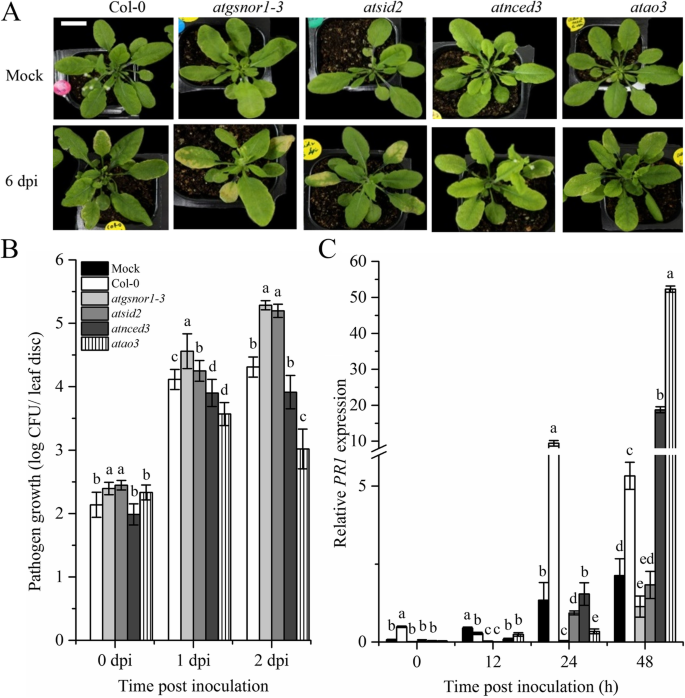
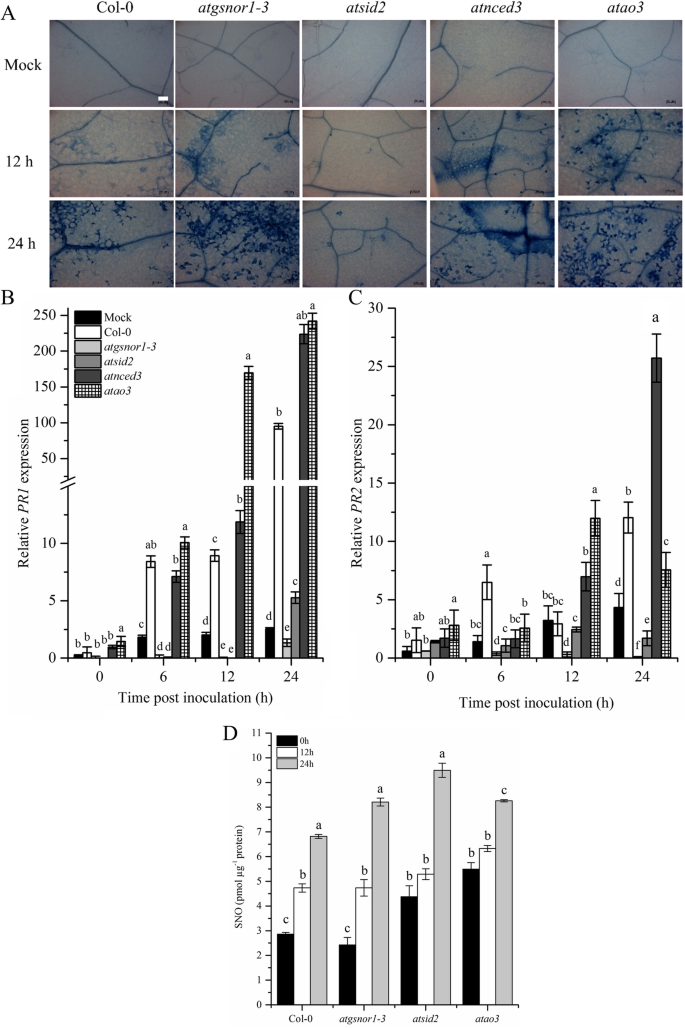
是否gydF4y2BaAtAO3gydF4y2Ba是通过接种WT确定的,gydF4y2BaAtao3, atnced3, atgsnor1-3gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba具有毒性的植物gydF4y2Ba太平洋标准时间gydF4y2Ba以评估所有基因型对毒性病原体的表型反应。我们发现,接种6天后(dpi),gydF4y2Baatao3gydF4y2Ba显示耐药表型,而gydF4y2Baatgsnor1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba显示敏感表型(图;gydF4y2Ba4gydF4y2Baa).我们进一步研究了病原体在WT中的生长情况gydF4y2Baatao3gydF4y2Ba以及相关的对照突变体。我们的结果表明,在0 dpi时,所研究的所有基因型的细菌生长均无显著差异;然而,在1和2 dpi时,gydF4y2Baatao3gydF4y2Ba与WT相比,病原菌生长显著降低(图;gydF4y2Ba4gydF4y2Bab)。此外,gydF4y2Baatgsnor1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba在1和2 dpi时,病原菌生长增加。但两组间病原菌生长无显著差异gydF4y2Baatnced3gydF4y2Ba和WT(图;gydF4y2Ba4gydF4y2Bab).植物在生物营养性病原体攻击时的反应主要由植物关键激素SA介导[gydF4y2Ba40gydF4y2Ba].因此,我们旨在确定的作用gydF4y2BaAtAO3gydF4y2Ba通过决定转录本积累的SA通路信号gydF4y2BaPR1gydF4y2Ba而且gydF4y2BaPR2gydF4y2Ba,与SA通路相关的关键标记基因。在早期,gydF4y2Baatao3gydF4y2Ba显示转录本积累减少gydF4y2BaPR1gydF4y2Ba;然而,在接种48 h时,转录本积累显著增加gydF4y2BaPR1gydF4y2Ba与WT的基因比较(图;gydF4y2Ba4gydF4y2Ba此外,c)。gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba在所有时间点上,与WT相比,转录本积累减少。所有基因型均显示减少gydF4y2BaPR2gydF4y2Ba与WT中的表达式相比(附加文件gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
AtAO3gydF4y2Ba负向调节基础防御。gydF4y2Ba一个gydF4y2Ba6 dpi出现症状。gydF4y2BabgydF4y2Ba病原体从渗透的叶子生长。gydF4y2BacgydF4y2Ba相对gydF4y2BaPR1gydF4y2Ba表达未遂后剧毒gydF4y2Ba太平洋标准时间gydF4y2BaDC3000在5 × 10gydF4y2Ba5gydF4y2Ba菌落形成单位(CFU) mLgydF4y2Ba−1gydF4y2Ba.面板中的数据点(gydF4y2BabgydF4y2Ba)为五个重复的平均值,而(gydF4y2BacgydF4y2Ba)为三个重复的平均值。专题小组背景(gydF4y2Ba一个gydF4y2Ba)被修改为更清晰,白色条代表比例尺等于1厘米。面板y轴(gydF4y2BacgydF4y2Ba)被打断,以澄清小数值。实验至少重复了三次。误差柱表示±SE。不同字母表示均值之间存在显著差异gydF4y2BapgydF4y2Ba≤0.05 (dmrt)。gydF4y2Ba
AtAO3负向调控r基因介导的抗性gydF4y2Ba
植物利用gydF4y2BaRgydF4y2Ba由核苷酸结合位点-富亮氨酸重复序列(NBS-LRRs)编码的基因,识别病原体释放的效应分子,从而诱导gydF4y2BaRgydF4y2Ba-基因介导抗性[gydF4y2Ba41gydF4y2Ba].这种耐药性的最终命运是HR,在感染部位限制病原体在感染组织内。我们接种WT,gydF4y2Baatao3gydF4y2Ba突变体,以及相关的对照gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba),台盼蓝染色观察HR。我们的结果表明增加的人力资源gydF4y2Baatao3gydF4y2Ba,然后是ingydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baatgsnor1-3gydF4y2Ba,而gydF4y2Baatsid2gydF4y2Ba接种12 h后几乎无HR(图;gydF4y2Ba5gydF4y2Baa).然而,观察到心率增加gydF4y2Baatgsnor1-3gydF4y2Ba,然后是gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba接种24 h后(图;gydF4y2Ba5gydF4y2Baa).我们进一步研究了接种病原体后感染叶片转录本的积累,发现gydF4y2Baatao3gydF4y2Ba显示增加gydF4y2BaPR1gydF4y2Ba在接种后6、12和24 h表达(图;gydF4y2Ba5gydF4y2Bab)。gydF4y2BaPR1gydF4y2Ba转录本积累减少gydF4y2Baatsid2gydF4y2Ba而且gydF4y2Baatgsnor1gydF4y2Ba3(图。gydF4y2Ba5gydF4y2Bab)。gydF4y2Baatao3gydF4y2Ba,gydF4y2BaPR2gydF4y2Ba转录本积累仅在接种后12小时增加(图;gydF4y2Ba5gydF4y2Bac)。gydF4y2Ba
AtAO3gydF4y2Ba消极的调节gydF4y2Bar基因,gydF4y2Ba介导的耐药性。gydF4y2Ba一个gydF4y2Baataao3gydF4y2Ba显示诱发HRgydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)接种。gydF4y2BabgydF4y2Ba而且gydF4y2BacgydF4y2Ba相对转录本积累gydF4y2BaPR1gydF4y2Ba而且gydF4y2BaPR2gydF4y2Ba基因用实时定量PCR (qPCR)及(gydF4y2BadgydF4y2Ba)后的SNO测量gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2Baavr的gydF4y2BaB)接种。面板中WT模拟植物中的白色小条(gydF4y2Ba一个gydF4y2Ba)表示比例尺,等于100 μM。面板y轴(gydF4y2BabgydF4y2Ba)被打断,以澄清小数值。这个表达式被规范化了gydF4y2Ba肌动蛋白gydF4y2Ba.误差柱表示±SE。不同字母表示均值之间存在显著差异gydF4y2BapgydF4y2Ba≤0.05 (dmrt)。gydF4y2Ba
我们还研究了细胞SNO水平gydF4y2Baatao3gydF4y2Ba突变系用作比较对照,如gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba后gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)接种。我们的结果表明,细胞SNO水平gydF4y2Baatao3gydF4y2Ba与WT相比,随时间的推移显著升高(图;gydF4y2Ba5gydF4y2Bad)。同样的,gydF4y2Baatgsnor1-3gydF4y2Ba与WT接种12 h时相同,0 h时略有降低,24 h时显著升高。如果gydF4y2Baatsid2gydF4y2Ba细胞SNO水平在接种后0和24 h均有升高,但在接种后12 h无显著差异(图2)。gydF4y2Ba5gydF4y2Bad)。gydF4y2Ba
Atao3对全身获得性耐药表现出不同的反应gydF4y2Ba
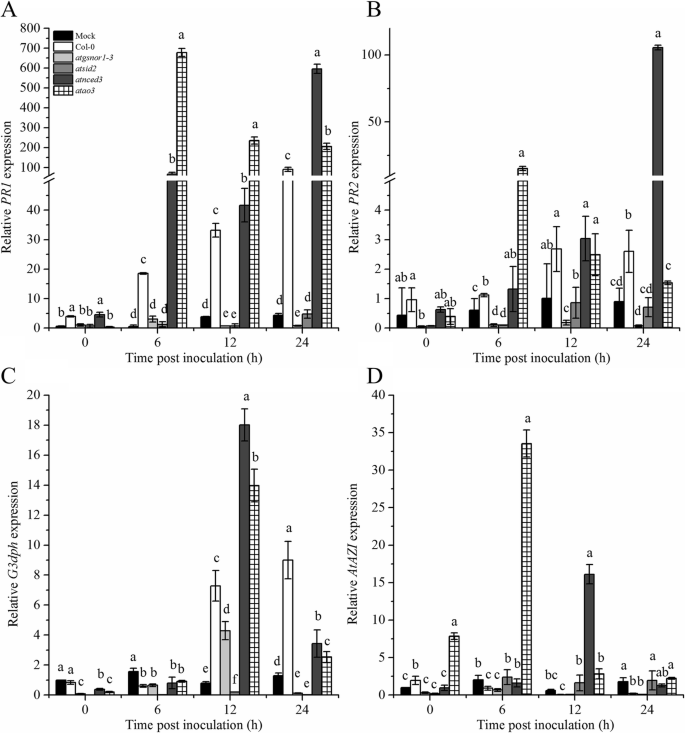
系统获得性抗性(Systemic acquired resistance, SAR)是一种重要的防御系统,是由植物感染部位向其他部位发出的信号所诱导的。据报道,NO、ROS参与了SAR的激活[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].因此,我们研究了AtAO3是否在SAR中起作用,并接种植物gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)在5 × 10gydF4y2Ba6gydF4y2BaCFU。从接种病原体后的系统叶片中采集叶片样本,对关键SAR标记基因如gydF4y2BaPR1gydF4y2Ba,甘油醛3-磷酸脱氢酶(gydF4y2BaG3PDHgydF4y2Ba)和杜鹃酸诱导剂(gydF4y2BaAZIgydF4y2Ba)随着时间的推移进行分析。的gydF4y2BaPR1gydF4y2Ba6 h和12 h时,叶片基因转录物积累显著增加gydF4y2Baatao3gydF4y2Ba,然后是ingydF4y2Baatnced3gydF4y2Ba,与WT相比(图;gydF4y2Ba6gydF4y2Baa).相比之下,模拟处理的植物表现出减少gydF4y2BaPR1gydF4y2Ba所研究的所有基因型的转录物积累(图;gydF4y2Ba6gydF4y2Baa)。同样的,gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba几乎没有显示gydF4y2BaPR1gydF4y2Ba表达式(无花果。gydF4y2Ba6gydF4y2Ba一个)。gydF4y2BaPR2gydF4y2Ba6 h时表达量高gydF4y2Baatao3gydF4y2Ba叶间差异无统计学意义(图2)。gydF4y2Ba6gydF4y2Bab)。此外,gydF4y2BaG3PDHgydF4y2Ba接种后12 h转录本积累增加gydF4y2Baatao3gydF4y2Ba系统性叶(图;gydF4y2Ba6gydF4y2Bac).易感突变系gydF4y2Baatgsnor1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba与WT相比,表达降低,而gydF4y2Baatnced3gydF4y2Ba接种后12 h转录本积累量最大(图;gydF4y2Ba6gydF4y2Bac).同样,另一种SAR标记基因gydF4y2BaAtAZIgydF4y2Ba随时间的变化而不同。在早期时间点,即接种后0、6和12 h,gydF4y2Baatao3gydF4y2Ba显示增加gydF4y2BaAZIgydF4y2Ba而在24 h时,其表达量降低(图2)。gydF4y2Ba6gydF4y2Bad).类似于gydF4y2BaG3DPHgydF4y2Ba,gydF4y2BaAZIgydF4y2Ba显示转录本积累增加gydF4y2Baatnced3gydF4y2Ba12 h(图;gydF4y2Ba6gydF4y2Bad)。gydF4y2Baatgsnor1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba而且gydF4y2Baatsid2gydF4y2Ba显示下降gydF4y2BaAZIgydF4y2Ba随时间变化的表达式(图;gydF4y2Ba6gydF4y2Bad)。gydF4y2Ba
AtAO3gydF4y2Ba负调控全身获得性抵抗(SAR)。相对转录本积累(gydF4y2Ba一个gydF4y2Ba)gydF4y2BaPR1gydF4y2Ba基因(gydF4y2BabgydF4y2Ba)gydF4y2BaPR2gydF4y2Ba基因(gydF4y2BacgydF4y2Ba)gydF4y2BaG3DPHgydF4y2Ba,及(gydF4y2BadgydF4y2Ba)gydF4y2BaAZIgydF4y2Ba利用实时荧光定量PCR (qPCR)技术对叶片进行基因分析gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2Baavr的gydF4y2BaB)接种。面板的y轴(gydF4y2Ba一个gydF4y2Ba)及(gydF4y2BabgydF4y2Ba)被打断,以澄清小数值。这个表达式被规范化了gydF4y2Ba肌动蛋白gydF4y2Ba.误差柱表示±SE (gydF4y2BangydF4y2Ba= 3)。显著差异由不同字母表示(gydF4y2BapgydF4y2Ba≤0.05)按DMRT计算。gydF4y2Ba
AtAO3可能通过aba介导的气孔调节来实现抗旱性gydF4y2Ba
AtAO3参与了ABA生物合成的最后一步。aba诱导的NO生成在干旱胁迫下调节气孔运动[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].因此,我们打算研究no诱导的可能作用gydF4y2BaAtAO3gydF4y2Ba在干旱胁迫调节方面。大约4周大的WT,gydF4y2Baatnced3gydF4y2Ba,gydF4y2Baatao3gydF4y2Ba突变体在干旱胁迫下保持水分7至10天。这两个gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba与WT相比,表现出严重的干旱症状(图;gydF4y2Ba7gydF4y2Baa).轻度干旱症状,如叶片枯萎早于(胁迫3天)gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba在WT中突变植株比在WT中突变植株多。gydF4y2Ba
AtAO3gydF4y2Ba是耐旱性所必需的。gydF4y2Ba一个gydF4y2Ba控制、干旱和恢复阶段下指示基因型的表型。gydF4y2BabgydF4y2Ba对照和干旱胁迫下各基因型的气孔结构。gydF4y2BacgydF4y2BaABA含量(来自新鲜样品)对干旱胁迫和控制条件的响应。gydF4y2BadgydF4y2Ba控制和干旱条件下的电解质泄漏(%)(gydF4y2BaegydF4y2Ba)复水24 h后的成活率。面板A中的白色条代表比例尺,长度为4cm;面板B中的白色条代表比例尺,长度为200 μM。误差条表示±SE。显著差异用星号表示(学生gydF4y2BatgydF4y2Ba以及)。*代表gydF4y2BapgydF4y2Ba< 0.05, **表示gydF4y2BapgydF4y2Ba< 0.01, ***表示gydF4y2BapgydF4y2Ba≤0.001。gydF4y2Ba
气孔调节在干旱胁迫下限制水分流失方面起着关键作用。我们假设,快速干旱的症状,如萎蔫可能是由于无力gydF4y2Baatao3gydF4y2Ba关闭气孔因此,我们对WT和的气孔结构进行了可视化gydF4y2Baatao3gydF4y2Ba控制系和抗旱植株。野生型植株气孔为闭合型,而两者气孔均为闭合型gydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baatao3gydF4y2Ba保持开放(图;gydF4y2Ba7gydF4y2Bab).利用ImageJ程序对气孔开度进行量化。结果表明,在干旱后7d (dpd),土壤水分含量显著降低gydF4y2Baatao3gydF4y2Ba突变体显示显著(gydF4y2BapgydF4y2Ba≤0.0001)与WT相比,打开气孔数更高(附加文件gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
同样,干旱诱导的ABA产生对气孔调节至关重要[gydF4y2Ba45gydF4y2Ba].gydF4y2BaAtAO3gydF4y2Ba参与ABA生物合成的最后一步;因此,从理论上讲,与WT相比,该基因功能的丧失应该产生更少的ABA。因此,我们确定了WT和敲除系的ABA水平gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba在控制和干旱胁迫下。我们的结果表明,在控制条件下,gydF4y2Baatnced3gydF4y2Ba与WT相比,ABA含量显著降低,但两者之间无显著差异gydF4y2Baatao3gydF4y2Ba相比之下,在7 dpd时,显著(gydF4y2BapgydF4y2Ba≤0.05)ABA含量显著降低gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba与WT相比(图;gydF4y2Ba7gydF4y2Bac).我们进一步研究了细胞膜稳定性或电解质泄漏,发现在0 dpd时,包括WT在内的所有基因型的电解质泄漏没有显著差异。然而,在7 dpd时,观察到的电解质泄漏显著增加gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba突变体(无花果。gydF4y2Ba7gydF4y2Bad).进一步测定不同基因型的回收率;我们重新浇水,24小时后观察。我们发现,生存率gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba均小于WT(图;gydF4y2Ba7gydF4y2Bae).这些结果表明,干旱条件下ABA的产生需要AtAO3。气孔打开gydF4y2Baatao3gydF4y2Ba干旱胁迫后的KO株系的闭合能力受到一定程度的影响,原因是干旱胁迫下ABA的产生较低gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba在干旱条件下。gydF4y2Ba
ABA生物合成和干旱信号基因的转录积累gydF4y2Ba
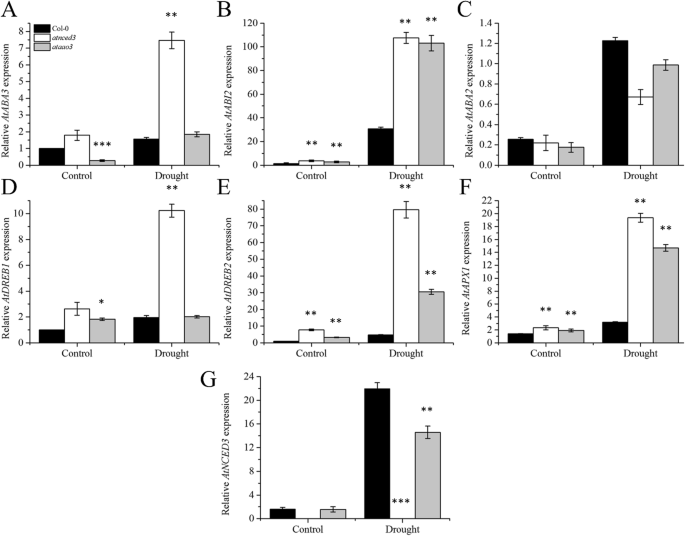
接下来,我们确定是否丧失了功能gydF4y2BaAtAO3gydF4y2Ba影响其他ABA生物合成基因。我们选择了关键的生物合成基因,如gydF4y2BaAtABA2gydF4y2Ba,gydF4y2BaAtABA3gydF4y2Ba,gydF4y2BaAtNCED3gydF4y2Ba并采用实时qPCR技术进行分析。我们的结果表明,除了gydF4y2BaABA3gydF4y2Ba,与WT相比无显著差异,其余ABA生物合成相关基因在gydF4y2Baatao3gydF4y2Ba与WT相比(图;gydF4y2Ba8gydF4y2BaA, C和G)。然而,参与ABA信号或干旱调控的基因,如gydF4y2BaAtABI2, AtDREB2gydF4y2Ba,gydF4y2BaAtAPX1gydF4y2Ba显示转录本积累增加gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba与WT相比(图;gydF4y2Ba8gydF4y2BaB, D, E和F)。gydF4y2BaAtDREB1gydF4y2Ba与WT相比,干旱胁迫后转录本积累无显著差异(图;gydF4y2Ba8gydF4y2Bad)。gydF4y2Ba
ABA生物合成及干旱信号相关基因在相关基因型中的表达。相对表达式gydF4y2Ba一个gydF4y2BaAtABA3gydF4y2Ba,gydF4y2BabgydF4y2BaAtABI2gydF4y2Ba,gydF4y2BacgydF4y2BaAtABA2gydF4y2Ba,gydF4y2BadgydF4y2BaAtDREB1gydF4y2Ba,gydF4y2BaegydF4y2BaAtDREB2gydF4y2Ba,gydF4y2BafgydF4y2BaAtAPX1gydF4y2Ba,gydF4y2BaggydF4y2BaAtNCED3。gydF4y2Ba实验至少重复了三次。误差柱表示±SE。显著性差异用星号表示(学生gydF4y2BatgydF4y2Ba以及)。*代表gydF4y2BapgydF4y2Ba< 0.05, **表示gydF4y2BapgydF4y2Ba< 0.01, ***表示gydF4y2BapgydF4y2Ba≤0.001。gydF4y2Ba
讨论gydF4y2Ba
ROS和RNS都是氧化还原活性分子,是在受到环境伤害后产生的。这些分子具有灭活细胞抗氧化系统的能力,从而改变细胞的氧化还原状态[gydF4y2Ba46gydF4y2Ba].后者的研究较少,在过去的几十年里,由于其在各种植物过程中的显著调节作用,引起了科学家的关注。RNS由NO(一种具有高扩散率的氧化还原活性小分子)产生,调节许多细胞过程,如气孔调节、种子萌发、抗病和植物对非生物胁迫的反应[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].NO通过调控某些基因的转录机制直接控制生理过程。利用微阵列研究了NO对基因表达的整体响应变化[gydF4y2Ba50gydF4y2Ba, RNA-seq [gydF4y2Ba25gydF4y2Ba,gydF4y2Ba51gydF4y2Ba],以及qRT-PCR [gydF4y2Ba52gydF4y2Ba].gydF4y2Ba
拟南芥AO基因家族由4个等位基因组成(gydF4y2BaAAO1-4gydF4y2Ba);它们被认为在ABA生物合成中至关重要,因为它们催化ABA生物合成的最后一步,包括脱落醛的氧化[gydF4y2Ba36gydF4y2Ba].在本研究中,我们重点研究了aba代谢相关基因gydF4y2Ba答:芥gydF4y2Ba通过基于rna序列的转录组分析,显示出对常见NO供体CySNO的差异反应。MDS图的生成是为了检测数据的分散性,我们发现在处理过的样本中有一个复制体显示了分散性,这可能是因为该复制体的基础基因表达水平较低(图2)。gydF4y2Ba1gydF4y2Bab).所有基因都参与了ABA的生物合成或信号传导(图。gydF4y2Ba9gydF4y2Ba).有趣的是,大多数ABA生物合成相关基因在NO供体反应中被下调,而大多数信号基因在NO供体反应中被上调。gydF4y2Ba9gydF4y2Ba).以往的研究也发现aba相关基因存在差异表达。有关臭氧处理的研究[gydF4y2Ba53gydF4y2Ba]报道了大约14个与ABA代谢有关的基因,这些基因也在我们的转录组中发现。这表明响应ROS和NO的基因之间存在显著的串扰,如[gydF4y2Ba54gydF4y2Ba].生物过程的GO术语揭示了大多数与蛋白质磷酸化相关的基因(11.5443%)。gydF4y2Ba1gydF4y2BaC),这是一种重要的翻译后修饰,调节蛋白质的功能以响应内部和外部刺激[gydF4y2Ba55gydF4y2Ba].这进一步支持了NO可能导致某些蛋白质翻译后发生重大变化的观点。NO被认为在生物系统中通过gydF4y2Ba年代gydF4y2Ba-亚硝化[gydF4y2Ba38gydF4y2Ba].类似地,在GO分子功能方面,大多数基因(23.40%)与氧化还原酶活性相关(图4)。gydF4y2Ba1gydF4y2Bad).氧化还原酶是调节NO生成和/或信号传导的关键酶[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].gydF4y2Ba
许多gydF4y2Ba独联体gydF4y2Ba-调控元件在cysno诱导的ABA代谢相关基因的启动子区域发现,这些启动子区域距离转录起始点的距离不同。其中包括参与调控干旱响应基因的ABRE (TACGTG) [gydF4y2Ba57gydF4y2Ba], EIRE (TTCGACC)参与最大诱导因子介导的基因激活[gydF4y2Ba58gydF4y2Ba]和ERE (ATTTCAAA,乙烯响应元件,顾名思义,调节乙烯介导的反应)[gydF4y2Ba59gydF4y2Ba].一些重要的干旱响应基因包括参与干旱胁迫调控的MBS (CAACTG myb结合位点)[gydF4y2Ba60gydF4y2Ba], WRKY转录因子结合位点W-box (TTGACC) [gydF4y2Ba61gydF4y2Ba(图。gydF4y2Ba2gydF4y2Ba),提示cysno诱导的aba相关基因可能参与生物和非生物胁迫相关基因的机制控制。生物信息学方法揭示了no响应基因在其启动子中含有大量的转录结合位点[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
的gydF4y2Baatao3gydF4y2Ba突变体在茎和根的生长方面对氧化和亚硝化胁迫表现出不同的响应。gydF4y2Ba3.gydF4y2Baa, c, d).氧化环境下茎根生长的减少主要是由于ROS的过度积累。ROS和RNS是在环境压力下产生的[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba62gydF4y2Ba].Vanderauwera等人的一项研究[gydF4y2Ba63gydF4y2Ba]表明植物对氧化应激的高敏感性可能是由于除了其他类型的ROS外,还含有高水平的过氧化物。增加笋和根的生长gydF4y2Baatao3gydF4y2Ba这可能是由于NO在种子萌发和幼苗生长中的积极作用,Kopyra和Gwozdz [gydF4y2Ba64gydF4y2Ba].同样,NO也被认为能打破种子休眠,促进植物生长,效果比GA更好gydF4y2Ba3.gydF4y2Ba[gydF4y2Ba65gydF4y2Ba].类似地,通过使用各种NO供体,Giba等人[gydF4y2Ba66gydF4y2Ba]揭示了NO在光敏色素控制后树萌发过程中的作用(gydF4y2Ba泡桐tomentosagydF4y2Ba).中SNO水平的增加进一步支持了这一点gydF4y2Baatao3gydF4y2Ba在对照组和gsno介导的亚硝化应激条件下,而在氧化应激条件下降低(图2)。gydF4y2Ba3.gydF4y2Bae).相反,与GSNO处理的植株相比,CySNO处理的植株在所有基因型中都表现出较低的SNO水平,但与WT CySNO处理的植株相比gydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baatao3gydF4y2Ba显示SNO积累增加(图;gydF4y2Ba3.gydF4y2Bae).奇怪的是,CySNO和GSNO处理的植物在SNOs积累方面表现出明显不同的行为,但这可能是由于He等人认为两种NO供体释放NO的能力不同。[gydF4y2Ba67gydF4y2Ba].gydF4y2Ba
如前所述,aba相关基因的启动子分析提示存在gydF4y2Ba独联体gydF4y2Ba-涉及防御的调控要素;因此,我们研究了gydF4y2BaAtAO3gydF4y2Ba在基础和gydF4y2BaRgydF4y2Ba-gene-mediated阻力。我们的研究结果表明gydF4y2BaAtAO3gydF4y2Ba负调节基础和gydF4y2BaRgydF4y2Ba-gene-mediated阻力。减少病原体的生长gydF4y2Baatao3gydF4y2Ba其次是增加gydF4y2BaPR1gydF4y2Ba基因表达(图;gydF4y2Ba4gydF4y2BaA, b,暗示gydF4y2BaAtAO3gydF4y2Ba负调控病原体诱导的SA通路。另一个SA通路相关基因的转录积累gydF4y2BaPR2gydF4y2Ba与的相比减少了gydF4y2BaPR1gydF4y2Ba.这可能是因为增加了gydF4y2BaPR1gydF4y2Ba这种表达已经有助于抵抗病原体,部分可能是一种储存额外代谢能量的策略,这些能量本可以被gydF4y2BaPR2gydF4y2Ba归纳。我们还观察到HR和gydF4y2BaPR1gydF4y2Ba对无毒病原体的反应(gydF4y2Ba太平洋标准时间gydF4y2BaDC3000表达gydF4y2BaavrBgydF4y2Ba效应)gydF4y2Baatao3gydF4y2Ba植物,表明gydF4y2BaAtAO3gydF4y2Ba同时也是消极调节gydF4y2BaRgydF4y2Ba-gene-mediated阻力。这有力地支持了假设gydF4y2BaAtAO3gydF4y2Ba作为SA缺陷突变体负调控病原体诱导的SA通路gydF4y2Baatsid2gydF4y2Ba表现为症状发展严重,病原体生长以增加为减少gydF4y2BaPR1gydF4y2Ba表达对有毒物质的反应gydF4y2Ba太平洋标准时间gydF4y2BaDC3000(无花果。gydF4y2Ba4gydF4y2Baa, b, c),减少人力资源和gydF4y2BaPR1gydF4y2Ba对无毒反应的表达gydF4y2Ba太平洋标准时间gydF4y2BaDC3000(无花果。gydF4y2Ba5gydF4y2Baa, b).先前的研究也表明aba缺失突变体对生物营养性病原体的抗性[gydF4y2Ba45gydF4y2Ba].广泛的研究已经证实,植物和它们的病原体不断竞争生存和食物。病原体相关分子模式(pamp)被植物模式识别受体识别,导致pamp触发免疫(PTI) [gydF4y2Ba41gydF4y2Ba].然而,一些病原体已经进化并通过修饰的PAMPs逃避PTI,导致效应剂触发的易感性。作为这一策略的一部分,植物已经进化出复杂的防御系统,包括植物抗病能力(gydF4y2BaRgydF4y2Ba)由NBS-LRR编码的基因来识别病原体释放的效应分子[gydF4y2Ba41gydF4y2Ba].因此,gydF4y2BaRgydF4y2Ba-基因介导的抗性是由gydF4y2BaRgydF4y2Ba-基因产物和gydF4y2Baavr的gydF4y2Ba限制病原体在寄主植物内的生长,主要导致HR [gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba].通过突变破坏SA通路(例如,gydF4y2BaNahGgydF4y2Ba而且gydF4y2Basid2gydF4y2Ba)显著降低了对病原体的抵抗力[gydF4y2Ba70gydF4y2Ba].SAR标记基因的表达提示gydF4y2BaAtAO3gydF4y2BaSA是一种小的酚类化合物,被认为在植物防御中起着关键作用。研究表明,SA在病原体识别,随后建立局部抗性,并最终将信号传递到系统组织和整个植物中所必需[gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].gydF4y2Ba
ABA,又称“应激激素”,是一种植物激素,在调节水分状态和气孔运动中起关键作用,以保护植物在不利干旱条件下的生长[gydF4y2Ba45gydF4y2Ba].此外,ABA已被证明可以通过外源施药或过表达参与ABA生物合成的基因对特定胁迫的耐受性产生积极影响[gydF4y2Ba73gydF4y2Ba].因此,我们打算确定ABA生物合成基因的作用gydF4y2BaAtAO3gydF4y2Ba朝着耐旱性的方向。我们的研究结果表明gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba突变体在干旱后7d出现快速枯萎,导致植株死亡(dpd;无花果。gydF4y2Ba7gydF4y2Baa).同理,两者都是gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba与WT相比,在干旱条件下ABA含量显著降低(图;gydF4y2Ba7gydF4y2Bac).更早的枯萎gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba这可能是由于它们无法关闭气孔,作为适应外部环境的一部分。当我们观察两者的气孔结构时,进一步证实了这一点gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba7 dpd后气孔仍保持开放状态(图;gydF4y2Ba7gydF4y2Bab)并得到气孔开度定量的支持(附加文件gydF4y2Ba3.gydF4y2Ba).这在一定程度上是预期的gydF4y2BaAtAO3gydF4y2Ba参与ABA的生物合成,主要被认为是调控气孔运动。类似地,Christmann等人。gydF4y2Ba74gydF4y2Ba]报道了ABA参与了干旱条件下气孔的关闭。这主要是为了限制水分流失。我们的结果进一步支持了这一点,即功能突变体的丧失gydF4y2Baatao3gydF4y2Ba而且gydF4y2Baatnced3gydF4y2Ba与WT相比,显示出快速和过度的水分流失。先前的研究结果也表明,aba控制的过程对植物的生存至关重要,aba缺乏突变体对水分胁迫很敏感[gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba].中ABA含量明显增加gydF4y2Baatao3gydF4y2Ba和WT几乎相似;而在干旱条件下,ABA含量降低gydF4y2Baatao3gydF4y2Ba显著降低(图;gydF4y2Ba7gydF4y2BaC),暗示gydF4y2BaAtAO3gydF4y2Ba可能只有在干旱条件下才需要ABA的生物合成。gydF4y2Ba
我们进一步打算确定功能丧失是如何突变的gydF4y2BaAtAO3gydF4y2Ba影响其他干旱胁迫相关基因的表达。我们发现除了gydF4y2BaABA3gydF4y2Ba,两组转录本积累无显著差异gydF4y2Baatao3gydF4y2Ba和WT,其余与ABA生物合成相关的基因如gydF4y2BaAtABA2gydF4y2Ba而且gydF4y2BaAtNCED3gydF4y2Ba与WT相比,转录本积累减少(图;gydF4y2Ba8gydF4y2BaC, G).然而,即使没有gydF4y2BaAtAO3gydF4y2Ba时,注意到一些ABA的产生,这表明,在缺乏gydF4y2BaAtAO3gydF4y2Ba,其他基因如gydF4y2BaAtAO2gydF4y2Ba可以执行此功能。在干旱条件下,主要参与ABA信号传导的基因,如gydF4y2BaAtABI2, AtDREB2gydF4y2Ba,gydF4y2BaAtAPX1gydF4y2Ba表现为诱导表达,表明这些基因对干旱胁迫的反应与细胞中ABA的含量无关;因此,它们被认为是干旱胁迫的关键调节器[gydF4y2Ba77gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba].gydF4y2Ba
考虑到在生物和/或非生物应激条件下产生的氧化还原活性分子之间发生了显著的串扰,确定NO在调节这些损伤中的作用将是有趣的。由于其物理化学性质,NO是一种转向分子,具有调节孪生(ROS和RNS)氧化还原分子的潜力。然而,NO的机制控制似乎相当复杂,因为NO可以直接控制某些基因的表达,并具有通过翻译后修饰等改变蛋白质功能的巨大潜力gydF4y2Ba年代gydF4y2Ba-亚硝化[gydF4y2Ba8gydF4y2Ba],酪氨酸硝化[gydF4y2Ba80gydF4y2Ba],以及甲基化[gydF4y2Ba81gydF4y2Ba].aba代谢相关基因对NO供体的反应表明NO直接或间接参与了干旱调节。然而,需要彻底的调查来阐明潜在的机制。gydF4y2Ba
结论gydF4y2Ba
本研究提示NO可能在调节植物ABA代谢中发挥作用。ABA生物合成基因作用的进一步研究gydF4y2BaAtAO3gydF4y2Ba在生物和非生物胁迫条件下表现出不同的作用。gydF4y2BaAtAO3gydF4y2Ba负向调控病原体诱导的SA通路,正向调控干旱胁迫。生化分析表明,在正常条件下gydF4y2BaAtAO3gydF4y2BaABA生产可能不需要,但在干旱条件下是需要的,如gydF4y2Baatao3gydF4y2Ba与野生型植株相比,野生型植株ABA含量显著降低。我们还认为干旱相关基因如gydF4y2BaDREB2gydF4y2Ba而且gydF4y2BaABI2gydF4y2Ba不同ABA含量对干旱有不同的响应。gydF4y2Ba
方法gydF4y2Ba
ABA代谢相关基因的转录组范围鉴定和分析gydF4y2Ba
此前,Hussain等人在一项基于rna序列的转录组学研究中报道了许多差异表达基因(DEGs)对1mm CySNO的响应。[gydF4y2Ba25gydF4y2Ba].在本研究中,我们重点研究了cysno诱导的ABA生物合成/代谢相关基因(包括上调和下调,直到另有说明)。Hussain等人描述了植物材料和RNA提取和RNA-seq分析方法的细节。[gydF4y2Ba25gydF4y2Ba].简单地说,RNA是从新鲜叶子中提取的,使用RNeasy Plant Mini Kit (Qiagen USA),按照制造商的标准程序。使用生物分析仪(Agilent®2100 Bio-analyzer;Agilent), RNA文库使用TruSeq™RNA文库准备试剂盒(Illumina USA)生成。接下来,使用KAPA文库定量试剂盒(Illumina USA)合成双链cDNA文库,并使用HiSeq-2500测序仪(Illumina USA)进行测序。通过使用Q20 > 40%的阈值水平处理原始序列读取来识别高质量的读取。Q20 < 40%,或者有10%歧义碱基的读取被丢弃[gydF4y2Ba82gydF4y2Ba].然后将高质量的读数对准gydF4y2Ba答:芥gydF4y2Ba使用TopHat和默认参数[gydF4y2Ba83gydF4y2Ba].基因注释来源于Ensembl [gydF4y2Ba84gydF4y2Ba],并使用Cufflinks软件包v2.2.1 [gydF4y2Ba85gydF4y2Ba].使用Cuffdiff v.2.2.1计算对照和处理条件下基因和转录本的表达量[gydF4y2Ba85gydF4y2Ba],以鉴定显著性的DEGs (Q < 0.05),然后进行进一步分析。gydF4y2Ba
所有的deg通过MapMan 3.6.0RC在拟南芥数据库中进行映射,如[gydF4y2Ba26gydF4y2Ba].基于为ABA代谢指定的BIN数(17.1.1,17.1.1.1.1,17.1.2和17.1.3),我们确定了约26个参与ABA代谢的DEGs(17个上调,9个下调)。所有的基因都是人工检查的,重复的条目被删除。利用FPKM值生成热图gydF4y2BaRgydF4y2Ba3.3.1版本。R (gydF4y2Bahttps://www.r-project.org/gydF4y2Ba)以可视化处理样本和对照样本之间的表达值差异,并开发了表示层次聚类的树状图。多维散射(MDS)图也由三份对照和cysno处理样本的FPKM值生成,以可视化数据中的离散性gydF4y2BaRgydF4y2Ba.gydF4y2Ba
启动子分析gydF4y2Ba
aba相关基因大多被认为只参与非生物胁迫。然而,这些基因对NO供体的反应也可能使它们成为生物应激的潜在目标。因此,我们打算研究cysno诱导的ABA代谢相关基因的启动子区域是否存在gydF4y2Ba独联体gydF4y2Ba监管元素。所有这些基因转录起始位点上游1 Kb的启动子序列从TAIR (gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba),并使用PlantCARE (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba).许多gydF4y2Ba独联体gydF4y2Ba-调控元件在启动子区被发现,其中少数在生物和非生物胁迫条件下都有重要作用的调控元件被选择出来;然后使用调控序列分析工具中的模式匹配工具进行映射[gydF4y2Ba86gydF4y2Ba]包,使用默认参数。使用microsoftpowerpoint (gydF4y2Bahttps://www.office.com/gydF4y2Ba)及adobephotoshopcs6 (gydF4y2Bahttps://www.adobe.com/products/photoshop.htmlgydF4y2Ba).gydF4y2BaAtAAO3gydF4y2Ba(AT2G27150)在ABA生物合成途径中起关键作用,因此选择其进行体内分析。它调节ABA生物合成的最后一步,在这一步中它将脱落醛转化为ABA。gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥种子,野生型Col-0gydF4y2Baatnced3gydF4y2Ba而且gydF4y2Baataao3gydF4y2Ba(AT2G27150),功能缺失突变体,从诺丁汉拟南芥种群中心(NASC) (gydF4y2Bahttp://arabidopsis.info/gydF4y2Ba).的gydF4y2Baatgsnor1-3gydF4y2BaATGSNOR1基因缺失是由爱丁堡大学的Gary Loake教授提供的。植物在1/2 Murashige和Skoog (MS)培养基上或23±2°C的土壤上生长,在长日照条件下(光照16小时和黑暗8小时)。植株在莲座期(4周龄植株)进行基因分型,以鉴定纯合子系。拟南芥WT和其他所有用于研究的系均具有Col-0遗传背景。ROS和RNS细胞水平的变化会影响含金属的酶,如过氧化物酶和过氧化氢酶[gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba].既然我们打算确定的作用gydF4y2BaAtAO3gydF4y2Ba基因在植物氧化还原胁迫条件下(氧化和亚硝化),我们使用gydF4y2Baatgsnor1-3gydF4y2Ba而且gydF4y2Baatcat2gydF4y2Ba由于突变体在植物免疫和生长中已被证实的作用,它们可作为比较对照[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].类似地,gydF4y2Baatsid2gydF4y2BaSA途径缺失突变体作为SA介导防御途径的对照[gydF4y2Ba89gydF4y2Ba),而gydF4y2Baatnced3gydF4y2Ba缺乏gydF4y2BaAtNCED3gydF4y2Ba用于aba相关的防御反应[gydF4y2Ba90gydF4y2Ba].gydF4y2Ba
氧化还原应力试验gydF4y2Ba
的可能作用gydF4y2BaAtAAO3gydF4y2Ba如前所述,将WT和KO突变体置于亚硝化和氧化应激条件下[gydF4y2Ba91gydF4y2Ba].简而言之,拟南芥种子WT和gydF4y2Baatao3gydF4y2Ba种子表面用含0.1% Triton X-100 (Sigma Aldrich,美国)的50%漂白剂溶液消毒5分钟。然后用无菌蒸馏水冲洗种子3次,在4℃下分层24 h,使种子均匀发芽。然后在添加2 mM H的1/2强度MS培养基上发芽gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba加1 μM甲基紫精(氧化应激)、1 mM GSNO和1 mM CySNO(亚硝化应激),每重复至少8粒。处理1周和2周后记录子叶发育频率(CDF,绿色发育种子的数量),处理2周后记录根和茎长。gydF4y2Ba
病原体生长和接种gydF4y2Ba
两种类型的细菌菌株,毒性和无毒gydF4y2Ba两gydF4y2Bapv。gydF4y2Ba番茄gydF4y2Ba(gydF4y2Ba太平洋标准时间gydF4y2Ba)被用于这项研究。致命的gydF4y2Ba太平洋标准时间gydF4y2BaDC3000无毒gydF4y2Ba太平洋标准时间gydF4y2BaDC3000表示gydF4y2BaavrBgydF4y2Ba如前所述,培养、维持和接种效应物[gydF4y2Ba48gydF4y2Ba].简单地说,两株细菌都在含有Luria-Bertani (LB)-琼脂培养基的培养皿上培养,并加入相关抗生素进行筛选(100 mg/mL利福平为毒力gydF4y2Ba太平洋标准时间gydF4y2BaDC3000和卡那霉素(50 mg/mL)和利福平用于gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (avrB)。在28℃下孵育过夜,然后将单个菌落转移到LB肉汤中,在28℃下连续震动孵育过夜。然后在台式离心机(LaboGene Model no 1524 Korea)中以8000 rpm离心3分钟收集细菌,在10 mM MgCl中重新悬浮gydF4y2Ba2gydF4y2Ba,以5 × 10的浓度向叶片背面注射gydF4y2Ba5gydF4y2BaCFU为毒,而5 × 10gydF4y2Ba6gydF4y2BaCFU为无毒菌株。接种三次,每株接种三片叶子。对照植物仅用缓冲液(10 mM MgCl)浸润gydF4y2Ba2gydF4y2Ba).定期观察植物的疾病症状,并随着时间的推移收集叶片样本进行进一步分析。gydF4y2Ba
实时荧光定量PCR分析gydF4y2Ba
实时荧光定量PCR (qRT-PCR)分析方法如下[gydF4y2Ba61gydF4y2Ba].简单地说,根据制造商的协议,使用Trizol®(Invitrogen, USA)从接种的叶片中提取总RNA。根据制造商说明,使用DiaStar™RT试剂盒(SolGent,韩国)合成互补DNA (cDNA)。然后将合成的cDNA作为模板,在实时PCR仪(Illumina, USA)中研究植物防御标记基因,如gydF4y2Ba公关gydF4y2Ba,参与sa依赖防御通路。这些基因及其引物序列的详细列表在附加文件中提供gydF4y2Ba4gydF4y2Ba.PCR使用EcoTM实时PCR仪,使用2× real-time PCR Master Mix(包括SYBR®Green I BioFACT™Korea),加入100 ng模板DNA和每个引物10 nM,最终体积为20 mL。“无模板对照”被用作含有蒸馏水而不是模板DNA的阴性对照。两步pcr在以下条件下进行40个循环:聚合酶在95°C激活15分钟,在95°C变性15秒,在60°C退火和延伸30秒。在60-95°C下评估熔化曲线,以验证每个引物对的扩增子特异性,并使用肌动蛋白作为内参基因。gydF4y2Ba
组织学染色gydF4y2Ba
小波型和小波型的超敏反应(HR)gydF4y2Baatao3gydF4y2Ba植物对gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)按照Koch和Slusarenko的描述,使用台盼蓝组织学染色对浸润进行定量[gydF4y2Ba92gydF4y2Ba].对于这个,WT的叶叶和gydF4y2Baatao3gydF4y2Ba植物接种gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)用乳酚台潘蓝染色,然后用饱和水合氯醛脱色。然后将叶子装在70%甘油的载玻片上,用光学显微镜捕捉图像。如前所述,使用Adobe Photoshop CS6根据台盼蓝染色强度定量细胞死亡(任意单位)[gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
SNO测量gydF4y2Ba
如前所述,评估各种应激后细胞SNO水平[gydF4y2Ba61gydF4y2Ba].简单地说,对于在氧化或亚硝化胁迫(在“氧化还原应激试验”小节中详细提到)的1 / 2 MS培养基上生长的植物,在暴露于各自的(氧化和亚硝化)胁迫条件后2周收集样品。用于测定植物致病后的SNO水平;选取4周龄的植株,分别于0、12、24 h采集样品gydF4y2Ba太平洋标准时间gydF4y2BaDC3000 (gydF4y2BaavrBgydF4y2Ba)接种。植物样品(各两片叶子作为一个重复)在液氮中研磨,并在PBS缓冲液中均质。然后,样品在冷藏离心机中以15000转/分的速度离心(1736 R LABOGENE Korea;转子GRF-L-m2.0-30) 10分钟。上清液转移到新鲜试管中,再次以15000转/分离心5分钟。将约100 ul上清液注入NO分析仪(NOA- 280i, Sievers, and USA)的吹扫容器中,记录峰值。采用Bradford法测定所有植物样品中的总蛋白质含量[gydF4y2Ba93gydF4y2Ba].用光密度法(OD)建立了测定样品中蛋白质浓度的标准曲线gydF4y2Ba595gydF4y2Ba)的牛血清白蛋白(BSA)标准。SNO含量(pmol。μggydF4y2Ba−1gydF4y2Ba通过比较每个样品的峰值与各种CySNO标准得到的值来计算样品中的蛋白质)。gydF4y2Ba
耐旱性试验gydF4y2Ba
以4周龄植株为研究对象,采用保水法进行干旱胁迫[gydF4y2Ba94gydF4y2Ba].用等量的水灌溉避免了实验误差,在水分完全吸收后将托盘转移到干燥的托盘底座上。将植物置于干旱条件下7 ~ 10天。对照植物定期浇水。研究了电解质泄漏和气孔调节等参数。研究了可能参与干旱胁迫调节的基因的转录积累。10 d后重新浇水,浇水24 h后计算回收率。对所有基因型在干旱胁迫下的表型反应进行了评估。gydF4y2Ba
用于细胞死亡定量的电解质泄漏测量gydF4y2Ba
离子或电解质泄漏的测量方法如下[gydF4y2Ba95gydF4y2Ba作了一些修改。在干旱后0天和7天,分别从对照和干旱胁迫处理的植株中采集叶片样本。叶盘(直径1 cm)分3个重复收集,每个重复至少3个(来自不同叶片)。用去离子水冲洗叶片,去除表面电解质,并转移到装有5毫升去离子水的玻璃管中。试管在室温下保持24小时,并持续轻度震动,使用便携式电导率仪(HURIBA Twin Cond B-173;日本);这被称为电解质泄漏(EL1)。然后将样品在120°C下高压灭菌20分钟,冷却至室温(~ 25°C)。再次测量各样品的电解质泄漏量(EL2)。EL(%)测定如下:gydF4y2Ba
El (%) = (el1 / el2) × 100。gydF4y2Ba
气孔结构分析gydF4y2Ba
以确定是否gydF4y2BaAtAO3gydF4y2Ba参与气孔调节,我们研究了WT和gydF4y2Baatao3gydF4y2Ba在控制和干旱条件下的突变体,如前所述[gydF4y2Ba96gydF4y2Ba].简单地说,在叶子的背面涂上一层薄薄的透明指甲油,然后晾干几分钟。将透明透明胶带小心地涂在干指甲油上,轻轻按压,使气孔清晰可见。胶带被小心地从叶子上取下来,安装在一个显微镜载玻片上。在Axioplan 2成像显微镜下观察制备的载玻片(Axioplan 2成像;卡尔蔡司,耶拿,德国)。为了量化干旱胁迫后WT和转基因株系的气孔开放程度,并从统计学上评价其气孔响应,我们使用ImageJ成像显微镜对图像进行了分析。gydF4y2Ba97gydF4y2Ba].选择直线工具测量每幅图像上的比例尺,将比例尺值设置为200 μm。设定刻度值后,在一个保护细胞内壁到另一个保护细胞内壁最宽处测量气孔。计算并绘制了野生型和转基因系各18个气孔的平均值。gydF4y2Ba
ABA含量测定gydF4y2Ba
齐等人的详细方法。gydF4y2Ba98gydF4y2Ba]用于内源ABA的定量。在对照和干旱条件下采集的植物样品进行冷冻干燥和研磨,得到细粉,然后用ABA (Me-[2H6]-ABA)标准提取和色谱。样品的部分因此甲基化使用重氮甲烷。最后采用GCMS (6890n网络气相色谱仪)对ABA进行检测和定量。信号离子(m/z-162和m/z-190对于Me-[2H6]- aba)和(m/z-166和m/z-194对于Me-[2H6]- aba)使用ThermoQuset(曼彻斯特,英国)监测。gydF4y2Ba
统计分析gydF4y2Ba
所有实验都重复了两次以上,并给出了具有代表性的结果。氧化还原胁迫试验的数据点平均为3个重复,每个重复5株植物,而致病性评估和菌落生长的数据点平均为5个重复。对于具有多重应力的实验,数据进行单向方差分析(one-way ANOVA),然后使用SAS统计程序9.2版(Cary, Nc,美国)进行邓肯多范围检验(DMRT)。其余数据进行标准误差(±SE)和学生分析gydF4y2BatgydF4y2Ba.测试计算gydF4y2BapgydF4y2Ba价值使用微软Excel程序。所有的图表都是在Origin 9.0软件中制作的。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有的支持性数据都可以作为附加文件与此手稿一起找到。在本研究中分析的进一步数据可根据通讯作者的合理要求提供。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 代谢:gydF4y2Ba
-
醛氧化酶类gydF4y2Ba
- AtSABP3:gydF4y2Ba
-
拟南芥水杨酸结合蛋白3gydF4y2Ba
- AZI:gydF4y2Ba
-
壬二酸诱导剂gydF4y2Ba
- 爆炸:gydF4y2Ba
-
基本的本地对齐搜索工具gydF4y2Ba
- 提供:gydF4y2Ba
-
子叶发育频率gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 公司:gydF4y2Ba
-
干旱后的天数gydF4y2Ba
- EL1:gydF4y2Ba
-
电解质泄漏1gydF4y2Ba
- G3PDH:gydF4y2Ba
-
甘油醛3-磷酸脱氢酶gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- 谷胱甘肽:gydF4y2Ba
-
谷胱甘肽gydF4y2Ba
- 人力资源:gydF4y2Ba
-
过敏的反应gydF4y2Ba
- 女士:gydF4y2Ba
-
Murashige和SkooggydF4y2Ba
- NBS-LRR:gydF4y2Ba
-
核苷酸结合位点-亮氨酸富重复序列gydF4y2Ba
- nc:gydF4y2Ba
-
9-cis-epoxycrotenoid加双氧酶gydF4y2Ba
- NPR1:gydF4y2Ba
-
发病相关基因-1的非表达gydF4y2Ba
- 哦:gydF4y2Ba
-
氢氧自由基gydF4y2Ba
- PMT:gydF4y2Ba
-
翻译修饰gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- RNA-Seq:gydF4y2Ba
-
RNA序列gydF4y2Ba
- RNIs:gydF4y2Ba
-
活性氮中间体gydF4y2Ba
- roi:gydF4y2Ba
-
活性氧中间体gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- 山::gydF4y2Ba
-
激素水杨酸gydF4y2Ba
- 特别行政区:gydF4y2Ba
-
全身获得性耐药性gydF4y2Ba
- TAIR:gydF4y2Ba
-
拟南芥信息资源gydF4y2Ba
- TFs:gydF4y2Ba
-
转录因子gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Culotta E, Koshland DE,没有消息就是好消息。Sci。1992;258(5090):1862 - 5。gydF4y2Ba
- 2.gydF4y2Ba
Durner J, Klessig DF。一氧化氮是植物中的信号。植物学报。1999;2(5):369-74。gydF4y2Ba
- 3.gydF4y2Ba
Bright J, Desikan R, Hancock JT, Weir IS, Neill SJ。aba诱导的拟南芥NO生成和气孔关闭依赖于H2O2的合成。植物学报,2006;26(1):344 - 344。gydF4y2Ba
- 4.gydF4y2Ba
第三种特异性:细胞信号传递中的活性氧和氮中间体。中华临床医学杂志,2003;11(6):769-78。gydF4y2Ba
- 5.gydF4y2Ba
上原T,中村T,姚德东,史志强,顾泽泽,马玉玲,等。s -亚硝基化蛋白-二硫化物异构酶将蛋白质错误折叠与神经退行性变联系起来。Nat。2006;441(7092):513 - 7。gydF4y2Ba
- 6.gydF4y2Ba
没有消息就是好消息,但是…gydF4y2Ba导管gydF4y2Ba.中华外科杂志,2011;28(4):583。gydF4y2Ba
- 7.gydF4y2Ba
李志强,李志强,李志强。蛋白质s -亚硝基化对神经元一氧化氮的影响。细胞生物学杂志,2001;3(2):193-7。gydF4y2Ba
- 8.gydF4y2Ba
斯塔姆勒JS, Simon DI, Osborne JA, Mullins ME, Jaraki O, Michel T,等。蛋白质与一氧化氮的s -亚硝基化:生物活性化合物的合成和表征。中国科学:自然科学,2001;29(1):1 - 8。gydF4y2Ba
- 9.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥s -亚硝基化蛋白的蛋白质组学分析。植物科学进展。2005;37(3):344 - 344。gydF4y2Ba
- 10.gydF4y2Ba
王永强,A飞灿,云B-W, R沙菲,Hofmann A, Taylor P,等。AtSABP3的s -亚硝基化可拮抗植物免疫表达。中国生物医学工程学报,2009;26(4):339 - 339。gydF4y2Ba
- 11.gydF4y2Ba
王超,王俊杰,董旭。植物免疫对NPR1通过s -亚硝基化和硫氧还蛋白构象电荷的依赖。科学(纽约,纽约州)。2008, 321(5891)。gydF4y2Bahttps://doi.org/10.1126/science.1156970gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
崔莉,李丽娟,李丽娟,李丽娟,等。一氧化氮通过拟南芥运输抑制剂反应1生长素受体的s -亚硝基化影响生长素信号。植物学报,2012;29(3):344 - 344。gydF4y2Ba
- 13.gydF4y2Ba
Romero-Puertas MC, Rodriguez-Serrano M, Sandalio LM。植物非生物胁迫下蛋白质s -亚硝基化研究综述。4.前沿植物科学,2013;gydF4y2Ba
- 14.gydF4y2Ba
王勇,王志刚,王志刚,王志刚,王志刚。s -亚硝基硫醇在植物抗病中的核心作用。中国科学:自然科学,2005;29(2):344 - 344。gydF4y2Ba
- 15.gydF4y2Ba
张志刚,张志刚,张志刚。干旱和盐胁迫下植物光合作用的调控机制。安Bot-London。2009年,103(4):551 - 60。gydF4y2Ba
- 16.gydF4y2Ba
极端环境下的植物:如何提高耐旱性?9.前沿植物科学,2018;gydF4y2Ba
- 17.gydF4y2Ba
气候变暖中的干旱胁迫和碳同化:可逆和不可逆的影响。中国植物学报。2016;203:69-79。gydF4y2Ba
- 18.gydF4y2Ba
刘志刚,张志刚,张志刚,等。渗透胁迫和干旱胁迫下大豆、小麦和小麦根中一氧化氮的生成。甘肃生物学报,2005;49(1-2):13-6。gydF4y2Ba
- 19.gydF4y2Ba
桑迪瑞P, Bhatnagar-Mathur P, Sharma KK。NO抗旱——一氧化氮在植物干旱中的多功能作用:我们有所有的答案吗?植物科学进展(英文版);gydF4y2Ba
- 20.gydF4y2Ba
Filippou P, Bouchagier P, Skotti E, Fotopoulos V.脯氨酸和活性氧/氮代谢参与了入侵植物艾兰属(Ailanthus altissima)对干旱和盐度的耐受反应。环境科学学报。2014;37(1):1 - 10。gydF4y2Ba
- 21.gydF4y2Ba
石涛,叶涛,朱建科,陈志林。一氧化氮的本构生成增强了拟南芥的抗旱性和广泛的转录重编程。中国机械工程学报,2014;26(3):344 - 344。gydF4y2Ba
- 22.gydF4y2Ba
贾亚特里G,阿古拉S, Raghavendra AS。一氧化氮是气孔关闭过程中保卫细胞中重要的二级信使。4.前沿植物科学,2013;gydF4y2Ba
- 23.gydF4y2Ba
Besson-Bard A, Astier J, Rasul S, Wawer I, Dubreuil-Maurizi C, Jeandroz S,等。植物一氧化氮反应基因的研究现状。植物科学进展,2009;37(4):344 - 344。gydF4y2Ba
- 24.gydF4y2Ba
黄晓明,黄晓明,张晓明,等。一氧化氮反应基因和启动子gydF4y2Ba拟南芥gydF4y2Ba:生物信息学方法。中国机械工程学报,2008;39(2):379 - 379。gydF4y2Ba
- 25.gydF4y2Ba
胡赛恩A, Mun BG, Imran QM,李苏,Adamu TA, Shahid M,等。一氧化氮介导的转录组分析揭示了多种调控通路的激活gydF4y2Ba拟南芥gydF4y2Ba.7.前沿植物科学,2016;gydF4y2Ba
- 26.gydF4y2Ba
李志强,李志强,李志强,等。no诱导的拟南芥转录因子基因的转录组谱表明,它们可能在多个生物学过程中发挥调控作用。Sci Rep-Uk。2018; 8(1): 771。gydF4y2Ba
- 27.gydF4y2Ba
高崎H,丸山K,高桥F,藤田M,吉田T,中岛K,等。SNAC-as是胁迫响应型NAC转录因子,介导aba诱导的叶片衰老。中国植物学报,2015;26(6):344 - 344。gydF4y2Ba
- 28.gydF4y2Ba
希克JA,齐佩尔MJB。气候驱动的树木死亡率:来自美国小针松死亡的见解。中国农业科学。2013;20(2):331 - 331。gydF4y2Ba
- 29.gydF4y2Ba
陈建平,陈建平,陈建平。玉米VP14对类胡萝卜素的特异性氧化裂解作用。Sci。1997;276(5320):1872 - 4。gydF4y2Ba
- 30.gydF4y2Ba
谭建平,王志刚,王志刚。玉米脱落酸生物合成的遗传控制。美国国家科学院。1997; 94(22): 12235 - 40。gydF4y2Ba
- 31.gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。拟南芥醛氧化酶的分子克隆与鉴定。植物细胞生理学杂志,1998;39(4):433-42。gydF4y2Ba
- 32.gydF4y2Ba
徐m, Peeters AJ, Koiwai H, Oritani T, Marion-Poll A, Zeevaart JA,等。拟南芥醛氧化酶3 (AAO3)基因产物催化叶片脱落酸生物合成的最后一步。自然科学进展,2000;29(3):389 - 397。gydF4y2Ba
- 33.gydF4y2Ba
Garcia-Mata C, Lamattina L.一氧化氮和脱落酸在保护细胞中的相互作用。植物科学进展。2002;29(3):339 - 344。gydF4y2Ba
- 34.gydF4y2Ba
赵昌昌,蔡国光,王永智,陈志华。在拟南芥中,硝酸盐还原酶NIA1和NIA2的缺失通过改变ABA核心信号成分的基因来破坏气孔关闭。植物信号行为研究。2016;11(6):e1183088。gydF4y2Ba
- 35.gydF4y2Ba
曹云云,吉冈K, Desveaux D. ABA在植物-病原菌相互作用中的作用。中国植物学报,2011;26(4):489 - 489。gydF4y2Ba
- 36.gydF4y2Ba
徐敏,高岩威,Akaba S, Komano T, Oritani T, Kamiya Y,等。拟南芥叶片中的脱落醛氧化酶。植物学报,2000;23(4):481-8。gydF4y2Ba
- 37.gydF4y2Ba
胡永强,刘松,袁宏明,李军,闫德伟,张建峰,等。过氧化氢酶基因消除光呼吸H的功能比较gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在拟南芥cat2光呼吸突变体中进行启动子和3 ' -非翻译区交换实验。植物细胞环境学报。2010;33(10):1656-70。gydF4y2Ba
- 38.gydF4y2Ba
尹文伟,史凯丽,尹敏,于敏,孟BG,李洙,胡珊,史波,Loake GJ:一氧化氮与s -亚硝基谷胱甘肽在植物免疫中的作用。中国生态学报,2016,26(2):516-526。gydF4y2Ba
- 39.gydF4y2Ba
福斯特MW,刘丽敏,曾敏,Hess DT, Stamler JS。亚硝化胁迫的遗传分析。48。2009;(4):792 - 9。gydF4y2Ba
- 40.gydF4y2Ba
对生物营养性和坏死性病原体防御机制的比较。植物学报。2005;43:205-27。gydF4y2Ba
- 41.gydF4y2Ba
Jones JDG, Dangl JL。植物免疫系统。Nat。2006;444(7117):323 - 9。gydF4y2Ba
- 42.gydF4y2Ba
Alvarez ME, Pennell RI, Meijer PJ, Ishikawa A, Dixon RA, Lamb C.活性氧中间体介导植物免疫系统信号网络的建立。细胞。1998;92(6):773 - 84。gydF4y2Ba
- 43.gydF4y2Ba
宋FM,古德曼RM。一氧化氮的活性依赖于水杨酸在烟草系统获得性抗性信号通路中的作用,但在一定程度上是必需的。植物微生物学报,2001;14(12):1458-62。gydF4y2Ba
- 44.gydF4y2Ba
王鹏鹏,杜亚友,侯玉军,赵颖,徐成昌,袁芳杰,等。一氧化氮通过OST1的s -亚硝基化负向调节保护细胞中的脱落酸信号。美国国家科学院。2015年,112(2):613 - 8。gydF4y2Ba
- 45.gydF4y2Ba
林长青,白伟,郑俊,金俊华,李世生。ABA在植物气孔防御和干旱胁迫中的作用。中华分子生物学杂志,2015;16(7):15251-70。gydF4y2Ba
- 46.gydF4y2Ba
洛杉矶。植物生理学中的ROS和RNS综述。应用物理学报,2015;26(10):2827-37。gydF4y2Ba
- 47.gydF4y2Ba
刘志刚,刘志刚,刘志刚,杨晓明。一氧化氮在植物抗病性中的作用。Nat。1998;394(6693):585 - 8。gydF4y2Ba
- 48.gydF4y2Ba
云B-W, A飞婵,尹M,赛迪NBB,乐必汉T,于M,等。NADPH氧化酶s -亚硝基化在植物免疫中调控细胞死亡。2011:264-8 Nat。gydF4y2Ba
- 49.gydF4y2Ba
赵玲,张峰,郭娟,杨艳,李斌,张磊。一氧化氮在两种生态型芦苇愈伤组织耐盐性中的作用。植物科学进展。2004;34(2):849-57。gydF4y2Ba
- 50.gydF4y2Ba
帕拉尼M, Rudrabhatla S, Myers R, Weirich H, Smith B, Leaman DW,等。拟南芥一氧化氮应答转录本的芯片分析。植物学报,2004;2(4):359-66。gydF4y2Ba
- 51.gydF4y2Ba
Begara-Morales JC, Sánchez-Calvo B, Luque F, Leyva-Pérez MO, Leterrier M, Corpas FJ, Barroso JB。拟南芥根与叶gsno反应基因的RNA-Seq差异转录组分析植物细胞物理。2014:pcu044。gydF4y2Ba
- 52.gydF4y2Ba
黄晓霞,冯俊杰,杜晓明,等。一氧化氮诱导拟南芥悬浮细胞耐一氧化氮替代氧化酶的转录激活。足底。2002;215(6):914 - 23所示。gydF4y2Ba
- 53.gydF4y2Ba
王晓明,王晓明,王晓明,等。一氧化氮对拟南芥臭氧诱导细胞死亡、激素合成及基因表达的影响。植物学报,2009;26(1):1 - 12。gydF4y2Ba
- 54.gydF4y2Ba
植物中活性氧和一氧化氮之间的相互作用:s -亚硝基谷胱甘肽还原酶的关键作用。自由自由基生物医学。2017。gydF4y2Ba
- 55.gydF4y2Ba
蛋白质磷酸化在生物调控中起着至关重要的作用。5 .《神经化学与细胞医学》1999;gydF4y2Ba
- 56.gydF4y2Ba
Millar TM, Stevens CR, Benjamin N, Eisenthal R, Harrison R, Blake DR.黄嘌呤氧化还原酶催化硝酸盐和亚硝酸盐在缺氧条件下还原为一氧化氮。中国科学(d辑),1998;gydF4y2Ba
- 57.gydF4y2Ba
金JS,米井J,吉田T,藤田Y,中岛J,大堀T,等。一个ABRE启动子序列参与了DREB2A基因的渗透胁迫响应表达,该基因编码了一种调节拟南芥干旱诱导基因的转录因子。中国生物医学工程学报。2011;42(12):366 - 366。gydF4y2Ba
- 58.gydF4y2Ba
烟草核蛋白与I类几丁质酶基因启动子中诱导反应元件的相互作用。植物分子生物学。1997;34(1):81-7。gydF4y2Ba
- 59.gydF4y2Ba
Ohme-Takagi M, Shinshi H.与乙烯响应元件相互作用的乙烯诱导DNA结合蛋白。植物学报。1995;7(2):173-82。gydF4y2Ba
- 60.gydF4y2Ba
干旱响应的转录调控:一个曲折的转录因子网络。5 .前沿植物科学,2015;gydF4y2Ba
- 61.gydF4y2Ba
Imran QM, Hussain A, Mun BG, Lee SU, Asaf S, Ali MA,等。转录组广泛鉴定和鉴定no反应WRKY转录因子gydF4y2Ba拟南芥gydF4y2BaL.环境实验机器人,2018;48:128 - 43。gydF4y2Ba
- 62.gydF4y2Ba
内田,杨田,高部,高部。过氧化氢和一氧化氮对水稻耐盐性和耐热性的影响。植物科学学报,2002;26(3):344 - 344。gydF4y2Ba
- 63.gydF4y2Ba
Vanderauwera S, Zimmermann P, Rombauts S, Vandenabeele S, Langebartels C, Gruissem W,等。拟南芥中过氧化氢调控基因表达的全基因组分析揭示了高光诱导的花青素生物合成转录簇。植物科学进展。2005;39(2):344 - 344。gydF4y2Ba
- 64.gydF4y2Ba
李志强,李志强,李志强,等。一氧化氮在植物生长调控和非生物胁迫中的作用。植物物理学报,2004;26(4):459-72。gydF4y2Ba
- 65.gydF4y2Ba
一氧化氮刺激种子萌发和去黄化,抑制下胚轴伸长,这是植物的三种光诱导反应。足底。2000;210(2):215 - 21所示。gydF4y2Ba
- 66.gydF4y2Ba
张志刚,王志刚,王志刚,王志刚。氮释放物对光敏色素控制后树种子萌发的影响。植物生长学报,1998;26(3):175-81。gydF4y2Ba
- 67.gydF4y2Ba
He WL, Frost MC.使用可溶性NO供体直接测量细胞培养条件下一氧化氮(NO)的实际水平。氧化还原生物学,2016;9:1-14。gydF4y2Ba
- 68.gydF4y2Ba
格莱泽布鲁克J,罗杰斯EE,奥苏贝尔FM。直接筛选拟南芥病易感性增强突变体的分离。遗传学。1996;143(2):973 - 82。gydF4y2Ba
- 69.gydF4y2Ba
帕克JE,霍鲁伯EB,弗罗斯特LN,福克A,甘恩ND,丹尼尔斯MJ。eds1的特征,拟南芥的一个突变,抑制了几个不同的RPP基因所指定的对Peronospora寄生的抗性。植物学报。1996;8(11):2033-46。gydF4y2Ba
- 70.gydF4y2Ba
范·威斯斯,李志刚,等。拟南芥NahG对丁香假单胞菌非寄主抗性的丧失。菜豆是水杨酸的降解产物。植物学报,2003;33(4):733-42。gydF4y2Ba
- 71.gydF4y2Ba
哈蒙德-科萨克KE,琼斯JD。抗性基因依赖的植物防御反应。《植物科学》1996;8(10):1773-91。gydF4y2Ba
- 72.gydF4y2Ba
津田K,佐藤M, Glazebrook J,科恩JD,片瞳f . MAMP-triggered和SA-mediated防御反应之间的相互作用(53卷,763 pg, 2008)。植物学报,2008;36(6):461。gydF4y2Ba
- 73.gydF4y2Ba
Vishwakarma K, Upadhyay N, Kumar N, Yadav G, Singh J, Mishra RK,等。植物脱落酸信号与非生物胁迫耐受性研究进展及展望。8.中国植物科学,2017;gydF4y2Ba
- 74.gydF4y2Ba
Christmann A, Weiler EW, Steudle E, Grill E.缺水根-梢信号中的水力信号。植物学报,2007;26(1):344 - 344。gydF4y2Ba
- 75.gydF4y2Ba
孙晓明,王晓明,王晓明。种子和幼苗脱落酸信号通路的研究。《植物科学》2002;14:S15-45。gydF4y2Ba
- 76.gydF4y2Ba
李文杰,李文杰,李文杰,等。NCED5对类环氧胡萝卜素的裂解调节ABA的积累,并与其他NCED家族成员一起影响种子休眠和耐旱性。植物学报,2012;29(3):344 - 344。gydF4y2Ba
- 77.gydF4y2Ba
Chak RKF, Thomas TL, Quatrano RS, Rock CD.基因ABI1和ABI2参与脱落酸和干旱诱导的Daucus carota L. Dc3启动子在转基因拟南芥(L.)保护细胞中的表达。Heynh。足底。2000;210(6):875 - 83。gydF4y2Ba
- 78.gydF4y2Ba
郭晓峰,李志强,李志强,等。抗坏血酸过氧化物酶1在拟南芥对胁迫组合的响应中起着关键作用。中国生物医学工程学报,2008;29(4):457 - 457。gydF4y2Ba
- 79.gydF4y2Ba
佐久间Y,丸山K,大阪部Y,秦F,关M,筱崎K,等。拟南芥转录因子DREB2A参与干旱响应基因表达的功能分析植物学报。2006;18(5):1292-309。gydF4y2Ba
- 80.gydF4y2Ba
Radi R.一氧化氮,氧化剂,蛋白质酪氨酸硝化。美国国家科学院。2004年,101(12):4003 - 8。gydF4y2Ba
- 81.gydF4y2Ba
胡建林,杨海军,穆建勇,卢廷林,彭建林,邓旭,孔志生,鲍立林,曹晓峰,左小俊。植物胁迫响应中一氧化氮对蛋白质甲基化的调控。中国生物医学工程学报,2017;29(4):344 - 344。gydF4y2Ba
- 82.gydF4y2Ba
Patel RK, Jain M. NGS QC Toolkit:用于下一代测序数据质量控制的工具包。PLoS One, 2012:gydF4y2Ba7gydF4y2Ba(2).gydF4y2Ba
- 83.gydF4y2Ba
Trapnell C, Pachter L, Salzberg SL. TopHat:发现RNA-Seq剪接连接。Bioinform。2009;25(9):1105 - 11所示。gydF4y2Ba
- 84.gydF4y2Ba
李志强,李志强,李志强,等。运用2014年。核酸工程学报,2014;42(D1): D749-55。gydF4y2Ba
- 85.gydF4y2Ba
特拉内尔C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ,等。RNA-Seq转录本的组装和定量揭示了细胞分化过程中未注释的转录本和异构体转换。中国生物工程学报。2010;28(5):511-U174。gydF4y2Ba
- 86.gydF4y2Ba
张志刚,张志刚,张志刚。烟草中豌豆豆荚素基因启动子活性的研究。生物化学学报,1989;21(2):326-31。gydF4y2Ba
- 87.gydF4y2Ba
克拉克A,德西坎R,赫斯特RD,汉考克JT,尼尔SJ。没有回头路:一氧化氮和程序性细胞死亡gydF4y2Ba拟南芥gydF4y2Ba悬挂的文化。植物学报,2000;24(5):667-77。gydF4y2Ba
- 88.gydF4y2Ba
傅克罗伊P,范苏依特G,库什尼尔S,因泽D,布里特JF。铁调节的APX1基因编码的胞质抗坏血酸过氧化物酶在拟南芥幼苗中的表达。植物科学进展。2004;34(2):366 - 366。gydF4y2Ba
- 89.gydF4y2Ba
Kim Y, Park S, Gilmour SJ, Thomashow MF。CAMTA转录因子和水杨酸在拟南芥低温转录组和抗冻性配置中的作用植物学报,2013;26(3):366 - 366。gydF4y2Ba
- 90.gydF4y2Ba
远藤A,泽田Y,高桥H,冈本M,池上K,小井H,等。拟南芥9-顺式环氧类胡萝卜素双加氧酶的干旱诱导发生在维管束组织细胞中。植物科学进展。2008;37(4):344 - 344。gydF4y2Ba
- 91.gydF4y2Ba
伊姆兰QM, Falak N, Hussain A, Mun B-G, Sharma A, Lee S-U,等。一氧化氮反应性重金属相关基因gydF4y2BaAtHMAD1gydF4y2Ba有助于发育和抗病gydF4y2Ba拟南芥gydF4y2Ba.7.前沿植物科学,2016;gydF4y2Ba
- 92.gydF4y2Ba
拟南芥易受霜霉真菌感染。《植物科学》1990;2(5):437-45。gydF4y2Ba
- 93.gydF4y2Ba
一种利用蛋白质-染料结合原理快速而灵敏地定量微量蛋白质的方法。生物化学。1976;72(1-2):248-54。gydF4y2Ba
- 94.gydF4y2Ba
蒋玉军,梁刚,于德强。WRKY57的激活表达使拟南芥具有耐旱性。植物学报,2012;5(6):1375-88。gydF4y2Ba
- 95.gydF4y2Ba
马苏米,李志强,李志强,等。干旱胁迫对毛茛水分、电解质渗漏及酶抗氧化活性的影响。中国机械工程学报,2010;42(5):3517-24。gydF4y2Ba
- 96.gydF4y2Ba
Shahzad R, Waqas M, Khan AL, Hamayun M, Kang SM, Lee IJ。不同温度条件下茉莉酸甲酯的叶面施药诱导了Pisum的生理激素变化。中国生物医学工程学报,2015;gydF4y2Ba
- 97.gydF4y2Ba
Schneider CA, Rasband WS, Eliceiri KW. NIH图像到ImageJ: 25年的图像分析。自然科学进展。2012;9(7):675 - 5。gydF4y2Ba
- 98.gydF4y2Ba
Qi QG, Rose PA, Abrams GD, Taylor DC, Abrams SR. Cutler AJ:甘蓝型油菜胚胎(+)-脱落酸代谢、3-酮酰基辅酶a合成酶基因表达及超长链单不饱和脂肪酸生物合成植物科学进展。1998;17(3):389 - 397。gydF4y2Ba
致谢gydF4y2Ba
感谢拟南芥生物资源中心提供种子,感谢Adamu Tefere Alem先生和Rolly Nukulu Kabange先生在实验过程中的指导。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了下一代生物绿色21计划(SSAC,授权号:SSAC)的资助。, PJ01342501),韩国农村振兴厅。此外,资助机构在研究设计、数据收集和解释或撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
QMI和B-WY设计了研究;MK、QMI和MS进行实验;MK、QMI、AHU和BGM对数据进行分析;MK、QMI、MS、SL测定SNO水平,MAK测定ABA水平,QMI、AHU起草稿件;IL和B-WY监督并严格审查了手稿。所有作者都已阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究所用植物材料均从拟南芥生物资源中心订购。所进行的实验符合国家和国际准则。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
在基于rna序列的转录组中显示对1 mM CySNO反应的ABA代谢相关基因列表。gydF4y2Ba
附加文件2gydF4y2Ba
转录本积累gydF4y2BaPR2gydF4y2Ba尝试P后基因gydF4y2Ba圣gydF4y2BaDC3000接种。gydF4y2Ba
附加文件3。gydF4y2Ba
控制和干旱胁迫条件下气孔张开的定量研究。gydF4y2Ba
附加文件4。gydF4y2Ba
qPCR分析的基因及其引物序列。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
汗,M,伊姆兰,Q.M,沙希德,M。gydF4y2Baet al。gydF4y2Ba一氧化氮诱发gydF4y2BaAtAO3gydF4y2Ba差异调节植物防御和耐旱性gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaBMC植物生物学gydF4y2Ba19日,gydF4y2Ba602(2019)。https://doi.org/10.1186/s12870-019-2210-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2210-3gydF4y2Ba
关键字gydF4y2Ba
- RNA-seq分析gydF4y2Ba
- Nitrosative压力gydF4y2Ba
- ABA代谢基因gydF4y2Ba
- 基底国防gydF4y2Ba
- RgydF4y2Ba-gene-mediated阻力gydF4y2Ba
- 干旱胁迫gydF4y2Ba
- 气孔调节gydF4y2Ba