- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
柑橘udp - glucosytransferase基因的异位表达提高了拟南芥花青素和原花青素的含量,提高了拟南芥的耐光性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba603gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
柑橘类水果是新鲜食用或果汁直接为人体提供各种膳食类黄酮。柑桔属植物代谢产物多样化,许多类黄酮生物合成基因是在非生物胁迫下诱导产生的。为了更好地理解潜在的机制,我们设计了一些过表达a的实验gydF4y2BaUDP-GLUCOSYL转移酶gydF4y2Ba甜橙基因(gydF4y2Ba素类gydF4y2Ba),以评估其在代谢和应激反应中的可能功能。gydF4y2Ba
结果gydF4y2Ba
我们的研究结果表明gydF4y2BaCs-UGT78D3gydF4y2Ba导致原花青素在种皮中大量积累,转基因拟南芥种子呈深棕色。此外,过表达株系叶片中总黄酮和花青素含量显著提高。基因表达分析表明,转基因拟南芥中许多类黄酮(黄酮醇)和花青素基因表达上调4 ~ 15倍。经过14 d强光胁迫后,转基因拟南芥表现出较强的抗氧化活性,叶片中花青素和类黄酮的总含量均高于野生型。gydF4y2Ba
结论gydF4y2Ba
我们的研究得出结论,柑橘gydF4y2BaCs-UGT78D3gydF4y2Ba该基因有助于原花青素在转基因拟南芥种皮中的积累,并通过积累总花青素和类黄酮含量,使其具有更好的抗氧化潜力(由于花青素的光保护活性)来耐受强光胁迫。gydF4y2Ba
背景gydF4y2Ba
柑橘主要是世界范围内种植的水果作物,其果实可新鲜食用或制成果汁(橙子和柑桔)。水果含有丰富的维生素、类胡萝卜素、叶酸、膳食纤维、类黄酮[gydF4y2Ba1gydF4y2Ba]、原花青素(PAs)及花青素[gydF4y2Ba2gydF4y2Ba并成为膳食代谢物的直接来源。类黄酮又分为黄酮类、异黄酮类、黄酮醇类、黄酮类、黄烷醇类和花青素类[gydF4y2Ba3.gydF4y2Ba]它们在植物抵御生物和非生物因素方面发挥着重要作用[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba];此外,类黄酮还可降低人类罹患癌症等多种慢性疾病的风险[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
原花青素(缩合单宁)是低聚或聚合类黄酮化合物[gydF4y2Ba8gydF4y2Ba].PAs在整个植物界广泛分布,但主要富集在种子和果实中[gydF4y2Ba8gydF4y2Ba].PAs功能保护植物免受非生物(紫外线辐射)和生物(真菌和虫害)因素的侵害[gydF4y2Ba9gydF4y2Ba]对人体也有好处(抗癌、抗炎和保护皮肤免受阳光伤害)[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].花青素也是类黄酮的亚类,与花粉传播、果实和花朵的颜色、植物防御和发育有关[gydF4y2Ba11gydF4y2Ba].花青素和黄酮醇的化学结构被认为具有很强的抗氧化性能,这对清除活性氧(ROS)至关重要[gydF4y2Ba11gydF4y2Ba].这些化合物保护植物免受各种环境因素的影响,如强光、寒冷、紫外线损伤、高温和生物胁迫[gydF4y2Ba12gydF4y2Ba].最近有报道称,黄龙冰入侵后,属于黄酮、黄酮醇和花青素生物合成途径的几个类黄酮途径基因(o-甲基转移酶、黄酮醇合成酶、类黄酮3′-单加氧酶、白花青素双加氧酶等)在柑橘中显著上调[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].类黄酮化合物因其抗菌、光保护和抗氧化能力而闻名于世。gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]和生物压力[gydF4y2Ba19gydF4y2Ba].每当柑橘植物暴露在不同的非生物和生物胁迫下,它们就会刺激其次级防御机制(如花青素和类黄酮)来保护自己免受恶劣环境条件的影响。gydF4y2Ba
在柑橘方面,许多研究报告在遗传[gydF4y2Ba20.gydF4y2Ba]和解剖水平来了解耐受和防御机制[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].许多研究报道了柑橘植物在非生物胁迫后积累次生代谢产物(类黄酮、花青素等)[gydF4y2Ba23gydF4y2Ba]或生物压力[gydF4y2Ba19gydF4y2Ba].然而,连接次级代谢产物和防御反应的关键基因却鲜为人知[gydF4y2Ba7gydF4y2Ba].柑橘属约有162种[gydF4y2Ba24gydF4y2Ba];其中甜橙、柑橘、柚子、柠檬和葡萄柚是世界上著名的栽培柑橘品种。柑桔属植物花青素含量不同;一些野生柑橘品种的果实、花朵和嫩叶中花青素含量较高[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
在植物中,udp -糖基转移酶(UGTs)是一个大型的基因家族,如模式植物gydF4y2Ba拟南芥gydF4y2Ba共包含120个ugt [gydF4y2Ba25gydF4y2Ba];这涉及次生代谢产物的生物合成、偶联激素、非生物和生物胁迫毒素,也影响植物细胞内稳态[gydF4y2Ba25gydF4y2Ba].此外,一些UGTs基因如UGT74B1酶在拟南芥硫甙生物合成中起作用[gydF4y2Ba26gydF4y2Ba].UGTs,尤其是GT1酶,参与调节花青素和各种有色聚合物的前体,使红葡萄的果实和花朵具有迷人的颜色(gydF4y2Ba葡萄gydF4y2Ba) [gydF4y2Ba27gydF4y2Ba].此外,GT1基因来自gydF4y2BaCyclocarya成果gydF4y2BaIljinsk(中国药用乔木植物)负责类黄酮苷等多种生物活性化合物的底物和生物合成,以及花青素等下游色素化合物的生物合成[gydF4y2Ba28gydF4y2Ba].GT1还参与黄酮醇和黄酮糖基化的催化过程[gydF4y2Ba28gydF4y2Ba].此外,gydF4y2Ba拟南芥gydF4y2BaUGT75C1和UGT78D2分别编码花青素5-O糖基转移酶和类黄酮3- o糖基转移酶,负责花青素、色素化合物和类黄酮的生物合成[gydF4y2Ba29gydF4y2Ba].龙胆草花青素3 ' - o -糖基转移酶(3 ' gt)的过表达(gydF4y2Ba龙胆trifloragydF4y2Ba)在转基因矮牵牛的花中积累了蓝色和紫色花青素(gydF4y2Ba佩妮矮牵牛gydF4y2Ba) [gydF4y2Ba30.gydF4y2Ba].UGTs基因直接参与花青素和黄酮醇苷的生物合成gydF4y2Ba拟南芥gydF4y2Ba(gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
基于先前发表的柑橘转录组学和基因表达研究[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba32gydF4y2Ba我们从苯丙烯类途径中选择了关键基因;此外,我们的基因表达和代谢数据表明,甜橙gydF4y2BaCs-UGT78D3gydF4y2Ba基因差异表达(在所选基因之间),并与代谢数据相关(附加文件)gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba).所以,我们选择了gydF4y2BaCs-UGT78D3gydF4y2Ba基因编码gydF4y2BaUDP-GLUCOSYL转移酶gydF4y2Ba从甜橙(gydF4y2Ba素类gydF4y2Ba)来过度表达gydF4y2Ba拟南芥gydF4y2Ba来评估它的功能。本研究将有助于了解代谢生物合成、基因调控及可能的耐受作用gydF4y2BaUDP-GLUCOSYL转移酶gydF4y2Ba基因向应激;此外,它还促进了药理工业,并协助代谢工程培育柑橘保护性代谢产物(植物化学物质)增加的品种。gydF4y2Ba
结果gydF4y2Ba
UGTs基因的选择与过表达gydF4y2Ba
在gydF4y2Ba素类gydF4y2Ba, UGTs基因调控与类黄酮和花青素积累呈正相关[gydF4y2Ba33gydF4y2Ba].此外,柑橘UGTs基因参与代谢[gydF4y2Ba34gydF4y2Ba]并在生长发育过程中表达出来[gydF4y2Ba35gydF4y2Ba].柑橘ugt参与类黄酮生物合成[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba]并刺激柑橘中花青素的生物合成[gydF4y2Ba37gydF4y2Ba].根据我们的(附加文件gydF4y2Ba2gydF4y2Ba)和已发表的转录组数据[gydF4y2Ba38gydF4y2Ba],我们选择了UGTs基因,并证实UGT78D3基因在柑橘品种中存在差异表达(gydF4y2Ba素类gydF4y2Ba)(附加文件gydF4y2Ba1gydF4y2Ba).因此,选择一个UGTs基因进行过表达gydF4y2Ba拟南芥gydF4y2Ba来评估它的功能。gydF4y2Ba
转基因拟南芥植株在TgydF4y2Ba1gydF4y2Ba采用CaMV35S正向和反向Cs5g24820基因特异性引物进行PCR,进一步确认转化植株。在TgydF4y2Ba2gydF4y2Ba根据基因表达和PCR结果筛选出3个独立的转基因株系(OX-1、OX-5和OX-7)。此外,TgydF4y2Ba4gydF4y2Ba产生的光应力实验。根据qRT-PCR结果,结果表明gydF4y2BaCs-UGT78D3gydF4y2Ba基因在所有转基因系中均比野生型上调25倍以上(图2)。gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba
过度的gydF4y2BaCs-UGT78D3gydF4y2Ba基因促进拟南芥原花青素积累。gydF4y2Ba一个gydF4y2Ba的过表达(OE)gydF4y2BaCs-UGT78D3gydF4y2Ba基因(gydF4y2BabgydF4y2Ba) OE和EV(空载体)种子颜色明显(gydF4y2BacgydF4y2Ba)呈现深褐色的OE种子(gydF4y2BadgydF4y2Ba)呈淡黄色的野生型种子(gydF4y2BaegydF4y2Ba种皮各节段呈红色的OE种皮香兰素测定(gydF4y2BafgydF4y2Ba)野生型种子,只有种皮边缘呈红色,其余种皮颜色均为淡黄色(gydF4y2BaggydF4y2Ba)种皮原花青素含量显著增加。值为三个重复的平均值±SE,使用Student 's t检验比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.01。(**)意义重大。WT:野生型,EV:空向量,OE:过表达gydF4y2Ba
过度的gydF4y2BaUDP-GLUCOSYL转移酶gydF4y2Ba基因促进种皮原花青素积累gydF4y2Ba
转基因拟南芥种皮颜色的研究gydF4y2Ba2gydF4y2Ba与空载体种子相比,种子线变成褐色。gydF4y2Ba1gydF4y2Bab)与野生型种子颜色浅黄色有显著差异(图;gydF4y2Ba1gydF4y2Bad).在TgydF4y2Ba3.gydF4y2Ba和TgydF4y2Ba4gydF4y2Ba代后,种皮颜色稳定,为深褐色(图;gydF4y2Ba1gydF4y2Bac).一般来说,拟南芥种子种壳中PAs的大量积累使种皮呈深褐色[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
香兰素与白花青素单体、PAs末端亚基、儿茶素反应并产生红色[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].用香兰素法测定TgydF4y2Ba3.gydF4y2Ba转基因种子。有趣的是,经过香兰素处理后,转基因种子种壳的深棕色呈现出明显的红色(图2)。gydF4y2Ba1gydF4y2Bae)与野生型种子(只有种皮边缘呈红色)相比(图;gydF4y2Ba1gydF4y2Baf).因此,可以确定转基因种皮的棕色是由于种子种皮中PAs的积累(图。gydF4y2Ba1gydF4y2BaG)比野生型。gydF4y2Ba
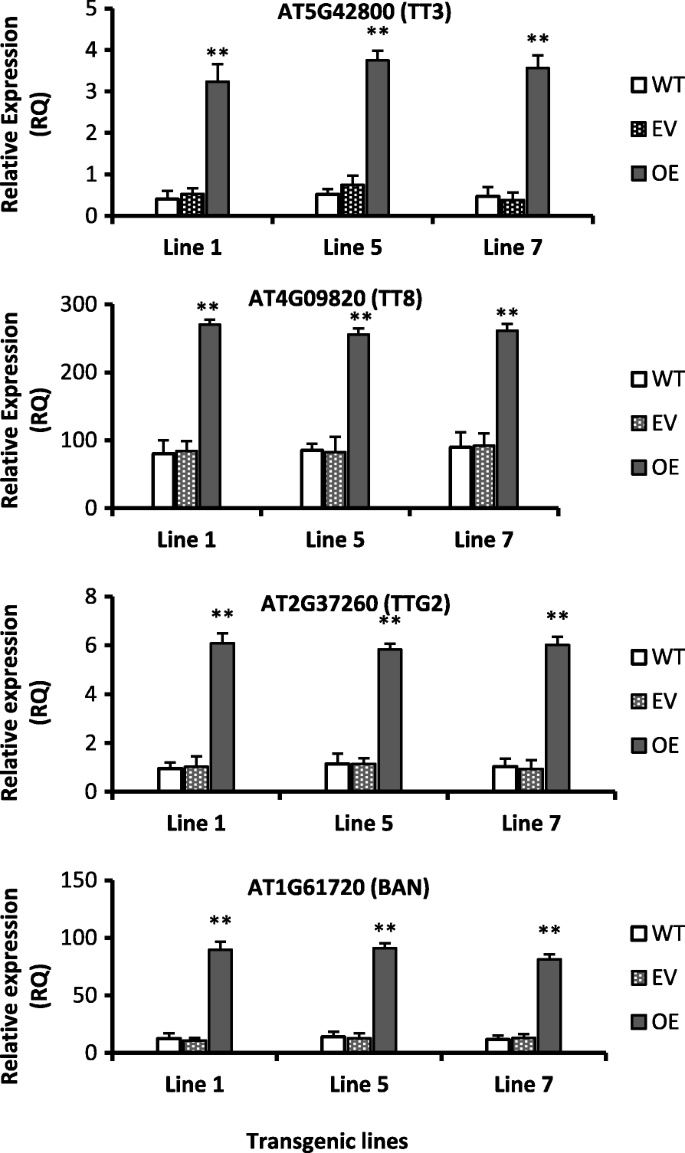
所有转基因株系种子中原花青素(PAC)含量均高于野生株系(图2)。gydF4y2Ba1gydF4y2Ba此外,原花青素生物合成途径相关基因AT5G42800 (TT3)、AT2G37260 (TTG2)、AT4G09820 (TT8)和AT1G61720 (BAN)在转基因种子中的表达较野生型种子显著上调(4倍以上)(图2)。gydF4y2Ba2gydF4y2Ba).在种子形成过程中上调TTG2、TT8和BAN的表达,有利于原花青素在种子皮中的大量积累gydF4y2Ba拟南芥gydF4y2Ba(gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].gydF4y2Ba
光照胁迫下转基因拟南芥花青素和原花青素合成调控基因上调。值为三个重复的平均值±SE,使用Student 's t检验比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.01,(**)极显著。基因id取自拟南芥基因组网站TAIR (gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba).TT3或DFR:二氢黄酮醇4-还原酶;TT8:透明testa 8;TTG2:透明毛胚2;禁止:也有。WT:野生型,EV:空向量,OE:过表达gydF4y2Ba
转基因植物中酚类化合物、类黄酮和花青素含量较高gydF4y2Ba
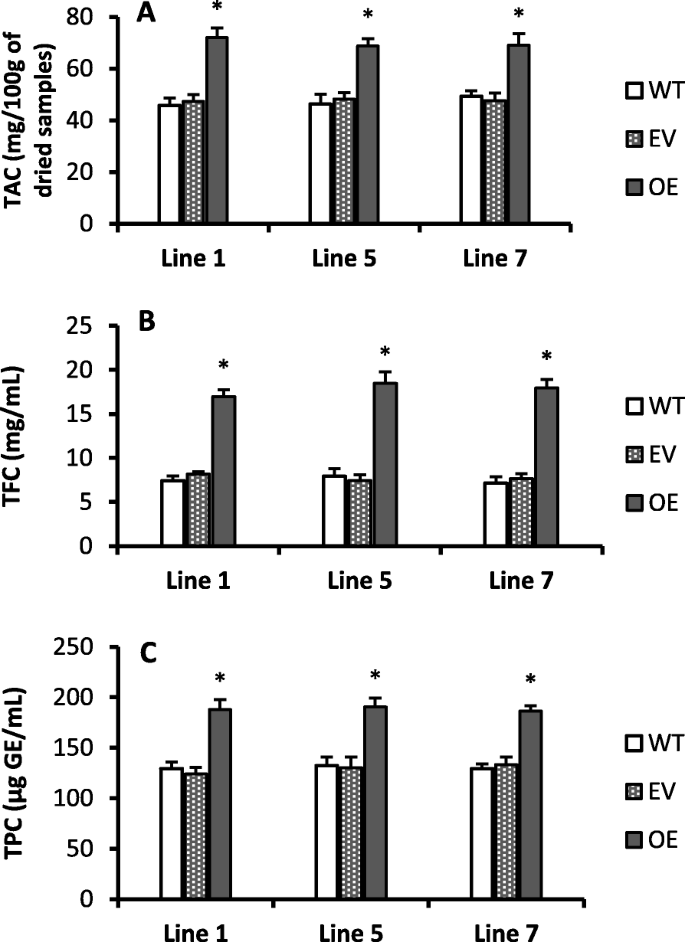
总黄酮浓度越高(图;gydF4y2Ba3.gydF4y2Bab)和总酚含量(图;gydF4y2Ba3.gydF4y2BaC)转基因株系与野生株系相比有显著差异。根据qRT-PCR表达数据gydF4y2BaCs-UGT78D3gydF4y2Ba基因超过25倍(图;gydF4y2Ba1gydF4y2Baa)和一些黄酮醇生物合成途径相关基因如AT3G55120 (TT5)、AT3G51240 (TT6)和AT5G07990 (TT7)在所有转基因株系中的诱导量是野生型的2-5倍(附加文件)gydF4y2Ba3.gydF4y2Ba).TT5参与类黄酮和花青素生物合成途径[gydF4y2Ba44gydF4y2Ba].高浓度的总花青素含量(TAC)(图;gydF4y2Ba3.gydF4y2Baa)和总黄酮含量(TFC)(图。gydF4y2Ba3.gydF4y2Bab)黄酮通路相关基因显著上调(图;gydF4y2Ba2gydF4y2Ba)表明该基因参与了花青素总量和类黄酮含量的提高。许多植物酚类化合物和类黄酮化合物具有显著的抗氧化特性,可帮助植物减轻在轻度胁迫下产生的自由基损伤[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
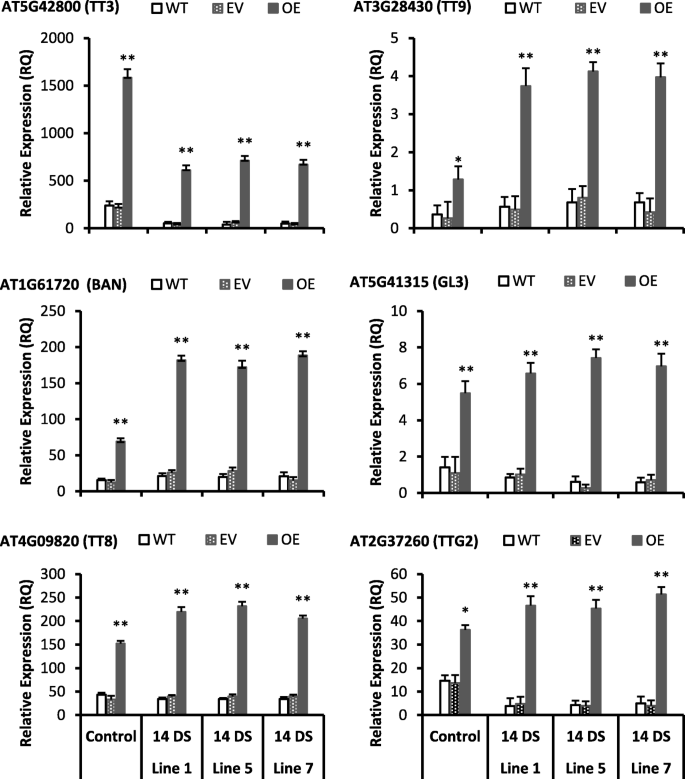
与野生型相比,所有转基因株系的总花青素含量(TAC)均显著增加。gydF4y2Ba3.gydF4y2Baa).与野生型相比,所有转基因株系的种子和叶片中TT3、TT8、AT3G28430 (TT9)和BAN的诱导均显著(4倍以上)。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).此外,AT5G41315 (GL3)和TTG2在所有转基因株系中的诱导量也显著高于野生型的4倍。然而,转基因系中AT4G22880 (ANS)、AT1G17260 (AHA)和AT5G05600基因表达量比野生型增加了2倍或不到2倍(附加文件)gydF4y2Ba3.gydF4y2Ba).ANS、AHA和AT5G05600基因直接或间接参与花青素的生物合成(gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba).TT3和TT5基因参与花青素生物合成[gydF4y2Ba44gydF4y2Ba].代谢和基因表达结果显示gydF4y2BaCs-UGT78D3gydF4y2Ba基因参与了诱导类黄酮和花青素生物合成途径积累更多的代谢产物的转基因拟南芥。gydF4y2Ba
高光胁迫后,转基因拟南芥黄酮和花青素合成调控基因上调。值为三个重复的平均值±SE,使用Student 's t检验比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.05(*)显著;gydF4y2BapgydF4y2Ba< 0.01(**)极显著。14 DS: 14天轻应激,WT:野生型,EV:空载体,OE:过表达。基因id取自拟南芥基因组网站TAIR (gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba)gydF4y2Ba
转基因拟南芥对光胁迫的代谢反应gydF4y2Ba
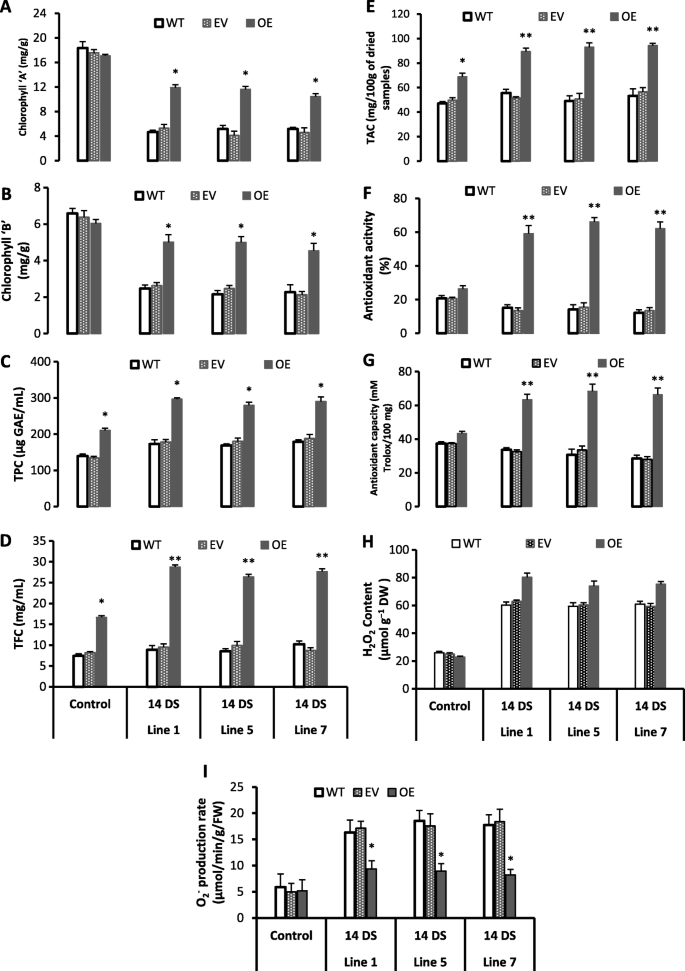
在14 d强光胁迫下,所有转基因株系的TPC、TFC、TAC均显著高于野生株系(图2)。gydF4y2Ba5度gydF4y2Ba- e)。此外,所有转基因株系在HLS后的TAC浓度均显著高于野生型株系(图2)。gydF4y2Ba5gydF4y2Bae).此外,所有转基因株系HLS后均呈深紫色表型(图。gydF4y2Ba6gydF4y2Bab)而野生型和空载体叶片表现为黄化和萎缩表型(图;gydF4y2Ba6gydF4y2Ba此外,经过14 d光胁迫后,所有转基因株系的TT8、TT9、BAN等花青素生物合成途径相关基因均表现出高表达(图5)。gydF4y2Ba4gydF4y2Ba).此外,TT3、TT8、TT9、BAN、TTG2和GL3基因(图。gydF4y2Ba4gydF4y2Ba)在所有转基因株系中均在强光胁迫下被高度诱导(2-15倍),这些基因参与原花青素和花青素生物合成途径(图。gydF4y2Ba6gydF4y2Bad).花青素是一种水溶性色素,具有很强的光保护特性,这可能是转基因株系耐HLS的原因。此外,此前也有报道称,花青素化合物具有很强的抗氧化性能,并能清除HLS过程中产生的自由基[gydF4y2Ba45gydF4y2Ba].因此,我们的表型、代谢和基因表达数据支持黄酮和花青素在HLS后的所有转基因株系中都显著积累。gydF4y2Ba
强光胁迫对抗氧化代谢的影响。gydF4y2Ba一个gydF4y2Ba;叶绿素gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba;叶绿素gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba;总酚含量(TPC)gydF4y2BadgydF4y2Ba;总黄酮含量,gydF4y2BaegydF4y2Ba;总花青素含量,gydF4y2BafgydF4y2Ba;抗氧化活性,gydF4y2BaggydF4y2Ba;抗氧化能力,gydF4y2BahgydF4y2Ba;过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容),gydF4y2Ba我gydF4y2Ba;超氧自由基(OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba).14 DS: 14天轻应激,WT:野生型,EV:空载体,OE:过表达。对照组:第1天;14 DS: 14天轻应激后。值为三个重复的平均值±SE,使用Student 's t检验比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.05(*)显著;gydF4y2BapgydF4y2Ba< 0.01(**)极显著gydF4y2Ba
强光胁迫后拟南芥的表型及柑橘的潜在功能步骤gydF4y2BaCs-UGT78D3gydF4y2Ba在花青素生物合成途径(gydF4y2Ba一个gydF4y2Ba) 25日龄野生型(WT)和过表达(OX)拟南芥(gydF4y2BabgydF4y2Ba)强光胁迫WT和OX植株14天后(gydF4y2BacgydF4y2Ba)空矢量线(EV)的HLS效应(gydF4y2BadgydF4y2Ba)承担柑橘的功能步骤gydF4y2BaUDP-GLUCOSYL转移酶gydF4y2Ba基因(Cs5g24820)(代谢途径由KEGG制成gydF4y2Bawww.genome.jp kegg /通路gydF4y2Ba;TAIRgydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba和[gydF4y2Ba19gydF4y2Ba])。使用学生t检验来比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.05(*)显著;gydF4y2BapgydF4y2Ba< 0.01(**)极显著。TT3或DFR:二氢黄酮醇4-还原酶;TT8, TT9:透明Testa 8,9;ANS:花青素合成酶;禁止:也有;TT9和TTG2:触发棕色原花青素的积累;GL3: TT8和GL3是影响花青素积累的基本螺旋-环-螺旋(bHLHs)转录因子gydF4y2Ba
在强光胁迫下,转基因拟南芥的叶绿素降解速度较慢,抗氧化活性较高。HLS处理14 d后,野生型和空载体系的叶绿素a和叶绿素b显著降低;但所有转基因株系的叶绿素a和叶绿素b含量均高于野生株系(图2)。gydF4y2Ba5gydF4y2Baa, b).环境胁迫导致叶绿素快速降解,表明植物更容易发生氧化应激,光吸收能力较低[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].我们的结果显示,在高水平的超氧自由基作用下,叶绿素a和叶绿素b迅速降解(图2)。gydF4y2Ba5gydF4y2Bai)在野生型植物中,而所有转基因系都具有高水平的叶绿素a和叶绿素b,而超氧自由基水平较低(图2)。gydF4y2Ba5gydF4y2Bai) HLS 14天后;这清楚地表明,野生型植物比转基因拟南芥更容易受到自由基损伤(图2)。gydF4y2Ba5gydF4y2Ba一个)。gydF4y2Ba
野生型拟南芥和转基因拟南芥在HLS期间的自由基清除潜力已被检测。在HLS处理14天后,所有转基因品系的抗氧化活性和抗氧化能力都显著高于野生品系(图2)。gydF4y2Ba5gydF4y2Baf, g)。此外,在强光胁迫下,野生型和空载体品系的抗氧化活性和抗氧化能力分别较对照(无胁迫)野生型和空载体品系无显著降低(图2)。gydF4y2Ba5gydF4y2Baf, g).这些结果表明,与野生型相比,HLS转基因拟南芥具有较高的自由基清除能力。此外,HLS后所有转基因株系的超氧自由基均显著低于野生型(图2)。gydF4y2Ba5gydF4y2Bai).非生物胁迫耐受性与高抗氧化活性和能力有关[gydF4y2Ba46gydF4y2Ba].因此,我们的结果表明,在高光胁迫下,野生型植物受到了高自由基的伤害(图2)。gydF4y2Ba5gydF4y2BaI)而转基因株系抗氧化能力强,对胁迫的耐受性更强。gydF4y2Ba
在HLS转基因株系中过氧化氢含量高于对照株系,在野生型植株中也有类似的趋势(图2)。gydF4y2Ba5gydF4y2Bah)。gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba是植物中重要的代谢物,参与控制各种针对异常情况的防御反应,如细胞信号和感知功能[gydF4y2Ba47gydF4y2Ba].最近的研究报道了HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba被认为是通过触发信号转导途径来保护植物免受非生物胁迫,使作物适应胁迫环境[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
讨论gydF4y2Ba
在gydF4y2Ba拟南芥,gydF4y2BaUGTs基因表达与花青素生物合成和黄酮醇苷积累呈正相关[gydF4y2Ba31gydF4y2Ba].糖基转移酶基因的过表达gydF4y2Ba素类gydF4y2Ba揭示了高积累的类黄酮苷和花青素生物合成[gydF4y2Ba33gydF4y2Ba].此外,UDP糖基转移酶基因从gydF4y2Ba柑橘unshiugydF4y2Ba(Marc.)参与代谢并将柠檬素苷元转化为葡萄糖苷[gydF4y2Ba34gydF4y2Ba].延迟UGTs基因表达可延缓柑橘果实的苦味[gydF4y2Ba49gydF4y2Ba].糖基转移酶基因在不同生长发育阶段均有显著表达gydF4y2Ba柑橘天堂金花蛇gydF4y2Ba(简历。Duncan),与类黄酮生物合成呈正相关[gydF4y2Ba35gydF4y2Ba].金桔UGT708G1 (gydF4y2BaFortunella植gydF4y2Ba)和取自萨摩柑的UGT708G2 (gydF4y2Ba柑橘unshiugydF4y2Ba)参与类黄酮的积累[gydF4y2Ba36gydF4y2Ba]并调节花青素色素的生物合成[gydF4y2Ba37gydF4y2Ba]而柑橘UGTs基因对不同环境条件的反应[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].据笔者所知,本研究提供了UGT78D3s在花青素和原花青素中均有作用的证据。gydF4y2Ba
原花青素的积累受TT2、TT8、TTG2基因调控,下游部分PAs生物合成基因也参与类黄酮生物合成途径[gydF4y2Ba42gydF4y2Ba].TT8等转录因子调控UGTs基因积累拟南芥原花青素和花青素[gydF4y2Ba42gydF4y2Ba].PAs一般积聚在种子种皮内层,使拟南芥种子呈深褐色[gydF4y2Ba42gydF4y2Ba].PAs的末端亚基与香兰素反应产生红色[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].PAs是无色的类黄酮聚合物,PAs氧化使成熟种子呈现棕色[gydF4y2Ba39gydF4y2Ba].此外,PAs还能保护种子免受不利环境条件的影响,延长种子寿命[gydF4y2Ba43gydF4y2Ba].转基因种子的表型为深褐色,而野生型和空载体种子的表型为淡黄色(图2)。gydF4y2Ba1gydF4y2Ba罪犯)。此外,香兰素试验显示,所有转基因种皮都有PAs的积累。gydF4y2Ba1gydF4y2Bae).此外,所有转基因株系的种子原花青素含量也较高(图。gydF4y2Ba1gydF4y2Bag)。gydF4y2Ba
我们的研究结果表明,与野生型相比,转基因系中的TT8和TTG2基因均上调(图2)。gydF4y2Ba2gydF4y2Ba).TT8是调控因子,参与调控类黄酮、原花青素和花青素的生物合成[gydF4y2Ba42gydF4y2Ba].拟南芥种子的棕色主要是由于PAs,其生物合成受TT8和TTG2基因调控,这些因子参与调节PAs通路的各种生物合成基因[gydF4y2Ba42gydF4y2Ba].此外,TT8还调控Jasmonate zimm -domain蛋白,从而触发花青素的产生。TTG2和TT8的表达对BAN在种子中积累PAs的正确表达至关重要[gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
一品红(gydF4y2Ba大戟属植物pulcherrimagydF4y2Ba)叶片积累了大量的水溶性花青素,并能承受强光胁迫,表明花青素化合物具有光防御作用[gydF4y2Ba45gydF4y2Ba].我们的结果也显示了花青素含量的高积累(图。gydF4y2Ba3.gydF4y2Ba一个和gydF4y2Ba5gydF4y2Bae),所有转基因株系叶片呈深紫色(图2)。gydF4y2Ba6gydF4y2Bab) HLS后比野生型和空向量(图;gydF4y2Ba6gydF4y2Bac);证明了过度表达gydF4y2BaCs-UGT78D3gydF4y2Ba该基因参与花青素的积累,保护植物免受HLS损伤。此外,实时PCR还显示,所有转基因株系的TT8、TT9、BAN基因均增加了许多倍(图2)。gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba6gydF4y2BaD)这些基因参与了花青素的生物合成。gydF4y2Ba
强光胁迫导致大豆叶片叶绿素a和叶绿素b含量迅速降低(gydF4y2Ba大豆gydF4y2Ba)光合效率降低的植物[gydF4y2Ba52gydF4y2Ba].在最近的一项研究中,一品红(gydF4y2Ba大戟属植物pulcherrimagydF4y2Ba)植物,当它们暴露在强光胁迫下[gydF4y2Ba45gydF4y2Ba].叶绿素含量高、抗氧化能力强的植物能耐受较长时间的非生物胁迫[gydF4y2Ba53gydF4y2Ba].我们的结果还表明,高光胁迫转基因株系具有明显更高水平的抗氧化活性(图2)。gydF4y2Ba5gydF4y2Baf, g)、叶绿素a和b含量(图;gydF4y2Ba5gydF4y2Baa, b)具有较低的超氧自由基(图。gydF4y2Ba5gydF4y2Bai)高于HLS野生型植物。非生物胁迫会降低抗氧化潜能、叶绿素含量,并降低植物的高收获能力,最终引发活性氧(ROS)的产生,并(由于自由基)对细胞造成严重损伤[gydF4y2Ba53gydF4y2Ba].gydF4y2Ba
过度的光胁迫使叶片中积累了大量的酚类化合物和黄酮醇等类黄酮化合物,对清除非生物过程中产生的ROS具有显著的抗氧化能力[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]和生物压力[gydF4y2Ba19gydF4y2Ba].黄酮醇作为光保护剂,具有很强的抗氧化活性,有助于对抗ROS物种,对抗过度光应激引起的氧化应激[gydF4y2Ba17gydF4y2Ba].此外,一品红在HLS后,花青素在叶片中积累,表明花青素具有较强的光保护作用[gydF4y2Ba45gydF4y2Ba].类黄酮和花青素具有弹性抗氧化特性,有助于光保护[gydF4y2Ba54gydF4y2Ba].我们的代谢结果显示,与野生型相比,所有转基因株系的花青素和类黄酮含量都较高(图2)。gydF4y2Ba3.gydF4y2Baa, b).这些结果表明,柑橘过表达gydF4y2BaCs-UGT78D3gydF4y2Ba基因与黄酮类化合物和花青素的生物合成密切相关;此外,基因表达数据显示黄酮醇和花青素生物合成相关基因的高表达(图2)。gydF4y2Ba4gydF4y2Ba),这也支持了代谢结果(图。gydF4y2Ba3.gydF4y2Baa, b, c).转基因植株通过触发类黄酮和花青素的生物合成来适应胁迫环境,使转基因株系对HLS具有更强的耐受性。gydF4y2Ba
近年来的研究报道了HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,通过刺激复杂的信号转导途径,导致在非生物和生物胁迫下的系统性获得性抗性和应激驯化[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].而且H的增量gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba水平也会诱导一些防御相关基因[gydF4y2Ba48gydF4y2Ba].我们的结果显示高HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba高光胁迫转基因株系与野生株系的含量比较(图2)。gydF4y2Ba5gydF4y2Bah).此外,所有转基因株系均表现出较高的抗氧化活性和抗氧化能力(图。gydF4y2Ba5gydF4y2Baf, g),在HLS之后。这说明转基因品系比野生品系具有更好、更强的自由基清除能力。这表明,在强光胁迫下,转基因拟南芥表现出较低的氧化应激,清除自由基的能力优于野生型拟南芥。因此,生物化学、代谢、表型和基因表达数据支持所有转基因株系都能耐受强光胁迫;由于花青素和类黄酮含量高,抗氧化能力优于野生型。gydF4y2Ba
结论gydF4y2Ba
过度的gydF4y2BaCs-UGT78D3gydF4y2Ba由于原花青素的积累,所有转基因拟南芥种子均呈深棕色。所有转基因株系叶片中总花青素和总黄酮含量均显著升高。经过14 d强光胁迫后,转基因拟南芥花青素积累明显,抗氧化活性和抗氧化能力均高于野生型。基因表达数据也支持转基因拟南芥中许多类黄酮醇和花青素生物合成基因较野生型上调。我们证明了过度表达gydF4y2BaCs-UGT78D3gydF4y2Ba基因在转基因种皮中积累原花青素,通过积累总花青素和类黄酮含量,使其具有较高的耐光胁迫能力,抗氧化能力优于野生型。该研究也为未来代谢工程培育具有更多保护性代谢物(植物化学物质)的品种提供了理想的候选基因。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
本研究为野生型gydF4y2Ba拟南芥gydF4y2Baecotype Columbia-0 (Col-0)(拟南芥种子在网上购买gydF4y2Bawww.arashare.cngydF4y2Ba)用于过度表达gydF4y2Ba柑桔udp -葡萄糖基转移酶gydF4y2Ba(Cs5g24820)基因(柑橘种子取自华中农业大学柑橘基因组实验室)。野生型拟南芥种子先用70% (v/v)乙醇消毒10 min,再用100% (v)乙醇消毒8 min,然后用双去离子水冲洗4次。然后将种子倒在含有4.43 g MS的Murashige和Skoog培养基培养皿中(干燥的基础培养基,补充植物技术实验室的维生素);25克蔗糖;将10 g琼脂1升1% (w/v)和培养皿留在20-22°C的生长室中,10天后将植物转移到小花盆(土壤)中。在辐照度为120 μmol量子m的生长室中培养3周gydF4y2Ba−2gydF4y2Ba70%相对湿度,温度约22±3°C,在16/8小时明暗周期下。gydF4y2Ba
载体构建与农杆菌转化gydF4y2Ba
构建T-DNA Gateway技术(Invitrogen) pK7WG2D载体(在拟南芥中过表达Citrus黄酮醇转移酶基因),该载体含有绿色荧光蛋白(GFP),同时由于新霉素磷酸转移酶II (nptII)基因而具有卡那霉素抗性(有助于植物视觉或人工选择)[gydF4y2Ba55gydF4y2Ba].利用cDNA,编码区gydF4y2BaCs-UGT78D3gydF4y2Ba采用基因特异性引物PCR扩增,提取质粒,克隆到pDONR221中,经L. R克隆酶酶促反应(invitrogen)干预(按厂家说明书),克隆到二元Gateway Vector pK7WG2D中。将pK7WG2D转入农杆菌GV3101中,通过花浸法将野生型拟南芥花浸入农杆菌溶液中转化为拟南芥[gydF4y2Ba56gydF4y2Ba].gydF4y2Ba
转基因株系和光胁迫条件gydF4y2Ba
利用农杆菌介导的转基因拟南芥株系进行转化。以野生型(WT)、转基因拟南芥35S:PK7WG2D(空载体)和3个独立过表达35S:PK7WG2D- ugt78d3 (OX-1、OX-5、OX-7)为载体,通过交叉检验和自交合成TgydF4y2Ba4gydF4y2Ba转基因植株分期进行14天的光胁迫试验。在每个阶段,拟南芥种子先在含卡那霉素(50 mg/L)的MS培养基上播种,得到阳性植株,然后用qRT-PCR进行表达分析。因此,在光胁迫实验中,使用25天大的野生型、空载体和转基因植物,在生长弯曲的条件下进行14天的高光胁迫(图2)。gydF4y2Ba6gydF4y2Baa、c);5万勒克斯光照压力,光照16小时,黑暗8小时,70%相对湿度,温度约24±2°C。在HLS处理第1天和14天后,采集叶片样品,立即用液氮冷冻,在−80℃保存,用于生化、代谢和基因表达分析。gydF4y2Ba
DNA提取及PCR分析gydF4y2Ba
采用2% CTAB法提取DNA [gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba].将50 ~ 100 mg新鲜拟南芥叶片碾碎成细粉,加入700 μl DNA缓冲液,65℃孵育90 min。加入氯仿-异戊醇(24:1)800 μl,慢速倒置10 min后,10000转/分离心10 min,取DNA球粒[gydF4y2Ba58gydF4y2Ba].根据制造商的说明,使用PCR- master mix (dream tag green-Thermo Scientific)进行PCR。gydF4y2Ba
RNA提取和实时定量PCR分析gydF4y2Ba
新鲜叶片采收后立即冷冻在液氮中,然后使用TRIzol RNA(提取试剂盒)试剂(Takara)进行RNA提取。RNA按照TRIzol试剂盒上的制造商说明进行提取。提取总RNA后,取1 μg总RNA,采用(Vazyme, R223-01) HiScript II QRT(逆转录酶)SuperMix for qPCR (+gDNA wiper)方法合成互补DNA (cDNA)。cDNA合成后,所有cDNA样本保存在−80°C下进行进一步的表达分析(qPCR)。qRT-PCR采用SYBR Green (YEASEN Biotec)。有限公司)PCR主混合和所有标准程序均按照生产商的说明进行。qRT-PCR采用3个技术重复(light cycler 480多孔板384-white),使用light cycler 480 II仪器(Roche)进行。通过2−ΔΔCt方法计算通路基因的相对表达量[gydF4y2Ba59gydF4y2Ba].拟南芥β-actin基因作为内参基因。qRT-PCR引物的详细信息见附加文件gydF4y2Ba4gydF4y2Ba。gydF4y2Ba
香兰素原花青素测定法gydF4y2Ba
用于香兰素测定,将野生型和过表达型种子放入1.5 ml离心管中,然后在6 M盐酸(HCl)中加入I毫升1%香兰素(w/v)染色溶液[gydF4y2Ba39gydF4y2Ba].大约一层种子已经覆盖1.5毫升管的底部。将成熟种子在室温下孵育1小时。孵育后,用体视显微镜(OLYMPUS、SZ61型)在玻片上用解剖针和镊子轻轻分离种皮。然后用光学显微镜(OLYMPUS, BX61型号)对染色后的种皮进行拍照[gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
原花青素含量的测定gydF4y2Ba
原花青素浓度的估算方法是:用液氮研磨20 mg拟南芥种子,然后加入1 ml提取缓冲液(丙酮70%:水29.5%:乙酸0.5%),稍加修改[gydF4y2Ba61gydF4y2Ba].离心4000rpm,取上清进行原花青素定量。取200 μl上述溶液,加0.5% (w/v)甲醇香草素3 ml和4% (v/v) HCl 1.5 ml。15分钟后,用分光光度计(日本岛津公司UV-1800型)在550nm处进行吸光度,而纯甲醇作为空白。使用儿茶素生成标准曲线,PAC值以毫克儿茶素当量(mg CE/克样品)表示。gydF4y2Ba
叶绿素含量的测定gydF4y2Ba
为了估算叶绿素' a '和' b ',拟南芥叶片组织(500 mg)用10 ml (ml) 80% (v/v)丙酮研磨成细粉[gydF4y2Ba62gydF4y2Ba],然后在室温(RT)黑暗条件下孵育4小时。在12000 rpm下离心5 min,将上清液收集到新管中,用分光光度计分别在645 nm和663 nm处测定吸光度(以80% (v/v)丙酮为空白)。叶绿素含量以毫克/升为单位,计算公式如下:gydF4y2Ba
酚类和黄酮类化合物总含量的测定gydF4y2Ba
提取gydF4y2Ba
用研杵和砂浆将100 mg叶片组织粉碎成粉末,然后加入5 mL 80%甲醇,在轨道摇床上以200转/分的速度RT静置2小时,然后离心[gydF4y2Ba63gydF4y2Ba].将上清混合物收集到新的管中,剩余的颗粒再次提取,采用与之前相同的程序(条件相似),将两种上清混合在15 mL管中,用于估算总酚和总黄酮含量。gydF4y2Ba
总酚含量(TPC)gydF4y2Ba
福林- ciocalteu试剂(FCR)法测定总酚含量[gydF4y2Ba63gydF4y2Ba].在新鲜的10毫升试管中取300微升上述制备好的提取物,与(10倍稀释的FCR与蒸馏水)2.25 mL FCR混合,然后进行5 - 10次温和倒置,rt孵育5分钟。然后加入2.25 mL碳酸钠(NagydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba) (60 g/L)溶液加入反应混合物中。然后在RT孵育2小时后,用分光光度计(型号UV-1800,岛津株式会社,日本)在725 nm处测定吸光度。使用没食子酸(GA)生成标准曲线,结果定义为每1克植物叶片干重的毫克GA当量(mg GAE/g)。gydF4y2Ba
总黄酮含量的测定gydF4y2Ba
总黄酮含量采用比色法进行微量修改[gydF4y2Ba64gydF4y2Ba].取配制好的甲醇提取物500 μl左右,加入2.25 mL蒸馏水,拌匀后加入5%亚硝酸钠150 μlgydF4y2Ba2gydF4y2Bart孵育6 min后,取300 μl 10%六水合氯化铝(AlClgydF4y2Ba3.gydF4y2Bah·6gydF4y2Ba2gydF4y2Ba在反应混合液中加入1 mol / l (M)的氢氧化钠(NaOH) 1000 μl,再加入vertex反应30 s。用分光光度计(日本岛津株式会社UV-1800型)在510 nm处瞬时测定反应混合物吸光度。使用芦丁化合物生成标准曲线,结果定义为每1克干燥植物叶片样品毫克芦丁当量(mg RE/g)。gydF4y2Ba
花青素总量(TAC)gydF4y2Ba
为测定总花青素含量,用研钵和杵将100 mg叶片组织研磨(使用液氮)[gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].然后将样品重新悬浮在5体积(以鲜重为基础)的萃取液(含45%甲醇(v/v)和5%乙酸v/v)中,缓慢倒置,然后在rt下(10,000 rpm)离心10分钟。将上清溶液收集到新管中,分别用分光光度计(日本岛津公司UV-1800型)测定花青素和叶绿素在530 nm和657 nm处的吸光度。然后用下式,用叶绿素在530 nm吸光度下校正花青素含量:gydF4y2Ba
*对于花青素,我们使用了5倍的提取量和0.1 g的叶子组织样本。gydF4y2Ba
抗氧化能力和活性(DPPH自由基清除试验)gydF4y2Ba
为了获得抗氧化能力和活性,将新鲜拟南芥叶片研磨(100 mg),并在1 mL提取液中均质(乙醇、水和乙酸,分别为70、29和1%),然后离心[gydF4y2Ba67gydF4y2Ba略作修改。上清液取30 μl,加入2.97 mL 0.1 mm的2,2-二苯基-1-苦酰肼(DPPH),暗培养30 min (RT),测定抗氧化能力。然后用分光光度计(日本岛津株式会社UV-1800型)在517 nm处测定样品吸光度。在2.97 mL DPPH中加入30微升萃取液(不含植物样品)作为对照。通过生成trolox标准曲线计算抗氧化能力,样品以(mM trolox / 100 mg)表示。而抗氧化(自由基清除)活性用下式描述:gydF4y2Ba
过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)gydF4y2Ba
过氧化氢采用三氯乙酸(TCA)法测定[gydF4y2Ba68gydF4y2Ba].将0.1 g碎叶样品再悬浮于1000 μl TCA(0.1%)溶液中,以10,000 rpm的转速离心10 min。取500 μl上清液,加入500 μl 10-mM磷酸钾缓冲液,再加入1000 μl 1 M碘化钾(KI),混合均匀,用分光光度计(型号UV-1800,日本岛津株式会社)在390 nm处检查吸光度读数。通过比较商品H的标准曲线吸光度计算样品吸光度gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba含量以微摩尔/克干燥样品表示。gydF4y2Ba
超氧自由基的测定gydF4y2Ba
超氧自由基(OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba)以0.1克新鲜叶片组织[gydF4y2Ba69gydF4y2Ba].一个单位的超氧自由基被定义为0.1单位的吸光度变化,每分钟在相应的波长值。用亚硝酸盐离子(NOgydF4y2Ba2gydF4y2Ba−gydF4y2Ba).在分光光度计(型号UV-1800,岛津株式会社,日本)530 nm处测定吸光度。gydF4y2Ba
统计分析gydF4y2Ba
使用statistic8.1 (Tallahassee Florida, USA)统计包对数据进行分析。使用Microsoft Excel 2010程序(Microsoft Corp., Redmond, WA, USA)制作标准误差和图表。差异被认为在gydF4y2BapgydF4y2Ba< 0.05,在gydF4y2BapgydF4y2Ba< 0.01。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在这项研究中产生或分析的所有数据都包含在这篇发表的文章[及其补充信息文件]中。gydF4y2Ba
缩写gydF4y2Ba
- CE:gydF4y2Ba
-
儿茶素等价物gydF4y2Ba
- DPPH:gydF4y2Ba
-
2, 2-diphenyl-1-picrylhydrazylgydF4y2Ba
- 货代:gydF4y2Ba
-
Folin-Ciocalteu试剂gydF4y2Ba
- 旅客:gydF4y2Ba
-
克gydF4y2Ba
- 遗传算法:gydF4y2Ba
-
没食子酸gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- HLS:gydF4y2Ba
-
强光胁迫gydF4y2Ba
- M:gydF4y2Ba
-
摩尔gydF4y2Ba
- Mg:gydF4y2Ba
-
毫克gydF4y2Ba
- mL:gydF4y2Ba
-
毫升gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba−gydF4y2Ba:gydF4y2Ba
-
超氧化物自由基gydF4y2Ba
- 牛:gydF4y2Ba
-
超表达gydF4y2Ba
- PAC:gydF4y2Ba
-
原花青素含量gydF4y2Ba
- 不是:gydF4y2Ba
-
原花青素gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- 转:gydF4y2Ba
-
每分钟轮数gydF4y2Ba
- RT:gydF4y2Ba
-
室温gydF4y2Ba
- TAC:gydF4y2Ba
-
花青素总含量gydF4y2Ba
- 交通:gydF4y2Ba
-
总黄酮含量gydF4y2Ba
- TPC:gydF4y2Ba
-
总酚含量gydF4y2Ba
- ugt:gydF4y2Ba
-
UDP glycosyl-transferasegydF4y2Ba
- μg:gydF4y2Ba
-
微克gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
黎波里E, La Guardia M, Giammanco S, Di Majo D, Giammanco M.柑橘类黄酮:分子结构、生物活性和营养特性:综述。食品化学。2007;104:466-79。gydF4y2Ba
- 2.gydF4y2Ba
黄东,王旭,唐忠,袁勇,徐勇,何俊,等。柑桔驯化过程中Ruby2-Ruby1基因簇的亚功能化。植物学报。2018;4:930-41。gydF4y2Bahttps://doi.org/10.1038/s41477-018-0287-6gydF4y2Ba。gydF4y2Ba
- 3.gydF4y2Ba
黄酮类化合物:化学、生物化学及应用。博卡拉顿:泰勒和弗朗西斯:CRC出版社;2005.gydF4y2Ba
- 4.gydF4y2Ba
Kaur H, Heinzel N, Schöttner M, Baldwin IT, Gális I. R2R3-NaMYB8调节苯丙-多胺缀合物的积累,这对于植物对昆虫食草动物的局部和全身防御至关重要gydF4y2Ba烟草attenuata则gydF4y2Ba。植物科学学报。2010;42(2):344 - 344。gydF4y2Ba
- 5.gydF4y2Ba
罗娟,李志强,李志强,李志强,等。植物类黄酮组成及抗病性的研究进展。2009;gydF4y2Bahttp://europepmc.org/patents/PAT/WO2009103960gydF4y2Ba。2009年8月27日访问。gydF4y2Ba
- 6.gydF4y2Ba
李志强,李志强,李志强,等。通过选择性转录因子的表达富集番茄果实中的健康花青素。生物工程学报。2008;26:1301-8。gydF4y2Ba
- 7.gydF4y2Ba
刘颖,E和英,萨。柑橘类水果的历史、全球分布和营养重要性。食品科学,2012;11:530-45。gydF4y2Ba
- 8.gydF4y2Ba
回顾原花青素和单宁类化合物-性质,发生,饮食摄入和对营养和健康的影响。中国农业科学,2000;gydF4y2Ba
- 9.gydF4y2Ba
原花青素是类黄酮研究的前沿吗?新植物,2005;165:9-28。gydF4y2Ba
- 10.gydF4y2Ba
Scalbert A, Johnson IT, Saltmarsh M.多酚类:抗氧化剂和超过1-3。中华医学杂志,2005;gydF4y2Ba
- 11.gydF4y2Ba
amamorini AM, Lazzarino G, Galvano F, Fazzina G, Tavazzi B, Galvano G. Cyanidin-3-O-β-吡葡萄糖苷保护心肌和红细胞免受氧自由基介导的损伤。自由基决议2003;37:453-60。gydF4y2Ba
- 12.gydF4y2Ba
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物科学,2001;gydF4y2Ba
- 13.gydF4y2Ba
马蒂内利,李丽娟,赵伟,等。阐明黄龙病发病机制的基因调控网络。PLoS ONE。2013; 8: e74256。gydF4y2Ba
- 14.gydF4y2Ba
徐敏,李颖,郑智,戴智,陶勇,邓霞。'病毒严重侵染柑桔的转录分析gydF4y2BaCandidatusgydF4y2BaLiberibacter asiaticus”。科学通报。2015;10:e0133652。gydF4y2Ba
- 15.gydF4y2Ba
王艳,周玲,余旭,Stover E,罗飞,段勇。基于基础抗性的黄龙病耐药和敏感柑橘植株转录组分析揭示了基础抗性在黄龙病耐药中的作用。前沿植物科学,2016;7:933。gydF4y2Ba
- 16.gydF4y2Ba
王宁,王志强,王志强,王志强,等。柑桔茎根对胁迫响应的转录和显微分析gydF4y2BaCandidatusgydF4y2Ba亚洲自由杆菌感染。科学通报。2013;8:e73742。gydF4y2Ba
- 17.gydF4y2Ba
黄酮类化合物在光保护中的多重功能作用。新植物,2010;186:786-93。gydF4y2Ba
- 18.gydF4y2Ba
科尔布CA, Käser MA, Kopecký J, Zotz G, Riederer M, Pfündel EE。自然可见光和紫外线辐射强度对葡萄叶片表皮紫外线筛选和光合作用的影响。植物学报。2001;127:863-75。gydF4y2Ba
- 19.gydF4y2Ba
饶俊梅,丁芳,王楠,邓霞,徐强。柑桔黄龙病宿主的代谢机制研究。植物科学2019;0:1-16。gydF4y2Ba
- 20.gydF4y2Ba
Mafra V, Kubo KS, Alves-Ferreira M, ribeio - alves M, Stuart RM, Boava LP,等。不同实验条件下柑桔基因型转录本规范化的参考基因。公共科学图书馆,2012;7:e31263。gydF4y2Ba
- 21.gydF4y2Ba
范杰,陈超,余强,Khalaf A, Achor DS, Brlansky RH,等。耐受粗柠檬和敏感甜橙对’s胁迫的转录和解剖学比较分析gydF4y2BaCandidatusgydF4y2Ba亚洲自由杆菌感染。植物与微生物相互作用。2012;25:1396-407。gydF4y2Ba
- 22.gydF4y2Ba
陈志伟,陈志伟,陈志伟,陈志伟,等。柑桔药用植物的营养成分及营养价值研究进展。食品功能。2018;9:78 - 92。gydF4y2Ba
- 23.gydF4y2Ba
Agati G, Stefano G, Biricolti S, Tattini M.“抗氧化剂”黄酮苷在叶肉中的分布gydF4y2BaLigustrum vulgaregydF4y2Ba树叶在对比强烈的阳光照射下。Ann Bot, 2009; 104:853-61。gydF4y2Ba
- 24.gydF4y2Ba
柑桔分类的基本讨论。中国科学,1977;14:1-6。gydF4y2Ba
- 25.gydF4y2Ba
李Y, Baldauf S, Lim EK, Bowles DJ。植物udp -糖基转移酶多基因家族的系统发育分析gydF4y2Ba拟南芥gydF4y2Ba。中国生物化学杂志,2001;gydF4y2Ba
- 26.gydF4y2Ba
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,等。拟南芥糖苷转移酶UGT74B1在硫代葡萄糖苷合成和生长素稳态调控中的作用。植物J. 2004; 40:893-908。gydF4y2Ba
- 27.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。类黄酮糖基转移酶的结构揭示了植物天然产物修饰的基础。Embo j . 2006; 25:1396-405。gydF4y2Ba
- 28.gydF4y2Ba
李娟,刘旭,高勇,宗刚,王东,刘敏,等。一种有利于底物和区域特异性黄酮葡萄糖苷生物合成的udp -葡萄糖苷转移酶的植物化学鉴定gydF4y2BaCyclocarya成果gydF4y2Ba。植物化学,2019;163:75 - 88。gydF4y2Ba
- 29.gydF4y2Ba
田东格,西山Y,平井MY,矢野M,中岛J,阿津原M,等。过表达MYB转录因子的拟南芥植物代谢组和转录组整合分析的功能基因组学。植物学报,2005;gydF4y2Ba
- 30.gydF4y2Ba
Fukuchi-mizutani M, Okuhara H, Fukui Y, Nakao M, Katsumoto Y, Yonekura-sakakibara K,等。一种新型udp -葡萄糖花青素3 ' -的生化和分子表征gydF4y2BaOgydF4y2Ba-葡萄糖基转移酶,蓝色花青素生物合成的关键酶,来自龙胆草。植物科学学报,2003;gydF4y2Ba
- 31.gydF4y2Ba
Jones P, Messner B, Nakajima J-I, Schäffner AR, Saito K. UGT73C6和UGT78D1,参与黄酮醇苷生物合成的糖基转移酶gydF4y2Ba拟南芥gydF4y2Ba。中国生物化学杂志,2003;gydF4y2Ba
- 32.gydF4y2Ba
黄晓明,杨晓明,杨晓明,杨晓明,等。柑桔幼苗对干旱和高温的敏感性与次生代谢的激活有关。植物科学,2017;7:1954。gydF4y2Ba
- 33.gydF4y2Ba
刘霞,林超,马霞,谭艳,王娟,曾敏。甜橙黄酮糖基转移酶的功能表征(gydF4y2Ba素类gydF4y2Ba).前沿植物科学,2018;9:1-14。gydF4y2Ba
- 34.gydF4y2Ba
喜多M,平田Y,森口T, Endo-inagaki T,松本R,长谷川S,等。柑桔类柠檬苷udp -糖基转移酶基因的克隆与鉴定。FEBS出版社2000;469:173-8。gydF4y2Ba
- 35.gydF4y2Ba
Daniel JJ, Owens DK, McIntosh CA.次生产物糖基转移酶和推定的糖基转移酶的表达gydF4y2Ba柑橘天堂金花蛇gydF4y2Ba(cv Duncan)成长与发展。植物化学。2011;72:1732-8。gydF4y2Ba
- 36.gydF4y2Ba
Ito T, Fujimoto S, Suito F, Shimosaka M, Taguchi G. c -糖基转移酶催化柑橘植物中二- c -葡萄糖类黄酮的形成。植物学报(英文版);2017;gydF4y2Ba
- 37.gydF4y2Ba
黄东,唐志,傅娟,袁勇,邓霞,徐强。CsMYB3和CsRuby1调控柑橘花青素生物合成的激活-抑制环。植物细胞物理学报。2019;198:1-13。gydF4y2Bahttps://doi.org/10.1093/pcp/pcz198gydF4y2Ba
- 38.gydF4y2Ba
王松,杨超,涂华,周杰,刘鑫,程勇,等。柑橘类黄酮的特征及其代谢多样性。科学通报2017;7:1-10。gydF4y2Ba
- 39.gydF4y2Ba
宣林,王忠,姜林。拟南芥种子原花青素的香兰素含量测定。Bio-protocol。2014; 4: e1309。gydF4y2Ba
- 40.gydF4y2Ba
Butler LG, Price ML, brotonton JE。原花青素(缩合单宁)的香兰素测定:用于估计聚合度的溶剂的改性。农业食品化学。1982;30:10 - 9。gydF4y2Ba
- 41.gydF4y2Ba
Deshpande SS, Cheryan M, Salunkhe DK, Luh BS。食品单宁分析。食品科学,1986;24:41 - 49。gydF4y2Ba
- 42.gydF4y2Ba
张志强,张志强,张志强,等。TTG2通过调控原花青素途径中的液泡转运步骤,控制拟南芥种皮单宁的发育调控。发展生物学,2016;419:54-63。gydF4y2Ba
- 43.gydF4y2Ba
Debeaujon I, Nesi N, Perez P, Devic M, Grandjean O, Caboche M,等。拟南芥原花青素积累细胞的分化调控及其在种子发育中的作用。《植物科学》2003;15:514 - 531。gydF4y2Ba
- 44.gydF4y2Ba
Routaboul J-M, Dubos C, Beck G, Marquis C, Bidzinski P, Loudet O,等。拟南芥类黄酮的代谢产物分析及自然变异的定量遗传学。中国科学(d辑),2012;gydF4y2Ba
- 45.gydF4y2Ba
张志刚,张志刚。花青素在强光胁迫响应中的作用。世界科学,2017;81:150-68。gydF4y2Ba
- 46.gydF4y2Ba
胡赛恩,哈立德,萨奇布,阿玛德,扎法尔,饶MJ,等。柑桔砧木的耐旱性与较好的抗氧化防御机制有关。植物学报。2018;40:135。gydF4y2Ba
- 47.gydF4y2Ba
牛肉EA, Day AM,摩根BA。过氧化氢传感和信号。化学学报。2007;26:1-14。gydF4y2Ba
- 48.gydF4y2Ba
kuukniak E, Urbanek H.过氧化氢在植物胁迫反应中的参与。植物学报,2000;22:195-203。gydF4y2Ba
- 49.gydF4y2Ba
zare - nahandi F, Hosseinkhani S, Zamani Z, Asadi-Abkenar A, Omidbaigi R.柠檬类udp -葡萄糖转移酶延迟表达导致柑橘延迟苦味。生物化学与生物物理学报,2008;gydF4y2Ba
- 50.gydF4y2Ba
韩世义,李俊,金淑梅,郑世杰,金建辉。Byungkyool黄酮糖基转移酶(gydF4y2Ba柑橘platymammagydF4y2Ba长的矮。田中交货)。中国生物医学工程学报,2017;gydF4y2Ba
- 51.gydF4y2Ba
黄艳,司毅,戴恩。嫁接对蜜桃低温响应基因表达的影响(gydF4y2Ba柑橘unshiugydF4y2Ba).Euphytica。2011;177:25-32。gydF4y2Ba
- 52.gydF4y2Ba
李海涛,高光胁迫与光合作用。植物学报。1999;25:3-16。gydF4y2Ba
- 53.gydF4y2Ba
Hasanuzzaman, Hossain MA, da Silva JAT, Fujita M.植物对非生物氧化应激的响应和耐受性:抗氧化防御是一个关键因素。作物胁迫管理展望策略。2012:261-315施普林格。gydF4y2Ba
- 54.gydF4y2Ba
Close DC, Mcarthur C.重新思考许多植物酚类物质对光损伤而非食草动物的保护作用?OIKOS。2002; 1:166 - 72。gydF4y2Ba
- 55.gydF4y2Ba
Karimi M, Inzé D, Depicker A. GATEWAY™农杆菌介导的植物转化载体。植物科学进展,2002;7:193-5。gydF4y2Ba
- 56.gydF4y2Ba
农杆菌介导的花浸渍转化的一种简化方法gydF4y2Ba拟南芥gydF4y2Ba。植物学报(英文版);1998;gydF4y2Ba
- 57.gydF4y2Ba
Kasajima I, Ide Y, ohhama - ohtsu N, Hayashi H, Yoneyama T, Fujiwara T.一种快速提取DNA的方法gydF4y2Ba拟南芥gydF4y2Ba进行PCR分析。植物摩尔生物学报告2004;22:49-52。gydF4y2Ba
- 58.gydF4y2Ba
爱德华K,约翰斯通C,汤普森C.一个简单和快速的方法制备植物基因组DNA PCR分析。核酸决议1991;19:1349。gydF4y2Ba
- 59.gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8。gydF4y2Ba
- 60.gydF4y2Ba
王智,陈敏,陈涛,宣林,李智,杜旭,等。TRANSPARENT TESTA 2在拟南芥种子早期发育阶段通过靶向FUSCA 3调控胚胎脂肪酸的生物合成。植物学报(英文版);gydF4y2Ba
- 61.gydF4y2Ba
用酸化香兰素分析缩合单宁。食品农业科学,1978;29:788-94。gydF4y2Ba
- 62.gydF4y2Ba
Sumanta N, Haque CI, Nishika J, Suprakash R.不同提取溶剂对常见蕨类植物叶绿素和类胡萝卜素的分光光度分析中国科学(d辑),2014;gydF4y2Ba
- 63.gydF4y2Ba
马扎G,高L, Oomah BD.选择性水果、蔬菜和谷物产品中的抗氧化活性和总酚。农学通报。1998;46:413 - 7。gydF4y2Ba
- 64.gydF4y2Ba
Dewanto V,吴X, Adom KK,刘荣荣。热加工通过增加总的抗氧化活性来提高番茄的营养价值。中国农业科学。2002;gydF4y2Ba
- 65.gydF4y2Ba
中田M, Mitsuda N, Herde M, Koo AJK, Moreno JE,铃木K,等。一种bhlh型转录因子,aba诱导的bhlh型转录因子/ ja相关的MYC2-LIKE1,作为抑制因子负调控拟南芥茉莉酸盐信号。植物学报,2013;gydF4y2Ba
- 66.gydF4y2Ba
中田,Ohme-Takagi。花青素含量的定量研究。Bio-protocol。2014; 4: e1098。gydF4y2Ba
- 67.gydF4y2Ba
Özgen M, Scheerens JC, Reese RN, Miller RA。接骨木总酚、花青素含量及抗氧化能力(gydF4y2BaSambucus黄花gydF4y2Bal .)登记入册。Pharmacogn Mag. 2010;6:198。gydF4y2Ba
- 68.gydF4y2Ba
韦利科娃V, Yordanov I, Edreva A.酸雨处理豆科植物的氧化应激和一些抗氧化系统:外源多胺的保护作用。植物科学,2000;gydF4y2Ba
- 69.gydF4y2Ba
冯勇,张敏,郭强,王刚,龚娟,徐勇,等。单泛素调控提高转基因烟草的耐寒性(gydF4y2Ba烟草gydF4y2Ba).植物化学学报,2014;gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
国家重点研发计划项目(2018YFD1000101)、国家自然科学基金项目(31872052、31572105)、广西科技重大专项项目(桂科AA18118046)资助。资助者在研究设计、数据分析和解释以及手稿写作中没有任何作用,而只是提供资金。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
MJR计划并设计了该研究;YX生产的植物材料;MJR进行实验,MJR和TX, YH收集并分析数据;MJR、XD、QX对结果进行解读,MJR撰写稿件,QX、YX对稿件进行修改。所有作者均已阅读并批准最终稿。gydF4y2Ba
作者的信息gydF4y2Ba
MJR,gydF4y2BaORCID ID:gydF4y2Ba0000-0003-4911-9451。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1gydF4y2Ba
。显示本研究用于基因表达分析的qPCR引物序列。gydF4y2Ba图S1。gydF4y2Ba显示了不同时期柑橘品种的基因表达规律。SWO:gydF4y2Ba甜橙gydF4y2Ba;阿瑟:gydF4y2BaAtalantia buxifoliagydF4y2Ba;重心:gydF4y2Ba植物gydF4y2Ba。gydF4y2Ba图S2gydF4y2Ba。表达了干旱和强光胁迫下的基因表达结果gydF4y2Ba素类gydF4y2Ba叶子。14 HLS,强光胁迫14天;14DDS:干旱胁迫14 d后。数值为三个重复的平均值±SE,并使用Student 's t检验比较对照和胁迫植物gydF4y2BapgydF4y2Ba< 0.05。(*)意义:gydF4y2BaPgydF4y2Ba< 0.01(**)极显著。gydF4y2Ba表S2。gydF4y2Ba显示本研究中使用的代谢物的细节和模式。gydF4y2Ba图S3。gydF4y2Ba利用不同柑橘种质(AB;gydF4y2BaAtalantia buxifoliagydF4y2BaCG;gydF4y2Ba植物gydF4y2Ba,和CS;gydF4y2Ba素类gydF4y2Ba).列表示黄酮和花青素的品种和行。gydF4y2Ba
附加文件2:gydF4y2Ba
12个关键基因的原始转录组数据:代表了三个柑橘物种在不同发育阶段(种子、叶子、花和果实)的基因表达模式数据。SWO:gydF4y2Ba甜橙gydF4y2Ba;阿瑟:gydF4y2BaAtalantia buxifoliagydF4y2Ba;重心:gydF4y2Ba植物gydF4y2Ba。gydF4y2Ba
附加文件3:图S1。gydF4y2Ba
显示本研究中使用的不同基因的表达。WT:野生型,EV:空向量,OE:过表达。值为三个重复的平均值±SE,使用Student 's t检验比较78D3-OE和WT,gydF4y2BapgydF4y2Ba< 0.05(*)显著;gydF4y2BapgydF4y2Ba< 0.01(**)极显著。基因id取自拟南芥基因组网站TAIR (gydF4y2Bahttps://www.arabidopsis.org/gydF4y2Ba).gydF4y2Ba
附加文件4:表S1。gydF4y2Ba
显示了参与黄酮和花青素途径的转录因子和酶的基因ID及其用于qRT-PCR的引物序列。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
饶明杰,徐艳,黄艳,黄艳。gydF4y2Baet al。gydF4y2Ba柑橘udp - glucosytransferase基因的异位表达提高了拟南芥花青素和原花青素的含量,提高了拟南芥的耐光性。gydF4y2BaBMC植物生物学gydF4y2Ba19日,gydF4y2Ba603(2019)。https://doi.org/10.1186/s12870-019-2212-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2212-1gydF4y2Ba
关键字gydF4y2Ba
- 柑橘类gydF4y2Ba
- 原花青素gydF4y2Ba
- 总黄酮含量gydF4y2Ba
- 花青素gydF4y2Ba
- 光保护gydF4y2Ba
- 拟南芥gydF4y2Ba