抽象的
背景
棉花的黄萎病是一种严重的土壤传导疾病,导致棉花产量大幅降低。先前的研究表明内生真菌毛壳菌属globosumCEF-082对棉花黄萎病具有一定的防治作用,并诱导棉花植株产生防御反应。然而,控制这种反应的综合分子机制尚不清楚。
结果
为了研究CEF-082诱导的信号转导机制,对经CEF-082预处理的棉花幼苗进行转录组测序。结果表明,接种CEF-082 24 h后,产生5638个DEGs,接种CEF-082 12 h后,产生2921个DEGs,接种CEF-082 48 h后,产生2153个DEGs黄萎病dahliae, 分别。在与CEF-082接种后24小时,Kegg浓缩分析表明,该DEG主要富含植物病原体相互作用,MAPK信号通路 - 植物,黄酮类生物合成和苯丙烷化生物合成途径。只有1209只特异性诱导棉花植物接种V. Dahliae.在生物控制真菌CEF-082的存在下,而不是仅接种棉花植物时V. Dahliae..GO分析显示,这些可富集主要是以下术语:ROS代谢过程,H2O2代谢过程,防御反应,超氧化物歧化酶活性和抗氧化活性。而且,许多基因,如ERF.,CNGC.,FLS2,my,GST.和CML.研究人员发现,在与防御相关的途径中,调控关键点的基因可能有助于V. Dahliae.电阻在棉花。这些结果为了解生防菌CEF-082提高棉花抗黄萎病能力的分子机制提供了依据。
结论
本研究结果表明,CEF-082能够调控棉花的多种代谢途径。治疗后,V. Dahliae.,加强了用CEF-082预胶的棉花植物的防御反应。
背景
棉(GossypiumSPP。)是全球培养的重要经济作物。棉花的黄萎病是一种严重的血管疾病,可根据棉花产量和纤维质量进行;1是由土壤传播的真菌引起的黄萎病dahliaeKleb。这种疾病可引起泛黄,枯萎,脱落,最终棉花植物死亡[2],病原菌作为土壤微菌核长期存活,寄主范围广,难以控制[3.].到目前为止,还没有发现能消除陆地棉黄萎病的杀菌剂(陆地棉L.)植物感染后[2,4,5].
目前,使用生物对照剂是一种有希望的,更环保的策略来控制棉花的垂直枯萎病毒[6].许多研究表明,各种生物对照剂可以在不同宿主物种中抑制黄藻枯萎病毒[7,8].Iturins调解防御反应,并显着激活PR1,液态氧,PR1024小时后V. Dahliae.感染(9].CEF-818产生的非挥发性物质(青霉菌simplicissimum),CEF-325(腐皮镰孢霉菌英语- 714 (),Leptosphaeriasp.)和CEF-642 (Talaromyces flavus.)抑制V. Dahliae.增长(10].Fusarium oxysporum47 (Fo47)减轻了辣椒黄萎病的症状;三个防御基因的表达,CABPR1,cachi2.和CASC1,在根中上调[11].枯草芽孢杆菌Dzsy21减少了南方玉米叶的疾病严重程度,并上调了表达水平PDF1.2[12].花椰菜的预接种verticillium.VT305减少症状发展和植物组织的定植黄萎病longisporum[13].多种真菌和细菌菌株对橄榄黄萎病表现出生防活性。这些微生物保护植物免受各种病原体的有害影响,引起诱导系统抗性(ISR),竞争营养物质和定殖空间,或通过生产植物激素和传递营养物质促进植物生长[14].
据报道,在感染的棉花植物中诱导了一系列免疫反应V. Dahliae..近年来,对侵染植物防御反应的转录组学研究V. Dahliae.已经鉴定出了多种信号转导途径和关键基因,包括棉花中参与植物激素信号转导、植物与病原互作、苯丙氨酸相关和泛素介导信号的信号转导途径;此外,这些研究还调查了关键调控基因家族的成员,如受体样蛋白激酶(receptor-like protein kinase, RLKs)、WRKY转录因子和细胞色素p450 (cytochrome p4500s, CYPs) [3.].表达水平苯丙氨酸ammonia-lyase(朋友),4-coumarate-CoA连接酶(4 cl),肉桂醇脱氢酶,caffeoyl-CoA O-methyltransferase (CCoAOMT),Caffeoyl O-甲基转移鼠(COMT)在苯丙氨酸代谢途径中,已显示在海岛棉中上调[2];401个转录因子(TFs)的表达水平,主要在MYB, bHLH, AP2-EREBP, NAC和WRKY家族中,已被证明是响应的上调或下调V. Dahliae.在拟南芥蒂利亚纳[15];环核苷酸门控通道(CNGC)、呼吸暴发氧化酶同源物(RBOH)、鞭毛蛋白敏感2 (FLS2)、茉莉酸ZIM结构域含蛋白(JAZ)、转录因子MYC2、调控蛋白NPR1和转录因子TGA等基因已被诱导V. Dahliae.在向日葵[16].有几项研究调查了植物在生物防治剂作用下的转录水平[17,18].
在先前的研究中,我们发现内生真菌毛壳菌属globosum从旱地棉花植物中分离的CEF-082抑制了生长V. Dahliae.提高棉花对黄萎病的抗性[19].然而,CEF-082诱导的信令机制是未知的。因此,本研究的目的是揭示CEF-082通过RNA序列分析揭示CEF-082对棉花枯萎的棉花抗性的分子机制。
结果
CEF-082对棉花和H疣枯萎病的控制作用2O2内容
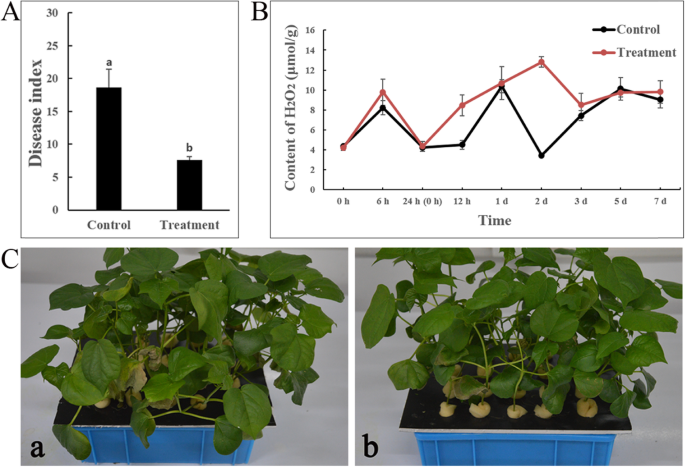
对照组疾病指数为18.61V. Dahliae.治疗组(CEF-082 +中)和7.62V. Dahliae.) 14 d后V. Dahliae.接种(图。1结果表明,CEF-082增强了棉花对黄萎病的抗性,生防效果为59.1%(图2)。1C)。
H2O2在实验的大部分时间内,治疗组的含量高于对照组,在5 dpi时低于对照组V. Dahliae..H2O2治疗组中的含量在2dpi(12.80μmol/ g),H.2O2对照组含量最高为1 dpi (10.38 μmol/g)。两组的变化相似,并在5 d后趋于稳定。1b)。
qRT-PCR验证RNA-Seq分析
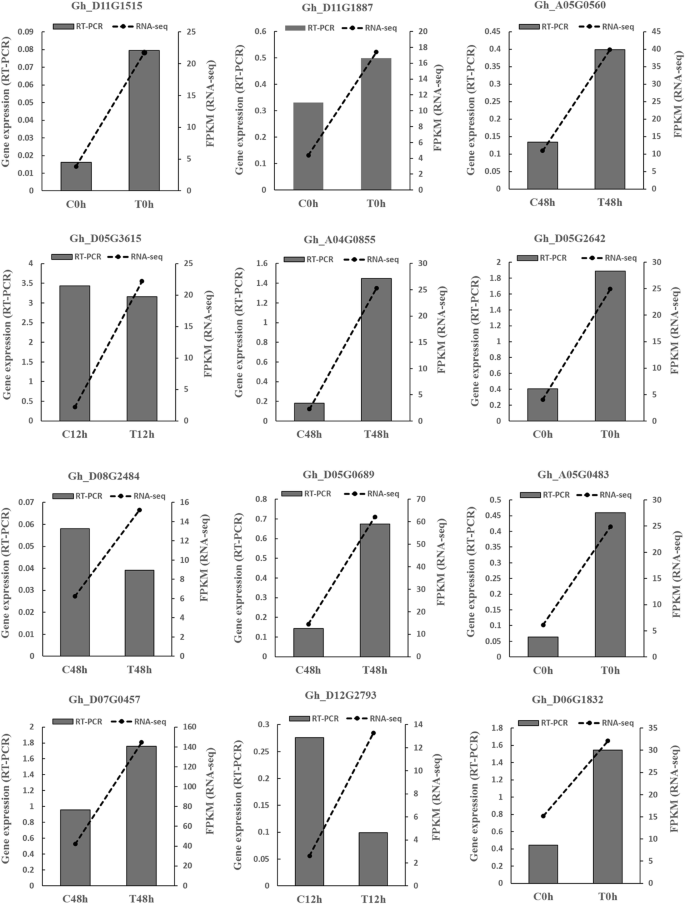
随机选取12个deg。采用qRT-PCR方法比较对照组和治疗组的基因表达水平。RNA-seq数据显示,这12个基因在0 h、12 h和48 h表达上调。qRT-PCR结果显示,12个基因中有9个基因表达上调,这与它们在转录组中的表达上调结果一致;但有3个基因表达下调,与转录组表达不一致,即:gh_d12g2793,Gh_D08G2484和Gh_D05G3615(无花果。2).此外,QRT-PCR数据中5个基因的上调水平低于RNA-SEQ数据中的5个基因。QRT-PCR数据高达75%与转录组数据一致。
egs的功能注释和富集分析
三个重复之间的最小相关性为95.5%(附加文件1:图S1)。18个阵列的主成分分析(PCA)(附加文件2(图S2)比较样品,探讨CEF-082和CEF-082处理后棉花转录组的动态变化诉dahliae。
18个样本的平均清洁读数为62.08米。清洁读数的最低Q20值为97.93,最低Q30值为90.06(附加文件9:表S2)。发现共有47,183个新的转录物,其中7288属于新的蛋白质编码基因(附加文件10:表S3)。
的re were 3480 upregulated and 2158 downregulated DEGs at 0 h, 1716 upregulated and 1205 downregulated DEGs at 12 h, and 1524 upregulated and 629 downregulated DEGs at 48 h. The greatest number of DEGs was identified after inoculation with CEF-082 for 24 h. After inoculation withV. Dahliae.,Deg的数量逐渐减少。
CEF-082在0 h诱导DEGsV. Dahliae.接种
用CEF-082接种24小时(0小时),鉴定5638次,浓缩分析显示出15种显着富集的途径,包括植物病原体相互作用,MAPK信号通路 - 植物,黄酮类生物合成,苯丙烷化生物合成,半乳糖新陈代谢,arachidonic acid metabolism, carotenoid biosynthesis, glutathione metabolism, sesquiterpenoid and triterpenoid biosynthesis, linoleic acid metabolism, other glycan degradation, glycosphingolipid biosynthesis - ganglio series, brassinosteroid biosynthesis, diterpenoid biosynthesis and sphingolipid metabolism (Q-value < 0.05) (Table1).在植物病原体相互作用途径中,有106个FLS2基因,88上调和18下调;7rboh.基因,5个上调和2下调;5上调钙依赖性蛋白激酶(CDPK基因;5CNGC.基因,3个上调和2下调;和57谷胱甘肽S-转移酶(GST.)在谷胱甘肽代谢途径中的基因,其中49的上调和下调8(图。3.).这些基因与活性氧(ROS)和钙的代谢有关2+.在MAPK信号通路工厂途径中,304次调节与ROS,CA相关的30个关键点2+,脱落酸(ABA),乙烯(ET),茉莉酸(JA),H2O2和FLS2。在类黄酮生物合成途径中,诱导了查尔酮合成酶(chalcone synthase, CHS)和阿ferulic -5-羟化酶(ferulic -5-hydroxylase, F5H)基因的表达。在苯丙类生物合成途径中,关键基因朋友和4CL.也被诱导。
GO富集分析表明,5638个基因主要富集在86个方面,包括膜的固有成分、膜的整体成分、膜的部分、膜、催化活性、对生物刺激的响应、细胞壁、氧化还原酶活性、防御反应、对刺激的响应、对胁迫的响应、和对真菌的响应(q值< 0.001),前15项列于表中2.16个基因中15个表达上调,1个表达下调。GO分类显示,生物过程、细胞成分和分子功能分别有18、14和12项,KEGG分类显示,DEGs主要属于代谢途径(2856)。
CEF-082的DEGS COMED CEF和V. Dahliae.
在12和48 h时,463个共享的DEGs在6个KEGG通路中显著富集(见表)3.).在植物病原体相互作用途径中,29℃下调8个关键点,包括CNGCs,钙调蛋白(CAM),FLS2,抗病蛋白RPS2(RPS2),热休克蛋白90kDA(HSP90),PTO相互作用蛋白1(PTI1),抗病蛋白RPM1(RPM1)和EIX受体1/2(EIX1 / 2)。在苯丙醇丙烷生物合成途径中,23℃调节9个关键点。在黄酮类生物合成途径中,12次调节8个关键点。富集的GO条款包括萜类代谢过程,氧化还原酶活,防御反应,H2O2代谢过程和ROS代谢过程术语。
仅在棉花接种的棉花诱导V. Dahliae.在CEF-082的存在下
在12小时和48小时内鉴定了总共1209种,仅在接种的棉花植物中诱导V. Dahliae.在CEF-082的存在下,但不是当棉花植物接种时V. Dahliae.只要。簇热点显示在不同阶段的这些基因的表达模式(附加文件3.:图S3)。KEGG分类结果显示,这些DEGs主要属于代谢(672个),并在5个KEGG通路中显著富集,包括类黄酮生物合成、吲哚生物碱生物合成、MAPK信号通路-植物、植物-病原互作和苯丙素生物合成(表)4).GO分类结果显示,在生物过程、细胞成分和分子功能方面分别有14、12和9个术语。氧化石墨烯富集表明这些DEGs在ROS代谢过程中富集(14 DEGs), H2O2代谢过程(12 DEGs)2O2分解代谢过程(12次),防御反应(31℃),超氧化物歧化酶活性(5℃,抗氧化活性(19℃),作用于超氧化物自由基作为受体(5℃),辅因子结合(75℃)和抗氧化剂酶活性DNA绑定(121次)(附加文件4:图S4)。
在12小时和48小时,获得96个共用次数,仅在接种的棉花植物中诱导V. Dahliae.在CEF-082的存在下,但不是当棉花植物接种时V. Dahliae.(额外的文件5:图S5)。通过KEGG分析,96个DEGs主要富集谷胱甘肽代谢和类黄酮生物合成(见表1)5).氧化石墨烯分析表明,DEGs具有丰富的超氧化物歧化酶活性、氧化还原酶活性、作为受体作用于超氧化物自由基和抗氧化活性。在96个deg中,9个编码的tf和20个编码的预测prg(附加文件11:表S4)。
蛋白质 - 蛋白质互动网络(附加文件6:图S6)通过在12小时和48小时之间共享的96℃和与它们以棉花相互作用的其他基因构成。获得六个枢纽基因,Gh_A05G1020,gh_d09g0858.,BGI_novel_G004376,gh_a08g0125,Gh_D07G1197和gh_a05g3508.其中,Gh_D07G1197在黄酮类生物合成途径中注释。
推定的R基因和TFS涉及耐霉菌枯萎病
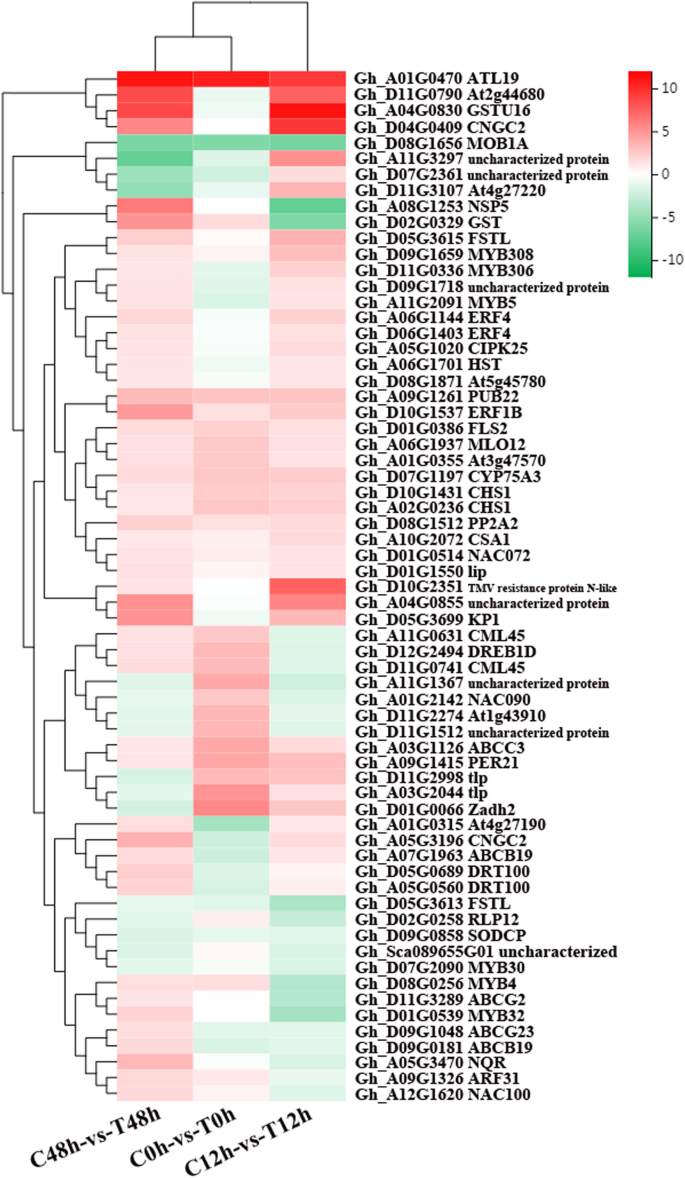
转录组分析的基础上,共有65个候选基因可能与棉花的抗黄萎病,包括5主办(其成员包含一个NB-ARC域),3中枢神经系统(成员U-box domain-containing蛋白激酶家族蛋白),5 NLs(其成员包含一个NBS-LRR域),7针对(其成员包含eLRR-TM-S / TPK域),7 Ns(其成员只包含一个国家统计局域),9 TNLs (TIR-NBS-LRR类的成员),6 Ts (NAC成员域包含蛋白质17),1 Mlo-like (Mlo-like耐药蛋白的一员)和2其他类型(电阻功能但不符合已知的类)。这些基因主要包括一个抗病蛋白、2个可能的钙结合蛋白(CML45)、3个乙烯响应转录因子(ERF)、2个环核苷酸门控离子通道2 (CNGC2)、5个MYB转录因子和2个GST(见表)6,7和8).65个基因的聚类热图(图。4)显示某些基因在0、12和48 h表达上调;某些基因在0 h表达下调,12和48 h表达上调;某些基因在0、12和48 h表达下调。
讨论
在12小时和48小时下鉴定的含量的数量低于0小时的鉴定。这些病例中的次数可能降低,因为植物被感染了V. Dahliae.并开始反击。CEF-082处理与CEF-082+处理之间的差异V. Dahliae.主要富集于5个信号通路:植物-病原互作、MAPK信号通路-植物、类黄酮生物合成、苯丙素生物合成和谷胱甘肽代谢。在感染向日葵植株中还诱导了植物与病原菌的相互作用和类黄酮的生物合成途径V. Dahliae.[16],结果也与Tan的结果一致[20.研究发现,番茄中大多数DEGs与苯丙类代谢和植物-病原互作途径有关。然而,在棉花转录组中谷胱甘肽代谢途径的报道却很少V. Dahliae..
很明显,植物对生物或非生物胁迫的反应依赖于几种信号通路的相互作用,包括JA、ET、水杨酸(SA)或ABA [21,22].Morán-diez等。[17]发现SA-和JA相关的DEG被下调答:芥孵育24小时后trichoderma harzianumT34。当病原菌攻击时,诱导一组受JA或ET影响的DEGs答:芥以前由光合殖民殖民Bradyrhizobium.sp。菌株,ORS278 [18].与ET,SA,JA,Brassinosteroid(Br)和细胞蛋白相关的次数进行了上调或下调V. Dahliae.棉花感染[3.].本研究还发现,无论是CEF-082处理后,还是接种后,ABA、生长素和赤霉素中的DEGs均显著诱导V. Dahliae..此外,与JA,ET,SA,BR和Cytokinin相关的DEG在仅用CEF-082处理的棉花植物中诱导。感染后也诱导了8种植物激素V. Dahliae.在向日葵[16].答案答:芥在感染时损害了蟾蜍素受体TiR1,AFB1和AFB3和养蛋白转运仪AXR4V. Dahliae.[23].因此,CEF-082和CEF-082V. Dahliae.会引起荷尔蒙的变化。
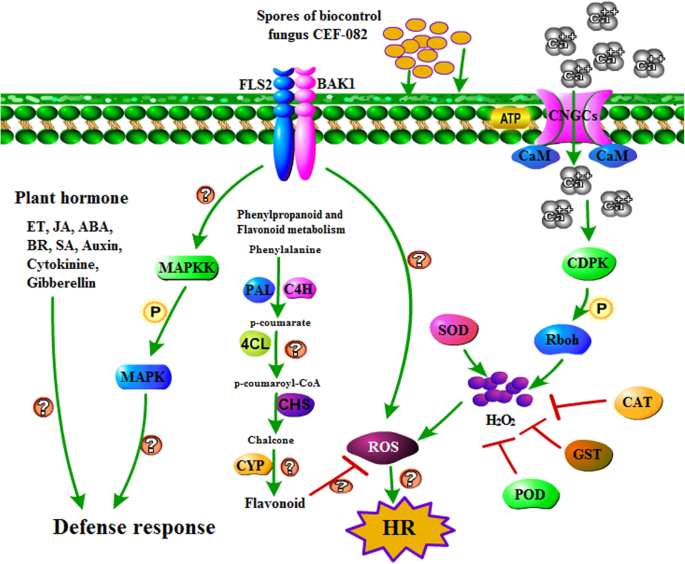
此前研究表明,植物感染病原体后,FLS2模式识别受体识别病原体,并通过ROS、JA、wrky和NO信号通路激活超敏反应(hypersensitive response, HR) [24,25],并由CNGC、RBOH、CaM/CML和FLS2介导[26,27,28].这些结果与本研究结果一致。本研究中,CEF-082处理24 h后,植物FLS2、Rboh、CDPK、CNGCs和GST的DEGs也不同程度上调或下调(图2)。3.).此外,大多数编码过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的基因也表达上调。这些基因与ROS的积累有关。治疗后48小时V. Dahliae.,编码CNGC,CAM / CML和FLS2的基因被上调。然而,在本研究中,没有诱导NO信号通路。
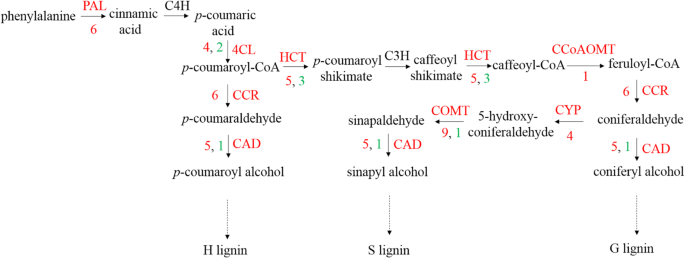
苯丙烷合成与棉花防御机制有关[29],而已知类黄酮可以缓冲应激引起的ROS稳态变化,并调节ROS信号级联[30.].植物CNGC亚基和凸轮构成一个分子开关,可打开或关闭钙通道[31].先前的报道显示,钙依赖的CDPK4和CDPK5通过磷酸化马铃薯NADPH氧化酶来调节ROS的产生[32].ROS不仅是重要的防御信号机制[33还可以通过建立HR来调节程序性细胞死亡[34].MAPK家族成员可以提高棉花对黄萎病的抗性[35].在本研究中,接种CEF-082 24 h后,植物对CEF-082的响应可能涉及某些信号转导途径(图2)。5).接种CEF-082后,FLS2识别CEF-082,诱导MAPK信号转导,钙通道打开。H2O2然后产生,导致活性氧爆发。植物激素也被诱导,包括ET、SA、JA、ABA、BR、生长素、赤霉素和细胞分裂素。黄酮类化合物和苯丙烷合成的信号通路也参与了这一过程。此外,CEF-082处理后诱导木质素合成(图2)。6).数字6指miedes等人的木质素生物合成途径。[36].肉桂醛4-羟化酶(C4H.) 和p-香豆素3羟基酶(C3.)在T0H-Vs-COH,T12H-Vs-C12H或T48 H-Vs-C48H中未诱导,但在C12H-VS-COH中诱导,其类似于Xu等人的结果。[37,他指出了这一点C4H-1和C4 h-3治疗后上调V. Dahliae..接种后三天V. Dahliae.,木质素和CEF-082 +的髓直径V. Dahliae.- 治疗植物略大于水+V. Dahliae.- 治疗植物(附加文件7:图S7)。T12 H和T48 H的防御响应类似于T0 h,并且在途径中仅诱导的几个关键点不同,在图1和2中示出。5和6.因此,推测CEF-082减少了棉花黄萎病枯萎病的发生,因为与CEF-082的接种可以使涉及防御的信号传导途径V. Dahliae.感染后。
木质素生物合成途径。该图是指Miedes等人的木质素生物合成途径。[36].红色或黑色表示CEF-082诱导或未诱导的关键点。红色的数字表示上调基因的数量,绿色的数字表示下调基因的数量。朋友,苯丙氨酸ammonia-lyase;C4H,肉桂酸4-hydroxylase;4 cl, 4-coumarate-CoA连接酶;摘要:,p-carmarate 3羟基化酶;HCT,羟基氨基酰基转移酶;CCR,肉桂酰CoA还原酶;CAD,肉桂醇脱氢酶;CCOAOMT,Caffeoyl-CoA O-甲基转移酶;F5H,错配5-羟化酶。图6是Miedes E的图的一部分,然后添加了上调和下调的基因的数量,并通过我们自己绘制,没有从纸上复制。在图6中上调和下调的基因号是我们来自RNA-SEQ的数据
当病原体感染植物时,它们会诱导一系列的防御反应。GST参与植物防御,可以删除ROS [38].植物gst可细分为八类,phi, zeta, tau, theta, lambda,脱氢抗坏坏酸还原酶(DHAR),延伸因子1 gamma (EF1G)和四氯氢醌脱卤酶(TCHQD) [39].GSTF8.已被用作早期压力和防御反应的标志[40]和Ja,茉莉酸甲酯,aba和h2O2可以诱导GST.表达 [41,42,43].LrGSTU5治疗后显然是上调的Fusarium oxysporum[44),GST.基因也上调g .取得处理V. Dahliae.[45].在这项研究中GST.CEF-082处理24 h后,基因也被显著诱导(图2)。3.),GST.棉花经水+处理后基因表达上调V. Dahliae..这些结果与Han等人的结果一致。和张等人。[44,45].某些GST.治疗组基因也有明显的诱导,而对照组则无明显的诱导诉dahliae。的GST.基因gh_a09g1509显示在烟草中增加对Verticillium枯萎的抗性[46].因此,我们认为CEF-082具有特异性诱导作用GST.保护棉花的基因V. Dahliae..
V. Dahliae.在感染棉质后可以诱导防御反应[3.].本研究将感病棉花品种接种生防菌CEF-082V. Dahliae.,这也诱导了一系列防御响应。与接种水+的植物相比V. Dahliae.,接种CEF-082 +的植株V. Dahliae.耐药相关基因表达明显上调或下调。因此,推测生防菌CEF-082接种后防御反应增强。此外,我们获得了1209个特异性的DEGs,这些DEGs在水+接种的植物中没有被诱导V. Dahliae.,但只在接种CEF-082 +的植株上诱导V. Dahliae..富集表明这些基因参与了ROS代谢过程。在CEF-082治疗后,棉的抗病抗性增强,因此,我们推断这些特定的参数可能是与植物疾病抗性有关的基因。
结论
CEF-082可诱导棉花的防御反应,并以适当的浓度为CEF-082进行预处理5孢子/ ml可以改善棉花(Jimian 11)的抗性转移到黄萎病枯萎病。转录组分析显示,在罗斯爆发,CA中涉及棉花叶片的基因2+木质素生物合成、黄酮类化合物和苯丙烷合成均显著上调或下调。CEF-082处理棉花植株可诱导防御反应,且接种CEF-082处理棉花植株的防御反应较强V. Dahliae.在CEF-082的存在下。此外,仅在接种的植物中诱导1209种特定的DEGSV. Dahliae.在获得生物控制真菌CEF-082的存在下。
方法
真菌菌种
棉花内皮细胞C.球状将CEF-082培养在马铃薯葡萄糖琼脂(PDA)板上培养20天。通过向每个板添加无菌水来获得孢子,在菌落中摩擦无菌刮刀,然后通过无菌乳酪封装过滤悬浮液,然后将悬浮液稀释至1×105孢子/毫升。V. Dahliae.VD1070-2在PDA培养7天,接种到液体Czapek-Dox培养基中[47],在25℃,150 rpm暗培养7 d。滤除菌丝,滤液稀释至1 × 107孢子/ ml孢子悬浮液。
棉花接种治疗
Jimian 11,一种高度垂直的枯萎的普通棉花品种,由Heqin Zhu教授提供来自棉花生物学研究所的棉花生物学研究所的国家重点实验室。它是一种选自杂交十字的品种[(Jihan 4×Ke 4104)f2×74 yu102]。用70%酒精消毒1 min, 1.05%次氯酸钠消毒10 min,然后用无菌水冲洗5次。棉花种子种植在蛭石中,出苗后转移到25 cm × 15 cm的塑料罐中,装2000 mL液体培养液。培养液按照Zhang等的方法配制[48,只做了一些修改。本试验采用2 mM NaCl代替2.5 mM KCl,其余9种矿质营养成分相同。在塑料罐上放置了一块有20个孔的黑色泡沫板,并将棉花放入孔中,并用海绵支撑。每个处理每盆20株,每个处理重复3次。每个处理从塑料盆中取出20株棉花,将棉花根部浸泡在300 mL的1 × 10培养基中接种CEF-0825孢子/mL悬液40 min,第一片真叶变平。对照组用水代替CEF-082孢子悬浮液。然后把棉花放回花盆里。在0 h、6 h和24 h后,每个处理每个生物重复的每个时间点随机采集5片叶片,24 h视为接种前0 hV. Dahliae.(24小时(0小时))。用CEF-082接种后24小时,使用相同的方法接种V. Dahliae.VD1070-2(1×107孢子/mL)。分别于12 h、1 d、2 d、3 d、5 d和7 d采集叶片样品,每个生物重复每个时间点随机采集5片叶片。包括三个生物学重复。
过氧化氢(H2O2) 内容
H2O2根据Sharma等人的方法估计内容。[49]微小修改。称量大约0.1g棉花叶并加入1ml丙酮中,用于冰浴均质化。然后将样品以8000×g和4℃离心10分钟,收集上清液。然后,加入25μL浓浓HCl和200μl氨溶液(17μm)的20%氯化钛。用丙酮洗涤沉淀物3次。之后,将洗涤的沉淀物溶于1.5ml H中2所以4(2 N),在415 nm处读取吸光度。
生防菌CEF-082对棉花黄萎病的防治效果
用VD1070-2在14d接种(DPI)后研究了上述水培幼苗。根据基于棉花幼苗的黄萎病枯萎病的五种规模分类的疾病指数,疾病严重程度进行评级[50].
RNA测序(RNA-SEQ)
使用多糖多酚RNA提取试剂盒(天根,北京)从棉花叶中提取RNA。进行电泳,并使用一滴(1000+)分光光度计检测RNA的浓度和质量。对24小时(0h(T0H,COH)),12小时(T12H,C12H)和48小时(T48 H,C48H)样品进行转录组测序。T0 H,T12H和T48H分别代表治疗组中的0,12和48h样品,COH,C12H和C48H分别代表对照组的0,12和48h样品。进行三种生物重复,并有18个样品。DNA文库和测序的构建是由北京基因组学研究所(BGI)进行的。使用SOAPnuke软件(BGI,Beijing)执行数据过滤。通过去除包含适配器的读取来获得清洁读取,读取超过5%的N和低质量序列。干净的读数被拼接并与参考值对齐g .分子基因组从棉花基因组网站中检索(https://www.cottongen.org/).计算每千碱基每转录本每百万mapping reads (FPKM)值,并用于估算测序深度和基因长度对mapping reads计数的影响。
差异表达基因(DEGs)的筛选与分析
The DEGseq R package(1.20.0)[详细信息]51[用于在纠正的标准下分析棉花叶中的棉花叶片或在CEF-082的标准下进行分析P值<0.001和绝对的log2比率≥1。转到(基因本体)术语和kegg(基因和基因组的京都甲基甲虫)途径(如果)富含DegsP值< 0.001。通过对植物抗性基因(PRG)数据库(identity≥40,E-Value <1E-5)[52].预先编码的TFS(E-value <1E-5)根据植物转录因子数据库[53].
定量逆转录-PCR(QRT-PCR)分析
植物病原体相互作用途径和R基因对于植物抗性很重要。随机选择涉及植物病原体相互作用途径和预测R基因的12次,以验证其表达的趋势是否与转录组测序结果一致。从三个复制实验中收集数据,用于QRT-PCR的样品与用于RNA-SEQ的样品相同。从样品叶中提取RNA并逆转录成cDNA。通过Bio-rad CFX96实时系统(Bio-rad,USA)进行QRT-PCR,并且每个PCR混合物(20μl)由10μl超级预混物加上Sybr绿色(天根),0.4μl的每个引物组成,2μLcDNA和7.2μl无菌水。每个样本涉及至少三种技术重复。PCR循环由95℃的初始变性步骤组成10分钟,其次是95℃的40个循环,30s,60℃,30s和72℃。棉花泛素以基因为内参,用2-Δct.方法。引物来自陆地棉基因荧光定量特异性引物数据库(https://biodb.swu.edu.cn/qprimerdb/)(额外的文件8:表S1)。
缩写
- 4 cl:
-
4-coumarate-CoA连接酶
- 阿巴:
-
脱盐酸
- BR:
-
芸苔类固醇
- C3h:
-
p-香豆素3羟基酶
- C4H:
-
肉桂醛4-羟化酶
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 猫:
-
催化剂
- CCoAOMT:
-
Caffeoyl-CoA O-methyltransferase
- CDPK:
-
钙依赖性蛋白激酶
- CHS:
-
Chalcone合成酶
- CML:
-
钙结合蛋白
- COMT的:
-
咖啡酰o-甲基转移酶
- CYP:
-
细胞色素P450蛋白质
- ERF:
-
乙烯响应转录因子
- 等:
-
乙烯
- F5H:
-
发错-5-羟化酶
- FLS2:
-
Flagellin-sensitive 2
- 销售税:
-
谷胱甘肽S-转移酶
- 人力资源:
-
过敏的反应
- HSP90:
-
热休克蛋白90 kda
- 是:
-
茉莉酸
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- 圆荚体:
-
过氧化物酶
- Pti1:
-
PTO相互作用蛋白1
- QRT-PCR:
-
定量逆转录PCR
- RBOH:
-
呼吸爆发氧化酶同源物
- ROS:
-
活性氧
- RPS2:
-
抗病蛋白RPS2
- SA:
-
水杨酸
- 草皮:
-
超氧化物歧化酶
参考文献
- 1.
田军,张学勇,梁保国。棉花杆状病毒抗凋亡基因p35和op-iap的表达(陆地棉提高对黄萎病的耐受性。《公共科学图书馆•综合》。2010;5 (12):e14218。
- 2.
孙强,姜洪辉,朱学勇,王宁华,何晓华,石玉忠,袁玉良,杜晓明,蔡玉峰。海岛棉与陆地棉响应分析黄萎病dahliae通过RNA测序。BMC基因组学。2013;14:852。
- 3.
张伟伟,张慧聪,刘凯,简国良,齐福军,司宁陆地棉相关的基因黄萎病dahliae通过比较转录组和反向遗传学分析。《公共科学图书馆•综合》。2017;12 (8):e0181609。
- 4.
关键词:棉花,黄萎病,天麻,抗真菌蛋白,基因表达,抗病性摩尔。2016;9(10):1436 - 9。
- 5.
张Y,王XF,荣W,杨杰,李泽,吴lq,张gy,ma zy。组织化学分析揭示了强大的内在防御海岛棉而不是g .分子与抵抗黄萎病dahliae.植物与微生物学报,2017;30(12):984-96。
- 6.
袁勇,冯慧娟,王立峰,李志峰,石玉强,赵丽华,冯志林,朱红旗。棉花根内生真菌对黄萎病生物防治的潜力。《公共科学图书馆•综合》。2017;12 (1):e0170557。
- 7.
Berg G,Fritze A,Roskot N,Spalla K.来自不同宿主植物的潜在生物控制流离失核的评估黄萎病dahliaeKleb。应用微生物学报2001;91:963-71。
- 8.
Giovanni B,Antonio Domenico M,Margherita D,Mario A,Matteo C.评估链霉菌番茄木栓根和茄子黄萎病的生物防治。应用生态学报。2013;72:128-34。
- 9.
韩Q,吴佛,王Xn,齐,施,仁,刘qh,zhao mw,唐厘米。细菌脂肽铁蛋白诱导黄萎病dahliae通过影响真菌信号通路和介导与病原体相关的分子模式触发免疫有关的植物防御反应的细胞死亡。环境Microbiol。2015;17(4):1166 - 88。
- 10.
李泽,王某,冯泽,赵立,施悉,朱h。来自不同疣抗性的内生真菌的多样性陆地棉并评估抗真菌活动Verticillium dahliae体外.J microbiol biotechnol。2014; 24(9):1149-61。
- 11.
Veloso J, Díaz J。Fusarium oxysporumFo47将保护赋予辣椒植物黄萎病dahliae和Phytophthora Capsici.,诱导防御基因的表达。植物病理学研究。2012;61(2):281 - 8。
- 12.
丁涛,苏波,陈晓军,谢世生,顾淑英,王强,黄大元,江海云。杜仲内生菌对南方玉米叶枯病的抑制作用。Microbiol前面。2017;8:903。
- 13.
Tyvaert L,Franças,debode j,höftem.ideophyteverticillium.Vt305保护花椰菜防止黄萎病。应用微生物学杂志。2014;116:1563-71。
- 14.
Varo A,Raya-Ortega MC,Trapero A.选择和评估生物控制的微生物黄萎病dahliae在橄榄。应用微生物学杂志。2016;121:767-77。
- 15.
苏晓峰,卢国强,郭红梅,张可欣,李晓坤,程红梅。动态转录组和代谢组分析黄萎病dahliae接种过的拟南芥蒂利亚纳.Sci众议员2018;8(1):1 - 11。
- 16.
郭sc,zuo yc,zhang yf,wu cy,su wx,金w,yu hf,yl,li qz。对向日葵基因响应的大规模转录组比较黄萎病dahliae.BMC基因组学,2017;18(1):42。
- 17.
Morán-Diez E, Rubio B, Domínguez S, Hermosa R, Monte E, Nicolás c拟南芥蒂利亚纳24小时与生物控制真菌一起孵育后trichoderma harzianum.植物营养与肥料学报,2012;
- 18.
Cartieaux F, Contesto C, Adrien Gallou A, desbroses G, Kopka J, Taconnat L, Renou JP, Touraine b拟南芥蒂利亚纳与Bradyrhizobium.菌株ORS278和假单胞菌含油pv。番茄DC3000导致复杂的转录组变化。植物生态学报。2008;21(2):244-59。
- 19.
张Y,冯泽,冯HJ,李紫育,施悉,赵立,朱恒,杨杰。内生真菌的控制效果毛壳菌属globosumCEF-082抗黄萎病陆地棉.Acta phytopathologica sinica。2016; 46(5):697-706。
- 20.
谭GX,刘克,康JM,徐嘉,张Y,Hu Lz,张j,李cw。番茄兼容相互作用的转录组分析黄萎病dahliae使用RNA测序。前植物SCI。2015; 6:428。
- 21.
acta physica sinica, 2017, 36 (4): 594 - 594拟南芥蒂利亚纳:关键的调节节点和新的生理情景。新植醇。2008;177:301-18。
- 22.
Pieterate CMJ,Leon-Reyes A,Van der Ent S,Van Wees Scm。小分子激素在植物免疫中的网络。NAT CHEM BIOL。2009; 5:308-16。
- 23。
Fousiaa S,Tsafourosb A,Roussosb Pa,Tjamos SE。增加抵抗力黄萎病dahliae在拟南芥植物在养肝信号传导中有缺陷。植物别墅。2018; 67:1749-57。
- 24。
姚明,周Q,Pei Bl,Li YZ。过氧化氢在防御反应期间调节动态微管细胞骨架黄萎病dahliae毒素在拟南芥.植物学报。2011;34(9):1586-98。
- 25。
Dang Zh,Zheng Ll,Wang J,Gao Z,Wu Sb,Qi Z,王YC。野生核心胚性盐应激反应的转录组分析Reaumuria trigyna.BMC基因组学。2013;下去。
- 26。
张H,杨yz,王海,刘米,李h,傅y,王子,聂yb,刘xl,ji wq。大规模转录组比较揭示了小麦响应条纹生锈和粉末状霉菌的不同基因激活。BMC基因组学。2014; 15:898。
- 27。
一氧化氮和铁作为盐胁迫对向日葵幼苗子叶血红素加氧酶活性的长距离信号响应。一氧化氮。2016;53:54 - 64。
- 28。
Yadav S,David A,Baluska F,Bhatla Sc。在向日葵胚源中偶然根部形成期间,快速养突诱导的一氧化氮积累和随后的蛋白质硝化。植物信号表现。2013; 8(3):E23196。
- 29。
bu bw,秋dw,zeng hm,guo lh,元jj,杨xf。真菌蛋白ELICITOR PEVD1诱导棉花的黄萎病抗性。植物细胞代表2014; 33:461-70。
- 30.
黄志强,王志强,王志强,等。黄酮类化合物对植物激素信号转导的影响。植物科学学报2018;
- 31。
潘YJ,柴XY,高QF,周LM,张SS,LI LG,栾S.植物CNGC亚基和钙调汀驱动振荡CA的动态相互作用2+频道活动。DEV细胞。2019; 48(5):710-25。
- 32.
Kobayashi M,Ohura I,Kawakita K,Yokota N,Fujiwara M,Shimamoto K,Doke N,Yoshioka H.钙依赖性蛋白激酶通过马铃薯NADPH氧化酶调节反应性氧物种的产生。植物细胞。2007; 19:1065-80。
- 33.
Eckardt na。植物细胞评论植物免疫:受体样激酶,ROS-RLK串扰,定量抗性和生长/防御权衡。植物细胞。2017; 29:601-2。
- 34.
关键词:镉,汞,渗透胁迫,活性氧生成酶,过氧化氢足底。2010;231:221-31。
- 35.
梦吉,高清,翟WB,施珏,张兆,张力,剑,张MP,齐FJ。MAPKK家族成员介导的棉花抗性对棉花抗性的微妙调节。植物SCI。2018; 272:235-42。
- 36.
陈志强,王志强,王志强,等。植物次生细胞壁在植物抗病中的作用。植物科学学报。2014;5:358。
- 37.
徐L,朱LF,涂,刘LL,元DJ,金L,LONG L,张XL。木质素代谢在棉花对枯萎的真菌的抵抗力方面具有核心作用黄萎病dahliae如RNA-SEQ依赖性转录分析和组织化学透露。J Exp Bot。2011; 62(15):5607-21。
- 38.
Chan C,Lam HM。推定的Lambda类谷胱甘肽S-转移酶在盐度应力下增强植物存活。植物细胞生理。2014; 55(3):570-9。
- 39.
王Z,黄SZ,贾安,刘耶,张操,徐,金紫红。香蕉中五种谷胱甘肽S-转移酶(GST)基因的分子克隆及表达(穆萨acuminataL. AAA组,cv。卡文迪什)。热带农业学报,2013;32(9):1373-80。
- 40.
撒切尔LF,坎普赫斯LG, Hane JK, Onate-Sánchez L,辛格KB。的拟南芥KH-域RNA结合蛋白ESR1在斋月信号传导的组分中起作用,无解释的增长抑制和抗应力。Plos一个。2015; 10:E0126978。
- 41.
植物谷胱甘肽转移酶。基因组医学杂志。2002;3:1-10。
- 42.
植物谷胱甘肽转移酶超家族的功能分化。生物化学杂志。2002;277(34):30859-69。
- 43.
植物生长调节剂与植物谷胱甘肽s -转移酶(GSTs)的功能相互作用。Vitam霍恩。2005;72:155 - 202。
- 44.
韩Q,陈岚,杨Y,崔XM,GE F,Chen Cy,Liu DQ。来自Lilium Regale Wilson的谷胱甘肽S-转移酶基因赋予转基因烟草抗性Fusarium oxysporum.Sci Hortic。2016;198:370-8。
- 45.
张y,王xf,ding zg,ma q,张gr,张sl,李zk,吴lq,张gy,ma zy。转录组仿形物海岛棉接种黄萎病dahliae为棉花改良提供资源。BMC基因组学。2013;14:637。
- 46.
李ZK,陈B,李XX,王吉,张义,王XF,yan yy,ke hp,yang j,wu jh等。新鉴定的谷胱甘肽S转移酶基因簇在棉花中提供了黄萎病枯萎病。工厂J. 2019; 98(2):213-27。
- 47。
张永林,李志峰,冯志林,冯慧杰,赵丽华,石玉强,胡雪萍,朱红旗。棉花黄萎病相关基因VdPR3的分离及功能分析咕咕叫麝猫。2015;61(4):555 - 66。
- 48。
张泽,张X,胡泽,王雪,张捷音,王XJ,王QL,张教。冠状素诱导的ROS积累后棉根缺乏K依赖性氧化胁迫。Plos一个。2015; 10(5):E0126476。
- 49。
Sharma A,Thakur S,Kumar V,Kesavan Ak,Thukral Ak,Bhardwaj R.24- ePibrassinolide通过调节Brassica Junceal的基因表达来刺激吡虫啉解毒。BMC植物BIOL。2017; 17(1):56。
- 50。
朱慧卿,冯志林,李志峰,石玉强,赵丽玲。棉花分离真菌的特性及其对棉花黄萎病生防潜力的评价。J Phytopathol。2013;161(2):70 - 7。
- 51。
王磊,冯志强,王昕,张晓霞。基于RNA-seq数据的差异表达基因鉴定。生物信息学。2010;26:136-8。
- 52。
Sanseverino W,Hermoso A,D'Alessandro R,Vlasova A,Andolfo G,Frusciante L等人。PRGDB 2.0:朝向植物中R-基因分析的基于社区的数据库模型。核酸RES。2013; 41:1167-71。
- 53。
Jin J,张H,Kong L,Gao G,Luo J.Planttfdb 3.0:一种门户网站,用于植物转录因子的功能和进化研究。核酸RES。2014; 42:1182-7。
致谢
我们感谢朱教授小组成员提供的技术援助、资金支持和有益的讨论。
资金
中国国家重点研究和发展方案(2017YFD0201900)和中国国家自然科学基金(31901938)支持这项工作。我们感谢所有的经济支持基础。资金组织为研究项目提供了财务支持,并参与了该研究的设计。
作者信息
从属关系
贡献
YZ,LZ,Hz和CT构思了这项研究。YZ和NY进行了实验。yz分析了结果并写了稿件,并提供了所有作者的反馈。纽约和赫兹讨论了结果并修改了稿件。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
18样品的相关热量点。
附加文件2:图S2。
18个样本的主成分分析。
附加文件3:图S3。
聚类热图1209度。
附加文件4:图S4。
氧化石墨烯富集分析1209 DEGs。
附加文件5:图S5。
venn图的degs。
附加文件6:图S6。
蛋白质相互作用网络96°和棉花相关基因。红色字体表示集线器基因。
附加文件7:图S7。
棉花植物截面中木质素组织化学分析。
附加文件8:表S1。
特异性引物序列用于qRT-PCR。
附加文件9:表S2。
排序质量统计表。
附加文件10:表S3。
新的成绩单概述。
附加文件11:表S4。
96个DEGs中推测的R基因和转录因子基因。
额外的文件12。
有关H的数据2O2内容。
额外的文件13。
关于疾病指数的数据。
额外的文件14。
qPCR数据。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
张,Y.,Yang,N.,Zhao,L.et al。转录组分析揭示了棉花的防御机制黄萎病dahliae在生防真菌的存在下毛壳菌属globosumCEF-082。BMC植物杂志20.89(2020)。https://doi.org/10.1186/s12870-019-2221-0.
收到了:
接受:
发表:
关键字
- 转录组
- 棉花
- verticillium Wilt.
- 机制
- 生物防除真菌