- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
受体激酶FERONIA调节开花时间GydF4y2Ba拟南芥GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba26GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
类受体激酶FEROINA (FER)通过感知快速碱化因子(RALF)肽,在调控植物营养生长中起着关键作用。然而,RALF1-FER在营养-生殖生长过渡中的作用尚不清楚。在这里,我们分析了FER影响开花时间的机制GydF4y2Ba拟南芥。GydF4y2Ba
结果GydF4y2Ba
我们发现了GydF4y2Ba拿来GydF4y2BamRNA水平表现出具有昼夜节律的振荡模式,并且时钟振荡器GydF4y2Ba昼夜CLOCK-ASSOCIATED1GydF4y2Ba(GydF4y2BaCCA1GydF4y2Ba)上调表达GydF4y2Ba拿来GydF4y2Ba通过与它的染色质结合。此外,GydF4y2Ba拿来GydF4y2Ba表达由时钟基因调节,并且FER也调节时钟基因的表达模式。通过其基因表达模式一致,通过调节某些开花相关基因的转录物积累和mRNA替代剪接来呈正调节开花,包括开花基因座C(FLC)及其同源物疯饮影响开花(MAF)GydF4y2Ba.GydF4y2Ba然而,与FER相比,RALF1配体负调控开花。GydF4y2Ba
结论GydF4y2Ba
我们发现,由CCA1上调的FER通过调节一些重要开花基因的转录本积累和mRNA选择性剪接(AS)来控制开花时间,这些发现将FER与花的转变联系起来。GydF4y2Ba
背景GydF4y2Ba
昼夜节点是一种典型的机制,通过内源和外部信号同步,以调节营养生殖生长转变。昼夜时钟由多个互锁反馈循环组成[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].简单地说,两个转录因子,例如,GydF4y2Ba昼夜CLOCK-ASSOCIATED 1GydF4y2Ba(GydF4y2BaCCA1GydF4y2Ba),GydF4y2Ba晚细长的幼杆子GydF4y2Ba(GydF4y2BaLHYGydF4y2Ba),是生物钟的关键组成部分,并抑制表达GydF4y2Ba伪响应调节器7GydF4y2Ba(GydF4y2BaPRR7GydF4y2Ba),GydF4y2BaPRR9。GydF4y2Ba反过来,GydF4y2BaPRR7GydF4y2Ba和GydF4y2BaPRR9GydF4y2Ba抑制mRNA的积累GydF4y2BaCCA1GydF4y2Ba和GydF4y2BaLHYGydF4y2Ba,形成晨圈[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].在中央循环中,GydF4y2BaCCA1GydF4y2Ba和GydF4y2BaLHYGydF4y2Ba抑制转录抑制因子的表达GydF4y2BaCAB表达的时间1GydF4y2Ba(GydF4y2BaTOC1.GydF4y2Ba)[GydF4y2Ba6.GydF4y2Ba,而表示GydF4y2BaTOC1.GydF4y2Ba下调表达水平GydF4y2BaCCA1GydF4y2Ba和GydF4y2BaLHYGydF4y2Ba[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba]GydF4y2Ba.GydF4y2Ba在晚间循环中,GydF4y2BaTOC1.GydF4y2Ba抑制的表达GydF4y2BaGIGANTEAGydF4y2Ba(GydF4y2BaGI.GydF4y2Ba)[GydF4y2Ba8.GydF4y2Ba,以及早花3 (ELF3)、ELF4和LUX心律失常(LUX)等晚花复合体(EC)抑制GydF4y2BaTOC1.GydF4y2Ba那GydF4y2BaGI.GydF4y2Ba,GydF4y2BaPRR9GydF4y2Ba[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].这三个连锁的反馈回路是生物钟的基本组成部分。GydF4y2Ba
在漫长的日期(LD)条件下,昼夜节日通过该昼夜节省开花时间GydF4y2BaGI-CONSTANSGydF4y2Ba(GydF4y2BaCO.GydF4y2Ba)GydF4y2Ba-flowering locus t.GydF4y2Ba(GydF4y2BaFT.GydF4y2Ba)途径,称为光周期途径[GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].CO是一种锌指转录因子,通过直接激活来促进开花GydF4y2BaFT.GydF4y2Ba表达 [GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].FT是花途径的关键调控因子,以及多种输入,包括GydF4y2BaFLC.GydF4y2Ba,通过调控的表达而整合GydF4y2BaFT.GydF4y2Ba[GydF4y2Ba18GydF4y2Ba].FLC,一个疯狂的盒式转录因子,有五个同源物,MAF1至MAF5,在GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2BaFLC.GydF4y2Ba是通过春化和自主途径抑制开花的关键抑制因子GydF4y2BaFT.GydF4y2Ba和GydF4y2Ba常数抑制因子1GydF4y2Ba(GydF4y2BaSOC1GydF4y2Ba).mRNA的表达GydF4y2BaFLC.GydF4y2Ba由几个基因调节,包括GydF4y2Ba葬礼GydF4y2Ba那GydF4y2BafGydF4y2Ba那GydF4y2BaFlk.GydF4y2Ba那GydF4y2BaFLD.GydF4y2Ba那GydF4y2BaVRN1GydF4y2Ba那GydF4y2BaVRN2GydF4y2Ba和GydF4y2BaVIN3GydF4y2Ba,在自主和vernalization途径中[GydF4y2Ba19GydF4y2Ba].此外,增加证据阶段表明GydF4y2BaFLC.GydF4y2Ba前体pre-mRNA的加工在调控开花时间中起着重要作用。例如,SC35和SCL蛋白调节GydF4y2BaFLC.GydF4y2Ba拼接控制开花GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba20.GydF4y2Ba].RNA结合蛋白RZ-1B和RZ-1C涉及通过与丝氨酸/精氨酸富含(SR)蛋白的相互作用的FLC拼接调节[GydF4y2Ba21GydF4y2Ba].ATU2AF65B通过调节FLC的替代剪接来脱离酸介导的开花的作用[GydF4y2Ba22GydF4y2Ba].所有这些数据表明,调节GydF4y2BaFLC.GydF4y2Bapre-mRNA和mRNA表达对开花至关重要。GydF4y2Ba
在真核生物中,选择性剪接(AS)是指一个基因产生多个mRNA亚型,调节基因表达,增加蛋白质多样性。AS是由剪接体介导的,剪接体由5个小的核核糖核蛋白颗粒(snRNPs)和超过180种蛋白质组成[GydF4y2Ba23GydF4y2Ba].有研究表明,AS通过整合外部环境信号(包括环境温度和环境胁迫)来调控植物转变的时间。例如,冷处理影响两种不同的丰度GydF4y2BaMAF2GydF4y2Ba剪接变体,GydF4y2BaMAF2 var1GydF4y2Ba和GydF4y2BaMAF2 var2GydF4y2Ba,在开花时间的调制中具有不同的功能[GydF4y2Ba24GydF4y2Ba].此外,开花位点M (FLM)有两个主要的剪接变异FLM-β和FLM-δ,它们与花的抑制因子SVP相互作用。SVP与蛋白剪接变体FLM-β相互作用,抑制低温下开花。相比之下,SVP-FLM-δ复合物的dna结合能力在高温下降低,以加速开花[GydF4y2Ba25GydF4y2Ba].称为SHK1激酶结合蛋白的蛋白质精氨酸甲基转移酶5(PRMT5 / SKB1)对于前mRNA剪接至关重要。该蛋白质从FLC启动子解离,盐胁迫诱导FLC表达的增加,这导致延迟开花[GydF4y2Ba26GydF4y2Ba].外部环境信号调节as诱导的开花。然而,将外部环境信号与开花基因的AS调控联系起来的受体目前还不太清楚。GydF4y2Ba
类受体激酶FERONIA (FER)是植物生长和环境线索之间的串扰节点,是植物生长和生存的通用调节剂[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba].糖基磷脂酰肌醇锚固蛋白(GPI-AP),即LRE(Lorelei)和LLG1(LRE样GPI-AP),其作为FER的伴侣/共同受体,在LLG1 / LER-FER察觉不同之后与FER一起工作RALF肽[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba].的功能丧失突变GydF4y2Bafer-4GydF4y2Ba导致细胞伸长的缺陷,导致延迟营养发育和较短的根毛[GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba,表明FER在某些营养组织中促进细胞生长。此外,FER还参与应激反应,如对温度、盐和病原体的反应[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba35GydF4y2Ba那GydF4y2Ba36GydF4y2Ba那GydF4y2Ba37GydF4y2Ba].因此,FER通过整合不同的环境线索和内源性因子来控制细胞的生长和应激反应GydF4y2Ba拟南芥GydF4y2Ba.在本研究中,我们发现,由CCA1上调的FER通过调控一些重要开花基因的转录本积累和mRNA AS来调控开花时间,从而与花的转变有关。GydF4y2Ba
结果GydF4y2Ba
FER转录本按CCA1控制的昼夜节律振荡GydF4y2Ba
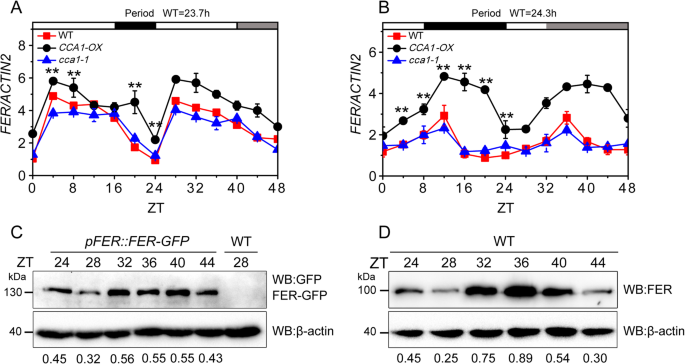
我们假设这一点GydF4y2Ba拿来GydF4y2Ba可能是由日昼夜节律控制,因为转录水平GydF4y2Ba拿来GydF4y2Ba基因取决于采样时间。因此,我们分析了的表达式GydF4y2Ba拿来GydF4y2Ba使用基于Web的工具“昼夜”(GydF4y2Bahttp://diurnal.mocklerlab.org/diurnal_data_finders/new.GydF4y2Ba)[GydF4y2Ba38GydF4y2Ba].结果表明GydF4y2Ba拿来GydF4y2Ba在LD、short-day (SD)和continuous-light (LL)条件下表现出日节律(图S1A-D)。根据qPCR分析,表达GydF4y2Ba拿来GydF4y2Ba在从16-H光/ 8-H暗(LD)条件下转移至LL条件并从8-H光/ 16-H暗(SD)条件转移至LL条件后,在有节奏地波动(图。GydF4y2Ba1GydF4y2Baa - b)。这GydF4y2Ba拿来GydF4y2Ba振荡持续约24小时。从LD转入LL条件后,转录水平GydF4y2Ba拿来GydF4y2Ba在Zeitgeber时间32 (zt32)和zt28 (zt28)分别达到最大值和最小值。GydF4y2Ba1GydF4y2Baa).相反,从SD转移到LL条件后,表达GydF4y2Ba拿来GydF4y2Ba增加,并在zt40达到峰值(图40)。GydF4y2Ba1GydF4y2Bab)。为了容易地评估一支乐队中的总FER蛋白(包括磷酸化和去磷酸化形式)水平,我们缩短了SDS-PAGE运行时间,以防止分离磷酸化和去磷酸化形式的FER [GydF4y2Ba27GydF4y2Ba].根据GFP的表达分析,在大肠杆菌中,FER蛋白的积累量最低和最高GydF4y2BaPFER:FER-GFPGydF4y2Ba标记的植株分别在zt28和zt32处被检测到(图。GydF4y2Ba1GydF4y2Bac).使用FER抗体(anti-FER)在WT植物上也得到了类似的结果(图。GydF4y2Ba1GydF4y2Bad).在LD条件下,FER蛋白表达与mRNA振荡模式一致,由于蛋白质翻译一般发生在mRNA转录后,所以FER蛋白与mRNA表达之间存在约4 h的延迟。确定的表达式是否GydF4y2Ba拿来GydF4y2Ba由此控制GydF4y2BaCCA1GydF4y2Ba,我们测量了GydF4y2Ba拿来GydF4y2BaWT的mRNA水平,GydF4y2BaCCA1 -GydF4y2Ba过度表达(GydF4y2BaCCA1-OX.GydF4y2Ba),GydF4y2BaCCA1-1GydF4y2BaLD和SD条件下的突变体植株。这GydF4y2Ba拿来GydF4y2BaMRNA水平在两者中振荡GydF4y2BaCCA1 -GydF4y2Baoverexpressing线(GydF4y2BaCCA1-OX.GydF4y2Ba)和GydF4y2BaCCA1-1GydF4y2Ba突变体。表达水平GydF4y2BaCCA1-OX.GydF4y2Ba在LD和SD两种条件下,WT植株的叶绿素含量均高于WT植株(图2)。GydF4y2Ba1GydF4y2Baa和b),这表明表达了GydF4y2Ba拿来GydF4y2Ba影响GydF4y2BaCCA1GydF4y2Ba.GydF4y2Ba
拿来GydF4y2Ba表情以每天的节奏振荡。GydF4y2Ba一种GydF4y2Ba拿来GydF4y2Ba表达GydF4y2BaCCA1-OX.GydF4y2Ba那GydF4y2BaCCA1-1GydF4y2Ba和LD条件下的WT工厂。每隔4小时采样一次的幼苗采用qPCR进行分析。昼、夜和主观的夜用白色、黑色和灰色条来表示。zt0表示样品采集当天的点亮时间。GydF4y2BaACTIN2GydF4y2Ba作为内部对照,计算相对mRNA水平;实验重复三次,误差棒代表三个技术重复的标准差。周期使用BioDare2进行分析。星号表示之间的显著差异GydF4y2BaCCA1-OX.GydF4y2Ba和WT (* *GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2BaB.GydF4y2Ba拿来GydF4y2Ba表达GydF4y2BaCCA1-OX.GydF4y2Ba那GydF4y2BaCCA1-1GydF4y2Ba和SD条件下的WT工厂。实验重复三次,误差棒代表三个技术重复的标准差。周期使用BioDare2进行分析。星号表示之间的显著差异GydF4y2BaCCA1-OX.GydF4y2Ba和WT (* *GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2BaCGydF4y2Ba免疫印迹分析。每隔4小时采集一次样品。所有蛋白质均从GydF4y2BaPFER :: FER-GFPGydF4y2Ba和WT幼苗,然后使用抗GFP抗体分析以检测FER-GFP蛋白。FER-GFP /β-肌动蛋白比在凝胶下方显示,使用β-肌动蛋白作为负载控制。实验独立地重复三次,结果是相似的。GydF4y2BaD.GydF4y2Ba免疫印迹分析。从WT幼苗中提取蛋白,然后用抗FER抗体进行分析,检测FER蛋白。以β-actin为加载控制,FER/β-actin比值显示在凝胶下方。至少进行了3次生物重复,得到了相似的结果。GydF4y2Ba
CCA1通过直接结合FER的染色质调控FER的表达GydF4y2Ba
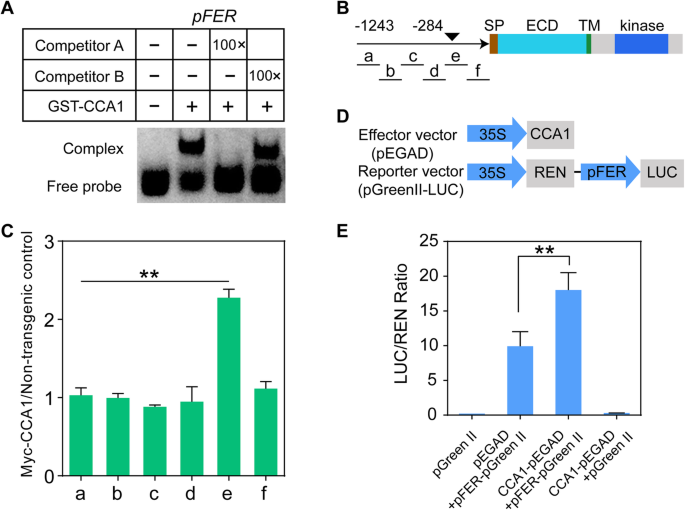
的mRNA表达水平GydF4y2Ba拿来GydF4y2Ba在GydF4y2BaCCA1-OX.GydF4y2Ba在LD和SD条件下的植物(图。GydF4y2Ba1GydF4y2Ba因为CCA1是一个转录因子,我们推测CCA1可能调节GydF4y2Ba拿来GydF4y2Ba表达与绑定到GydF4y2Ba拿来GydF4y2Ba染色质的GydF4y2Ba拟南芥GydF4y2Ba.有趣的是,染色质GydF4y2Ba拿来GydF4y2Ba包含EE(AAATATCT)元素(附加文件GydF4y2Ba2GydF4y2Ba:图S2A和B),这是LD条件下CCA1的候选结合位点[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].另外,根据芯片-SEQ数据,CCA1绑定GydF4y2Ba拿来GydF4y2Ba染色质(GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].来确认CCA1与GydF4y2Ba拿来GydF4y2Ba我们对GST-CCA1蛋白进行了纯化,并进行了电泳迁移试验(EMSA)。如图1所示。GydF4y2Ba2GydF4y2Baa、CCA1与GydF4y2BapfGydF4y2Ba,其中包含一个EE元素。然后我们用未标记的WT和突变体(AAATATCT突变为GGGGGGGG)探针进行竞争EMSA,发现WT探针,而不是突变体探针,与标记探针竞争,这表明CCA1特异性结合GydF4y2Ba拿来GydF4y2Ba染色质GydF4y2Ba.GydF4y2Ba我们随后使用WT (Col-0)和染色质免疫沉淀(ChIP)检测GydF4y2Ba35 s:: CCA1-MycGydF4y2Ba与抗myc抗体系。碎片GydF4y2Ba拿来GydF4y2Ba含EE元素的染色质富集GydF4y2Ba35 s:: CCA1-MycGydF4y2Ba但不是LD条件下的WT植物,这表明CCA1结合GydF4y2Ba拿来GydF4y2Ba染色质在体内(图。GydF4y2Ba2GydF4y2BaB和C)。此外,我们进行了双荧光素酶(LUC)测定以确定CCA1是否调节表达式GydF4y2Ba拿来GydF4y2Ba通过直接互动GydF4y2Ba拿来GydF4y2Ba染色质。在本实验中GydF4y2BaCCA1GydF4y2Ba过度建设(GydF4y2BaCCA1-pEGADGydF4y2Ba)作为效应器,而GydF4y2BaPFER-LUCGydF4y2Ba记者(GydF4y2BapFER-pGreen二世GydF4y2Ba)是读数(图。GydF4y2Ba2GydF4y2Bad)。如图1所示。GydF4y2Ba2GydF4y2Bae中,LUC活性GydF4y2BaCCA1-pEGADGydF4y2Ba小组高于那个GydF4y2BapEGADGydF4y2Ba对照组,这表明GydF4y2BaCCA1GydF4y2BacoExpression增加了表达GydF4y2Ba拿来GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba.因此,CCA1直接绑定到GydF4y2Ba拿来GydF4y2Ba染色质和上调GydF4y2Ba拿来GydF4y2Ba表达GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba
CCA1与FER的染色质区域相互作用并促进其表达。GydF4y2Ba一种GydF4y2Ba通过EMSA检测,证实CCA1与FER启动子的EE基序结合。竞争者A为没有FITC标记的CCA1结合基序;竞争对手B为未标记FITC的突变EE片段。pFER: FER片段包含假定的CCA1结合位点。个别DNA探针的序列列在附加文件中GydF4y2Ba13GydF4y2Ba:表5。这些实验独立地重复了四次,得到了相似的结果。GydF4y2BaB.GydF4y2Ba启动子(箭头)、信号肽(SP)、胞外结构域(ECD)、跨膜结构域(TM)和激酶结构域(kinase)的示意图。黑色三角形表示EE元件(AAATATCT)的位置,黑色实线表示ChIP-qPCR扩增的DNA区域。GydF4y2BaCGydF4y2BaChIP-qPCR。ChIP检测使用抗myc抗体。通过qPCR扩增出的DNA区域在b中以黑色实线标记。数值相对于非转基因对照,并且进行了三次独立实验,结果相似,误差棒代表三个生物重复的SD (**)GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).D.GydF4y2Ba报告和效应构建体用于瞬时表达测定。任荧光素酶用作内部对照,以使单个测定中的值标准化。GydF4y2BaE.GydF4y2Ba相关报道活动(LUC/REN)GydF4y2Ba拟南芥GydF4y2Ba原生质体。误差柱代表三个生物重复的标准差,用星号表示差异显著(**)GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).
FER突变改变了时钟基因的表达模式GydF4y2Ba
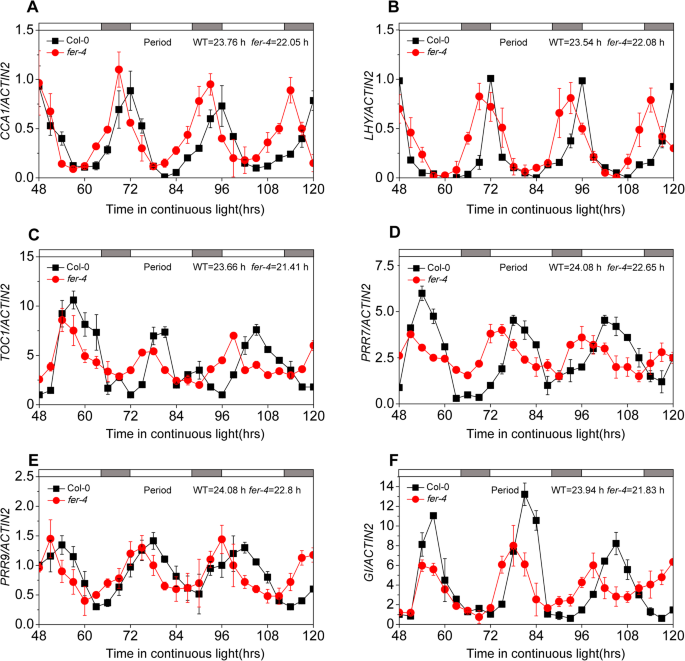
因为这个表达式GydF4y2Ba拿来GydF4y2Ba基因在植物中表现出一种昼夜节律,我们测试了基因的表达是否GydF4y2Ba拿来GydF4y2Ba是简单的时钟机构输出还是是否GydF4y2Ba拿来GydF4y2Ba它是一种受体激酶,也是整合细胞外信号的时钟机制的调节器。六个时钟基因的表达水平,即,GydF4y2BaCCA1GydF4y2Ba那GydF4y2BaLHYGydF4y2Ba那GydF4y2BaTOC1.GydF4y2Ba那GydF4y2BaPRR7GydF4y2Ba那GydF4y2BaPRR9GydF4y2Ba和GydF4y2BaGI.GydF4y2Ba,在WT和GydF4y2Bafer-4GydF4y2Ba突变体每3小时检测一次,然后使用BioDare2网站分析这些基因[GydF4y2Ba41GydF4y2Ba].分析表明,这六个基因的周期在GydF4y2Bafer-4GydF4y2Ba突变体植株比野生型植株短(图。GydF4y2Ba3.GydF4y2Baf)。除了缩短生物钟基因的周期GydF4y2Ba拿来GydF4y2Ba突变改变了GydF4y2BaCCA1GydF4y2Ba那GydF4y2BaTOC1.GydF4y2Ba和GydF4y2BaPRR7GydF4y2BaLD条件下的基因(附加文件GydF4y2Ba3.GydF4y2Ba:图S3A-D)。的振幅GydF4y2BaCCA1GydF4y2Ba(振幅:Col-0 = 0.38和GydF4y2Bafer-4GydF4y2Ba = 0.68) in thefer-4GydF4y2Ba突变体(附加文件GydF4y2Ba3.GydF4y2Ba:图S3A)。然而,GydF4y2BaTOC1.GydF4y2Ba和GydF4y2BaPRR7GydF4y2Ba转录水平减少GydF4y2Bafer-4GydF4y2Ba突变体。这些结果表明GydF4y2Ba拿来GydF4y2Ba表达由时钟基因调节,并且FER调节时钟基因的表达模式。GydF4y2Ba
拿来GydF4y2Ba突变影响时钟基因的表达模式。表达水平GydF4y2BaCCA1GydF4y2Ba(GydF4y2Ba一种GydF4y2Ba),GydF4y2BaLHYGydF4y2Ba(GydF4y2BaB.GydF4y2Ba),GydF4y2BaTOC1.GydF4y2Ba(GydF4y2BaCGydF4y2Ba),GydF4y2BaPRR7GydF4y2Ba(GydF4y2BaD.GydF4y2Ba),GydF4y2BaPRR9GydF4y2Ba(GydF4y2BaE.GydF4y2Ba),GydF4y2BaGI.GydF4y2Ba(GydF4y2BaFGydF4y2Ba)WT和的转录物GydF4y2Bafer-4GydF4y2Ba显示L1条件下的突变植物。在LD条件下生长七天幼苗,转移至ZT 0的LL,以3-H间隔采样并使用QPCR分析。周期使用BioDare2进行分析。所有实验均至少进行三次,结果相似,误差条表示三种技术复制的SDGydF4y2Ba
FER调节开花时间GydF4y2Ba
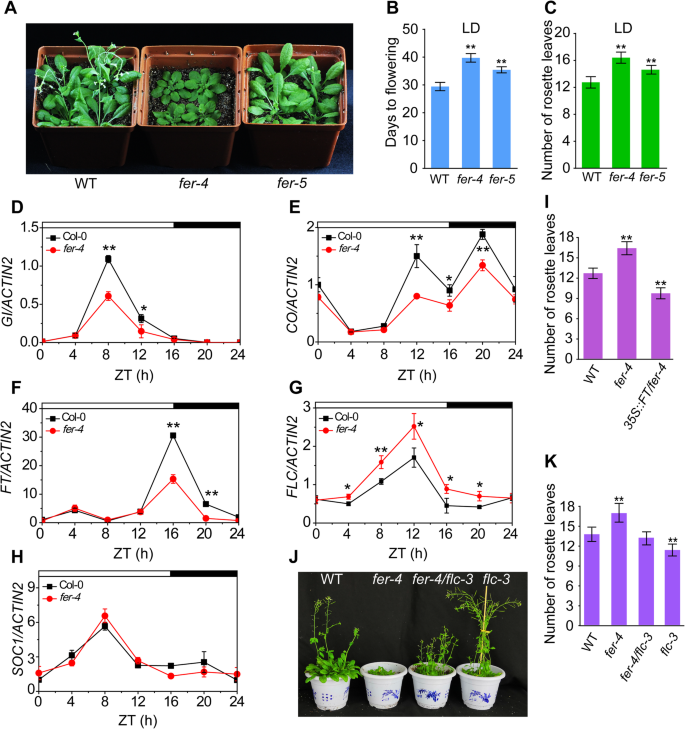
CCA1过表达导致虽然镇压导致延迟开花GydF4y2BaGI.GydF4y2Ba[GydF4y2Ba42GydF4y2Ba,作为高度表达GydF4y2BaCCA1GydF4y2Ba被观察到GydF4y2Bafer-4GydF4y2Ba突变体(附加文件GydF4y2Ba3.GydF4y2Ba:图S3A)。我们推测FER可能在控制开花时间中发挥作用。花开的时候GydF4y2Bafer-4GydF4y2Ba检查突变体和WT植物。在LD条件下,GydF4y2Bafer-4GydF4y2Ba突变体在开花时间上表现出显著的延迟,无论是通过开花的天数还是开花时的叶子数量来衡量(图。GydF4y2Ba4.GydF4y2Baa - c)。这种表型也在GydF4y2BasrnGydF4y2Ba[GydF4y2Ba34GydF4y2Ba那GydF4y2Ba43GydF4y2Ba,这是另一回事GydF4y2Ba带- - - - - -GydF4y2Banull突变体在生态型c24背景中(附加文件GydF4y2Ba4.GydF4y2Ba:图S4A-C)。我们发现了GydF4y2Bafer-5GydF4y2Ba,是FER的敲除突变体(Duan et al., 2010),具有晚开花表型(图2)。GydF4y2Ba4.GydF4y2Baa - c)。确定延迟开花表型的分子机制GydF4y2Bafer-4GydF4y2Ba突变体,我们检查了表达GydF4y2BaGI.GydF4y2Ba-GydF4y2BaCO.GydF4y2Ba-GydF4y2BaFT.GydF4y2Ba,光周期开花的关键途径。在里面GydF4y2Bafer-4GydF4y2Ba突变体,表达GydF4y2BaGI.GydF4y2Ba在zt4开始增加,在zt8达到峰值,这与野生型植物的发现相似。然而,GydF4y2BaGI.GydF4y2Ba高峰时GydF4y2Bafer-4GydF4y2Ba突变体显著低于WT(图。GydF4y2Ba4.GydF4y2Bad)。类似地,振荡模式GydF4y2BaCO.GydF4y2BaWT植物中的转录物类似于GydF4y2Bafer-4GydF4y2Ba突变体,但表达水平GydF4y2BaCO.GydF4y2Ba突变体比WT低(图。GydF4y2Ba4.GydF4y2Bae),导致较低的峰值GydF4y2BaFT.GydF4y2Ba观察到的表达GydF4y2Bafer-4GydF4y2Ba突变体(无花果。GydF4y2Ba4.GydF4y2Baf).进一步证实FER主要通过GydF4y2BaGI.GydF4y2Ba-GydF4y2BaCO.GydF4y2Ba-GydF4y2BaFT.GydF4y2Ba途径,我们检查了另外两种关键开花因子,FLC和SOC1的表达。FLC是自主和常规途径的中心节点,并且FLC表达明显升高GydF4y2Bafer-4GydF4y2Ba突变体与野生型植株比较,表明春化途径或自主途径受到影响GydF4y2Bafer-4GydF4y2Ba突变体(无花果。GydF4y2Ba4.GydF4y2Bag).此外,学生的成绩单水平GydF4y2BaSOC1GydF4y2Ba不受影响GydF4y2Bafer-4GydF4y2Ba突变体(无花果。GydF4y2Ba4.GydF4y2Bah).确定FLC和FT调控开花的遗传作用GydF4y2Bafer-4GydF4y2Ba突变体col0、col0、GydF4y2Bafer-4GydF4y2Ba那GydF4y2Ba35 s:英国《金融时报》/ fer-4GydF4y2Ba那GydF4y2Baflc-3GydF4y2Ba和GydF4y2BaFER-4 / FLC-3GydF4y2Ba植物。开花的时间GydF4y2Ba35 s:英国《金融时报》/ fer-4GydF4y2Ba植物比那些早GydF4y2Bafer-4GydF4y2Ba突变体和WT植物(图。GydF4y2Ba4.GydF4y2Bai),表明FT的表达可以恢复花期晚的表型GydF4y2Bafer-4GydF4y2Ba突变体。而且,功能的丧失GydF4y2BaFLC.GydF4y2Ba在GydF4y2Bafer-4GydF4y2Ba突变体背景减轻了晚开花表型GydF4y2Bafer-4GydF4y2Ba突变体(无花果。GydF4y2Ba4.GydF4y2Baj-k),表明FLC参与了fer介导的加速花的转变。综上所述,这些结果表明,FER调控植物的开花GydF4y2Ba拟南芥GydF4y2Ba通过多种途径。GydF4y2Ba
FER调控拟南芥的开花时间。GydF4y2Ba一种GydF4y2Ba不同基因型植株在LD条件下生长35 d的照片。GydF4y2BaB.GydF4y2Ba在LD条件下,开花时间被测量到花朵下花。星号表示与WT相比的显着差异(GydF4y2BaNGydF4y2Ba = 15, **P.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2BaCGydF4y2Ba叶片数的统计分析GydF4y2Bafer-4GydF4y2Ba和GydF4y2Bafer-5GydF4y2Ba植物与WT植物相比。值是至少15株植物的平均值±SD(**GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2BaD.GydF4y2Ba-GydF4y2BaHGydF4y2Ba表达水平的GydF4y2BaGI.GydF4y2Ba(D),GydF4y2BaCO.GydF4y2Ba(E),GydF4y2BaFT.GydF4y2Ba(F),GydF4y2BaFLC.GydF4y2Ba(G)GydF4y2BaSOC1GydF4y2Ba(H) WT和GydF4y2Bafer-4GydF4y2Ba突变植株显示。在LD条件下培养14日龄幼苗,取样并进行qPCR分析。白天和黑夜分别用白条和黑条表示。所有实验都至少进行了三次,得到了相似的结果。值为平均值±标准差(*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).一世GydF4y2BaWT抽薹时莲座叶片数的统计分析GydF4y2Bafer-4GydF4y2Ba和GydF4y2Ba35 s:英国《金融时报》/ fer-4GydF4y2Ba在LD条件下生长的植物。实验独立重复三次,结果相似(GydF4y2BaNGydF4y2Ba> 20日* *GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2BajGydF4y2BaWT的表型,GydF4y2Bafer-4GydF4y2Ba那GydF4y2BaFER-4 / FLC-3GydF4y2Ba和GydF4y2Baflc-3GydF4y2Ba在LD条件下生长。GydF4y2BaK.GydF4y2Ba不同基因型与野生型植株叶片数的统计分析(GydF4y2BaNGydF4y2Ba> 20)。误差条代表标准差。这些实验至少进行了三次。星号表示与WT相比有显著差异(**)GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)GydF4y2Ba
FER调节一些与开花相关基因的截止GydF4y2Ba
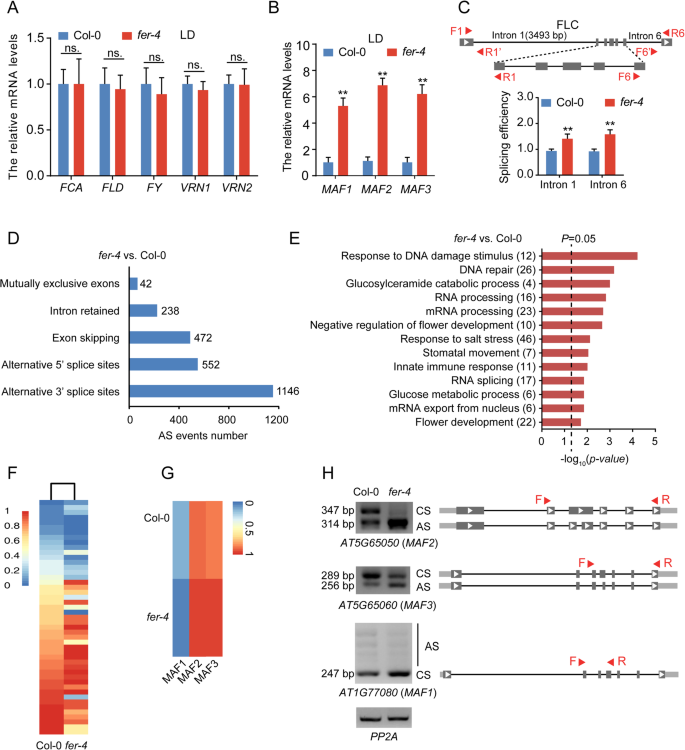
随后,我们重点研究了FLC表达上调的机制GydF4y2Bafer-4GydF4y2Ba与WT植物相比突变体。有两种可能的解释,用于在此处观察到的FLC的更高表达GydF4y2Bafer-4GydF4y2Ba突变体。一,是GydF4y2Ba拿来GydF4y2Ba突变可能会降低一些监管机构的表达GydF4y2BaFLC.GydF4y2Ba释放GydF4y2BaFLC.GydF4y2Ba其次,FER突变可能导致FLC剪接异常,导致功能性FLC mRNA增加。探讨的沉默机制GydF4y2BaFLC.GydF4y2Ba,我们检查了各种FLC监管机构,包括GydF4y2Ba开花控制位点aGydF4y2Ba(GydF4y2Ba葬礼GydF4y2Ba),GydF4y2Ba开花轨迹DGydF4y2Ba(GydF4y2BaFLD.GydF4y2Ba)GydF4y2Ba,财政年度GydF4y2Ba那GydF4y2Ba春化1GydF4y2Ba(GydF4y2BaVRN1)GydF4y2Ba和GydF4y2BaVRN2GydF4y2Ba,受到了影响GydF4y2Bafer-4GydF4y2Ba突变体。结果表明,这些基因的mRNA表达水平仅显示出略微略微的差异GydF4y2Bafer-4GydF4y2Ba与WT植物相比,突变体表明在观察到的FLC表达增加GydF4y2Bafer-4GydF4y2Ba突变体不是由这些基因引起的(图。GydF4y2Ba5.GydF4y2Baa).我们还检测了FLC的三个同源物的mRNA水平,即,GydF4y2BaMAF1GydF4y2Ba那GydF4y2BaMAF2GydF4y2Ba和GydF4y2BaMAF3GydF4y2Ba.这些基因的表达水平显著升高GydF4y2Bafer-4GydF4y2Ba突变体与野生型植物相比(图。GydF4y2Ba5.GydF4y2Bab),这表明这一点GydF4y2Ba加GydF4y2Ba同源物可能作为FER的靶标。然后我们测量剪接与未剪接的FLC转录本的比例,以分析FLC内含子1和6的剪接效率[GydF4y2Ba44GydF4y2Ba].内含子1和内含子6的剪接效率均增加GydF4y2Bafer-4GydF4y2Ba突变体与野生型植物相比(图。GydF4y2Ba5.GydF4y2Bac和附加文件GydF4y2Ba5.GydF4y2Ba:图S5)。我们预测,提高剪接效率GydF4y2BaFLC.GydF4y2Ba内含子1和6会导致未剪接RNA水平下降,但会导致剪接RNA水平上升。因此,剪接FLC RNA水平的增加增加了GydF4y2BaFLC.GydF4y2Ba在GydF4y2Bafer-4GydF4y2Ba与WT植物相比突变体。GydF4y2Ba
拟南芥中开花相关基因的前mRNA剪接需要FER。GydF4y2Ba一种GydF4y2Ba-GydF4y2BaB.GydF4y2BaWT和GydF4y2Bafer-4GydF4y2BaZT 4. LD,漫长的一天条件。GydF4y2BaACTIN2GydF4y2Ba用作内部对照基因。误差条表示三个技术重复的标准差。所有实验均至少进行三次(NS。意味着没有重要; **GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).CGydF4y2BaFLC的基因组结构。灰色盒子代表外显子;黑线表示内含子;F,正向引物;R,反向引物;引物对F1/R1 '和F6 ' /R6分别用于检测FLC内含子1和6的未剪接RNA。F1/R1和F6/R6检测野生型和野生型的剪接mRNAGydF4y2Bafer-4GydF4y2Ba突变体。GydF4y2BaACTIN2GydF4y2Ba用于内部控制。七天历史的Col-0和GydF4y2Bafer-4GydF4y2Ba在LD条件下生长幼苗并在ZT 12处收集。计算剪接效率(剪接/未燃烧)。实验进行三次(**GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).D.GydF4y2Ba之间的差分拼接事件的数量GydF4y2Bafer-4GydF4y2BaRNA测序(RNA- seq)分析检测突变体和WT (GydF4y2BaNGydF4y2Ba= 3)。GydF4y2BaE.GydF4y2Ba基因本体论(GO)富集的基因之间具有显著的剪接变化GydF4y2Bafer-4GydF4y2Ba和WT (GydF4y2BaNGydF4y2Ba= 3)。黑色虚线表示GydF4y2BaP.GydF4y2Ba = 0.05. The numbers indicated the representative genes involved in the pathway.FGydF4y2Ba差分前mRNA拼接的热图GydF4y2Bafer-4GydF4y2Ba基于RNA-SEQ分析检测的外显子包合物水平的突变体和野生型。GydF4y2BaGGydF4y2Ba开花相关基因的差分前mRNA剪接的热图(GydF4y2BaMAF1GydF4y2Ba那GydF4y2BaMAF2GydF4y2Ba和GydF4y2BaMAF3GydF4y2Ba),基于RNA-seq数据的外显子包含水平(GydF4y2BaNGydF4y2Ba= 3)。GydF4y2BaHGydF4y2Ba半定量PCR (Semi-quantitative PCR, semi-qPCR)验证差异剪接事件GydF4y2Bafer-4GydF4y2Ba突变和Col-0。七天历史的Col-0和GydF4y2Bafer-4GydF4y2Ba在LD条件下生长幼苗并在ZT 4处收集.CS表示组成型剪接,并且如表明替代剪接。红色三角形显示出半QPCR使用的引物的位置(补充表5)。GydF4y2Bapp2a.GydF4y2Ba用作内部控制。实验独立地重复三次,结果GydF4y2Ba
我们进行了RNA-SEQ分析以确定FER介导的剪接的额外潜在的目标花卉相关基因。我们产生了超过4000万读,89.8%的生成读取可以与Tair10参考基因组正确对齐(附加文件GydF4y2Ba6.GydF4y2Ba:图S6A)。通过绘制每个转录本单元的reads覆盖范围,我们发现其分布均匀,没有明显的3 ' /5 '偏倚(附加文件)GydF4y2Ba6.GydF4y2Ba:图S6B),映射读取对基因模型的比较(TAIR10)揭示了大约99%的读取映射到外显子(附加文件GydF4y2Ba6.GydF4y2Ba图S6C),表明该cDNA文库质量较高。RNA-Seq分析显示,1753和1634个基因表现出更高的水平(至少2倍于GydF4y2BaP.GydF4y2Ba < 0.05) and lower transcript levels, respectively, in thefer-4GydF4y2Ba与Col-0植物相比(附加文件GydF4y2Ba6.GydF4y2Ba:图S6D及附加文件GydF4y2Ba9.GydF4y2Ba:表S1)。基于RNA-Seq数据,鉴定出2450个基因存在剪接缺陷GydF4y2Bafer-4GydF4y2Ba突变体与WT控制相比(GydF4y2BaP.GydF4y2Ba< 0.05,包含水平差异> 0.05或<−0.05),可分为5类:1146个3’剪接位点(a3’ss)、552个5’剪接位点(a5’ss)、472个外显子跳跃(ES)、238个内含子保留(IR)和42个互斥外显子(MXE)(图2)。GydF4y2Ba5.GydF4y2Bad和附加文件GydF4y2Ba10GydF4y2Ba:表S2)。基因本体论术语富集分析显示,不同的剪接基因参与RNA加工、盐胁迫响应和花的发育调控(图。GydF4y2Ba5.GydF4y2BaE和其他文件GydF4y2Ba11GydF4y2Ba:表S3)。我们鉴定了大约28个可能参与fer介导剪接的花相关基因,其中包括MAF1、MAF2、FY和胚花2 (EMF2)GydF4y2Ba12GydF4y2Ba:表S4)。为了更好地可视化不同的拼接GydF4y2Bafer-4GydF4y2Ba和WT在开花相关途径中,我们使用了显示剪接变化的基因的热图(图2)。GydF4y2Ba5.GydF4y2Baf)表明拼接模式显着改变GydF4y2Bafer-4GydF4y2Ba突变体。通过半QPCR分析,我们还证实了一些与开花相关的基因(GydF4y2BaMAF1GydF4y2Ba那GydF4y2BaMAF2GydF4y2Ba,GydF4y2BaMAF3GydF4y2Ba)表现出剪接变化(图。GydF4y2Ba5.GydF4y2Bag和h和附加文件GydF4y2Ba13GydF4y2Ba:表S5)。总之,这些结果支持CER在调节开花中的功能GydF4y2Ba拟南芥GydF4y2Ba通过中介。GydF4y2Ba
在LD条件下,RALF1肽影响开花时间GydF4y2Ba
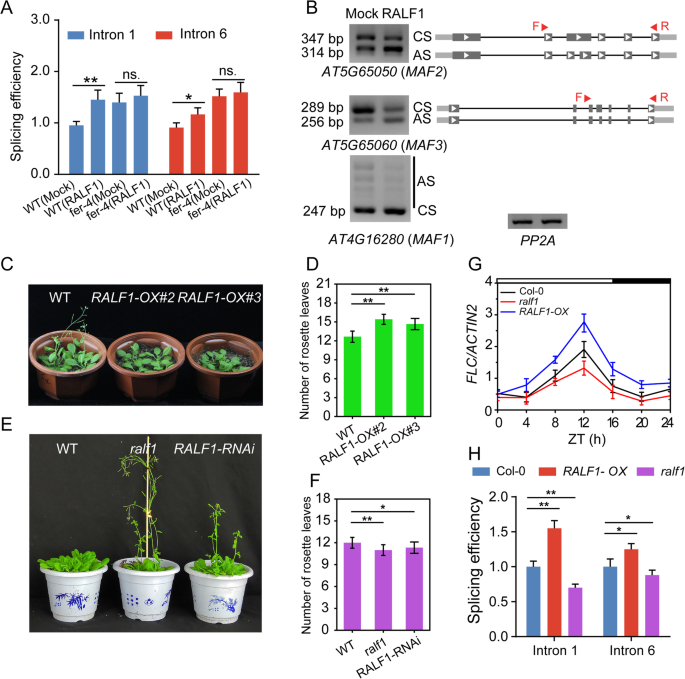
FER是RALF1和RALF23的受体[GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba[本研究在这项研究中,被证明是涉及一些开花相关基因的控制。我们测试RALF1或RALF23是否可以用作肽激素,其通过激活FER来改变开花基因的拼接模式。首先,我们分析了EPLANT中RALF1和RALF23的表达,发现两者都在拍摄顶点中表达(附加文件GydF4y2Ba7.GydF4y2Ba:图S7A-B)。qPCR进一步证实,在芽中表达了RALF1(补充文件)GydF4y2Ba7.GydF4y2Ba:图S7C)。我们随后使用RALF1作为分析RALF肽在开花控制中的作用的例子。wt和GydF4y2Bafer-4GydF4y2Ba将突变植株用RALF1多肽处理,检测FLC内含子1和6的剪接效率。在col0植株中,经RALF1处理后,FLC内含子1和6的剪接效率显著提高,而在col0植株中,由RALF1处理引起的FLC内含子1和6的剪接效率变化显著减弱GydF4y2Bafer-4GydF4y2Ba突变体(无花果。GydF4y2Ba6.GydF4y2Ba一种)。为了调查MAFS的前mRNA剪接是否受RALF1调节,我们分析了有或没有RALF1治疗的MAFs的剪接变化。结果表明,在RALF1处理的植物中改变了MAF1-3的剪接模式,类似于所获得的结果GydF4y2Ba拿来GydF4y2Ba突变植物,表明FER和RALF1可能对调节一些开花基因的作用相反(图。GydF4y2Ba6.GydF4y2Bab)。我们随后评估了RALF1在调节开花时间的作用GydF4y2Ba拟南芥GydF4y2Ba.首先,我们获得了两个GydF4y2BaRALF1 -GydF4y2Ba过度抑制线条(GydF4y2BaRALF1-OX#2GydF4y2Ba和GydF4y2BaRalf1-ox#3GydF4y2Ba),并确定了两个GydF4y2Baralf1GydF4y2Ba突变体(GydF4y2Baralf1GydF4y2Ba-knockout和GydF4y2BaRALF1-RNAiGydF4y2Ba-knockdown行)(附加文件GydF4y2Ba8.GydF4y2Ba:图S8A-D)。在LD条件下,两者GydF4y2BaRALF1-OX.GydF4y2Ba与WT株系相比,该株系表现出晚开花表型(图。GydF4y2Ba6.GydF4y2Ba光盘)。相比之下,GydF4y2Baralf1GydF4y2Ba突变体,GydF4y2BaRALF1-RNAiGydF4y2Ba线显示出早期开花的表型(图。GydF4y2Ba6.GydF4y2Bae-f)。mRNA水平GydF4y2BaFLC.GydF4y2Ba在增加GydF4y2BaRALF1-OX.GydF4y2Ba并减少了GydF4y2Baralf1GydF4y2Ba突变体,与开花表型一致。GydF4y2Ba6.GydF4y2Bag).此外,内含子1和6的剪接效率也增加了GydF4y2BaRALF1-OX.GydF4y2Ba植物和减少GydF4y2BaRALF1GydF4y2Ba与wt相比突变体。总之,这些结果表明,RALF1还调节开花基因的剪接,与FER相比,对开花时间产生相反的效果。GydF4y2Ba
RALF1调节开花时间。GydF4y2Ba一种GydF4y2Ba对野生型和野生型幼苗FLC内含子1和6的剪接效率进行qPCR分析GydF4y2Bafer-4GydF4y2Ba有或没有RALF1处理的突变体。样品在zt4点采集。条形图表示平均值±标准差,实验独立重复3次(ns。意味着没有显著;*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).B.GydF4y2Ba不同的剪接变体GydF4y2Ba加GydF4y2Ba在Col-0中有或没有RALF1处理,如半QPCR分析所确定的。CS表示构成拼接,并且表示替代剪接。将MRNA从7-D旧幼苗中分离,并在ZT 4中收集样品。结果重复三次,结果是相似的。GydF4y2BaCGydF4y2Ba野生型的开花基因型GydF4y2BaRALF1-OX.GydF4y2Ba在LD条件下的工厂。GydF4y2BaD.GydF4y2Ba莲座叶的数量在wt(GydF4y2BaNGydF4y2Ba = 15) andRALF1-OX.GydF4y2Ba(GydF4y2BaNGydF4y2Ba= 15) LD条件下。数据以均数±标准差表示,实验独立重复三次,结果相似(**)GydF4y2BaP.GydF4y2Ba< 0.01;单因素方差分析与Tukey检验)。GydF4y2BaE.GydF4y2Ba野生型开花基因型,GydF4y2Baralf1GydF4y2Ba和GydF4y2BaRALF1-RNAiGydF4y2Ba在LD条件下生长。GydF4y2BaFGydF4y2Ba开花时间是通过抽薹时莲座叶的数量来测定的。错误条表示SD (GydF4y2BaNGydF4y2Ba= 15)。这些实验独立地重复了三次,得到了相似的结果。统计学上显著差异用星号(*)表示GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba< 0.01;单因素方差分析与Tukey检验)。GydF4y2BaGGydF4y2Ba表达水平的GydF4y2BaFLC.GydF4y2BaqPCR检测7-d龄Col-0,GydF4y2BaRALF1-OX.GydF4y2Ba和GydF4y2Baralf1GydF4y2Ba突变的幼苗。误差条表示三个技术重复的标准差。白天和黑夜分别用白条和黑条表示。这些实验至少进行了四次。GydF4y2BaHGydF4y2BaFLC内含子1和内含子6在Col-0幼苗中的剪接效率GydF4y2BaRALF1-OX.GydF4y2Ba和GydF4y2Baralf1GydF4y2Ba突变体。幼苗在LD条件下生长7 d,收集和zt12。引物对F1/R1 '和F6 ' /R6分别用于检测FLC内含子1和6的未剪接RNA。引物对F1/R1和F6/R6检测拼接后的mRNA。实验共进行三次,条形为平均值±标准差(*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01,one-way ANOVA with Tukey’s test)
讨论GydF4y2Ba
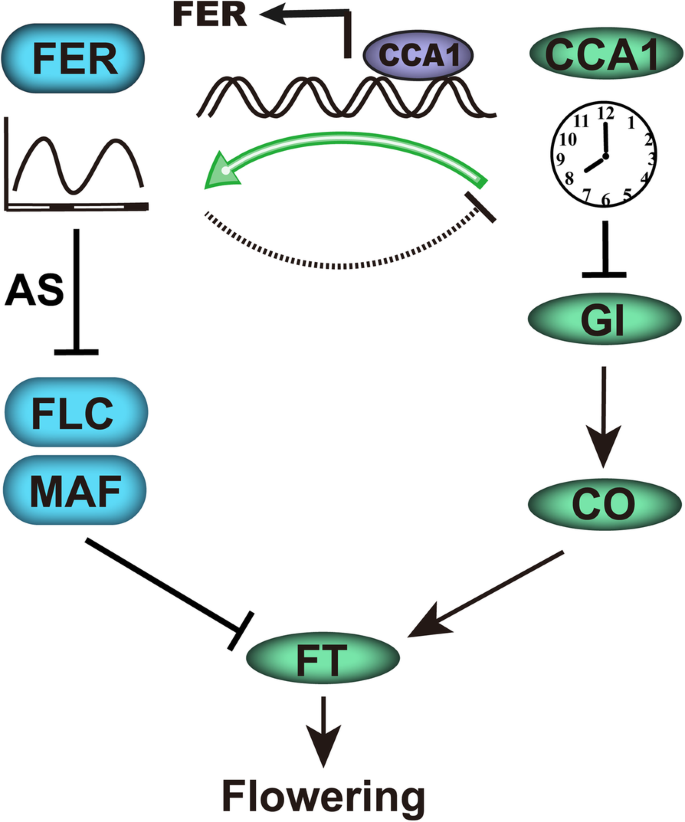
几个环境信号夹带昼夜振荡器。在这项研究中,我们发现FER仅作为时钟的简单输出,而且作为时钟基因的调节器。FER突变影响昼夜节律输出的周期长度和幅度(图。GydF4y2Ba3.GydF4y2Baa-f和附加文件GydF4y2Ba3.GydF4y2Ba:图S3A-D),从而抑制下游GydF4y2BaGI.GydF4y2Ba部分通过CO-FT途径,进一步延迟开花时间(图2)。GydF4y2Ba7.GydF4y2Ba).FER还参与其他的开花途径,主要通过抑制FLC和FLC相关的MAFs(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
昼夜节律时钟协调对多种环境挑战的响应,这些挑战是无柄植物无法避免的。更重要的是,许多细胞信号通路的强度是由昼夜节律时钟调控的,这个过程被称为昼夜节律门控[GydF4y2Ba45GydF4y2Ba].因此,生物钟对植物的生长和健康非常重要。这里,我们展示了GydF4y2Ba拿来GydF4y2Ba与昼夜节律一起波动(图。GydF4y2Ba1GydF4y2Baa - b)。为什么GydF4y2Ba拿来GydF4y2Ba在植物细胞中表现出一种节律?FER是植物生长和胁迫反应的通用调节剂[GydF4y2Ba28GydF4y2Ba那GydF4y2Ba37GydF4y2Ba],并作为胞外或胞内线索串扰的关键节点[GydF4y2Ba29GydF4y2Ba].我们建议每天的节奏GydF4y2Ba拿来GydF4y2Ba可能作为一个重要的输出生理门控和提供一个健康优势。例如,FER介导了对植物免疫反应的抑制[GydF4y2Ba32GydF4y2Ba],其mRNA的最低点大约出现在午夜和黎明,这两个时间主要以孢子产生和孢子传播为特征[GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba].这一发现与FER昼夜节律可能参与防御反应的假设相一致。此外,淀粉在白天积累,夜间降解,FER还调节叶片淀粉代谢[GydF4y2Ba48GydF4y2Ba].我们观察到GydF4y2Ba拿来GydF4y2Ba在拂晓开始增加,在zt4处达到峰值,然后在黄昏时减少(图4)。GydF4y2Ba1GydF4y2Baa),这与FER的昼夜节律可能也与淀粉代谢有关的假设相一致。更重要的是,每天的节奏GydF4y2Ba拿来GydF4y2Ba可能赋予FER平衡营养和生殖生长时间的能力,以响应环境信号的变化。GydF4y2Ba
一些研究表明,与FER相比,RALF在某些组织和/或环境反应中起相反的作用。例如,GydF4y2BaRALF22/23 -GydF4y2Ba过表达转基因植物和GydF4y2Bafer-4GydF4y2Ba突变体表现出类似的生长迟缓表型和对盐胁迫的敏感性增加[GydF4y2Ba37GydF4y2Ba].RALF1和FER在叶片生长中分别起负作用和正作用[GydF4y2Ba33GydF4y2Ba那GydF4y2Ba49GydF4y2Ba].在这里,我们发现RALF1和FER在开花和某些MRNA中具有不同的作用。这种现象的一种可能原因是FER可能会招募不同的下游因素,以满足其上下文特异性的角色。此外,RALF23,作为FER的另一个配体[GydF4y2Ba32GydF4y2Ba,也表达在茎尖。进一步的研究应该探究RALF23和FER是否在开花调控中发挥相同的作用。GydF4y2Ba
截至前mRNA的AS是一个重要的监管机制。据报道,若干蛋白质或信令途径在植物中调节。我们的研究表明,RALF1肽通过FER来影响开花相关基因,进一步调节开花时间。然而,RALF1-FER途径用于调节mRNA的机制仍然是较差的理解。另外,诸如许多MRNA的机制由RALF1-FER轴调节和RALF1-FER调节的mRNA的生理意义,如仍然未知,并且应该在进一步的研究中检查这些过程。GydF4y2Ba
结论GydF4y2Ba
在这里,我们发现,被CCA1上调的FER不仅输出时钟,而且调控时钟基因。该蛋白可能通过调控开花相关基因(包括FLC及其同源物(MAFs))的mRNA表达和AS来控制植物-生殖生长过渡。GydF4y2Ba.GydF4y2Ba
方法GydF4y2Ba
植物生长条件GydF4y2Ba
拟南芥GydF4y2Ba(Columbia生态型)在所有实验中均作为WT,除非另有说明。这GydF4y2Bafer-4, flc-3GydF4y2Ba突变体,GydF4y2Ba35 s::英国《金融时报》GydF4y2Ba那GydF4y2BaUBI :: FER-FLAGGydF4y2Ba(GydF4y2BaFER-OX.GydF4y2Ba),GydF4y2BasrnGydF4y2Ba已被描述[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].GydF4y2BaCCA1-OX.GydF4y2Ba由Paul P. Dijkwe提供[GydF4y2Ba51GydF4y2Ba],和GydF4y2Baralf1GydF4y2Ba突变体(SALK_036331) [GydF4y2Ba52GydF4y2Ba从Abrc获得并使用特定引物确认(附加文件GydF4y2Ba8.GydF4y2Ba:图S8A-B及附加文件GydF4y2Ba13GydF4y2Ba:表S5)。为GydF4y2Ba无论在哪里:RALF1-FlagGydF4y2Ba转基因植物(GydF4y2BaRALF1-OX.GydF4y2Ba),在控制下,将RALF1的全长CDS亚克隆到PCAMBIA 1301向量中GydF4y2Ba无论在哪里GydF4y2Ba启动子通过同源重组attB1和attB2位点(Gateway重组克隆技术)。这GydF4y2BaRALF1-OX.GydF4y2Ba行是使用GydF4y2Ba农杆菌属,GydF4y2Ba媒介花浸法,并使用特定的引物进行鉴定(附加文件GydF4y2Ba8.GydF4y2Ba:图S8C-D及附加文件GydF4y2Ba13GydF4y2Ba:表S5)。GydF4y2Ba
为了分析时钟基因的表达,种子在4°C、添加1.0%蔗糖和0.8%琼脂(pH 5.8)的1/2 MS培养基上种植3 d。在光照强度为50 ~ 60 μmol m的条件下,将种子转入16 h光照/8 h暗的LD或8 h光照/16 h暗的SD处理GydF4y2Ba−2GydF4y2Ba年代GydF4y2Ba−1GydF4y2Ba和22°C的恒定温度。7日龄幼苗在LD/SD条件下生长,然后转入zt24恒光条件下进行FER节律分析。GydF4y2Ba
RNA提取及qPCR分析GydF4y2Ba
对于mRNA表达分析,在液氮中收获样品并粉末。使用Trizol试剂(Ambion,15,596-026)提取总RNA,并使用DNase I(Takara)消化以除去基因组DNA。通过使用cDNA合成试剂盒(FERMENSA,K1622),通过1000ng的总RNA合成cDNA。使用MX3000P(Stratagene)与Sybr预混物进行QPCRGydF4y2Ba前任GydF4y2BaTaq II(豆类)。用于qPCR分析的引物列于附加文件GydF4y2Ba13GydF4y2Ba:表S5,和GydF4y2BaACTIN2GydF4y2Ba作为昼夜节律实验的内部参考。使用42循环程序(95°C, 15 s;60°C, 20 s / cycle)。GydF4y2Ba
的表达式GydF4y2Ba拿来GydF4y2Ba使用网络工具“Diurnal”对相关基因亚家族进行调查,SD下的基因表达数据根据COL_SD (GydF4y2Ba拟南芥GydF4y2BaCol-0在SD昼夜条件下生长),LD下的基因表达数据以长日条件(GydF4y2Ba拟南芥GydF4y2BaLer菌株,生长在LD的昼夜条件下)。LL下基因表达数据按LL23_LDHH [GydF4y2Ba拟南芥GydF4y2BaCOL-0在昼夜节束光(12h),光(12h)/热(24小时)下生长,并进行光(24小时)。使用BIODARE2分析时钟基因的周期和幅度(GydF4y2Bahttps://biodare2.ed.ac.ukGydF4y2Ba)及FFT NNLS方法[GydF4y2Ba41GydF4y2Ba].GydF4y2Ba
Semi-qPCR分析GydF4y2Ba
七天历史的Col-0和GydF4y2Bafer-4GydF4y2Ba幼苗在22°C的低温条件下生长,在zt4采集。在RALF1肽处理实验中,将7 d龄的幼苗用1/2液体MS处理3 h,然后在zt4下收集,液氮粉末状提取RNA。利用半定量PCR (semi-qPCR)分析开花基因的AS(如:GydF4y2BaMAF1GydF4y2Ba那GydF4y2BaMAF2GydF4y2Ba,GydF4y2BaMAF3GydF4y2Ba),GydF4y2Ba蛋白磷酸酶2GydF4y2Ba(GydF4y2Bapp2a.GydF4y2Ba)作为参照基因,如RNA剪接实验所述[GydF4y2Ba53GydF4y2Ba].FLC内含子保留1和6的引物根据Xiong等[GydF4y2Ba22GydF4y2Ba].用2× Master Mix (TsingKe, TSE004)按照生产说明书配制半qpcr混合剂。反应在95°C初始孵育10分钟,随后在95°C孵育15 s, 55°C孵育30 s, 72°C孵育1 min/kb,共26个循环。半定量pcr产物在1.5%琼脂糖凝胶上电泳,溴化乙啶染色。用于半qpcr分析的引物序列见附加文件GydF4y2Ba13GydF4y2Ba:表S5。GydF4y2Ba
花期的测定GydF4y2Ba
对于玫瑰花叶测量,在22°C的LD条件下在土壤中以60°C的温度为80-100μmolm的温室,在土壤中以随机方式生长。GydF4y2Ba−2GydF4y2Ba年代GydF4y2Ba−1GydF4y2Ba.为每个独立实验种植每种基因型的40多种植物。根据莲座中心的中心的可见花蕾和从三个生物学重复开始的日子来确定开花时间。GydF4y2Ba
免疫印迹分析GydF4y2Ba
用于分析LD条件下的蛋白质水平,WT和GydF4y2BaPFER :: FER-GFPGydF4y2Ba植株在1/ 2ms培养基上种植7 d。收获样品并在液氮中粉末状。然后,用缓冲液(50 mM Tris-HCl pH 7.5, 150 mM NaCl, 5.0%甘油,EDTA-2Na, 1.0% Triton X-100)提取200 mg幼苗30 min,然后用10.0% SDS-PAGE分离,检测同一条带内两种形式的FER(磷酸化和非磷酸化)。与我们之前的研究相反,我们没有在SDS-PAGE凝胶中加入甘油[GydF4y2Ba27GydF4y2Ba,我们缩短了运行时间,便于在单个波段内调查总的FER水平。用槽转移法将凝胶印迹在NC过滤膜上。用5.0%脱脂乳在4℃搅拌下阻断印迹1小时,与抗gfp抗体(CMC, 1:5000)和FER抗体(1:3000)在RT搅拌下孵育4 - 5小时,然后用TBS-T在RT搅拌下洗涤3次,每次7分钟。将印迹与牛奶中1:10000稀释的二抗在室温下搅拌孵育1小时,进行增强化学发光检测(Thermo Scientific, 34,075)。以β-肌动蛋白作为负载对照。GydF4y2Ba
基因克隆和双luc分析GydF4y2Ba
提取基因组DNAGydF4y2Ba拟南芥GydF4y2Ba叶子使用DNeasy植物迷你套件(Qiagen,69,104),启动子GydF4y2Ba拿来GydF4y2Ba(GydF4y2BapfGydF4y2Ba)从基因组DNA中克隆,其编码区GydF4y2BaCCA1GydF4y2Ba基因从cDNA中克隆。用于PCR分析的基因特异性引物列于附加文件GydF4y2Ba13GydF4y2Ba:表S5。的放大产物GydF4y2BapfGydF4y2Ba克隆到pGreenII-LUCGydF4y2BaBamGydF4y2Ba嗨GydF4y2Ba以区域GydF4y2BaI位点添加萤火虫LUC报告基因GydF4y2BaCCA1GydF4y2Ba克隆到pEGAD中生成35S::CCA1-pEGAD效应体[GydF4y2Ba54GydF4y2Ba].此外,35S启动子控制下携带Renilla (REN) LUC的pGreenII-LUC载体作为内控。CCA1与GydF4y2Ba拿来GydF4y2Ba启动子按LUC与REN的比值进行评价。报告向量和效应向量被共同转化成GydF4y2Ba拟南芥GydF4y2Ba使用PEG方法如前所述的原生质体[GydF4y2Ba43GydF4y2Ba].在22℃温育24小时后,使用双LUC测定试剂盒(Promega,E1910)测定转化的原生质体。根据制造商的说明,使用Fluoroskan Ascent Fl(Thermo Scientific)评估Luc和Ren的读数。GydF4y2Ba
EMSA.GydF4y2Ba
对于EMSA,表达了GST-CCA1的重组蛋白GydF4y2Ba大肠杆菌GydF4y2Ba然后用GST珠进行纯化。将20 fmol fitc标记探针与5 μg纯化的GST-CCA1蛋白孵育,进行dna -蛋白结合反应。竞争实验,5μg纯化GST-CCA1蛋白和100×无标号的竞争对手或100×特异性的竞争对手B孵化在绑定缓冲(100毫米Tris-HCl pH = 8.0,德勤5毫米,2.5毫米EDTA,特里同x - 100和25%甘油0.25%)15分钟,其次是增加20 fmol FITC-labeled调查了20分钟。然后,将结合反应混合物加载到4% PAGE凝胶上(不含SDS),在0.5× TBE缓冲液中溶解40分钟,然后在荧光成像板上曝光。GydF4y2Ba
芯片分析GydF4y2Ba
ChIP分析如前所述[GydF4y2Ba55GydF4y2Ba].简而言之,三周大的col0和GydF4y2Ba35 s:: CCA1-MycGydF4y2Ba在LD条件下的土壤中成长在ZT 0下,并用37mL萃取缓冲液1(0.4M蔗糖; 10mM Tris-HCl,pH 8.0; 5mmβ-Me; 0.1mM PMSF)处理。在真空下含有1%甲醛15分钟。加入最终浓度为0.125M甘氨酸以淬灭交联,并施加真空5分钟。将植物用水冲洗两次,研磨成含有液氮的粉末,并在萃取缓冲液1 [0.4 m蔗糖;10 mm tris-HCl,pH 8.0;5 mmβ-me;0.1毫米PMSF;完全蛋白酶抑制剂鸡尾酒片剂(Roche)]。将过滤的溶液在4℃下以2100g离心20分钟,将沉淀重悬于1.5ml萃取缓冲液2 [0.25μm蔗糖;10 mm tris-hcl pH 8.0; 10 mM MgCl2GydF4y2Ba,1%triton x-100;0.1毫米PMSF;5 mmβ-me;完全蛋白酶抑制剂鸡尾酒片剂(Roche)]。将样品在4℃下以12000g离心10分钟,并在核裂解缓冲液中裂解[50mM Tris-HCl pH 8.0,10mM EDTA,1%SDS,0.1mM PMSF和蛋白酶抑制剂鸡尾酒片剂(Roche)].将染色质溶液超声处理以将DNA剪切至200-600bp,将超声化的染色质悬浮液以12000g离心5分钟,并将上清液在芯片稀释剂缓冲液中稀释10倍[16.7mm Tris-HCl pH8.0,167mm]NaCl,1.1%Triton X-100,1.2mM EDTA,0.1mM PMSF,完全蛋白酶抑制剂鸡尾酒片(Roche)]。将抗Myc抗体预先结合至蛋白A / g磁珠,与染色质溶液混合,并在4℃下孵育过夜。然后用低盐缓冲液(50mM Tris-HCl pH 8.0,150mM NaCl,0.2%SDS,0.5%Triton X-100,2mM EDTA)洗涤珠子,高盐缓冲液(20mM Tris-HCl pH 8.0,500mM NaCl,0.2%SDS,0.5%Triton X-100,2mM EDTA),LiCl洗涤缓冲液(20mM Tris-HCl pH 8.0,0.25M LiCl,1%NP 40,1%脱氧胆酸盐,1mM EDTA) and TE Washing Buffer (10 mM Tris-HCl pH 8.0, 1 mM EDTA). The chromatin fragments were eluted with Elution Buffer (50 mM Tris-HCl pH 8.0, 10 mM EDTA, 1% SDS) and incubated at 65 °C for 12 h. The eluate was treated with proteinase K to digest proteins. The DNA was purified with the DNA purification kit, and 50 μl TE Buffer was added to elution. 1 μl DNA sample was used for qPCR, and the primers used for qPCR are listed in Additional file13GydF4y2Ba:表S5。GydF4y2Ba
FLC测量的拼接效率GydF4y2Ba
FLC的剪接效率如前所述[GydF4y2Ba44GydF4y2Ba].简而言之,将5μg的总RNA被反转转录为cDNA,CDNA用作QPCR中的模板,以扩增FLC内含子1,用底漆F1和R1拼接,夹持拼接结;FLC内含子6用底漆F6和R6拼接,覆盖拼接结;FLC内含子1与引物F1和R1',FLC内含子6与引物F6'和R6未亮起。拼接效率由剪接RNA归一化的剪接RNA的水平计算为未燃烧的RNA水平。GydF4y2Ba
RNA-SEQ分析GydF4y2Ba
七天历史的Col-0和GydF4y2Bafer-4GydF4y2Ba在LD条件下生长并在ZT 4上收集的幼苗用于总RNA提取。在制造商的协议之后用Mirvana miRNA隔离套件(Ambion,AM1561)提取总RNA。使用Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)评估RNA完整性。具有RNA完整性数(rin)≥7的样品进行随后的分析。根据制造商的说明,使用Truseq Stranded MRNA LT样品制剂套件(Illumina,San Diego,CA)构建图书馆。Illumina测序在上海OE Biotech进行。有限公司与Illumina测序平台(Illumina Hiseq X十)。GydF4y2Ba
使用NGS QC工具包处理原始数据(原始读取)[GydF4y2Ba56GydF4y2Ba].低质量读被删除。剩下的读数被映射到GydF4y2Ba拟南芥GydF4y2Ba使用hisat2的TAIR10基因组[GydF4y2Ba57GydF4y2Ba].通过rMATS识别剪接事件,根据Matlin等人[GydF4y2Ba58GydF4y2Ba那GydF4y2Ba59GydF4y2Ba].GydF4y2BaP.GydF4y2Ba设置值< 0.05和包含水平差异> 0.05或<−0.05为剪接差异显著的阈值。每个基因的FPKM值用袖扣计算[GydF4y2Ba60GydF4y2Ba],每个基因的读计数由htseq-count获得[GydF4y2Ba61GydF4y2Ba].使用DESEQ(2012)函数估算率和Nbinomtest来鉴定差异表达基因(DEGS)。GydF4y2BaP.GydF4y2Ba值< 0.05,倍数变化> 2或倍数变化< 0.5为显著差异表达的阈值。通过聚类分析,探讨基因表达模式。将原始RNA-seq数据上传到NCBI数据库,登录号为SRX5988587。GydF4y2Ba
统计数据GydF4y2Ba
使用SPSS(版本17.0)软件,通过学生的T-Test或通过多变量比较(单向ANOVA)来分析数据的任何显着差异。所有统计测试都清楚地描述了图例和/或方法部分。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。GydF4y2Ba
缩写GydF4y2Ba
- 为:GydF4y2Ba
-
可变剪接GydF4y2Ba
- CCA1:GydF4y2Ba
-
昼夜CLOCK-ASSOCIATED1GydF4y2Ba
- CCA1-OX:GydF4y2Ba
-
CCA1过度表达GydF4y2Ba
- 有限公司:GydF4y2Ba
-
君士坦斯GydF4y2Ba
- 度:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- 电子商务:GydF4y2Ba
-
晚上复杂GydF4y2Ba
- ELF3:GydF4y2Ba
-
早开3.GydF4y2Ba
- EMF2:GydF4y2Ba
-
胚胎花2GydF4y2Ba
- FCA:GydF4y2Ba
-
开花控制位点aGydF4y2Ba
- 带:GydF4y2Ba
-
FERONIAGydF4y2Ba
- 方法:GydF4y2Ba
-
开花轨迹CGydF4y2Ba
- 盛名:GydF4y2Ba
-
开花轨迹DGydF4y2Ba
- FLM:GydF4y2Ba
-
开花轨迹米GydF4y2Ba
- 英国《金融时报》:GydF4y2Ba
-
开花轨迹TGydF4y2Ba
- GI:GydF4y2Ba
-
GIGANTEAGydF4y2Ba
- HERK1:GydF4y2Ba
-
HERCULES1GydF4y2Ba
- LD:GydF4y2Ba
-
漫长的一天GydF4y2Ba
- LHY:GydF4y2Ba
-
晚细长的幼杆子GydF4y2Ba
- 噢,GydF4y2Ba
-
连续光GydF4y2Ba
- 勒克斯:GydF4y2Ba
-
勒克利斯莫GydF4y2Ba
- 加:GydF4y2Ba
-
疯狂影响开花GydF4y2Ba
- PP2A:GydF4y2Ba
-
蛋白磷酸酶2GydF4y2Ba
- PRMT5:GydF4y2Ba
-
蛋白质精氨酸甲基转移酶GydF4y2Ba
- PRR7:GydF4y2Ba
-
伪响应调节器7GydF4y2Ba
- PRR9:GydF4y2Ba
-
伪响应调节器9GydF4y2Ba
- 拉尔夫:GydF4y2Ba
-
快速碱化因素GydF4y2Ba
- SC35:GydF4y2Ba
-
35-KDA拼接因子GydF4y2Ba
- SD:GydF4y2Ba
-
短暂的一天GydF4y2Ba
- SNRNPS:GydF4y2Ba
-
小的核糖核蛋白颗粒GydF4y2Ba
- SOC1:GydF4y2Ba
-
常数抑制因子1GydF4y2Ba
- SR:GydF4y2Ba
-
丝氨酸/精氨酸丰富GydF4y2Ba
- 高级副总裁:GydF4y2Ba
-
营养期短GydF4y2Ba
- :“家庭主父”GydF4y2Ba
-
忒修斯1GydF4y2Ba
- TOC1:GydF4y2Ba
-
CAB表达的时间1GydF4y2Ba
- VRN1:GydF4y2Ba
-
春化1GydF4y2Ba
- ZT型:GydF4y2Ba
-
授时因子时间GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
《植物生理过程与生理动态的整合》。[j] .光子学报。2015;16(10):598-610。GydF4y2Ba
- 2.GydF4y2Ba
Cui Z,Xu Q,王X.核心时钟通过拟南芥前mRNA剪接调节。J Exp Bot。2014; 65(8):1973-80。GydF4y2Ba
- 3.GydF4y2Ba
高等植物的昼夜节律系统。植物学报2009;60:357-77。GydF4y2Ba
- 4.GydF4y2Ba
Nakamichi N,Kiba T,Henriques R,Mizuno T,Chua NH,Sakakibara H.伪响应调节器9,7和5是拟南芥昼夜节奏中的转录压缩机。植物细胞。2010; 22(3):594-605。GydF4y2Ba
- 5.GydF4y2Ba
Farre EM, Harmer SL, Harmon FG, Yanovsky MJ, Kay SA。PRR7和PRR9在拟南芥生物钟中的重叠和不同作用。咕咕叫医学杂志2005;15(1):47-54。GydF4y2Ba
- 6.GydF4y2Ba
大山,杨诺夫斯基,哈蒙FG,马斯P,凯萨。拟南芥生物钟内TOC1和LHY/CCA1的相互调节科学。2001;293(5531):880 - 3。GydF4y2Ba
- 7.GydF4y2Ba
Gendron JM, Pruneda-Paz JL, Doherty CJ, Gross AM, Kang SE, Kay SA。拟南芥生物钟蛋白TOC1是一种dna结合转录因子。中国科学院院刊2012;109(8):3167-72。GydF4y2Ba
- 8.GydF4y2Ba
黄卫东,黄卫东,黄卫东。拟南芥昼夜节律钟的核心结构。科学。2012;336(6077):75 - 9。GydF4y2Ba
- 9.GydF4y2Ba
Nusinow DA, Helfer A, Hamilton EE, King JJ, Imaizumi T, Schultz TF, Farre EM, Kay SA。ELF4-ELF3-LUX复合物将生物钟与下胚轴生长的日控制联系起来。自然。2011;475(7356):398 - 402。GydF4y2Ba
- 10.GydF4y2Ba
Herrero E,Kolmos E,Bujdoso N,Yuan Y,Wang M,Berns MC,Uhlworm H,Zerean G,Saini R,Jaskolski M等。早期开花4在核中招募早期开花3维持拟南芥昼夜节奏。植物细胞。2012; 24(2):428-43。GydF4y2Ba
- 11.GydF4y2Ba
Fowler S,Lee K,Onouchi H,Samach A,Richardson K,Morris B,Conceand G,Putiill J. Gigantea:调节拟南芥中的光周期开花的昼夜时钟控制基因,并用几个可能的膜跨越域编码蛋白质。Embo J. 1999; 18(17):4679-88。GydF4y2Ba
- 12.GydF4y2Ba
Suarez-Lopez P, Wheatley K, Robson F, Onouchi H, Valverde F, Coupland G. CONSTANS在生物钟和拟南芥开花控制之间的调节。大自然。2001;410(6832):1116 - 20。GydF4y2Ba
- 13.GydF4y2Ba
Bohlenius H,Huang T,Charbonnel-Campaa L,Brunner Am,Jansson S,施特劳斯SH,Nilsson O.Co / FT监管模块控制树木中开花和季节性生长停滞的时间。科学。2006; 312(5776):1040-3。GydF4y2Ba
- 14.GydF4y2Ba
宋永华,沈金生,金月-舒舒立,黄志明。叶片光周期开花的时间测量机制。植物学报2015;66:441-64。GydF4y2Ba
- 15.GydF4y2Ba
王志强,王志强,王志强,等。光周期开花过程中CONSTANS蛋白的调控。科学。2004;303(5660):1003 - 6。GydF4y2Ba
- 16.GydF4y2Ba
Onouchi H,Igeno Mi,Perilleux c,Graves K,植物肠杆菌诱变过表达致癌的植物表明了拟南芥开花时间基因之间的新型相互作用。植物细胞。2000; 12(6):885-900。GydF4y2Ba
- 17.GydF4y2Ba
康斯坦斯靶基因在拟南芥生殖发育中的作用。科学。2000;288(5471):1613 - 6。GydF4y2Ba
- 18.GydF4y2Ba
Michaels SD, Amasino RM。开花位点C编码一个新的MADS结构域蛋白,作为开花的抑制因子。植物细胞。1999;11(5):949 - 56。GydF4y2Ba
- 19.GydF4y2Ba
花阻遏基因FLC的调控:染色质背景下转录的复杂性。植物学报。2011;14(1):38-44。GydF4y2Ba
- 20。GydF4y2Ba
Yan Q,夏X,Sun Z,方Y.拟南芥SC35和SC35样丝氨酸/精氨酸富含蛋白质的耗尽会影响基因子集的转录和剪接。Plos Genet。2017; 13(3):E1006663。GydF4y2Ba
- 21。GydF4y2Ba
吴智,朱丹,林旭,苗静,顾磊,邓旭,杨强,孙凯,朱丹,曹晓峰。RZ-1B和RZ-1C的rna结合蛋白在拟南芥发育过程中pre-mRNA剪接和基因表达的调控中起着关键作用。植物细胞。2015;28(1):55 - 73。GydF4y2Ba
- 22。GydF4y2Ba
熊F,任JJ,Yu Q,Wang Yy,Lu CC,Kong LJ,Otegui Ms,Wang XL。ATU2AF65B通过调节ABI5和FLC中的前体信使RNA剪接,在拟南芥中的脱落酸介导开花。新植物。2019年。GydF4y2Bahttps://doi.org/10.1111/nph.15756GydF4y2Ba.GydF4y2Ba
- 23。GydF4y2Ba
摩尔·MJ,新泽西州普罗德富特Pre-mRNA的加工可以追溯到转录和转译。细胞。2009;136(4):688 - 700。GydF4y2Ba
- 24。GydF4y2Ba
拟南芥剪接变异表达对拟南芥开花的影响acta botanica yunnanica(云南植物研究). 2013;41(1-2):57-69。GydF4y2Ba
- 25。GydF4y2Ba
Posé D, Verhage L, Ott F, Yant L, Mathieu J, Angenent GC, Immink RGH, Schmid m。大自然。2013;503(7476):414 - 7。GydF4y2Ba
- 26。GydF4y2Ba
王张Z,张,张Y, X,李,李问曰,李问,张叶,徐Y,雪Y,保庄K,美国拟南芥花发起者SKB1赋予高盐宽容通过改变组蛋白调节转录和pre-mRNA拼接H4R3和小核核糖核蛋白LSM4甲基化。植物细胞。2011;23(1):396 - 411。GydF4y2Ba
- 27。GydF4y2Ba
陈俊,俞F,刘y,du c,li x,朱S,王x,lan w,rodriguez pl,liu x等。Feronia与ABI2型磷酸酶相互作用,以便于在拟南芥中脱离酸和RALF肽之间的信号交叉谈话。Proc Natl Acad Sci U S A. 2016; 113(37):E5519-27。GydF4y2Ba
- 28。GydF4y2Ba
Nissen KS, Willats W, Malinovsky FG。了解CrRLK1L的功能:细胞壁和生长控制。植物学报,2016;21(6):516-27。GydF4y2Ba
- 29。GydF4y2Ba
廖华,唐瑞玲,张晓霞,栾树华,于凤峰。FERONIA受体激酶在激素信号转导和应激反应中的作用。植物生理学报。2017;58(7):1143-50。GydF4y2Ba
- 30.GydF4y2Ba
GE Z,Temselhaus T,Qu L. CRRLK1L受体复合物如何感知RALF信号。趋势植物SCI。2019; 24(11):978-81。GydF4y2Ba
- 31.GydF4y2Ba
Haruta M,Sabat G,Stecker K,Minkoff BB,Sussman Mr。肽激素及其受体蛋白激酶调节植物细胞膨胀。科学。2014; 343(6169):408-11。GydF4y2Ba
- 32.GydF4y2Ba
受体激酶FER是一种受ralf调控的支架,调控植物免疫信号通路。科学。2017;355(6322):287 - 9。GydF4y2Ba
- 33.GydF4y2Ba
张AY,吴hm。THESEUS 1, FERONIA及其亲属:细胞壁感应受体激酶家族?植物学报。2011;14(6):632-41。GydF4y2Ba
- 34.GydF4y2Ba
段琦,Kita D,李超,张AY,吴hm。FERONIA受体样激酶调控根毛发育的RHO GTPase信号通路。中国科学(d辑:地球科学)2010;GydF4y2Ba
- 35.GydF4y2Ba
Feng W, Kita D, Peaucelle A, Cartwright HN, Doan V, Duan Q, Liu MC, Maman J, Steinhorst L, Schmitz-Thom I, et al., 2014 . (sci)FERONIA受体激酶通过Ca(2+)信号通路在盐胁迫下维持细胞壁的完整性。咕咕叫医学杂志。2018;28(5):666 - 75。GydF4y2Ba
- 36.GydF4y2Ba
郭H,Nolan TM,Song G,Liu S,Xie Z,Chen J,Schnable PS,Walley JW,Yin Y.Feronia受体激酶通过抑制拟南芥中的茉莉酸信号传导来促进植物免疫。Curr Biol。2018; 28(20):3316-24。GydF4y2Ba
- 37.GydF4y2Ba
赵灿,余忠,姜伟,朱鹏,徐传聪,张磊,陶华,Lozano-Duran R,朱家强。富含亮氨酸重复延伸蛋白调节拟南芥的耐盐性。中国科学(d辑:地球科学)2018;GydF4y2Ba
- 38.GydF4y2Ba
Mockler TC, Michael TP, Priest HD, Shen R, Sullivan CM, Givan SA, McEntee C, Kay SA, Chory J. The DIURNAL项目:DIURNAL和昼夜表达分析,基于模型的模式匹配和启动子分析。《冷泉生物学》2007;72:353-63。GydF4y2Ba
- 39.GydF4y2Ba
Nagel DH,Doherty CJ,Pruneda-Paz JL,Schmitz RJ,Ecker Jr,Kay Sa。基因组 - 宽识别CCA1靶标在拟南芥中揭示了扩展的时钟网络。Proc Natl Acad Sci U S A. 2015; 112(34):E4802-10。GydF4y2Ba
- 40.GydF4y2Ba
生物时钟- associated1基因对拟南芥昼夜节律钟的直接抑制作用。植物细胞。2016;28(3):696 - 711。GydF4y2Ba
- 41.GydF4y2Ba
zelinski T, Moore AM, Troup E, Halliday KJ, Millar AJ。昼夜节律数据周期估计方法的优点和局限性。《公共科学图书馆•综合》。2014;9 (5):e96462。GydF4y2Ba
- 42.GydF4y2Ba
2 .王志强,王志强,王志强。拟南芥中CCA1和ELF3的互作对下胚轴长度和开花时间的影响。植物杂志。2012;158(2):1079 - 88。GydF4y2Ba
- 43.GydF4y2Ba
Yu F,Qian L,Nibau C,Duan Q,Kita D,Levasseur K,Li X,Lu C,Li H,Hou C等。Feronia受体激酶途径通过激活ABI2磷酸酶抑制拟南芥中的脱落酸信号。Proc Natl Acad SCI U S A. 2012; 109(36):14693-8。GydF4y2Ba
- 44。GydF4y2Ba
吴马夸特,Raitskin O, Z,太阳问院长刘F c .反义转录的功能的后果拼接COOLAIR方法转录。摩尔细胞。2014;54(1):156 - 65。GydF4y2Ba
- 45。GydF4y2Ba
生物时钟在植物中的作用。植物科学进展。2015;20(4):230-7。GydF4y2Ba
- 46。GydF4y2Ba
Slusarenko AJ, Schlaich NL。拟南芥霜霉病由透明壳孢菌(原Peronospora parasitica)引起。植物学报。2003;4(3):159-70。GydF4y2Ba
- 47。GydF4y2Ba
王伟,Barnaby JY, Tada Y, Li H, Tor M, Caldelari D, Lee DU,付晓东,董欣。植物免疫应答的中枢生理节律调控机制。大自然。2011;470(7332):110 - 4。GydF4y2Ba
- 48。GydF4y2Ba
杨涛,王丽,李春华,刘玉玲,朱胜,戚玉英,刘昕,林强,栾淑芳,于飞。受体蛋白激酶FERONIA与甘油醛-3-磷酸脱氢酶的相互作用对叶片淀粉积累的影响。生物化学学报。2015;465(1):77-82。GydF4y2Ba
- 49。GydF4y2Ba
Bergonci T,Ribeiro B,Ceciliato PH,Guerrero-Abad JC,Silva-Filho MC,Mora DS。Arabidopsis Thaliana RALF1反对芸苔类化合物对根细胞伸长和侧根形成的影响。J Exp Bot。2014; 65(8):2219-30。GydF4y2Ba
- 50。GydF4y2Ba
何锐,李旭,钟敏,严军,季锐,李旭,王强,吴东,孙敏,唐东,等。在拟南芥中,光响应型F-box蛋白FOF2通过促进FLC表达调控花的开始。工厂j . 2017, 91(5): 788 - 801。GydF4y2Ba
- 51.GydF4y2Ba
生物节律时钟相关1调节ROS稳态和氧化应激反应。中国科学院院刊2012;109(42):17129-34。GydF4y2Ba
- 52.GydF4y2Ba
杜超,李晓霞,陈静,陈伟,李波,李超,王丽,李军,赵旭,林杰,刘旭,栾淑芳,于芳。受体激酶复合物对植物根生长的抑制作用GydF4y2Ba拟南芥GydF4y2Ba.Proc Natl Acad Sci U S A. 2016; 113(51):E8326-34。GydF4y2Ba
- 53.GydF4y2Ba
James AB, Syed NH, Bordage S, Marshall J, Nimmo GA, Jenkins GI, Herzyk P, Brown JW, Nimmo HG.可变剪接介导拟南芥生物钟对温度变化的响应。植物细胞,2012;24(3):961 - 81。GydF4y2Ba
- 54.GydF4y2Ba
Hellens RP,Allan AC,Friel En,Bolitho K,Grafton K,Templeton MD,Karunairetnam S,Gleave AP,Laing Wa。功能基因组学的瞬时表达载体,植物中启动子活性的定量和RNA沉默。植物方法。2005; 1:13。GydF4y2Ba
- 55.GydF4y2Ba
Liu H ., Yu X ., Li K ., Klejnot J ., Yang H ., liisiero D ., Lin C., Lin C. effects of CRY2 and CIB1 on转录和花启动的相互作用。科学。2008;322(5907):1535 - 9。GydF4y2Ba
- 56.GydF4y2Ba
Patel RK,Jain M.NGS QC Toolkit:用于下一代测序数据的质量控制的工具包。Plos一个。2012; 7(2):E30619。GydF4y2Ba
- 57.GydF4y2Ba
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。GydF4y2Ba
- 58.GydF4y2Ba
沉S,Park JW,Lu ZX,Lin L,Henry Md,吴yn,周Q,兴Y.RMATS:从复制RNA-SEQ数据中的差分替代拼接的鲁棒和灵活检测。Proc Natl Acad Sci U S A. 2014; 111(51):E5593-601。GydF4y2Ba
- 59.GydF4y2Ba
Matlin AJ,Clark F,Smith CW。了解替代拼接:朝向蜂窝代码。NAT Rev Mol Cell Biol。2005; 6(5):386-98。GydF4y2Ba
- 60。GydF4y2Ba
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验分析。NAT PROTOC。2012; 7(3):562-78。GydF4y2Ba
- 61。GydF4y2Ba
Anders S,Pyl Pt,Huber W. htseq - 使用高吞吐量排序数据的Python框架。生物信息学。2015; 31(2):166-9。GydF4y2Ba
致谢GydF4y2Ba
我们感谢Hongtao Liu,Paul P. Dijkwe,以及Alice Cheung提供本研究中使用的突变体。GydF4y2Ba
种子的来源GydF4y2Ba
这GydF4y2Bafer-4, flc-3GydF4y2Ba突变体,GydF4y2Ba35 s::英国《金融时报》GydF4y2Ba那GydF4y2BaUBI :: FER-FLAGGydF4y2Ba(GydF4y2BaFER-OX.GydF4y2Ba),GydF4y2BasrnGydF4y2Ba已被描述[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].GydF4y2BaCCA1-OX.GydF4y2Ba由Paul P. Dijkwe提供[GydF4y2Ba51GydF4y2Ba],和GydF4y2Baralf1GydF4y2Ba突变体(SALK_036331)来源于ABRC。GydF4y2Ba
资金GydF4y2Ba
来自中国国家自然科学基金的补助金(NSFC-31571444,31400232)支持这项工作。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
FY和LW构思了项目和设计的研究;LW,TY,BW和XL进行了研究;QL,FY贡献了新的试剂/分析工具;FY,LW和SL分析数据并写了这篇论文;所有作者审查并批准了发布的稿件。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
表达水平的GydF4y2Ba拿来GydF4y2Ba在LD,SD和LL下。使用基于Web的工具的条件GydF4y2Ba日GydF4y2Ba的表达GydF4y2Ba拿来GydF4y2Ba与GydF4y2Ba拟南芥GydF4y2Ba哥伦比亚菌株0在SD昼夜条件下生长。的表达GydF4y2Ba拿来GydF4y2Ba在LD条件下与GydF4y2Ba拟南芥GydF4y2Ba在LD昼夜节律条件下生长。的表达GydF4y2Ba拿来GydF4y2Ba在LL条件下与GydF4y2Ba拟南芥GydF4y2BaCol-0在昼夜光照条件下(12 h、12 h和24 h)生长。GydF4y2Ba
附加文件2:图S2。GydF4y2Ba
染色质的几个GydF4y2BaCrRLK1LGydF4y2Ba含有EE基序(A)CCA1结合EE基序的亚家族基因。(b)在几个染色体中含有EE基序的序列GydF4y2BaCrRLK1LGydF4y2Ba亚科的基因。数字表示从ATG起始密码子上游开始的序列长度。GydF4y2Ba
附加文件3:图S3。GydF4y2Ba
fer-4GydF4y2Ba突变体改变某些时钟基因的振幅(E) qPCR分析GydF4y2BaCCA1GydF4y2Ba(一种),GydF4y2BaLHYGydF4y2Ba(B),GydF4y2BaTOC1.GydF4y2Ba(C)和GydF4y2BaPRR7GydF4y2Ba(D) WT和GydF4y2Bafer-4GydF4y2BaLD下的突变植物。以3-H间隔收获7天幼苗。白天和黑夜分别用白条和黑条表示。使用BIODARE2分析幅度。所有实验均以相似的结果进行至少三次,误差条表示三种技术复制的SD(*GydF4y2BaP.GydF4y2Ba< 0.05, * *GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).
附加文件4:图S4。GydF4y2Ba
亏损的延误开花GydF4y2Ba拟南芥GydF4y2Ba(A) WT (C24)的开花基因型GydF4y2BasrnGydF4y2Ba在LD条件下突变体(另一个FER NULL突变体)。在45d的强度为50μmolM-2 S-1的光条件下植物生长。显示了三个独立重复的代表性实验。(b)随着LD条件下的花卉日为花的开花时间。值是至少15株植物的平均值±SD。星号表示显着差异(**GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。(C)野生型莲座叶片数(GydF4y2BaNGydF4y2Ba= 15)和GydF4y2BasrnGydF4y2Ba(GydF4y2BaNGydF4y2Ba= 15) LD条件下。条形图表示SD (**)GydF4y2BaP.GydF4y2Ba< 0.01,单因素方差分析与Tukey’s检验)。GydF4y2Ba
附加文件5:图S5。GydF4y2Ba
未剪接的FLC内含子1和内含子6的相对mRNA水平下降GydF4y2Bafer-4GydF4y2Ba突变体。从LD条件下生长的7 d龄幼苗中提取总RNA, zt12采集总RNA。引物对F1/R1 '和F6 ' /R6分别用于检测FLC内含子1和6的未剪接RNA。引物对F1/R1和F6/R6检测拼接后的mRNA。实验进行了三次,条形图表示平均值±SD (**)GydF4y2BaP.GydF4y2Ba < 0.01, Student’s t-test).
附加文件6:图S6。GydF4y2Ba
野生型和野生型RNA-seq数据的质量分析GydF4y2Bafer-4GydF4y2Ba(A) RNA reads作图结果。(B) RNA-seq读覆盖率在Col-0和Col-0中的分布GydF4y2Bafer-4GydF4y2Ba沿着转录单位的长度绘制突变体。x轴表示基因体的百分位数,y轴表示读取数。(C)沿着注释的rna序列的分布GydF4y2Ba拟南芥GydF4y2Ba在col0和GydF4y2Bafer-4。GydF4y2Ba在映射的reads中,超过99%的reads映射到注释的外显子。(D)转录本上调或下调基因的总结GydF4y2Bafer-4GydF4y2Ba通过RNA-seq实验确定突变体。GydF4y2Ba
附加文件7:图S7。GydF4y2Ba
QPCR分析RALF1 mRNA水平在不同组织中RALF1(A),RALF23(B)表达式模式如条形图:GydF4y2Bahttp://bar.utoronto.ca/GydF4y2Ba.(c)RALF mRNA的QPCR分析表明RALF1在根部高度表达,并且在拍摄顶点中表达。从10天的根,射击顶点和叶中提取RNA。叶片中RALF1的表达与其他两个组织类型相比较低。GydF4y2BaACTIN2GydF4y2Ba用于内部控制。GydF4y2Ba
附加文件8:图S8GydF4y2Ba
.分离和表征GydF4y2Baralf1GydF4y2Ba突变体,GydF4y2BaRALF1-OX.GydF4y2Ba线GydF4y2Ba(一)GydF4y2Ba验证SIGnAL中描述的T-DNA插入位置(GydF4y2Bahttp://signal.salk.edu/cgi-bin/tdnaExpress.GydF4y2Ba).对于ATG起始密码子,黑盒是外显子,白盒是UTR。通过PCR和PCR产物的DNA测序,确定T-DNA插入的确切位置(用三角形表示)。GydF4y2Ba(B)GydF4y2BaT-DNA插入物存在于此GydF4y2Baralf1GydF4y2Ba突变体但不在WT基因组DNA中。GydF4y2Ba(C)GydF4y2Ba相对的mRNA水平GydF4y2BaRALF1GydF4y2Ba和八个不同的基因GydF4y2BaRALF1-OX.GydF4y2Ba行。GydF4y2BaACTIN2GydF4y2Ba作为内对照,计算相对mRNA水平。这些实验至少进行了三次,得到了相似的结果。GydF4y2Ba(D)GydF4y2Ba转基因GydF4y2BaRALF1-OX.GydF4y2Ba用PCR方法对其进行验证。WT植物作为阴性对照。GydF4y2Ba
附加文件9:表S1。GydF4y2Ba
显著(> 2倍,GydF4y2BaP.GydF4y2Ba< 0.05)GydF4y2Bafer-4GydF4y2Ba与RNA-seq分析确定的WT进行比较。GydF4y2Ba
附加文件10:表S2。GydF4y2Ba
具有可变剪接事件的基因GydF4y2Bafer-4GydF4y2Ba通过RNA-seq分析确定。GydF4y2Ba
附加文件11:表S3。GydF4y2Ba
富集分析显示的富集类别GydF4y2Ba拿来GydF4y2Ba淘汰赛与wt相比。GydF4y2Ba
附加文件12:表S4。GydF4y2Ba
开花与替代拼接事件相关的基因GydF4y2Bafer-4GydF4y2Ba通过RNA-seq分析确定。GydF4y2Ba
附加文件13:表S5。GydF4y2Ba
引物列表。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
王,L.,Yang,T.,Lin,Q.GydF4y2Ba等等。GydF4y2Ba受体激酶FERONIA调节开花时间GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2BaBMC植物杂志GydF4y2Ba20,GydF4y2Ba26日(2020年)。https://doi.org/10.1186/s12870-019-2223-yGydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-2223-yGydF4y2Ba
关键词GydF4y2Ba
- FERONIAGydF4y2Ba
- 昼夜时钟GydF4y2Ba
- 开花GydF4y2Ba
- 信使rna可变剪接GydF4y2Ba
- RALF1肽GydF4y2Ba