摘要
背景
在亚热带季风气候的樱桃果实开发期间,雨棚覆盖范围广泛应用,目的是降低过度降雨量造成的果实落下和破裂。在雨棚覆盖下,樱桃植物的叶片和果实的特点可能适应微气密的变化。然而,这种适应性的分子机制仍然尚不清楚,尽管澄清它可能有助于提高雨棚覆盖下樱桃的产量和质量。
结果
为了更好地了解雨棚覆盖下樱桃的调节和自适应机制,分别在三个发育阶段分别用叶片和水果中的羊羔Hiseq和单分子实时测序的组合鉴定了38,621和3584个差异表达基因。其中,关键基因,例如编码光合 - 天线蛋白的基因(Lhca和奇迹)和光合电子传输车(PSBP.,PSBR.,ps,及PetF),在雨棚覆盖物的应用后进行上调,导致光利用效率提高。参与碳固定的基因的mRNA水平,即,rbcl.和红细胞表面,与无遮蔽条件下相比明显增加,导致CO2利用率。此外,参与叶绿素的基因的转录水平(丙烯酸-,hemN,及CHLH.)和类胡萝卜素合成(crtB,PDS.,crtISO,及LCYB.)在庇护的叶片早先达到比未应用的叶子中的叶子达到尖峰,从而促进叶子中的有机物积累。值得注意的是,苯丙醇丙烷代谢途径所涉及的关键基因的表达水平(朋友,C4H.,及四氯化碳)和黄酮类化合物(CHS,气,F3'H,DFR,及ANS)的表达也早于未遮荫果实,有利于果实花青素含量的增加。
结论
根据相关基因的生理指标和转录表达水平,系统揭示了樱桃植物的自适应调节机制。这些调查结果可以帮助了解雨棚覆盖在雨雨中的中国樱桃栽培的效果。
背景
樱桃是一种受欢迎的春夏季水果,因为它的早熟和美味的味道,以及它的抗氧化特性[1].樱桃树喜欢阳光充足、没有死水的环境[2].在果实发育过程中,它们易受天气的影响,如雨和冰雹,这是造成果实严重掉落和开裂的主要原因[3.].
无色雨棚覆盖物,适用于葡萄等水果作物[4]和苹果[5]越来越多地在全球范围内使用,这可能会显着增强水果产量[6],但对果实品质无明显不良影响[7].然而,雨棚覆盖物可能不可避免地改变树冠的微气体,导致光合作动辐射(PAR)减少[8],被认为是营养生长和果实发育的关键制约因素[9].因此,光能利用和光保护之间的灵活调节对植物在变化光照条件下的性能和田间适应性至关重要[10.].
最近,在许多物种中的生理调整方面,植物对弱光和遮阳条件的适应性主要记录在许多物种(如橡皮树)11.)、棉花(12.],和甜樱桃[13.]人们普遍认为,植物对不利条件的生理适应性的转变最终可归因于分子水平的改变。迄今为止,已在许多作物中使用转录组学策略分析了植物在可变光照和/或温度条件下的适应性调节机制;在例如,玉米中的差异表达基因(DEG)主要参与大多数同化过程(光合作用和碳固定途径),即通过修改叶绿素(Chl)进行光合作用光捕获生物合成,暗示了复杂的调控机制以及冷信号和光信号过程之间的相互作用[14.].在弱光条件下,耐弱光水稻品种光系统I和II复合体及电子转运相关基因的表达量增加;因此,在弱光条件下,光合作用相关基因的加速表达有助于维持水稻产量[15.]此外,在弱光条件下,叶片需要保持有效的抗氧化能力,以维持其碳水化合物生产水平[16.[足以证明通过集成多个信号来实现叶片对低光条件(小时或天)的调节或调整,如研究所示拟南芥[10.].虽然叶片对短期光变化的适应已经有了相当多的研究,但叶片对长期弱光的生理和分子反应迄今尚未阐明。
光强调控果皮中花青素的合成和积累[17.].由于春季频繁,通过8-22%的光损失严重抑制了花青素生物合成[18.]类黄酮和苯丙烷途径在草莓果实色素合成中起着关键作用[19.].花青素生物合成的结构基因,如朋友,CHS,气,F3H,DFR,ANS,及UFGT,在甜樱桃中有报道[20.].在遮荫下,以往的研究主要集中在葡萄果实花青素含量与相关基因转录之间的互作[21.].然而,迄今为止,尚未阐明对类黄酮和/或苯丙烷型途径的基因表达谱的庇护覆盖物的分子调节,这可能有助于更好地理解花青素积累。
樱桃(cerasus pseudocerasusLINDL。)在中国西南部广泛种植,其特征在于亚热带季风的区域,春季频繁雨水,严重限制了樱桃行业的扩张。此前,遮蔽覆盖物的使用基本上是合理的,以有助于总Pn积累和果实产量升高,并对樱桃的植物生长和果实品质没有明显的不利影响[22.].为了充分了解樱桃对遮荫下小气候变化的适应性和调控机制,本研究的目的如下:1)通过转录组分析发现遮荫下的差异基因;2)鉴定与生长发育相关的关键基因;3)揭示光采、光合电子传输和抗氧化系统等调控网络,为该水果作物种植系统的创新改良提供有力的支持。
结果
单分子实时(SMRT)测序概述
为了获得遮蔽和未遮蔽条件下的基因表达谱,对叶片进行了SMRT测序和Illumina RNA-Seq测序(图2)。1a) 和水果(图。1b)开花后35,45,第55天(DAF35,DAF45和DAF55)。总共扫描了1,048,866次过滤后聚合酶读取(21.55g)。来自相同聚合酶读取序列的亚亚亚亚曲线产生圆形一致序列(CCS),其产生685,339ccs序列。其中,获得了542,795个全长非嵌合(FLNC)序列,得到5'-底漆,3'-引物和多-1,包括所有CCS的79.20%是FLNC(300-22,293bp)。这种比例在两种组织之间略有不同,叶片数据集中为34.96%,水果数据集中为44.25%。FLNC读取的平均长度在附加文件中呈现2:表S1,FLNC读取的长度分布显示在附加文件中1:图S1。叶片和果实图书馆的FLNC长度> 2 KB的果实图书馆分别占相应FLNC的63.95和65.21%。蛋白质编码基因转录物和FLNC的比较揭示了强大的一致性,这表现出比以前的基因模型预测的illumina RNA-SEQ数据更好地恢复大转录物,特别是在2500-4000-BP尺寸范围的尺寸范围内[23.].
单基因的注释和功能分类
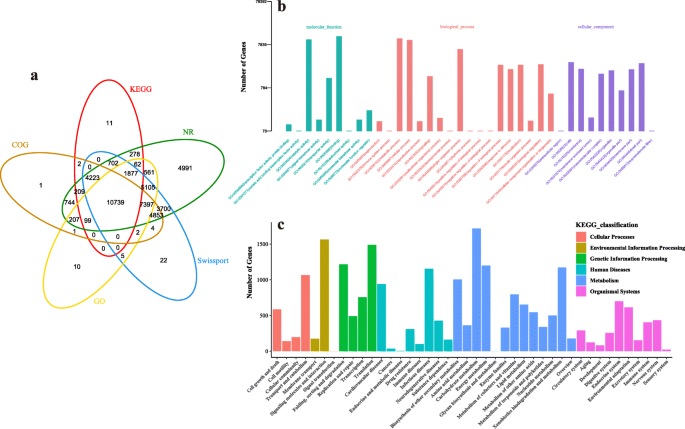
利用BLAST比对技术对unigenes的功能进行了注释,并与NCBI non冗余蛋白序列(NR)、同源蛋白组簇(COG)、人工注释和回顾的蛋白序列数据库(Swiss-Prot)、京都基因与基因组百科全书(KEGG)、基因本体论(去)]。在分布到各数据库的45,825个unigenes中,Nr为45,747个(占总数的97.35%),COG为28,481个(占60.61%),SwissProt为38,629个(占82.20%),KEGG为18,202个(占38.73%),GO为26,065个(占55.46%)。2a) 。
NR数据库的分析表明樱桃的最高同源物李属却已或者P. Persica共有28481个单基因被分为三大类37个功能组:分子功能组(MF)9个,生物过程组(BP)18个,细胞成分组(CC)10个(图。2b、 附加文件4:表S3)。分类基因的GO词条前三名分别为“蛋白结合”(4812)、“ATP结合”(3907)和“蛋白激酶活性”(2272);BP的“蛋白磷酸化”(2273)、“氧化还原过程”(1833)和“信号转导”(1255);“膜”(1656)、“膜的组成部分”(1571)和“核”(748)代表CC。
总共,将18,202个unigenes映射到265 kegg数据库路径中。前三名Kegg途径是“新陈代谢,碳水化合物代谢”(1719);“环境信息处理,折叠,分类和退化”(1563);和“遗传信息处理,翻译”(1491)(图。2C,附加文件5:表S4)。其中,碳代谢(map 01200)、RNA转运(map 03013)、氨基酸生物合成(map 01230)、内质网蛋白质加工(map 04141)、剪接体(map 03040)、淀粉和蔗糖代谢(map 00500)等4个基因的单基因图谱中所占比例最高。
屏蔽罩下deg的功能分类
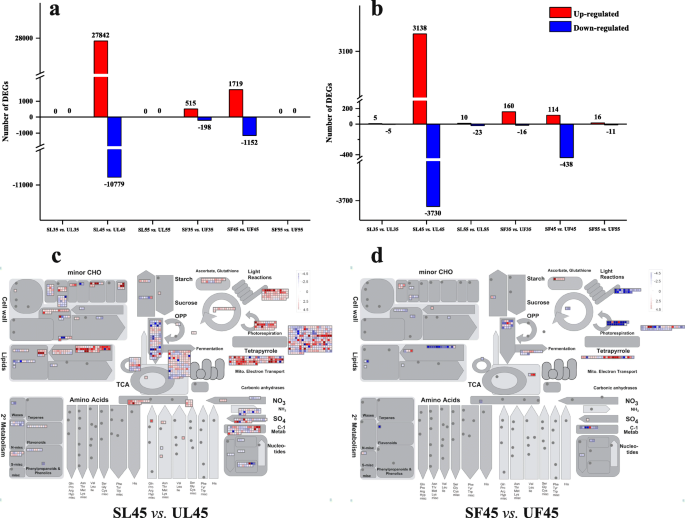
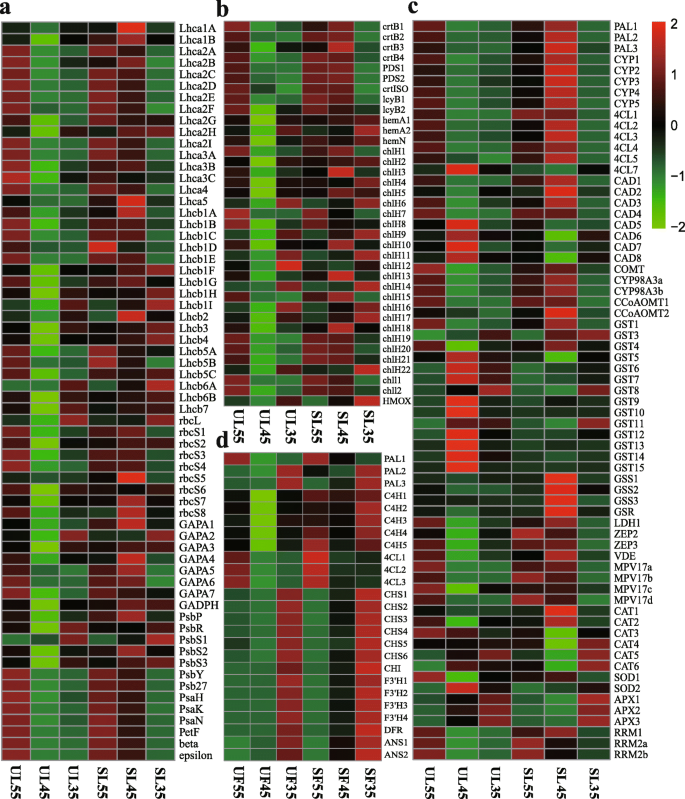
Illumina RNA-Seq(附加文件6:表S5)。根据Illumina的数据,对三个阶段的基因表达进行两两比较(SL vs. UL, SF vs. UF)。在低par条件下,GO数据库共检测到38621 (SL35 vs. UL35、SL45 vs. UL45、SL55 vs. UL55)和3584 (SF35 vs. UF35、SF45 vs. UF45、SF55 vs. UF55) deg对小气候变化的响应。此外,获得了38621 DEGs用于SL45对UL45, 2871 DEGs用于SF45对UF45(图)。3.a) 。在整个三个发展阶段,总共6911和1755℃被从叶片和水果中的Kegg数据库中检测到;分别获得SL45和SF45和SF45与UF45的6868和1552℃(图。3.b).为了评估叶片和果实对遮荫覆盖的适应性,使用MapMan分析了生物化学途径的总体变化(附加文件)7表S6),包括DAF45时SL vs. UL和SF vs. UF的差异值(图。3.C,D)。Mapman注释显示了这些DEGS的生化途径的总体变化。在DAF45的避难所覆盖下的叶片的代谢活性大大增加,并且将DEGS分配给不同的功能类别,例如光合作用,次生代谢,辅酶代谢,RNA生物合成等(图。3.c) 。在遮蔽盖45天下,果汁的果实,其特征在于次生新陈代谢,细胞壁组织,氨基酸代谢等的上调(图。3.d)。
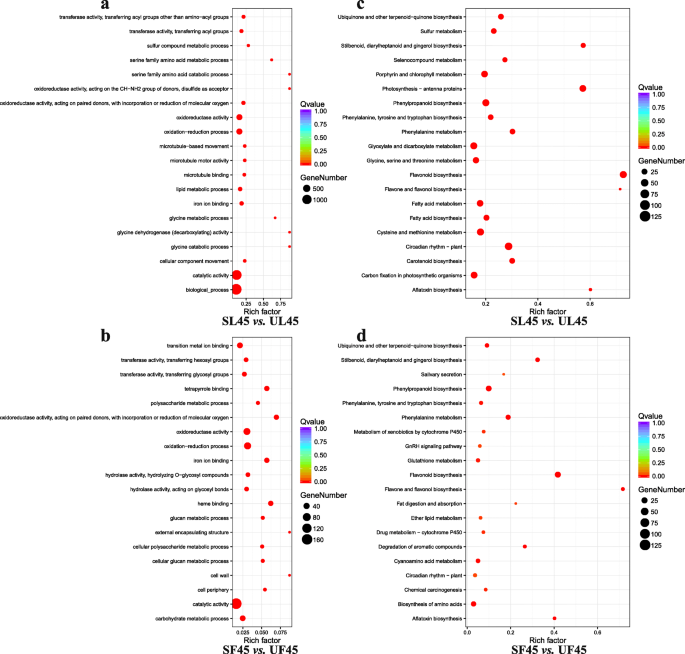
与UL和UF相比,SL中GO词条上调的基因在“催化活性”、“生物过程”、“氧化还原酶活性”和“氧化还原过程”等方面显著富集(图)。4a) SF的上调基因主要与DAF45的“催化活性”、“生物过程”、“氧化还原酶活性”和“氧化还原过程”等相关(图。4b)。与UL相反,来自SL的上调基因与UL包括与“昼夜节律 - 植物”相关的那些“甲氧腈和二羧酸代谢”,“卟啉和叶绿素代谢”和“光合生物中的碳固定”等(无花果。4c);此外,在DAF45位点,SF的上调基因与“氨基酸的生物合成”、“苯丙氨酸的生物合成”、“苯丙氨酸的代谢”和“类黄酮的生物合成”等特别相关(图5)。4d)。
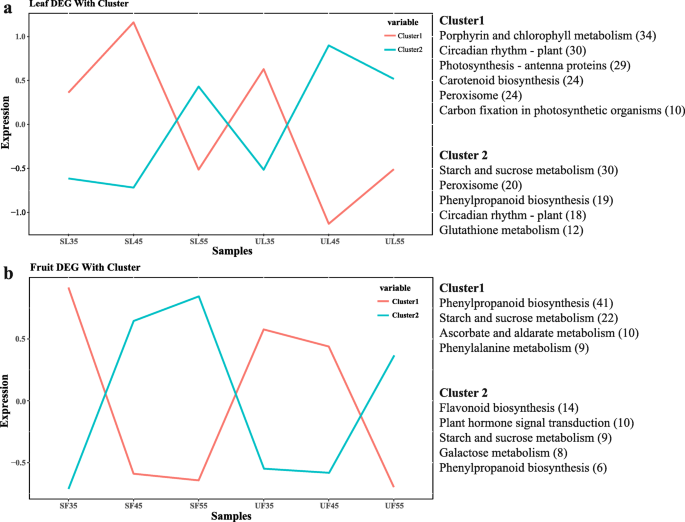
采用常见的表达模式进一步分析SL与UL之间以及SF与UF之间三个阶段的DEG;总的来说,将7244(叶)和1707(果)DEG分为四个簇(图。5)。大多数候选DEG分为叶簇1(3796个基因)或果簇1(1271个基因)。通过KEGG途径富集,描述了在每个相似的调控转录簇中富集的生物学途径。叶簇1中的DEGs在SL的DAF45处表现出峰值表达,包括负责卟啉和胆叶素代谢、植物昼夜节律、光合作用触角蛋白、类胡萝卜素生物合成、过氧化物酶体和光合生物体中碳固定的广泛基因。DEGs主要参与光合作用,这反映了叶片在经过长时间的遮雨覆盖后,能够在DAF35~DAF45之间保持有效的适应性。对于叶簇2中前五个累积途径,DEG在UL的DAF45处表现出峰值表达,包括过氧化物酶体、苯丙烷生物合成和谷胱甘肽代谢,这些DEG主要参与抗氧化系统(图。5a) 。同时,对于果实簇1中的前四个富集的途径,DAF35在SF的DAF35中显示出峰值表达,包括负责苯丙醇化生物合成,淀粉和蔗糖代谢,抗坏血酸和醛酸盐代谢的广泛基因,以及苯丙氨酸代谢。最后,对于果实簇2中的前五个富集的途径,DEG在SF的DAF55下显示出峰值表达,包括类黄酮生物合成,植物激素信号转导,淀粉和蔗糖代谢和苯丙烷生物合成(图。5b)。转录结果表明,叶片对微气门的适应性主要归因于调节光合特性,同化,抗氧化状态和昼夜节律。将含糖的糖和花青素中的生物合成的基因在DAF35中上调,直至DAF55,反映了与无庇护条件下的营养的营养积累。
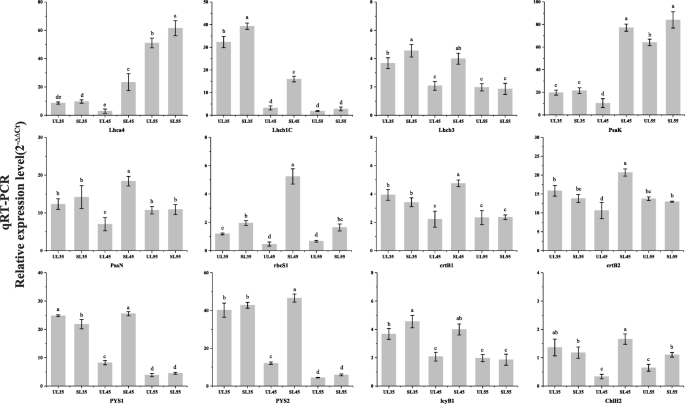
为了验证RNA Seq结果的真实性,随机选择12个DEG,并通过qRT PCR分析其表达谱。qRT PCR分析结果表明,这些DEG的表达谱与RNA Seq评估的表达谱相似(图。6),证实了我们RNA-Seq数据的可靠性和准确性。
参与庇护叶片光合体系的基因的表达
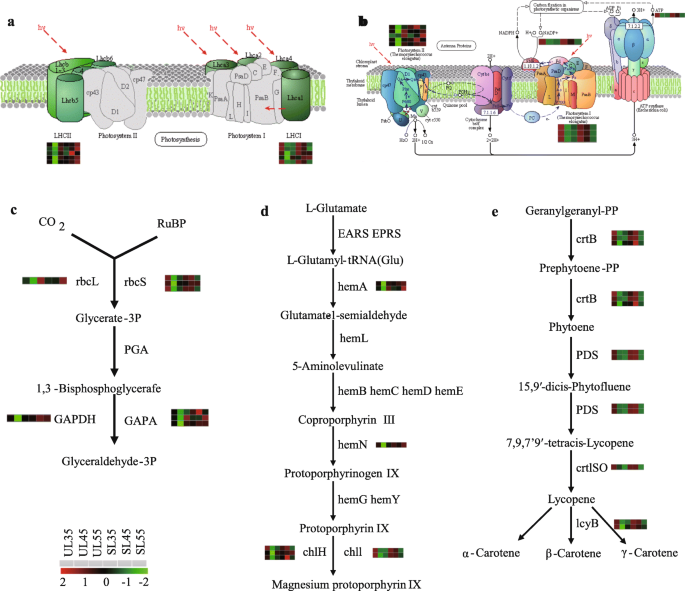
为了阐明樱桃树在暴露于遮蔽物后的果实发育过程中对小气候变化的分子适应性,从过滤的DEG中筛选出与环境敏感性相关的基因,以供进一步研究(图。7和8)大多数DEG编码天线蛋白,或参与电子传递的蛋白,光系统I(PSI)和光系统II(PSII)中的反应中心,以及CO2固定,与DAF45的UL相比,在SL中高度表达(图。7a) 。
70多个基因被注释到三个代谢途径:光合作用天线蛋白(ko00196)、光合作用(ko00195)和光合生物中的碳固定(ko00710)。因此,我们关注与光合效率密切相关的这些基因的转录水平(图。7a).所有注释的聚光Chl a/b结合蛋白复合物I和II的DEGs (大型强子对撞机),即编码CHL A / B结合蛋白复合物I的17个基因(Lcha1,Lcha2,Lcha3,Lcha4,及立法会五题)和20个基因编码CHL A / B结合蛋白复合物II(LCHB1,LCHB2.,LCHB3.,LCHB4.,LCHB5.,LCHB6.,及LCHB7.),在DAF45位点SL表达上调(图。7A.8a) 。此外,编码参与反应中心和光合作用中的电子传输的蛋白质的13个基因,包括PSI反应中心亚单位x(诗篇),反应中心亚基VI(诗篇)、PSI反应中心亚基普桑(普桑),PSII氧不变增强剂蛋白2(PSBP.)、PSII 10 kDa蛋白(PSBR.),psii修复蛋白PSB27-H1(PSB27.),光合电子传输的Ferredoxin(PetF)和h+/ na.+运输腺苷三磷酸酶β亚单位(AtpF),在庇护覆盖下上调(图。7A.8b) ,而细胞色素f复合物的一个基因(善待动物组织)和一个H基因+/ na.+运输腺苷三磷酸酶亚基α(ATPF1AI)在碳固定途径中,D-核酮糖1,5-二磷酸(RuBP)和CO2在核酮糖二磷酸羧化酶大链作用下产生3-磷酸甘油酯(3-PGA)(rcbl.)和核酮糖二磷酸羧化酶小链(rcbs.);然后,3-PGA被甘油醛3-磷酸脱氢酶(GADPH.)及甘油醛-3-磷酸脱氢酶(地对空导弹),完成了光合作用的能量储存过程,增加了光合产物的产量和积累。其中,有一个基因rbcl.,九个基因红细胞表面,一个基因GADPH.和七种基因地对空导弹在有遮蔽的覆盖下显著上调。值得注意的是rbcl.和地对空导弹是上调的≥10倍(图。7A.8c) 。
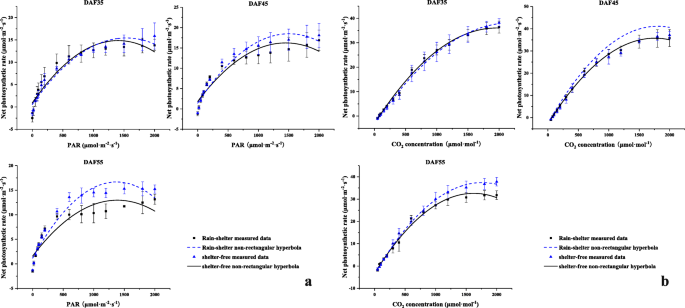
结合PAR-Pn和CO2-Pn曲线显示,受遮挡叶片的Pn较低,但在果实发育的前两个阶段间差异不显著(图2)。9).遮荫叶片的AQY和ACE分别显著增加13.0和23.5%;LCP和CCP分别为13.87和75.62 μmol·m- 2·年代- 1在DAF45(附加文件8:表S7)。总体而言,结合叶片的光合特性和转录组学结果,研究结果表明,遮荫叶片具有更强的捕获和利用弱光的能力,同时保持稳定的CO2利用效率。这表明在遮荫覆盖下,有可能在短时间内对弱光条件有良好的适应。
遮荫叶片光合色素基因的表达
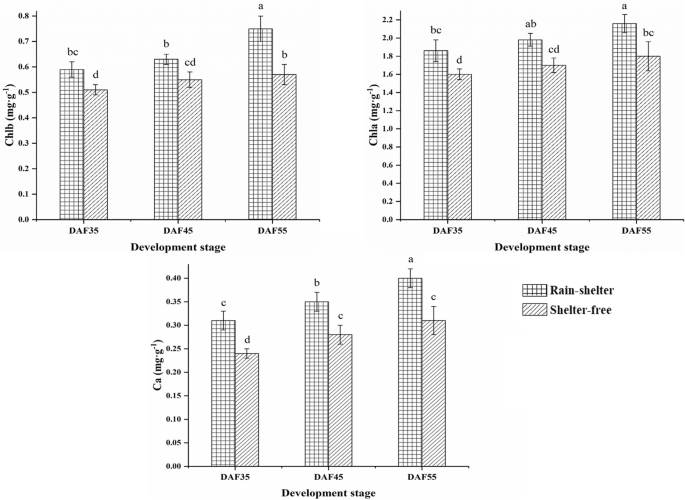
植物对弱光的适应性与光合色素合成途径密切相关[25.].在该研究中,参与卟啉和叶绿素代谢(KO00860)的34个基因和与浮动叶中的每一个三萜骨架生物合成(KO00900)和类胡萝卜素生物合成(KO00906)的一个基因在DAF45上调节(图。7b).关于注释到Chl合成和类胡萝卜素生物合成的DEGs,一个编码香叶酰香叶酰二磷酸还原酶的基因(CHLP.),一个编码氧不依赖粪卟啉原III氧化酶的基因(hemN),两个编码谷氨酰trna还原酶的基因(丙烯酸-),编码镁嵌合酶亚单位的23个基因H(ChlH)和两个编码镁螯合酶亚基I的基因(克利)等,在DAF45遮荫下上调(图。8d) .此外,15顺式植物烯合酶的四个基因(crtB),两个15-cis-植物去饱和酶的两个基因(PDS.)脯霉素异构酶基因(crtISO)和两种番茄红素β-环化酶(LCYB.)在DAF45的庇护覆盖下上调(图。8e)。光合色素CHL A,CHL B和汽车的内容倾向于在遮蔽覆盖下增加。此外,内容物高于续;例如,CHL A增加了14至16.7%,CHL B在13.6%至24%,并且在庇护的覆盖下,汽车始终如一地增加了20%至22.6%(图。10.).与遮蔽叶片中的CHL和类胡萝卜素合成有关的基因的转录水平也完全证实,它们不会受到庇护覆盖物的不利影响(图。7B8);相反,遮荫覆盖会提高基因转录水平,从而增加色素含量。
受保护叶中抗氧化系统相关基因的表达
活性氧清除酶,如草地,过氧化氢酶(猫),过氧化物酶(荚),抗坏血酸过氧化物酶(APX),以及非酶抗氧化剂(谷胱甘肽,类胡萝卜素等)对于ROS排毒是必不可少的[26.].丙二醛(MDA)可用作不同应力条件下脂质过氧化的指标。与抗氧化能力有关的多种基因的转录水平(包括过氧化物组织(KOO 4146),苯丙醇丙烷生物合成(KO00940),谷胱甘肽代谢(KO00053)和类胡萝卜素生物合成(KO00906),略微与微凸菌状况略微波动(图。7c) 。大多数抗氧化相关基因的表达在S1中明显高于DAF45的UL;例如,过氧化物酶机中涉及的八个基因(编码草地,及猫), 32个参与苯丙类生物合成的基因[编码反式肉桂酸4-单加氧酶,CYP;苯丙氨酸ammonia-lyase,朋友;4-coumarate-CoA连接酶,四氯化碳;肉桂醇脱氢酶,计算机辅助设计;咖啡酸3-O-methyltransferase,COMT的;5-O-(4-香豆酰)-D-奎宁-3′-单加氧酶,C3'H.;Caffeoyl-CoA O-甲基转移酶,CCOAOMT.;和荚];八个与谷胱甘肽代谢相关的基因(编码谷胱甘肽合成酶,GSS.;谷胱甘肽还原酶,GSR.;谷胱甘肽S-transferase,GST.);和16个基因参与类胡萝卜素生物合成(编码Zeaxanthin环氧酶,ZEP.;紫黄质脱环氧化酶,维德;β-胡萝卜素3-hydroxylase,CrtZ;beta-ring羟化酶,LUT5;番茄红素beta-cyclase,LCYB.;脱落酸8 ' -羟化酶,CYP707A)在DAF45中显示比在UB中的SL中显着更高的表达(图。7c) 。
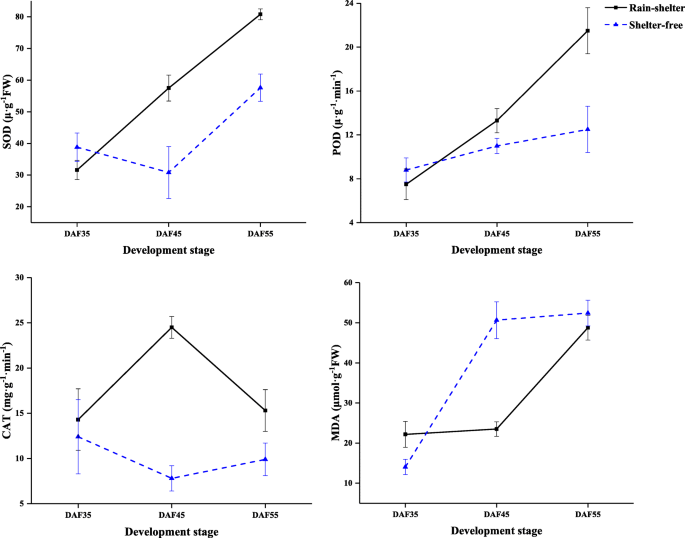
叶片中抗氧化酶活性和丙二醛含量也随着小气候的变化而变化。在DAF35时,两种植物的活性无显著差异草地,荚,及猫SL和UL;遮荫下MDA含量较高。在DAF45处理下,抗氧化酶活性高于无遮荫处理,而MDA含量低于UL处理荚,草地,及猫活动分别增加1.7倍、1.9倍和1.3倍(图。11.).这些结果表明,RSC期间叶片中的抗氧化剂酶的活性增加,这使得植物清除ROS的能力,并阻止膜脂过氧化的损伤,从而保持光合效率。结果表明与基因表达水平的结果相同的趋势。
遮荫果实花青素合成相关基因的表达
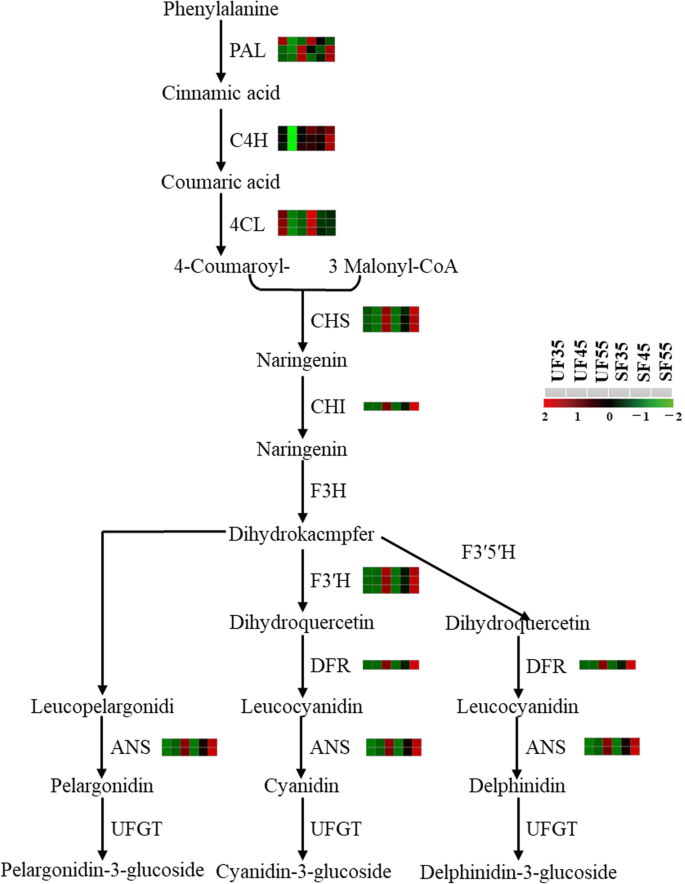
遮荫覆盖下成熟樱桃果实花青素含量显著高于未遮荫覆盖下成熟樱桃果实[22.].水果的上调基因主要参与苯丙烷类生物合成(ko00940)和类黄酮生物合成(ko00941)。从DAF35到果实成熟,保护水果中超过25个基因的转录水平开始增加(图。7d);其中12个基因参与苯丙类生物合成,其中1个基因为朋友,六个基因C4H.,五个基因四氯化碳.其中,表达式C4H.和四氯化碳此外,对于编码查尔酮合酶的13个参与类黄酮生物合成的基因而言(CHS),chalcone异构酶(气),黄烷酮3′-羟化酶(F3'H)、二氢黄酮醇4-还原酶(DFR),和花青素合酶(ANS)在DAF45时,遮荫果实中的表达显著较高(图。12.).结果表明,在受保护的果实中,花青素的合成速度加快,积累周期延长。
讨论
住房覆盖下的光合适应
叶片/果实生理特性的改变可能涉及对小气候变化的适应性反应,而基因的转录调控是植物适应诸如光和温度等环境因素变化的分子基础。光合作用是植物生长、产量和产量的关键[27.]因此,农艺技术通常特别注重提高光合作用。在低光照强度下,植物的光合效率主要取决于采光装置对小气候条件的适应性,其中PSI/PSII代表植物对低光照的适应性w光[28.].大型强子对撞机在收集光和保护光方面发挥重要作用[29.].奇迹(PSII)被报道在低光强度下被转录放大以增强光子捕获[30.].差异表达的植物的转录物大型强子对撞机对弱光胁迫的响应可能在维持弱光胁迫下的正常代谢活动中发挥集体作用;例如,基因编码LCHB.在弱光条件下,耐弱光水稻品种的基因表达上调[15.];在目前的研究中,所有与成员相关的次数大型强子对撞机,如LCHA.和LCHB.共有37个基因参与了光捕获蛋白表达的调控(图。7a).与未被遮挡的叶片相比,有9个基因编码Lcha29个基因编码LCHB1差异;其最高表达水平增加了6倍(Lcha2)及11倍(LCHB1).此外,PSB27.,这对于能量代谢和有效恢复的光电爆发PSII复合物至关重要[31.],在遮荫叶片中也上调。PSBS.可能稳定PSII-LHCII超复杂结构,可以提高电子传输效率[32.];在目前的研究中,PSBS.在被遮挡的叶片中上调(图。7a) .在光合作用的光反应过程中,编码LCHs的基因表达上调,其中,LCHB.促进了弱光条件下光能的吸收和传输,提高了光捕获面积和光捕获效率。遮荫叶片的光合特性表现为LCP降低,AQY增加8:表S7)。推测,这些基因通过提高光吸收和电子传输的效率来调节与雨棚覆盖相关的低光环境的适应性叶适应性,这是重要的作用,从而提高了光吸收和电子传输的效率,导致弱光效用的改善。
二磷酸核酮糖羧化酶(rbcl.和红细胞表面)是位于致催化光合作用CO的叶绿体造口中的双官能酶2固定以形成核糖苷-1,5-双磷酸(RUBP)[33.];转录水平rbcl.和红细胞表面基因可以直接反映叶子的光合效率[34.].现有的证据证明,激活状态二磷酸核酮糖羧化酶受光强的影响[35.];因此,上调的调控rbcl.和红细胞表面在遮荫下的樱桃叶片中可能起着关键作用2固定(图7a) .在合作期间2光合作用中的同化,基因编码二磷酸核酮糖羧化酶(rbcl.和红细胞表面)被上调;其中,基因表达rbcl.增加了10.8倍;9基因的红细胞表面也调节(图。8c).遮荫叶片的光合特性方面,CCP降低,ACE增加(附文件8:表S7)。这些结果表明CO的增强2低光强度下的同化可以归因于上调二磷酸核酮糖羧化酶-相关基因,在叶片对遮荫覆盖的适应中起重要作用,为植物的营养生长和生殖生长提供物质基础。
以往的研究表明,Chl的合成机制在适应弱光条件中起着至关重要的作用[11.].氯的合成直接影响光合效率[36.[CHL B是稳定存在光收获复合蛋白(LHCP)的先决条件[37.].研究发现Chl b的增加有利于LHCP的增加和对短波长的光的吸收,从而有效地提高了植物在弱光条件下的光照能力[37.].此外,耐弱光水稻品种Chl b的明显增加有利于在弱光下捕获光能并驱动电子传递,从而维持较高的光合速率[16.,38.].在本例中,含量(mg·g- 1遮荫叶片中Chl b的含量也显著高于未遮荫叶片(图。9),有利于叶片LHCP的稳定性,从而提高弱光下对光能的利用。的赫马,赫曼,ChlH和ChlL基因在植物叶绿素合成中起着关键作用。其中,ChlH是一种多功能蛋白,在质体到核和植物激素信号转导途径中发挥作用。ChlH加速了ChlM的催化活性,催化mg -原卟啉转化为mg -原卟啉IX单甲酯;这是合成叶绿素的关键酶,最终导致叶绿素的合成[39.]在目前研究的遮荫叶片叶绿素合成途径中,编码赫马,赫曼,ChlH,及ChlL在被遮蔽的树叶中向上调节。此外,还有23个基因编码ChlH差异(图。7b)。因此,在遮蔽覆盖下提高了与CHL合成相关的多种基因的表达,并且CHL B含量的增加改善了LHCP状态,导致遮蔽叶的光合效率提升(图。10.).
避难所覆盖下的抗氧化能力调节
ROS是由植物在压力下产生的,这可能导致PSII和PSI的光抑制和光氧化损伤[40]研究表明,活性氧的积累受一系列抗氧化化合物的调节;在光胁迫下,植物中参与抗氧化系统的基因表达受到不同程度的抑制[41].抗氧化酶(草地,猫,荚等)和非酶抗氧化剂(叶黄素、木质素、谷胱甘肽、花青素等)在响应非生物胁迫中发挥不同的作用[41].在低光条件下,显示低耐耐水稻品种通过持有有效的光合速率和耐氧气来维持其碳水化合物生产水平[15.]类似地,遮荫叶片中的抗氧化酶活性较高,这可以避免膜脂过氧化并有助于维持光合效率(图。11.).同时,一个基因草地,两个基因猫和六个基因荚在被保护层的叶片中,有5个基因被抑制。7c) 。因此,庇护叶片光合容量的提高可能会显着促成ROS清除。
类胡萝卜素可以捕获光能,在光保护中起关键作用;β-胡萝卜素参与能量传递过程,在清除光合反应中心的单线态氧方面发挥重要作用[42].在类胡萝卜素合成途径中,九个基因编码crtB,PDS.,crtISO,及LCYB.在遮雨的叶片中被上调(图。8d),遮蔽叶中胡萝卜素含量较高(图。10.)此外,叶黄素在光收集天线系统中具有猝灭三重态Chl和激发单重态Chl的光保护功能[43],通过清除氧化物提供抗氧化活性,从而防止脂质过氧化[44].在目前的研究中,五个基因LUT5,crtZ,及LCYB.叶黄素合成在受遮挡的叶片中上调。这些结果进一步证明,受保护的叶片增强了类胡萝卜素合成基因的表达,并在一定程度上促进了光合作用。
据报道,基因编码朋友,4CL,CYP.和CCOAOMT.遮荫大豆品种中苯丙素通路在弱光环境下上调[45].同样的,14个基因朋友,四氯化碳,及CYP被发现在此处的遮荫叶下表达上调(图。7c).谷胱甘肽(GSH)可作为电子供体灭活自由基,或作为几种抗氧化酶的辅助因子[46]用以解毒在不同应激条件下产生的过氧化氢[47];在这项研究中,基因GSS.和GSR.在遮荫覆盖下的樱桃叶中也表达上调(图。7c) 。
综上所述,遮荫叶的抗氧化能力与抗氧化酶和多种非酶抗氧化剂结合,最大限度地发挥了保护作用,降低了弱光强的负面影响,在一定程度上保持了遮荫叶较高的光合效率。
遮荫条件下花青素生物合成的调控
据报道,遮蔽物内的太阳辐射、空气湿度和空气温度受到防雨遮蔽物的影响[48].花青素积累也受微环境变化的影响[49].同时,光质量可以通过调节相关基因的表达模式影响花青素的合成[50]因此,花青素含量受代谢网络中相应基因的差异表达控制,这归因于环境因素的变化[51].现有证据表明VvPAL通过催化苯丙氨酸至肉桂酸对苯基丙烷生物合成途径(花青素合成的途径)中起关键作用[19.].参与花青素生物合成的结构基因拟南芥显示是在类黄酮生物合成途径调节的初始和晚期中表达的酶(花药素合成下游的途径),例如CHS和气(初期),以及DFR和ANS(晚期)对于花青素生物合成至关重要[52].此外,CHS催化苯丙酸途径向类黄酮途径的起始步骤,这对果实花青素的合成和积累尤为重要[53].在甜樱桃中,DEGs包括朋友,四氯化碳,CHS,气,F3'H,DFR,及ANS被证实参与花青素的合成[54].随着樱桃果实成熟的进程,参与花青素合成的基因可能在无遮蔽条件下上调[20.]在另一项研究中,发现与无遮蔽条件下的葡萄皮相比,遮蔽条件下葡萄皮中的酚类化合物含量降低[55].此外,先前的一项研究,据证明,在庇护覆盖下的葡萄中,葡萄酒丰富VvF3的5是什么和VvF3'H显著减少[56]在本研究中,这些DEG参与苯丙烷和类黄酮的生物合成,如朋友,C4H.,四氯化碳,CHS,及气,在覆盖条件下上调(图。7d).其中,三种编码基因的表达四氯化碳增加3.5倍和一个基因编码C4H.在类黄酮生物合成途径中,与无遮蔽条件下生长的果实(DAF45)相比,DEGs编码CHS,气,F3'H,DFR,及ANS是上调的,其中5个基因编码CHS增加了3.5倍以上(图3)。12.).有力的证据表明,与未受欢迎的甜樱桃相比,所涵盖的甜樱桃的酚的平均水平增加了14%。结果表明,在覆盖条件下存在的酚类可以通过较大的温度波动和中等而是在盖子下的小光条件下进行温度的温度(不等)来解释[9]先前的研究也表明,在果实发育过程中,花色素苷的合成受到上游代谢产物(如糖)的限制,这证明花色素苷的积累与光同化物密切相关[57].葡萄花青素含量的增加主要是由于葡萄功能叶寿命的延长、叶片同化产物的增加和果实可溶性固形物含量的增加;最终花青素的含量也增加了[21.]从目前研究的转录组学调控结果来看,遮荫覆盖下果实的花青素合成通过与上游/下游途径中的关键酶协同作用增加了果实的花青素含量。通过增加参与苯丙烷生物合成和类黄酮生物合成的基因的上调,可以增加花青素的合成和积累。当然,这一过程也离不开叶片对弱光的适应,弱光为果实花青素的合成提供了同化产物。
共同,樱桃树可以通过调节参与光捕获的基因来改善光合作用和抗氧化能力(LCHs)、二氧化碳固定(二磷酸核酮糖羧化酶),光合色素合成(ChlH)和抗氧化系统(类胡萝卜素和酚类物质),最终增强其对遮荫下弱光强度的适应能力。
结论
综上所述,本研究利用PacBio和Illumina测序技术,在控制和遮荫处理下获得了中国樱桃3个发育阶段叶片和果实的转录组信息。遮荫下樱桃叶片和果实的适应性调节主要与叶片和果实的生理特性(LCP、CCP和Chl含量)和转录组表达谱有关。转录组数据也证实了叶片对弱光的适应机制主要是通过调控LHCP合成、光合电子传递、CO等基因的转录谱来实现的2固定,以及光合色素和抗氧化剂的合成。遮荫叶在低光强下通过积极的上调保持了较高的捕光能力LCHA.和LCHB.表达式,推广有限公司2通过提升语言的表达来固定rbcl.和红细胞表面,增强了的表达CHLH.此外,改善类胡萝卜素、苯丙烷和谷胱甘肽的抗氧化剂生物合成可以全面确保叶片在低光照强度下产生足够的碳水化合物。朋友,C4H.,四氯化碳,CHS,气,F3'H,DFR,及ANS在庇护覆盖物下的果实中有显着上调,这可能导致庇护水果中的花青素积累。本研究及其调查结果可以作为中国樱桃未来基因组研究的宝贵资源。DEG数据还可以提供有用的候选基因,以阐明中国樱桃和其他品种的适应机制与低光状况和其他非生物应激。
方法
植物材料
试验在2016 - 2018年进行的果园在贵州府,P.R.中国(纬度26°70'N,经度107°51'e),其特征是亚热带的季风气候。在该遗址,平均温度为14°C,相对湿度为88%,年度总降水为1220毫米。五岁的中国樱桃树(“Manaohong”品种)在每一行和每棵树之间的3米处间隔开,带有树干和分支的开放式中心模型。所有树木都使用相同的集成技术进行管理。通过覆盖无色聚乙烯膜(半覆盖以确保通气)进行试验,透射率约为70%,从盛开之前施用,直到果实收获。钢框架遮蔽的长度,宽度和高度分别为30μm,10μm和4米(在地上)。未被处置的树木被设定为控制(续)。在开花(DAF35,DAF45和DAF55)后35,第45天和第55天,每次庇护和未受处置条件下的三棵树标记为样品收集。未采用未应用的叶片(UL35,45和55),未采用的果实(UF35,45和55),遮蔽叶(SL35,45和55)和遮蔽的水果(SF35,45和55);立即在液氮中冷冻; and stored at − 80 °C for physiological indicator measurement and RNA isolation.
雨遮蔽下叶片的生理特性
光合作用的光响应(PAR-Pn)和CO2反应(有限公司2-在9:00之间测量遮蔽物覆盖和无遮蔽物条件下的Pn)曲线 a、 上午11点半到11点半 a、 在晴朗的日子,使用便携式红外气体分析仪(Li-6400XT;Li Cor,Inc.,Lincoln,NE,USA)2-响应曲线采用Farquhar数学模型进行拟合(Prioul and Chartier, 1977)。在0 ~ 200 μmol·m的PAR范围内,AQY和CE呈线性回归- 1·年代- 1和公司2浓度范围为0 ~ 200 μmol·mol- 1;计算LCP和CCP。每棵树选择两个新的南枝(每个遮蔽层选择三棵树),从枝的基部选择第5片成熟叶。
对每棵树的30片成熟叶片进行取样,以量化以下参数,并对每种遮蔽和非遮蔽条件进行三次生物复制。为了尽量减少树冠的位置效应,从四个方向采集叶片:东部、南部、西部和北部。根据Shi等人(2013)描述的方法测定叶绿素a、叶绿素b和类胡萝卜素(Car)的含量。丙二醛(MDA)含量和超氧化物歧化酶活性(草地, E.C.1.15.1.1)的测量方法由Wen等人(2011)记录。过氧化物酶(荚,例如1.11.1.7)和过氧化氢酶(猫, E.C. 1.11.1.6),采用前面描述的方法(Sharma et al., 2016)用分光光度计测定。采用microplate分光光度计(Thermo Scientific, MA, USA)测定所有提取物的吸光度。
总RNA提取,PacBio和Illumina文库构建和测序
共制备36个样本[2个有遮挡的覆盖物(有遮挡和未遮挡)× 3个阶段(DAF35、45和55)× 2个组织(叶和果实)× 3个生物重复],使用QIAGEN RNeasy Plus Mini Kit (Cat。74134号)。使用Nanodrop 2000分光光度计和QUBIT荧光仪(Life Technologies)测定RNA的纯度和浓度,使用安捷伦2100生物分析仪(Agilent Technologies)评估RNA的完整性。
将三个阶段(DAF35、45和55)的合格叶片(UL和SL)和果实(UF和SF)的rna等效混合到两个相应的文库中。利用SMART PCR cDNA Synthesis Kit (Clontech, Cat。639206号)。采用KAPA HiFi PCR试剂盒对PCR进行优化;使用BluePippin大小选择系统(Sage Science, Beverly, MA, USA)对不同的cDNA片段(0.5-2 kb, 2-3 kb, > 3 kb)进行分类。PCR产物使用SMRTbell Template Prep Kit 1.0 (part.100-259-100)按照供应商的协议进行扩增和构建。利用PacBio Sequel V2.1实时纳米孔测序仪对文库进行测序,共5个细胞(1个细胞用于果实,4个细胞用于叶子);对0.5 ~ 6 kb的混合文库进行测序。共使用36份合格的RNA样本进行Illumina测序。RNA样本用于poly(A)+选择使用寡核苷酸(DT)磁珠,同时构建RNA-SEQ库。使用PACBIO续集和HISEQ X TEN测序cDNA文库武汉Nextomics Biosciences Co.,Ltd。
数据处理和基因功能注释
收集PACBIO续集的序列数据,使用SMRTLINK 5.0获得高质量共有转录序列。随后,用于纠错(ICE)算法的迭代聚类用于消除冗余并提高全长转录物的准确性。Illumina Hiseq的原始数据通过内心的Perl脚本处理。通过删除包含适配器的读取,读取包含Poly-N区域的读取以及从原始数据的低质量读取获得清洁数据。同时,Illumina Hisiq读数用于纠正所有全长的单分子实时(SMRT)突出的全长成绩单[58].使用CD-HIT-EST去除冗余序列后的校对校正序列[59用作进一步分析的参考序列。针对NR,COG,SWISS-PROF,KEGG和GO的数据库搜索基因函数。
差异表达,GO和KEGG浓缩分析
使用RSEM(v1.1.12)计算所有样本的干净读数,并将其标准化为每千碱基转录本每百万片段映射读数(FPKM)值的片段数[60].使用DESEQ包测定不同治疗之间的次数[61].FDR值< 0.05,log2FoldChange绝对值≥1(或<−1)用于识别显著差异表达的基因。涉及使用WEGO软件的deg的GO功能分类统计[62].基于Kegg orthology数据库实现了Degs的代谢路径分配(http://www.genome.ad.jp/kegg/)使用KAAS系统(http://www.genome.jp/tools/kaas/).总体路径分析主要基于Mercator4和Mapman4工具[63].MapMan BIN是基于自动和手动注释推断出来的。使用R语言、Cluster、Fpc、Ggplot2和Reforme2软件包评估叶片和果实中DEGs的不同表达模式;聚类方法是K-均值聚类。
定量实时PCR(qRT-PCR)分析
使用PowerUp™SYBR Green Master Mix (ThermoFisher, Chongqing, China),在10 μL的体积中,包含5 μL SYBR Green Master Mix, 150 ng(叶片)/100 ng(果实)cDNA模板,通过qRT-PCR验证不同条件下的样品(包括叶片和果实)的表达水平。正向和反向引物各0.4 μM。qRT-PCR扩增如下:95℃30 s, 95℃5 s, 60℃30 s,共40个循环。三个樱桃肌动蛋白基因(乌布斯,CYP2.,及ACT2.)被用作参考基因,如前所述[64,65];引物序列列于表S2中。使用2计算相对基因表达−ΔΔ计算机断层扫描方法(66]使用CFX Connect™实时PCR检测系统(Bio-Rad Laboratories,CA,USA)。所有验证都在三种生物学和技术复制中进行。
统计分析
使用SPSS 21.0软件包(Chicago, IL, USA)进行Duncan和Tukey检验,评估所有数据的显著差异。所有数据以至少三次重复的平均值和标准差(SD)表示。图由Origin 9.0 (Origin Lab, Northampton, MA, USA)构建。
可用性数据和材料
支持本文结论的数据集包含在本文及其附加文件中。本研究期间使用和/或分析的数据集可根据合理要求从作者处获得(Tian Tian,tiantiangzu@163.com;广乔,13518504594@163.com).
缩写
- 答:
-
花青素合成酶
- BP:
-
生物过程
- 复写的副本:
-
蜂窝组件
- CCS:
-
循环一致序列
- DEG:
-
差异表达基因
- FLNC:
-
全长非嵌合体
- 走:
-
基因本体
- 冰:
-
误差的迭代聚类
- KEGG:
-
京都基因和基因组百科全书
- LHCP:
-
光收集复合蛋白
- 标准:
-
光合有效辐射
- PDS:
-
八氢番茄红素desaturase
- SD:
-
标准偏差
- SMRT:
-
单分子实时
参考
- 1。
Acero N,Gradillas A,Beltran M,GarcíA A,Mingarro DM.不同甜樱桃酚类化合物分布和抗氧化性能的比较(李属鸟结核品种。食品化学。2019;279:260–71.
- 2。
Muccillo L、Colantouni V、Sciarrillo R、Baiamonte G、Salerno G、Marziano M、Sabatino L、Guarino C.坎帕尼亚(意大利)甜樱桃的分子和环境分析(李属鸟结核l .)生物栽培避难所鉴定与保护的品种。Sci Rep-Uk。2019; 9:6796。
- 3.
Kafle GK,Khot LR,Zhou J,Bahlol HY,Si Y.防止雨水引起甜樱桃开裂的精确喷雾应用:理解雨水和水果开裂敏感性导致的钙流失。阿姆斯特丹科学杂志,2016;203:152–7。
- 4.
高y,李xx,韩mm,杨xf,李z,王j,潘qh。雨水栽培栽培改变多酚和挥发性代谢的碳分配,胰腺炎。霞多丽·霞多丽葡萄葡萄。Plos一个。2016; 11:E156117。
- 5.
ozkan y,yıldızk,küçükere,Çekicc,Özgenm,akçay.PV的早期性能。jonagold苹果在五棵树训练系统中的m.9。Hortic SCI。2012; 39:158-63。
- 6.
yan w,longle。钙磷酸中钙含水钙含水樱桃采后分裂的生理生化变化。食品化学。2015; 181:241-7。
- 7.
Faniadis D,Drogoudi Pd,Vasilakakis M.品种,果园海拔和储存对甜樱桃的水果品质特征的影响(李属鸟结核《阿姆斯特丹音乐学院》,2010;125:301-4。
- 8.
白桦、白桦、白桦、白桦和白桦对紫丁香叶片衰老速率和时间的影响紫丁香丁香.树杂志。2019;39:961 - 70。
- 9.
Overbeck V,Schmitz M,Tartachnyk I,Blanke M.使用dualex非破坏性测量确定不同甜樱桃果园覆盖下的光可用性™. 《欧洲农业杂志》,2017;93:50-6。
- 10
关键词:水稻,光,变化,基因表达,光合作用植物杂志。2019;179(4):1632 - 57。
- 11
王低频。橡胶树对光强变化的生理和分子响应(Hevea Brasiliensis Muell..arg。)。植物理性生物生物。2014; 83:243-9。
- 12.
行距和遮荫对不同生育时期棉花产量和纤维品质的影响。Eur J Agron. 2015; 65:18-26。
- 13。
Overbeck v,Schmitz M,Blanke M.有针对性的迫使提高甜樱桃果实的质量,营养和健康价值。J SCI食物农业。2017; 97:3649-55。
- 14。
Szalai G,Majláthi,PálM,Gondor OK,Rudnóys,奥拉·克,沃纳沃·r,卡拉波斯B,Janda T.玉米玉米冷驯化过程中的janus面对的本质。前植物SCI。2018; 9:850。
- 15.
Sekhar S,Panda D,Kumar J,Mohanty N,Biswal M,Baig MJ,Kumar A,Umakanta N,Samantaray S,Pradhan SK,Shaw BP,Swain P,Behera L.活跃分蘖期低光胁迫诱导的耐低光和敏感水稻品种的比较转录组图谱。Sci Rep Uk.2019;9:5753。
- 16.
刘QH,吴X,陈B,MA J,Gao J.低光对水稻农艺和生理特性的影响,包括粮食产量和质量。米科。2014; 21:243-51。
- 17.
Weber S, Damerow L, Kunz A, Blanke M.花青素合成和光利用可以通过反射覆盖可视化的光穿透树冠。J植物杂志。https://doi.org/10.1016/j.jplph.2018.12.008.
- 18.
Solomakhin AA,Blanke Mm。覆盖冰雹对苹果园水果质量和微气门的不利影响。j sci食物agr。2007; 87:2625-37。
- 19.
苗玲,张艳,杨旭,肖军,张华,张智,王颖,姜刚(草莓属×阿纳纳萨)水果。食品化学。2016;207:S2122214610。
- 20。
Wei H,Chen X,Zong X,Shu H,Gao D,Liu Q.甜樱桃红色和黄色果实中涉及的基因的比较转录组分析(李属鸟结核l .)。《公共科学图书馆•综合》。2015;10:e0121164。
- 21。
李涛,刘玲,姜超,刘颖,石磊。互遮荫对大田高粱光合调节的影响。J Photoch Photobio B. 2014; 137:31-8。
- 22。
Tian T, Qiao G, Deng B, Wen Z, Hong Y, Wen X. effect of rain shelter coverings on chinese cherry营养生长及果实性状樱桃采用)。Sci Hortic-Amsterdam。2019; 254:228-35。
- 23。
刘X,Mei W,Soltis PS,Soltis de,Barbazuk WB。在没有参考基因组的情况下检测来自单分子的长读序列的可选转录同种型。Mol Ecol Resour。2017; 17:1243-56。
- 24。
《京都基因与基因组百科全书》。核酸研究,2000;28:27-30。
- 25。
Alessio C,Simonetta P,Marco F,Vania M,Angelo B,Mariangela S,Claudio P. Zeta-Carotene去饱和酶的基因编码的缺陷表征向日葵非休眠-1突变体。植物细胞生理。2004; 45:445-55。
- 26。
李妮,悦C,曹豪,钱,郝谢,王叶,王我,丁cq,王xc,杨yj。在茶叶植物的年轻和成熟叶片中差异冷敏感机制的转录物测序解剖(山茶花Sinensis.).J植物杂志。2018; 224-225:144-55。
- 27。
冯y,山,高r,刘文,雍t,王X,吴x,杨w.中继条带间隔系统中的大豆幼苗生长与灯数,红色:远红比例。现场裁剪。2014; 155:245-53。
- 28。
Raik W,Lars D,Katharina BU,Wolfgang F,Thomas P.对波动的光质的长期反应是一种重要且独特的光适应机制,它支持植物的生存拟南芥在弱光条件下。植物。2008;228:573-87。
- 29.
蒲超,桂学勇,杨强,李乃珍,程智,冯奇珍,荣志国。基于itraq的定量蛋白质组学分析甘蓝型油菜叶片揭示与叶绿素缺乏相关的途径。J蛋白质组。2015;113:244-59。
- 30.
Floris M,Robaglia C,Elodie L,Bassi R,Alboresi A.在Light Regress下的光收获基因表达的转录后控制;轻应力。植物mol biol。2013; 82:147-54。
- 31
陈辉,张丹,郭军,吴辉,金敏,卢强,卢超,张磊拟南芥为有效修复光损伤的光系统ii。植物学报2006;61:567-75。
- 32
董磊,杜伟,刘凯,孙瑞,刘超,王凯,杨晨。pbs蛋白在光照条件下光系统ii超复合物重构中的作用。acta botanica yunnanica(云南植物研究). 2015;
- 33
Palacio S, MMG大师。地中海矮灌木芽生根能力与碳水化合物和氮储量的关系。安Bot-London。2007; 100:865 - 74。
- 34
王泽,白我,哦,朱耶。芸苔类固态信号网络和光学发生调节。Annu Rev Genet。2012; 46:701。
- 35
Ning Z, Kallis RP, Ewy RG, Portis AR拟南芥需要对较大的rubisco活化酶亚型进行氧化还原调节的能力。美国科学院学报2002;99:3330–4。
- 36。
Tibor S,Boris H,JićíPetri,Bernhard G,Andrej P.叶绿素生物合成的转录和翻译后控制通过黑色术语蛋白氯化物氧化酶氧化酶挪威云杉.Photosynth杂志2017;132:1-15。
- 37。
Valladares F,Niinemets U.遮阳耐受性,复杂性质和后果的关键植物特征。ANN REV ECOL EVOL S. 2008; 39:237-57。
- 38。
冯y,冯l,刘q,吴x,风扇y,拉扎马,程y,陈俊,王x,yong t。光强度与红细比值之间的相互作用对大豆光合作用的影响叶子在阴凉条件下。Environ Exp Bot。2018; 150:79-87。
- 39.
Osanai T, Imashimizu M, Seki A, Sato S, Tabata S, Imamura S, Asayama M, Ikeuchi M, Tanaka K. Chih, mg螯合酶的h亚基,是sige的一个反sigma因子聚囊藻。PCC 6803. P Natl Acad Sci USA。2009; 106:6860-5。
- 40
Khanal N,Bray GE,Grisnich A,Moffatt BA,Gray GR.中国光合适应和低温的差异机制拟南芥以及极端微生物eutrema salsugineum。Plants-Basel。2017年,32。
- 41
Yan J,Yu L,Xuan J,Lu Y,Lu S,Zhu W. de Novo转录组序列测序和基因表达仿形菠菜(菠菜oleraceaL.)在热应激下叶。Sci Rep-Uk。2016; 6:19473。
- 42
Stefano C, Zhirong L, Niyogi KK, Roberto B, Luca d拟南芥SZL1突变体揭示了β-胡萝卜素在照相我的光照学中的关键作用。植物理性。2012; 159:1745-58。
- 43。
叶黄素和叶黄素在光保护系统中的作用。Acta botanica sinica; 2012:182-93。
- 44。
Luca D,Holt NE,Shanti K,Marcel F,Stefano C,Donatella C,Frank HA,Jean A,Roberto B.玉米黄质通过调节特定采光天线亚基的叶绿素三重态产量来保护植物光合作用.生物化学杂志.2012;287:41820-34。
- 45。
刘,任米,刘T,杜永丽Zt,刘X,刘j,侯赛,杨w.遮阳胁迫对大豆茎木质素生物合成的影响。J Intent agr。2018; 17:1594-604。
- 46。
Montserrat M, Albert M, Anna C, Carmen GR, Fernández-Checa JC。线粒体谷胱甘肽,一种关键的生存抗氧化剂。抗氧化氧化还原信号。2009;11:2685-700。
- 47。
Naguib AE, El-Baz FK, Salama ZA, Hanaa HA, Ali HF, Gaafar AA。提高酚类、黄酮类和硫代葡萄糖苷作为抗氧化剂的花椰菜响应有机和生物有机肥。J chemical Soc. 2012; 11:135-42。
- 48。
Kennedy JA,Jones GP.过量间苯三酚存在下酸催化后原花青素裂解产物的分析.农业食品化学杂志,2001;49:1740-6。
- 49。
张艳,胡伟,彭晓霞,孙波,王旭东,唐辉。草莓2个基因型果实发育过程中花青素和原花青素合成特性对不同光品质的响应。J Photoch Photobio B. 2018; 186:225-31。
- 50。
agarwal a,gupta sd。发光二极管(LED)的影响及其对控制环境植物生产系统植物生长发育的潜力。Curr Biotechnol。2016; 5:28-43。
- 51.
JAAKOLA L.新见解果实中的花青素生物合成调节。趋势植物SCI。2013; 18:477-83。
- 52.
Pelletier MK,Murrell JR,Shirley BW.植物中黄酮醇合酶和白细胞花青素双加氧酶基因的特征拟南芥.“早”和“晚”基因差异调控的进一步证据。植物杂志。1997;113:1437。
- 53.
Katia P,Chiara T.生殖器官花青素合成调节的最新进展。植物科学。2011;181:219–29.
- 54.
Liu Y, Shen X, Zhao K, Ben Y, Guo X, Zhang X, Li T.不同颜色甜樱桃花色苷生物合成基因的表达分析李属鸟结核《植物生长规律》2013;32:901-7。
- 55.
孟江飞,宁鹏飞,徐腾飞,郑振文葡萄简历。赤霞珠针对浆果皮的酚醛概况和葡萄疾病的发病率。分子。2012年; 18:381-97。
- 56
Koyama K,Goto Yamamoto N.不同发育阶段的束遮荫影响“赤霞珠”葡萄浆果皮中的酚类生物合成。美国社会科学杂志,2008;133:743–53。
- 57
段B,歌曲,赵y,姜y,shi p,meng j,张z.赤霞珠的赤素素生物合成调控动态变化(葡萄雨季在雨棚栽培下生长。食品化学。2019;283:404–13。
- 58
Leena S, Eric R. Lordec:准确和高效的长读错误校正。生物信息学。2014;30:3506-14。
- 59
Xu Z,Peters RJ,Wei宁斯J,罗H,廖B,张X,朱Y,吉A,张B,胡S。通过组合测序平台获得的全长转录组序列和剪接变异体应用于不同的植物根组织丹参和tanshinone生物合成。植物j . 2015; 82:951 - 61。
- 60
杜威出版社。Rsem:有或没有参考基因组的RNA-seq数据的准确转录本定量。Bmc生物信息学。2011;12:323。
- 61
王力坤,冯志新,王旭,王新伟,张晓刚。Degseq:一个用于从RNA-seq数据中识别差异表达基因的R包。生物信息学。2010;26:136-8。
- 62
贾Y,林F,洪坤Z,雍Z,Jie C,曾金Z,Jing W,Shengting L,Ruiqiang L,Lars B. Wego:一种用于绘制Go注释的Web工具。核酸RES。2006; 34:W293-7。
- 63
Schwacke R,Ponce Soto GY,Krause K,Bolger AM,Usadel B.Mapman4:适用于多组数据分析的精细蛋白质分类和注释框架。摩尔植物。2019;12(6):879–92.
- 64
夏Y,张F,陶义,歌曲S,方J.参考基因选择,用于不同樱桃基因型,发育阶段和器官的定量实时PCR标准化。Sci Hortic-Amsterdam。2015; 181:182-8。
- 65
朱益,王y,张h,邵x,李yq,郭wd。中国樱桃中可靠参考基因的选择与表征(樱桃),采用实时定量PCR (qRT-PCR)。农业生物技术。2015;23:690-700。
- 66
Schmittgen TD,Livak KJ。通过比较C(T)法分析实时PCR数据。NAT PROTOC。2008; 3:1101-8。
致谢
不适用。
基金
国家自然科学基金(31760552)、贵州省核心项目(2016-2520)、贵州省创新人才计划(2016-4010)和贵州省生物学一级学科建设计划(GNYL[2017] 009)资助项目。我们感谢所有的基础经济支持。资助机构为研究项目提供了资金支持,但没有参与研究的设计、数据收集、数据分析或手稿的撰写。
作者信息
隶属关系
贡献
XPW设计了研究。TT在GQ、ZW、BD、ZLQ和HY的帮助下进行了实验。TT收集了实验数据并起草了手稿。XPW和GQ审查了手稿和部分数据分析。所有作者都阅读并批准了最终手稿。
通讯作者
伦理宣言
伦理批准和同意参与
这些实验没有利用转基因技术,也没有涉及受保护物种。本研究使用的“玛瑙红”采自贵州大学示范基地福泉某果园。它不需要特定的许可。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
补充资料
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
全长非嵌合reads (flnc)的密度。
附加文件2:表S1。
PacBio Sequel实时测序概述。四排“SL和UL”1-4“代表叶库,行”SF和UF“代表水果库。A.聚合酶,PacBio Sequel产生的原始读数;B亚筛选,后过滤后聚合酶读取;C插入的排序时间;D循环一致序列的数目;E全长非嵌合数量。
附加文件3:表S2。
用于QRT-PCR的引物序列。
附加文件4:表S3。
GO注释的分类(前50个GO术语)。
附加文件5:表S4。
KEGG注释的分类。
附加文件6:表S5。
RNA-Seq数据统计。
附加文件7:表S6。
遮雨条件下叶片和果实中MapMan注释的生化途径。
附加文件8:表S7。
不同阶段叶片不同条件的光合作用的反应。这些值表示三棵树的平均值±SD(六片叶子·树- 1)。在同一列中,不同字母后面的平均值在P< 0.05。
权利和权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
田T,乔G,文,Z。等比较转录组分析显示樱桃自适应机制下的分子调节(cerasus pseudocerasusLINDL。)到遮住覆盖物。BMC植物杂志20,27(2020)。https://doi.org/10.1186/s12870-019-2224-x
收到:
接受:
发表:
关键词
- 樱桃
- 避雨棚
- 转录调控
- 光合作用
- 花青素生物合成