摘要
背景
植物基因组中含有大量的HAK/KUP/KT转运体,它们在钾的吸收和转运、渗透势调节、耐盐性、根系形态发生和植物发育等方面发挥着重要作用。甘蔗种植区土壤缺钾严重。然而,(黑/ KUP / KT基因家族仍有特征在于甘蔗(糖).
结果
在这项研究中,30(黑/ KUP / KT基因在蔗糖spontaneum.分析了系统发育、复制事件、基因结构和表达模式。系统发育分析(黑/ KUP / KT来自15个代表性植物的基因表明,该基因家族分为四组(IV片蔓延)。古代全基因组重复(WGD)和最近的基因重复促成了扩展(黑/ KUP / KT基因家族。非同义对同义的替代比(Ka/Ks)分析表明,纯化选择是推动进化的主要力量(黑/ KUP / KT基因。散度时间(黑/ KUP / KT基因家族的估计范围为基于KS分析的134.8至233.7 mya,这表明它是植物中的古老基因家族。基因结构分析表明(黑/ KUP / KT基因在进化过程中伴随着内含子的获得/丢失。RNA-seq数据分析表明(黑/ KUP / KT进化支II和III的大部分基因在各组织中以构成性表达为主,而进化支I和IV的大部分基因在不同发育阶段的被测组织中无表达或表达量极低。表达SSHAK1和SsHAK21在低k+压力。酵母功能互补分析显示SSHAK1和SsHAK21可以拯救k+在酵母突变体中摄取。
结论
本研究提供了进入进化史的见解(黑/ KUP / KT基因。HAK7/9/18主要在茎的上光合区和成熟区中表达。HAK7/9/18/25受到阳光的调节。SSHAK1和SsHAK21在有限钾条件下对钾的获取起重要的调节作用+供应。我们的研究结果为进一步研究其功能提供了有价值的信息和关键候选基因(黑/ KUP / KT基因在糖.
背景
钾是植物生长发育所必需的矿质营养物质,也是植物中含量最丰富的一价阳离子,约占植物干重的2~10% [1].钾参与许多重要的生理生化过程,如细胞充盈调节、细胞电荷平衡调节、酶活性调节和蛋白质合成[1].植物缺钾的症状通常表现为茎弱、易倒伏、抗旱抗寒能力下降和叶片黄化,这是由于蛋白质和叶绿素的降解,导致组织坏死[2].因此,钾对提高作物产量和品质具有重要意义。甘蔗是重要的糖能源作物,生长期长,生物量大,钾肥吸收量大。一方面,据估计,甘蔗生产一吨糖大约需要吸收2~2.5公斤钾[3.,4].另一方面,甘蔗主要种植在亚热带和热带地区,土壤酸化和钾淋溶现象普遍。甘蔗产区栽培层全钾和速效钾含量较低。
植物细胞保持相对较高和稳定的钾+浓度(约100~150 mM)+浓度在0.01~1 mM范围内变化很大[5].一般认为,植物吸收钾有两种机制,即外源钾离子浓度低(< 0.2 mM)时通过钾离子转运体的高亲和力转运系统(HATS)和钾离子通道的低亲和力转运系统(LATS),钾离子浓度高(> 0.5 mM)时通过钾离子通道[6,7].根据其结构和功能,植物钾转运体可分为5个科:(1)振动筛通道;(2) TPK(串联孔K+)通道;(3) HAK(高亲和K+运输器)/ kup(k+吸收通透酶)/ KT (K+运输车);(4)HKT运输车;和(5)CPAS(阳离子 - 质子抗污染术)[2,8].其中,(黑/ KUP / KT家庭是最大的,广泛分布于细菌,真菌和植物中,但尚未在动物细胞中鉴定[9].
根据他们与细菌kup和真菌hak运输机的同源性[10],植物Hak / Kup / Kt运输器构件AtKUP1和HvHAK1是从拟南芥和大麦中克隆出来的11,12].这两个基因都可以补充k+吸收缺陷菌株的酵母,表明他们有钾转运活性。随后,几(黑/ KUP / KT成员被克隆和确定,如AtKUP3和AtHAK5在拟南芥中,Oshak1.在大米和CAHAK1.在辣椒中,它们也被证明是高度亲和性的钾转运体[13,14,15,16].基于比较基因组方法,13,27和27(黑/ KUP / KT基因分别在拟南芥、水稻和玉米中被鉴定[17,18,19].这些预测的HAK/KUP/KT转运体被分为四个簇。(黑/ KUP / KT K+转运体在植物钾离子的获取和转运、盐胁迫、渗透调节以及根的形态发生和表型中发挥着广泛的作用[7].表达Oshak1.在K+饥饿的大米,奥莎德克5.在根中表达较少,但在芽中表达丰富[20.,21.].一些离子,尤其是钠离子+和NH4+,可以对表达的额外影响(黑/ KUP / KT基因(22.,23.].
HAK/KUP/KT K的转录调控+转运体是不同植物对K反应的普遍机制+饥饿的压力(8].的(黑/ KUP / KT进化支I的基因,例如AtHAK5,Oshak1.,CAHAK1.和ThHAK5,在对照条件下,根和地上部均表现出低表达水平,而在根中则表现出高表达水平+缺乏压力(12,13,14,16].而HAK/KUP/KT K+其他三个赛车的运输人表现出不同的表达模式[24.,因为大多数K+运输司机不是由k引起的+饥饿(25.].在拟南芥中,bHLH121 (basic helix-loop-helix 121)、DDF2 (dwarf and delayed flowering 2)、JLO (jagged lateral organs)和TFII_A (transcription initiation factor II_A gamma chain)等转录因子与拟南芥的启动子结合HAK5的并在低K下激活其表达+压力(26.].hak / kup / kt k的激活+转运体也在转录后和/或翻译后水平受到调控。AtHAK5Hepper和番茄的其同源物可以由CIPK23(CBL-相互作用蛋白激酶23)/ CBL(钙碱B样蛋白)复合物激活[27.].
综上所述,植物HAK/KUP/KT钾转运体的功能研究已经进行了大量的研究,并取得了重要进展。但是,已知的功能性(黑/ KUP / KT基因主要是在少数植物中鉴定的,例如拟南芥,水稻和玉米,但它们的生理功能和甘蔗的调节机制仍然未知。在这项研究中,基于新发布的美国spontaneum基因组(28.,我们确定了(黑/ KUP / KT基因家庭美国spontaneum.分析了不同物种间的系统发育关系、外显子/内含子的组织结构和基因表达。这些结果为甘蔗钾利用效率的遗传改良提供了有价值的信息和可靠的候选基因。
结果
的识别h基因在甘蔗
根据比较基因组学,29岁SBHAK.从高粱(高粱双色甘蔗是甘蔗的近亲)。利用高粱的蛋白质序列h作为参照,30个不同的基因美国spontaneum HAK)基因(表1),不包括等位基因,从四倍体的基因组中鉴定出来美国spontaneumap85 - 441 (28.].每个基因包含1到4个等位基因,平均为3个(附加文件1).30SsHAK基因分布在7个区域美国spontaneum染色体:1号染色体包含6个基因;2号染色体包含7个基因;3号染色体包含4个基因;4号染色体包含两个基因;5号染色体包含5个基因;6号和8号染色体各包含3个基因。没有SsHAK7号染色体上的基因被鉴定(附加文件)1).
所有30个预测的Sshak蛋白有一个典型的“K_TRANS”结构域(PF02705),其特异于Hak / Kup / Kt钾转运蛋白成员。对于一致性,这些SsHAK基因是根据先前的报道命名的o .马唐HAK)命名法及系统发育关系[17].如果两个SsHAK基因同样接近单一奥什坦基因,然后使用相同的名称,然后是字母“a”和“b”(表1).两个paralogousSsHAK基因(SsHAK19a和SsHAK19b)与同一高粱基因Sobic.006G062100相对应,这可能是高粱基因丢失或甘蔗基因重复造成的。所鉴定的30个SsHAKs氨基酸的数量为487 ~ 967,平均为758个。SsHAKs的预测等电点(pI)的变化范围为5.88 ~ 9.26,平均pI为8.15。分子量范围为55.84 kDa ~ 106.49 kDa,平均84.47 kDa1).Sshak蛋白中的跨膜结构域的预测表明,最多包含11或12个跨膜螺旋,其类似于高粱中的研究结果。由狼Psort预测的Sshak蛋白的亚细胞位置主要是血浆膜,最适合其作为运输器维持k的角色+在甘蔗体内平衡。此外,SsHAK蛋白还位于内质网、液泡、细胞质、高尔基体和叶绿体等细胞器上。高粱SsHAKs与其同源基因的蛋白序列比对表明美国spontaneum和高粱双色共享身份的比例从81到98%不等,平均为92.5%1).435对比对结果显示,SsHAK19a和SsHAK19b的同源性最高(96%),其他基因对的同源性在28 ~ 82%之间,平均为46%,表明SsHAK19a和SsHAK19b的同源性最高SsHAKS是一个古代基因家族,序列偏差高(附加文件2).
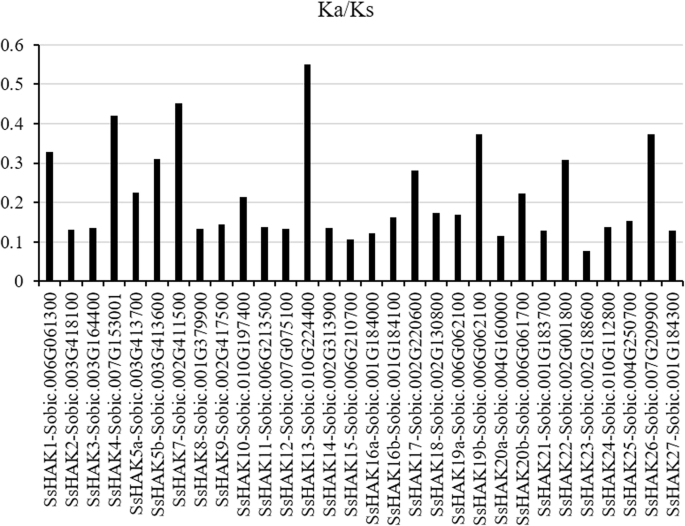
非同义与同义之间的替代比(Ka/Ks)Shaks.并计算其高粱中的原始基因,以研究甘蔗的进化功能约束。结果表明,除了ka / ks比例小于0.5SsHAK13,表明净化选择是推动生物进化的主要力量h基因(图。1).
非同义词(ka)和同义词(ks)替换比率Shaks.和高粱的同源性。Ka/Ks比值由Easy_KaKs计算程序(https://github.com/tangerzhang/fafucgb/tree/master/easy_ka.ks)
系统发生的分析h基因在美国spontaneum被子植物和代表
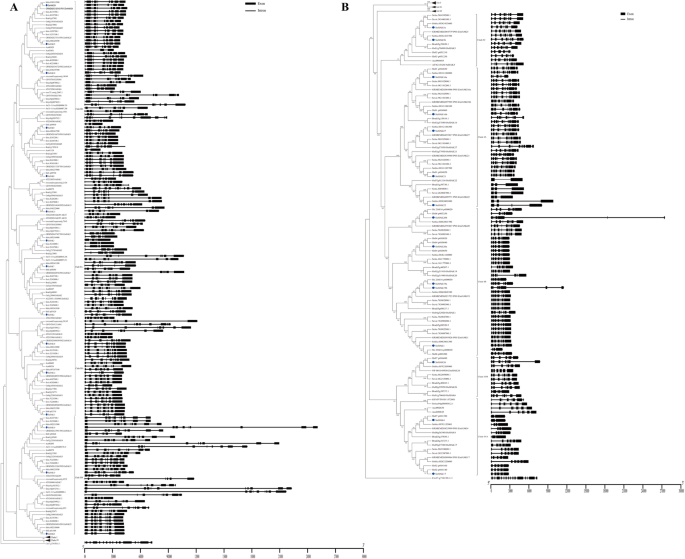
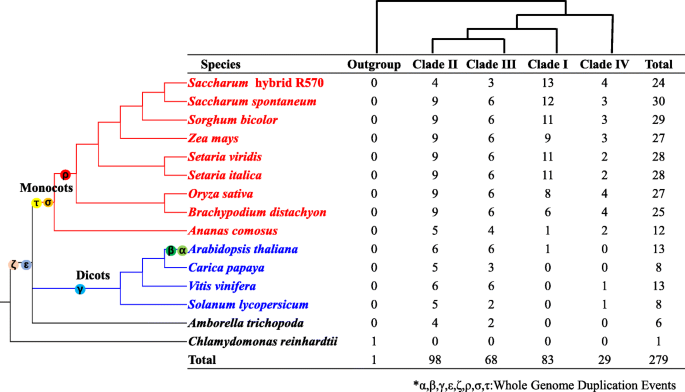
分析的演变h基因家庭美国spontaneum和不同的植物,总共278个h来自14个代表性的Angiosperms和a的基因h成员来自Chlamydomonas Reinhardtii.由于除了使用邻接方法来构建系统发育树的基团(图。2额外的文件3.).278年h基因包括来自Amborella trichopoda,8来自茄属植物lycopersicum, 13vitis Vinifera,8来自卡里卡番木瓜, 13拟南芥蒂利亚纳,12来自ananas comosus., 25Brachypodium distachyon, 27日从栽培稻, 28日Setaria Italica., 28日Setaria冬青, 27日从玉米29日,高粱双色, 30蔗糖spontaneum和24起从糖混合R570 [29.].在补充数据中提供了来自15个代表植物物种的279 Hak / Kup / Kt转运蛋白的氨基酸序列(附加文件4).
这些h根据以往的报道,基因可以分为四个分支(I, II, III, IV)奥什塔克斯[17].在答:trichopoda,最早的分歧性患者,只有6个h而在双子叶和单子叶中,基因的数量在野阵营范围从8到30(图。2和3.),表明古代全基因组复制(WGD)促进了基因组的扩展h双子叶和单子叶的基因家族。包括进化枝II和进化枝IIIh这表明这些基因的祖先可能在被子植物分裂之前就已经存在了。2和3.).进化枝I和进化枝IV主要包含h单子叶植物的基因。八十三h在CLADE I中鉴定了基因,其中只有一个h基因是答:comosus(ACO006685,同源SSHAK5),拟南芥(AtHAK5),另一个81h这些基因来自所有8个被检测的基因禾本科物种(无花果。2和3.).29在野阵营其中只有2个来自双子叶植物。这些结果表明在野阵营分布不均。
根据高粱和甘蔗的KS值(附加文件5),四簇的分歧时间在野阵营据估计。Ks的中位值在1.644 ~ 2.851之间,其对应的发散时间在134.8 ~ 233.7 Mya之间,表明h是一个古老而分散的家族。此外,还有两对重复的Shaks.(SsHAK5a / 5 b和SsHAK16a / 16 b)分别在18.94和58.14 Mya(附加文件6).这些结果表明SsHAK家族是一个古老的基因家族,最近发生了基因复制事件。
外显子/内含子的组织h家庭美国spontaneum和其他被子植物
研究了该区的构造特征及其演化h基因家族中外显子/内含子的结构在野阵营将其映射到系统发生树中,并分析其基因特征和模式(图。2).的外显子数h15种植物的科分布在2 ~ 16种之间,平均8.4种,279种中217种(77.8%)。h基因有8到10个外显子(附加文件7和8).这一结果暗示了被子植物的最后共同祖先(LCA)h基因有8到10个外显子。
的外显子数Shaks.从2到12之间变化,一半Shaks.拥有8或9个外显子。模式的SsHAK基因结构类似于h高粱和玉米在同一枝上的基因结构表明h基因结构Panicoideae相对节省了。在思克我,外显子号码h基因变异范围为2 ~ 12个,在4个进化支中变异最大。值得注意的是,这是h亚家族的基因SsHAK22只有2到4个外显子;然而,蛋白质的大小保持一致,这可能是由于内含子的丢失。进化枝II有最多的h基因,98分中有60次在野阵营拥有9个外显子,5分:5分Shaks.窝藏8个外显子。SsHAK3/8/10比高粱中的原始基因更少的外显子;第一个外显子SsHAK13第七个外显子SsHAK24比高粱中的相应外显子小,均导致氨基酸序列更短美国spontaneum(桌子1,无花果。2).在进化支III中,外显子数相对保守,68个外显子中有61个外显子h具有8至10个外显子的基因,而基因尺寸大大变化,主要是由于内含子的不同尺寸。Clade IV中的外显子数范围为2至8,平均值为7,比其他片状小。值得注意的是,这是h亚家族的基因SSHAK4只有2 ~ 5个外显子,可能是进化过程中内含子丢失所致。结果表明在野阵营不同进化动态下的继承基因结构重建美国spontaneum以及研究中的其他被子植物。
表达式的分析h基因在糖物种
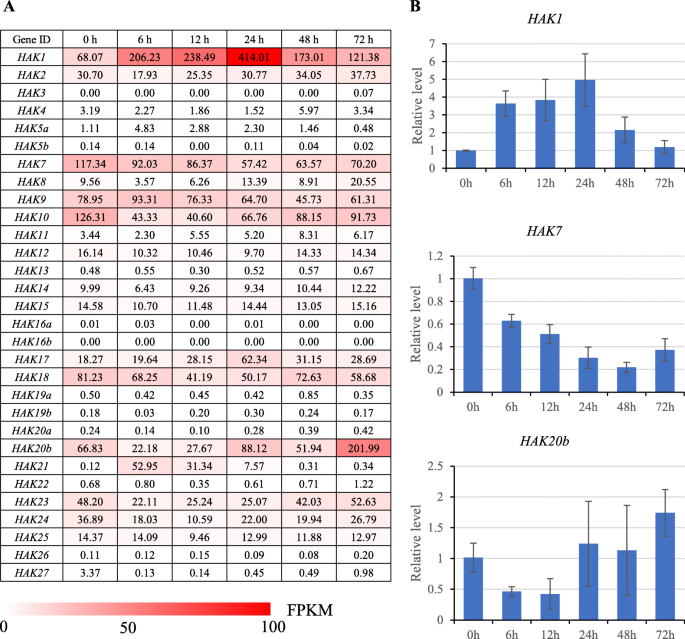
研究的表达谱和势函数在野阵营在糖根据4组RNA-seq数据,比较基因表达模式:1)不同发育阶段和组织;2)叶片梯度;3)昼夜节律;4)低钾胁迫处理。的FPKM值HAK1,HAK7和HAK20b在0 h、6 h、12 h、24 h、48 h和72 h条件下,YT55的活性明显增强+通过RT-QPCR验证了稳态条件。相对表达水平与FPKM值呈正相关(R2= 0.8419,附加文件9),暗示基于RNA-SEQ分析的基因表达的可靠性。
的表达模式在野阵营在不同的组织阶段
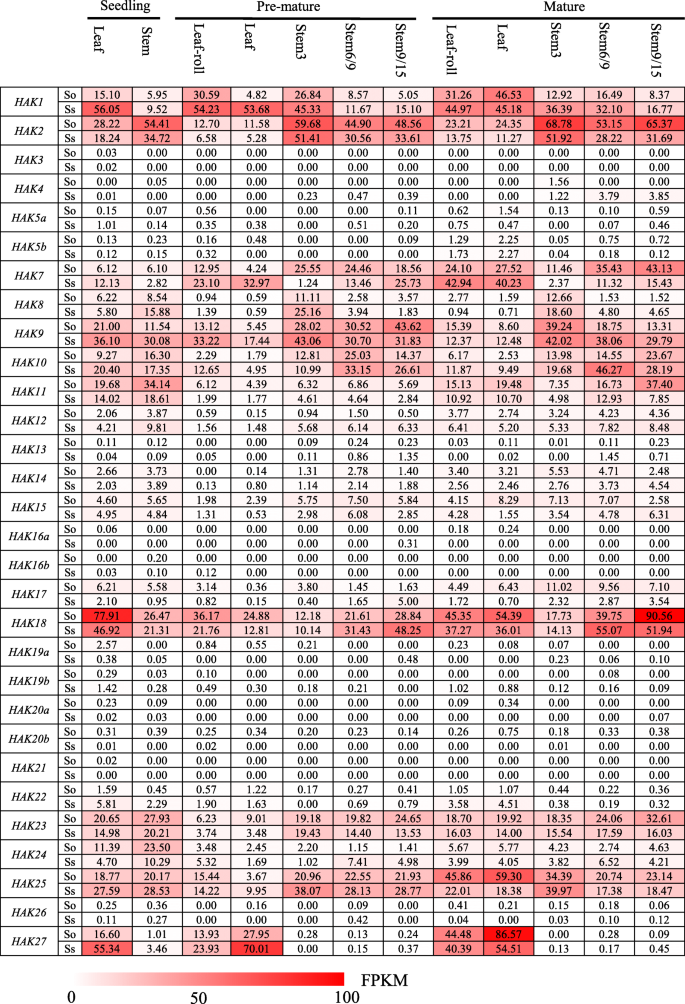
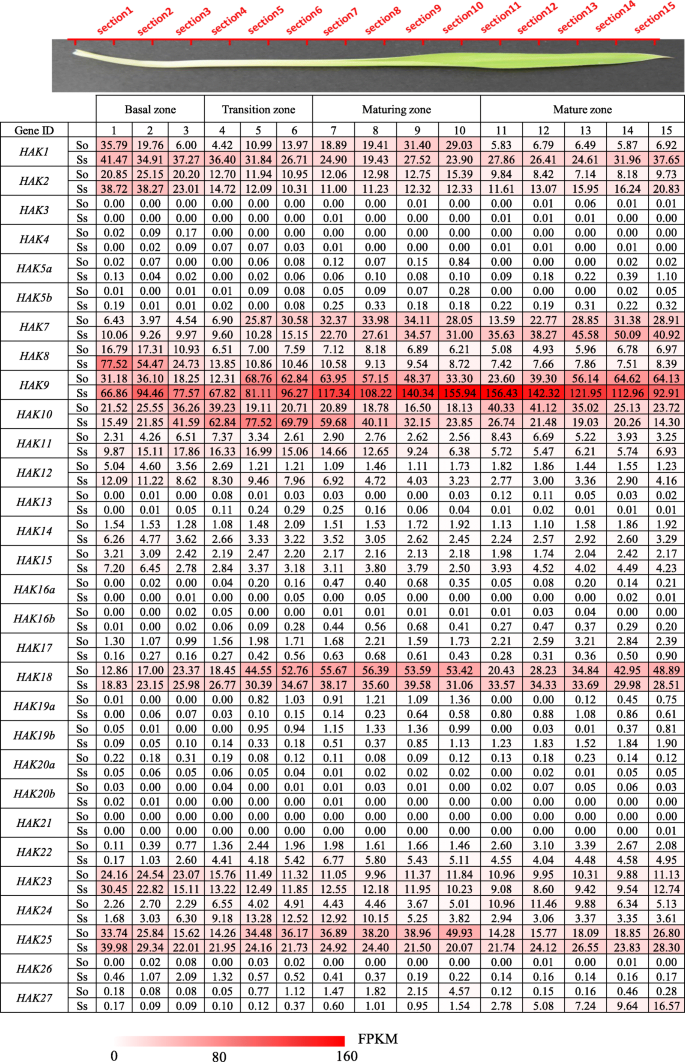
研究不同品种间的基因功能差异糖物种,转录组概况在野阵营在两个糖物种,S. Officinarum.和S. Spontaneum,基于RNA-seq分析了5个不同组织的3个发育阶段(幼苗期、早熟期和成熟期),2个叶片(叶片和叶卷)和3个茎(未成熟、成熟和成熟)组织(图2)。4).在30h基因分析,18个基因(Hak3 / 4 / 5A / 5B / 12 / 13/14 / 15/16A / 16B / 17 / 19A / 19B / 20A / 20B / 21/22/26)在两者的所有检查组织中显示出非常低或无法检测的表达水平糖物种。HAK1和HAK2有不同的表达模式吗糖物种。HAK1的表达水平更高美国spontaneum比在s . officinarum叶片中的表达水平高于三种不同阶段的茎中的表达水平。HAK2的表达水平更高S. Officinarum.比在美国spontaneum,且茎中表达量高于叶。HAK8主要在上茎表达,而中茎和下茎表达量很低。HAK9和HAK10茎的表达水平高于叶子。HAK18在所有组织中均有表达,且表达量较高,特别是在苗期叶片和成熟茎中。值得注意的是,HAK27在叶片中均有高表达,但在茎中表达量很低或无法检测到。
的表达模式在野阵营穿过叶片梯度
进一步探讨的功能分歧h在源组织中,我们研究了光合作用基因的表达模式在野阵营在不断发展叶片段梯度S. Officinarum.和美国spontaneum(图。5).糖叶片按玉米的方法分为4个区域:基部区(库组织)、过渡区(库源过渡)、成熟区和成熟区(光合作用活跃的完全分化区)[30.].与不同发育阶段的表达模式一致,18h基因(Hak3 / 4 / 5A / 5B / 12 / 13/14 / 15/16A / 16B / 17 / 19A / 19B / 20A / 20B / 21/22/26)的表达量非常低或未被检测到,表明它们在糖运输中的作用有限(图。5).HAK1和HAK2在基底区显示比其他3区更高的表达水平。表达水平HAK7从底部到顶端逐渐增加美国spontaneum叶,而在S. Officinarum.,HAK7在成熟区表达量高于其他3个区。表达水平HAK8从叶基部到叶尖逐渐减少S. Officinarum.和美国spontaneum.HAK9表现出不同的表达模式美国spontaneum和S. Officinarum..在美国spontaneum的表达水平HAK9从基部到成熟区逐渐增加,在成熟区逐渐减少。在美国spontaneum的表达水平HAK9在过渡区至成熟区表达量下降,在成熟区表达量上升,且在成熟区表达量较高S. Officinarum.,建议在这两个分裂后的基因功能分歧糖物种。HAK10中过渡区表达量较高美国spontaneum和更高的表达水平在成熟区S. Officinarum..HAK18在两者中显示了成熟区的更高表达水平美国spontaneum和S. Officinarum.,而HAK23在两者中显示出基部区域的表达水平更高糖物种。HAK25在成熟区表现出较高的表达水平S. Officinarum.但在基底区有较高的表达水平美国spontaneum.
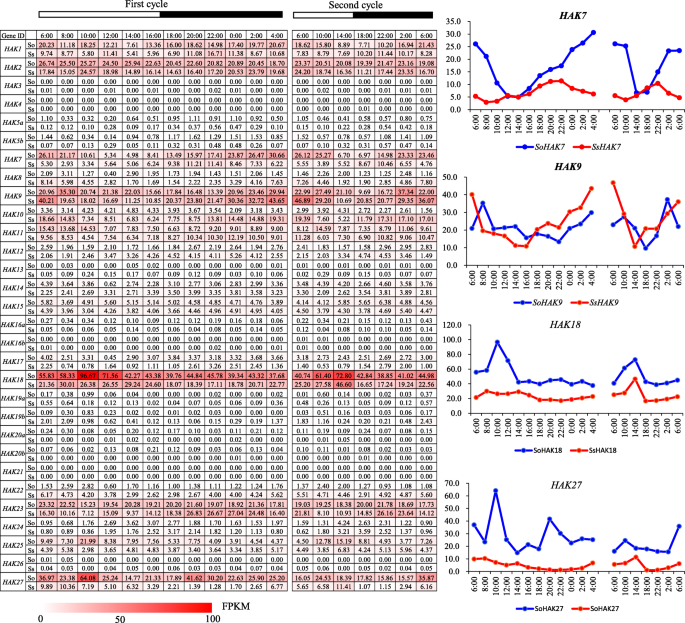
的表达模式在野阵营在昼夜节律中
钾离子作为一种酶激活剂,参与一系列的光合作用过程[31.].分析的表达模式在野阵营在白天的周期中,我们研究了这两种植物成熟叶片的转录组谱糖在24小时内每隔2小时种一次,在另外24小时内每隔4小时种一次。在不同发育阶段和叶段梯度上,18个基因(Hak3 / 4 / 5A / 5B / 12 / 13/14 / 15/16A / 16B / 17 / 19A / 19B / 20A / 20B / 21/22/26)的表达水平非常低或无法检测糖,进一步支持它们在生长和发育中有限的作用(图。6).此外,HAK8和HAK24在两个24小时内也显示低表达水平。HAK1,HAK2,HAK7,HAK18和HAK27的表达水平较高S. Officinarum.比在美国spontaneum,而HAK9和HAK10中显示更高的表达式级别美国spontaneum比在S. Officinarum..HAK1和HAK2两者中没有昼夜表达模式糖物种。HAK7夜间表达量高于白天,中午表达量最低S. Officinarum.但未见日表达模式美国spontaneum.HAK10在夜间显示比白天更高的表达水平美国spontaneum但未见日表达模式美国officinarum。HAK9在晚上显示出更高的表达水平比两者都在白天糖物种.HAK18和HAK27早上表现出更高的表情糖物种。这些发现表明功能差异h基因的昼夜节律。
的表达模式在野阵营在K+不足的压力
研究的函数发散性h研究了甘蔗中响应低钾胁迫的基因的表达谱在野阵营根源于糖在低钾胁迫下0 h、6 h、12 h、24 h、48 h和72 h,对杂交品种YT55进行试验+压力(图。7).在30h分析的基因,14个基因(HAK3/4/5a / 5 b / 11/13/16a / 16 b / 19 20 / 19 b / / 22/26/27)在暴露于低钾环境前后表现出非常低或检测不到的表达水平+压力。值得注意的是,HAK1在低钾条件下,对根系有较强的诱导作用+在24 h达到最高,随后在48 h和72 h下降。HAK21暴露于低k+在12 h内受到胁迫,但随后下调至低表达水平。HAK20b在12 h内下调,72 h后上调至最高水平。HAK7,HAK10,HAK18和HAK24暴露于低k+压力。其他在野阵营,如HAK12/14/15/25,构成表达。
功能互补验证SSHAK1和SsHAK21酵母突变株R5421
SSHAK1和SsHAK21被选中在酵母中互补验证,因为它们均响应低k诱导+压力。以仅携带空载体pYES2.0的转化酵母菌株作为对照。pYES2.0转化的酵母与pYES2.0-转化的酵母生长无明显差异SSHAK1或pYES2.0 -SsHAK21在SC/−ura含有100mm KCl的培养基中(图。8).但是,当KCl浓度降至10mm时,酵母的生长转化SSHAK1和SsHAK21效果优于空载体转化的酵母。当KCl浓度降低到1 mM时,空载体转化酵母的生长受到显著抑制,而空载体转化酵母的生长受到显著抑制SSHAK1或SsHAK21几乎未受影响(图。8).这些结果表明都有SSHAK1和SsHAK21可以恢复K+在酵母突变株R5421中具有吸收功能,表明它们具有钾转运活性。
讨论
的(黑/ KUP / KT钾转运子家族已被广泛报道与钾有关+植物的跨膜运输。它们还在应对盐和干旱胁迫以及根和茎的形态发生方面发挥着重要作用[7].然而,全基因组分析(黑/ KUP / KT基因家族尚未进行糖由于其复杂的遗传背景。最近发布的美国spontaneum基因组让我们确定了30个h基因美国spontaneum.此外,248年h来自13种其他代表性植物物种和小组的基因用于构建系统发育树并研究进化h基因在糖.此外,基于RNA-seq的表达分析显示,在不同的时空中,基因的表达呈现出不同的功能差异h为未来的功能分析提供了有价值的信息和可靠的候选基因。
进化的h基因家庭糖被子植物和代表
WGD或多倍体化、基因丢失和二倍体化被认为是植物重要的进化力量[32.,33.].被子植物、pancore eudiicot和单子叶植物起源于ε、γ和σ WGD事件,这些事件已被严格的系统基因组学方法揭示[33.].最近的一项研究表明,菠萝比其他禾草植物少一个古老的ρ WGD事件[34.].答:trichopoda是已知最早的从其他被子植物中独立进化而来的被子植物,引起了植物学家的广泛关注。在这项研究中,共有279人在野阵营结合WGD信息,我们可以对15种被子植物中主要WGD事件进行研究h基因进化。在野阵营从不同的植物种类中可以分为4个进化枝:进化枝IV、进化枝I、进化枝III和进化枝II。在此基础上,估计了四支演化支之间的发散时间SsHAK基因家族(134.8 - 233.7 Mya,附加文件5),SsHAK在被子植物的σ WGD事件之前(约130 Mya)和ε WGD事件之后(约220 Mya) [33.].
的数量在野阵营在四个分支中变化很大(从29到98,图。3.),这与之前的一项研究一致在野阵营在Angiosperms中的不同碎片中不均匀地分布[35.].在我的思工中,只有一个h基因成员来自答:comosus和拟南芥,而在禾本科物种,h数字范围为6 ~ 13。这一结果表明,WGD或近期的基因复制在很大程度上促进了基因的扩展在野阵营.SsHAK5a / 5 b,SsHAK16a / 16 b,SsHAK19a / 19 b是串联复制的吗SsHAK20a / 20 b可能已经源自转换重复。lcasSSHAK5和SsHAK18(在分支III中)可能发生在单子叶植物和双子叶植物分裂之前。HAK5的推测在拟南芥以外的其他双子叶植物中缺失,这可能是由于h家庭。HAK18在所有的单子叶和双子叶植物中都保留了h家庭,以及表达剖面分析HAK18也证实了这一点。
在进化枝II和进化枝III中,Sshak2.和Sshak7.在ε WGD事件中被保留下来,而在双子叶植物中,这两个同源基因丢失。Sshak3.和SsHAK13是后答:trichopoda已经与其他高管分开进化。SSHAK8,Sshak9.和SsHAK10假设从ε WGD事件中保留;SsHAK11,SsHAK12,SsHAK15,SsHAK24和SsHAK25在σ WGD事件中被保留下来,因为只有单子叶植物含有这些基因。SsHAK14和SsHAK23被假定从ε WGD事件中保留,但是HAK14可能在双子叶植物中消失了。进化枝IV中含有最少的在野阵营.SSHAK4和SsHAK17起源于单圈子和双旋胞龙和分裂后的分裂前答:trichopoda来自Angiosperms。lca的SsHAK26在分裂后起源稻科植物类和菠萝。
的h植物基因家族具有保守性较差的外显子/内含子结构。外显子的数目糖范围为2至12(图。1额外的文件7的变化范围糖比大米的直径大[17)、玉米(19]和小麦[36.].外显子/内含子获得/丢失、外显子/伪外显子化和插入/缺失三种机制主要导致同源或副同源基因的外显子-内含子结构差异[37.].虽然基因结构Shaks.变化较大,蛋白大小相对保守,提示外显子与内含子结构存在差异Shaks.主要由内含子的增加/丢失引起。进化枝I和进化枝IV属于较老的h家庭糖,所以在野阵营在漫长的进化过程中,根据“内含子早期”理论,推测这两个进化支中有更多的内含子获得/丢失事件[38.,39.].该研究的结果还支持这种观点,因为疏水板I和CLADE IV中的外显子数的变化远大于疏水板II和CLADE III中的变化。
基因表达与功能分化在野阵营在糖
K的转录调节+转运体是植物对低钾反应的一种常见机制+压力(8,表达模式分析可以提供对潜在功能的深入了解h基因家族。在这项研究中,我们发现最多h进化支I和进化支IV的基因在所有检测样本中都表现出低或无法检测的表达水平。大多数h支II和支III的基因在所有被测组织中均有强烈表达。这些结果与之前的研究结果一致h水稻基因[17),拟南芥25.]和小麦[36.].五个奥什坦基因(OsHAK2/10/15/23/25)在三种不同基因型的所有检测组织中均有表达[17].在拟南芥中,13个中有12个(黑/ KUP / KT基因来自支II和支III,其中大部分在根、叶、角果和花中表达[25.].类似的,大多数TaHAKs在所有组织中均有组成性表达[36.].
性能+压力倾向于诱导k的上调表达+转运蛋白基因(40].以往的研究表明Oshak1.在水稻20.],TaHAK1在小麦36.),PBRHAK1在梨[41.通过k诱导+饥饿。在本研究中SSHAK1在低钾条件下迅速增加+这一结果与之前的研究结果一致。值得注意的是,SsHAK21在短时间的K+- 术治疗,然后快速下调(瞬态激活),表明SsHAK21参与了低k+甘蔗的应激反应。米饭中发现了类似的结果,如OsHAK21维持离子稳态和耐盐胁迫的功能[42.].SSHAK1,SsHAK17和SsHAK21表明它们可能在维持正常生长和介导钾离子获取方面发挥重要作用+不足。此外,近一半SsHAK在所有测试组织中,在所有阶段甚至在低钾状态下,基因都没有表达或表达水平非常低+由于甘蔗中的WGD事件导致的基因官能冗余可能引起的应力。
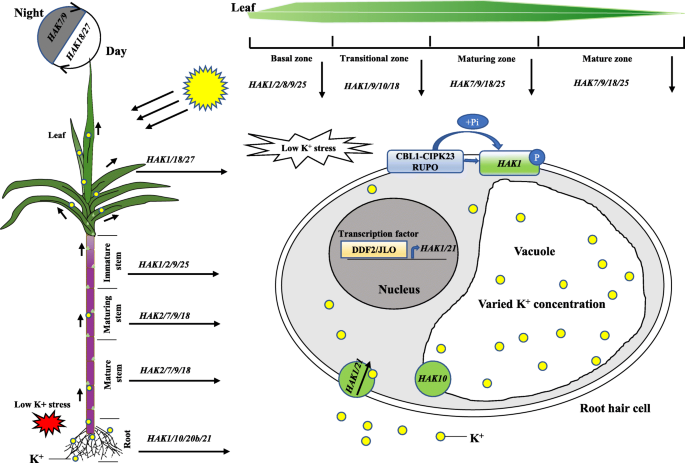
根系获得K+从土壤溶液中,然后k+在细胞内的室间运输,从根到芽。在此基础上,提出了一种基于30的表达谱的原理图模型SsHAK以阐明基因在植物组织和甘蔗根毛细胞中的时空表达(图。9).HAK7/9/18主要表达于成熟和成熟茎叶组织中,表明其在K+在这些组织中运输。HAK7/9/18/25也显示出昼夜节律的表达模式,表明这些基因受阳光的调节。性能+应激诱导的转录表达上调h基因。在拟南芥中,DDF2、JLO、ARF2、RAP2.11、TFII_A、bHLH121等转录因子直接结合拟南芥的启动子AtHAK5诱导其表达并增加对低k的耐受性+盐胁迫[26.].在这项研究中,表达了HAK1和HAK21也可能受到转录因子(TFs)的正调控,如DDF2和JLO,进一步的实验,如酵母单杂交试验,可用于筛选TFs。辣椒和番茄中的AtHAK5及其同源物可被CIPK23 (cbl相互作用蛋白激酶23)/CBL1(钙调磷酸酶b样蛋白)复合物激活[27.].在水稻中,OsHAK1/19/20可以被一种类似受体的蛋白激酶RUPO(破裂花粉管)磷酸化[43.].在本研究中,CBL-CIPK复合物和受体样激酶RUPO也可能通过磷酸化依赖的相互作用,作为高亲和力钾转运体(如HAK1)的调控因子。
的角色的示意图模型在野阵营基于甘蔗的基因表达谱。在叶子和茎的成熟和成熟区域,HAK7/9/18是主要表达基因。此外,这些基因也呈现出日表达模式。HAK25主要表达于叶组织的成熟和成熟区,而HAK2主要在茎中表达。性能+应激诱导表达上调HAK1和HAK21.DDF2、JLO等转录因子可能直接结合于的启动子Hak1 / 21.为了诱导基因表达,随后促进Hak运输术,例如Hak1和Hak 21,以获得K+在根。HAK1可能被CBL1-CIPK23复合物或受体样激酶RUPO(破裂花粉管)磷酸化并激活。K+液泡中的钾浓度变化很大,以维持细胞的钾含量+体内平衡。一些HAK转运体,如HAK10,位于液泡的液泡内,可能在调控K的过程中起作用+浓度在液泡
结论
在这项研究中,30h(高亲和性K+通过对甘蔗的比较基因组学分析,鉴定了转运体(Transporter)基因。进化分析表明,古代的全基因组复制(WGD)和近代的基因复制都促进了基因家族的扩展,纯化选择是进化的主要动力。(黑/ KUP / KT基因在进化过程中伴随着内含子的获得/丢失。低k下RNA-SEQ的表达分析+应激和不同发育阶段表现出时空表达和功能差异(黑/ KUP / KT基因家族。酵母功能互补分析表明SSHAK1和SsHAK21介导的K.+传输性能下+压力。这些结果为甘蔗钾利用效率的遗传改良提供了有价值的信息和可靠的候选基因。
方法
植物材料
两个糖物种,LA-Purple (S. Officinarum., 2n = 8x = 80,原产于美国,传入中国;这些植物是由福建农林大学张教授的实验室提供的)和SES-208 (美国spontaneum,2n = 8x = 64,起源于美国,并被介绍到中国;the plants were provided by Zhang’s laboratory in Fujian Agriculture and Forestry University), were cultivated at Fujian Agricultural and Forestry University (Fuzhou, 119°16′48″E, 26°4′48″N, Fujian, China) and sampled for gene expression pattern analysis.
K+吸收缺陷酵母突变株R5421 (ura3-52 his3Δ200 leu2Δ1 trp1Δ1 ade2 trk1Δ::HIS3 trk2Δ::HIS3)由南京农业大学徐国华教授提供。当外界钾浓度低于10 mM时,R5421无法正常生长。大肠杆菌DH5α感受态细胞和表达载体pYES2.0购自中国大连TaKaRa生物技术有限公司。
分别采集9月龄和12月龄的成熟植株的叶卷、叶片(完全展开的叶片)、顶端未成熟节间、早生节间和成熟节间的组织样本,分析其在不同发育阶段的表达模式。甘蔗节间从上到下编号。如前所述,从35日龄植株中采集幼苗期的叶和茎组织[44.,45.].
对于表达模式的分析,叶梯度,二糖在光照强度为350 μmol/m的温室中培养2/秒,14:10 L/D, 30℃L/22℃D, 60%相对湿度。15日龄LA-Purple和11日龄SES208种植光期3 h后的第2片叶片和样品制备方法见Li等[30.].
以LA-Purple和SES208的成熟植株为研究对象,从上午6点开始,间隔2 h,连续采集叶片12次,分析叶片的日变化规律。于2017年3月2日凌晨6点开始,连续采样7次,间隔4小时。2017年3月3日。2017年3月2日,福州的日出和日落时间是早上6:25。和下午6:05。分别。组织收集按照前面描述的方法进行[34.].
对于低钾胁迫下的表达模式分析,糖杂交品种YT55(由广州甘蔗产业研究所选育,在广东省瓮源县甘蔗育种基地种植)在正常钾水平(3.0 mmol /L)下温室培养20 d,然后转入钾+- 用于饥饿处理的养分溶液(0.1mmol / L)。在饥饿后,在0h,6h,12h,24h,48 h和72h下收集来自6株植物中的6株植物的根的混合样品(总共收集了总共的全部的生物学重复)并储存在液氮中总RNA分离。
同源性搜索分析
根据之前的报道,蛋白质序列为13,27和27(黑/ KUP / KT发现的基因家族拟南芥蒂利亚纳,栽培稻和玉米[17,18,19]是从植物血红素v12.1获得的(https://phytozome.jgi.doe.gov/pz/portal.html).用这些蛋白质序列作为疑问,推定成员(黑/ KUP / KT利用BLASTP程序对14个代表性被子植物基因组、9个单子叶植物(糖混合R570 [29.],蔗糖spontaneum,高粱双色,玉米,Setaria冬青,Setaria Italica.,栽培稻,Brachypodium distachyon和ananas comosus.),4个二榫(拟南芥蒂利亚纳,卡里卡番木瓜,vitis Vinifera,茄属植物lycopersicum),Amborella trichopoda.具有e值<1e的序列−10被选为HAK/KUP/KT候选人。然后,对鉴定的HAK/KUP/KT蛋白进行PFAM (https://pfam.xfam.org)和CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bWRPSB.cgi)数据库。另外,一个h基因Chlamydomonas Reinhardtii.被选为外群体。
序列和系统发育分析
利用ExPASy预测HAK/KUP/KT蛋白的等电点(pI)和相对分子量。https://web.expasy.org/compute_pi/).外显子-内含子结构用TBtools进行了评估[46.].TMHHM服务器v.2.0 (/ TMHMM / http://www.cbs.dtu.dk/的服务)预测HAK/KUP/KT蛋白的跨膜结构域。利用WoLF PSORT预测HAK/KUP/KT蛋白的亚细胞位置https://www.genscript.com/wolf-psort.html).
利用neighbor-jointing (NJ)方法推断了14种代表性被子植物的进化历史[47.].基于蛋白质序列比对,系统发育树(黑/ KUP / KT采用NJ方法构建基因家族。NJ树的构建使用MEGA7 [48.]的“配对删除”和“泊松校正”模型。树内部分支的可靠性通过bootstrap测试(1000次重复)进行评估,百分比显示在分支旁边。
30对的非同义替代比(Ka)、同义替代比(Ks)和Ka/Ks比值(黑/ KUP / KT利用Easy_KaKs计算程序(https://github.com/tangerzhang/FAFU-cgb/tree/master/easy_KaKs).采用小样本Fisher精确检验验证该方法计算的Ka和Ks的有效性[49.].散度时间T计算为T = Ks/ (2 × 6.1 × 10)- 9)×10- 6米娅(50.].
分析表达分析在野阵营在糖基于RNA-SEQ
RNA制备、cDNA文库构建和RNA-seq文库测序如前所述[51.,52.].将原始数据与可用数据进行比对美国spontaneumAP85-441使用Trinity的参考基因模型(https://github.com/trinityrnaseq/trinityrnaseq/wiki).计算每千碱基/百万定位片段(FPKM)值来表示如前所述的基因表达水平[51.,52.].
的验证hRT-qPCR检测基因表达水平
表达水平的三个h基因(HAK1,HAK7和HAK20b)在…的根源糖在6个时间点(0 h、6 h、12 h、24 h、48 h和72 h)下,对杂交品种YT55进行了试验+通过RT-QPCR验证 - 验证了明确条件,以使表达水平标准化,2个组成型表达基因,真核延伸因子1a(eEF-1a),肌动蛋白作为内参基因,每个样品有3个生物学重复和3个技术重复。(附加文件10).反转录、实时PCR反应程序及相对表达量计算,如Wang等所述[52.].
酵母表达载体构建及功能互补实验SSHAK1和SsHAK21
Primer Premier 5用于设计引物(附加文件)11),以低钾胁迫处理12 h后YT55 RNA合成的cDNA为模板进行扩增SSHAK1和SsHAK21.扩增产物从凝胶中回收,用In-Fusion酶(TaKaRa Biotechnology Co., Ltd, Dalian, China)连接到表达载体pYES2.0上。结扎产物转化为大肠杆菌主管DH5α.细胞。筛选阳性单克隆克隆体,测序验证,提取质粒进行酵母转化。用s.c. EasyComp™转化试剂盒(Invitrogen公司,Carlsbad, CA, USA)制备酵母突变株R5421的感受态细胞并进行转化。分离带有空载体和目的基因的酵母菌株,梯度稀释后接种于含100 mM、5 mM和0 mM KCl的SC/−ura培养基中。30℃培养3-5天后观察结果。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。
缩写
- Bhlh121:
-
基本Helix-Loop-Helix 121
- CBL:
-
钙调磷酸酶b蛋白
- CIPK:
-
CBL-interacting蛋白激酶
- DDF2:
-
矮人和延迟开花2
- FPKM:
-
每千比赛的碎片每百万映射碎片
- (黑/ KUP / KT:
-
高亲和性K+Transporter / K.+透性酶/ K吸收+转运体
- 詹妮弗·洛佩兹:
-
锯齿状横向器官
- K a:
-
非纯粹的替代比例
- Ks:
-
同义替代率
- LCA:
-
最后一个共同的祖先
- RT-qPCR:
-
反向transcription-quantitative PCR
- TF:
-
转录因子
- TFII_A:
-
转录起始因子II_A γ链
- WGD:
-
全基因组重复
参考文献
- 1.
Leigh RA, Wyn Jones RG。一种关于生长所需钾离子的临界浓度与该离子在植物细胞中的分布和功能有关的假说。新植醇。1984;97:1-13。
- 2.
植物对钾缺乏的反应:钾转运蛋白的作用。中国农业科学。2006;57(2):425-36。
- 3.
《Everglades Histosols甘蔗养分积累与去除研究》。阿格龙j . 1993; 85:310-5。
- 4.
木ra。氮,磷和钾在南非甘蔗生产中的作用。肥料RES。1990年; 26:89-98。
- 5。
白色PJ。提高作物对钾的吸收和利用。植物营养与土壤学报,2013;176(3):305-16。
- 6。
Epstein E,Rains DW,Elzam Oe。大麦根钾吸收双重机制的解决。Proc Natl Acad Sci U S A. 1963; 49(5):684-92。
- 7。
李W,徐G,Alli A,Yu L.植物Hak / Kup / Kt K(+)运输商:功能和规定。Semin Cell Dev Biol。2018; 74:133-41。
- 8。
王勇,吴文辉。高等植物钾离子的转运与信号转导。植物生物学杂志。2013;64:451-76。
- 9.
Corratge-Faillie C,Jabnoune M,Zimmermann S,非常AA,Fizames C,Novemal Cells中的钾和钠运输:TRK / KTR / HKT运输家族。细胞mol寿命。2010; 67(15):2511-32。
- 10.
舍利梅M,Bakker EP。核苷酸序列和3'-末端缺失研究表明K(+从大肠杆菌中摄取的蛋白质由一个疏水核心与一个大且部分必需的亲水C端相连。J Bacteriol。1993;175(21):6925 - 31所示。
- 11.
关键词:AtKuP1, K+转运蛋白,拟南芥植物细胞,1998;10(1):63 - 73。
- 12.
圣玛丽亚GE,卢比奥F,杜布科夫斯基J,罗德里格斯-纳瓦罗aHAK1大麦基因是一个大基因家族的成员,编码高亲和力钾转运体。植物细胞。1997;9(12):2281 - 9。
- 13。
水稻钾转运体HAK基因的克隆及功能分析。植物杂志。2002;130(2):784 - 95。
- 14。
Gierth M, Maser P, Schroeder JI。钾转运体AtHAK5在K(+)剥夺诱导的高亲和力K(+)摄取和AKT1 K(+)对K的渠道贡献(+)的吸收动力学。植物杂志。2005;137(3):1105 - 14所示。
- 15.
Kim EJ, Kwak JM, Uozumi N, Schroeder JI。AtKUP1:编码高亲和力钾运输活性的拟南芥基因。植物细胞。1998; 10(1):51-62。
- 16。
高亲和度K的克隆与功能表征+辣椒转运体HAK1。植物学报。2004;56(3):413-21。
- 17。
Gupta M,邱X,王L,谢W,张C,熊L,连X,张Q.KT / Hak / Kup钾转运蛋白家族及其全生命周期表达谱系在水稻中(栽培稻).中国生物医学工程学报。2008;28(5):437-52。
- 18。
MäserP,山茱萸S,Schroeder Ji,Ward JM,Hirschi K,Sze H等。拟南芥阳离子转运蛋白家族中的系统发育关系。植物理性。2001; 126:1646-67。
- 19.
张震,张军,陈勇,李锐,王辉,魏军h玉米钾转运蛋白基因家族(玉米l .)。acta photonica sinica; 2012;39(8): 8465-73。
- 20。
陈国光,胡强,罗林,杨涛,张树华,胡玉玲,徐国光。水稻钾转运体OsHAK1在低钾和高钾胁迫下的耐盐性。植物学报。2015;38(12):2747-65。
- 21。
杨涛,张胜,胡勇,吴芳,胡强,陈刚,蔡俊,吴涛,莫然宁,于林,等。钾转运体OsHAK5在低钾供应水平下水稻根向地上部吸收和转运钾的作用植物杂志。2014;166(2):945 - 59。
- 22。
Nieves-Cordones M,Miller AJ,Aleman F,Martinez V,Rubio F.对血浆膜电位控制在编码番茄高亲和力钾转运蛋白Hak5的基因表达中的调整作用。植物mol biol。2008; 68(6):521-32。
- 23.
阿塔克5和阿塔克t1对K的相对贡献+在高亲和力浓度范围内的吸收。杂志。2008;(4)134:598 - 608。
- 24.
苏海峰,赵超,张海峰。hak型K(+)转运蛋白是响应普通冰厂中的盐度胁迫而调节。植物理性。2002; 129(4):1482-93。
- 25.
Ahn SJ, Shin R, Schachtman DP。的表达KT / KUP研究了拟南芥根毛在拟南芥基因表达中的作用+吸收。植物杂志。2004;134(3):1135 - 45。
- 26.
Hong JP,Takeshi Y,Kondou Y,Schachtman DP,Matsui M,Shin R.调节拟南芥的转录因子识别与表征HAK5的.植物细胞生理。2013; 54(9):1478-90。
- 27.
Ragel P, Rodenas R, Garcia-Martin E, Andres Z, Villalta I, Nieves-Cordones M, Rivero RM, Martinez V, Pardo JM, Quintero FJ,等。cbl相互作用蛋白激酶CIPK23调控hak5介导的高亲和力K+拟南芥根的摄取。植物理性。2015; 169(4):2863-73。
- 28.
张建军,张旭,唐华,张强,华欣,马旭,朱凤峰,朱旭。同源多倍体甘蔗的等位基因定义基因组蔗糖spontaneum关键词:人工智能,人工神经网络,人工神经网络
- 29.
Garsmeur O, Droc G, Antonise R, Grimwood J, Potier B, Aitken K, Jenkins J, Martin G, Charron C, Hervouet C,等。高度复杂的甘蔗基因组的花叶单倍体参考序列。Nat Commun。2018;9(1):2638。
- 30。
李P,Ponnala L,Gandotra N,Wang L,Si Y,Tausta Sl,Kebrom Th,Prinout n,Patel R,Myers Cr等。玉米叶片转录组的发育动态。NAT Genet。2010; 42(12):1060-7。
- 31。
陆志强,谢科,潘永强,任涛,陆军,王敏,沈强,郭树清。钾对植物叶片光合作用和水分导度的调控作用。植物细胞环境。2019。https://doi.org/10.1111/pce.13553.
- 32.
Edger PP, Pires JC。基因和基因组复制:剂量敏感性对核基因命运的影响。Chromosom杂志2009;17(5):699 - 717。
- 33.
焦友,Wickett NJ,Ayyampalayam S,Chanderbali As,Landerr L,Ralph Pe,Tomsho LP,Hu Y,Liang H,Soltis PS等。种子植物和贪眼的祖先多倍体。自然。2011; 473(7345):97-100。
- 34.
Ming R,Vanuren R,Wai Cm,Tang H,Schatz MC,Bowers Je,Lyons E,Wang Ml,Chen J,Biggers E等。菠萝基因组和凸轮光合作用的演变。NAT Genet。2015; 47(12):1435-42。
- 35.
关键词:被子植物,HAK/KUP/KT蛋白,多样性,物种多样性植物科学学报2016;7:127。
- 36.
程X,刘X,毛,张X,陈S,Zhan K,Bi H,徐H.基因组 - 范围鉴定与分析Hak / Kup / Kt Potasium转运蛋白小麦的基因家族(Triticum aestivum.l .)。中华医学杂志。2018;19(12):3969。
- 37。
徐光国,郭超,单洪,孔洪波。基因外显子-内含子结构的差异分析。中国科学院院刊2012;109(4):1187-92。
- 38。
内含子获得和损失的生物学。趋势麝猫。2006;22(1):16 - 22。
- 39。
Rogozin IB, Sverdlov AV, Babenko VN, Koonin EV。真核生物基因外显子-内含子结构的进化分析。短暂的Bioinform。2005;6(2):118 - 34。
- 40.
王勇,吴文辉。植物钾离子转运和信号转导的调控。植物学报。2017;39:123-8。
- 41.
王颖,陆军,陈东,张军,齐科,程瑞,张浩,张胜KT / (/ KUP家庭在梨。基因组。2018;61(10):755 - 65。
- 42。
关键词:水稻,钾离子转运体OsHAK21,盐胁迫,盐胁迫植物学报。2015;38(12):2766-79。
- 43。
刘丽,郑超,邝波,魏林,严玲,王涛。受体样激酶RUPO与钾转运体相互作用对水稻花粉管生长和完整性的调控。公共科学图书馆麝猫。2016;12 (7):e1006085。
- 44。
陈勇,张强,胡伟,张旭,王磊,华鑫,于青,明锐,张杰。果糖激酶基因家族的进化与表达糖.BMC基因组学。2017;18(1):197。
- 45。
张强,胡伟,朱飞,王磊,于青,明锐,张军。水稻蔗糖转运蛋白家族的结构、系统发育、等位基因单倍型及表达糖.BMC基因组学。2016; 17:88。
- 46。
陈昌杰,夏锐,陈辉,何玉华。TBtools,一个为生物学家提供的工具箱,集成了各种hts数据处理工具和用户友好的界面。BioRxiv预印本,2018年。
- 47.
王志强,王志强。基于遗传算法的系统发育树重建方法。acta physica sinica, 2017, 36(4): 497 - 503。
- 48.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 49.
格雷厄姆jgu。费舍尔的确切考验。j r stat soc ser a(stat soc)。1992年; 155(3):395-402。
- 50。
林奇M,Conery JS。作用的进化命运和二份基因的后果。科学。2000; 290(5494):1151-5。
- 51。
胡w,hua x,张q,王家,沉q,张x,王k,yu q,林yr,ming r等人。甜蜜家庭进化和功能分歧的新见解糖基于比较基因组学。植物学报。2018;18(1):270。
- 52。
王勇,华旭,徐军,陈铮,范涛,曾智,王华,Hour AL .,余强,明锐,等。比较基因组学揭示了镁转运子家族的基因进化和功能差异糖.BMC基因组学。2019;20(1):83。
致谢
感谢福建农林大学海霞科学技术研究所基因组学与生物技术中心为我们提供了访问的机会糖数据。作者感谢南京农业大学徐国华教授提供的酵母突变株。
资金
本研究得到了GDAS科技开发项目(2019GDASYL-0103028)的资助,用于采购用于RT-qPCR的试剂和耗材HAK1,HAK7和HAK20b);广东科学院专项资金(2019GDasyl-0104013和2017GDASCX-0105,用于在低钾应力下支付YT55的RNA-SEQ);广东省甘蔗剑麻大麻产业技术体系创新队(2019KJ104-04,用于支付技术人员植物甘蔗YT55);中国广东省科技种植工程(2014b070705002,用于福州和广州旅行费用进行酵母互补实验);和中国农业研究系统(CARS201707,用于此手稿的文章处理费用)。
作者信息
隶属关系
贡献
XF、JZ、YQ对实验进行了构思和设计。XF、YW、NZ、ZW、QZ、JW、XW、LW、JZ进行了实验,并对数据进行了分析。XF写了手稿。所有作者阅读并批准了最终论文。
相应的作者
伦理宣言
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
的h基因的等位基因蔗糖spontaneum.
附加文件2。
利用NCBI BLASTP计算甘蔗HAK蛋白的相似性。
附加文件3。
系统发育关系KT / (/ KUP15种代表性植物的基因家族。
附加文件4。
15种代表性植物279个HAK/KUP/KT转运体的氨基酸序列分析
附加文件5。
四支之间的分流时间h家庭高粱双色和蔗糖spontaneum.
额外的文件6。
之间的分歧paralogousSsHAK基因对蔗糖spontaneum.
额外的文件7。
统计每个外显子的数目h.
额外的文件8。
不同数量的外显子比例在野阵营来自15种植物。
额外的文件9。
RNA-seq数据与RT-qPCR的相关系数HAK1,HAK7和HAK20b.
额外的文件10。
用于RT-QPCR验证的引物h基因在糖混合YT55。
额外的文件11。
用于克隆的引物SSHAK1和SsHAK21并构建酵母表达载体。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
冯雪梅,王玉梅,张宁。et al。全基因组系统特性(黑/ KUP / KT基因家族及其在植物生长期间的表达谱系,并响应低k+压力糖.BMC植物BIOL.20,20(2020)。https://doi.org/10.1186/s12870-019-2227-7
收到了:
接受:
发表:
关键字
- 糖
- (黑/ KUP / KT
- 进化
- 基因表达
- 性能+压力