摘要
背景
许多革兰氏阴性菌使用N-酰基高丝氨酸内酯(AHLs)相互交流并协调他们的集体行为。最近,越来越多的证据表明,寄主植物能够感知并响应细菌AHL。一旦启动,植物处于一种改变的状态,使植物细胞能够更快和/或更强烈地响应随后的病原体感染或非生物胁迫。
结果
在本研究中,我们报道了用N-3-氧-辛酰-高丝氨酸内酯(3OC8-HSL)对病原菌具有抗性两pv。番茄DC3000 (太平洋标准时间在拟南芥DC3000)。3OC8-HSL预处理及随后的病原菌入侵导致过氧化氢爆发性增加,水杨酸积累,致病相关基因表达强化PR1和PR5.在太平洋标准时间DC3000胁迫下,3OC8-HSL处理植株的过氧化物酶、过氧化氢酶、苯丙氨酸解氨酶、超氧化物歧化酶等防御相关酶活性升高。此外,3oc8 - hsl引物抗太平洋标准时间DC3000在表达细菌的植物中受损NahG基因和npr1突变体。此外,异染色质合酶(ICS1),一种关键的水杨酸生物合成酶,以及其表达的两个调节因子,SARD1和CBP60g,经3OC8-HSL预处理增强,然后接种病原菌。
结论
我们的数据表明,3OC8-HSL介导了拟南芥对半生物营养细菌感染的防御反应,并且3OC8-HSL介导的抗性依赖于SA信号通路。这些发现可能有助于建立一种新的植物病害控制策略。
背景
植物和微生物的共同进化使植物发展出复杂的病原体防御机制。植物中的病原检测包括对病原或微生物相关分子模式(PAMPs或MAMPs)的识别[1,2通过模式识别受体(PRRs)和模式触发免疫(PTI)的激活。虽然病原体可能通过III型分泌系统(TTSS)分泌pti抑制效应物进入植物细胞,但反过来,植物激活第二层防御,称为效应触发免疫(ETI),这是在宿主细胞质或质外体中识别病原体效应蛋白后激活的[3.,4].除了PTI和ETI的局部防御机制外,感染部位远端的植物组织也可以诱导系统性抗性。系统抗性有诱导系统抗性(ISR)和系统获得性系统抗性(SAR)两种机制;前者对有益的土壤微生物有反应,而后者则与病原体的攻击有关[5,6,7,8].化学处理也可刺激抗性机制,包括2.6-二氯异烟酸(INA)、苯并-(1,2,3)-噻二唑-7-羧酸s -甲酯(BTH)和ß-氨基丁酸(BABA) [9,10].INA和BTH是植物激素SA的类似物。若干诱导抗性过程与启动现象有关,启动是在病原体攻击时表达特定防御反应的增强能力[9].与未启动的细胞相比,启动使细胞能够以更快、更强的方式对更低水平的刺激做出反应[9,11].因此,准备就绪的植物处于一种生理状态,在最初的刺激后迅速和强烈地抵御病原体的挑战;只要启动机制本身的代谢需求相对较低,这种状态就可能将相关的代谢成本降至最低[11,12,13,14].这个启动现象是由Kauss和他的同事们首先报道的[15],从那时起,就有一些引信被记录下来。baba通过水杨酸(SA)和脱落酸(ABA)依赖途径诱导启动功能,诱导胼胝质沉积增强和盐胁迫耐受性[16]BABA诱导的耐药性也会干扰病原体产生的细菌毒素冠状腺素的作用两[17].杜鹃花酸是一种可移动的代谢物,它可以在局部和系统组织中积累,通过合成活性氧(SAR)到原生植物中,增加SA的产生,并提供抗性p .两[18].除了病原体衍生的激发子外,一些低分子量的代谢物,包括水杨酸甲酯(MeSA)、脱氢松香酸、壬二酸、哌果酸和β-氨基丁酸可能参与了植物系统抗性的诱导[18,19,20.].此外,研究表明,低浓度SA或其商业衍生物BTH处理可调节防御反应,导致植物对病原体攻击的反应更快[21].这些数据表明,启动诱导剂引发的抗病性可以作为新的疾病控制策略的基础,并有助于可持续农业的发展。
N-酰基-高丝氨酸内酯(AHLs)是细菌群体感应(QS)信号的一种,用于细菌细胞间的通讯。许多有益和致病的革兰氏阴性细菌产生AHLs,并利用它们来协调种群中单个细胞的行为。一些报告表明,AHLs可以在广泛的哺乳动物细胞系中引发免疫调节反应;根据AHL浓度和细胞类型,可以观察到刺激和抑制免疫效应[22,23,24,25].Jahoor等(2008)证实核激素受体(NHR)家族的过氧化物酶体增殖物激活受体ppar和PPARβ可能是动物AHL的候选受体。已知,ahl可被植物细胞感知,而植物细胞又会对这些细菌信号做出特定的反应[25].蛋白质组学和转录组分析表明,植物根对AHLs的表达水平有显著变化[26,27,28,29].其他研究表明AHLs可以以一种结构和剂量依赖的方式调节植物的根结构[27,30.]G蛋白和钙信号也与植物对细菌AHL的反应有关[31,32,33].之前,我们报道了AtMYB44正调控拟南芥初生根伸长的诱导N-3-氧-己基-高丝氨酸内酯(3OC6-HSL) [34].在番茄中,根表面的定殖具有沙雷氏菌属liquefaciensMG1,生产N-丁基高丝氨酸内酯(C4-HSL)和N-己酰高丝氨酸内酯(C6-HSL)诱导对叶病原真菌的系统抗性主产,而ahl阴性美国liquefaciens突变体MG44未能诱导这种抗性[29].同样,接种与沙雷氏菌属plymuthicaHRO-48产生C4−/C6-HSL,N3-hydroxy-butyl-homoserine内酯,N-3-羟基己醇基高丝氨酸内酯对黄瓜有一定的保护作用瓜果腐霉西红柿和豆子来自葡萄孢菌感染;相比之下,一个美国plymuthicaAHL产生缺陷的突变体不能保护这些病原体[35].Zarkani et al.(2013)研究表明,抗两引起的Ensifer meliloti(Sinorhizobium meliloti)在拟南芥植株中的积累N-3-氧-十四烷酰-高丝氨酸内酯(3OC14-HSL),而ahl阴性接种草木犀或产生3oc8 - hsl的菌株根瘤菌etli菌株对抗性无影响p .两[36].另一篇报道描述了诱导抗性的作用草木犀大麦、小麦和番茄等农作物[37].纯AHLs的应用也影响植物的防御反应。在拟南芥中,3OC14-HSL和N-3-氧-十二烷基-高丝氨酸内酯(3OC12-HSL)处理增强了对生物营养和半生物营养病原体的抗性,这些效果依赖于MPK6的强烈和长期激活[38].作者进一步证明,3OC14-HSL处理后,病原菌的攻击增加了植物细胞壁中酚类化合物的积累、木质素和胼胝质的沉积。此外,oxylipin在远端组织中积累,促进气孔关闭,增强植物抗性[28,39].Schenk等人[39发现侧链长度较短和中等的AHLs影响根构型发育,而侧链长度较长的AHLs诱导拟南芥的系统抗性。与这一假设一致的是,C4-HSL和C6-HSL处理拟南芥根时没有诱导系统抗性反应;相反,植物激素调控基因的表达和生长素/细胞分裂素的含量发生了改变[27].而在番茄中,C6-HSL和C4-HSL在较小程度上提高了SA-和乙烯依赖防御基因的表达量和SA水平[29].这些相互矛盾的发现反映了AHLs介导的植物和细菌之间相互作用的复杂性。然而,这些结果表明,细菌AHLs可以诱导植物的启动状态。在此背景下,植物对不同AHLs的反应以及不同AHLs在启动诱导中的作用值得进一步研究。
本研究旨在探讨3OC8-HSL是否诱导植物的防御反应启动。用3OC8-HSL预处理的拟南芥植株接种病原菌,细菌滴度H2O2随后分析防御相关基因的表达。并对3oc8 - hsl介导的引物的分子机制进行了评价。结果表明,3OC8-HSL通过启动拟南芥的防御反应来保护拟南芥免受半生物营养病原体的侵袭,并且3OC8-HSL介导的启动需要SA信号通路。
结果
3OC8-HSL保护拟南芥免受两pv。番茄感染
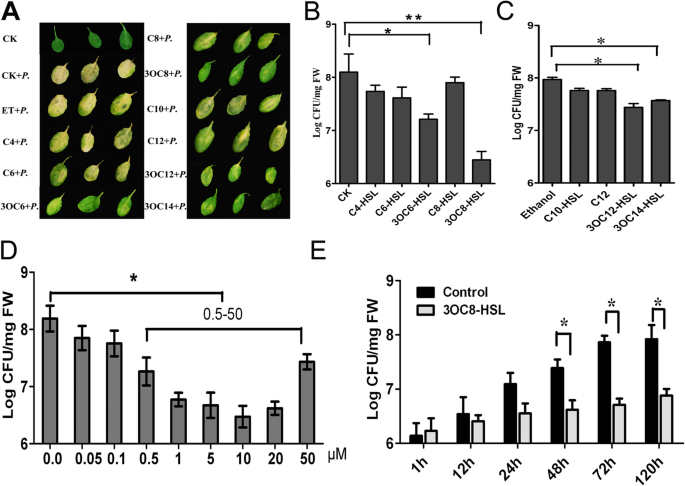
3OC14-HSL和3OC12-HSL以前被发现在拟南芥和大麦中启动病原体特异性防御反应[38]相反,短链AHL C6-HSL处理后,在拟南芥中未观察到抗性诱导[27].因此,用中间ahl进行电阻感应试验,如N-辛酰高丝氨酸内酯(C8-HSL)和N-癸酰-高丝氨酸内酯(C10-HSL)及其衍生物可以帮助阐明该反应是否与长链ahl特异性相关,以及C3原子上的氧基取代是否为该活性所必需。用不同的AHL化合物(10 μM)对离体拟南芥叶片进行预处理2 d,然后喷施太平洋标准时间DC3000 (OD600= 0.1)。接种后3 d记录发病症状。3OC8-HSL、3OC6-HSL、3OC12-HSL和3OC14-HSL预处理后叶片无明显变化太平洋标准时间DC3000症状,而经其他AHLs预处理的叶片变黄或出现水浸病变(图。1a).我们还在10 μM 3OC8-HSL和其他8个ahl(在C3位置有不同的酰基链长度和修饰)的不育水培系统中对拟南芥根进行了2天的预处理。这种植物的叶子被接种了太平洋标准时间DC3000用细菌悬浮液喷洒。在接种后72 h,对叶片组织中的菌落形成单位(cfu)进行计数。在乙醇中制备了尾部10个碳以上的AHLs原液,以乙醇预处理作为长链AHLs的对照。本研究中其他AHLs测试采用水处理对照。我们发现AHL对植物防御反应的启动效应取决于AHL的结构。3OC8-HSL预处理对病原菌增殖抑制作用最强,3OC6-HSL、3OC12-HSL和3OC14-HSL对细菌生长抑制作用中等在足底.与对照相比,C4-HSL、C6-HSL、C8-HSL、C10-HSL和C12-HSL预处理植株的病原菌繁殖无显著差异(图2)。1b、c).前2天施用不同浓度的3OC8-HSL太平洋标准时间DC3000叶面接种评价剂量依赖性诱导效果。在浓度小于0.5 μM时,3OC8-HSL没有降低病原菌滴度,但降低了细菌的生长在足底当浓度大于0.5 μM时,显著降低(图4)。1d).为了监测3oc8 - hsl预处理植株叶片上的病害进展情况,我们在病原菌侵染后对cfu进行了120 h的监测。而未经过3OC8-HSL预处理的拟南芥叶片中细菌滴度逐渐升高,病原菌在3OC8-HSL预处理的拟南芥叶片中增殖受到显著抑制(图2)。1e)。
3oc8 - hsl处理的拟南芥抗性增强两pv。番茄3000.一个的症状,太平洋标准时间DC3000对野生型拟南芥的侵染效果不同N-酰基高丝氨酸内酯(AHL)化合物。将5周龄土生拟南芥离体叶片喷施10 μM不同浓度的AHL化合物,处理2 d后喷施太平洋标准时间DC3000 (OD600= 0.1)。接种后3 d记录发病症状。缩写:CK, MgCl接种的野生型拟南芥Col-02;P,野生型拟南芥Col-0接种太平洋标准时间DC3000。其余缩略语表示以下预处理:ET、乙醇;C4, C4-HSL;C6, C6-HSL;3 oc6 3 oc6-hsl;3 oc8 3 oc8-hsl;C8, C8-HSL;C10, C10-HSL;3 oc12 3 oc12-hsl;3 oc14 3 oc14-hsl; C12, C12-HSL.b,扩散太平洋标准时间DC3000在水培拟南芥植株根部喷施不同10 μM AHL (C4-C8)化合物48 h,然后再喷施太平洋标准时间DC3000 (OD600= 0.1)。接种后72 h计数菌落形成单位(cfu)。c,扩散太平洋标准时间DC3000在水培拟南芥植株根部喷施不同10 μM AHL (C10-C1)化合物48 h后,再喷施太平洋标准时间DC3000 (OD600= 0.1)。d、3OC8-HSL浓度对诱导抗性的影响太平洋标准时间在拟南芥DC3000。将水培植株根部用不同浓度的3OC8-HSL处理48 h后接种叶面太平洋标准时间DC3000 (OD600= 0.1)。以72 hpi计数cfu。e, 3OC8-HSL抑制作用太平洋标准时间DC3000在拟南芥中的生长。用水培法培养的植物的叶子接种太平洋标准时间DC3000 (OD600= 0.1),经10 μM 3OC8-HSL预处理48 h后。在指示的hpi处计数cfu。数据为三个独立生物重复的平均值±标准差(SD)。*显示有统计上显著差异(P< 0.05,学生t检验)。**表示差异有统计学意义(P< 0.01,学生t检验)
3OC8-HSL对褐飞虱生长和毒力的影响太平洋标准时间DC3000也在体外进行了评估。在添加3oc8 - hsl的培养基中培养至10 μM时,病原菌无抑制作用太平洋标准时间DC3000增长或影响其毒性(附加文件3.:图S2A和S2B)。发现3OC8-HSL不直接影响半生物营养病原体的适应度和毒力太平洋标准时间尽管DC3000增强了疾病扰动在足底表明3OC8-HSL具有植物防御激活剂的功能。
3OC8-HSL预处理增强H2O2病原体感染积累
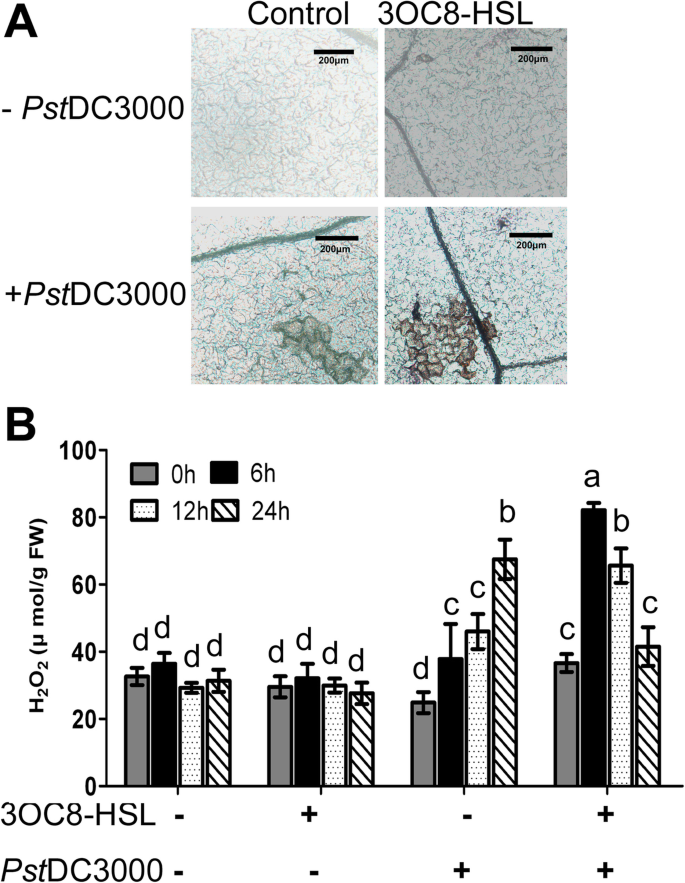
当植物遭遇生物或非生物胁迫时,会触发活性氧的爆发,进而激活防御反应[40].3OC8-HSL对H2O2用二氨基联苯胺(DAB)染色法分析了叶片的产量。在水培培养基中加入10 μM 3OC8-HSL处理后,采集拟南芥Col-0植株离体叶片,供根系吸收太平洋标准时间DC3000接种。未处理对照的染色结果显示含有H2O2在显微镜下观察,未处理的叶片中只有几个细胞呈深棕色。2a).相反,H2O2后被观察到太平洋标准时间DC3000接种3oc8 - hsl预处理叶片(图。2a).然而,单独使用3OC8-HSL对H无影响2O2生产(图。2a).我们也测量了H2O210 μM 3OC8-HSL处理后离体叶片中含量的变化太平洋标准时间DC3000感染(无花果。2b H)。2O2经3oc8 - hsl预处理的叶片在不接病原菌的情况下,未检测到形成太平洋标准时间DC3000喷接种不经3OC8-HSL预处理的对照叶片产生显著的H2O224 hpi时的产量(图。2b) 。一种非常迅速和强烈的H积累2O2在经3oc8 - hsl预处理的叶片中检测到病原菌(图。2b).在这些预先处理过的植物的接种叶中,H2O2累积量在6 hpi时达到峰值,并持续升高至12 hpi,提示3OC8-HSL预处理联合太平洋标准时间DC3000挑战诱导增强H2O2积累。
3OC8-HSL引物和病原菌攻击对H2O2积累。一个H2O2积累。水培拟南芥植株在含10 μM 3OC8-HSL或不含3OC8-HSL的Hoagland培养基(对照)中预处理2 d后喷施太平洋标准时间DC3000 (OD600= 0.1)溶液,在0、6、12和24 hpi处收集。叶片在DAB染色液中孵育24 h。去除染色后,在显微镜下按规定的时间(bar = 200 μm)拍照。每个处理6个叶片进行试验,在3个独立试验中获得了相似的结果。bH2O2用3OC8-HSL预处理和病原体挑战拟南芥的定量分析。按照上述方法采集样品,H2O2含量检测采用Velikova et al.(1971)所描述的方法。数值为三个独立实验的平均值±标准差。不同字母表示差异有统计学意义(P < 0.05,邓肯检验)
拟南芥中3OC8-HSL引物增强PR基因表达和防御相关酶活性
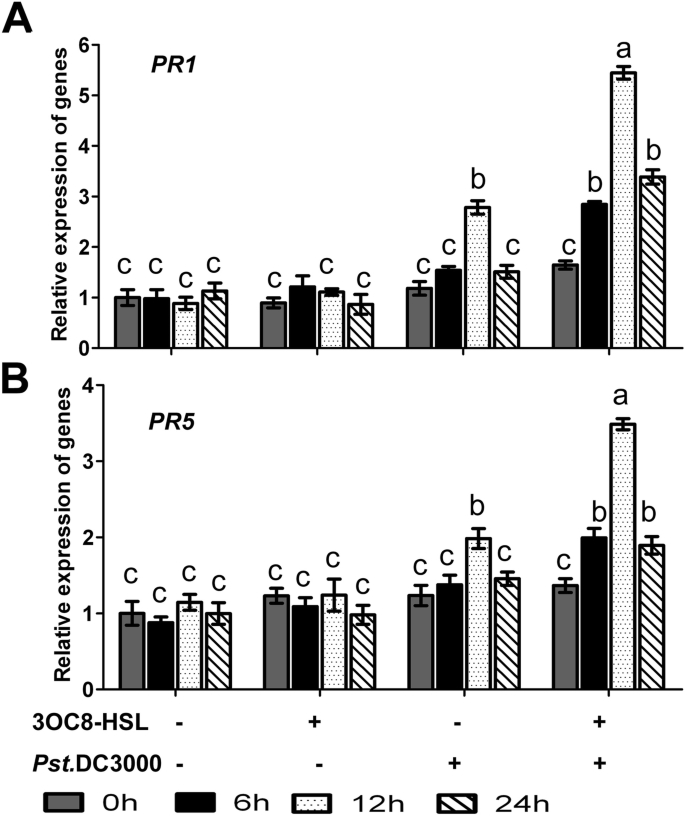
致病相关基因,包括PR1和PR5(thaumatin-like protein),常被用作防御疾病的分子指标太平洋标准时间DC3000。为了研究3OC8-HSL的作用动力学,PR1和PR5监测表达水平。在未接种病原菌的3oc8 - hsl预处理叶片中,PR1和PR5转录产物没有积累,而两个基因的转录在12小时后被观察到太平洋标准时间DC3000在未经过3OC8-HSL预处理的拟南芥植株上接种(图。3.).在3oc8 - hsl预处理的植物太平洋标准时间接种DC3000后,在6 hpi时已经检测到两个基因的显著转录积累,在12 hpi时,这两个基因的水平比没有3OC8-HSL预处理的植株要高得多(图3)。3.).
过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)等防御相关酶是植物诱导防御反应的关键组分。为了研究3OC8-HSL对植物防御反应的影响是否由防御相关酶介导,分别对3OC8-HSL处理和未处理的植物进行了研究太平洋标准时间DC3000处理后,测定POD、CAT、PAL和SOD活性(图2)。4).在不感染的情况下,3OC8-HSL处理的根与未处理的植物相比,没有诱导植物叶片中四种酶中的任何一种的活性(图2)。4).另一方面,未经处理的植物太平洋标准时间与对照相比,DC3000侵染株的四种酶水平均略有升高。在经过3oc8 - hsl预处理的植物叶片中,随后接种病原菌后,这四种酶的活性水平都明显升高。4).综上所述,这些结果表明,3OC8-HSL预处理启动增强公共关系病原菌感染后防御相关酶的基因表达及活性。
3OC8-HSL预处理增强病原体感染时SA的积累
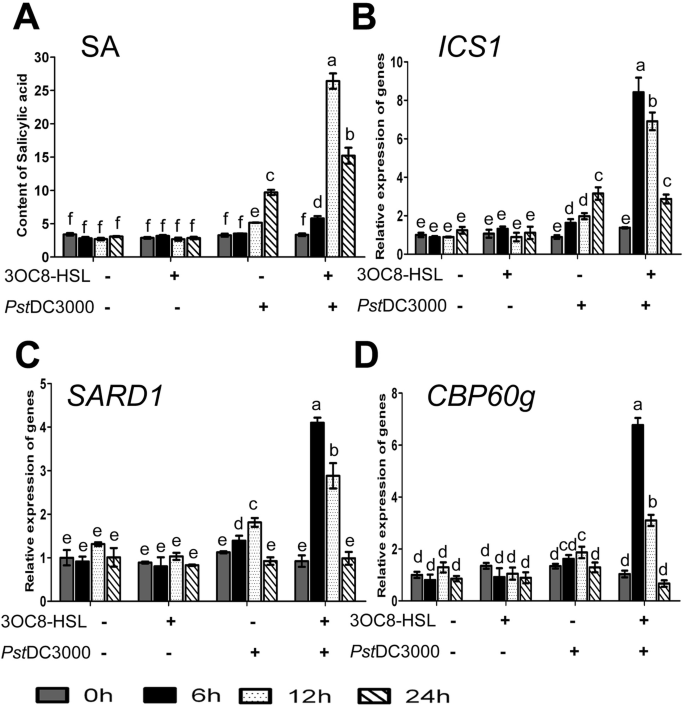
研究了3OC8-HSL对大鼠肝细胞凋亡的影响公共关系这些基因通常受SA调控,表明SA信号可能参与了3oc8 - hsl诱导的拟南芥启动。然而,3OC8-HSL预处理是否影响病原菌接种后SA的合成和积累尚不清楚。为了解决这个问题,我们用3OC8-HSL预处理根2天,测定了植物叶片中SA的水平和SA生物合成基因的表达太平洋标准时间DC3000接种。在3OC8 HSL未经处理的植物中太平洋标准时间DC3000感染后,12hpi ~ 24hpi处游离SA含量增加;在感染前处理的植株中,游离SA的积累更多,且在12 hpi时积累更多(图2)。5a).在这两种情况下,游离SA的浓度都保持在24 hpi的高水平。5a).这些结果表明,3OC8-HSL诱导植物增强SA在系统组织中的积累,以应对病原菌的攻击。
异chorismate (IC)途径是植物中SA生物合成的主要途径,IC合成酶(ICS)由该基因编码ICS1是这一途径中的一种关键酶。此外,CBP60g及其同源基因SARD1(两种钙调素(CaM)结合转录因子)可作为对照ICS1转录(41,42,43为了进一步研究3OC8-HSL对SA生物合成调控的影响,我们采用qRT-PCR进行定量ICS1,CBP60g,SARD13OC8-HSL预处理2天的野生型拟南芥叶片转录水平太平洋标准时间DC3000叶片接种。3 oc8-hsl-pretreated植物,ICS1和SARD1转录水平在6 hpi和12 hpi时升高,而CBP60g转录本在6 hpi时被强烈诱导(图。5b).在水处理控制装置中,太平洋标准时间DC3000接种后,这三个基因的转录水平在12 hpi水平上适度增加。这些数据表明,3OC8-HSL增强了SA生物合成基因在病原菌攻击时的表达。
3oc8 - hsl诱导的启动依赖于SA信号通路
结果表明,感染半生物营养性病原体后,3OC8-HSL启动了SA反应基因的表达太平洋标准时间DC3000(无花果。3.).为了进一步研究3OC8-HSL增强的抗性对SA信号的依赖,我们将3OC8-HSL应用于以下不育系统水培系统的植物的底层培养基上太平洋标准时间DC3000侵染:野生型拟南芥Col-0NPR1有缺陷的突变体npr1-1,NahG转基因植物(NahG).所有植物均生长了2年 水培培养周,然后在根部用3OC8-HSL预处理2周 前几天太平洋标准时间DC3000叶片接种。在野生型植株接种3天后,3OC8-HSL预处理显著降低了细菌滴度在足底与水处理对照组相比(图。6).相反,3OC8 HSL增强了对太平洋标准时间DC3000在npr1-1和NahG植物(图。6),提示拟南芥中3OC8-HSL诱导抗性反应需要sa依赖途径。
讨论
在这项关于3OC8-HSL对植物免疫系统影响的研究中,我们证明了3OC8-HSL可以促进主根伸长[32,44也能启动植物对半生物营养细菌的防御反应。3OC8-HSL预处理增强H2O2植物防御相关基因的表达和防御相关酶的活性增强。此外,我们的数据表明,由3oc8 - hsl介导的耐药需要sa相关信号通路。
AHLs在酰基链长度(4到18个碳)和脂肪酸链γ位羟基(OH)或羰基(O)取代上有所不同,在70多种革兰氏阴性细菌中已鉴定出大量AHLs [45].植物对不同的AHLs有不同的反应方式。一般而言,侧链短(4 ~ 6个碳)的ahl调节根的生长发育,而长链ahl如C12-和C14-HSL诱导植物抗性[27,28,30.,32,38,39,44,46,47,48].缺乏直接证据表明中间AHL(如C8-HSL和C10-HSL)的参与,以及它们在植物防御反应中脂肪酸链C3位置被氧基取代。在本研究中,我们表明3OC8-HSL预处理增强了对太平洋标准时间在拟南芥DC3000。体外分析表明,3OC8-HSL并不直接抑制病原菌的生长,也不影响其毒力。因此,3OC8-HSL对病原无直接作用,但增强了抗病能力在足底这表明3OC8-HSL实际上是一种植物防御激活剂。我们之前报道3OC8-HSL可以促进拟南芥主根的生长[32].有报道称3OC8-HSL是自然栖息地中常见的群体感应信号[49].根际土壤中几种植物致病菌包括两,果胶杆菌和泛菌生产3OC8-HSL作为细胞间通讯的信号分子[50].植物可能在与微生物的长期相互作用过程中进化出感知AHL的机制,从而识别周围环境中入侵细菌的存在并采取防御措施。结合目前的研究结果,我们认为3OC8-HSL促进了植物根系的生长,并在植物中起到了激发剂的作用。此外,我们的数据表明,在AHLs的C3位置被羰基取代与更有效的抗性诱导有关,因为3OC8-HSL和3OC6-HSL启动了拟南芥的防御反应,而C8-HSL和C6-HSL没有启动防御反应(图2)。1).类似地,Schikora等人[38]对抗性诱导效果最强的是3OC14-HSL和3OC12-HSL预处理植株。
活性氧的产生,如H2O2产生,是植物对病原菌攻击的最早防御反应之一。病原体侵入前3OC8-HSL预处理增强H2O2相比之下,太平洋标准时间未经预处理的DC3000接种可导致H变缓且适中2O2拟南芥叶片(图。2).因此,快速而强的H2O2合成是由3OC8-HSL引发的防御机制之一,与之前的报告一致,发现增强的H2O2病原菌接种后的积累是诱变植物的典型反应之一[51,52].此外,与未处理对照相比,3OC8-HSL处理后的病原菌攻击导致POD、SOD和CAT活性增强(图2)。4).这些酶在H2O2因此,本研究结果提示H2O2体内平衡也由3OC8-HSL启动。综上所述,这些数据清楚地表明H2O2积累是3oc8 - hsl诱导引物的组成部分。
SA在拟南芥抗病性中起关键作用p .两[7].我们证明了SA信号通路参与了3oc8 - hsl诱导的抗性启动太平洋标准时间DC3000通过几行证据。也就是说,太平洋标准时间3OC8-HSL预处理后的DC3000感染导致:1)叶片中游离SA积累增加;2) SA生物合成基因的强而快速表达诱导ICS1随着CBP60g和SARD1,两个转录因子基因ICS1;(3)增强表达PR1和PR5这两个基因通常受病原菌感染时SA途径的调控。除此之外,3oc8 - hsl介导的抗太平洋标准时间DC3000在npr1-1突变体,NahG转基因植物。经3OC8-HSL预处理而不经后续病原菌攻击,不能诱导SA的积累或表达ICS1,CBP60g,SARD1,PR1,或PR5.虽然太平洋标准时间未经预处理的DC3000接种触发了SA的生物合成PR1和PR5与经3oc8 - hsl预处理的植物相比,其诱导时间、诱导峰出现时间和诱导幅度均明显推迟和降低。这些结果表明,3OC8-HSL预处理诱导植物对病原菌的极端敏感状态,使植物能够快速、强烈地启动SA信号,以防止或减轻病原菌的攻击。在baba处理过的烟草中也发现了类似的SA依赖性[53]和拟南芥[54].类似地,3oc14 - hsl诱导的抗性依赖于oxylipin和SA信号通路[28,47].oxylipin,包括JA和相关代谢物,是脂源性信号化合物,在对病原体感染的反应中积累。然而,3oc14 - hsl诱导的抗性被发现与ja无关[28].还需要进一步的研究来确定除SA以外的其他植物激素,如JA,是否参与了3oc8 - hsl诱导的抗性。
Joshi等人[55肉桂酸(CA)和水杨酸(SA)等植物酚酸影响毒力Pectobacterium aroidearum和巴西亚种通过群体感应(QS)规例[55].将细菌暴露于非致死剂量的SA可抑制QS基因的表达,包括expI,expR,pc1 - 1142(luxR并下调毒力因子的表达,如胸大肌,图像的基本单位,peh,yheO,由QS系统管理。因此,SA治疗降低了毒力Pectobacterium spp。土豆和马蹄莲。从目前的结果来看,3OC8-HSL可以触发SA级联反应,从而可能影响病原菌。
在病原体攻击时加强细胞壁提供了一个防止病原体入侵的额外结构屏障[56,57].胼胝质沉积增加,酚类化合物和木质素显示在flg22挑战,ahl引发的拟南芥[28].在c10 - hsl处理的大麦芽中,Götz-Rösch等[57]发现,C6-HSL处理后,大麦脱氢抗坏血酸还原酶活性较对照植株提高384%,而根系SOD活性则下降至对照植株的23%。大麦和山药豆的植物生长和色素含量对三种不同的AHL (C6-HSL、C8-HSL和C10-HSL)的响应较小,表明AHL处理引发了重要解毒酶活性的组织和化合物特异性变化。PAL是合成木质化和细胞壁强化所需前体的关键酶[58].PAL活性是应激条件的一个极其敏感的指标,通常与防御反应有关[59].在本研究中,我们观察到在根上施用3OC8-HSL和叶面接种病原菌后PAL活性的提高。POD和SOD是参与拟南芥造壁过程的氧化还原酶,在病原菌侵染前,3OC8-HSL预处理可显著增强这两种酶的活性。综上所述,我们的研究结果表明,3OC8-HSL与3OC14-HSL的作用类似,通过增强细胞壁来诱导植物对病原菌的抗性。
结论
我们的研究结果表明,3OC8-HSL具有一种新的生物学功能:它通过启动植物防御反应来实现抗病,从而限制病原菌的生长在足底抑制接种物的繁殖。3OC8-HSL将植物转变为一种高能力状态,并在随后的病原体挑战下触发强化的分子和细胞防御反应。植物中AHLs的启动机制本身的代谢需求相对较低,因此可能是一种有效且经济的病原体响应策略,其代谢成本最低。在传统的疾病防治方法中,3OC8-HSL可以作为一种满足环境法规要求的新型起爆剂。
方法
植物生长、AHL预处理及病原菌接种
的种子拟南芥ecotype Columbia-0 (Col-0), Col-0表达细菌NahGT-DNA插入缺失突变体npr1-1(CS3726)从拟南芥信息资源(TAIR,https://www.arabidopsis.org)种子表面用75%(v/v)乙醇灭菌1小时 最低浓度和30%(v/v)次氯酸钠,持续5小时 用无菌蒸馏水冲洗5分钟后,种子发芽并在含有MS培养基(pH)的琼脂平板上生长 5.8).将这些植物放置在一个带有16 h灯/8 h暗光周期,100 μmol M−2年代−1温度为22±2℃。对于病原体增殖,H2O2植物在无菌系统水培系统中培养,以消除未知微生物对植物的影响(附加文件2:图S1)。这个系统从物理上把植物的根和芽分开。在MS琼脂培养基上萌发10天后,将根长2cm的两片叶子的幼苗移栽于装有450ml Hoagland无菌培养基的塑料无菌容器(18 cm × 11 cm的Eppendorf容器,用Parafilm薄膜覆盖)中,培养2周。在此期间后,底层培养基与新鲜培养基交换。直接在培养基中加入AHL进行预处理。两天后,对叶子进行喷雾接种太平洋标准时间DC3000。以下为疾病症状分析太平洋标准时间DC3000感染,离体叶片从土壤生长的拟南芥。将上述10日龄平板育苗移栽到蒸汽灭菌的商用盆栽土/珍珠岩(3:1)混合土壤中,然后在生长室中培养4周。离体叶片在无菌半强MS培养基上漂浮,用AHLs处理2 d,然后喷雾接种太平洋标准时间DC3000。
本研究用于预处理的9种ahl (C4-HSL、C6-HSL、6-HSL、C8-HSL、3OC8-HSL、C10-HSL、C12-HSL、3OC12-HSL、3OC14-HSL)均购自Sigma-Aldrich (Taufkirchen, Germany)。C4-HSL、C6-HSL、6-HSL、C8-HSL、3OC8-HSL为水溶性;C10-HSL、C12-HSL、3OC12-HSL和3OC14-HSL均可溶于乙醇。因此,以水处理(未预处理)植物为对照,以乙醇处理植物为对照。将AHLs溶解在各自的溶剂中,作为10 mM的原液,并在10 μM或指示的工作浓度下使用。所有复合溶液通过0.22 μm过滤器进行灭菌。将ahl直接加入霍格兰培养基中,搅拌均匀。太平洋标准时间DC3000在King’s B培养基中培养过夜,加入利福平(50 μg/ml),使OD600 = 0.6-1.0。离心收集细菌细胞,用10 mM氯化镁洗涤2,用10毫米氯化镁重悬2.用…接种拟南芥太平洋标准时间DC3000,将菌悬液调整至OD值600= 0.1 in 10 mM MgCl2含0.02% Silwet 77。在AHL处理两天后,用细菌悬浮液喷接种植株,直到所有叶片上都覆盖着细小的液滴。在接种病原菌后的指定时间点,收获100 mg叶片组织,用10 mM MgCl匀浆2.将连续稀释的匀浆用50 μg/mL利福平涂于含有选择性菌落形成单位(CFU)抗生素的King’s B培养基板上。所有实验都是在未经处理的对照植物上进行的。进行了3个独立的生物学实验,每个实验有3个技术重复。
分析H2O2积累
确定H2O2用3OC8-HSL引物积累拟南芥植株,在含10 μM 3OC8-HSL或不含3OC8-HSL(对照)的Hoagland培养基中预处理2 d。树叶被喷上了太平洋标准时间DC3000 (OD600= 0.1)的解决方案。在接种后6小时(hpi),用DAB (Sigma-Aldrich, Germany)染色法检测ROS的形成。叶片样品在DAB溶液(1 mg/ml 3,3-二氨基联苯胺水溶液)中22℃过夜,用乙醇/氯仿/三氯乙酸(4:1:15)去染24 h。用徕卡DM4000B显微镜(德国徕卡公司)拍摄叶片。实验共进行3次,每次6片叶子。H2O2采用铁氧化法测定铁的含量2+在有木醇橙存在的情况下,它会产生与铁的有色络合物3+在A56060].H2O2通过与标准曲线比较测定样品中的含量。进行了3个独立的生物学实验,每个实验有3个技术重复。
转录分析
综上所述,在喷施3OC8-HSL或不加3OC8-HSL处理的水培拟南芥地上部苗期,分别在喷施3OC8-HSL处理后0、6、12和24 h采集太平洋标准时间DC3000 (OD600 = 0.1)。使用TaKaRa RNA Plus试剂(中国大连)提取均质植物组织的总RNA,用于基因表达的相对定量,比较CT方法[61]和7500 Real Time PCR系统(Applied Biosystems, Foster City, CA, USA)。目的基因水平归一化为内参基因β肌动蛋白.每个数据点代表三个独立实验的平均值。作为技术对照,每个qRT-PCR实验在同一96孔板上重复4次。采用附加文件中所列引物进行qRT-PCR1S1:表。
水杨酸测量
采用3oc8 - hsl预处理的拟南芥水培苗,分别在0、6、12、24 h后提取并定量测定游离水杨酸(SA)太平洋标准时间DC3000叶片接种。将植物组织在液态氮中冷冻并粉碎2.取冷冻组织(0.5 mg)进行SA提取和HPLC定量。采用Waters 1525高效液相色谱(Waters Technologies)进行色谱分析。分离是通过Inertsil ODS C实现的18柱(50 3 4.6 mm, 2.5 mm;GL科学)。乙酸钠(90%)和甲醇(10%)分别作为流动相A和B。荧光强度检测,激发波长为313 nm,发射波长为405 nm [62].流速为0.5 ml/min,进样量为10 μl。柱温保持在25℃。
酶活性测定
经3oc8 - hsl预处理的水培拟南芥幼苗24 h后采集叶片太平洋标准时间DC3000接种(OD600= 0.1)。用冷冻组织(100 mg)检测酶活性。超氧化物歧化酶(SOD)活性测定采用Beauchamp法和Fridovich法[63].基于CAT分解的H2O2可通过添加钼酸铵快速终止。剩下的H2O2与钼酸铵反应生成一种黄色络合物。H2O2加到提取的上清液中作为底物,在240 nm处测量产量,计算CAT活性[64].POD活性测定依据Wang等人[65,基于pod催化H2O2的反应。酶活性测定的吸光度波长为420 nm。PAL酶活性的测定如前所述[66]根据PAL催化反式肉桂酸苯丙氨酸氨生成的原理,通过测量290处的吸光度来测定酶的活性 进行了三个独立的生物学实验,每个实验有三个技术重复。
统计分析
所有实验数据均采用DPS v7.05程序进行统计分析。图中使用了学生的测试。1.图中使用了单变量和多变量分析(ANOVA)和邓肯的新多范围测试。2,3.,4,5,6.所有数据用3 - 4个独立实验的平均值±SD表示。
数据和材料的可用性
在本研究中使用和/或分析的数据集可从通讯作者在合理要求。
缩写
- 3 oc8-hsl:
-
N3-oxo-octanoyl-homoserine内酯
- 阿坝:
-
脱落酸
- AHL:
-
N-acyl-homoserine
- 蓝芽:
-
Benzothiadiazole
- 猫:
-
过氧化氢酶
- 菌落:
-
克隆形成单位
- ETI:
-
Effector-triggered免疫力
- 谷胱甘肽:
-
谷胱甘肽
- H2O2:
-
过氧化氢
- 人力资源:
-
过敏的反应
- 在:
-
2.6 -dichloro-isonicotinic酸
- ISR:
-
诱导系统抗性
- MAMP:
-
Micro-associated分子模式
- 惩罚:
-
甲基Jasmonate
- 朋友:
-
苯丙氨酸氨裂解酶
- PAMP时:
-
其分子模式
- 圆荚体:
-
过氧化物酶
- 公关:
-
Pathogenesis-related基因
- PRRs:
-
模式识别受体
- 太平洋标准时间DC3000:
-
两pv。番茄DC3000
- 公共交通信息:
-
Pattern-Triggered免疫力
- QS:
-
群体感应
- ROS:
-
活性氧
- RT-qPCR:
-
实时定量聚合酶链反应
- 山:
-
水杨酸
- SOD:
-
超氧化物阴离子自由基
- 特别行政区:
-
系统获得性耐药
- tts:
-
III型分泌系统
参考文献
- 1.
“诱发子的复兴:模式识别受体对微生物相关分子模式和危险信号的感知”。植物学报2009;60:379-406https://www.annualreviews.org/doi/10.1146/annurev.arplant.57.032905.105346.
- 2.
多兹,拉斯金,JP。植物免疫:植物-病原体相互作用的综合观点。[j] .地理科学进展,2010,27(8):539-48。https://doi.org/10.1038/nrg2812.
- 3.
邦纳迪五世,腾格尔JL。细胞内免疫受体信号复合物有多复杂?植物科学学报2012;3:237。https://doi.org/10.3389/fpls.2012.00237.
- 4.
陈志强,王志强,陈志强,等。植物NLR功能的进化与保护。Immunol前面。2013;4:297。https://doi.org/10.3389/fimmu.2013.00297.
- 5.
Van wee SC, Van der Ent S, Pieterse CM。有益微生物引发的植物免疫反应。植物学报。2008;11(4):443-8。https://doi.org/10.1016/j.pbi.2008.05.005.
- 6.
Dempsey DA, Klessig DF。sos -过多信号导致系统性获得性耐药性?植物科学进展,2012;17(9):538-45。https://doi.org/10.1016/j.tplants.2012.05.011.
- 7.
傅志强,董旭。系统获得性抗性:将局部感染转化为全球防御。植物生物学年鉴。2013;64:839–63。https://doi.org/10.1146/annurev-arplant-042811-105606.
- 8.
Shah J,Zeier J.系统获得性抗性中的远程通信和信号放大。前沿植物科学。2013;4:30https://www.frontiersin.org/articles/10.3389/fpls.2013.00030/full.
- 9.
陈志强,陈志强,陈志强,等。植物与病原菌相互作用的启动机制。植物科学进展,2002;7(5):210-6。
- 10.
等。BTH和BABA诱导豌豆对锈病(Uromyces pisi)的抗性,涉及植物抗毒素的差异积累。足底。2015;242(5):1095 - 106。https://doi.org/10.1007/s00425-015-2339-8.
- 11.
防卫启动的分子层面。植物科学进展。2011;16(10):524-31https://linkinghub.elsevier.com/retrieve/pii/S1360138511001300.
- 12.
刘永强,刘永强,等。在拟南芥中,丝裂原活化蛋白激酶3和6是充分启动胁迫反应所必需的。植物学报。2009(3):944-53。https://doi.org/10.1105/tpc.108.062158.
- 13.
陈志强,李志强,李志强,等。拟南芥免疫系统的构建及其免疫机制。植物病理学杂志。2013 1月;14(1):58-70。https://doi.org/10.1111/j.1364-3703.2012.00827.x.
- 14.
范浩腾等。拟南芥防御启动的成本和收益。中国科学院院刊2006;103(14):5602-7。https://doi.org/10.1073/pnas.0510213103.
- 15.
刘志强,王志强,王志强,等。二氯异烟酸和水杨酸作为系统性获得性抗性的诱导剂,增强了欧芹对真菌诱导子的反应。植物学报1992;(5):655-60 http://doi.wiley.com/10.1111/j.1365-313X.1992.tb00134.x。
- 16.
等。剖析拟南芥β -氨基丁酸诱导的启动现象。植物细胞。2005;17(3):987 - 99。https://doi.org/10.1105/tpc.104.029728.
- 17.
陈春华,陈春华,陈春华,等。通过特异性抑制拟南芥对冠状肽的反应,启动增强防御反应。植物学报2011年2月;65(3):469-79。https://doi.org/10.1111/j.1365-313X.2010.04436.x.
- 18.
王丽君,王丽君,王丽君,等。启动系统植物免疫。科学。2009;324(5923):89 - 91。https://doi.org/10.1126/science.1170025.
- 19.
王志强,王志强,王志强,等。水杨酸甲酯是植物系统获得抗性的重要移动信号。科学。2007;318(5847):113 - 6。https://doi.org/10.1126/science.1147113.
- 20.
Návarová H, Bernsdorff F, Döring AC,等。皮酚酸是一种内源性的防御扩增和引物,是诱导植物免疫的重要调控因子。植物细胞,2012;24(12):5123 - 41。https://doi.org/10.1105/tpc.112.103564.
- 21.
李志强,李志强,李志强,等。大豆和酪蛋白水解物诱导葡萄的免疫反应和对葡萄葡萄球菌的抗性。Front Plant Sci. 2014 12月23日;5:716。https://doi.org/10.3389/fpls.2014.00716.
- 22
Kravchenko VV, Kaufmann GF, Mathison JC等。通过细菌小分子破坏NF-kappa B信号通路来调节基因表达。科学。2008;321(5886):259 - 63。https://doi.org/10.1126/science.1156499.
- 23
王志强,王志强,王志强,等。铜绿假单胞菌群体感应信号分子N-(3-氧十二烷基)-高丝氨酸内酯通过AP1途径诱导大鼠成纤维细胞中基质金属蛋白酶9的表达。生物技术与生物化学。2015;79(10):1719-24。https://doi.org/10.1080/09168451.2015.1056509.
- 24
陈志强,王志强,王志强,等。铜绿假单胞菌群体感应分子N-(3-氧十二烷酰)-高丝氨酸-l -内酯(3-O-C12-HSL)诱导人免疫细胞HLA-G表达。感染Immun。2015;83(10):3918 - 25所示。https://doi.org/10.1128/IAI.00803-15.
- 25
作者简介:王志强,男,博士,主要研究方向为生物医学工程。过氧化物酶体增殖物激活受体介导宿主细胞对铜绿假单胞菌自身诱导剂的促炎反应。中国微生物学杂志。2008年7月;190(13):4408-15。https://doi.org/10.1128/JB.01444-07.
- 26
苗超,刘芳,赵强,等。拟南芥幼苗对细菌群体感应信号3-氧辛酰高丝氨酸内酯响应的蛋白质组学分析。生物化学学报。2012;427(2):293-8。https://doi.org/10.1016/j.bbrc.2012.09.044.
- 27
冯立军,张志强,张志强,等。拟南芥对根际细菌群体感应分子n -己酰- dl -高丝氨酸内酯的响应足底。2008年12月;229(1): 73 - 85。https://www.ncbi.nlm.nih.gov/pubmed/18766372。
- 28.
引用本文:陈志强,陈志强,陈志强,等。n -酰基高丝氨酸内酯通过水杨酸/羟脂途径诱导植物增强细胞壁,并诱导植物对细菌病原体的抗性。植物细胞,2014,26(6):2708 - 23所示。https://doi.org/10.1105/tpc.114.126763.
- 29.
许海格。n -酰基- l-高丝氨酸内酯根际细菌诱导番茄系统性抗性的研究。植物学报。2006;29(5):909-18。https://doi.org/10.1111/j.1365-3040.2005.01471.x.
- 30.
高丝氨酸内酯:植物真的会听细菌说话吗?植物信号学报。2009;4(1):50-1https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2634072/.
- 31.
宋胜,贾志,徐建军,等。n -丁基高丝氨酸内酯是细菌群体感应信号分子,可诱导拟南芥根细胞内钙离子的升高。生物化学学报。2014;414:355-60https://www.ncbi.nlm.nih.gov/pubmed/25628641.
- 32.
刘锋,卞志强,贾志强,等。GCR1和GPA1参与了细菌群体感应信号n -酰基高丝氨酸内酯诱导的拟南芥主根伸长的促进。植物与微生物学报。2012;25(5):677-83。https://doi.org/10.1094/MPMI-10-11-0274.
- 33.
赵强,张超,贾志,等。钙调素参与拟南芥主根伸长的n -3-氧-己酰高丝氨酸内酯调控。植物学报2015;5:807。https://doi.org/10.3389/fpls.2014.00807.
- 34.
赵强,李敏,贾志,等。拟南芥AtMYB44正调控n -3-氧-己基-高丝氨酸内酯诱导的初生根伸长。植物与微生物相互作用学报。2016;29(10):774-85。https://doi.org/10.1094/MPMI-03-16-0063-R.
- 35.
庞勇,刘旭,马勇,等。根际沙雷氏菌的系统抗性诱导、根定殖和生防活性依赖于n -酰基高丝氨酸内酯。植物病理学杂志。2009;124:261-8。https://doi.org/10.1007/s10658-008-9411-1.
- 36.
Zarkani AA, Stein E, Röhrich CR等。高丝氨酸内酯影响植物对根瘤菌的反应。中华医学杂志。2013;14(8):17122-46。https://doi.org/10.3390/ijms140817122.
- 37.
Hernández-Reyes C, Schenk ST, Neumann C,等。n -酰基高丝氨酸内酯生产细菌保护植物免受植物和人类病原体。生物科技活》。2014;7(6):580 - 8。https://doi.org/10.1111/1751-7915.12177.
- 38.
Schikora A,Schenk ST,Stein E,等人。N-酰基高丝氨酸内酯通过改变AtMPK6的活化作用,赋予对生物营养和半生物营养病原体的抗性。植物生理学。2011;157(3):1407–18。10.1104% 2 fpp.111.180604.
- 39.
陈志强,陈志强,陈志强,等。拟南芥的生长和防御是由细菌群体感应分子调控的。植物学报。2012;7(2):178-81。10.4161% 2 fpsb.18789.
- 40.
Prithiviraj B, Perry LG, Badri DV,等。由根分泌的植物毒素介导的化学促进和诱导病原菌抗性。新植醇。2007;173(4):852 - 60。https://doi.org/10.1111/j.1469-8137.2006.01964.x.
- 41.
王立军,王志强,王志强,等。CBP60g和SARD1在水杨酸信号转导中起部分冗余的关键作用。植物j . 2011; 67(6): 1029 - 41。https://doi.org/10.1111/j.1365-313X.2011.04655.x.
- 42.
张勇,徐胜,丁鹏,等。一个植物特异性转录因子家族的两个成员对水杨酸合成的控制和系统性获得抗性。中国科学院院刊2010;107(42):18220-5。https://doi.org/10.1073/pnas.1005225107.
- 43.
万东,李锐,邹斌,等。钙调素结合蛋白CBP60g是拟南芥抗病性和抗旱性的正调节蛋白。植物学报2012;31(7):1269-81。https://doi.org/10.1007/s00299-012-1247-7.
- 44.
金光,刘芳,马辉,等。两种g蛋白偶联受体候选蛋白,Cand2和Cand7,参与了细菌群体感应信号n-酰基高丝氨酸内酯介导的拟南芥根生长。生物化学学报。2012;417(3):991 - 905。https://doi.org/10.1016/j.bbrc.2011.12.066.
- 45.
Williams P.细菌世界中的群体感应、通讯和跨领域信号传递.微生物学.2007年12月;153(第12部分):3923-38。https://doi.org/10.1099/mic.0.2007/012856-0.
- 46
关键词:拟南芥,n -酰基- l-高丝氨酸内酯,群体感应信号,根发育植物学报2008;31:1497-509。
- 47
Schenk ST,Schikora A.AHL通过氧化脂质和水杨酸的启动功能。前沿植物科学。2015;5:784。https://doi.org/10.3389/fpls.2014.00784.
- 48
白晓东,王志强,王志强,等。n- 3-氧-癸酰-l -高丝氨酸内酯通过过氧化氢和一氧化氮依赖的环GMP信号激活生长素诱导的不定根形成。植物杂志。2012;158(2):725 - 36。https://doi.org/10.1104/pp.111.185769.
- 49
Pierson EA, Wood DW, Cannon JA, Pierson LS。小麦根际细菌间n -酰基高丝氨酸内酯的群体间信号传递。植物与微生物的相互作用。1998;11:1078-84。https://doi.org/10.1094/MPMI.1998.11.11.1078.
- 50.
王志强,王志强,王志强,等。酰基高丝氨酸内酯介导的附生细菌间的交互作用调节紫丁香假单胞菌在叶片上的行为。ISME j . 2009; 3:825-34。https://doi.org/10.1038/ismej.2009.30.
- 51.
Orozco Cardenas ML,Narvaez Vasquez J,Ryan CA.。过氧化氢作为第二信使,在番茄植物中诱导防御基因,以应对创伤、系统蛋白和茉莉酸甲酯。植物细胞。2001;13(1):179-91https://www.ncbi.nlm.nih.gov/pmc/articles/PMC102208/.
- 52.
Pellinen RI,Korhonen MS,Tauriainen AA等。过氧化氢激活brich中的细胞死亡和防御基因表达。植物生理学。2002;130(2):549–60.10.1104% 2 fpp.003954.
- 53.
Siegrist J,Orober M,Buchenauer H.β-氨基丁酸介导的烟草花叶病毒抗性的增强依赖于水杨酸的积累.植物病理生理学.2000;56:95–106。https://doi.org/10.1006/pmpp.1999.0255.
- 54.
Zimmerli L, Jakab G, Metraux JP,等。β-氨基丁酸增强拟南芥的特异性防御机制。中国科学院院刊2000年11月7日;97(23):12920-5。https://doi.org/10.1073/pnas.230416897.
- 55.
乔希,伯德曼,利普斯基等。植物酚酸影响果胶杆菌和胡萝卜素的毒力。通过群体感应调节巴西利亚ense。植物病理学杂志。2016;17(4):487-500。https://doi.org/10.1111/mpp.12295.
- 56.
王志强,王志强,王志强,等。富氢脯氨酸糖蛋白与植物防御。J Phytopathol。2010;158(9):585 - 93。https://doi.org/10.1111/j.1439-0434.2010.01669.x.
- 57.
Götz-Rösch C, Sieper T, Fekete A, et al.细菌n -酰基-高丝氨酸内酯对大麦和山药豆生长参数、色素、抗氧化能力和外生II相解毒酶的影响植物学报。2015;6:205。https://doi.org/10.3389/fpls.2015.00205.
- 58.
Weisshaar B, Jenkins GI。苯丙素的生物合成及其调控。植物学报。1998;1(3):251-7http://linkinghub.elsevier.com/retrieve/pii/S1369526698801131.
- 59.
Dixon RA, Paiva NL。应激Phenylpropanoid新陈代谢。植物学报。1995;7(7):1085-97。https://doi.org/10.1105/tpc.7.7.1085.
- 60.
盖伊C,柯林斯J,格比奇J m。铁-二甲酚橙络合物溶液中铁的测定。学生物化学肛门。1999;273(2):143 - 8。https://doi.org/10.1006/abio.1999.4207.
- 61.
Livak KJ,Schmittgen TD.使用实时定量PCR和2(−方法。方法。2001;25(4):402-408。doi:https://doi.org/10.1006/meth.2001.1262.
- 62.
杨志强,王志强,王志强,等。水杨酸对海芋花序热生产的调控。中国科学(d辑:地球科学)1989;86(7):2214-8。10.1073% 2 fpnas.86.7.2214.
- 63.
超氧化物歧化酶:改进的测定方法和适用于丙烯酰胺凝胶的测定方法。学生物化学肛门。1971;44(1):276 - 87。https://doi.org/10.1016/0003 - 2697 (71) 90370 - 8.
- 64.
唐永华,等。花生AP2/ERF基因JcDRFB2可改变转基因水稻front的生长和盐胁迫反应。植物科学。2017;8:306。https://doi.org/10.3389/fpls.2017.00306.
- 65.
王永春,高长青,梁亚宁,等。柽柳bZIP基因介导烟草对盐胁迫的生理响应。植物生理学报。2010年2月15日;167(3):222-30。https://doi.org/10.1016/j.jplph.2009.09.008.
- 66.
等。分子植物病理学-一个实用的方法,vol . I. Physiol Mol plant Pathol. 1992;40(3):226。https://doi.org/10.1016/0885 - 5765 (92) 90064 - 3.
致谢
我们感谢Adam Schikora教授为改进本手稿所作的宝贵讨论和建议。
资金
基金资助:国家重点基础研究发展计划项目(No. 2015CB150600);国家自然科学基金项目(No. 31270880);河北省自然科学基金项目(No. C2015302020)。每个资助机构都是根据一项研究提案批准这些资金的。这些机构对实验设计,数据分析和解释,或手稿的写作没有影响。
作者信息
从属关系
贡献
FL和SSS设计了项目;FL, ZHJ, CS, YLH和HM进行了实验;FL、QZ和SSS对数据进行分析;FL和SSS撰写了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘芳,赵强,贾志强。et al。N-3-氧代-辛酰基-高丝氨酸内酯介导的抗药性启动两需要水杨酸信号通路拟南芥.BMC植物杂志20.38 (2020). https://doi.org/10.1186/s12870-019-2228-6
收到了:
接受:
发表:
关键字
- 拟南芥
- 群体感应(QS)
- 启动
- 水杨酸(SA)
- 植物防御
- N3-oxo-octanoyl-homoserine内酯(3 oc8-hsl)