摘要
背景
苜蓿是中国北方广泛栽培的高质量饲料。最近,苜蓿植物在冬季生存的失败造成了实质性的经济损失。水管理引起了相当大的关注,作为冬季存活的潜在改善的方法。本研究的目的是确定水管制度的变化是否影响苜蓿的冷冻耐受性。
结果
在保水能力分别为80和25%的水分条件下,分别在4/0°C(光/暗)和−2/−6°C(光/暗)的低温条件下栽培紫花苜蓿品种WL353LH。水分胁迫下的半致死温度比水分充足的苜蓿低。在水分亏缺和低温条件下,总可溶性糖、总氨基酸和脯氨酸的库大小发生了显著变化。代谢组学分析揭示了72个不同代谢物的亚类,其中脂质和类脂分子(如脂肪酸、不饱和脂肪酸和甘油磷脂)以及氨基酸、多肽和类似物(如脯氨酸甜菜碱)在缺水条件下上调。一些碳水化合物(如d -麦芽糖和棉子糖)和类黄酮在低温下也上调。最后,京都基因和基因组百科全书的分析揭示了18条显著富集的途径,涉及碳水化合物、不饱和脂肪酸、氨基酸和甘油磷脂的生物合成和代谢。
结论
水分亏缺显著提高了紫花苜蓿的抗冻性,这与可溶性糖、氨基酸、脂质及类脂分子含量的增加有关。这些物质参与渗透调节,低温防护,细胞膜的合成,流动性和稳定性。本研究为通过水分管理提高紫花苜蓿越冬存活率提供了参考。
背景
紫花苜蓿(Medicago Sativa.L.)是一种高质量的饲料,在中国北方广泛种植,冬季寒冷却很严重。极端寒冷导致苜蓿失败在冬季生存,这是其再生和生产的障碍,导致严重的经济损失。提高苜蓿生存能力冬季的能力已成为一种紧急的生产问题。
紫花苜蓿对冬季冰冻条件的应对反应可分为3个不同的阶段:驯化、冻结和去驯化[1,2].驯化的初始步骤是通过在秋天较短光周期和较低温度下引发生长减少[3.].紫花苜蓿在冷冻反应中积累相容可溶性糖和低分子氮化合物,细胞膜组成发生变化[4,5]为有助于改善冷冻耐受性6].一般情况下,在驯化过程中,以温度在0°C至5°C之间的生长期作为评估紫花苜蓿生存能力的标准[7].在随后的冻结阶段,苜蓿停止生长。冠是最敏感的冷应力组织[8].当温度在以下弹簧中增加时,苜蓿通过去适应过程失去了一些获得的冰箱耐热性[9].
在暴露于低温期间,植物细胞积累了活性氧物质[10.],其氧化细胞膜并产生丙二醛[11.].因此,丙二醛水平是膜脂过氧化的指标[12.].在冷胁迫条件下,植物细胞的膜透性增加。在以往的研究中,半致死温度(LT50),即导致50%细胞浆渗漏的温度,已被用来评估植物的抗冻性,并通过测量电导率进行量化[13.].在对寒冷的响应中,植物细胞的生化变化导致了低温驯化,从而提高了紫花苜蓿抵抗不利环境条件的能力。这种生化变化包括可溶性碳水化合物和氮化合物(蛋白质和氨基酸)含量的变化和膜脂成分的改变[9,14.,15.].代谢组学分析基于液相色谱 - 质谱(LC-MS)是,以确定这样的变化的有效方法。
在农业生产中,水分亏缺启动是提高作物抗冻性的有效途径。类似于低温和短日条件,水分胁迫可以启动霜硬机制,以诱导抗冻性。这在红柳山茱萸(山茱萸颖Michx。)16]甚至在草本植物如冬天黑麦(Secale Cereale.L,简历。彪马)[17]和小麦(Triticum aestivum.L.)[18].豆科苜蓿的生长与光周期,秋季和初冬的变化气温下降减小。暴露苜蓿的水分亏缺通过增强其抗冻性[增加其越冬19].此外,还研究了落叶前高水位(100%持水能力)和水分亏缺(50%持水能力)对紫花苜蓿越冬存活的影响。水分亏缺有利于根系生长和主根中总可溶性蛋白和营养贮藏蛋白的积累,从而提高了越冬存活率和春季恢复率[20.].与此相反,充足的水有助于旺盛的生长,并延缓初冬冷硬的过程[21].然而,水分亏缺是否会限制枝、根的生长,以及主根中氮化合物的积累,这些都不利于提高抗寒性[22].
土壤水分影响苜蓿抗冻结的能力。灵感来自交叉适应[23,我们假设持续缺水将增强紫花苜蓿的抗冻性。因此,本研究的目的如下:1)研究两种土壤-水分条件下紫花苜蓿的抗冻性差异;2)利用生化和代谢组学分析确定水分亏缺对抗冻性的影响。
方法
植物材料
Seeds of alfalfa (cultivar WL353LH, fall dormancy 4.0) were sown in plastic pots (diameter, 15 cm; height, 20 cm). The pots were filled with a mixture of soil, perlite, and vermiculite at a ratio of 100:30:55 (g:g:g). The water-holding capacity of the mixture was 109.7% (g:g). The experiment was conducted in a growth room with the following conditions: 24 ± 2 °C/20 ± 2 °C (light/dark), 60–65% atmospheric relative humidity, and a 12-h light/12-h dark photoperiod with a photosynthetic photon flux density of 350 μmol/m2/ s。所有花盆每天浇水,每月用等量的霍格兰营养液施肥一次。
实验治疗
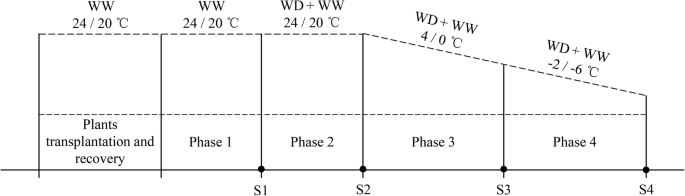
发芽三个月后,选择四个相同的幼苗并移植到聚氯乙烯管(直径,10cm;高度,15cm)中。将管子填充在2.1节中描述的相同混合物。为这项研究制备了共有42个管道,其具有两种水中治疗方法,每个治疗方法有六个生物重复和四个实验阶段。所有的管子都浇水至80%的水控容量,然后在培养室中留下2周。然后,管道随机安排在LRH-200-GD(太钟医疗器械,广东,中国)低温孵化器中。在四个实验相期间,培养箱中的混合土壤和温度的水分含量如图1所示。1.第一阶段的条件是持水量80%,24/20°C(光/暗)。植物在此条件下生长1周,然后采集样品以代表原始状态。在第二阶段,将剩余的36根管道分为两组,一组混合土壤含水率控制在25%持水能力(WD),另一组保持在80%持水能力(WW)。培养箱温度设置为24/20°C(光/暗)。在WD水分水平达到后的第3天取样。第3阶段,在WD和WW仍保持土壤含水率的情况下,将培养箱温度由24/20°C改为4/0°C(光/暗),冷驯化2天后取样。在第4阶段,温度以−2℃/d的速率下降,在温度达到−2℃/−6℃(光照/黑暗)后第二天取样。从第1阶段到第4阶段,光周期为12小时,光合光子通量密度约为150 μmol/m2/s保持在培养箱中。
采样
在每个采样点,如图2所示。1将地上部分与地下部分分开,用水冲洗,用滤纸吸干表面。正如之前的研究所述,我们在地下约5厘米的范围内收集了冠[24,25,26].The crown samples were cut into three segments in preparation for the freezing tolerance test, metabolomics assays, and other analyses, and two out of three segments were frozen at − 80 °C until used. After crown sampling, the dry weight of the aboveground parts was determined, and that of the belowground parts was calculated using the total fresh weight and the moisture content of the remaining root tissues.
冷冻糖耐量试验
为冷冻耐受试验制备了六种冠状样品的六种重复。将冠切成薄片,将碎片分成九个2ml离心管。将管在4℃下储存2小时,然后放置在冰上以临时保存。在九九减少温度下,在恒温循环器ZX-5C(Zhixin,上海)中进行了冷冻试验。对于在相1中收集的样品,将冷冻温度设定为0, - 2,-4, - 6, - 8, - 10, - 12, - 14和-16℃。对于在阶段2中收集的样品,温度设定为-2,-4, - 6, - 8, - 10, - 12, - 14, - 16, - 18℃。对于在相3和4中收集的样品,温度设定为-4,6,4-8, - -10, - 12, - 14, - 16, - 18,和 - 20℃。对样品进行每个温度处理1.5小时,在醇浴中。将一个冷冻的抽样管取出并在冰上解冻过夜。第二天,在将冠切片转移到15ml管中并与5ml去离子水混合之前,将取样管在4℃下解冻2小时。 The sampling tubes were placed on a gyratory platform shaker HZQ-A (Hengrui Instrument and Equipment, Changzhou, Jiangsu, China) at 120 r/min for 12 h. Electrical conductivity (EL1)采用FE38电导率仪(metttler Toledo, Shanghai, China)测量。然后将冠样在120°C下蒸压30分钟,重新测量电导率(EL)2).的去离子水的电导率测定为EL。在给定的冷冻温度下的相对电解质泄漏计算如下:
LT的50冠的计算如下:
其中Y表示相对电解质泄漏,X表示冷冻温度,A,B和K是常数。
丙二醛、碳水化合物和氮化合物含量的测定
为了测定丙二醛、淀粉、总可溶性糖、总可溶性蛋白、总氨基酸和脯氨酸的含量,采用Draper [27], Yemm [28],sedmak [29],罗森[30.]和巨魔[31],按照相应的商用试剂盒(南京建城生物工程研究所,南京,中国)的说明。丙二醛与硫代巴比妥酸反应生成红褐色物质,在532 nm处具有最大吸光度值。因此,根据吸光度值计算丙二醛含量。用80%乙醇将淀粉从可溶性糖中分离出来,再用浓硫酸水解成葡萄糖。然后用蒽酮比色法定量葡萄糖,由葡萄糖浓度计算淀粉浓度。可溶性糖与浓硫酸和蒽酮反应生成蓝绿色衍生物,在620 nm处具有最大吸光度值。总可溶性糖含量由吸光度值计算。由- nhh反应形成的蓝色化合物3.+,考马斯亮蓝试剂在595 nm处有最大吸光度值。因此,以595 nm处的吸光度值计算总可溶性蛋白的含量。氨基酸与铜反应形成的蓝绿色化合物2+在650 nm处有最大吸光度值;因此,可用此方法计算总氨基酸含量。用磺基水杨酸提取脯氨酸。脯氨酸与酸性茚三酮反应生成的产物在650 nm处有最大吸光度值;因此,用这个值来计算脯氨酸含量。在确定了这些化合物的浓度后,它们的值根据根组织的水分含量归一化,如桑切斯[32].这种数据的正常化使我们可以在具有不同水分含量的群体之间进行有意义的比较。
无目标代谢组学分析
从第2 - 4阶段,6个生物重复进行代谢组学分析。各组分别命名为WD_1、2、3和WW_1、2、3。为研究水分亏缺对常温和低温抗冻性的影响,分别在WD_1与WW_1、WD_2与WW_2、WD_3与WW_3阶段和WD_2与WD_1、WD_3与WD_2、WW_2与WW_1、WW_3与WW_2阶段进行了对比。
代谢物提取
冰冻的树冠在液氮中磨成细粉。准确称量每个样品(60 mg粉末状冠组织),加入20 μl内标液(l -2-氯苯丙氨酸,甲醇制备,0.3 mg/ml)和0.6 ml甲醇:水溶液(7:3,v:v)提取代谢物。均质2 min,超声提取30 min,−20℃孵育20 min。4°C高速离心15分钟(17,540×g)。最后将上清液200 μl放入LC-MS样品瓶中进行检测。为了监测仪器分析的稳定性和重复性,质量控制样品通过从每个样品中汇集等体积的方法制备,这些质量控制样品与每个样品的等体积一起分析。质量控制样品定期插入,每7个样品后进行分析。
液相色谱-质谱分析
在LC-MS分析是使用超高效液相飞行质谱系统的色谱 - 四极时间(Waters公司,米尔福德,MA,USA)进行。For hydrophilic interaction LC separation, the samples were analyzed using an Acquity BEH C18 column (100 mm × 2.1 mm i.d., 1.7 μm; Waters Corporation). Separation was achieved using the following gradient: 5–20% B over 0–2 min, 20–60% B over 2–8 min, 60–100% B over 8–12 min, 100% B over 12–14 min, 100% B–5% B over 14–14.5 min, and holding at 5% B for 1 min, where B is acetonitrile [including 0.1% (v:v) formic acid], A is H2O [包括0.1%(V:V)甲酸],加B的总比例为100%。在分离过程中,流速为0.40mL / min,将塔保持在45℃,并注射体积为3.00μL。使用配备有正面或负离子模式的电喷雾电离源的TOF MS收集MS数据。毛细管,采样和碰撞电压分别为1.0 kV,40 V和6eV。离子源和溶剂去除温度分别设定为120℃和500℃,具有900L / h的脱溶气体流动。以50到1000收集质心数据 m / z扫描时间0.1 s,间隔0.02 s。
代谢物分离和生物信息学分析
使用加工软件代理QI(Waters Corporation)转换原料质谱数据,用于基线过滤,峰值识别,集成,保留时间校正,峰对准和均匀化。接下来,按照Sanchez描述的方法[32],所有峰值强度值均与根组织含水量归一化,以便不同组之间进行比较。最后,我们得到了一个包含保留时间、质量电荷比和峰值强度的数据矩阵(.xls)。采用SIMCA-P软件(V14, Umetrics, Umea, Sweden)对数据矩阵进行主成分、偏最小二乘判别和正交偏最小二乘判别分析。由正交偏最小二乘判别分析得到的变量对投影(VIP)值的影响阈值具有统计学显著性,结合学生t检验(P-value)的原始数据。VIP代谢产物> 1.5和P< 0.05被认为有统计学意义。使用人类代谢组数据库(Human Metabolome Database,http://www.hmdb.ca/),脂质地图(http://www.lipidmaps.org/),以及代谢物生物学作用(http://csbg.cnb.csic.cs/mbrole).然后,利用京都基因与基因组百科全书(KEGG,https://www.genome.jp/kegg/pathway.html)数据库。代谢产物分类,主要代谢途径检测和富集分析也进行了。
数据分析
生物量、丙二醛、碳水化合物、氮化合物和LT50数据进行两相之间,并使用SPSS 20.0(SPSS公司,Chicago,IL,USA)相内方差分析。多范围测试使用至少显著差异进行,差异被认为是显著的P < 0.05.
结果
地上部分和地下部分的干重
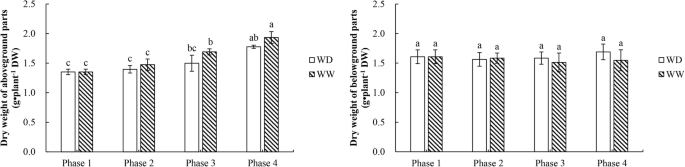
为了评价它的冰冻耐受性苜蓿的生长的影响,进行了测定(图地上的干重和地下部分。2).地上部干重在第1 ~ 4期显著增加,但在2个水控处理间差异不显著。地下部分干重在第1 ~ 4期变化不大,2个水控处理间无显著差异。
Semi-lethal温度
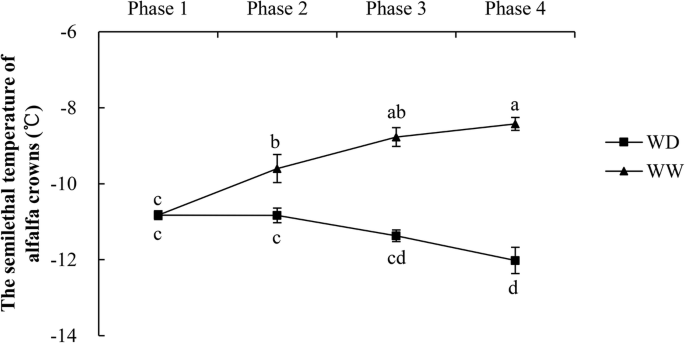
从阶段4末端的表型判断(图。3.(a-d), WW处理的苜蓿植株比WD处理的苜蓿植株受到更严重的损害,表现为叶片的相对电解质渗漏率较高(75% vs. 33%)。WD处理显著提高了紫花苜蓿的抗低温能力。如图1所示。4,LT的50在WW中,从第1阶段到第4阶段,冠数逐渐增加,而在WD中没有。在第二阶段结束时,LT50WD显著低于WW,暴露于4/0°C和−2/−6°C后差异增加。从第一阶段到第四阶段,LT50WW组的冠温度升高2.40°C (22.2%), WD组的冠温度降低1.19°C(11.0%)。常温条件下,水分亏缺提高了紫花苜蓿的抗冻性,低温条件下,抗冻性进一步增强。
丙二醛含量
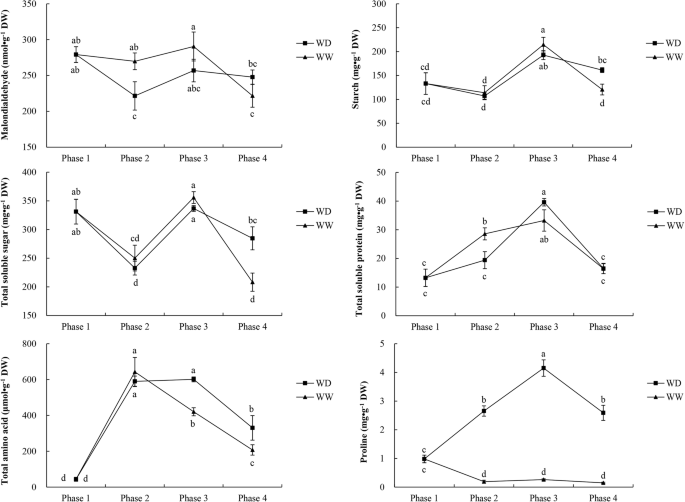
两种处理苜蓿冠中丙二醛的浓度如图所示。5.在第2阶段结束时,WW中丙二醛含量显著高于WD。而在第3和第4期结束时,两个水控处理的丙二醛含量差异不显著。
碳水化合物和氮化合物
在WD和WW处理期间,植物中包括碳水化合物和氮化合物在内的五种化合物的浓度如图所示。5.淀粉和总可溶性糖的含量在相3中增加并在阶段4中降低。在第4期结束时,WD的淀粉和总可溶性糖的含量显着高于WW。WW的阶段2末端的总可溶性蛋白质浓度显着高于WD。随后,WD中的可溶性蛋白质含量在相3中显着增加并且在第4阶段的两种处理之间的可溶性蛋白质含量下降显着差异。在WD中的总氨基酸含量较高比WW在WW中,在第3阶段的末端,WD中的含量明显高于WW,WD处理相比,WD治疗导致阶段脯氨酸含量的显着增加。WD中的脯氨酸含量增加在冷驯化期间(相3),然后在冷冻条件下降低(阶段4)。总的来说,在第2,3和4阶段结束时,脯氨酸含量显着(P < 0.05) higher in WD than in WW.
微分代谢物
微分代谢产物的分离
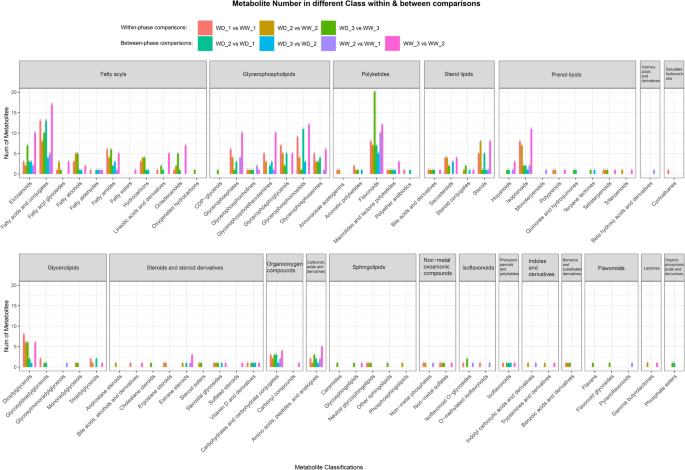
如图1所示。6,WD和WW之间的显着差异代谢物基于标准VIP> 1.5和P < 0.05. Table1和额外的文件1分别显示差异代谢物的数量和详细信息。在相内比较中,WD_1和WW_1中有3个差异代谢物上调,WD_3和WW_3中有25个差异代谢物上调。在相间比较中,WD_2对WD_1的差异代谢物上调量高于WD_3对WD_2的差异代谢物上调量,而WW_2对WW_1和WW_3对WW_2的差异代谢物上调量相近。7个对照组中差异代谢物上调的详细信息,包括分类和折叠变化,在附加文件中进行了总结2.
差异代谢物的分类
如图1所示。7,七个比较中的差分代谢物被分为20个类和72个子类。从总差分代谢物中的每个类别中的差异代谢物比例判断(附加文件3.),脂肪酰基,甘油脂,甘油,甘油磷脂,聚酮,戊酚脂质,类固醇和类固醇衍生物,甾醇脂质,羧酸和衍生物,以及有机氧化剂是最活跃的代谢物。在超类水平下,活性代谢物被分类为脂质和脂质状分子,以及羧酸及其衍生物,以及有机氧化合物。在亚类水平上,大约有18种活性差分代谢物,包括脂肪酸及其缀合物,黄酮类化合物,亚红糖苷,甘油磷膦,异戊二烯和碳水化合物和碳水化合物缀合物。总之,七种比较中鉴定的差分代谢物主要包括碳水化合物,氨基酸,脂肪酸,甘油磷脂和黄酮类化合物。
在三个相内比较中,上调的差异代谢物包括超类水平的脂质和类脂分子以及有机酸及其衍生物(附加文件)2).在亚类水平上,这些代谢物可分为二十烷类、脂肪酸及其缀合物、亚油酸及其衍生物、十八烷类、甘油磷酸丝氨酸、氨基酸和肽及其类似物。在本研究中,所有这些代谢物在缺水条件下均上调。
在4个阶段间比较中,在亚类水平上鉴定出34种上调差异代谢物。除了在相内比较中提到的代谢产物,其他上调的代谢产物包括甘油磷酸、甘油磷酸胆碱、甘油磷酸乙醇胺、甘油磷酸甘油、甘油磷酸肌醇、类黄酮、碳水化合物和碳水化合物缀合物。这些上调的差异代谢产物是脂质和类脂分子(在超类水平上),氨基酸,多肽和类似物,碳水化合物和碳水化合物缀合物(在亚类水平上)。所有这些代谢物在温度下降时都表现出丰度的增加。
KEGG分析
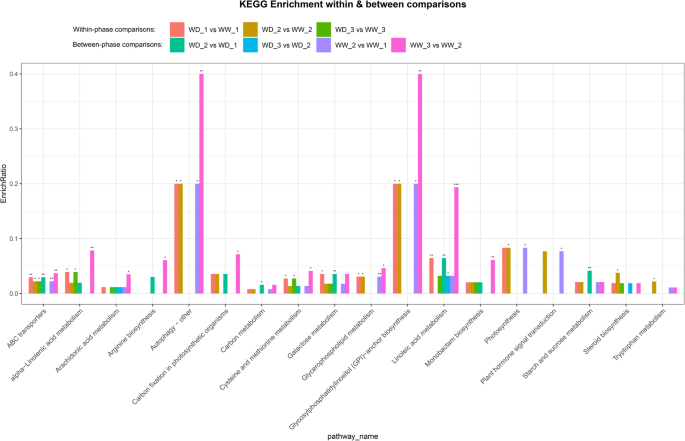
一些分离差的代谢产物有CID号,这使他们能够在KEGG数据库进行注释。共有18个突出信号通路被显著富集的(P < 0.05,P< 0.01,P< 0.001),鉴别出差异化合物(图。8).这些途径主要参与碳水化合物、不饱和脂肪酸、氨基酸和甘油磷脂的生物合成和代谢。KEGG分析确定的其他未显著富集的途径列在附加文件中4.
18个显著富集途径的富集比例。星号表示在的意义P< 0.05 (*),P< 0.01 (**)P < 0.001 (***). Within-phase and between-phase comparisons revealed pathways affected by water deficit and low temperatures, respectively. WW and WD: substrate moisture at 80 and 25% of water-holding capacity, respectively. WD_1, 2, 3 and WW_1, 2, 3 represent samples collected at the ends of phases 2, 3, and 4, respectively
主要途径涉及的差异代谢物
在阶级,参与18个突出途径中所涉及的差分代谢物包括非金属氧代苯胺化合物,甘油磷脂,脂肪酰基,有机氧化剂,类固醇和类固醇衍生物,羧酸和衍生物,以及吲哚及其衍生物(表2).在超类水平上,这些代谢物包括脂类和类脂分子、有机酸和衍生物以及有机氧化合物。在亚类水平上,主要是甘油磷酸胆碱、甘油磷酸乙醇胺、亚油酸及其衍生物、二十烷类、脂肪酸及其缀合物、氨基酸、多肽及其类似物、碳水化合物及其缀合物。
讨论
水分亏缺对膜透性和耐冻性的影响
前期研究表明,无论是在20/15°C(昼/夜)还是在低温/冻结温度下,田间持水量为25%的紫花苜蓿的抗冻性均高于田间持水量为60%和100%的紫花苜蓿,说明适度水分亏缺可增强其抗冻性[19].在这项研究中,LT50苜蓿中的WD治疗比WW治疗显著降低。在地上的变化和地下干重的分析证实,在LT的差异50在WD和WW之间的差异不是由苜蓿生长差异引起的(图。2).因此,我们的研究结果也支持了紫花苜蓿在常温下水分亏缺显著提高其抗冻性的结论,而在低温条件下这一效应会增强。
丙二醛水平反映了细胞膜脂质过氧化的程度[12.].在第2阶段末,WW和WD的丙二醛含量差异显著,而在第3和4阶段末差异不显著。在第2和第3阶段末,WW中丙二醛含量略高于WD。脂质过氧化对细胞膜的损害更大,WW的细胞膜通透性和细胞浆渗漏高于WD(图)。4).
生化变化与抗冻性的相关性
冷冻胁迫抑制植物细胞代谢和减少水的吸收,从而诱导脱水或渗透胁迫[33,34].以前的研究报告说,生化物质,包括与渗透调节有关的生物化学物质,当苜蓿暴露在低温下时,在皇冠和根茎中积聚[35,36,37].此外,先前的一项研究报道,紫花苜蓿的可溶性蛋白质含量受低温、冷驯化或冷冻影响[15.].在本研究中,虽然在冷驯化和冷冻(第3和第4阶段)过程中可溶性蛋白含量发生了显著变化,但在两个处理之间差异不显著。这表明可溶性蛋白对寒冷和冰冻有可测量的反应,但对水分亏缺没有反应。可溶性糖可以作为冷冻保护剂,通过防止突发性渗透休克和冰的形成,它们有助于在冷冻诱导干燥过程中稳定大分子和质膜的完整性[38,39,40,41,42].在这项研究中,WW和WD治疗之间的总可溶性糖含量显着不同。淀粉和总可溶性糖的含量减少在冷冻阶段4中,但是一些可溶性糖可能仍然被捕获在不溶性淀粉中,因此,不可用促进细胞的渗透潜力。苜蓿累积氨基酸,例如脯氨酸,响应于干旱胁迫而作为渗透调控分子的氨基酸[43,44].虽然脯氨酸在收购冷冻耐受性中的作用仍然不明确,但来自转基因实验的证据支持应激诱导的脯氨酸的适应性值[24].
将苜蓿暴露在低,非冻结温度(约0-5°C)诱导改善冷硬化的形态,生理和生化变化,并导致收购冷冻耐受性[45,46].在本研究中,植物在4/0°C(光/暗)条件下进行2 d的冷驯化处理。虽然总可溶性糖和总可溶性蛋白的含量在这一时期有所增加,但WW处理的紫花苜蓿植株的抗冻性没有显著提高。这可能是由于不适应环境造成的。即从24/20°C降至4/0°C(光/暗)后的4/0°C(光/暗)短期驯化(2 d)可能是不够的。然而,在该冷驯化处理(第3期)中,WD处理苜蓿的抗冻性显著提高,可能与脯氨酸含量的显著增加有关。在驯化过程中,WW和WD处理的总可溶性糖和总可溶性蛋白含量均有所增加。此外,在第4阶段结束时,WW和WD处理的可溶性糖含量差异显著。因此,可溶性糖也可能在提高紫花苜蓿的耐冻性方面发挥作用。4期低温暴露后,紫花苜蓿的抗冻性在WW期下降,在WD期增加,进一步证明水分亏缺提高了紫花苜蓿的抗冻性。
综上所述,水分亏缺和低温条件下,大豆可溶性糖和氨基酸(包括脯氨酸)含量增加。这些物质可能有助于提高在中度缺水条件下的抗冻性。
差异代谢物对抗冻性的贡献
微分代谢产物进行了分类,以评估在冷冻接受WD和WW处理厂之间的宽容他们的不同贡献。内相进行比较,以检测差动代谢物和苜蓿的两个水制度下的耐冻性之间的相关性。生物合成和脂质和脂质样分子和氨基酸,肽,和类似物的代谢显着增强,以及这些化合物的丰度水平的水分亏缺条件下增加的。质膜温度传感和重大伤害的暴露于低温的网站[7,47].低温将膜脂相从高度流体转变为一种刚性凝胶,在凝胶中脂类紧密堆积并高度有序。刚性凝胶相可以使膜更容易渗透,更容易破裂[48].然而,植物要想在寒冷环境中生存,就必须能够维持细胞膜的结构和功能的完整性。脂质成分的变化与质膜低温稳定性的变化有关[47,49].Glycerophosphoserines,一类甘油磷脂的,进行缺水条件下上调,如由内相比较来确定。甘油磷脂由磷酸盐和两种脂肪酸或脂肪醇[的50],是植物生物膜的主要成分[51].相内比较发现,两种不饱和脂肪酸,二十烷酸和亚油酸在缺水条件下上调。不饱和脂肪酸的存在可能有助于维持膜的流动性CIS.双键。不饱和脂肪酸比例的增加提高了冷或冷冻应激期间膜的完整性/稳定性和细胞功能[47,52].此外,极低温导致的冻伤也以质膜为靶点,较高的脂肪酸在膜脂中的比例可以增强膜的耐低温性和稳定性[53].脯氨酸甜菜碱,一个重要的渗透保护剂和苜蓿中确定的主要甜菜碱[54],在水缺勤治疗过程中也上调。因此,由于脂质组合物的变化和增加的渗透调节的结果,膜稳定性可能起到重要作用,以提高水 - 缺陷条件下苜蓿的冷冻耐受性。
了解代谢物和后续冷驯化耐冻性和冷冻温度之间的关系可以通过水分亏缺提高耐冻性的机制线索。在四之间相比较,上调的代谢物,主要是脂质和脂质样分子(在超电平),氨基酸,肽和类似物,和碳水化合物和碳水化合物缀合物(在子类级别)。除了在内部相比较所讨论的代谢物,碳水化合物(包括d-葡萄糖,棉子糖,麦芽四糖,麦芽三糖,和d-麦芽糖)和黄酮类化合物显示出在温度下降在丰度水平的增加。可溶性糖在增强,因为他们的冷冻保护功能的抗冻性起着重要的作用[38,39].据报道了类黄酮类药物的各种功能。例如,它们用作非酶抗氧化剂[55]缓解盐度引起的氧化应激[56,紫外光[56]和热[57].转录组修饰表明寒冷胁迫诱导的类黄酮生物合成增强也有报道素类l . (58].此外,在冷驯化过程中积累的黄酮类化合物对提高植物的抗冻性也有一定的作用拟南芥蒂利亚纳[59].在我们的研究中,我们检测到冷驯化和冻结期间上调差别的代谢产物。我们的研究结果表明,这些代谢产物在提高苜蓿的抗寒性起着重要的作用。
结论
在本研究中,连续水分亏缺处理显著提高了紫花苜蓿的抗冻性。总可溶性糖和总氨基酸(包括脯氨酸)含量的增加可能是造成乳酸含量差异的原因50在接受两种治疗的植物之间。The upregulation of lipids and lipid-like molecules (e.g., fatty acids, unsaturated fatty acids, and glycerophospholipids) and amino acids (e.g., proline betaine), as well as the enhancement of related metabolic pathways, may also have contributed to the enhanced freezing tolerance of alfalfa under water-deficit conditions. Other compounds that showed increased abundance levels at low temperatures included flavonoids and carbohydrates, such as D-maltose, D-glucose, raffinose, maltotetraose, and maltotriose. These results indicate that water management can improve the freezing tolerance of alfalfa and is an effective strategy to increase the winter survival of alfalfa crops in northern China.
缩写
- CID:
-
复合识别号码
- KEGG:
-
京都基因和基因组百科全书
- LC-MS:
-
液相色谱-光谱法
- LT.50:
-
半致死温度导致50%的细胞浆渗漏
- 贵宾:
-
对投影值的影响可变
- WD:
-
保持生长水分在25%持水能力的水分亏缺处理
- WW:
-
生长水分保持在80%保水能力的良好水分处理
参考文献
- 1。
李伟,王春华,李敏,王雪梅。拟南芥胞外脂质和塑质脂质在冷冻和冷冻后恢复过程中的差异降解。J Biol Chem. 2008; 283:461-8。
- 2.
Trischuk RG, Schilling BS, Low NH, Gray GR, Gusta LV。春油菜、冬油菜和冬小麦的冷驯化、脱驯化和再驯化:碳水化合物、冷诱导应激蛋白和春化作用的研究。Environ Exp Bot. 2014; 106:156-63。
- 3.
Stout DG, Hall WJ。不列颠哥伦比亚省内陆紫花苜蓿的秋季生长和冬季生存。植物学报1989;69:491-9。
- 4.
Korn M,Gärtnert,erban a,Kopka J,Selbig J,Hincha DK。预测拟南芥冷冻耐受性和杂种耐热性耐受性耐受性。莫尔植物。2010; 3:224-35。
- 5.
作者简介:陆志刚,男,博士,副教授。植物对寒冷的反应:小麦的转录组分析。acta botanica yunnanica(云南植物研究);2010;8:749-71。
- 6.
陈J,汉克,李商C J,张H,刘F,王J,刘备y . H,蛋白质组学分析揭示freezing-tolerant冷适应机制的差异,freezing-sensitive紫花苜蓿的品种。植物科学学报2015;6:105。
- 7.
托马斯休曼氏金融。植物冷驯化:抗冻基因及其调控机制。植物生理学报1999;50:571-99。
- 8.
Pembleton KC,Volenec JJ,Rawnsley RP,Donaghy DJ。Taproot成分和皇冠芽的分区受到紫红色的赤字的影响(Medicago Sativa.L.)。农作物科学。2010; 50:989-99。
- 9。
盖伊尔Cl。冷驯化和冷冻应力耐受性:蛋白质代谢的作用。Annu Rev植物植物植物Mol Biol。1990; 41:187-223。
- 10。
Janská A, Marˇsík P, Zelenková S, Ovesná J.寒冷压力和适应代谢调节的重要因素是什么?植物医学杂志。2010;12:395 - 405。
- 11.
uemura m,steponkus pl。植物中的冷驯化:脂质组合物与质膜的低温稳定性之间的关系。j植物res。1999; 112:245-54。
- 12.
胡y,Cao J,Liu P,Guo D,王Y,Yin J,Zhu Y,Rahman K.茶多酚与小鼠辐射诱导的血液化学改变组合的保护作用。植物素描妇。2011; 25:1761-9。
- 13.
杨勇,贾Z,陈楼桑Z,自然低温驯化和两个木兰科树种不同抗寒性deacclimation的马L.对比分析。Acta physiol植物。2015; 37:129。
- 14.
在低温下生长的植物的生理和分子变化。足底。2012;235:1091 - 105。
- 15.
Dhont C,Castonguay Y,纳多P,贝朗格G,德拉波R,拉伯格S,Avice JC,Chalifour FP。氮储备,春天再生和田间生长的苜蓿(苜蓿)在秋天落叶的越冬成活率。Ann Bot。2006; 97:109-20。
- 16.
陈H,李博士。低温,水分应激和短时间内的相互作用在红色OSIER Dogwood中诱导茎霜难度的诱导。植物理性。1978; 62:833-5。
- 17.
Siminovitch D,Cloutier Y.在冬季黑麦幼苗的垂直沉淀和干旱耐受的24小时诱导在室温下在黑暗中的室温下的冷冻胁迫。植物理性。1982; 69:250-5。
- 18.
Cloutier Y,Siminovitch D.在冬小麦和黑麦品种的冷和干旱引起的霜冻耐寒之间的相关性。植物理性。1982; 69:256-8。
- 19.
陈建平,李永华。土壤水分对紫花苜蓿耐冷性的影响。植物学报1980;60:139-47。
- 20。
张志强,张志强,张志强,等。干旱对co2浓度升高的影响2和温度对根瘤紫花苜蓿扦插前后主根氮和营养贮藏蛋白(VSP)积累的影响植物科学。2007;172:903-12。
- 21。
McKenzie JS, McLean GE。阿尔伯塔比弗洛奇苜蓿耐寒性连续五个冬天的变化。植物学报1980;60:703-12。
- 22。
夏播期、施氮和灌水量对紫花苜蓿(Medicago sativa L.)秋季VSP积累和春季再生动态的影响。中国农业大学学报2002;53:111-21。
- 23。
侯赛因MA,李Z,Hoque TS,伯里特DJ,藤田男,Munné博世S.热或冷启动引起的交叉耐受非生物胁迫的植物:主要监管机构和机制。原生质。2018; 255:399-412。
- 24.
Castonguay Y,贝特朗A,Michaud的R,拉伯格S.冷诱导的苜蓿人口生物化学和分子变化对耐冻性选择性地改善。农作物科学。2011; 51:21-32。
- 25.
红三叶草抗冻性的蛋白质组学分析(三叶草pratenseL.)。BMC植物BIOL。2016; 16:65。
- 26.
刘Z,杨G,李X,严Y,孙健,高R,孙Q,王Z.秋季休眠调控苜蓿的冷驯化(苜蓿)期间CAS18,VSP和CORF基因的表达。农作物牧场sci。2016年67:666-78。
- 27.
丙二醛作为脂质过氧化的指标。方法Enzymol。1990;186:421-31。
- 28.
Yemm EW, Willis AJ。用蒽酮估算植物提取物中碳水化合物的含量。j . 1954; 57:508-14。
- 29.
Sedmak JJ,格罗斯伯格SE。蛋白质快速,灵敏,和通用的测定采用考马斯亮蓝G250。肛门生物化学。1977; 79:544-52。
- 30.
一种改进的茚三酮比色法分析氨基酸。Arch Biochem biophysics . 1957; 67:10-5。
- 31。
巨魔W,LINDSLEY J.一种测定脯氨酸的光度法。J Biol Chem。1955年; 215:655-60。
- 32。
陈志强,王志强,王志强,等。大豆干旱适应的代谢组学研究进展。Plant Cell Environ. 2012; 35:36 - 49。
- 33。
Chinnusamy V,诸Ĵ,植物中基因表达的诸冷J.应力调节。趋势植物SCI。2007; 12:444-51。
- 34。
木犀榄(Olea europaea)品种的过冷抗冻性:质外体水分、溶质含量和细胞壁硬度的作用。植物学报。2015;38:2061-70。
- 35。
可溶性糖引发的耐寒性:一个多方面的对策。植物科学学报2015;6:203。
- 36.
Fowler S,Thomashow MF。拟南芥转录组分析表明除了CBF冷应激途径之外,还在冷驯化过程中激活多种调节途径。植物细胞。2002; 14:1675-90。
- 37.
KrasenskyĴ,Jonak C.干旱,盐和温度胁迫诱导的代谢重排和调控网络。J Exp Bot。2012; 63:1593-608。
- 38.
紫花苜蓿冠可溶性碳水化合物积累的酶控制。作物科学。1998;38:1183-9。
- 39.
Cunningham SM, Nadeau P, Castonguay Y, Laberge S, Volenec JJ。棉子糖和水苏糖的积累,半乳糖醇合酶的表达和对照苜蓿种质的越冬损伤。作物科学。2003;43:562 - 70。
- 40.
拟南芥原生质体中细胞内糖含量的改变改变了冻干诱导的膜损伤的发生率。植物学报2003;26:1083-96。
- 41.
Keunen E, Peshev D, Vangronsveld J, Van den Ende W, Cuypers A.植物糖是在非生物胁迫中氧化挑战的关键角色:扩展了传统的概念。植物学报。2013;36:1242-55。
- 42。
植物的冷信号传导和冷响应。中华医学杂志。2013;14:5312-37。
- 43。
水胁迫对结瘤紫花苜蓿脯氨酸和可溶性总糖含量的影响。杂志杆菌。1992;84:55-60。
- 44。
C, Bournoville R, Bonnemain JL。水分亏缺对紫花苜蓿韧皮部液中脯氨酸和其他氨基酸含量的影响。植物杂志。1996;111:109-13。
- 45。
Mohapatra SS,Poole RJ,Dhindsa Rs。苜蓿(Medicago Sativa L.CV.Saranac)的冷驯化,冷冻抗性和蛋白质合成。J Exp Bot。1987年; 38:1697-703。
- 46。
作者简介:葛瑞(1985 -),男,博士生导师。冷驯化和耐寒性:光和温度的复杂相互作用。植物杂志。1997;114:467 - 74。
- 47。
拟南芥的冷驯化:对质膜脂组成和冻害的影响。植物杂志。1995;109:15-30。
- 48.
Murata N, Los DA。膜流动性和温度感知。植物杂志。1997;115:875-9。
- 49.
Welti R,李伟,李男,桑Y,Biesiada H,周贺,Rajashekar CB,威廉姆斯TD,王X.剖析细胞膜脂质在植物胁迫反应:磷脂酶Dα在拟南芥冰冻引起血脂变化的作用。J Biol Chem。2002; 277:31994-2002。
- 50。
Ejsing CS,Duchoslav E,Sampaio的Ĵ,西门子K,邦纳R.自动识别并且由多个前体离子扫描甘油磷脂分子物质的定量。肛门化学。2006; 78:6202-14。
- 51.
王志强,王志强,王志强,等。一个全面的脂类分类系统。欧洲脂质科学技术。2005;107:337-64。
- 52.
Cyril J,Powell GL,Duncan RR,Baird WV。低温曝光响应海滨盆地膜极性脂质脂肪酸的变化。农作物科学。2002; 42:2031-7。
- 53.
Sung Dy,Kaplan F,Lee KJ,Guy Cl。获得极端温度的耐受性。趋势植物SCI。2003; 8:179-87。
- 54。
陈志强,陈志强,陈志强。nacl胁迫下紫花苜蓿脯氨酸甜菜碱的积累和代谢。植物杂志。2004;135:1583 - 94。
- 55。
德维Ĵ,Sanwal SK,Koley TK,米什拉GP,Karmakar P.变异豌豆中总酚和抗氧化活性(豌豆L.)基因型不同成熟度的持续时间,种子和花性状及其与产量相关联。SCI Hortic。2019; 244:141-50。
- 56。
Giovanni A,Stefano B,Lucia G,Francesco f,Alessio F,Massimiliano T.通过L.Vulgare叶中的UV辐射和根区盐度同样增强了黄酮类化合物的生物合成。J植物理性。2011; 168:204-12。
- 57。
曹d,李红,易Ĵ,张健,对缓解热应激的绿豆黄酮车H.抗氧化性能。Plos一个。2011; 6:e21071。
- 58。
蒂齐亚娜C,伊万娜P,戈弗雷多P,朱塞佩RR,安吉拉RLP。血橙对低温胁迫的表达分析:类黄酮生物合成途径的启示。基因。2011;476:1-9。
- 59。
黄酮类化合物是拟南芥耐冻性和冷驯化的决定因素。Sci众议员2016;6:34027。
确认
感谢上海美杰生物科技有限公司(http://www.majorbio.com/)寻求技术援助。感谢Edanz集团(中国)李文编集的Jennifer Smith博士和Lesley Benyon博士(www.liwenbianji.cn/ac),编辑这篇稿子的草案的英文文本。从汪吁榧,崔彦军和李玉英的支持也表示感谢。
资金
本研究得到国家重点研发计划(批准号:)资助。基金资助项目(批准号:2016YFC0500608-2);CARS-34)。资助机构对研究的设计、数据的收集、分析和解释或手稿的写作没有贡献。
作者信息
隶属关系
贡献
LXL和XHY对研究进行了设计和修改。XHY进行了研究并撰写了手稿。LZY在数据采集方面提供了帮助。TZY, HF, LXL协助撰写稿件。所有的作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
徐华,李志强,佟志强。等等。代谢组分析显示,某些物质有助于提高紫花苜蓿(Medicago Sativa.L.)连续水赤字后。BMC植物杂志20,15(2020)。https://doi.org/10.1186/s12870-019-2233-9
已收到:
接受:
发表:
关键词
- 冻结公差
- 紫花苜蓿
- 饲草
- 水分亏缺
- 代谢组学
- LC-MS.