- 研究
- 开放获取
- 发表:
盐诱导的细胞内囊泡贩运基因的表达,car-gtp,他们与na的关联+鹰嘴豆(Cicer Arietinum.l .)
BMC植物生物学体积20.文章编号:183.(2020.)
抽象的
背景
鹰嘴豆是一种重要的豆科植物,在生长季节对盐胁迫具有一定的耐受性。然而,耐盐的水平和机制在不同的品种和品种之间可能存在差异。一个大家庭car-GTP基因与植物胞内囊泡运输超家族基因同源,在植物应对盐胁迫中发挥重要作用。
结果
为了确定哪种基因家族成员参与鹰嘴豆盐应答,来自六种选定的鹰嘴豆植物(Genesis 836,Hattrick,ICC12726,Rupali,Slasher和yubiley)的植物暴露于盐度应力,并为专业解决了表达轮廓car-GTP基因在盐暴露5、9和15天后发生分枝。研究了基因分支表达谱(利用针对每个分支所有成员的简并引物)与植物生物量和Na等耐盐指标的关系+积累。13份成绩单中有11份carrt-PCR可以检测到曲折,但只有六个(Caraba2.,−B,−C,−D,−E和−H由于简并引物对包含多个基因成员的进化支表达量低或扩增效率低,因此可采用qRT-PCR进行定量分析。三个基因分支的表达谱,Carabb.,−D和−E,在所有6个鹰嘴豆品种中都非常相似,显示出一个高度协调的网络。Salt-induced增强Caraba2.第15天表达量呈极显著正相关(R2= 0.905)+积累在树叶。然而,与对照相比,以相对植物生物量产量估算的耐盐性与钠无关+在叶中积累,也不与任何研究的表达谱car三磷酸鸟苷的基因。
结论
协调的网络CaRab-GTP可能参与细胞内贩运的基因对鹰嘴豆植物的盐度应激反应很重要。
背景
的rab.-GTP基因家族编码小胍三磷酸酶(GTP) - 困扰蛋白,其与其他类似基因的群体一起存在,ARF.,跑,ρ和拉.rab.-GTPS在真核生物中普遍存在,并且参与细胞内的囊泡贩运。rab-gtp蛋白质存在于包括整个内膜系统(内质网,高尔基装置,溶酶体和内体)的所有细胞内膜上,以及核,线粒体,真空和血浆膜[1,2,3.,4,5].一些rab.-GTPS也是植物叶绿体膜的局部化[6].rabo - gtps执行多种功能,包括外吞和内吞作用、膜分化、细胞器发育、裂变和运动性、细胞分裂、信号传递和器官发生[7,8].GTP水解调节活性(GTP结合)和非活性(gdp结合)形式之间的转变[9].GDP / GTP交换蛋白或因子(GEPS或GEF),包括转运蛋白颗粒II(Trappii)和GDP解离抑制剂(GDI),增强和抑制两种形式之间的过渡过程[10].GDIs保留rabp - gtp在其gdp结合形式,这导致rabp - gtp从其膜分离,这与rabb护送蛋白(rep)和rabp - gtp的前酰基化,使rabp - gtp循环和重新定位到新的膜上,以进行多轮囊泡运输[10,11,12,13,14,15,16].
Rab-GTP蛋白调节的细胞内贩运过程对于植物发育至关重要,包括花粉管生长[17],果实成熟[18],豆类植物的根和根瘤发育[19,20.,21和下胚轴生长[22,并参与植物对各种生物[23,24,25]和非生物压力[26,27].植物rab.-根据预测的蛋白质结构,gtp基因可以分为9个可能分支中的8个[28],称为分支A-H [29,30.,31].
raba(rab11)成员调解之间的运输反式-高尔基网络和质膜。在拟南芥蒂利亚纳,Raba2a蛋白报告为Trappii的相互作用伴侣[10].拉巴-GTP基因直接参与植物对NaCl的反应,是植物耐盐所必需的基因。四个主要AtRabA1成员被淘汰了A. Thaliana.突变体行Raba1b.,导致盐度的过敏率[32,而转基因水稻则过度表达OsRabA(也称为OsRab11)与野生型植物相比显示较高的盐度耐受性[33].rabb.(rab2.)的成员也被证明对非生物压力有反应。SSRABB.(还SSRAB2.)的转录水平Sporobolus stapfianus响应脱水而增加,再水水后减少[34),而LfRab从复活节百合花百合formolongi由干旱和盐胁迫诱导[35].rabc.(rab18),rabd.(rab1.),rabe.(Rab8)基因在植物胁迫实验中研究较少。然而,在我们之前的研究中我们确定鹰嘴豆CARABC基因是响应盐度和快速脱水的高度表达,但通过干旱下调[36].在杨树中,体组成型活化的过表达ptrabe1b.在有盐的情况下生长加快[37].
rabf.(rab5.),rabg.(Rab7)主要调节液泡与前液泡间隔之间的运输[27,38,39,40,41].编码蛋白与栓系复合物相互作用,包括' Class C core vacuole/endosome栓系' (CORVET)和' Homotypic fusion and protein sorting ' (HOPS)复合物,介导贩运泡和靶膜[42].盐度对内吞作用和细胞内运输的影响已在前面进行了综述[43,44].在拟南芥,rabf.基因存在于早期核内体中,并参与了从高尔基体到液泡前室的运输[45,46,47].AtRabF(AtRab5)编码ARA6蛋白,其在盐胁迫中具有功能性作用[5].在MESEMBRYANTHEMUM CRYSTLINUM,的转录水平mcrabf.(也称为McRab5b)增加了3天的盐胁迫,但对叶衰竭和渗透压并不反应[48.].rabg.也是跨不同物种的非生物压力的关键因素。转录水平的OsRabG(OsRab7),AlRabG(AlRab7)在水稻和盐生禾草中因脱水和盐分而上调Aeluropus lagopoides., 分别 [49.,50.].超表达的内源性rabg.基因导致增强盐度耐受性拟南芥(AtRabG[51.]), 白饭 (OsRabG[52.])和花生(Ahrabg.[53.),),而表达rabg.来自非生物耐逆境植物的基因狼尾草glaucum(一种耐旱的谷物作物)Prosopsis juliflora(一种豆科植物)烟草也具有耐盐性(PGRABG / PGRAB7.和pjrabg./PJRAB7.[54.,55.])。rabh.基因没有得到尽可能多的研究,而是两个拟南芥基因,AtRabH1b和AtRabH1c都被证明局限于高尔基人拟南芥和烟草植物,前者也有一个不确定的隔间[56.].AtRabH1b最近还显示出调节端膜隔室和质膜之间的纤维素合酶复合物的贩运[22].
如上所述,存在许多盐诱导的表达的实例rab.-GTP基因及改善植物过度生产Rab-GTP蛋白的盐度耐受性。转基因拟南芥,水稻和烟草过度表达rab.-GTPs在盐胁迫下也会在植物组织中积累更多的钠[51.,52.,55.],过表达系的根尖泡数量增加。这表明耐盐性的提高不是由于钠的排除,而是由于隔离。除了增加内吞率和钠+在根和芽的液泡中积累拟南芥过表达系也显示活性氧(ROS)水平下降,可能是由于NADPH氧化酶活性下降[51.].
的rab.鹰嘴豆的gtp (Cicer Arietinum.)很少受到关注,但最近的基因组序列和转录组数据库的可访问性使得可以识别54car基因[36,代表八种植物中的每一种rab.-GTP分类:24卡巴基因,3Carabb., 5CARABC, 4克拉布, 5纳拉豆, 2CARABF.7骗子和图4Carabh.基因。大卡巴基因思工进一步分为亚片(8Caraba1., 4Caraba2., 2Caraba3., 5Caraba4.3Caraba5.和2Caraba6.基因)。Khassanova等。[36也报道说CARABC基因受非生物应激,特别是盐度和干燥的高度调节。本研究的目的是确定哪个其他car基因在C. arietinum.并找出应对盐度胁迫的关键因素。根据鹰嘴豆的商业用途和耐盐性选择了6个鹰嘴豆品种[36,57.,58.].
结果
鹰嘴豆在盐存在下的生长
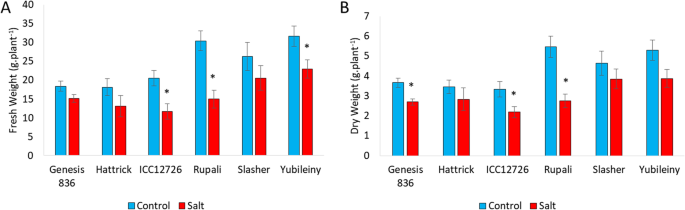
6份鹰嘴豆种质在NaCl胁迫下均表现出一定程度的生长障碍,表现为鲜重(FW)和干重(DW)下降。1),以及包括褪绿、褐变和衰老在内的视觉症状(附加文件)1,图S1-S2)。
1个月的盐暴露后,CV植物。Rupali受到最严重影响的,只保留了相对于在控制条件下种植的植物的FW和DW的50%。两种加入,ICC12726和yubiley,被判断为对盐度的适度敏感,而Genesis 836和Slasher保持相对不受影响并耐盐。Hattrick的植物并未显示重量受损,但在视觉上受到毒性的清晰症状(附加档案1,图。S2)。
Na的积累+和K+在鹰嘴豆植物的叶子中
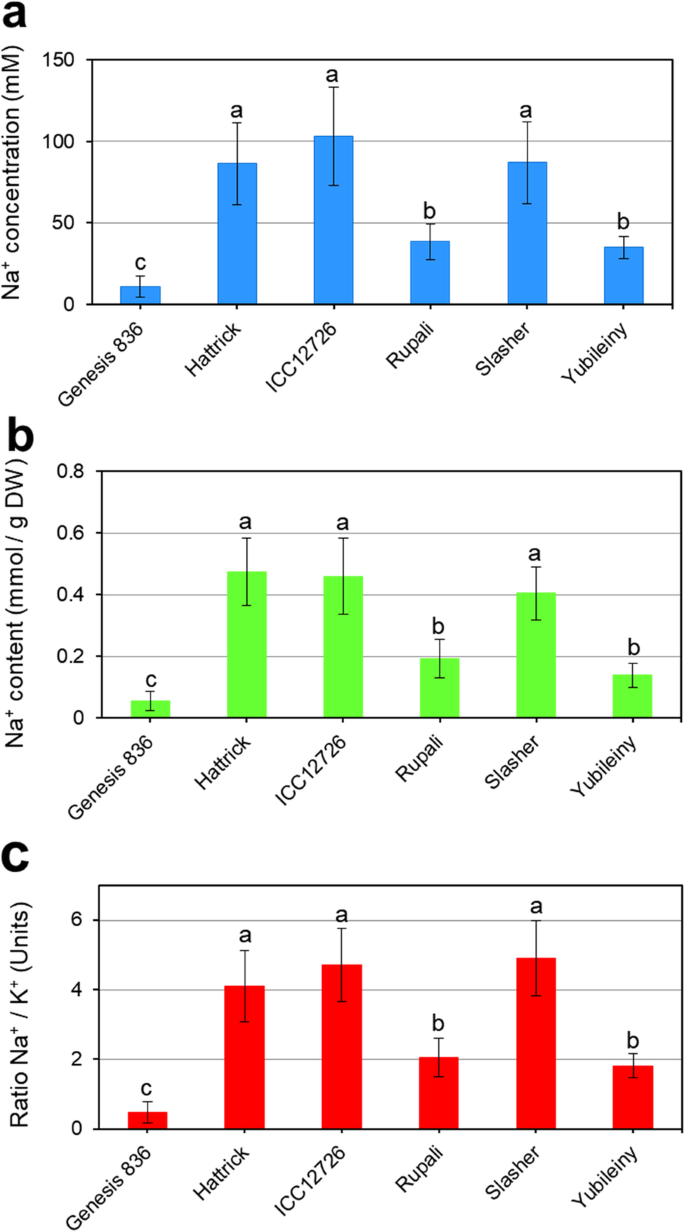
Na水平+和K+在NACL应用后1个月的植物中,在最年轻的叶子中测量了最年轻的叶子。复制植物之间存在相当大的变化,这可以解释在其他测量中看到的一些可变性。尽管如此,明显的趋势是明显的,NA差异高达10倍+钠在鹰嘴豆品种汁液中的含量最高,最低+.创世纪836的植物含有Na的最低浓度和含量+,10毫米(图。2a)和0.05 mmol/g DW(图1)。2b)和na+/ K+比率(0.5)较低(图。2C)。相比之下,Hattrick的植物,ICC12726和Slasher都非常高+水平可达100 mM,约0.5 mmol/g DW+/ K+最高可达4.5的比率。鲁佩尼和yubileiny有低于中度的na+水平(约40毫米钠+SAP中浓度和0.15-0.2 mmol NA+含量/g DW), Na含量适中+/ K+比率(约为2.0)(图。2).因为Na的两种计算方法之间没有显著差异+积累(在SAP和干燥的叶样品中),我们使用NA+/ K+比率作进一步的相关分析。
分析car基因表达
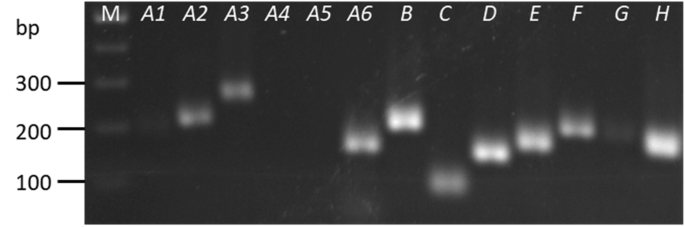
以前的工作已经建立了一个分类系统car-GTP基因家族[36].至少有54个car基因,简并引物的设计是针对每个主要分支或亚分支,而不是单个基因,通过针对分支成员之间的最高同源区域(附加文件1,图。S3)。除了与密切相关的所有片域的底漆集,获得了预期尺寸的产品Caraba4.和−A5(图。3.).引物的演化支Caraba4.和−A5非常堕落。除了除了所有剩余的片断之外,可以获得具有适当验证QPCR效率的引物Caraba3.和−A6.CaRabA1−F和−G低于量化限制,因此无法测量。Caraba2.,−B,−C,−D,−E和−H扩增良好,引物效率高,可用于qPCR。
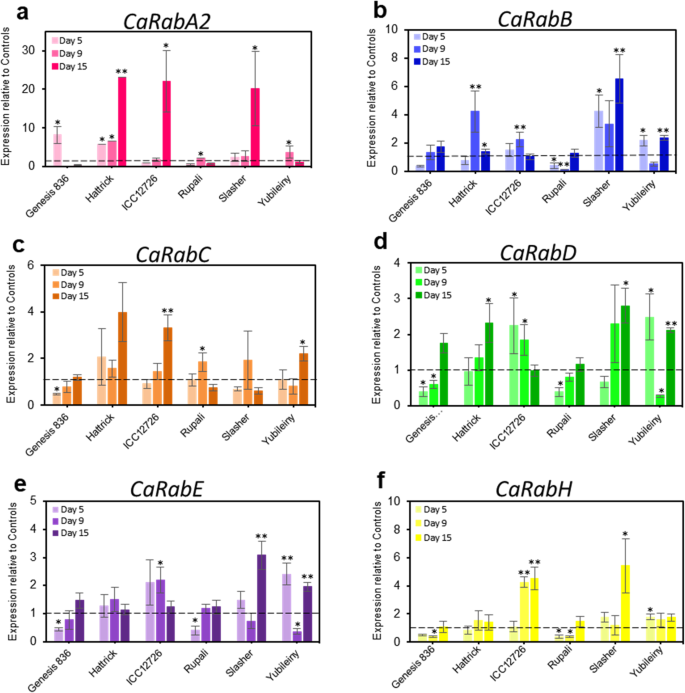
利用qRT-PCR对6个鹰嘴豆基因型在盐胁迫或不盐胁迫下生长的叶片中的转录本进行了定量分析(图2)。4).的转录水平car基因演化支A2,B,C,D,E和H在三个时间点测量:‘early’(第5天;从第一次施盐开始5天开始收集)、“中期”(第9天)和“后期”(第15天)。由于短暂的性质rab.基因调控、早期采样时间点是获得基因良好表达谱的必要条件。
定量RT-PCR分析car在盐胁迫(90mm NaCl)下,6份鹰嘴豆材料的基因发生了变化。盐处理对基因转录水平的影响:(一种)Caraba2.;(b)Carabb.;(C)CARABC;(d)克拉布;(e)纳拉豆;和(f)Carabh..根据首次加盐后的天数,在三个时间点采集样品。基因表达数据使用相对于两个内参基因转录水平的平均单位进行归一化,CAHSP90、热休克蛋白(GR406804)和CaEf1α延伸因子1- α (AJ004960)。条形图代表相对于所有时间点的控制设备的方法,它们被设置为1个单位,并由虚线表示。*p < 0.05, **p< 0.01基于对照和盐组个体基因型的双向方差分析和事后Tukey检验(n= 4-8±s.e.m.)
各种表达car基因分支成员因基因型不同和对盐的反应不同而不同。然而,Caraba2.在Hattrick,ICC12726和Slasher的后期时间点,表达显着强度强烈地强大(约20倍)。积极,但不太明显,表达的变化Caraba2.在盐胁迫的早期,其他品种也有同样的表现(图。4一个)。
片状成员的表达,Carabb.,−D和−E在大多数鹰嘴豆的种类和时间点上是相似的(图。4b, d和e)。例如,在创世纪836和鲁帕利,表达Carabb.,−D和−E而Yubileiny在早、晚两个时间点出现双峰表达,在中间时间点显著下降。Hattrick、ICC12726和Slasher表现出更多可变的,但仍然显著的上调Carabb.,−D和−E一个或多个时间点的基因。Pearson的相关性分析证实了高相似性(R2= 0.640 - -0.754,p< 0.01)的表达趋势。
除了创世纪836,表达CARABC在所有研究的鹰嘴豆种群中都是相似的,显示出显着但变化,在不同的时间点增加,特别是在Hattrick,ICC12726和yubileiny的后期时间点2-4倍(图。4C)。找到了非常不同的表达方式Carabh.在《创世纪》836和Rupali中表达下调,也观察到Carabb.,−D和−E,而Yubileiny、ICC12726和Slasher在早、中、晚3个时间点表达增加(图2)。4f)。
na的相关分析+积累和car基因表达
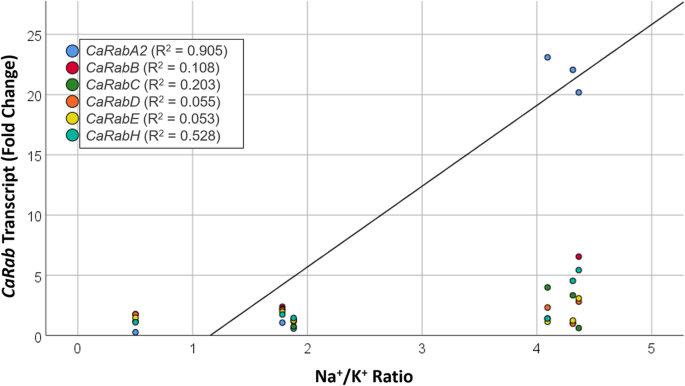
采用线性回归分析进一步探讨两者之间的关系car基因表达,Na+六种鹰嘴豆栽培品种积累和盐度耐受性。将所有基因和单个基因之间的表达与生物量和Na进行比较+/ K+数据。很强的相关性(R2= 0.905,p < 0.01) was observed between the Na+/ K+的表达谱Caraba2.在盐胁迫15天后(图2)。5).na之间没有观察到显着的相关性+/ K+比例和任何其他基因或时间点。同样,相对生物量与任何基因在任何时间点均无显著相关。
讨论
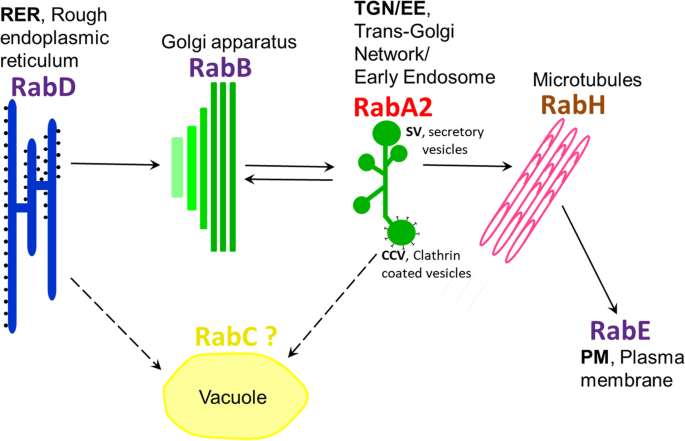
先前的研究与拟南芥研究表明,rabp - gtp多肽存在于几乎所有的胞内膜上,似乎参与了重要物质胞内运输的协调网络。有些还受转运蛋白颗粒II (Transport Protein Particle II, TRAPPII)系统调控,该系统促进GTP和GDP之间的交换,从而激活或抑制rabp -GTP [10,59.].为此网络生成的模型基于来自的证据拟南芥在非应力条件下生长的组织[10,40,60.].最新型号[10Rabd蛋白质与粗糙的内质网(RER)有关,而Rabb和Raba在Golgi和反式-GOLGI网络/早期内肢组(TGN / EE)。Rabd和Raba2 Clades的成员由Trappii调节。由TGN / EE产生的分泌囊泡(SV)沿着兔子指导的微管输送,然后在由Rabe控制的质膜处停靠。Clathrin涂覆的囊泡(CCV)也由TGN / EE产生,但这些囊泡在Rabf和Rabg的控制下直接转移到真空中。
在本研究中,代表13中的11个成绩单car检测到基因片状,但只有六种QRT-PCR可以量化六种。其中五片枝条(Caraba2.,−B,−D,−E和−H)含有同源基因拟南芥[10],除了CARABC.这并不奇怪,因为双子叶植物物种喜欢A. Thaliana.和C. arietinum.拥有非常相似的基因。rabc.,在植物文献中很少受到关注,此前已显示鹰嘴豆对非生物胁迫作出反应[36].六种表达谱car获得基因片材,以致盐度耐受性不同的六种鸡斑,定义为相对于在土壤中暴露于90mM NaCl的10mM NaCl后的对照植物的盐处理植物的生物量。
虽然每次加入都有一种特定于基因型的模式car-GTP基因表达,表达三种基因曲线,Carabb.,−D和−E因此,无论生长条件如何,这些基因都可能作为一个协调网络的一部分。这三个分支的共同调控可能反映了它们参与了囊泡从高尔基体和RER到质膜的运输。而表达这“三重奏”中的个别成员car-GTP基因在每次加入中强烈协调,在六种载体中,它们的表达模式在六种过程中完全不同。例如,它们对Genesis 836的盐度的反应与yubileiny的盐度非常不同。这可能反映了鹰嘴豆植物的含量非常不同的背景,导致基因型特异性反应,但也可以反映植物对盐的多刻度反应,这涉及许多其他基因[61.].
表达Caraba2.基因思工与NA表现出强烈的正相关+积累(无花果。5).三种鹰嘴豆品种hat、ICC12726和Slasher积累了较高的Na+在叶子中(图。2),Caraba2.NaCl处理15 d后,这些品种的表达显著增强(约20倍)。其余3个品种,创世纪836、鲁帕里和Yubileiny, Na含量均较低+积累,Caraba2.基因表达未上调(图。4).确切的作用Caraba2.在Na+叶子的积累尚未确定,但是拉巴一般认为会员在反式-GOLGI网络和等离子体膜[60.].因此,我们可以推测Caraba2.控制SV和/或CCV的形成,包封细胞溶溶胶NA+并将其贩运到血浆膜,液泡或两者。似乎是上调的Caraba2.纳米累积后发生的表达+在叶细胞的细胞质中,最多15天占最大响应。这可能导致增加Caraba2.TNG / EE的蛋白质伴随着Na的能力增加+转移到细胞的其他部分。
由于放大效果差,放大效率低CARABF.和骗子,从我们的实验中不可能对这些基因支的表达及其在鹰嘴豆植物对盐胁迫响应中的作用做出结论。CaRabF和CaRabG蛋白定位于液泡前隔间和膜并控制到液泡的运输[38,39,41].他们在贩卖罗人方面也很重要+离子,基于转基因研究[5,51.].有趣的是,在盐存在下,本地化拟南芥RabF蛋白ARA6从液泡前室转移到质膜[5],建议贩运的双向方向性,依赖于细胞环境。尚不清楚这种现象是否发生在植物中的其他Rab-GTP蛋白。
一些rab.-GTP过表达的研究发现,植物存活率的提高伴随着高钠+积累(51.,52.,55.],表明封存是耐盐性的有效手段,Rab-GTP贩运对NA很重要+上解决。然而,rabo - gtps对Na的增强作用具有不同的功能和特定的机制+搬迁可能有所不同。例如,rab.定向贩卖罗+- 诱导囊泡可以从血浆膜到液泡中拟南芥细胞培养(62.].此外,rabo - gtps参与酵母和哺乳动物细胞内核内体、液泡前间隔和液泡的融合[63.,64.,这可以按照建议增加存储容量拟南芥AtRabG超表达行(51.].此外,rabg - gtp蛋白还参与了新的膜材料的传递,如离子通道或转运体,这些材料反过来可以调节Na+和Cl-在不同的膜上运输,如哺乳动物上皮细胞所见,其中破坏与囊性纤维化有关[65.].
虽然三个鹰嘴豆植物展示展示了高NA+叶片中的积累,另外三个(创世纪836,鲁普利和yubileiny)似乎是“钠排除者”,基本上不那么少+在他们的叶子里(图。2).排除NA.+在创世纪836中,从叶子中提取的效果是hatattrick、ICC12726和Slasher的10倍。根据我们的观察,另一项研究表明耐盐的Genesis 836是一种有效的钠+而对盐敏感的Rupali积累的Na含量略高+.也有不同的细胞间积累模式,其中创世纪836分隔了Na+而Rupali则积累了Na+在所有类型的细胞中,对光合作用速率和植物健康造成损害[57.,58.].Na的重定向+Genesis 836中的特定细胞类型可能涉及Rab-GTP蛋白,其可以交通na+离子从细胞溶溶胶到血浆膜以细胞类型特异性方式排出,或增加Na+同时抑制钠进入上皮细胞+摄入到叶肉细胞。在我们的实验中,Genesis 836显示了早期的,短暂的增强Caraba2.rupali在任何时间点没有显示出对该基因的任何上调。既然是其他car基因在这两个品种之间表现出相似的反应,Caraba2.基因对于调节NA可能是重要的+创世纪836叶片不同细胞类型之间的重新定位。需要进一步的研究来确定来自的四种基因中的哪一个Caraba2.Clade负责这一点,并探索其他鹰嘴豆外部的细胞间隔,高响应Caraba2.基因的表达。确定哪种类型的囊泡(即SV或CCV)受其调控也很重要Caraba2..无论这些问题的答案如何,我们的研究表明表达了Caraba2.与Na+积累在树叶。
基于鹰嘴豆山区未发现的新关系,我们提出了一种略微调整的植物RAB-GTP贩运模型,其浓稠于盐胁迫(图。6).在这个模型中,我们提出TGN/EE的膜泡不仅在RabH和RabE的指示下向质膜动员,而且在RabA2的指示下向液泡和/或质膜动员。这可以促进Na+通过直接沉积过量Na,在液泡中螯合+从胞嘧醇或将离子输送通道递送到液泡中,用于增强NA+吸收。这两个过程都是通过ccv介导的。质膜的分泌,通过svv实现随后的细胞间区隔化,也可能是重要的。
尽管上述观察结果,但应该注意的是,盐度耐受性本身(估计为生物量产生相对于对照植物)与任何NA都不相关+这六种中的任何一种的积累或表达模式car基因片。这表明na+积累本身并不能保证鹰嘴豆的耐盐性,而只是许多不同机制中的一种,可能涉及到更多的基因。尽管如此,Na+叶片的积累及其与Caraba2.基因表达,以及基因型依赖的稳定表达Carabb.,−D和−E在这里报告,指出一个角色的细胞内贩运carGTP基因在耐盐表型中。
结论
car-GTP基因的表达模式表明,在盐胁迫下,鹰嘴豆细胞内运输的协调网络是起作用的Carabb.,−D和−E有非常相似的表情。这“三重奏”可能形成通过内体系统的主要运输路线。自从Caraba2.响应盐与Na强烈相关+在叶片中积累,在贩运环境条件时可能更重要。这确认了以前的报告表明了重要作用car鹰嘴豆植物对盐度响应的基因家族。
方法
植物材料
鹰嘴豆品种,Hattrick和Slasher,由澳大利亚Pulse育种公司开发,授权给Seednet,并在澳大利亚作为商业品种使用。种子由悉尼大学(澳大利亚)的Helen Bramley慷慨提供。种质资源Genesis 836和Rupali是根据以往研究中对比的耐盐性选择的[57.,66.].创世纪836起源于ICARDA(国际干旱地区农业研究中心,叙利亚)。Rupali来自西澳农业部和GRDC(澳大利亚),获得AWB种子公司(澳大利亚)的许可。ICC12726来自ICRISAT集合(印度)。Genesis 836、Rupali和ICC12726种子由澳大利亚阿德莱德SARDI-PIRSA的Tim Sutton提供。Yubileiny原产于俄罗斯Krasnokutskaya育种站,是鹰嘴豆本地田间试验的标准品种。种子由哈萨克斯坦农业技术大学提供。
植物生长与盐胁迫
试验在澳大利亚阿德莱德(Adelaide)的直径18厘米的花盆中进行,花盆内衬塑料袋,并装入2.6公斤BioGro土壤混合物。种子在装有湿润Whatmann纸的培养皿中发芽5天,然后用人工接种根瘤菌(NodulAid,巴斯夫,澳大利亚)将幼苗移栽到盆中(每盆4苗)。盆栽植物在有土壤的控温温室中生长1个月,昼夜温度为25°C/20°C,使用16 h LED生长灯(~PAR 500) (Heliospectra AB,瑞典)。花盆每周浇水两次,保持土壤水分水平在田间容量的80%。
对于盐应激,将150ml 190mM NaCl施加到每个罐中,每次增加四次,每天两次,2天。基于80%现场容量的可用土壤水分,实验中的计算水平达到了90毫米NaCl,在上次施用后达到90毫米NaCl,并保持直至实验结束。在对照盆中,使用不具有NaCl的相同的自来水在相同的时间表中使用。没有补充的Cacl.2由于土壤中有效钙含量充足,所以在对照植株中没有明显的缺钙症状。
盐胁迫和植物生物量生产的视觉症状
在整个实验过程中拍摄图像,以记录对照和盐处理植物的视觉差异,包括叶片褪绿、褐变和衰老、茎杆硬度下降和植被减少。
自上次盐施用以来每月1个月测量新鲜的重量(FW)和干重(DW),在每个治疗组中使用八种植物的整个芽。植物在芽的底部切割,称重,然后在80℃的烘箱中干燥2天,然后测量干重。样品也被用于来自这些植物的火焰光度法。
火焰光度法对Na+和K+测量在叶子
在1个月的盐暴露后收获生物质之前,从植物中收集最小的完全发达的叶子。来自主要拍摄的两片叶子从每株植物汇集,制作八个生物重复。记录FW和DW,后者在80℃下干燥样品2天后。DW和组织SAP(FW-DW)都用于计算NA+和K+根据先前公布的谷物测定方法测定的叶片样本含量[67.].在10ml 1%HNO中消化叶样品3.在80°C下放置4小时。钠和钾离子浓度用火焰光度计(Sherwood, UK,模型420)测量,并以浓度(mM在植物汁液中)或含量(每克DW)表示[68.].
RNA提取,cDNA合成,半定量PCR和qPCR分析
在末施盐后第5、9和15天,从每组对照和盐处理盆中随机选取4株(4个生物重复)。两片发育完全的幼嫩叶片被快速冷冻在液氮中,并储存在−80°C。
冷冻叶片样品用氮冷不锈钢球轴承剧烈旋转研磨。按照前面描述的方案,使用trizol样试剂提取RNA [69.].在DNase治疗(NEB Biolab,England)之后,使用Protoscript-II逆转录酶试剂盒(Neb Biolab,England),2μgRNA逆转录。用水(1:10)稀释的cDNA样品用于半定量RT-PCR和QRT-PCR分析。对于半定量RT-PCR,将来自所有样品的cDNA合并在一起并用作含有1.8mM MgCl的反应中的模板2,0.2mm DNTP,每种引物的0.25μm和1.0单位的Go-Taq DNA聚合酶(Promega,USA)。用以下程序进行扩增:94℃2分钟;30℃的30次,10 s,55℃,10 s,72°C为15秒;和最终延长在72°C延长1分钟。使用Geldoc系统(Biorad,USA),在含有Gelred(Biotium,USA)的1.5%琼脂糖凝胶中,在含有Gelred(Biotium,USA)中的1.5%琼脂糖凝胶中的可视化。扩增子大小在88和210 BP之间变化,并在附加文件中存在关于引物的信息1(表S1)。
对于qRT-PCR表达分析,KAPA SYBR Fast Universal Mix (KAPA Biosystems, USA)根据先前描述的方案,在Real-Time qPCR系统CFX96 (BioRad, USA)中使用[70].靶基因表达水平相对于两个内参基因转录水平的几何平均值进行归一化:HSP90.、热休克蛋白90 (GR406804)和CaEf1α,延伸系数1-alpha (AJ004960) [71.].相对转录水平car用于定量RT-PCR分析的基因见附加文件1(表S2,图S4)。
统计分析
采用Excel 365 (Microsoft)和SPSS 25.0.0.0 (IBM)软件包,采用未配对法计算分析均数、标准误差和显著性水平t-检验、方差分析和Pearson相关函数。
缩写
- 闭路:
-
Clathrin-coated囊泡
- 轻型护卫舰:
-
C级芯液泡/内体系列
- DW:
-
干重
- 情感表达:
-
早期内部组
- 弗兰克-威廉姆斯:
-
鲜重
- GDI:
-
胍二磷酸酶解离抑制剂
- GDP:
-
胍二磷酶
- GEF:
-
国内生产总值(GDP) /三磷酸鸟苷交换因素
- 创业计划:
-
国内生产总值(GDP) /三磷酸鸟苷交换蛋白
- 三磷酸鸟苷:
-
胍三磷酸酶
- 跳:
-
均型融合和蛋白质分类
- 代表:
-
Rab护送蛋白质
- r:
-
粗面内质网
- ROS:
-
活性氧
- SV:
-
分泌囊泡
- TGN:
-
反式高尔基网络
- TRAPPII:
-
转运蛋白颗粒II
参考
- 1.
基于GTP-binding的dna编码的33个不同的小蛋白的鉴定莲花japonicus.,以及根结节发育过程中相应mrna的表达。植物j . 1997; 11(2): 237 - 50。https://doi.org/10.1046/j.1365-313x.1997.11020237.x..
- 2.
Stenmark H, Olkkonen VM。Rab GTPase家族。基因组医学杂志。2001;2:3007。https://doi.org/10.1186/gb-2001-2-5-reviews3007.
- 3.
我们。rabo -护航蛋白/鸟嘌呤核苷酸解离抑制剂超家族的分子进化。中国生物医学杂志2003;14:3857-67。https://doi.org/10.1091/E03-04-0227.
- 4.
Schwartz SL,Cao C,Pylypenko O,Rak A,Wandinger-Ness A. Rab GTP酶一目了然。J Cell SCI。2008:3905-10。https://doi.org/10.1242/jcs.03495.
- 5。
作者简介:田志刚,男,博士,主要研究方向为生物力学。植物特异性RAB GTPase ARA6调控的膜转运途径。细胞生物学杂志。2011;13(7):853-9。https://doi.org/10.1038/ncb2270.
- 6。
GTPases在叶绿体囊泡运输中的作用。植物科学学报。2014;5:472。https://doi.org/10.3389/fpls.2014.00472.
- 7。
Zhen Y,Stenmark H. Rab GTP酶的细胞功能一目了然。J Cell SCI。2015; 1218:3171-6。https://doi.org/10.1242/jcs.166074.
- 8。
Kirchhelle C, Chow C, Foucart C, Neto H, Steirhof Y, Kalde M,等。植物rabb GTPase对几何边的确定是植物器官发生过程中细胞模式形成的基本原理拟南芥.DEV细胞。2016; 36:386-400。https://doi.org/10.1016/j.devcel.2016.01.020.
- 9。
马歇尔CJ。蛋白质戊烯化:蛋白质 - 蛋白质相互作用的介体。科学。1993年; 259(5103):1865-6。https://doi.org/10.1126/science.8456312.
- 10.
Kalde M, Elliott L, Ravikumar R, Rybak K, Altmann M, Klaeger S, et al.;拟南芥转运蛋白颗粒(TRAPP)复合物与Rab GTPases的相互作用。植物j . 2019。https://doi.org/10.1111/tpj.14442.
- 11.
Muñoz FJ, Esteban R, Labrador E, Dopico B.一种新的鹰嘴豆rabg - gdi cDNA在幼苗中的表达。植物生理与生物化学。2001;39:363-6。
- 12.
小的gtp结合蛋白。杂志启;2001 81(1):153 - 208。https://doi.org/10.1152/physrev.2001.81.1.153.
- 13.
Yaneva I,Niehaus K.来自RAB结合GDP-解离抑制剂的分子克隆与表征Medicago truncatula.植物生理与生物化学。2005;43:203-12。https://doi.org/10.1016/j.plaphy.2005.01.019.
- 14.
Wu Y, Tan K, Waldmann H, Goody RS, Alexandrov K. study of preylated Rab GTPase with Rab escort protein and GDP解离抑制剂的相互作用分析解释了这两种调控因子的必要性。《美国国家科学院学报》上。2007; 104(30): 12294 - 12299。doi: 10.1073 _pnas.0701817104。
- 15.
刘志,罗晨,李玲,董玲,灿五。GDP解离抑制蛋白基因的分离、鉴定及表达分析MiRab-GDI从Mangifera indica.L. SCI HORTIC。2015; 185:14-21。https://doi.org/10.1016/j.scienta.2015.01.008.
- 16。
Martín-Davison AS, Pérez-Díaz R,索托F,马德里-埃斯皮诺萨J, González-Villanueva E,皮萨罗L,等。的参与SchRabGDI1从Solanum Chilense.在内吞转运和耐盐胁迫方面。植物科学。2017;263:1-11。https://doi.org/10.1016/j.plantsci.2017.06.007.
- 17。
Rab11 gtpase调控的膜运输对烟草花粉管顶端聚焦生长至关重要。植物细胞。2005;17:2564 - 79。https://doi.org/10.1105/tpc.105.033183.
- 18。
Lawson T,Mayes S,Lycett GW,Ch CF.植物兔子和果实成熟的作用。Biotechnol Genet Eng rev. 2018; 34:181-97。https://doi.org/10.1080/02648725.2018.1482092.
- 19。
Ichinose Y, Toyoda K, Barz W.鹰嘴豆防御反应中三个gtp结合小蛋白的cDNA克隆和基因表达。Acta botanica sinica(云南植物研究)1999;
- 20.
豆科植物和非豆科植物中GTPases家族的系统发育和表达分析。植物学报。2018;13(2):e1432956。https://doi.org/10.1080/15592324.2018.1432956.
- 21.
Memon Ar,Schwager CK,Niehaus K.小GTP酶在根和结节中的表达Medicago truncatula简历。Jemalong。Acta Bot Croatica。2019; 78(1):1-8。https://doi.org/10.2478/botcro-2019-0008.
- 22。
何敏,兰敏,张波,周勇,王颖,朱玲,等。rabb - h1b对于纤维素合酶的转运和下胚轴的生长是必不可少的拟南芥蒂利亚纳.acta botanica yunnanica(云南植物研究)2018;60:1051-69。https://doi.org/10.1111/jipb.12694.
- 23。
一种保守的RxLR效应与宿主raba型GTPases相互作用抑制囊泡介导的抗菌蛋白分泌。植物j . 2018; 95(2): 187 - 203。https://doi.org/10.1111/TPJ.13928.
- 24。
郑华,苗平,林旭,李丽,吴超,陈旭,等。小GTPase rab7介导的FgAtg9转运在自噬依赖的发育和致病性中是必不可少的镰刀菌素graminearum.Plos Genet。2018; 14(7):E1007546。https://doi.org/10.1371/journal.pgen.1007546.
- 25。
Rivero C, Traubenik S, Zanetti ME, Blanco FA。植物生物相互作用中的小GTPases。小gtpase。2019; 10(5): 350 - 60。https://doi.org/10.1080/21541248.2017.1333557.
- 26。
agarwal p,reddy mk,sopory sk,agarwal pk。植物兔子:表征,功能多样性,以及压力耐受的作用。植物Mol Biol rep。2009; 27:417-30。https://doi.org/10.1007/s11105-009-0100-9.
- 27。
王志强,王志强,王志强,等。植物内质体运输过程中两个RAB5组的整合。eLife。2018; 7: e34064。https://doi.org/10.7554/eLife.34064.001.
- 28.
这么多。小gtp结合蛋白及其在植物中的功能。植物生长调节剂。2007;26:369-88。https://doi.org/10.1007/s00344-007-9022-7.
- 29.
Pereira-Leal JB,Seabra MC。小GTP结合蛋白Rab系列的演变。J Mol Biol。2001; 313(4):889-901。https://doi.org/10.1006/jmbi.2001.5072.
- 30.
卢瑟福S,摩尔i拟南芥Rab GTP酶系列:另一个谜团变异。CurrOp植物BIOL。2002; 5:518-28。https://doi.org/10.1016/s1369 - 5266 (02) 00307 - 2.
- 31。
Rehman RU, Sansebastiano DGP。植物Rab GTPases在膜运输和信号转导中的作用。在:哈基姆KR, Rehman RU, Tahir I,编辑。植物信号转导:了解分子串扰。新德里:施普林格;2014.51 - 73页。https://doi.org/10.1007/978-81-322-1542-4-3.
- 32.
引用本文:田志刚,田志刚,田志刚,等。拟南芥RABA1 GTPases参与拟南芥与拟南芥之间的运输反式-高尔基网络和质膜,是耐盐胁迫所必需的。植物j . 2013; 73(2): 240 - 9。https://doi.org/10.1111/tpj.12023.
- 33.
Chen C,Heo JB。植物中组成型活性OSRAB11的过表达增强了对高盐度水平的耐受性。J植物BIOL。2018; 61:169-76。https://doi.org/10.1007/s12374-018-0048-0.
- 34.
O'Mahony PJ,Oliver MJ。从干燥耐受草地上表征干燥响应的小GTP结合蛋白(RAB2)Sporobolus stapfianus.植物mol biol。1999; 39:809-21。https://doi.org/10.1023/A:1006183431854.
- 35.
Hohlader J,Park Ji,Robin Ahk,Sumi Kr,诺伊。复活节百合中应激相关基因的鉴定,表征和表达谱分析(百合formolongi).基因。2017;8:172。https://doi.org/10.3390/genes8070172.
- 36.
kassanova G, Kurishbayev A, Jatayev S, Zhubatkanov A, Zhumalin A, Turbekova A, et al.;细胞内囊泡运输基因,rabc.-GTP,在盐度和快速脱水条件下高表达,但在干旱条件下表达下调(Cicer Arietinum.l .)。麝猫。2019;晚。https://doi.org/10.3389/fgene.2019.000.
- 37.
张军,李勇,刘波,王磊,张磊,胡建军,等。描述的Populus rab.家族基因的功能ptrabe1b.盐宽容。BMC Plant Biol. 2018;18:124。https://doi.org/10.1186/s12870-018-1342-1.
- 38.
布里拉达C,Rojas-Pierce M.真空贩运和生物发生:该领域的成熟。CurrOp植物BIOL。2017; 40:77-81。https://doi.org/10.1016/j.pbi.2017.08.005.
- 39。
RAB和SNARE蛋白驱动的植物液泡运输。植物学报。2014;22:116-21。https://doi.org/10.1016/j.pbi.2014.10.002.
- 40.
Rab GTPases在植物膜运输中的作用。植物学报。2008;11:610-9。https://doi.org/10.1016/j.pbi.2008.09.010.
- 41.
张C,希克斯GR,Raikhel NV。植物真空的分子组成:重要但不太了解调色剂脂质的法规和作用。植物。2015; 4:320-33。https://doi.org/10.3390/plants4020320.
- 42.
Takemoto K, ebink, Askani JC, Krüger F, Gonzalez ZA, Ito E,等。在拟南芥中,不同的系链复合物,SNARE复合物和Rab GTPases介导液泡膜融合。继续Ntl学术美国。2018, 115 (10): e2457 - 66。https://doi.org/10.1073/pnas.1717839115.
- 43.
杨志强,王志强,王志强,等。拟南芥GTPase基因超家族的分析。植物杂志。2003;131:1191 - 208。https://doi.org/10.1104/pp.013052.
- 44.
陈志强,陈志强。植物盐胁迫对盐胁迫的响应。IUBMB生活。2015;67:677 - 86。https://doi.org/10.1002/iub.1425.
- 45.
孙ej, Kim ES,赵敏,Kim SJ, Kim H, Kim Y,等。Rha1是拟南芥Rab5的同源物,在可溶性货物蛋白的液泡运输中起着关键作用。植物细胞。2003;15:1057 - 70。https://doi.org/10.1105/TPC.009779..
- 46。
Kotzer Am,Brandizzi F,Neumann U,Paris N,Moore I,Hawes C. AtraBF2B(ARA7)在烟草叶片表皮细胞中的真空贩运途径起作用。J Cell SCI。2004; 117(26):6377-89。https://doi.org/10.1242/jcs.01564.
- 47。
李G,孙ej, Lee MH, Hwang I. The拟南芥RAB5同源物rha1和ARA7本地化到预先定位的舱室。植物细胞生理。2004; 45(9):1211-20。
- 48。
张志强,王志强。Rab5家族一个小的gtp结合蛋白的特性MESEMBRYANTHEMUM CRYSTLINUM在盐胁迫早期,表达水平增加。植物学报。2000;42:923-36。
- 49。
南美,金世文,尹德,李世逸,赵mj,朴世杰。分子和生化分析OsRab7,米饭Rab7同源物。植物细胞生理。2003; 44:1341-9。https://doi.org/10.1093/pcp/pcg163.
- 50。
Rajan N, Agarwal P, Patel K, Sanadhya P, Khedia J, Agarwal PK.一个重要囊泡运输基因靶蛋白的分子特征和鉴定AlRab7从盐排泄烟灰Aeluropus lagopoides..DNA细胞BIOL。2015; 34:83-91。https://doi.org/10.1089/DNA.2014.2592.
- 51。
通过过度表达细胞内囊泡转运蛋白AtRab7 (AtRabG3e)诱导盐和渗透胁迫耐受性。植物杂志。2004;134:118-28。https://doi.org/10.1104/pp.103.025379.
- 52。
Peng x,ding x,chang t,wang z,liu r,zeng x等。囊泡贩运基因的过度表达,OsRab7,增强水稻中的耐盐性。SCI世界J. 2014; 214:483526。https://doi.org/10.1155/2014/483526.
- 53。
隋杰,李克,陈gx,yu my,ding st,wang js等。盐度抗性后盐度抗性耐盐度抗性耐盐性响应小GTP结合兔蛋白在花生中的含量抗性的数字表达分析。genet mol res。2017; 16:GMR16019432。https://doi.org/10.4238/gmr16019432.
- 54。
agarwal pk,agarwal p,jain p,jha b,reddy mk,sopory sk。来自的应激诱导小GTP结合蛋白PGRAB7的组成型过表达狼尾草glaucum增强转基因烟草对非生物胁迫的耐受性。植物细胞代表2008;27:05 - 15。https://doi.org/10.1007/s00299-007-0446-0.
- 55。
George S,Parida A.来自Phropephyte的Rab家族GTP酶的过度表达Prosopis juliflora转基因烟草对盐胁迫具有耐受性。中国人民大学学报(自然科学版)2011;38(3):1669-74。https://doi.org/10.1007/s11033-010-0278-9.
- 56.
j . jhansen JN, Chow C, Moore I, Hawes C. atab - h1b和AtRAB-H1cGTPases是酵母Ypt6的同源物,在表达时靶向高尔基体蛋白烟草和拟南芥蒂利亚纳.中国生物医学工程学报。2009;60(1):3179-93。https://doi.org/10.1093/jxb/erp153.
- 57.
Khan HA, Siddique KHM, Colmer T.通过钠毒性测定鹰嘴豆的盐敏感性。足底。2016;244(3):623 - 37。https://doi.org/10.1007/S00425-016-2533-3.
- 58.
Kotula L,Clode PL,Cruz JJDL,Colmer Td。鸡眼的盐度耐受性与“排除”叶片中Na的能力有关。J Exp Bot。2019年。https://doi.org/10.1093/JXB/ERZ241.
- 59.
Renna L, Stefano G, Slabaugh E, Wormsbaecher C, Sulpizio A, Zienkiewicz K,等。TGNap1是植物亚群体微管依赖的稳态平衡所必需的trans高尔基网络。NAT Communce。2018; 9(1):5313。https://doi.org/10.1038/s41467-018-07662-4.
- 60.
RAB和ARF GTPases在囊泡运输中的调控作用。植物杂志。2008;147:1516-26。https://doi.org/10.1104/pp.108.121798.
- 61.
王敏,李军,王敏,程安,等。谷物豆类和盐胁迫的恐惧:机制和管理策略的重点。中华医学杂志。2019;20(4):799。https://doi.org/10.3390/ijms20040799.
- 62.
Orlova YV,Sergienko Ov,Khalilova La,Voronkov As,Fomenkov Aa,NoSov Av等。培养的内吞囊泡钠转运拟南芥蒂利亚纳(l)Heynh。细胞。中国生物医学工程学报。2019;55(4):359-70。https://doi.org/10.1007/s11627-019-10005-7.
- 63.
Papini E,Satin B,Bucci C,De Bernard M,Telford JL,Manetti R等人。小GTP结合蛋白RAB7对于诱导的细胞真空是必不可少的幽门螺杆菌细胞毒素。EMBO j . 1997; 16(1): 15 - 24。https://doi.org/10.1093/mboj/16.1.15.
- 64.
骨头,Millar JBA,Toda T,Armstrong J.调节液泡融合和裂变粟酒裂殖酵母:一种依赖于MAP激酶的渗透反应。咕咕叫医学杂志。1998;8(3):135 - 44。https://doi.org/10.1016/s0960-9822(98)00060-8.
- 65.
Farinha cm,Matos P. Rab GTP酶规范贩运渠道和运输车 - 重点是囊性纤维化。小gtpase。2018; 9(1-2):136-44。https://doi.org/10.1080/21541248.2017.1317700.
- 66.
Turner NC, Colmer TD, Quealy J, Pushpavalli R, Krishnamurthy L, Kaur J,等。鹰嘴豆的耐盐性和离子积累(Cicer Arietinum.L.)经受盐胁迫。植物土壤。2013; 365:347-61。https://doi.org/10.1007/S11104-012-1387-0..
- 67.
陈志强,陈志强,陈志强,等。植物耐盐性和耐盐性小子.品种sci。2009; 59(5):671-8。
- 68.
陈志强,王志强,王志强,等。野生二粒小麦耐盐、耐钠和生长发育的遗传多样性研究。小麦属植物dicoccoides.Sci繁殖。2010;60(4):426 - 35。
- 69.
张志强,张志强,张志强,等。HVP10编码V-PPase是大麦的主要候选基因HvNax3钠排斥基因:来自精细定位和表达分析的证据。足底。2013;237:1111-22。https://doi.org/10.1007/s00425-012-1827-3.
- 70.
Sweetman C,Soole Kl,Jenkins Cld,Da。豆类中替代氧化酶基因的基因组结构及表达。植物细胞环境。2019; 42:71-84。https://doi.org/10.1111/pce.13161.
- 71.
Garg R,Sahoo A,Tyagi Ak,Jain M.验证鹰嘴豆定量基因表达研究的内部对照基因(Cicer Arietinum.l .)。生物化学学报。2010;396(2):283-8。https://doi.org/10.1016/j.bbrc.2010.04.079.
致谢
我们要感谢南澳弗林德斯大学(澳大利亚)和努尔苏丹(哈萨克斯坦)S.Seifullin哈萨克农业技术大学的工作人员和学生,感谢他们对这项研究的支持,并帮助对手稿进行了批判性的评论。
数据和材料的可用性
本研究中的所有生成和分析数据都包含在本发表的文章中及其补充信息文件中。
关于这个补充剂
本文已作为一部分发布BMC植物生物学卷20补充1,2020:第5次国际科学会议的选定文章“植物遗传学,基因组学,生物信息学和生物技术”(Plantgen2019)。补充的完整内容可在HTTPS://www.cinefiend.com/articles/supplements/volume-20-supplents 1中在线获得。
资金
本研究由澳大利亚研究理事会/粮食研究发展公司、产业转型研究中心资助项目IH140100013 (DD)和哈萨克斯坦教育和科学部研究项目BR05236500 (SJ)资助。出版费用由奖助金和计划共同资助。资助方在研究设计、数据收集、分析和解释、决定发表或手稿准备方面没有作用。
作者信息
从属关系
贡献
CS和GK对植物生长和基因表达进行了实验,并写了稿件的第一个版本;TM和NB参与植物生长实验,收集的叶样品,提取RNA和合成的cDNA;AK和SJ在哈萨克斯坦的建议和监督实验;NG在实验中建议并编辑了稿件;PL建议和监督协作实验和数据分析,并编辑了稿件的最终版本;CJ建议和监督生物信息学数据分析,并编辑了稿件的初始版本;KS建议和监督基因表达分析;DD建议和监督罐中盐度耐受的实验,并编辑了稿件的最终版本;ys监督所有实验并编辑了稿件的早期版本。所有作者都阅读并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
斯威特曼,卡萨诺瓦,G,米勒,tet al。盐诱导的细胞内囊泡贩运基因的表达,car-gtp,他们与na的关联+鹰嘴豆(Cicer Arietinum.l .)。BMC植物BIOL.20.183(2020)。https://doi.org/10.1186/s12870-020-02331-5
收到了:
接受:
发表:
关键字
- 鹰嘴豆
- 基因表达
- rab.-GTP基因
- 盐胁迫
- 盐度
- 粉彩贩运