摘要
背景
非生物胁迫的作物生产力是挑战,其中干旱胁迫是最常见的。NF-Y基因,特别是NF-YA基因,调节对非生物胁迫的耐受性。
结果
大豆NF-Y基因gmnfya5鉴定了其具有的所有21中最高的转录水平NF-YA基因大豆(甘氨酸最大L.)干旱胁迫下。干旱引起的成绩单gmnfya5被ABA合成抑制剂萘普生(NAP)抑制。gmnfya5成绩单在与根和叶比其他组织更高水平的营养生长和生殖生长阶段的各种组织中检测到,这是由与gmnfya5启动子:GUS融合试验。过度的gmnfya5在转基因拟南芥中,通过降低叶子的气孔孔和水分损失引起幼苗的增强耐旱性。过度表达和抑制gmnfya5结果表明,与空载体(EV)相比,大豆的抗旱性分别增强和减弱。aba依赖基因的转录水平(ABI2,ABI3,NCED3,LEA3,RD29A.,P5CS1,GmWRKY46,GmNCED2和Gmbzip1.)和不依赖aba的基因(DREB1A,DREB2A,DREB2B,GmDREB1,GmDREB2和GmDREB3)在转基因植物中过度表达gmnfya5均高于在干旱胁迫下的野生型植物的更高;抑制gmnfya5转录产生相反的结果。GmNFYA5可能调控的转录本丰度GmDREB2和Gmbzip1.通过结合到体内的启动子。
结论
我们的结果表明过度表达gmnfya5通过aba依赖和aba不依赖途径提高了大豆的抗旱性。
背景
作物通常受非生物胁迫引起全世界的土壤破坏和作物损失[1,2].水分胁迫,干旱或盐要么造成的,是一个重大的挑战。干旱是更广泛的,比盐胁迫损伤[3.].对干旱的适应涉及复杂的监管网络,涉及控制水通量和蜂窝渗透调整[4,5,6].ABA通过调节气孔开度和在干旱胁迫下发挥重要作用的AP2/ERF和MYB家族成员等干旱响应基因来调控植物的抗旱性[7,8,9].ABA合成抑制剂如萘普生和钨显示ABA的重要性[10,11].
CCAAT盒结合因子(CBF),又称核因子Y (NF-Y)或血红素激活蛋白(HAP),由NF-YA、NF-YB和NF-YC亚基组成[12,13,14].在单子叶植物和双子叶植物,只是这些亚基中的一个由几十基因编码的,而只有一个或两个基因存在于动物[13].不同的NF-Y家族的成员在调节植物发育和生长不同的功能,如开花时间,株高,根伸长,胚胎发生,和种子发芽[15,16,17,18,19,20.,21,22,23,24,25,26].
NF-Y基因是非生物应激诱导反应的调节基因。例如,过度表达AtNFYA5在拟南芥中引起影响了许多干旱胁迫相关的基因的表达[增强的对干旱胁迫耐27].携带的额外副本的转基因水稻品系OsNFYA7表明通过aba独立途径提高了抗旱性[28].转基因水稻过量表达OsHAP2E[29)和bermudagrassCdt-NFYC1[11]表现出更好的抗旱性和耐盐性。几个与压力相关的测量显示ZmNFYB2导致转基因玉米植物[抗旱30.].然而,显示出NF-YS水分胁迫下发挥着重要作用,多数报告涉及到水稻和拟南芥。少数NF-Y的成员的职能大豆得到了证实。gmnfya3和GmNFYB1,具有这些基因的转基因拟南芥株系对干旱胁迫的耐受性增强[31.,32.].然而,大豆中许多其他NF-Y成员的生物学功能还有待验证。
在这项研究中,gmnfya5,是NF-YA家族的大豆成员,受干旱和ABA的诱导。转基因拟南芥和大豆株系过度表达gmnfya5对干旱胁迫的耐受性通过aba依赖和aba不依赖途径增强。考虑到这些结果,我们建议gmnfya5是遗传改善的优异候选基因,以增强大豆的耐旱性。
结果
分离和表征gmnfya5
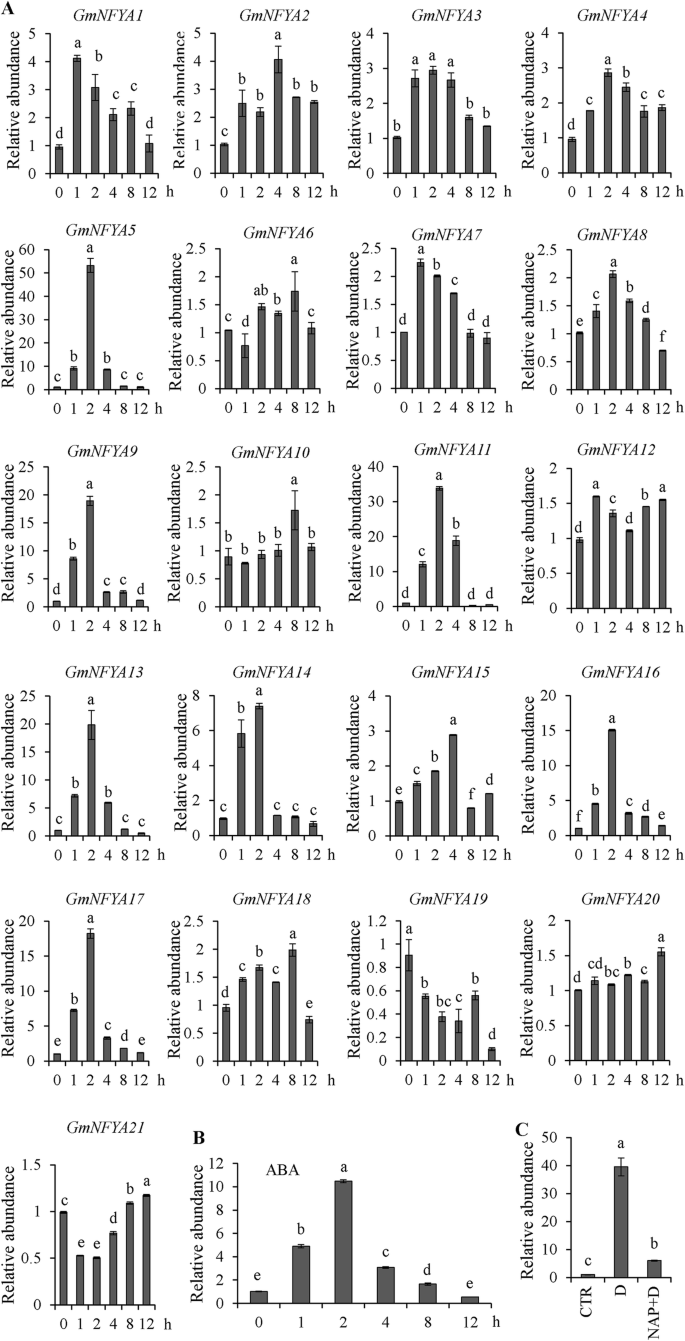
NF-YA基因介导干旱耐受性[27,28,31.].二十人NF-YA利用qRT-PCR技术研究了干旱胁迫对幼苗叶片的影响。gmnfya5transcript was highest among all genes at 2 h after drought stress (Fig.1A)和转录gmnfya5ABA显著诱导(图。1B).利用离体叶片了解ABA是否会影响干旱诱导的转录gmnfya5通过使用NAP,ABA生物合成的抑制剂。这gmnfya5transcript under drought treatment for 2 h was similar to the above pattern relative to the control (Fig.1A和C)。然而,预处理NAP抑制的表达水平gmnfya5(无花果。1C)。
gmnfya5受干旱胁迫和ABA的影响。(A)利用qRT-PCR分析干旱胁迫下大豆21个NF-YA基因的转录本。表达水平归一化为GmCYP2.gmnfya5在0小时的转录物设置为1.0,并且三个生物重复的SD由误差杆表示。(b)成绩单gmnfya5响应于在大豆中ABA处理进行分析。表达水平归一化为GmCYP2.gmnfya5第0页的成绩单 h设置为1.0,三个生物复制的SD由误差条表示(C) 基因的qRT-PCRgmnfya51 mM NAP处理大豆植株对干旱胁迫的响应对照、干旱和干旱+ NAP分别由CTR、D和D + NAP表示。的水平gmnfya5控制条件下的转录物设定为1.0,内部对照是GmCYP2.三个生物重复的SD用误差棒表示。显着差异P < 0.05由列上方的不同字母表示
gmnfya5用等电点编码303个氨基酸残基的37.68kd多肽(P.我8.86)。GmNFYA5与拟南芥NF-YA蛋白具有高度保守的核心区域;它们由两个亚结构域组成:一个NF-YB/C和DNA结合亚结构域,通过连接子连接,需要与NF-YB/C异源二聚体结合,以及CCAAT结合序列。用星号表示的氨基酸图S1A是批判性的保守的残留物。GMNFYA5和拟南芥NF-YA蛋白的对齐表明它具有在保守域中的ATNFYA5具有最高的身份。基于保守结构域中的氨基酸序列的系统发育分析显示GMNFYA5与Arabidopsis Atnfya6和Atnfya5聚集(图印地).
组织特异性表达分析和亚细胞定位
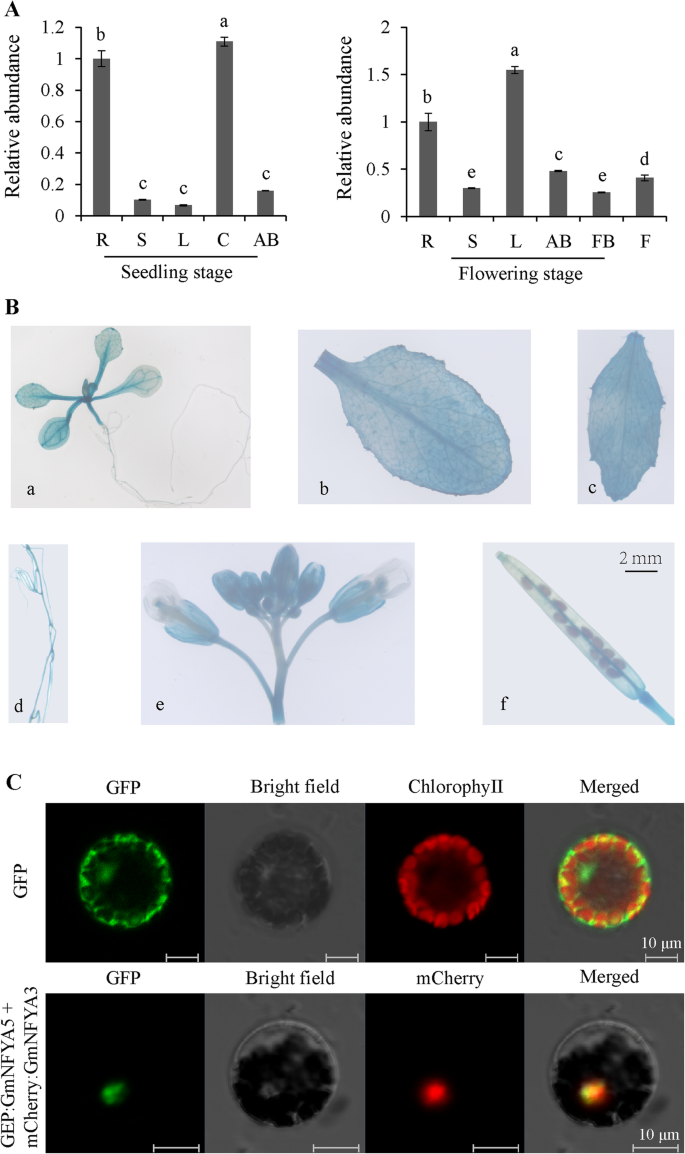
表达gmnfya5采用qRT-PCR方法对正常条件下营养生长和生殖生长阶段的根、茎、子叶、叶、顶端芽、花芽和花等不同组织进行了qRT-PCR检测。gmnfya5在这两个发育阶段的每一个组织中检测到的成绩单,与同级别苗开花相比,叶一显著增加(图2一个)。成绩单丰根和叶是比其他组织高(图2一个)。更详细地研究表达模式,转基因拟南芥t3.行过表达gmnfya5启动子:GUS制作。在各种组织中检测到GUS的表达(图2B) 。gmnfya5花组织中表达量最高,叶维管系统和根中表达量也最高。叶片方面,幼苗的GUS染色水平较低,开花期的GUS染色水平较高(图2)。2B)与qRT-PCR结果一致。
基因的组织特异性表达分析及亚细胞定位gmnfya5.(a)表达丰富的gmnfya5基因大豆组织在幼苗和开花阶段。在正常条件下的大豆组织用于提取总RNA。相对转录水平gmnfya5在大豆组织是由指示垂直的列。gmnfya5根内转录本设为1.0,内部对照为GmCYP2。三个生物重复的SD用误差棒表示。显着差异P < 0.05由列上方的不同字母表示。(b)表达模式gmnfya5启动子:GUS转基因拟南芥植物的各种组织。一个5日龄幼苗,b玫瑰花叶,c茎生叶,d根,e花,f长角果。比例尺,2mm (C) GmNFYA5亚细胞定位。GFP-GmNFYA5和mCherry-GmNFYA3融合蛋白在转化细胞中的荧光仅定位于细胞核。比例尺,10 μm
为了研究细胞内GMNFYA5的定位,重组载体P16318GFP:gmnfya5和mCherry的:gmnfya3共转化到拟南芥的原生质体。在转化细胞中两个融合蛋白的GFP和荧光mCherry的分别定位专门向细胞核(图2D),而对照GFP则均匀分布于原生质体细胞(图。2C),从而表明GmNFYA5是一个核定位的蛋白。
灵敏度35S:GmNFYA5Arabidopsis植物到外源ABA和PEG
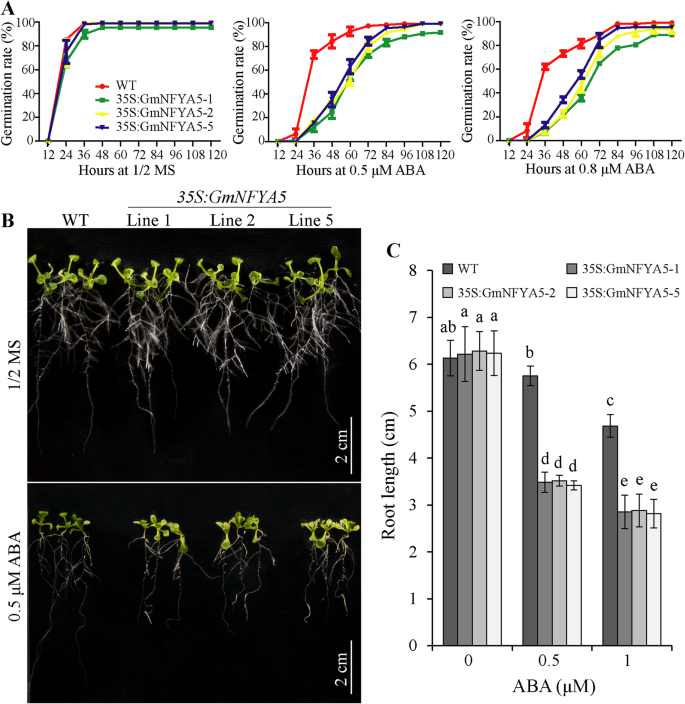
转基因拟南芥植物的过度表达gmnfya5来阐明基因的功能。三个纯合子转基因株系(35s:gmnfya5-1,35s:gmnfya5-2和35S:GMNFYA5-5)进行功能分析(图。5B) 。确定ABA敏感性是否受gmnfya5,种子35S:GmNFYA5和WT拟南芥植物发芽上用不同浓度的ABA的1/2 MS培养基中。发芽率分别为对照条件下相似(图3.A) 。在存在0.5和0.8的情况下 μM ABA种子萌发在两种培养基中均受到显著抑制35S:GmNFYA5,但对WT萌发的抑制明显小于35S:GmNFYA5线;germination of WT seeds reached 73% at 36 h compared with 12 to 19% for35S:GmNFYA5lines treated with 0.5 μM ABA (Fig.3.一个)。检测到仅7至13%的萌芽35S:GmNFYA5而0.8 μM ABA处理36 h的WT种子则为62%(图2)。3.一个)。
WT和之间的根生长的差别抑制35S:GmNFYA5苗是在用ABA处理也观察到。Three-day-old seedlings under normal conditions were transferred to1/2 MS medium with 0.5–1 μM ABA. After one week, roots lengths of35S:GmNFYA5植株比野生型植株短(图。3.B和C)。
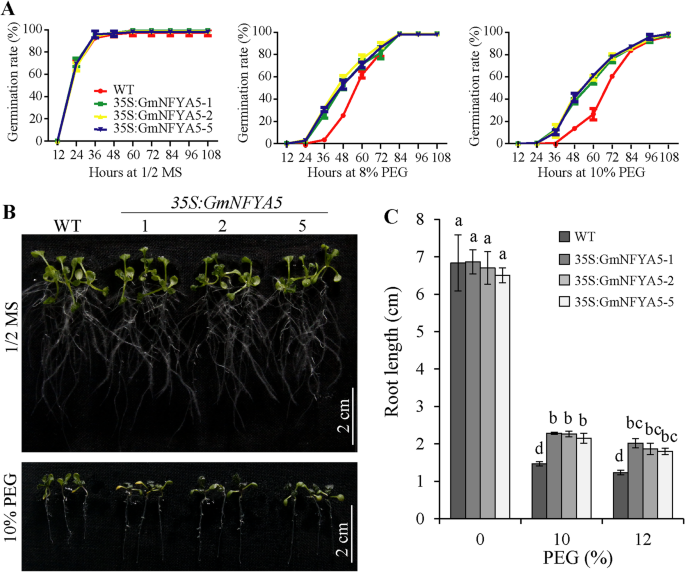
不同浓度的PEG对WT发芽的影响,35S:GmNFYA5还评估了线条。WT种子的萌发对PEG更敏感而不是35S:GmNFYA5线条。与53-59%的萌发相比35S:GmNFYA5拟南芥种子在8% PEG处理48 h后,WT种子仅萌发25%(图2)。4A). WT种子的萌发率进一步延迟35S:GmNFYA5拟南芥种子在10%PEG中(图。4一个)。幼苗生长也差异通过PEG(图抑制。4B和C)。
宽容的35S:GmNFYA5拟南芥幼苗对干旱胁迫的响应
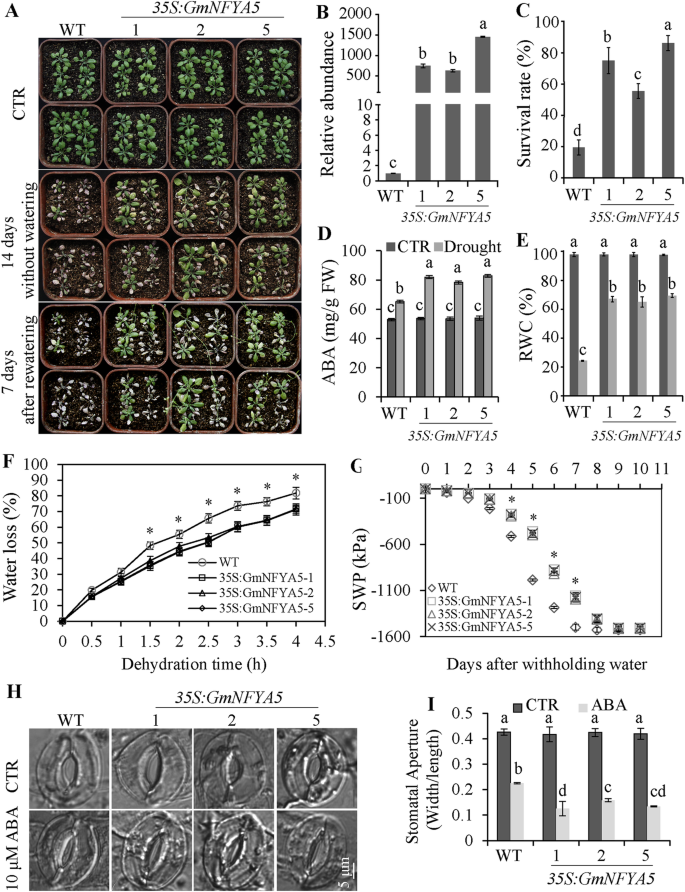
确定是否过度表达gmnfya5增强的旱宽,3周龄35S:GmNFYA5WT拟南芥幼苗被剥夺水分。WT幼苗的土壤水势(SWP)下降较快35S:GmNFYA5线(图5G). WT和35S:GmNFYA5干旱胁迫7 d和9 d后,品系均下降到最低水平。分离的叶子35S:GmNFYA5植物也比wt慢慢地损失水(图。5d)。在ABA的浓度35S:GmNFYA5在干旱治疗后7天后均高于WT植物,并且在正常条件下生长植物时没有显着差异(图。5d)。与这些结果一致,气孔从离体叶片孔35S:GmNFYA510 μM ABA处理下的株系显著小于野生型株系,而未处理叶片无显著差异(图2)。5h和i)。
改良的抗旱性和气孔孔径分析35S:GmNFYA5拟南芥植物。(A)干旱耐受性评估35S:GmNFYA5拟南芥植物。3周龄的植株在无水条件下生长14天,然后再浇水7天。抗旱性的35S:GmNFYA5拟南芥属年代植物通过能力检测时,干旱胁迫后恢复正常条件下恢复增长。(b)gmnfya5检测到的转录物35S:GmNFYA5拟南芥线。表达水平归一化为Tub8.成绩单gmnfya5在WT植株中设置为1.0;三个生物重复的SD用误差棒表示。(C-G)测定存活率、ABA浓度、RWC、失水率和SWP35S:GmNFYA5拟南芥和WT线。(H-I)气孔在孔35S:GmNFYA5Arabidopsis和WT植物为零和10μmAba治疗。使用Adobe Photoshop CS5中的标尺工具测量气孔孔的宽度/长度。秤杆,5μm。数据代表三个生物重复的平均SD (n= 54)。显著性差异P < 0.05用列上方不同字母表示
干旱处理14 d后,野生型植株比野生型植株更容易发生极端萎蔫35S:GmNFYA5线(图5A) 。这个35S:GmNFYA5植物保持65-69%的RWC和54-62%的离子泄漏,而WT植物叶片中的24%RWC和79%离子泄漏相比。在其中没有检测到显着差异35S:GmNFYA5在正常条件下和WT控制(图。5E和图S3).重新浇水7天后,大多数WT植物未能恢复(生存率为19%),而大多数情况下35S:GmNFYA5植物保持膨压和表现出较高的回收率(56-86%存活)(图5C).这些结果表明,过度表达gmnfya5增强转基因拟南芥系的耐药性。
小麦的耐旱性35S:GmNFYA5拟南芥系在整个生长周期内都得到维持
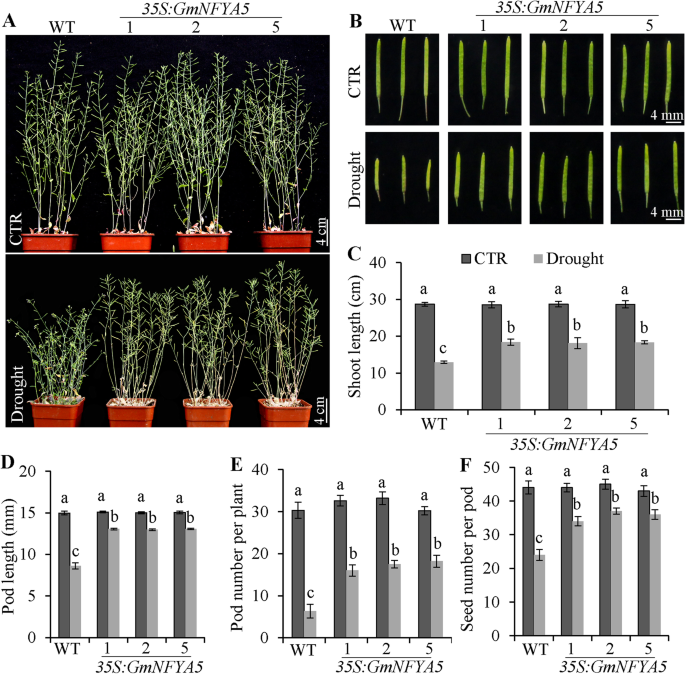
gmnfya5过度表达增加了抗旱性35S:GmNFYA5拟南芥系在幼苗阶段。然而,这种增长必须转化为增强抗旱能力遍及整个生长周期,并最终导致增加干物质或种子产量。在持续干旱处理的拍摄和锅长度35S:GmNFYA5植株显着延长(图6A-d),荚数每荚植物和种子数分别比WT(图显著更高。6E和F)。之间没有区别35S:GmNFYA5和正常条件下生长的WT植株。这些结果表明gmnfya5过度表达拟南芥植物可以改善相对于WT控制耐旱性和种子产量。
改进的耐旱性35S:GmNFYA5拟南芥植物遍布整个生长周期。(A)的耐旱性评估在35S:GmNFYA5拟南芥在一个完整的生长周期。Scale bar, 4 cm. (B) Pod lengths in35S:GmNFYA5和WT拟南芥植物来自对照和干旱条件。秤条,4毫米。(C-F)测量每株植物的芽长,荚长,荚数和每个豆荚的种子编号35S:GmNFYA5和在控制和干旱条件下的WT植物。数据代表三个生物重复的平均SD (n = 18). Significant differences at P < 0.05 are indicated by different letters above the columns
应激相关基因的转录概况35S:GmNFYA5拟南芥
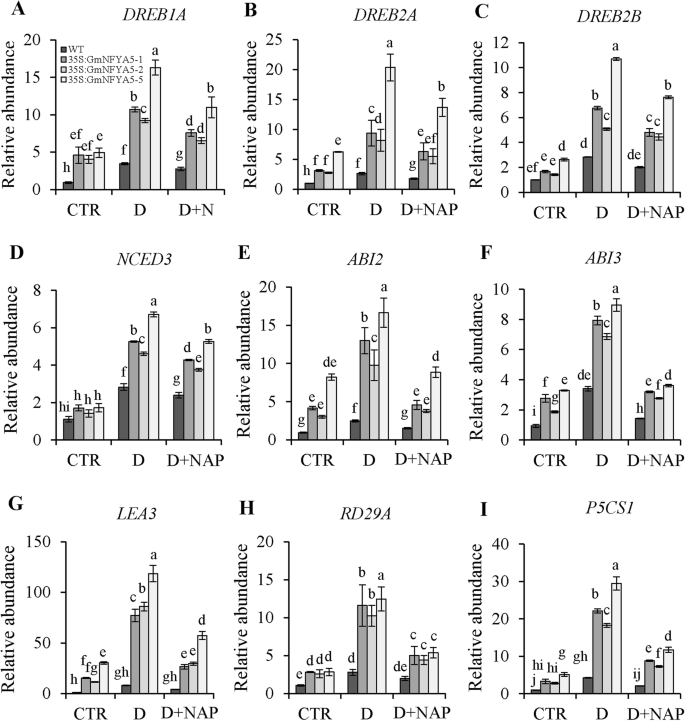
要检查的作用gmnfya59个胁迫相关基因,包括6个aba依赖基因(ABI2,ABI3,NCED3,LEA3,RD29A.和P5CS1)及3个不依赖aba的基因(DREB1A,DREB2A和DREB2B)三个中测定35S:GmNFYA5拟南芥系中比较干旱条件下野生型植物,干旱+ NAP和对照处理。在控制条件成绩单DREB1A,DREB2A,DREB2B,ABI2,ABI3,LEA3,RD29A.和P5CS1在里面35S:GmNFYA5植物比野生型植物显著较高;水平NCED3转录物没有不同(图。6). 此外,所有的基因都明显地产生了更高的转录水平35S:GmNFYA5植物比在干旱胁迫下的WT(图7). 然而,NAP显著抑制干旱诱导的所有基因的转录,尤其是NAP基因的转录ABI2,ABI3,LEA3,RD29A.和P5CS1在干旱+休息治疗中(图。7练习)。
相对转录水平DREB1A,DREB2A,DREB2B,ABI2,ABI3,NCED3,LEA3,RD29A.和P5CS1在里面35S:GmNFYA5和野生拟南芥植株三种条件下。相对转录水平是由指示垂直的列,并标准化为Tub8.在正常条件下,野生型植物胁迫相关基因的转录物在1.0设置。Control, drought and drought pretreated with NAP are indicated by CTR, D and D + NAP, respectively. Data represent mean SD for three biological replicates. Significant differences P < 0.05 are indicated by different letters above the columns
转基因大豆植物的耐旱性压力
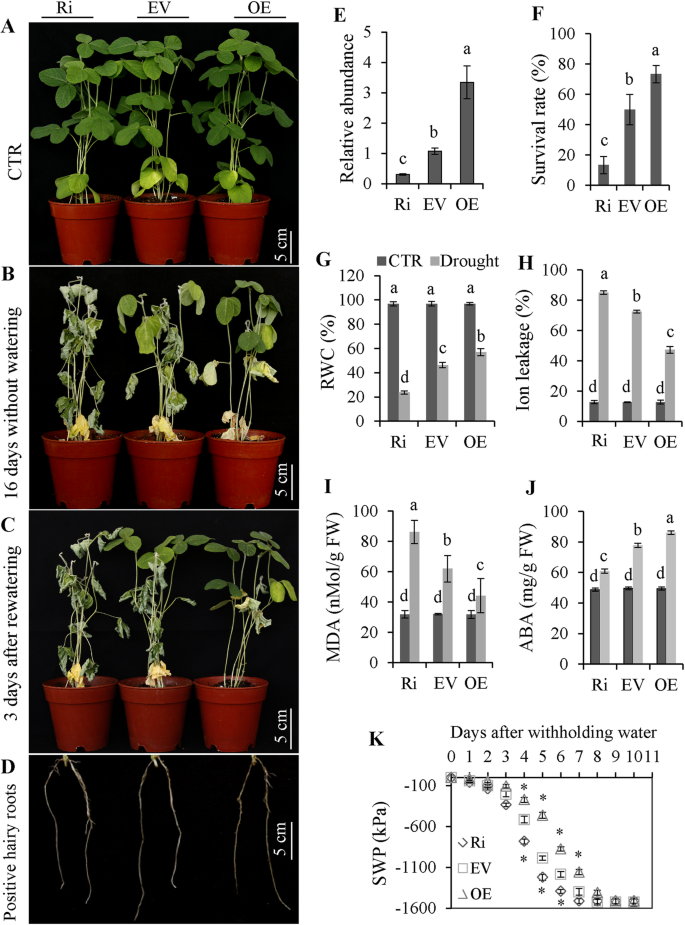
通过对转基因大豆株系OE、EV和RNAi的研究,获得了转基因大豆株系OE、EV和RNAi答:rhizogenes- 介质的毛状根转化(图。8d)调查的功能gmnfya5在大豆。相对mRNA水平gmnfya5通过qRT-PCR检测,OE植株中EV含量显著高于EV植株,EV植株又显著高于RNAi植株(图2)。8E)。这nthe plants that had positive hairy roots were planted into the soil for 7 days to establish the normal growth. These plants were used to explore the drought tolerance following deprivation of water.
耐旱转基因大豆植物。(A-d)的耐旱性是在转基因大豆植物进行评价。Transgenic soybean plants with positive hairy roots were transferred to plastic pots containing a mixture of peat and vermiculite (1:1, v/v) and grown for 7 days. Water deprivation for 16 days was followed by re-watering for 3 days. The hairy roots phenotype is shown in Fig.8D.转基因大豆植株的抗旱性是通过干旱胁迫后恢复正常条件下的生长能力来测定的。比例尺,5厘米。(E)相对转录gmnfya5在三种转基因大豆线中检测到。成绩单gmnfya5在EV植物中设定为1.0,表达水平归一化至GmCYP2.(F-K)转基因大豆株系的存活率、RWC、离子渗漏、MDA、ABA浓度和SWP。数据代表三个生物重复的平均SD (n = 18)。显著性差异P < 0.05用列上方不同字母表示
这一个年代年代一个y showed that the rate of decline in SWP was fastest in RNAi lines with minimum levels in RNAi, EV and OE lines being reached at 7, 8 and 9 days after initiation of drought treatment (Fig.8k)。假设在根中诱导的ABA转移到其他组织[33.的ABA含量,在保持水分7天后测定大豆叶片的ABA含量。在干旱胁迫下,OE植株的ABA浓度高于EV植株,而RNAi植株的ABA浓度则相反。在控制条件下,各株系间无差异(图。8J)
RNAi植物因停水16天而表现出严重萎蔫 白天,EV植物的萎蔫程度较低,OE植物的外观接近健康(图。8 b).在干旱胁迫下,相对于EV植物,RNAi植物的离子渗漏和MDA水平显著升高,RWC显著降低,而OE植物则相反(图2)。8胃肠道)。在复水3 d后,OE植株的存活率显著高于EV植株,而几乎所有RNAi植株都无法恢复(图2)。8C和图8F)。
转基因大豆胁迫相关基因的转录谱
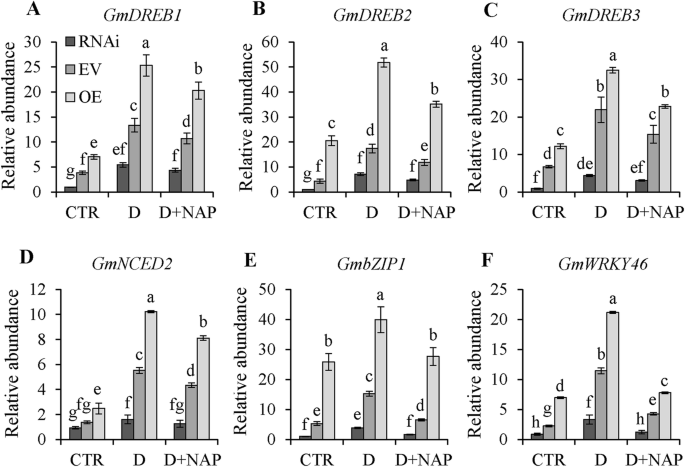
包括3个ABA依赖基因在内的6个应激反应基因的转录水平(GmDREB1,GmDREB2和GmDREB3)及3个不依赖aba的基因(GmWRKY46,GmNCED2和Gmbzip1.)采用qRT-PCR技术对对照、干旱和干旱+NAP处理的水稻植株进行分析。在对照条件下,基因的表达水平显著升高GmDREB1,GmDREB2,GmDREB3,GmWRKY46和Gmbzip1.在大豆OE毛状根中检测到,与EV株系相比,RNAi株系的效果相反。GmNCED2转录物显示RNAi和EV植物之间没有显着差异(图。9f)。6个基因在OE株系中的表达量均显著高于EV株系,而RNAi株系的表达量明显低于EV株系。NAP抑制了干旱诱导的所有基因转录本的水平,特别是GmWRKY46和Gmbzip1.(无花果。9E和F)。
拟南芥原生质体的转录激活研究
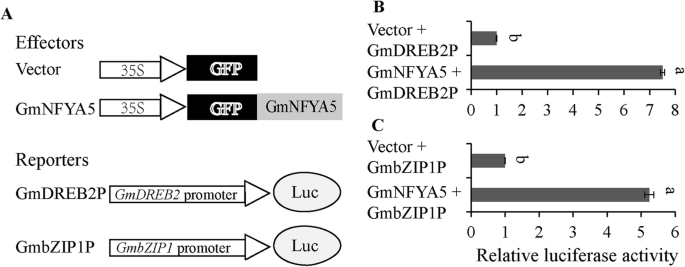
通过PLACE程序分析15个应激反应基因的启动子(http://www.dna.affrc.go.jp/PLACE/signalscan.html).每种基因发现一到六个CCAAT元素(表S2).两个应力相关基因(GmDREB2和Gmbzip1.选择确定GMNFYA5是否可以在拟南芥原生质体瞬态表达系统中与体内的启动子结合。重组PGREENII 0800:GmDREB2p / GmbZIP1p将p16318GFP空载体或p16318GFP共转化到拟南芥原生质体中:gmnfya5向量(图。10一个)。表达GFP-GMNFYA5的原生质体表现出与GFP相比的LUC报道基因的显着更高的表达水平(图。10B和C)。
讨论
干旱是最普遍和损害的非生物压力[3.].干旱胁迫下多重转录级联调控基因[34.,35.].在这些级联反应中诱导的转录因子基因反过来调节相关的下游基因来抵抗干旱胁迫的影响。结果表明,大部分NF-YA成员对干旱胁迫有响应。1A),与先前的观察结果一致[36.].NF-YA基因的转录水平gmnfya5最高下面干旱处理。组织特异性表达分析显示该转录物丰gmnfya5在根中比叶子以外的其他组织更高(图。2A),这意味着gmnfya5与耐旱性有关。同样,在转基因植物中具有抗旱能力的一些基因在正常条件下在根中保持了最高的转录本丰度[11,27,37.].
除了受到干旱胁迫的诱导,gmnfya5ABA上调转录水平,NAP抑制转录水平(图)。1b和c),表明这一点gmnfya5响应干旱的转录依赖于ABA信号的串扰。干旱胁迫下,ABA水平升高,抑制磷酸酶2Cs的活性,通过磷酸化等途径使气孔关闭[38.,39.,40]. 正如预期的那样,过度表达gmnfya5赋予的干旱耐受性经由ABA依赖性途径(图的转基因拟南芥植物。5).在干旱处理,过表达gmnfya5增加的表达水平NCED3以增强ABA合成(图5D和无花果。7d),增加ABA积累导致缩小的气孔孔(图。5h.h和图。5I),引起从叶还原水损失(图5与这些结果一致,SWP35S:GmNFYA5线比在WT(图下降得更慢。5G)。报告过表达的gmnfya3[31.],Cdt-NFYC1[11],RING-H2[41.] 和GmTGA17[42.]增强了转基因株系对ABA的敏感性和抗旱性,这在本研究中得到了证实(图。3.).此外,一些生理指标,特别是SWP,在以前的报道中没有报道[6,27,32.,37.].
ABA作为一种重要的信号传导媒介,控制着许多胁迫诱导基因的表达[43.,44.),如ABI2,ABI3,LEA3,RD29A.和P5CS1,其功能作为干旱耐受性的正调节[45.,46.,47.,48.].这些基因保持更高的转录水平35S:GmNFYA5拟南芥植物与正常和干旱条件下野生型植物(图进行比较。7练习)。随着NAP的引入,这些基因的转录水平降低,证明ABA在调控植物抗旱性方面发挥了关键作用。然而,gmnfya5过表达通过Up-Condating通过其他通路增强耐旱性的功能DREB1A,DREB2A和DREB2B(无花果。7A-C),其过表达通过aba独立途径提高拟南芥的抗旱性[49.,50.,51.,52.].最重要的是,我们展示了过度表达gmnfya5导致种子产量显著提高35S:GmNFYA5干旱条件下拟南芥与野生型植物的比较(图。6).
gmnfya5在转基因大豆植株抗旱性的正调控中发挥作用;这些植物的RNAi引起了一些生理指标的显著变化(图。8).功能gmnfya3和GmNFYB1之前只在转基因拟南芥幼苗中进行了研究[32.,37.].在OE大豆植株中,aba依赖基因(Gmbzip1.和GmWRKY46)和不依赖aba的标记基因(GmDREB1,GmDREB2和GmDREB3)在植物中以um-consemating耐旱性作用的作用[45.,49.,51.,53.,54.],维持了较高的转录水平,而在RNAi植物中则出现了相反的效果(图。9).结果表明gmnfya5转基因拟南芥和大豆植株通过aba依赖和aba独立途径获得耐旱性。
1到6个CCAAT独联体在本研究中使用的所有标记基因的启动子中检测到 - 输送元素(表S2).转录激活测定显示出启动子GmDREB2和Gmbzip1.与GmNFYA5结合,提高LUC报告基因在体内的表达水平(图)。10B和C)。结果给予进一步深入了解耐旱按规定gmnfya5通过ABA依赖和ABA的拟南芥和大豆的无关途径。
结论
转基因大豆和拟南芥过表达gmnfya5生理指标和干旱相关基因转录水平均显示出较强的抗旱性。gmnfya5应为正基因,可以增加的抗旱性,并因此具有用于在大豆的分子育种使用的潜力。
方法
所有实验均以三种生物复制进行。
孤立gmnfya5
总RNA从大豆中分离(甘氨酸最大L. MERR。)栽培品种威廉姆斯82通过先前描述的方法[37.].全长cDNA的gmnfya5˚F5'-GTAAGTGCGACTCTAAGCAAGCCT-3'和R 5'TAATGTAAATGAGCCAAGGATGACT-3':通过PCR用KOD-PLUS DNA聚合酶(TOYOBO,日本)和下列引物获得的。扩增产物测序纯化并克隆到pEASY-Blunt载体(TransGen,中国)。
植物生长与处理
品种威廉姆斯82在含有泥炭和蛭石(1:1,v / v)的塑料盆(直径为20cm深度)的塑料罐(直径为15厘米,20cm),温室为28/18°C日/夜,相对湿度70%和14/10小时光/暗度photoperiod [55.].二十天幼苗用于评估表达模式。对于干旱处理,将整个植物除去,洗涤并置于层流罩中,用于逐渐干旱暴露12小时[11].ABA处理:100 μM ABA处理12 h;两种处理分别在0、1、2、4、8和12 h时采集大豆叶片,立即用液氮冷冻分离RNA。了解ABA是否参与干旱诱导的转录gmnfya5,离体叶片置于H2O对于1小时以消除伤口应激的影响,然后用蒸馏水或1mm萘普酸(ABA合成抑制剂)处理3小时,然后进行干旱处理2小时[11].叶在H中漂浮2o在整个时期构成正常控制。收集大豆叶并立即通过液氮冷冻以分离RNA。
测定转录水平gmnfya5在各种组织,根,茎,子叶,叶和的20天龄大豆幼苗顶芽进行取样,并立即通过用于分离RNA的液氮中冷冻。根,茎,子叶,叶,顶芽,花芽和50日龄大豆植株的花也被采样,并立即冷冻用于RNA的分离。All the experiments were carried out in a greenhouse at 28/18 °C day/night, 70% relative humidity and a 14/10 h light/darkness photoperiod.
生成和干旱待遇35S:GmNFYA5拟南芥行
的CDSgmnfya5被克隆到以区域一个名为pCAMBIA1302和由CaMV35S启动子驱动的使用引物组5'-GGGACTCTTGACCATGATGAAGAACTTATGTGAG-3'和5'-TCAGATCTACCATGGCCATAAGGACTGATAGACG-3'矢量的I位点。该pCAMBIA1302:gmnfya5将构建传入农杆菌肿瘤术用花浸法测定菌株GV3101侵染拟南芥。利用德国罗氏公司(Roche)的湿霉素(Hygromycin)筛选阳性转基因拟南芥株系1植物和T2比如。
转基因拟南芥(35s:gmnfya5-1,35s:gmnfya5-2和35S:GMNFYA5-5)和哥伦比亚生态型-0(WT)幼苗在该研究中使用。Seeds were surface-sterilized with 70% ethanol and thrice washed with sterile water, followed sterilization with 1% sodium hypochlorite for 15 min and again washing three times with sterile water. The seeds were sown on half-strength Murashige and Skoog medium (1/2 MS, 2% sucrose, 0.8% agar). After 2 days at 4 °C in darkness they were placed in a tissue culture room at 22 °C and 70% relative humidity with a 16/8 h light/darkness photoperiod. For drought treatment, 3-week-old seedlings which had been transferred to plastic pots (8 cm in length, width and depth) containing a mixture of peat and vermiculite (1:1, v/v) for 7 days were deprived of water until they became wilted, after which they were irrigated and recovered for 7 days.
研究对照、干旱和干旱+ NAP条件下标记基因的转录水平35S:GmNFYA5拟南芥植株,叶龄3周35S:GmNFYA5并且将wt幼苗放入h中2O处理1 h以消除创面应力的影响,然后放置于h2O or 1 mM NAP solution for 3 h, and then transferred to a laminar flow hood for 2 h as drought treatment. The leaves of35S:GmNFYA5野生型幼苗在H2O代表的整个期间均在正常控制。叶进行取样,并立即通过用于分离RNA的液氮中冷冻。所有处理均在日光温室中进行,温度为22℃,相对湿度为70%,光/暗周期为16/8 h。
进一步探讨的功能gmnfya5,35S:GmNFYA5在正常和干旱条件下对拟南芥进行了研究。正常对照组,3周大35S:GmNFYA5和WT拟南芥植物种植,含水良好的处理和0.35克H.2Øg ^- 1dry soil (soil water potential is − 70 kPa) was maintained as the soil water content. For drought treatment, Soil water content was deprived of water to 0.20 g H2Øg ^- 1干燥土壤(土壤水位潜力为-280kPa)。每天称重两种治疗的盆,并用水调节,以维持目标土壤水势直至收获[56.].所有处理均在日光温室中进行,温度为22℃,相对湿度为70%,光/暗周期为16/8 h。
大豆种子由中国农业科学院作物科学研究所李娟邱博士提供。拟南芥种子是从Abroc购买的(https://abrc.osu.edu/researchers).
亚细胞定位
的编码序列(CDS)的gmnfya5没有终止密码子框融合于矢量p16318GFP GFP的N-末端,并用连接BAMHI站点生成p16318GFP:gmnfya5CaMV35S启动的控制下融合构建体的启动子使用引物组5'-TATCTCTAGAGGATCCATGAAGAACTTATGTGAG-3'和5'-TGCTCACCATGGATCCCATAAGGACTGATAGACG-3'。的CDSgmnfya3编码核局部化蛋白[31.]克隆到生态利用引物5 ' - tctattttccggtgaattcatgcaaactgtttatcttt -3 '和5 ' -ACTAGTCTCGAGGAATTCAACTTTAAGGTTGCAGCA-3 '构建载体pLVX-IRES-mCherry的RI位点。以GmNFYA3:mCherry融合蛋白作为核标记。拟南芥原生质体的制备如下所述[57.].转染后的原生质体22℃黑暗孵育16-18 h,共聚焦激光扫描显微镜(Zeiss, LSIM 700)观察GFP荧光信号[58.].
子:格斯分析
启动子的gmnfya5来自大豆的DNA扩增品种威廉姆斯82用引物˚F5'-AAGAGGAACACAGAAGTCTATGAGT-3'和R 5'GCACATCAGATTCAGAGGAAGTCCC-3'。将产物导入重建pCAMBIA1305载体(GFP编码区通过GUS编码区替代)掺入生态ri和以区域I位点与正向引物5 ' -CCATGATTACGAATTCAAGAGGAACACAGAAGTC-3 '和反向引物5 ' -CTCAGATCTACCATGGCTCACATAAGTTCTTCAT-3 '。这个结构被引入农通过花浸法将菌株GV3101转入拟南芥Col-0。利用潮霉素筛选转基因阳性拟南芥株系,获得纯合子株系。
发芽和根系生长测定
Sterilized seeds were sown on 1/2 MS medium with 8–10% PEG 6000 (PEG) and 0.5–0.8 μM ABA respectively and placed in a tissue culture room at 22 °C and 70% relative humidity with a 16/8 h light/darkness photoperiod after stratification at 4 °C for 2 d in darkness. The germination rates were recorded every 12 h until completion. To investigate root growth of the35S:GmNFYA5拟南芥系,3日龄幼苗暴露于1/2 ms培养基,10-12%PEG和0.5-1μmaba。一周后,测量根长度。
答:rhizogenes大豆发根的介导的转化
的CDSgmnfya5插入到pCAMBIA3301载体掺入以区域我和BstEII位点用以下引物:f5 ' -GGACTCTTGACCATGATGAAGAACTTATGTGAG-3 '和R 5 ' -ATTCGAGCTGGTCACCCATAAGGACTGATAGACG-3 '。635 bp合成RNAi发夹片段(图。S2)中的溶液引入到pCAMBIA3301载体和用相同的限制位点连接。该pCAMBIA3301:gmnfya5、pCAMBIA3301空载体和pCAMBIA3301:RNAi-gmnfya5.将构建传入答:rhizogenesK599,在组织培养室内,白天/晚上28/18℃,相对湿度70%,光/暗周期14/10 h,侵染5日龄大豆幼苗下胚轴,诱导毛状根2周[59.].使用PAT/bar (EnviroLogix, America)和qRT-PCR的QuickStix试剂盒筛选毛状根阳性转化子。具有阳性毛状根的转基因大豆株系命名为OE-gmnfya5(OE),空向量(EV)和RNAi-gmnfya5(RNAi),然后转移到盛有泥炭和蛭石混合物(1:1,v/v)的塑料盆(深度11厘米,直径13.5厘米)生长7天,然后去水直至枯萎。
为了分析干旱和干旱+ NAP条件下转基因大豆植株中干旱相关基因的转录情况,将3个转基因毛状根系放入H2o 1小时以消除伤口应力,按照H放置2O或1 3个月的mM NAP溶液 h、 在转移至层流罩2小时之前 h为干旱处理。根在水中漂浮2O代表的整个期间均在正常控制。All treatments were carried out in a tissue culture room at 28/18 °C day/night, 70% relative humidity and a 14/10 h light/darkness photoperiod. Roots were sampled and immediately frozen by liquid nitrogen for isolation of RNA.
转录水平分析
根据制造商在应用生物系统7500实时PCR系统上的制造商的说明,通过用转型顶部绿色QPCR Supermix(Transgen)(20μl)进行的QRT-PCR测量转录物水平。由...设计的基因特异性引物https://biodb.swu.edu.cn/qprimerdb/用于qRT-PCR检测的方法列于表S1.
失水量测定
脱离了3周历史拟南芥系的叶子,在组织培养室中在22℃和70%相对湿度下每30分钟测量重量。初始鲜重的百分比在9点时用于代表转基因和WT植物中的水损失。
ABA浓度与气孔孔径分析
在剥夺水分7天后,用ABA ELISA试剂盒(中国建城)测定大豆和拟南芥叶片的ABA浓度[60.].
叶子的质询35S:GmNFYA5在气孔开口缓冲液(5mm MES,10mM KCl,50mM CaC1中,将WT Arabidopsis幼苗进行3小时。2, pH值5.6),如前所述[61.].然后将叶子转移到h2O或10 μM ABA溶液在22℃、相对湿度70%的温室中处理2小时。测定了无叶肉细胞包围的气孔复合体的气孔孔径。
丙二醛(MDA),相对含水量(RWC)和离子泄漏的测量
在干旱治疗后,在3周龄拟南芥植物中测量了RWC和离子泄漏14天。在干旱治疗16天后测量转基因大豆植物中的MDA含量,RWC和离子泄漏。测量MDA内容物,并如前所述计算[58.,62.].RWC和离子泄漏的测定方法如前所述[63.,64.].
土壤水势测定(SWP)
当转基因大豆和拟南芥植物停止供水时,根据制造商的说明,在干旱处理试验中测量SWP,直到使用WP4-T露点仪(Decagon Devices,USA)将其降至最低水平。WP4-T露点仪因其准确性在多份报告中被用于研究[56.,65.].
转录激活测定
启动子GmDREB2(ABA-related基因)和Gmbzip1.(ABA-UNRELATE基因)被克隆到含有由CAMV 35s启动子驱动的Renilla Luciferase(REN)基因的LUC报道载体PGREEN II 0800中并用作内部对照。用PEG4000介导的转化提取并将效应和报告质粒提取并引入拟南芥原生质体中。按照描述进行测定[6].
统计分析
本研究中的所有测量都在生物学上三次复制。所有数据的方差分析都是使用SPSS统计22(IBM,USA)进行完全随机化设计模型的预制。Duncan的测试用于评估植物线或治疗之间的差异P= 0.05。
可用性数据和材料
在这项研究中的大豆基因序列是从植物基因组学资源下载(https:///phytozome.jgi.doe.gov/pz/portal.html.)和国家生物技术信息中心(https://www.ncbi.nlm.nih.gov/).本研究中的拟南芥基因序列从拟南芥信息资源(TAIR)下载(http://www.arabidopsis.org/).本研究使用的qRT-PCR引物设计于https://biodb.swu.edu.cn/qprimerdb/.qRT-PCR的基因来源及专用引物列于表S1.
本研究使用的拟南芥和大豆植物分别按照ABRC和邱丽娟博士的指导进行处理。
缩写
- 阿巴:
-
脱落酸
- 绿色荧光蛋白:
-
绿色荧光蛋白
- MDA:
-
丙二醛
- 小憩:
-
甲氧萘丙酸
- RWC:
-
相对含水量
参考
- 1.
GOLLDACK D,Luking I,Yang O.植物耐受性和盐度:胁迫调节转录因子及其在细胞转录网络中的功能意义。植物细胞批准。2011; 30(8):1383-91。
- 2.
黄GT,马胜利,白LP,张立,马H,贾P,刘俊,钟男,郭ZF。在冷,盐和干旱植物胁迫信号转导。分子生物学代表2012; 39(2):969-87。
- 3。
朱镕基JK。植物的盐和干旱胁迫信号转导。植物学报2002;53:247-73。
- 4.
李春华,李春华,李春华,等。植物对干旱和盐胁迫的耐受性研究进展。植物科学学报。2014;5:151。
- 5。
徐志生,陈敏,李凌龙,马永忠。在ERF转录因子家族在植物中的作用。植物学。2008; 86(9):969-77。
- 6。
崔XY,高Y,郭J,余TF,郑WJ,刘YW,陈J,徐ZS,马YZ。BES/BZR转录因子TaBZR2通过激活TaGST1积极调节干旱反应。植物生理学。2019;180(1):605–20.
- 7。
张立立力,赵格,夏C,贾吉兹,刘X,孔XY。小麦R2R3-MYB基因TamyB30-B,改善了转基因拟南芥中的干旱胁迫耐受性。J Exp Bot。2012; 63(16):5873-85。
- 8。
戴晓阳,徐YY,马QB,徐咏,王婷,薛YB,庄K。R1R2R3 MYB基因OsMYB3R-2的过度表达提高了转基因拟南芥对冷冻、干旱和盐胁迫的耐受性。植物生理学。2007;143(4):1739–51.
- 9。
徐志生,夏丽琴,陈明,程晓刚,张瑞英,李丽玲,赵应祥,卢勇,倪征镒,刘林,等。小麦乙烯响应因子1 (TaERF1)的分离及分子特性研究。植物学报。2007;65(6):719-32。
- 10.
关键词:9-顺式环氧类胡萝卜素双加氧酶,脱落酸,生物合成,生物活性植物杂志。2004;135(3):1574 - 82。
- 11.
陈敏,赵艳艳,卓超,卢树华,郭志强。水稻耐盐耐旱基因的克隆及表达分析。植物生态学报;2015;13(4):482-91。
- 12.
Thirumurugan T,ITO Y,Kubo T,Serizawa A,Kurata N.Hap家族基因在水稻中的鉴定,表征和相互作用。Mol Gen Genomics。2008; 279(3):279-89。
- 13.
彼得罗尼K、库莫托RW、格涅苏塔N、卡尔文扎尼V、福纳里M、托内利C、霍尔特BF 3、曼托瓦尼R。植物核因子Y转录因子的混乱生活。植物细胞。2012;24(12):4777–92.
- 14。
Laloum T,德美达S,GAMAS P,博丹男,Niebel A. CCAAT盒结合转录因子在植物中:Y这么多?趋势植物SCI。2013; 18(3):157-66。
- 15.
陈志强,王志强,王志强,等。拟南芥单克隆抗体(HAP3b)的过度表达对拟南芥主根伸长的影响。植物生理生化学报。2011;49(6):579-83。
- 16。
蔡X,BallifĴ,远藤S,戴维斯ē,梁男,陈d,DeWald d,克雷普斯Ĵ,朱T,吴Y.推定的CCAAT结合转录因子是拟南芥开花时间的调节。植物理性。2007; 145(1):98-105。
- 17。
拟南芥和烟草同源的NF-YC2亚基被光氧化胁迫激活并诱导开花。中华医学杂志。2012;13(3):3458-77。
- 18。
侯X,周Ĵ,刘成,刘升,沉L,俞H.核系数Y介导的基因SOC1开花编排拟南芥响应的H3K27me3去甲基化。NAT Communce。2014; 5:4601。
- 19。
邝RW光碟。叶状子叶1- like定义了一类对胚胎发育至关重要的调节剂。植物细胞。2002;15(1):5日至18日期间召开。
- 20。
三好K,伊藤Y,芹泽A,仓田N. OsHAP3基因调控水稻叶绿体的生物合成。植物杂志2003; 36(4):532-40。
- 21。
穆杰,谭H,郑Q,傅F,梁Y,张J,杨X,王T,崇K,王XJ,等。叶子叶1是拟南芥脂肪酸生物合成的关键调节因子。植物生理学。2008;148(2):1042–54.
- 22。
Myers Za,Kumimoto RW,SiriClana Cl,Gayler Kk,升降机JR,Pezzetta D,Holt III BF。核因子Y,亚基C(NF-YC)转录因子是拟南芥的光膀胱阳性调节因子。Plos Genet。2016; 12(9):E1006333。
- 23。
Stephenson TJ,McIntyre CL,Collet C,Xue GP。TaNF-YB3参与了普通小麦光合作用基因的调控。功能整合基因组学。2011;11(2):327–40.
- 24。
魏X,徐军,郭H,蒋丽,陈S,郁C,周Z,胡P,翟H,皖J. DTH8抑制开花的大米,同时影响株高和产量潜力。植物理性。2010; 153(4):1747至1758年。
- 25。
Wenkel S,图尔克女,歌手K,Gissot L,乐GourrierecĴ,Samach A,科普兰德G. CONSTANS和CCAAT盒结合复杂的共享的功能上重要的结构域和相互作用以调节拟南芥开花。植物细胞。2006; 18(11):2971-84。
- 26。
关键词:FPF1,水稻,开花时间,根系发育植物学报2005;24(2):79-85。
- 27。
李文霞,ooono Y,朱军,何晓军,吴建明,Iida K, Lu XY,崔旭,Jin H,朱建军。拟南芥nnfya5转录因子在转录和转录后均受到调控,以促进抗旱性。植物细胞。2008;20(8):2238 - 51。
- 28。
Lee DK, Kim HI, Jang G, Chung PJ, Jeong JS, Kim YS, Bang SW, Jung H, Choi YD, Kim JK。NF-YA转录因子OsNF-YA7以不依赖脱落酸的方式表达水稻对干旱胁迫的耐受性。植物科学。2015;241:199 - 210。
- 29。
Alam MM、Tanaka T、Nakamura H、Ichikawa H、Kobayashi K、Yaeno T、Yamaoka N、Shimomoto K、Takayama K、Nishina H等。水稻血红素激活蛋白基因(OsHAP2E)的过度表达可增强对病原体、盐分和干旱的抗性,并增加光合作用和分蘖数。植物生物技术杂志。2015;13(1):85–96.
- 30
纳尔逊DE,Repetti PP,亚当斯TR,克里尔曼RA,吴Ĵ,华纳DC,DC Anstrom,本森RJ,卡斯蒂格尼PP,Donnarummo MG。,等人。植物核因子Y(NF-Y)乙亚基赋予干旱耐受性和导致对限水英亩玉米改进的产率。国家科学院院刊美A. 2007; 104(42):16450-5。
- 31.
Ni Z,Hu Z,Jiang Q,张H.gmnfya3,miR169的靶基因,是对干旱胁迫的植物耐受性的正调节因子。植物mol biol。2013; 82(1-2):113-29。
- 32.
李伟,王涛,李勇。转基因拟南芥的转录因子GmNFYB1对其非生物胁迫抗性的影响。植物学报,2017;97(3):501-15。
- 33.
吉田T,Christmann A,山口筱崎K,烧烤E,弗尼AR。重温ABA的基础作用 - 角色压力之外。趋势植物SCI。2019; 24(7):625-35。
- 34.
细胞对脱水和冷胁迫的反应和耐受性的转录调控网络。植物学报2006;57:781-803。
- 35.
徐志生,陈敏,李凌龙,马永忠。AP2/ERF转录因子家族在作物改良中的作用及应用植物学报,2011;53(7):570-85。
- 36.
郭志强,阮海峰,阮海峰。大豆NF-Y基因的全基因组表达分析揭示了其在发育和干旱反应中的潜在功能。中国生物医学工程学报。2015;29(3):1095-115。
- 37.
倪ZY,胡Z,江QY,张H. GmNFYA3,miR169的靶基因,是植物耐受性的正调节剂对干旱胁迫。植物mol biol。2013; 82(1-2):113-29。
- 38。
Fujii H, Chinnusamy V, Rodrigues A, Rubio S, Antoni R, Park SY, Cutler SR, Sheen J, Rodriguez PL, Zhu JK。脱落酸信号通路的体外重建。大自然。2009;462 (7273):660 - u138。
- 39。
Geiger D,Scherzer S,Mumm P,Stange A,Marten I,Bauer H,Ache P,Matschi S,Liese A,Al-Rasheid Kas等。保护细胞阴离子通道SlAC1的活性由干旱应激信号传导激酶 - 磷酸酶对控制。P Natl Acad Sci USA。2009; 106(50):21425-30。
- 40.
Ma Y,Szostkiewicz I,Korte A,Moes D,Yang Y,Christmann A,Grill E.PP2C磷酸酶活性的调节剂作为脱落酸传感器。科学。2009; 324(5930):1064-8。
- 41.
柯JH,杨SH,韩KH。拟南芥RING-H2基因的上调,XERICO,通过增加脱落酸生物合成赋予耐旱性。植物杂志2006; 47(3):343-55。
- 42.
李波,刘勇,崔学勇,付建东,周彦波,郑文杰,兰建辉,金光国,陈明,马永忠,等。通过对大豆TGA转录因子的全基因组特征和表达分析,发现了一个与抗旱性和耐盐性有关的新的TGA基因。植物学报。2019;10:549。
- 43.
胡XJ,陈d,林恩麦金太尔C,费尔南达Dreccer男,张ZB,DrenthĴ,Kalaipandian S,常H,薛GP。热休克因子C2A充当在通过ABA介导的监管途径发展籽粒热保护主动的机制。植物细胞环境。2018; 41(1):79-98。
- 44。
Koornneef男,莱昂,Kloosterziel KM,施瓦茨SH,Zeevaart JAD。在拟南芥脱落酸生物合成和信号转导的遗传和分子清扫。植物生理学生物化学。1998; 36(1-2):83-9。
- 45。
罗旭,白旭,孙旭,朱东,刘波,纪伟,蔡辉,曹磊,吴军,胡敏,等。野生大豆WRKY20在拟南芥中的表达增强了抗旱性并调节了ABA信号。J Exp Bot. 2013;64(8): 2155-69。
- 46。
春日男,刘Q,三浦S,山口筱崎K,筱崎K.提高植物干旱,盐,和由单个应力诱导的转录因子的基因转移冰冻耐受性。NAT BIOTECHNOL。1999; 17(3):287-91。
- 47。
张旭,张斌,李明杰,尹晓明,黄丽芬,崔永超,王明明,夏霞。水稻c2h2型锌指蛋白OsMSR15基因的克隆及其对水稻抗旱性的影响。植物学报,2016;59(3):271-81。
- 48。
关键词:ABA-Insensitive3(ABI3)/Viviparous1, AtABI5转录因子共表达,抗旱性生物技术学报;2014;12(5):578-89。
- 49。
陈敏,王启勇,程晓刚,徐志生,李凌亮,叶晓刚,夏立强,马永忠。GmDREB2是一种大豆drea结合转录因子,在转基因植物中具有耐干旱和高盐性。生物化学学报。2007;353(2):299-305。
- 50
陈M,Xu Z,夏L,Li L,Cheng X,Dong J,Wang Q,MA Y.在大豆(Glycine Max L.)中的DRE结合转录因子基因,GMDREB3的冷诱导调节和功能分析.J Exp Bot。2009; 60(1):121-35。
- 51
金T,张Q,李伟,尹d,李Z,王d,刘斌,刘L. GmDREB1的应力诱导表达转基因苜蓿赋予的耐盐性。植物细胞组织器官的崇拜。2009; 100(2):219-27。
- 52
拟南芥DREB2基因编码的drec结合蛋白参与脱水和高盐反应基因表达的组织和表达。植物学报。2000;42(4):657-65。
- 53
王RK,王策,飞YY,盖JY,赵TJ。全基因组的识别和大豆类胡萝卜素氧基因的转录分析期间的非生物胁迫处理。分子生物学代表2013; 40(8):4737-45。
- 54
高树全,陈明,徐志生,赵长平,李丽,徐慧娟,唐玉梅,赵旭,马永忠。大豆GmbZIP1转录因子能增强转基因植物的多种非生物抗逆性。植物学报。2011;75(6):537-53。
- 55.
Mutava RN,SJK王子,Syed NH,Song L,Valliyodan B,Chen W,Nguyen HT。了解大豆中非生物胁迫耐受机制:大豆对干旱和洪水应力的比较评价。植物生理学生物化学。2015; 86:109-20。
- 56.
Bresson J,Varoquaux F,BontPart T,Touraine B,Vile D. PGPR菌株Phyllobacterium STM196诱导生殖延迟和生理变化,从拟南芥中改善耐旱性。新植物。2013; 200(2):558-69。
- 57.
赵世朋,徐志松,郑文杰,赵伟,王应祥,于飞,陈敏,周玉波,闵德辉,马永忠,等。大豆RAV家族的全基因组分析和GmRAV-03参与盐、干旱胁迫和外源ABA处理的功能鉴定。植物学报2017;
- 58.
刘鹏,徐志生,陆鹏,胡丹,陈敏,李凌龙,马永忠。小麦PI4K基因的产物具有苏氨酸自磷酸化活性,在拟南芥中具有耐旱和耐盐性。中国农业科学。2013;64(10):2915-27。
- 59.
Kereszt A,李DX,Indrasumunar A,阮CDT,Nontachaiyapoom S,Kinkema男,Gresshoff PM。发根农杆菌 - 介导的大豆转化为研究根系生物学。NAT PROTOC。2007; 2(4):948-52。
- 60.
王Y,李T,SJ约翰,陈男,常Ĵ,杨G,他G的CBL相互作用蛋白激酶TaCIPK27赋予耐旱性和转基因拟南芥外源ABA的敏感性。植物生理学生物化学。2018; 123:103-13。
- 61.
田伟,侯川,任志军,潘玉军,贾建军,张宏文,白福林,张鹏,朱海峰,何玉康,等。拟南芥CO2响应的分子途径。Nat Commun。2015;6。
- 62.
吕S,杨A,张K,王L,张J。甜菜碱合成的增加提高了棉花的耐旱性。摩尔品种。2007;20(3):233–48.
- 63.
吕S,苏伟,李H,郭Z。脱落酸提高三倍体狗牙根的耐旱性,并涉及过氧化氢和一氧化氮诱导的抗氧化酶活性。植物生理生化。2009;47(2):132–8.
- 64.
郭志,欧伟,卢舒,钟强。4个不同敏感水稻品种抗氧化系统对低温和干旱的响应差异。植物生理生化学报。2006;44(11-12):828-36。
- 65.
阿瑟·E,土佬男,Moldrup P,Resurreccion交流,医药盘MS,川本K,小松T,德容格LW。土壤的比表面积和在低饱和度土壤保水的非奇点。土壤科学志上午J. 2013; 77(1):43-53。
致谢
我们提供的大豆种子感谢丽娟邱博士(作物科学研究所,中国农业科学院)。
资金
这项研究是由经济中国农业(2018ZX0800909B)部的国家转基因重大项目的设计和执行实验的支持,和中国国家自然科学基金(31871624)进行数据分析,编写和修改稿件。
作者信息
隶属关系
贡献
ZSX和JHZ协调项目,构思,设计性实验,并编辑书稿;XJM进行了实验,并写了第一稿;TFY,XHL,WJZ,XYC和JM进行生物信息学和工作进行的实验;JC,YBZ和MC提供分析工具和管理试剂;YZM协调项目;XJM贡献了宝贵的讨论。所有作者都已经阅读并赞成最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究不适用伦理审批和参与同意。
同意出版物
本研究不适用于出版的同意。
利益争夺
两位作者宣称没有相互竞争的经济利益。
额外的信息
出版商说明
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
GmNFYA5在拟南芥的保守结构域和NF-YA家族成员的序列比对。(A)序列在GmNFYA5保守结构域和在拟南芥NF-YA家族的10个成员的对准。两个子域和链接下划线。星号表示关键氨基酸。的(B)系统发育分析gmnfya5拟南芥NF-YA家族有10个成员。使用MEGA 7.0构建了无根邻接树。
附加文件2:图。S2。
RNAi-序列gmnfya5.发夹结构由三个序列组成:RNAi-的正序列gmnfya5在绿蓝色,反向互补序列,和内含子gmnfya5紫色。限制性网站以区域我和BstEII在水平线上方用红色表示。将序列插入pCAMBIA3301载体,生成pCAMBIA3301:RNAi-gmnfya5.构造。
附加文件3:图S3。
离子渗漏的35S:GmNFYA5拟南芥在正常和干旱条件下处于苗期。数据代表三个生物重复的平均SD。显著差异P < 0.05由列上方的不同字母表示。
附加文件4:表S1。
在这项研究中用于定量RT-PCR引物清单。
附加文件5:表S2。
基因的启动子序列分析,通过上调gmnfya5在转基因拟南芥和大豆株系中。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
马,xj。,yu,tf。,李,xh。et al。过度的gmnfya5赋予耐旱性,以转基因拟南芥和大豆植物。BMC植物BIOL.20,123(2020)。https://doi.org/10.1186/s12870-020-02337-z
收到了:
接受:
发表:
关键字
- ABA敏感性
- 甘氨酸最大
- 核因子ya.
- 耐药机制