摘要
背景
生物和非生物胁迫是农业中生长、持久性和产量下降的主要原因。在过去的十年中,rna测序和利用改变胁迫相关基因表达的转基因技术已经被用来更好地了解导致多种物种耐盐的分子机制。鉴定转录因子,当在植物中过度表达时,提高多重胁迫耐受性可能对作物改良有价值,但有时过度表达导致在正常植物生长过程中的有害影响。
结果
Brachypodium与野生型相比,组成型表达BdbZIP26:GFP基因的植株身材较低。通过RNA-Seq比对WT和bZIP26转基因植株,发现了7772个差异表达基因(DEGs)。其中987个基因在3个转基因品系中均有差异表达。这些deg中的许多与那些经常观察到的响应非生物和生物胁迫的deg相似,包括信号蛋白,如激酶/磷酸酶、钙/钙调蛋白相关蛋白、氧化酶/还原酶、激素生产和信号转导、转录因子以及疾病反应蛋白。有趣的是,有许多与蛋白质周转相关的deg,包括泛素相关蛋白、F-Box和U-box相关蛋白、膜蛋白和核糖体合成蛋白。转基因和对照植株暴露在盐胁迫下。在控制条件下,WT和转基因株系之间的许多DEGs也在WT中表达差异,以响应盐度胁迫。这表明,转录因子的过度表达将植物置于一种应激状态,这可能导致植物的身材下降。
结论
与野生型相比,BdbZIP26:GFP的组成表达对植物生长产生整体负面影响,导致植物发育不良,在盐胁迫条件下对野生型植物的响应也类似。基因表达分析的结果表明,转基因植物处于一种持续的应激状态,它们试图分配资源以生存。
背景
生物和非生物胁迫在农业生产中造成重大损失,因为作物的生长、持久性和产量下降。确定减少产量损失和提高抗逆性的可行战略对实现全球粮食安全目标至关重要。为了开发这些策略,了解植物如何在分子水平上感知和响应胁迫是非常重要的,这有助于识别提高植物抗逆性的目标基因或途径。近年来,关于植物对各种生物和非生物胁迫的感知、信号和反应的关键组成部分,已经有了许多研究。植物利用受体、膜通道、各种类型的激酶和磷酸酶、离子通量、钙/钙调素相互作用蛋白、活性氧(ROS)和植物激素来感知和传递不同类型的胁迫[1].转录因子(TFs)参与信号级联反应,是调控基因表达以应对生物和非生物胁迫以及生长发育的关键组成部分[2,3.].植物中大约有60个不同的转录因子家族[4],一些家族更频繁地与植物的生物和非生物胁迫反应相关,如MYB (v-myb禽成髓细胞病病毒癌基因同源物)[5], bHLH [6), AP2 /小块土地[7,8], WRKY [9),南京(10]及bZIP转录因子[11,12,13].
在过去的几年中,人们从各种植物的转录组中发现了碱性亮氨酸拉链(bZIP)转录因子[11,12,13,14].bZIP转录因子家族的特点是具有一个结合DNA的基本区域和一个亮氨酸拉链二聚体(N - X7- r / k - x9- l - x6- l - x6- L) (11].这是一组较大的植物转录因子,其成员参与植物生长发育的许多方面,如萌发、种子成熟、衰老和开花;还有参与生物和非生物应激反应网络的成员[11].为了更好地了解bZIP转录因子在胁迫响应中的作用,该家族的几个成员在不同的植物物种中被过表达或沉默,以评估它们对非生物/生物胁迫耐受性的影响及其对植物生长发育的影响。小麦lip19 bZIP转录因子(Wlip19),它被低温、干旱和ABA激活,当在烟草中过表达时,赋予了提高的非生物胁迫耐受性[15].过度的BrachypodiumbZIP10转录因子(Bradi1g30140.1) inBrachypodium诱导几种保护性氧化应激基因的表达,导致氧化应激耐受性增加[16],对植物生长发育的影响很小。小麦TabZIP60该基因在聚乙二醇、盐、低温和脱落酸(ABA)处理下有较强的诱导作用,在过表达时能提高抗旱性、耐盐性和抗冻性拟南芥,随着幼苗表现出对ABA的敏感性增加[17].另一个小麦转录因子TabZIP174定位于细胞核,并对ABA敏感。转基因拟南芥overexpressingTabZIP174脯氨酸、可溶性糖和叶绿素含量较高,抗旱性较好[18].干旱-、ROS-和aba诱导的水稻bZIP62转录因子在使用增强型启动子(35S + VP64通用转录激活模块)在水稻中过表达时,表现出对干旱和氧化胁迫的耐受力增强[19].当热、盐、冷、脱水反应型小麦bZIP转录因子在拟南芥,转基因植株对盐度、干旱、高温和氧化胁迫的耐受性更强,活性氧清除酶水平升高,活性氧水平降低[14].很明显,bZIP家族转录因子在植物对非生物胁迫的响应中起着不可或缺的作用。
最近,有96个bZIP转录因子在Brachypodium distachyon对其在各种植物组织中的表达水平以及对一系列环境胁迫、重金属胁迫和植物激素的响应进行了表征和分析[12].在他们的研究中,他们发现bZIP27 (Bradi1g76690;草bZIP26(我们的bZIP26)在低温、高温、聚乙二醇、氯化钠、水杨酸、苄氨基嘌呤和脱落酸胁迫下表达上调。此外,bZIP27的表达随着重金属(如锰、镉和铅)的暴露而下调。他们还预测bZIP27能够与其他bZIP转录因子进行同源或异二聚。Bradi1g76690在水稻中的同源性为Os03g03550 (OsbZIP25)、Os08g43090 (osbzip68)和Os10g38820 (OsbZIP78);拟南芥中最接近的同源基因为At4g38900 (AtbZIP29)和At2g21230 (AtbZIP30) [12].Bradi1g76690编码的蛋白序列在NCBI上有一个BLAST,与RF2a和RF2b蛋白同源。该家族的成员最初被确定为与水稻东gro病毒启动子中的Box II序列相互作用的蛋白质,并负责激活病毒的转录[20.,21].本文描述了在组成性启动子控制下过表达bZIP26:GFP对植物生长的影响,以及野生型之间转录组差异的分析Brachypodium(WT)和转基因Brachypodium在控制和长期盐胁迫条件下的植株(TR)。
结果
与野生型相比,转基因株系的表达及表型分析
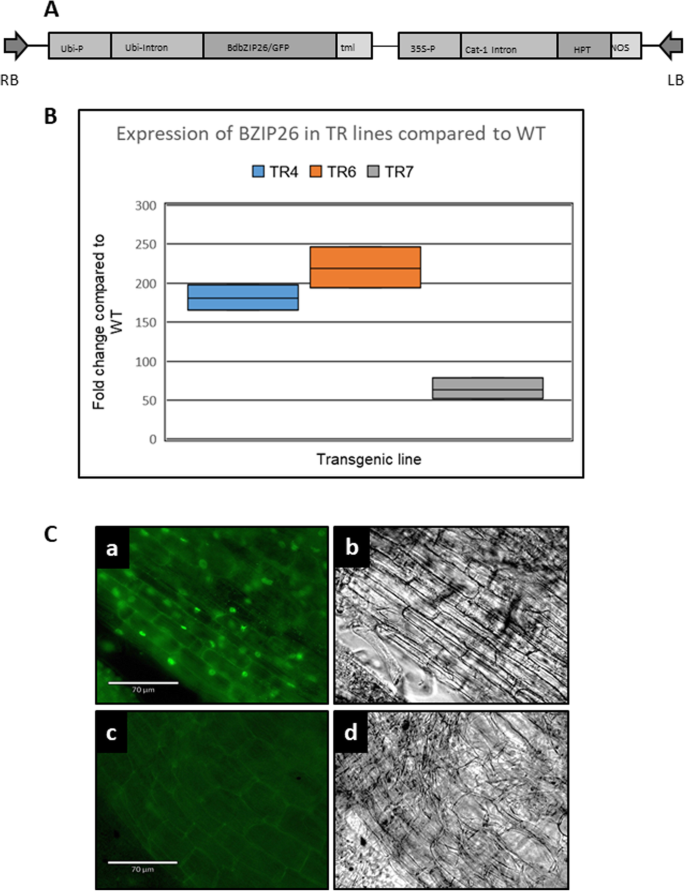
与对照条件下的野生型植株相比,检测来自三个独立转化事件的植株(TR4、TR6和TR7)的bZIP26表达水平。与WT相比,转基因植株的转基因表达水平变化范围如图所示。1B. TR7在3个转基因株系中表达量最低,较WT增加64倍。与WT相比,TR4和TR6的表达量增加了1倍,平均分别为181和219。接下来,我们想确定蛋白质在细胞内的位置。利用Echo Revolve D137显微镜在明亮视野和荧光条件下(Echo Laboratories;圣地亚哥,CA)。转基因根截面图像如图所示。1C-a(荧光)和C-b(亮场)。荧光信号在细胞核中很强,这与它作为转录因子的活性是一致的。沿细胞边缘可见微弱的荧光阴影,但在荧光下WT根中也可见(图1)。1碳碳)。WT根的亮场图像如图所示。1c - d。
Brachypodium以野生型和纯合子TR4、TR6和TR7植株为研究对象,研究转基因对正常和盐度胁迫下植株生长的影响。令人惊讶的是,与野生型相比,未经处理的转基因植株的身材有所下降(图。2a), TR4植株最短。对3周龄植株的分析显示节间长度的变化。与WT(17.8+/−1.3 mm)相比,TR4(12.65+/−1.1 mm)和TR6(14.0+/−.89 mm)前两个节点之间的距离显著减少(数据未显示;TR7未测),但下一个节间向上的长度在WT系和TR系之间无显著差异。在½强度的MS培养基上生长的幼苗的身材下降也很明显[22,如图所示。2b. WT植株(幼苗1-3,从板左侧开始)的根和梢比TR4(幼苗4-6)、TR6(幼苗7-9)和TR7(幼苗10-12)发育得多。为了确定激素是否能缓解生长差异,我们将种子置于含2 μM ABA的½强度MS培养基中,但在这种培养基中,WT和TR株系都不能发芽(数据未显示)。当种子先发芽,然后放置在½MS和2 μM ABA的环境中,令人惊讶的是,转基因植株一开始比根和芽更长的野生型植株生长得更快,但在生长2周后,叶片顶端开始出现坏死。2c).为确定转基因植株的矮化表型是否可以用GA拯救,将种子发芽后置于½MS含20 μM GA3的培养基上。转基因植株的生长与加了ga的培养基上的野生型植株相似,或略快(图1)。2d).我们还想看看转基因植物在盐度胁迫下的表现。在本试验中,4 - 5周龄植株用100 mM盐处理3周。盐胁迫会导致野生型和转基因植株发育不良(图1)。2e).野生型植株仍然比转基因植株大,但差异没有对照条件下那么明显(图2)。2a), WT植株叶片顶端坏死较多(图1)。2e)。
bZIP26:GFP转基因株系(TR)相对于野生型(WT)植株的生长。一个TR4、TR6、TR7和WT植株在Conviron PGW40生长室中生长7.5周。罪犯预萌发种子在Murashige和Skoog培养基上的组织培养TC80室生长。对于所有的盘子,幼苗从左到右排列;3株WT植株、3株TR4植株、3株TR6植株、3株TR 7植株和平板垂直放置在生长室中。幼苗在以下培养基上生长,时间如下:b½MS培养基,不含激素12 d;c½MS介质,2 μM ABA处理21 d;或d½MS介质,20 μM GA3, 7d;e盐度对WT和TR植物生长的影响,在相同的条件下生长一个用100 mM NaCl处理3周
RNA-sequencing
为了研究转基因植株矮化表型的潜在分子机制,以及盐胁迫对WT和转基因植株的影响,我们对WT、TR4、TR6和TR7植株在对照和长期盐胁迫(100 mM盐胁迫3 wks)下的RNA-Seq进行了研究。测序产生的库平均每个库5273万次读取(表1).从每个RNA-Seq复制中,大约89%的高质量过滤reads与Brachypodiumv3.1基因组。的所有库的读计数的摘要和映射到Brachypodium野生型和对照TR4、TR6和TR7的生物复制(H2O)和长期盐(salt)条件见表1.所有差异表达基因的热图2小于2或大于2的fold changes显示在补充图1(附加文件2).这张热图显示了控制和盐处理,以及控制条件下的WT和TR系的不同分支。
野生型与转基因系(TR)在对照条件下的基因表达分析
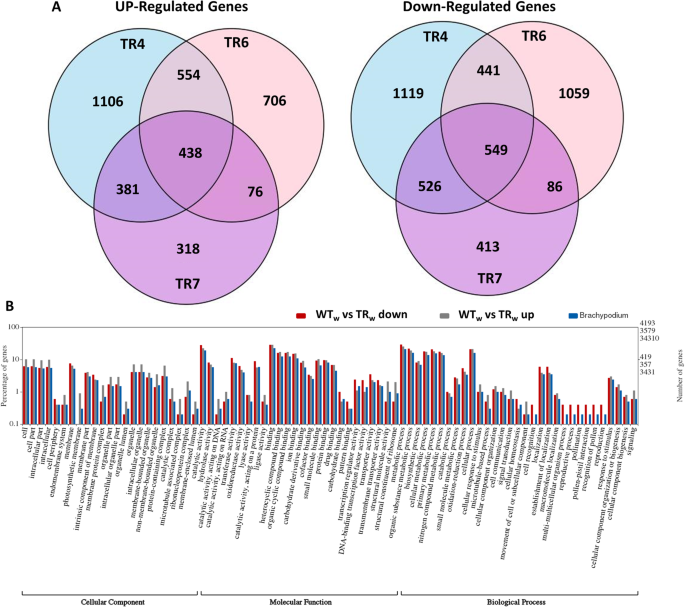
比较WT与所有TR系的基因表达情况。总的来说,与野生型相比,在对照条件下生长的TR系中有7772个基因被鉴定为差异表达(4193个下调,3579个上调)(附加文件)3.:表S2)。在TR和WT比较中发现的3579个上调基因中,3个转基因株系共有438个基因。图中是TR中上调和下调基因相对于WT的三向文氏图。3.a. TR系中与WT相比差异下调的4193个基因中,3个转基因系共有549个基因。转基因系7的总体差异表达基因数最低,为2787个;与正常条件下的WT相比,有1213个上调,1574个下调。3.a).转基因株系4与对照条件下的WT相比,有5114个差异表达基因(上调2479个,下调2635个),TR6有3909个差异表达基因(上调1774个,下调2135个)。
为了更好地了解TR系和WT系之间差异调控的基因类别,我们使用WEGO (Web Gene Ontology Annotation Plot)程序对差异表达基因在细胞成分、分子功能和生物过程类别中的GO注释进行分析。WEGO图显示了过多和不足代表的GO术语,以及每个类别的基因数量和百分比Brachypodium转录组。WT植物与TR4、TR6、TR7系之间差异表达基因(DEGs)显著上调和下调的基因类别,以及各类别基因总数(%)Brachypodium如图所示。3.b.在细胞成分类别中,与WT相比,TR中基因上调的亚类别中,大多数与细胞部分、膜(内膜、光合作用、蛋白复合物)、细胞器(细胞内、膜结合、非膜结合)和各种复合物(蛋白、微管相关、催化和核蛋白)相关。有趣的是,下调基因在光合膜、细胞器管腔、膜蛋白复合物和封闭管腔膜亚类中表现不足。在分子功能类别中,上调基因在催化(水解酶、DNA、RNA)、氧化还原酶、裂解酶、连接酶、与各种化合物结合、结构分子活性和核糖体结构成分亚类别中略过表达,在碳水化合物和DNA结合转录因子活性亚类别中仅略过表达。在大多数亚类中,分子功能类的下调基因普遍略过表达,但在核糖体亚类的催化活性(作用于RNA或DNA)、结构分子活性和结构成分等方面的表达不足。对于生物过程,许多亚类别中上调和下调基因的比例都略高,包括代谢、生物合成和分解代谢过程、对刺激的反应和细胞成分亚类别的生物发生。在繁殖亚类中,没有上调基因,下调基因过多。信号传导、生物发生和细胞对刺激亚类别的反应在上调基因中略过。
与野生型相比,转基因系在对照条件下的基因表达有差异
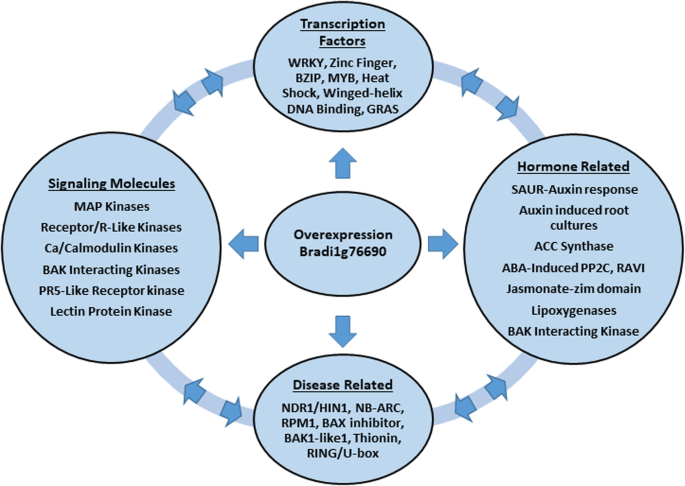
为了进一步研究bZIP26的过表达如何调节基因表达,从而影响TR系与WT相比所观察到的变化,我们分析了至少两个转基因系中存在的上调和下调基因。根据图中超过/不足的GO术语类别。2,我们进行了关键词搜索,以识别与野生型相比,转基因系中潜在的信号通路、生物合成通路和代谢通路的差异调控(表2).至少有2个转基因系较WT上调和下调的基因总数分别为1449和1604。在这些基因中,有347个上调基因和221个下调基因没有功能注释(表)2).根据图中WEGO图表。3.在美国,对刺激的反应是被过度代表的GO子类别之一,这包括与感知、信号和对不同压力的反应相关的基因。在生物和非生物胁迫反应中,植物经常使用钙+ 2钙/钙调蛋白结合蛋白/激酶和钙调神经蛋白b样蛋白及其相互作用激酶作为传感器和信号蛋白([23]及内部的参考文献,[24])。使用“钙调素”、“钙调素”和“钙调神经磷酸酶”查询上下两组基因,结果显示,与野生型相比,TR系中有32个钙/钙调素/钙调神经磷酸酶基因差异下调,只有6个基因差异上调(表)2).钙调素结合蛋白/激酶在这些下调基因中表达最高,但也有钙依赖蛋白激酶和EF手钙结合蛋白表达下调。钙依赖的脂质结合蛋白,被认为参与信号转导和囊泡运输[25],但也可能消极调节防御反应[26和细胞死亡[27],在下调和上调的DEGs中都存在。
包括上述钙相关蛋白激酶,与WT相比,转基因植物中有75个上调表达的蛋白激酶和140个下调表达的蛋白激酶差异(表)2).各种类型的激酶,如富亮氨酸重复序列、富亮氨酸受体样蛋白激酶、丝裂原活化蛋白激酶(MAPK)和MAPK KKs均存在于上调和下调的DEGs中。凝集素相关蛋白激酶,参与激素信号和生物和非生物应激感知[28],在下调的DEGs中表现得更明显。富含半胱氨酸的受体样激酶,在多种非生物胁迫下诱导,并参与病原体反应和细胞死亡[29,30.],在下调的DEGs中表现得更明显。其他几种仅存在于下调的DEGs中的蛋白激酶包括“U-box结构域蛋白激酶”,可能参与目标蛋白的泛素化和随后的降解[31];“壁相关激酶”,由激素和损伤诱导,参与抗病信号传导[32,33];和参与油菜素内酯信号转导的BAK1激酶[34,35和病原体反应[36].
植物蛋白磷酸酶调节蛋白激酶的作用,是磷调节信号系统的组成部分[37].蛋白磷酸酶2A和2C在信号转导中起关键作用[37],在下调的DEGs中更为普遍。有趣的是,与野生型相比,aba诱导的PP2C基因3 Bradi2g54810表达下调,而另一个与ABI3/VP1 2相关的基因(RAV1;Bradi2g02710)差异。RAV1被认为是生长负调控因子,油菜素内酯可抑制RAV1基因表达。有趣的是,RAV1过表达导致ABA不敏感[38].在上调的DEGs中,其他激素相关基因包括乙烯生物合成限速酶1-氨基环丙烷-1-羧酸合酶7(增加~ 36倍)[39].此外,还有几个生长素应答基因(“SAUR-like生长素应答蛋白家族”和“生长素诱导根培养1”)被上调[40,41].TR系中下调的激素相关基因还包括编码9-cis-环氧类胡萝卜素双加氧酶9的基因,该基因是ABA生物合成的关键酶[42],以及一个编码茉莉酸-子域蛋白11的基因,该蛋白是JA信号通路的重要组成部分[43].
另一类“刺激反应”蛋白质包括植物对病原体做出反应时产生的蛋白质。163个分类为病原/抗病的基因热图与log相关并有差异表达2小于2和大于2的折叠变化见补充图2(附加文件4).在这张热图中,WT和TR6形成了一个远离TR4和TR7的簇,这与TR6表型与WT的差异小于其他两个转基因株系是一致的。这个热图包括R蛋白,它有一个核苷酸结合位点和一个富亮氨酸重复序列(NBS-LRR) [44].具有NB-ARC结构域和/或LRR结构域和抗病响应(dirigt -like蛋白)的抗病基因[45]在上调的DEGs中更为普遍2),而NPR1-like蛋白(病原体相关基因1-like的非表达者),在植物病原体相互作用中也很重要[46],只存在于下调的DEGS中。有几个编码“MATE外排蛋白家族”成员的基因被显著下调。该家族的成员与拟南芥的抗病性有关,并参与水杨酸的合成和运输出叶绿体[47,48,49].三个编码抗菌肽的硫蛋白基因[50],在上调基因中发现,在下调基因中存在一个。
五肽和四肽重复序列(PPR, TPR)蛋白主要在叶绿体和线粒体中发挥作用,它们可以结合RNA转录本,通过稳定RNA转录本、调节翻译以及在细胞器基因的转录和翻译中发挥作用来影响它们的表达[51,52].四聚肽重复序列在类囊体膜生物发生中是必不可少的[53和四聚肽重复Pyg7,被证明参与光系统I (PSI)的稳定性,并对PSI组装至关重要[54].有趣的是,五肽和四肽重复DEGs在差异上调基因中比在下调基因中更普遍(表)2).除了增加光系统稳定性的五四肽重复序列基因外,还有许多编码光系统II反应中心蛋白的基因,这些基因在上调的DEGs中表现得更为明显。
导致基因表达差异的机制有很多。一种可能很少被人想到的是核糖体蛋白在转录后和翻译调节中的作用[55,56,57].特异性核糖体蛋白在非生物和生物胁迫下的差异表达之前已经有报道[55,56,58,59].有趣的是,在这项研究中,核糖体蛋白在上调(41个上调,9个下调)的DEGs中有更高的表达。编码核糖体蛋白和光合作用相关蛋白的基因在细胞成分类别中也最为丰富。
转录因子在调节应激反应基因表达方面也很重要。在56个转录因子家族中,有几个转录因子家族通常与应激反应相关,包括MYB、WRKY、bZIP、NAC和AP2-ERF [60].转录因子和差异表达的213个基因的热图2小于2或大于2的fold changes显示在补充图3(附加文件5).这张热图显示了在控制条件下TR基因型在一个分离于WT的分支中聚类,并且TR4和TR7之间的关系更密切,这与观察到的表型相一致。在3个转基因株系中,有63个转录因子在对照和至少2个株系之间表达差异,其中45个转录因子下调,这可能表明植物为了生存而选择性地降低代谢。在这些下调的基因中,bZIP、Heat Shock和GRAS转录因子家族各有4个。在WRKY和MYB转录因子家族中,分别有15个和8个成员表达下调。WRKY和MYB家族转录因子在植物发育、激素信号转导以及对多种生物和非生物胁迫的响应等过程中发挥着重要的调控作用[9,61,62].MYB转录因子也与BHLH(碱性螺旋-环-螺旋)蛋白相互作用[63],该家族共有8个成员,同样存在差异下调。4个bZIP转录因子分别存在于上调和下调的DEG类别中,这很有趣,因为已知bZIP转录因子可以与其他bZIP蛋白同源或异二聚。GRAS蛋白在激素(赤霉素和茉莉酸)信号、光敏色素信号和分生组织发育中起重要作用[64,65],并且在上调(2)和下调(4)的DEGs中都存在。NAC结构域包含蛋白质,参与各种应激信号通路,并可能在激素之间的相互作用中发挥作用[66,67],在下调的DEGs中表现得更明显(下调15个DEGs)。这21个上调转录因子包括MYB(9)、bZIP(4)、GRAS(2)、NAC(3)和WRKY(3)基因家族成员。有可能,差异下调基因水平的增加是植物将其资源重新分配到对植物生存至关重要的程序的结果。
有趣的是,WT系和TR系之间有一些与细胞周期和细胞死亡过程相关的基因表达存在差异。cyclin D3编码的上调基因之一,该家族成员参与细胞分裂期间的G1-to-S转变,并被认为有助于调节细胞周期进程,以响应营养和激素信号[68].其他上调基因编码的小gtpase,在细胞周期进程中很重要,以及相互作用的基因,如“Ran BP2/NZF锌指状超家族蛋白”[69和“来自植物的rho相关蛋白9”[70].有趣的是,负责从无活性GTPase向活性GTPase转化的基因编码蛋白,如RHO鸟嘌呤交换因子3和Rab GTPase激活因子家族蛋白被下调[69,70].其他一些与细胞死亡相关的基因也存在于下调的DEGs中。这些基因编码了一个Bax抑制剂-1蛋白,该蛋白抑制细胞死亡引发Bax蛋白;和Bcl-2相关的anthanogene (BAG)蛋白家族成员,被认为在促进细胞生存中发挥关键作用(综述在[71])。调节细胞周期和细胞死亡的能力可能是转基因系为生存分配资源的必要条件。
盐胁迫下转基因系与野生型植株的比较
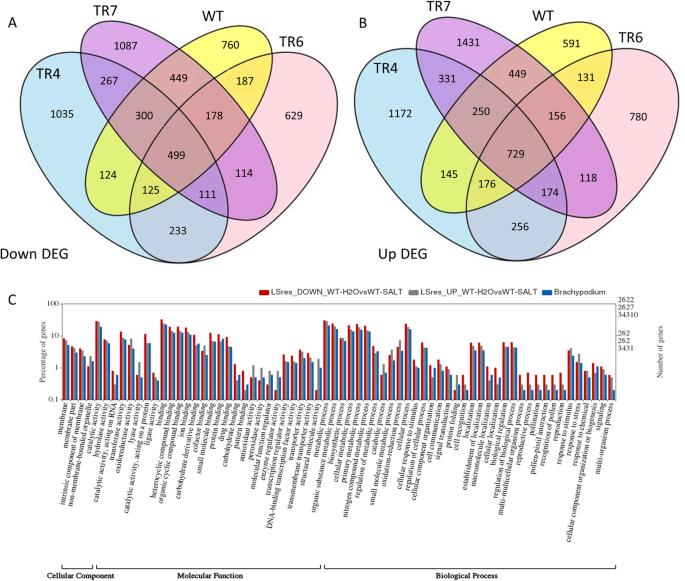
为了更深入地了解转基因株系和WT株系之间的差异,我们研究了长期盐度胁迫对植物生长的影响。经过3周的盐胁迫(100mm NaCl), WT和转基因株系都发育不良,开始出现叶尖褐变现象,WT株系的叶尖褐变现象更为明显(图1)。2e). Venns基因中对长期盐胁迫的上下调控基因数据列于表S3(附加文件)6).图中显示了TR4、TR6、TR7和WT在盐胁迫下共有且唯一的上下调控基因的文氏图。4a(向下)和b(向上)。表中总结了盐胁迫对DEGs的影响3..在长期盐胁迫下差异调控的12987个基因中,与对照相比,处理植株中53%的基因表达上调,47%的基因表达下调。所有转基因系与WT之间约有11%的上调基因和8%的下调基因是相同的(表3.).只有2.5%的上调和1.8%的下调基因在三个转基因株系中都有,而在WT中没有。另外大约10%的上调和下调基因只在三个转基因株系中的两个中存在,而在WT中没有(表)3.).如果观察每个转基因株系与WT之间唯一共享的deg的比例,在39 - 47%的单个转基因株系中与WT共享,而38-60%的WT deg与每个TR株系共享。虽然TR7分享了更多的WT deg,这可能是由于与该转基因系相关的deg总体数量较多。TR6似乎与WT最相似,因为总的上调和下调的TR6 deg中也有47%存在于WT的deg中。TR4可能与WT的差异最大,大约有40%的上调和下调的DEGs与WT的DEGs共享。TR4也是转基因株系中矮化程度最高的。
为了更好地了解野生型和TR型植物在长期盐胁迫下的差异调控基因类型,利用WEGO程序对这些差异表达基因在细胞成分、分子功能和生物过程类别中的GO注释进行分析。对照和长期盐处理WT植株中DEGs显著上调和下调的亚类,以及各亚类的基因总数(%)Brachypodium转录组如图所示。4c.在野生型植物中,上调和下调的DEGs均在膜部分亚类中过多;而在非膜结合细胞器亚类中,上调和下调的基因分别过多和过少。分子功能类的几个组在下调和上调的DEGs中均有过度表达,如结合、转运体、催化活性和连接酶;而上调基因在裂解酶、抗氧化、过氧化物酶和结构分子类中过多;而下调基因在催化(RNA和蛋白质)、连接酶、结合(碳水化合物、小分子、蛋白质)和转录中过多。在生物过程方面,许多亚类别在上调和下调的DEGs中都略有过度。过度表达下调基因的亚类包括细胞对刺激的反应、细胞过程/成分、细胞识别和定位以及繁殖。上调的DEGs在分解代谢过程、蛋白质折叠、应激反应和氧化还原等与非生物应激反应相关的过程中均有表达。在转基因株系中也发现了许多相同的趋势(数据未显示),但在转基因植物中,细胞和细胞器成分亚类别中,DEGs上调和下调的比例更高。与结构分子活性相关的上调的DEGs在WT中表达过多,而在TR中表达不足。 While the up-regulated DEGs in the peroxidase category were highly over-represented in the WT plants, they were not enriched in the transgenic lines. Many of the categories over- and under-represented are what one would expect in plants responding to abiotic stress.
由于在对照条件下TR株系发育不良,与盐胁迫下的WT株系相似,我们认为在对照条件下WT和TR株系之间差异表达的基因是否会与盐胁迫下WT中唯一差异表达的基因重叠将是一件有趣的事情。在所有3个转基因系中,与野生型相比,在对照条件下上调的438个基因中,在长期盐条件下的野生型中也上调了202个基因。同样,在所有3个转基因系中,与对照条件下的野生型相比,549个基因下调,其中226个基因在长期盐胁迫下的野生型植株中也下调,这表明这些重叠基因在盐胁迫应答中发挥了作用。这也意味着,与对长期盐胁迫不敏感的WT相比,TR系中有323个下调和236个上调的DEGs。与野生型相比,在所有三个TR系中存在的基因,在野生型长期盐胁迫下的DEGs中不存在的基因,使用豹分类系统进一步检查[72]来识别存在的基因类型。下调的DEGs与催化活性、结合活性和转运蛋白活性有关,主要的蛋白质类别为水解酶、氧化还原酶、转移酶和转运蛋白。上调的DEGs也主要分为催化活性和结合活性两大类,蛋白类与核酸结合、水解酶、转移酶、转运体和酶调节性相关。盐处理后的野生型植物共有基因的基因分类和总上调、下调的DEGs没有发生较大的变化。
rna测序数据的定量RT-PCR验证
为了验证RNA-seq结果,采用qRT-PCR对RNA-seq结果中鉴定的DEGs进行分析。选取WT系与TR系在对照和盐胁迫下差异表达的基因进行分析。RNA-Seq和qRT-PCR结果的比较见图S4(附加文件7).所有基因的RNA-seq结果与qRT-PCR结果基本一致,验证了RNA-seq文库。
讨论
在过去的20年里,人们越来越多地利用生物技术来提高作物的抗逆性。据报道,过表达bZIP转录因子可增加对干旱、盐度、寒冷和/或病原体的耐受性[3.].bZIP27(与我们的BZIP26相同)转录因子先前被发现对冷、热、聚乙二醇、氯化钠、水杨酸、苄氨基嘌呤和脱落酸有反应[12,这表明它可能在应激反应中发挥关键作用。在本文中,我们研究了过表达bZIP26以提高抗逆性的可能性,研究了组成型过表达bZIP26转录因子对植物表型的影响,并比较了野生型和bZIP26转基因株系在控制和盐度胁迫条件下的转录组。在NCBI网站上进行BLAST搜索,发现与Bradi1g76690蛋白同源性最近的一个拟南芥同源性为46% (AAK84220.1)。拟南芥bZIP29蛋白在拟南芥核心细胞周期机制的相互作用组学研究中被鉴定[73],后来被证明在增殖组织中表达,并参与细胞壁组织[74].在我们的研究中,当培养基中添加GA时,组织培养中观察到的生长发育不良得到了缓解,并且在ABA存在下TR系比WT生长得更好。这表明,在转基因植物中观察到的身材下降与激素有关。这种发育不良的表型与Van Leen等人的研究是一致的。74],当他们在拟南芥中过表达bZIP29基因时,植株叶片生长受损,叶片数量减少。
为了进一步研究转基因植株的发育不良表型,我们比较了野生型植株和对照条件下TR系的转录组。转录组分析显示,bZIP26过表达影响的基因范围很广。图中是WT和转基因系之间差异表达的基因汇总。5.在我们的分析中,我们发现了许多参与激素生物合成、感知和反应的deg。有趣的是,RNA-Seq揭示了几个编码abi -1样蛋白的基因的下调。ABI蛋白是在筛选ABA不敏感突变体时首次发现的,这些突变体可以在ABA存在的情况下生长[75].我们还发现ABA生物合成途径中的一个基因- 9 -顺式环氧类胡萝卜素双加氧酶在转基因植物中表达下调。这与转基因幼苗在ABA胁迫下生长的能力是一致的。有趣的是,其中一个编码ACC合成酶的基因,对乙烯生物合成很重要,在转基因株系中显示出显著的上调。乙烯在生物和非生物胁迫下被诱导产生[76,77].令人惊讶的是,虽然乙烯产生的基因被上调,但一些乙烯反应元件被下调。这些表达的差异可能是由于表达的组织特异性(根冠/根vs芽),研究这些基因的组织特异性表达可能会提供更多的信息。乙烯的产生也可能导致生长素在植物内部的再分配[78].在本研究中,上调和下调的基因中均存在生长素响应基因和几种生长素外排载体,提示生长素分布可能发生变化。转基因株系中有几个茉莉酸域蛋白基因表达下调。这些蛋白质是茉莉酸信号通路的一部分,但也被认为与防御反应有关,突变体表现出对各种病原体的敏感性增加,也表现出营养生长的减少[79].结果表明,转基因植株乙烯、生长素、ABA和JA的合成和/或信号通路发生了改变。
bZIP26蛋白的BLAST搜索栽培稻与bZIP26同源性最接近的蛋白为转录因子rf2b样蛋白(XP_015627932.1),同源性为58.8%。水稻中RF2a和RF2b基因曾被证明可调控水稻东菌丝状病毒的表达[20.,21].由于bZIP蛋白以二聚体的方式运作,我们有趣地发现,在转基因株系中上调的bZIP基因之一(Bradi4g22130)与小麦条锈病诱导的rf2样基因密切相关。在转基因株系中,许多抗病基因表达上调,提示bZIP26可能参与生物胁迫应答。有趣的是,编码WRKY转录因子的基因和编码tgal3型bZIP转录因子的基因可能参与调控致病相关非表达基因[80],在转基因植株中呈负调控;npr1构成因子4 (SNC1)和npr1样蛋白3的抑制因子也是如此[81].许多含NB-ARC结构域的抗病蛋白、dirige -like蛋白和植物硫蛋白基因在转基因株系中表达上调。植物防御基因也受乙烯调控,这是抗病相关基因表达增加的另一种可能,因为在ACC生物合成中编码速率限制步骤的基因在转基因株系中也被上调。有可能这些基因是由bZIP26间接调控的,也有可能是受到胁迫的植物诱导这些防御基因来保护自己免受病原菌的攻击。
叶绿体是一个重要的细胞器,不仅进行光合作用,还进行氨基酸、脂类、脂肪酸、维生素和植物激素的生物合成[82].有趣的是,在转基因系中,大量的光系统II反应中心蛋白被上调,这表明植物正在努力保持光合机制的完整。转基因株系中也有许多核糖体蛋白表达上调。核糖体蛋白在干旱条件下高效用水植物中的差异表达已经被证明[83].还有许多下调的编码不同细胞色素p450的DEGs,它们对介导防御化合物的生物合成和毒素的解毒具有重要作用[84],并且,先前已被证明是在多种非生物胁迫下诱导的[85].
含有WRKY和NAC结构域的蛋白转录因子参与了生物和非生物胁迫响应,在转基因植物中这些蛋白转录因子的表达量多为下调。许多编码应激信号蛋白的基因在上调和下调的DEGS中都存在,但在下调的基因中存在更多,例如激酶、磷酸酶、钙/钙调素相关基因、转录因子和转运蛋白。很明显,TR系中许多与胁迫相关的途径都被激活了,但很难弄清影响这些变化的潜在机制以及它们如何影响植株的高度。
结论
在过去的20年里,人们越来越多地利用生物技术来提高作物的抗逆性。在本文中,我们研究了过表达bZIP26转录因子的影响Brachypodium他们发现,它以一种消极的方式影响植物的生长,使植物的身材下降,并激活多种与胁迫相关的途径。转基因植株的ABA-、生长素-、乙烯-和ja相关通路基因表达发生变化;这两种因素都可能导致植物的身高下降。在未来的研究中,研究这些植物如何对病原体作出反应,以确定这些病原体反应基因是否有助于抵御某些类型的病原体,这将是一件有趣的事情。此外,如果该基因在胁迫诱导启动子下的表达能潜在地缓解本研究中观察到的负表型,并提高盐胁迫下的性能,这将是一件有趣的事情。
限制
尽管研究多个转基因株系很重要,因为它们在基因组中的位置插入可能导致转录谱的差异,这使转基因影响的分析变得复杂。
方法
建设农杆菌属向量
BdbZIP26命名法(蛋白名称,基因ID [Bradi1g76690],核苷酸序列)从转录因子数据库中获得http://www.grassius.org.将BdbZIP26基因进行融合克隆的引物导入改良的pART载体,并在ZmUbi1启动子控制下表达[86]含有一个c端GFP标签[87,88,89]是使用Clontech基于web的In-Fusion克隆引物设计工具设计的。用正向(5’- tcgactctagaggatccatggactcgcgcgg)和反向(5’- TGCTCACCATGGATCCCTCTCTGGGCTCATGGTTG)引物扩增bZIP26的编码区b . distachyon植物。按照制造商的建议进行载体制备和In-Fusion克隆反应,并将产物转化为DH5α感受态细胞。质粒用Qiagen middiprep柱纯化,测序验证构建,转化为根癌土壤杆菌AGL1 [90].矢量图如图所示。1一个。
Brachypodium纯合子系的转化、生长条件及鉴定
BrachypodiumBd21-3种子来自John Vogel博士(美国农业部农业研究所,奥尔巴尼CA)。Brachypodium转换时农杆菌属包含Ubi:bZIP26:GFP的AGL1按照前面描述执行[91,92].简单地说,从种子中无菌分离出未成熟胚胎,置于愈伤组织诱导培养基(CIM)上,培养置于黑暗中。黄色致密胚性愈伤组织每2-3周在相同培养基上传代培养,培养胚性愈伤组织。约6 - 8周后,胚性愈伤组织悬浮于液体LS培养基中[93], 200 μM乙酰丁香酮(Sigma;MO), 2.5 mg/L二氯苯氧乙酸(Sigma;MO), 0.1%声速PE/F68 (Sigma;MO)和部分bZIP26:GFP载体AGL1 (od值~ 0.6),约15 min。取出液体,将胚性愈伤组织移至干燥无菌的Whatman滤纸上,黑暗放置3天。共培养后,将胚性愈伤组织转移到含150 mg/L timentin的CIM培养基中进行防治农杆菌属增长。1周后,将愈伤组织转移到含有150 mg/L timentin和40 mg/L潮霉素的CIM培养基中,筛选转化的愈伤组织。另外3-5周后,转化的(活)愈伤组织转移到含有40 mg/L潮霉素的再生培养基中,在28℃下放置16小时光照/8小时黑暗循环。再生苗在发育过程中去除,在相同条件下置于MS蔗糖培养基洋红色盒子上。幼苗被转移到土壤中,在一个塑料圆顶下驯化一周,然后按照先前一篇论文中描述的那样生长[16].阳光种植混合(Sun Gro Horticulture Inc., Bellevue, WA)用于所有温室种植。施用Osmocote Plus 15-9-12缓释肥。植物在温室条件下生长和处理(光照16小时,白天24°C,夜间18°C)。
为了鉴定转化子,我们用PCR检测幼苗是否存在潮霉素磷酸转移酶基因。用快速一步提取(ROSE)法从幼苗中纯化基因组DNA [94].实时PCR检测系统(Bio-Rad Laboratories;使用Hercules, CA)进行PCR分析,程序如下:95°C, 3:00 min,然后按照制造商的建议,95°C, 15 s, 60°C, 1:00 min,在延伸周期中检测FAM荧光团。q-PCR使用的引物和探针有:Hyg引物F1020 (GCTTGGTTGACGGCAATTT)、Hyg引物R1155 (CCACTATCGGCGAGTACTTCTA)和探针序列(5 '−/56-FAM/ACACAAATC /ZEN/GCCCGCAGAAGC/3IABkFQ/−3 ')。培养扩增出潮霉素磷酸转移酶基因的植株,收集种子。对后代进行纯合子系鉴定,以供进一步研究。选择独立转化事件中bZIP26基因表达升高的3个转基因株系(TR4、TR6和TR7)进行进一步分析。
应力分析
测序实验中,植物在步入式生长室Conviron模型PGW40中生长,设置为10小时光照,昼夜温度为24°C/ 18°C。Thirty-one-day-old盆栽Brachypodium用清水(对照植株)或100mm氯化钠(前3天每盆100mls NaCl溶液,然后每隔一天100mls)处理3周,以评估WT和TR4、TR6和TR7在对照和盐度胁迫条件下的生长情况。3周后,从对照和处理植株上采集样本(包括植株的地上部分、根冠和约1厘米的根),立即用液氮冷冻,并在−80°C保存直到处理。
植物激素对植物早期生长的影响
将WT和转基因植株的种子置于½MS (Murashige和Skoog)培养基上,培养基中含有15 g蔗糖/L和1%琼脂,直至根长2.5-5 mm,然后转移到不含激素的20 μM GA3 (Sigma G1025;2 μM ABA (Sigma A1049;圣路易斯,密苏里州)。将种子直接置于ABA含量为2 μM的培养基中,野生型和转基因植株均未在ABA存在的条件下萌发。将平板垂直放置于组织培养TC80室(Conviron;拉马、加拿大)。图片分别在转移到激素板后21天拍摄,以获取ABA,转移到对照植株后12天拍摄,转移到GA处理后7天拍摄。取具有代表性的平板拍照,每个基因型的3个种子排列在一起,顺序总是WT、TR4、TR6、TR7。
RNA提取和定量
在使用Direct-zol™RNA MiniPrep试剂盒(Zymo Research;欧文,CA)。冷冻后的组织加入TRI试剂中,用Ultra-Turrax T25匀浆器(IKA;Wilmington, NC)在4设置30秒,并在−80°C快速冻结。将样品解冻,混合,13000 x g离心2min以去除碎屑,并使用制造商推荐的条件进行处理,包括柱上DNase处理(Zymo Research;欧文,CA)。用DS-11分光光度计(DeNovix;Wilmington, DE),使用Superscript III first strand Synthesis SuperMix试剂盒(Invitrogen;卡尔斯巴德,CA)的建议。
定量逆转录- pcr (qRT-PCR)
BioRad iTaq™通用SYBR Green Supermix和BioRad Real Time PCR检测系统(Bio-Rad Laboratories;Hercules, CA)进行qRT-PCR分析。引物用QuantiPrime设计[95]使用网站的默认设置。利用序列稀释的单个cDNA扩增产物的标准曲线,评估引物对的扩增效率和线性。只使用熔体曲线良好、效率在90-110%以内的引物进行定量研究。的BdUBC18基因作为内参基因进行归一化[96].用于qRT-PCR和qPCR的引物列在表S1(附加文件1).的ΔΔCT值用于表达分析,如应用生物系统在其“使用实时定量PCR进行基因表达相对定量指南”(https://assets.thermofisher.com/TFS-Assets/LSG/manuals/cms_042380.pdf) [97].
Illumina公司RNA-sequencing
俄勒冈州立大学基因组研究和生物计算中心(OSU CGRB)对RNA样本进行了测序。使用Wafergen RNA试剂盒对每个样本进行3次重复,在安捷伦生物分析仪(Agilent Technologies, CA)上检查质量,在Illumina HiSeq 3000 (San Diego, CA)上完成100 bp的成对末端序列。
分析
序列是适配器和质量裁剪与参数-q 15,10 [98].每个RNAseq复制都与Brachypodiumv3.1基因组(国际Brachypodium倡议,2010)99与HISAT2 [One hundred.].使用SAMtools操作BAM文件[101].StringTie [102]被用来定量排列的序列。DESeq2进行差异表达[103].创建了自定义Perl脚本以进一步分析结果。使用WEGO 2.0显示过多的GO术语[104]使用上下调控的基因Brachypodium基因集。使用R (R Core Team, 2017)包VennDiagram构建Venn图[105].数据在DESeq2中使用方差稳定变换(vst)进行转换。Pheatmap [106]被用来创建热图,并使用欧几里得距离聚类。
缩写
- 阿坝:
-
脱落酸
- bZIP:
-
基本亮氨酸拉链
- 度:
-
差异表达基因
- 遗传算法:
-
赤霉酸
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 走:
-
基因本体论
- 存在:
-
定量逆转录聚合酶链反应
- 生理盐水:
-
氯化钠
- ROS:
-
活性氧
- TR:
-
转基因
- WT:
-
野生型
参考文献
朱镕基JK。植物的非生物胁迫信号和响应。细胞。2016;167(2):313 - 24。
可汗萨,李茂忠,王思敏,尹海军。重论植物转录因子在对抗非生物胁迫中的作用。中国生物医学工程学报。2018;19(6):1634。
王慧,王慧,邵辉,唐欣。利用转录因子转基因技术提高植物非生物胁迫抗性的研究进展。植物学报。2016;24(4):433 - 436。
金晶,张慧,孔亮,高光,罗军。PlantTFDB 3.0:植物转录因子功能和进化研究的门户。中国生物医学工程学报2013;42(D1): D1182-7。
李志强,李志强,李志强,等。拟南芥中MYB转录因子的研究进展。植物科学进展。2010;15(10):573 - 581。
杨晓燕,杨晓燕,王晓燕,等。干旱和低温胁迫下基因表达调控网络的研究进展。植物学报,2003;6(5):410-7。
张志刚,张志强,张志勇,等。AP2/ERF家族转录因子在植物非生物胁迫应答中的作用。生物物理学报,2012;1819(2):86-96。
李志强,李志强,李志强,等。DREB转录因子在植物抗生物和非生物胁迫中的作用。植物学报,2006;25(12):1234 - 1234。
杨振宇,杨振宇。WRKY转录因子:植物中最重要的转录因子。植物信号行为。2014;9(2):e27700。
王晓燕,王晓燕,王晓燕,等。NAC转录因子在植物生物和非生物胁迫中的调控作用。Microbiol前面。2013;4:248。
刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强,刘志强拟南芥.植物学报,2002;7(3):106-11。
刘欣,楚卓。bZIP转录因子的全基因组进化特征及其在多种非生物胁迫下的表达分析Brachypodium distachyon.BMC基因组学。2015;16(1):227。
Nijhawan A, Jain M, Tyagi AK, Khurana JP。水稻基本亮氨酸拉链转录因子家族基因组调查及基因表达分析。植物杂志。2008;146(2):333 - 50。
黄晓燕,李晓燕,李晓燕,等。小麦bZIP转录因子的全基因组分析及非生物胁迫下TabZIP转录因子的功能鉴定。Sci众议员2019;9(1):4608。
李志强,李志强,李志强,等。转录因子LIP19对小麦非生物胁迫抗性的影响。中国生物医学工程学报。2008;59(4):891-905。
Glover-Cutter KM, Alderman S, Dombrowski JE, Martin RC。通过激活一种缺锌转录因子增强氧化应激抗性Brachypodium distachyon.植物杂志。2014;166(3):1492 - 505。
张磊,张磊,夏晨,赵刚,刘军,贾军,孔欣,一种新的小麦bZIP转录因子TabZIP60在转基因中具有多重非生物抗性拟南芥.杂志。2015;153(4):538 - 54。
李欣,冯斌,张峰,唐勇,张玲,马玲,赵超,高松,小麦bZIP转录因子家族a亚群成员生物信息学分析及TabZIP174参与干旱响应的功能鉴定。植物学报。2016;31(4):429 - 436。
杨松,徐凯,陈松,李涛,夏慧,陈丽,刘慧,罗丽。胁迫响应型bZIP转录因子OsbZIP62改善水稻干旱和氧化耐性。植物学报,2019,19(1):260。
尹艳,朱强,戴松,兰姆C,比奇RN。RF2a是水稻韧皮部特异性东菌丝状病毒启动子的bZIP转录激活子,在维管发育中起作用。EMBO j . 1997; 16(17): 5247 - 59。
戴松,张震,陈松,比奇RN。水稻bZIP转录激活子RF2b与RF2a相互作用,参与水稻东gro病症状的发生发展。中国科学(d辑)2004;
一种改良的烟草组织培养快速生长和生物测定的培养基。杂志。1962;15(3):473 - 97。
张志刚,张志刚。钙调蛋白在植物非生物胁迫应答中的作用。植物科学进展。2015;6:809。
拟南芥和水稻cblp - cipk信号网络的基因组学研究(英文)植物杂志。2004;134(1):43-58。
刘建平,刘建平,刘建平,等。拟南芥钙依赖性脂质结合蛋白(AtCLB):一种新的非生物胁迫应答抑制因子。中国生物医学工程学报。2011;62(8):2679-89。
杨慧,李艳,华军。拟南芥C2结构域蛋白BAP1负调控防御反应。植物j . 2006; 48(2): 238 - 48。
杨慧,杨松,李艳,华军。拟南芥BAP1和BAP2基因是细胞程序性死亡的一般抑制剂。植物杂志。2007;145(1):135 - 46所示。
植物凝集素受体样激酶在植物生长发育和胁迫应答中的作用。摩尔。2013;6:1405-18。
Wrzaczek M, Brosché M, Salojärvi J, Kangasjärvi S, Idänheimo N, Mersmann S, Robatzek S, Karpiński S, Karpińska B, Kangasjärvi J.臭氧和植物激素对拟南芥CRK/DUF26组受体样蛋白激酶的转录调控。中国生物医学工程学报,2010,30(1):1 - 9。
Yadeta KA, Elmore JM, Creer AY, Feng B, Franco JY, Rufian JS, He P, Phinney B, Coaker G.一种富含半胱氨酸的蛋白激酶与膜免疫复合物有关,其半胱氨酸残基是细胞死亡所必需的。植物杂志。2017;173(1):771 - 87。
蛋白质组学数据库和工具破译翻译后修饰。J蛋白质组。2011;75(1):127 - 44。
Kanneganti V, Gupta AK。植物中壁相关激酶的概述。植物学报。2008;24(3):393 - 393。
杨平,Praz C, Li B, Singla J, Robert CA, Kessel B, Scheuermann D, Lüthi L, Ouzunova M, Erb M, Krattinger SG。玉米壁相关激酶Zm WA-RLK 1介导的真菌抗性与苯并恶嗪类物质含量的降低有关。新植醇。2019;221(2):976 - 87。
Li J, Wen J, Lease KA, Doke JT, Tax FE, Walker JC。BAK1,拟南芥LRR受体样蛋白激酶,与BRI1相互作用并调节油菜素内酯信号。细胞。2002;110(2):213 - 22所示。
李丽娟,李志强。brassinosteroid信号转导的受体激酶对BRI1/BAK1。细胞。2002;110(2):203 - 12所示。
Chinchilla D, Zipfel C, Robatzek S, Kemmerling B, Nürnberger T, Jones JDG, Felix G, Boller T.鞭毛蛋白诱导的受体FLS2和BAK1复合体启动植物防御。自然。2007;448(7152):497 - 500。https://doi.org/10.1038/nature05999.
蛋白质磷酸酶2C (Protein phosphatase 2C, PP2C)在高等植物中的作用。植物化学学报1998;38(6):919-27。
傅敏,姜浩,孙世喜,金sk,南浩。拟南芥RAV转录因子的一个亚群可以独立于ABA调节干旱和盐胁迫的响应。植物生理学报,2014;55(11):1892-904。
Adams DO,杨顺丰。乙烯生物合成:鉴定1-氨基环丙烷-1-羧酸作为蛋氨酸转化为乙烯的中间体。中国科学:地球科学(英文版)。1979;76(1):170-4
植物生长素诱导的大豆聚腺苷化rna的研究。植物化学学报,1987;9(6):611-23。
Neuteboom LW, Ng JM, Kuyper M, Clijdesdale OR, Hooykaas PJ, Van Der Zaal BJ。生长素诱导侧根形成过程中积累的mrna对应的cDNA克隆的分离和鉴定植物化学。1999;39(2):273 - 273。
熊磊,朱克杰。脱落酸生物合成的调控。植物杂志。2003;133(1):29-36。
王勇,乔玲,白军,王鹏,段伟,袁松,袁刚,张峰,张磊,赵超。小麦茉莉酸盐- zim域转录抑制子全基因组的特性研究(英文)小麦l .)。BMC基因组学。2017;18(1):152。
van der Biezen EA, Jones JD。NB-ARC结构域:植物抗性基因产物和动物细胞死亡调控因子共享的一种新的信号基序。咕咕叫医学杂志。1998;8 (7):R226-8。
García-Olmedo F, Molina A, Alamillo JM, Rodríguez-Palenzuéla P.植物防御肽。肽科学。1998年,47(6):479 - 91。
王晓东,王晓东,王晓东,等。植物抗病相关基因NPR1的非表达基因及其家族的研究进展。植物学报。2019;https://doi.org/10.3389/fpls.2019.00102.
Nawrath C, Heck S, Parinthawong N, Métraux JP。EDS5是水杨酸依赖的抗病信号的重要组成部分拟南芥是MATE转运体家族的一员。植物细胞。2002;14(1):275 - 86。
杨志明,杨志明,杨志明,杨志明,等。拟南芥水杨酸合成关键因子EDS5的叶绿体包膜定位。植物信号行为。2013;8(4):e23603。
M Serrano, Wang B, Aryal B, Garcion C, aboumansour E, Heck S, Geisler M, Mauch F, Nawrath C, Métraux JP。从叶绿体输出水杨酸需要多药和毒素挤出样转运体EDS5。植物杂志。2013;162(4):1815 - 21所示。
Nawrot R, Barylski J, Nowicki G, Broniarczyk J, Buchwald W, Goździcka-Józefiak A.植物抗菌肽。叶形线Microbiol。2014;59(3):181 - 96。
Lurin C, Andrés C, Aubourg S, Bellaoui M, Bitton F, Bruyère C, Caboche M, Debast C, Gualberto J, Hoffmann B, Lecharny A.全基因组分析拟南芥五肽重复蛋白揭示了它们在细胞器生物发生中的重要作用。植物细胞。2004;16(8):2089 - 103。
罗威拉公司,史密斯公司。PPR蛋白-细胞器RNA代谢的协调者。杂志。2019;166(1):451 - 9。
张志强,张志强,张志强,等。四肽重复蛋白在光合器官生物发生中的作用。中国生物医学杂志2016;324:187-227。
杨慧,李萍,张安,文霞,张磊,陆春。四聚肽重复蛋白Pyg7与PsaC相互作用在光系统I组装中的作用拟南芥.工厂j . 2017, 91(6): 950 - 61。
Sormani R, Masclaux-Daubresse C, Daniele-Vedele F, Chardon F.核糖体成分的转录调控是由应激根据细胞的区隔决定的拟南芥.《公共科学图书馆•综合》。2011;6 (12):e28070。
merchant C, Stepanova AN, Alonso JM。植物翻译规则:有趣的过去,激动人心的现在和充满希望的未来。植物j . 2017; 90(4): 628 - 53年。
杨志刚,张志刚。翻译器官在衰老和应激反应中的变化。机械老化发展。2017;168:30-6。
Nagaraj S, Senthil-Kumar M, Ramu VS, Wang K, Mysore KS。植物核糖体蛋白RPL12和RPL19在非宿主抗病中发挥作用。植物学报,2016;6:1192。
de la Cruz MT, Adame-García J, Gregorio-Jorge J, Jiménez-Jacinto V, Vega-Alvarado L, Iglesias-Andreu L, Escobar-Hernández EE, Luna-Rodríguez M.增加核糖体蛋白活性:翻译重编程在香草planifolia杰克。,一个gainst镰刀菌素感染。bioRxiv。2019年,660860年。https://doi.org/10.1101/660860.
李志强,李志强,李志强,Oñate-Sánchez L.转录因子在植物防御和胁迫反应中的作用。植物学报,2002;5(5):430-6。
李志强,李志强,李志强,等。拟南芥MYB转录因子家族的全基因组分类与表达分析。BMC基因组学。2012;13(1):544。
张志强,张志强。MYB转录因子在植物体内的表达。趋势麝猫。1997;13(2):67 - 73。
齐默尔曼IM,海姆马,魏沙尔B,乌里格JF。全面的识别拟南芥MYB转录因子与R/ b样BHLH蛋白相互作用。植物j . 2004; 40(1): 22-34。
GRAS蛋白在植物信号转导和发育中的作用。足底。2004;218(5):683 - 92。
GRAS家族蛋白特异性相互作用的结构基础。592年2月Letts也。2018;(4):489 - 501。
黄晓明,李志强,李志强,等。NAC蛋白在植物抗逆性中的调控作用。植物科学进展,2012;17(6):369-81。
袁欣,王慧,蔡静,李丹,宋飞。NAC转录因子在植物免疫中的作用。Phytopath杂志2019;1(1):3。
Kwon HK, Wang MH. d型细胞周期蛋白基因(Nicta;CycD3;4)控制细胞周期进程,以响应烟草的糖可利用性。植物生理学报。2011;34(2):393 - 393。
Avis JM, Clarke PR. Ran,一种参与核过程的GTPase:它的管理者和效应器。中国生物医学工程学报。1996;10(3):323 - 327。
王晓燕,王晓燕,王晓燕,等。GTPases的结构与信号转导途径研究。植物杂志。2018;176(1):57 - 79。
刘志强,刘志强。植物内质网应激与细胞程序性死亡的关系。植物学报。2014;35(5):429 - 436。
H Mi, Muruganujan A, Ebert D, Huang X, Thomas PD。PANTHER version 14:更多基因组,一个新的PANTHER GO-slim和富集分析工具的改进。中国生物医学工程学报,2018;47(D1): D419-26。
Van Leene J, Hollunder J, Eeckhout D, Persiau G, Van De Slijke E, Stals H, Van Isterdael G, Verkest A, Neirynck S, Buffel Y, De Bodt S.靶向相互作用组学揭示了一个复杂的核心细胞周期机制拟南芥.微生物学报。2010;6(1):397。
Van Leene J, Blomme J, Kulkarni SR, Cannoot B, De Winne N, Eeckhout D, Persiau G, Van De Slijke E, Vercruysse L, Vanden Bossche R, Heyndrickx KS。拟南芥转录因子bZIP29的功能特征揭示了其在叶片和根系发育中的作用。中国生物医学工程学报2016;67(19):5825-40。
拟南芥三种ABA不敏感突变确定了控制ABA响应重叠亚群的基因。植物杂志。1990;94(3):1172 - 9。
艾克尔JR,戴维斯RW。植物防御基因受乙烯调控。中国科学:地球科学(英文版)1987。
阿佩尔鲍姆A,杨顺丰。水分亏缺诱导应激乙烯的生物合成。植物杂志。1981;68(3):594 - 6。
孙鹏,田启元,陈杰,张文华。铝诱导的根伸长抑制拟南芥由乙烯和生长素介导。中国生物医学工程学报2009;61(2):347-56。
郭琦,IT专业,豪GA。生长-防御冲突的解决:茉莉酸信号的机制研究。中国生物医学工程学报。2018;
陈敏,白伟,阮德,吴涛,陈晓东,Ronald PC。水稻NPR1同源物1和3 (NH1和NH3)、TGA转录因子和耐药负调节因子(NRR)蛋白的互作特异性和共表达。BMC基因组学,2014;15(1):461。
张燕,高志强,董晓丽,李霞。植物抗病基因功能获得性突变导致npr1-1基因构成1下游信号转导通路的组成性激活。植物细胞。2003;15(11):2636 - 46。
黄晓明,黄晓明,黄晓明。叶绿体的进化、结构和功能,F1000prime报告,第6卷;2014.
Moin M, Bakshi A, Saha A, Udaya Kumar M, Reddy AR, Rao KV, Siddiq EA, Kirti PB。籼稻的激活标记鉴定了核糖体蛋白作为调控植物水分利用效率和非生物胁迫耐性的潜在靶点。植物细胞环境学报。2016;39(11):2440-59。
王俊,马舒勒。玉米细胞色素P450单加氧酶响应安全剂和细菌病原体的特性研究。植物杂志。2001;125(2):1126 - 38。
张志刚,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇,张志勇。相声对生物和非生物胁迫的响应拟南芥:利用cDNA芯片分析细胞色素P450基因超家族的基因表达。植物生理学报,2004,30(3):327 - 327。
Gleave AP:一种具有T-DNA组织结构的多功能二元载体系统,有助于将克隆的DNA高效地整合到植物基因组中。植物化学。1992;20(6):1203-7。
王敏,李卓,Matthews PR, Upadhyaya NM, Waterhouse PM。农杆菌介导单子叶植物转化的改良载体。热带亚热带生物技术国际研讨会,第2 461页。Acta Hortic 1998。1997; 461:401-8。
Wang MB, Upadhyaya NM, Brettell RIS, Waterhouse PM。内含子介导的植物转化选择标记基因改良根癌土壤杆菌.金雀花育种。1997;51(4):325-34。
Murray F, Brettell R, Matthews P, Bishop D, Jacobsen J.农杆菌属利用GFP和GUS报告基因介导了4个大麦品种的转化。植物学报,2004,22(6):397-402。
Lazo GR, Stein PA, Ludwig RA。一个DNA transformation-competent拟南芥基因组文库中农杆菌属.生物/技术。1991; 9(10): 963 - 7。
刘志强,刘志强。农杆菌介导的高效农杆菌转化Brachypodium distachyon近交系Bd21-3。植物学报2008;27(3):491 - 496。
刘志强,刘志强,刘志强。农杆菌介导的模式草的转化和自交系的发育Brachypodium distachyon.植物细胞组织器官学报。2006;84(2):199-211。
烟草组织培养对有机生长因子的需要量。杂志。1965;18(1):100 - 27所示。
Steiner JJ, Poklemba CJ, Fjellstrom RG, Elliott LF。一种用于PCR和RAPD分析的单管基因组DNA快速提取方法。中国生物医学工程学报1995;23(13):2569-70。
Arvidsson S, Kwasniewski M, Riaño-Pachón DM, Mueller-Roeber B. quantprime -一个用于定量PCR的可靠高通量引物设计的灵活工具。BMC生物信息学。2008;9(1):465。
洪珊珊,徐培杰,杨文敏,向芳,朴景明。利用实时荧光定量PCR技术探索二穗短柄草基因表达研究的有效内参基因。中国生物医学工程学报,2008;8(1):32。
使用实时定量PCR进行基因表达相对定量的指南。https://assets.thermofisher.com/TFS-Assets/LSG/manuals/cms_042380.pdf.
Martin M. Cutadapt从高通量测序读取中移除适配器序列。EMBnet j . 2011; 17(1): 10 - 2。
国际Brachypodium倡议。模型草的基因组测序与分析Brachypodium distachyon.大自然。2010;463(7282):763。
Kim D, Paggi JM, Park C, Bennett C, Salzberg SL.基于图形的基因组比对和HISAT2和hisat基因型的基因分型。生物科技Nat》。2019;37(8):907 - 15所示。
李H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, Marth G, Abecasis G, Durbin R.序列比对/地图格式与SAMtools。生物信息学。2009;25(16):2078 - 9。
Pertea M, Kim D, Pertea GM, Leek JT, Salzberg SL. HISAT, StringTie和Ballgown RNA-seq实验的转录水平表达分析。Nat Protoc。2016;11(9):1650 - 7。
利用DESeq2对RNA-seq数据的折叠变化和离散度进行适度估计。基因组医学杂志。2014;15(12):550。
张你们J,方L,郑H, Y,陈J,张Z,王J,李,李R, Bolund L,王J . WEGO: web工具绘制注释。核酸杂志2006;34(增刊2):W293-7。
陈H,布特罗斯PC。VennDiagram:在R. BMC生物信息学中生成高度可定制的Venn和Euler图的软件包。2011;12(1):35。
Kolde R. Pheatmap:漂亮的热图。R包v. 1.0.8。(2015)。https://CRAN.R-project.org/web/packages/pheatmap/index.html.
致谢
特别感谢Thomas Lockwood的出色技术支持。本研究中所采用的实验方法符合美国现行法律法规。在本出版物中使用贸易、商号或公司名称是为了方便读者。这种使用不构成美国农业部或农业研究服务对任何产品或服务的官方认可或批准,而排除其他可能合适的产品或服务。美国农业部是平等机会的提供者和雇主。
资金
这项研究由美国农业部-农业研究局(USDA-ARS)提供资金;国家计划215:牧草和牧场系统;项目没有:2072 - 21000 - 054 - 00 - d。的USDA-ARS provided funding to the research project, but played no role in the design of the study, collection, analysis, the interpretation of data and in the writing of this manuscript. These were the sole responsibilities of the authors.
作者信息
从属关系
贡献
RCM和JED构思并参与了该研究的设计。BAK进行生物信息学分析;RCM和技术人员进行RNA分离,进行qPCR基因表达和分析。RCM进行了数据分析和解释。RCM、BAK和JED起草了手稿。所有作者阅读并批准最终稿。
相应的作者
道德声明
伦理认可和同意参与
这份手稿中提出的研究是由美国农业部-农业研究局的科学家进行的,并得到了饲料种子和谷物研究单位的研究负责人的批准。所有实验均符合美国政府的联邦法律和俄勒冈州的规定。USDA-ARS项目编号:2072-21000-054-00D。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
用于qRT-PCR表达分析的选择基因的引物列表,以及用于湿霉素磷酸转移酶基因转基因植物的引物/探针的列表。
附加文件2:图S1。
通过差异表达筛选的3536个基因的热图p-value 0.05, FDR 0.5, log2Fold changes <−2或大于2。对数值进行方差稳定变换。治疗H2O和salt,以及基因型WT或转基因4HA, 6FA, 7DA用彩色条表示。样本(列)和基因(行)使用欧氏距离聚类和树突图显示。
附加文件3:表S2。
3个转基因株系与野生型比较差异表达基因的Venn数据。
附加文件4:图S2。
同时通过p值0.05、FDR 0.5、log差异表达过滤器的163个被归为抗病相关基因的Heatmap2Fold changes <−2或大于2。对数值进行方差稳定变换。治疗H2O和盐,以及WT或转基因4HA, 6FA, 7DA的基因型在列的上方用彩色条表示。疾病相关基因类型的分类显示在“分类”图例标题下,并显示在行的左侧。样本(列)聚类使用欧氏距离和一个树状图显示。
附加文件5:图S3。
同时通过p值0.05、FDR 0.5和log差异表达筛选的213个被归类为转录因子的基因的热图2Fold changes <−2或大于2。对数值进行方差稳定变换。治疗H2O和盐,以及WT或转基因4HA, 6FA, 7DA的基因型在列的上方用彩色条表示。转录因子类型的基因分类显示在“分类”图例标题下,并显示在行的左侧。样本(列)聚类使用欧氏距离和一个树状图显示。
附加文件6:表S3。
100 mM NaCl处理3周后TR4(1)、TR6(2)、TR7(3)和野生型(WT)上调基因Venn数据。
附加文件7:图S4。
RNA-Seq数据的定量RT-PCR验证。日志2利用RNA-Seq数据绘制qRT-PCR得到的fold change值。qRT-PCR所用引物见补充表1.
附加文件8:表S4。
野生型与各转基因株系之间以及野生型对照与长期盐处理之间的下调基因差异表达表
附加文件9:表S5。
野生型与各转基因株系之间以及野生型对照与长期盐处理之间上调基因的差异表达表
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议授权,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和源代码,提供知识共享许可协议的链接,并说明是否进行了修改。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的知识共享许可中,并且您的预期使用不被法定法规允许或超过允许的使用,您将需要直接从版权所有者获得许可。如欲查阅本牌照副本,请浏览http://creativecommons.org/licenses/by/4.0/.知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在对数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Martin, r.c., Kronmiller, b.a和Dombrowski, j.eBrachypodium distachyon过表达BdbZIP26转录因子。BMC植物杂志20.174(2020)。https://doi.org/10.1186/s12870-020-02341-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02341-3
关键字
- bZIP26
- Brachypodium
- 盐胁迫
- RNA-Seq
- 转录组