- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
过度表达gydF4y2BaPpSnRK1αgydF4y2Ba通过调控ABA信号通路和活性氧代谢增强番茄耐盐性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba128gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
snf相关激酶1 (SnRK1)是细胞信号网络的关键组成部分。已知SnRK1能对各种各样的胁迫作出反应,但其在盐胁迫反应和耐受性中的确切作用仍然很大程度上未知。gydF4y2Ba
结果gydF4y2Ba
在这项研究中,我们报道了编码α亚基的基因过表达gydF4y2Ba碧桃SnRK1gydF4y2Ba(gydF4y2BaPpSnRK1αgydF4y2Ba)在番茄中添加盐可以提高耐盐性。小麦耐盐性的提高gydF4y2BaPpSnRK1αgydF4y2Ba-研究发现,过度表达的植物与增加gydF4y2BaPpSnRK1αgydF4y2Ba表达水平和SnRK1激酶活性。和gydF4y2BaPpSnRK1αgydF4y2Ba盐胁迫下,过表达品系叶片损伤程度较野生品系低,脯氨酸含量增加,丙二醛(MDA)含量降低。此外,gydF4y2BaPpSnRK1αgydF4y2Ba通过增加抗氧化酶基因和抗氧化酶活性的表达水平来增强活性氧物质(ROS)代谢。我们进一步测序了WT和三个的转录组gydF4y2BaPpSnRK1αgydF4y2Ba用RNA-seq技术鉴定了1000个过表达株gydF4y2BaPpSnRK1αgydF4y2Ba- 在MAPK信号通路(植物),植物 - 病原体相互作用和植物激素信号转导,包括许多抗氧化酶,包括许多抗氧化酶,以及这些基因,可以响应刺激,代谢过程和生物调节。此外,我们确定了几种盐胁迫响应基因的转录水平,gydF4y2BaSlPP2C37gydF4y2Ba,gydF4y2BaSlPYL4gydF4y2Ba,gydF4y2BaSlPYL8gydF4y2Ba,gydF4y2BaSlNAC022gydF4y2Ba,gydF4y2BaSlNAC042,gydF4y2Ba和gydF4y2BaSlSnRK2gydF4y2Ba家庭发生了显著的变化gydF4y2BaPpSnRK1αgydF4y2Ba,表示gydF4y2BaSnRK1αgydF4y2Ba可能参与ABA信号通路,提高番茄耐盐性。总之,这些发现为其潜在机制提供了新的证据gydF4y2BaSnRK1αgydF4y2Ba植物盐耐受表型的会议。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,植物的耐盐性可能受到盐胁迫的调控gydF4y2BaSnRK1αgydF4y2Ba.进一步的分子和遗传方法将加速我们对gydF4y2BaPpSnRK1αgydF4y2Ba并通过基因工程和其他相关策略对番茄耐盐性进行遗传改良。gydF4y2Ba
背景gydF4y2Ba
目前,盐胁迫影响了全球6%以上的地区(超过8亿公顷土地),且受感染地区继续增加[gydF4y2Ba1gydF4y2Ba].在植物体内,高盐会影响水分和养分的吸收,降低光合作用,从而抑制植物生长,造成产量损失。在细胞水平上,高盐可扰乱正常代谢,引起“生理干旱”、离子毒性或对蛋白质、核酸等大分子物质造成复杂的二次损伤[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
植物的耐盐性基本上是由耐盐基因决定的。新的耐盐基因的分离和耐盐种质的有效鉴定是提高植物耐盐性的关键策略[gydF4y2Ba3.gydF4y2Ba].最近,已经进行了使用函数突变体和过度表达系的广泛遗传和分子研究,以研究模型植物和作物物种中耐盐性的分子基础。据报道,丝裂原活化蛋白激酶(MAPK),钙皮蛋白B样相互作用蛋白激酶(CIPK)和SNF1相关蛋白激酶家族(SNRK)家族和许多转录因子(TFS)等蛋白质激酶和许多转录因子(TFS),如NAC(NAM,ATAF1,2和CUC2),AP2 / ERF,MYB,WRKY,BZIP,在环境压力响应中发挥重要作用[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].因此,通过分子研究筛选耐盐基因是保护植物免受盐胁迫的必要手段。gydF4y2Ba
SnRK1的结构和功能与酵母SNF1和哺乳动物AMPK相似[gydF4y2Ba13gydF4y2Ba].SNRK1全酶是包含催化α亚基,调节γ或βγ亚基,以及作为支架连接α和γ亚基的β亚基[gydF4y2Ba13gydF4y2Ba].α催化亚基t -环上的保守苏氨酸磷酸化是SNF1/AMPK/SnRK1保持活性所必需的[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
SnRK1参与植物的蔗糖和脂质代谢,在逆境条件下对胁迫信号作出反应,从而调节植物的生长发育[gydF4y2Ba18gydF4y2Ba].例如,SNF1催化活性的增加和激活环中保守的thri -210的磷酸化发生在暴露于钠或氧化应激的酵母细胞中,这表明与AMPK相似,SNF1是在响应这些应激时被激活的[gydF4y2Ba19gydF4y2Ba].此外,有报道称SnRK1活性是拟南芥抗洪所必需的[gydF4y2Ba20.gydF4y2Ba].同样,SnRK1是拟南芥在各种胁迫条件下自噬诱导的一种必需激酶[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
蔗糖非发酵相关蛋白激酶(SnRKs)家族可以通过应激信号的级联放大调控多个信号通路来响应应激,并启动应激反应。根据三级结构的差异,SnRKs家族可以进一步细分为三个亚家族:snrk1、SnRK2和snrk3 [gydF4y2Ba22gydF4y2Ba].在拟南芥中,SnRK2.2/SnRK2.4/SnRK2.6是响应非生物胁迫的重要ABA信号调节因子[gydF4y2Ba23gydF4y2Ba], SnRK3通过与ABA信号通路中的调控因子相互作用间接参与ABA信号传递,从而增强植物的抗逆性。例如,ABI2与SnRK3.11/SnRK3.13/SnRK3.15强互作,调控盐胁迫相关基因的表达,使植物对胁迫信号更加敏感,提高耐盐性[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].在拟南芥中,SnRK1受aba不敏感1 (ABI1)和蛋白磷酸酶2CA组(PP2CA)的负调控[gydF4y2Ba26gydF4y2Ba].因此,我们推测SNRK1通过ABA信号传导或其他途径参与非生物应激响应。gydF4y2Ba
桃子(gydF4y2Ba碧桃gydF4y2Ba)是一种独特的植物,可能起源于中国。它含有丰富的有价值的遗传资源,可用于研究和提高植物的抗逆性[gydF4y2Ba27gydF4y2Ba].在这项研究中,全长gydF4y2Ba碧桃SnRK1αgydF4y2Ba(gydF4y2BaPpSnRK1αgydF4y2Ba)序列得到gydF4y2Ba碧桃gydF4y2Ba(林)。类等。野生型(WT)和3个转基因番茄幼苗过表达gydF4y2BaPpSnRK1αgydF4y2Ba(OE-1、OE-4和OE-7)。为了研究SnRK1在盐胁迫下可能的调控机制,我们比较了WT和转基因番茄植株在盐胁迫下的表型,并分析了包括ROS代谢能力、抗渗透胁迫能力等生理指标。此外,我们对WT和3个基因的转录组进行了测序gydF4y2BaPpSnRK1αgydF4y2Ba利用RNA-seq技术鉴定了大约1000个差异表达基因(DEGs)。我们进一步检测了与SnRK1显著相关的盐胁迫相关基因的表达水平,验证了SnRK1与已知ABA受体之间的相互作用,为SnRK1在盐胁迫反应中的作用提供了证据。说明SnRK1α可能参与ABA信号通路或活性氧代谢,从而提高番茄的耐盐性。总的来说,我们的研究结果表明,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba有利于提高植物的耐盐性。gydF4y2Ba
结果gydF4y2Ba
PpSnRK1αgydF4y2Ba过表达系具有较高的SnRK1活性和耐盐性gydF4y2Ba
为了进一步识别WT和gydF4y2BaPpSnRK1α-gydF4y2Ba过表达番茄株系(gydF4y2BaPpSnRK1αgydF4y2BaOe)的表达水平gydF4y2BaPpSnRK1αgydF4y2Ba在过表达系(OE-1、OE-4、OE-7)和WT中检测,结果如图所示。gydF4y2Ba1gydF4y2Ba一个。gydF4y2BaPpSnRK1αgydF4y2Baoe表现出显著的更高gydF4y2BaSnRK1αgydF4y2Ba表达水平高于野生型gydF4y2BaSnRK1αgydF4y2BaOE-1和OE-4的表达水平相对高于OE-7(图7)。gydF4y2Ba1gydF4y2Ba一个额外的文件gydF4y2Ba1gydF4y2Ba).其次,SnRK1的活性有三种gydF4y2BaPpSnRK1αgydF4y2Ba在盐处理2小时后,oe显著增加,比WT高11.9-17.8%(图4)。gydF4y2Ba1gydF4y2Bab).但高盐处理24 h后,SnRK1活性下降gydF4y2BaPpSnRK1αgydF4y2Baoe.第三,12天后,oe-1、oe-4、oe-7和WT的相对电子电导分别为64.84%、60.43%、64.17%和88.49% 盐处理天数(图。gydF4y2Ba1gydF4y2Bac)。一般来说,gydF4y2BaPpSnRK1αgydF4y2Ba过表达细胞株表现出比WT更低的细胞损伤水平。Evans蓝染色实验进一步验证了这些观察结果(图)。gydF4y2Ba1gydF4y2Bad).因此,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba提高了植物的耐盐性,且改良水平与改良水平成正比gydF4y2BaPpSnRK1αgydF4y2Ba基因表达和SNRK1活性。这些结果一起证明了这些结果gydF4y2BaPpSnRK1αgydF4y2Ba过表达增强番茄耐盐性。gydF4y2Ba
PpSnRK1αgydF4y2Ba过表达系具有更高的SnRK1活性和更高的耐盐性。gydF4y2Ba一个gydF4y2Ba相对表达水平gydF4y2BaSnRK1gydF4y2Ba(PCR采用同源片段和特异性片段gydF4y2BaPpSnRK1gydF4y2Ba(gydF4y2Ba碧桃gydF4y2Ba),gydF4y2BaSlSnRK1gydF4y2Ba(gydF4y2Ba茄属植物lycopersicumgydF4y2Ba)和gydF4y2BaPpSnRK1αgydF4y2Baoverexpressing植物)。这张图片被裁剪了,简单直观,原始图片在附加文件中gydF4y2Ba1gydF4y2BabgydF4y2BaSnRK1活性测定gydF4y2BacgydF4y2BaWT和gydF4y2BaPpSnRK1αgydF4y2Ba过表达系gydF4y2BadgydF4y2Ba伊文思蓝染色。注:在b和c中,数据用三个生物重复的平均值±标准误差(S.E.)表示gydF4y2Ba
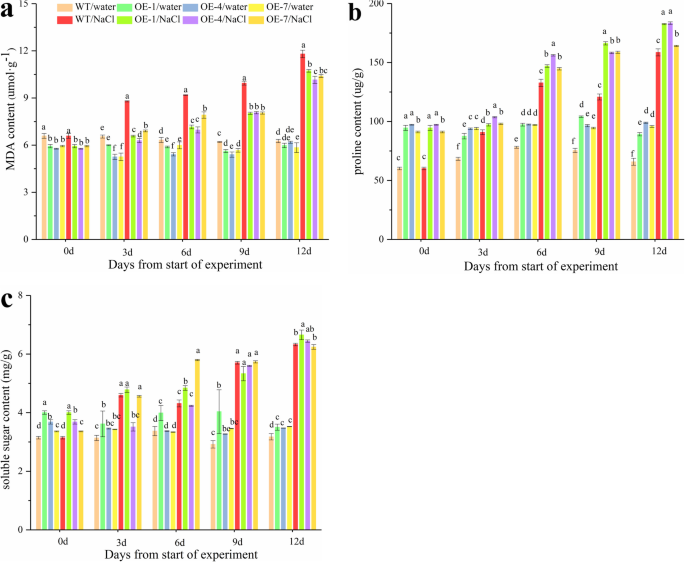
PpSnRK1αgydF4y2Ba调节膜脂过氧化和脯氨酸积累响应盐胁迫gydF4y2Ba
进一步确定gydF4y2BaPpSnRK1αgydF4y2Ba降低细胞膜的过氧化程度,积累脯氨酸[gydF4y2Ba28gydF4y2Ba]来抵抗盐胁迫,我们监测了WT和MDA含量和脯氨酸含量的变化gydF4y2BaPpSnRK1αgydF4y2Ba大江前后进行盐处理。不同品种间MDA含量无显著差异gydF4y2BaPpSnRK1αgydF4y2Baoe和WT植株在正常条件下,MDA含量显著增加gydF4y2BaPpSnRK1αgydF4y2Ba高盐处理12天后,oe明显低于野生型(图2)。gydF4y2Ba2gydF4y2Baa).另一方面,gydF4y2BaPpSnRK1αgydF4y2Ba在对照处理12天后,oe的脯氨酸含量比WT显著增加(图2)。gydF4y2Ba2gydF4y2Bab) 此外,脯氨酸含量在土壤中积累到较高水平gydF4y2BaPpSnRK1αgydF4y2Ba比野生型在盐胁迫下(图。gydF4y2Ba2gydF4y2Bab).然而,总可溶性糖含量也被测定,发现可溶性糖水平之间的差异是有限的gydF4y2BaPpSnRK1αgydF4y2Baoe和WT(图。gydF4y2Ba2gydF4y2Bac) .总的来说,这些结果表明gydF4y2BaPpSnRK1αgydF4y2Ba过表达导致细胞膜过氧化程度的降低和脯氨酸在盐胁迫下的积累。gydF4y2Ba
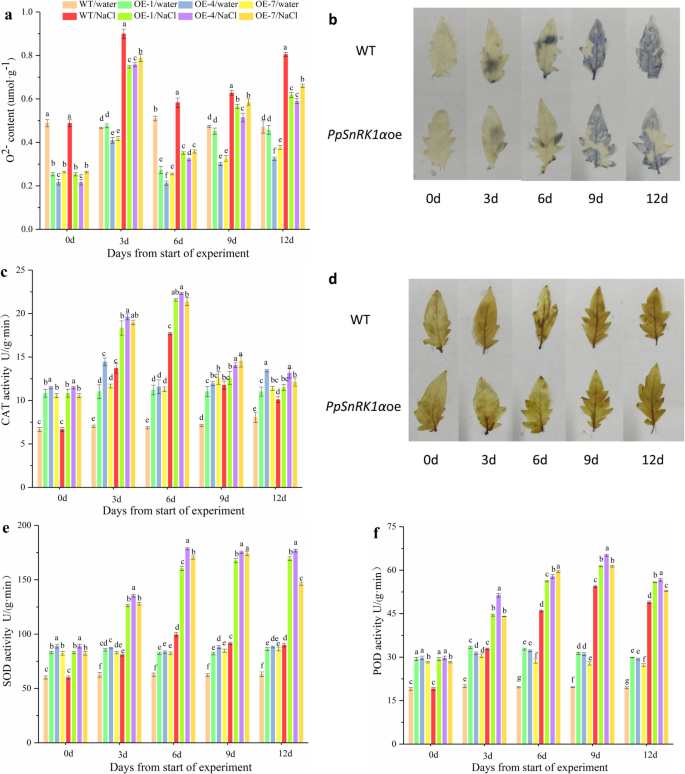
PpSnRK1αgydF4y2Ba过表达系在盐胁迫下ROS含量降低,抗氧化酶活性升高gydF4y2Ba
进一步研究其机制gydF4y2BaPpSnRK1αgydF4y2Ba过表达系增强了番茄的耐盐性gydF4y2BaPpSnRK1αgydF4y2Ba研究了野生型和转基因植物的活性氧代谢,以及抗氧化酶活性和ROS含量的差异。经过12天的盐处理,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba导致O显著下降(17-26%)gydF4y2Ba2−gydF4y2Ba含量,与WT植物中的水平相比(图。gydF4y2Ba2gydF4y2Baa).与这些观察结果一致,NBT染色显示,在盐胁迫下,转基因植株的叶片比野生型叶片受到的损伤小(图2)。gydF4y2Ba2gydF4y2Bab) 。gydF4y2Ba
在正常生长条件下,转基因品系的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶体(POD)活性均高于野生型(图2)。gydF4y2Ba2gydF4y2Bac、 此外,超氧化物歧化酶和过氧化物酶活性的增加gydF4y2BaPpSnRK1αgydF4y2Ba高盐处理12天后,过表达品系比WT增加了62.9-96.7%和8.0-15.8%(图2)。gydF4y2Ba2gydF4y2Bae,f)。更重要的是,gydF4y2BaPpSnRK1αgydF4y2Ba在盐胁迫下,oe的CAT活性高于WT。这一结果与DAB染色实验结果一致,表明转基因植株的过氧化氢含量较WT低,CAT活性较高(图2)。gydF4y2Ba2gydF4y2Ba这些结果表明gydF4y2BaPpSnRK1αgydF4y2Ba可能在抗氧化系统中发挥作用,保护植物在盐胁迫下。gydF4y2Ba
过度表达gydF4y2BaPpSnRK1αgydF4y2Ba改变SnRK2家族基因的表达水平(gydF4y2BaSnRK2.1-SnRK2.7gydF4y2Ba)及抗氧化酶基因(gydF4y2Ba草皮gydF4y2Ba,gydF4y2Ba圆荚体gydF4y2Ba,gydF4y2BaCAT1)gydF4y2Ba番茄酱gydF4y2Ba
表达水平gydF4y2Ba草皮gydF4y2Ba,gydF4y2Ba圆荚体gydF4y2Ba,gydF4y2BaCAT1gydF4y2Ba采用实时荧光定量PCR (qRT-PCR)检测gydF4y2BaPpSnRK1αgydF4y2Ba为了进一步了解SNRK1是否改变了超氧化物基因在遗传水平的表达。根据图。gydF4y2Ba4gydF4y2Ba抗氧化酶(SOD、POD和CAT)编码基因的转录水平最高,分别为野生型的6.839、4.705和4.421倍gydF4y2BaPpSnRK1αgydF4y2Ba高盐度条件下的过表达植物(图。gydF4y2Ba4gydF4y2Ba).因此,可以看出,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba在遗传或转录水平上增加抗氧化酶基因的表达水平。gydF4y2Ba
有七个gydF4y2Ba茄属植物lycopersicum SnRK2gydF4y2Ba基因(gydF4y2BaSlSnRK2sgydF4y2Ba),与拟南芥同源gydF4y2BaSnRK2.2gydF4y2Ba/gydF4y2BaSnRK2.3gydF4y2Ba/gydF4y2BaSnRK2.6gydF4y2Ba番茄的基因[gydF4y2Ba29gydF4y2Ba].在gydF4y2BaPpSnRK1αgydF4y2Ba过度表达的植物,其表达水平gydF4y2BaSnRK2.1gydF4y2Ba是没有明显变化的,而表达呢gydF4y2BaSLSNRK2.2.gydF4y2Ba,gydF4y2BaSLSNRK2.3gydF4y2Ba和gydF4y2BaSLSNRK2.5.gydF4y2Ba无论是否存在盐胁迫(图。gydF4y2Ba4gydF4y2Ba).相比之下,表达水平gydF4y2BaSLSNRK2.4gydF4y2Ba增加在gydF4y2BaPpSnRK1αgydF4y2Ba两种情况下的oe(图。gydF4y2Ba4gydF4y2Ba).然而,表达水平gydF4y2BaSLSNRK2.7.gydF4y2Ba在正常条件下被抑制,而在盐胁迫下则增加(图。gydF4y2Ba4gydF4y2Ba)gydF4y2Ba.gydF4y2Ba因此,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba复杂影响的表达水平gydF4y2BaSlSnRK2gydF4y2Ba.gydF4y2Ba
WT和gydF4y2BaPpSnRK1αgydF4y2Ba超表达植株gydF4y2Ba
进一步评价其分子机制gydF4y2BaPpSnRK1αgydF4y2Ba过表达在更广泛的范围内赋予耐盐性,这是三种基因表达谱的差异gydF4y2BaPpSnRK1αgydF4y2Ba对正常条件下的oe(oe-1、oe-4和oe-7)和WT植物进行分析。使用Illumina平台对WT和三个转基因系的三个生物复制品进行测序,并进行大约4000到5100万次高质量读取(具有快速QC质量分数) > 36)每个生物复制获得(附加文件gydF4y2Ba2gydF4y2Ba).在所有获得的序列中,92 ~ 94%可以被映射到一个独特的染色体位置。样本中每个转录本的表达水平用片段/千分片/千分片/千分片/千分片/千分片/千分片/千分片/千分片(FPKM)表示。同一样本的三个重复之间存在较高的线性相关性,说明重复之间的差异很小(附加文件)gydF4y2Ba3.gydF4y2Ba).通过比较WT和转基因植物的转录组,确定了差异表达基因(DEGs) [gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].我们总共鉴定了1009个DEG,其中668个上调,341个下调gydF4y2BaPpSnRK1αgydF4y2Ba与WT相比,过表达植株(图。gydF4y2Ba5gydF4y2Baa).这些结果表明大量基因的表达被改变gydF4y2BaPpSnRK1αgydF4y2Ba过度表达,这些基因或直接或间接地受到gydF4y2BaSnRK1gydF4y2Ba.gydF4y2Ba
测试是否gydF4y2BaSnRK1αgydF4y2Ba过表达通过调节盐应答基因的表达、上调和下调基因的功能注释和KEGG通路富集分析来缓解盐的严重影响gydF4y2BaPpSnRK1αgydF4y2Baoe被执行(附加文件gydF4y2Ba4gydF4y2Ba;无花果。gydF4y2Ba5gydF4y2Bab;额外的文件gydF4y2Ba5gydF4y2Ba)MAPK(丝裂原活化蛋白激酶)信号通路——植物、植物-病原相互作用和植物激素信号转导是基因调控的主要KEGG通路gydF4y2BaPpSnRK1αgydF4y2Baoe。然后将GO术语分配给deg。许多基因参与了各种细胞成分、分子功能和生物过程(图。gydF4y2Ba5gydF4y2Bac) ,其中1714个GO术语在上调的DEG中富集,1334个GO术语在下调的DEG中富集(补充文件gydF4y2Ba6gydF4y2Ba).在DEGS中,对生物过程中的刺激,代谢过程和生物调节的反应分子功能中的抗氧化活性是明显的富集术语(图。gydF4y2Ba5gydF4y2Bac).值得注意的是,17个过氧化物酶基因的表达水平被显著调控gydF4y2BaPpSnRK1αgydF4y2Ba过表达植物,特别是过氧化物酶21被上调6倍,可能会提高转基因植物在盐条件下去除ROS的能力(附加文件gydF4y2Ba4gydF4y2Ba).这一假设得到了不同品系中ROS积累模式的支持(图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
抗氧化酶活性和OgydF4y2Ba2−gydF4y2Ba在WT和gydF4y2BaPpSnRK1αgydF4y2Ba超表达。gydF4y2Ba一个gydF4y2BaO的比较gydF4y2Ba2−gydF4y2Ba和之间的含量gydF4y2BaPpSnRK1αgydF4y2Ba超表达,gydF4y2BabgydF4y2BaNBT染色检测叶片中的超氧化物gydF4y2BacgydF4y2BaWT与CAT活性比较gydF4y2BaPpSnRK1αgydF4y2Ba过表达系gydF4y2BadgydF4y2BaH DAB染色gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在树叶gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba比较野生型与野生型SOD (e)和POD (f)活性gydF4y2BaPpSnRK1αgydF4y2Ba超表达。注:在a, c, e和f中,每个样品有三个生物重复。数据显示为三次技术重复的平均值±segydF4y2Ba
PpSnRK1αgydF4y2Ba过表达会改变一些转录因子和下游基因的表达,特别是应激相关基因的转录水平gydF4y2Ba
在所有的deg中,我们鉴定了101个转录因子(TFs),它们属于37个家族(附加文件)gydF4y2Ba7gydF4y2Ba和gydF4y2Ba8gydF4y2Ba).有趣的是,来自B3,Garp-G2样,淋巴和腕骨系列的TFS的表达水平,而来自其他家庭的TFS的TFS,例如GRF(生长调节因子)和HSF(热休克转录因子),被抑制了。鉴于100多个TFS改变了表达水平gydF4y2BaPpSnRK1αgydF4y2Ba我们得出结论,TFs直接或间接地受到gydF4y2BaPpSnRK1αgydF4y2Ba,gydF4y2BaPpSnRK1αgydF4y2Ba可能通过直接结合某些基因或转录因子的启动子来调控它们的表达。gydF4y2Ba
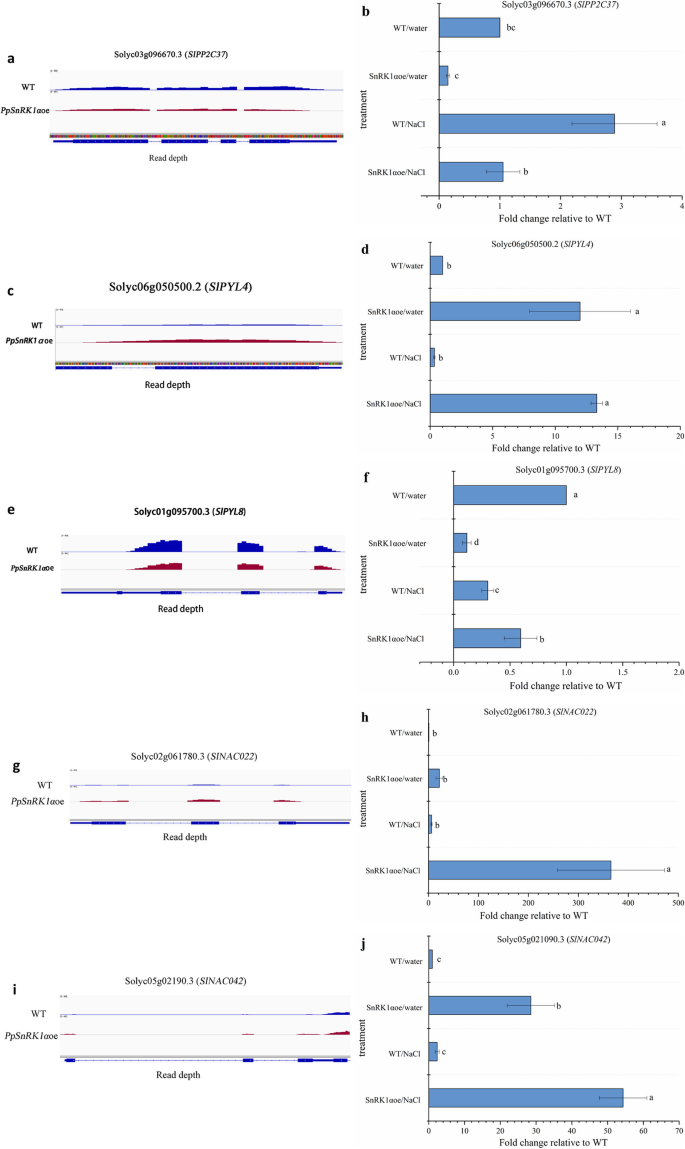
为了进一步研究SnRK1在胁迫反应中的作用,研究了6个胁迫应答基因在WT和WT之间的表达水平gydF4y2BaPpSnRK1αgydF4y2Ba比较了两种情况。其中,编码胁迫应答蛋白的基因包括参与ABA信号通路的磷酸酶2C (solyc03g096670.3)、PYL (pyrabactin resistance(PYR)like) /PYR (pyrabactin resistance)(solyc06g0505002和solyc01g095700.3) [gydF4y2Ba32gydF4y2Ba] .surpringly,调节的TFS还包括盐相关基因,例如gydF4y2Ba南汽gydF4y2Ba其中一些成员已被证明能增强水稻和拟南芥对各种非生物胁迫的耐受性。如图所示。gydF4y2Ba6gydF4y2Baa, RNA-seq显示gydF4y2BaSlPP2C37gydF4y2Ba的表达水平在正常情况下显著下调gydF4y2BaSlPP2C37gydF4y2Ba是上调的gydF4y2BaPpSnRK1αgydF4y2Baoe和WT在盐胁迫下的表达水平,而gydF4y2BaSlPP2C37gydF4y2Ba比WT植物中低1.3倍(图。gydF4y2Ba6gydF4y2Baa, b)。此外,aba受体的表达水平gydF4y2BaSlPYL4gydF4y2Ba(solyc06g050500.2)和gydF4y2BaSlPYL8gydF4y2Ba(solyc01g095700.3)gydF4y2BaPpSnRK1αgydF4y2Ba过表达植物也被改变(图。gydF4y2Ba6gydF4y2Bac, d, e, f),例如gydF4y2BaSlPYL4gydF4y2Ba成绩单水平增加了11至13倍gydF4y2BaPpSnRK1αgydF4y2Ba这与RNA-seq的结果一致。gydF4y2Ba6gydF4y2Bac、 d);鉴于gydF4y2BaPYL8gydF4y2Ba正常条件下转基因株系的表达量下降,与RNA-seq的结果一致,在盐胁迫下表达量略有上升(图2)。gydF4y2Ba6gydF4y2Bae、 f)。有趣的是,gydF4y2BaSlNAC022gydF4y2Ba和gydF4y2BaSlNAC042gydF4y2Ba在gydF4y2BaPpSnRK1αgydF4y2Ba在正常条件和盐胁迫下,oe在wt中,以及上调的表达水平gydF4y2BaSlNAC022gydF4y2Ba和gydF4y2BaSlNAC042gydF4y2Ba在gydF4y2BaPpSnRK1αgydF4y2Ba在盐胁迫下,oe分别是WT的359.1倍和52.0倍。gydF4y2Ba6gydF4y2Bag, h, i, j)。这些数据表明gydF4y2BaSnRK1αgydF4y2Ba可以改变胁迫相关基因的表达,并有可能提高番茄植株的耐盐性。gydF4y2Ba
讨论gydF4y2Ba
当植物响应盐胁迫时,一些蛋白激酶被激活,调控大量的防御相关基因,这些变化有利于植物防御机制的建立。植物对盐胁迫的响应与SnRKs家族密切相关,可能通过SOS (salt too - Sensitive)信号通路和ABA信号转导[gydF4y2Ba2gydF4y2Ba].虽然目前还不清楚植物是如何特别应对胁迫的,但有充分的证据表明SnRKs可以参与许多物种对盐胁迫的抵抗[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
作为细胞信号网络的关键组成部分,gydF4y2BaSnRK1gydF4y2Ba可以与不同形式和能量状态的糖分子相互作用,调节其他激酶的活动,并与tf相互作用,在应激条件下维持细胞内能量平衡[gydF4y2Ba18gydF4y2Ba].据我们所知,gydF4y2BaAKIN10gydF4y2Ba(同源gydF4y2BaPpSnRK1αgydF4y2Ba)可以通过AKIN10激酶活性依赖的蛋白修饰负调控AtMYC2蛋白的积累,从而应对非生物胁迫[gydF4y2Ba35gydF4y2Ba].gydF4y2BaSnRK1gydF4y2Ba还控制钠gydF4y2Ba+gydF4y2Ba在高盐胁迫下,Na/K通量和维持Na/K稳态[gydF4y2Ba36gydF4y2Ba].此外,gydF4y2BaSnRK1gydF4y2Ba能对黑暗、缺氧和盐水条件下的高或低葡萄糖水平作出反应,并在逆境下调节植物的能量代谢[gydF4y2Ba37gydF4y2Ba].在这项研究中,我们确定gydF4y2BaPpSnRK1αgydF4y2Ba结果表明,异位表达可增强番茄耐盐表型(图。gydF4y2Ba1gydF4y2Ba).与之前的研究一致,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba在盐胁迫下,品系细胞活力较高,生长较好gydF4y2BaPpSnRK1αgydF4y2BaSnRK1的表达水平和活性(图。gydF4y2Ba1gydF4y2Ba),这表明gydF4y2BaSnRK1gydF4y2Ba是番茄耐盐性的正调节因子。因此,gydF4y2BaPpSnRK1αgydF4y2Ba除了它在耐盐性中的作用外,可能还有其他潜在的机制。gydF4y2Ba
活性氧的积累是植物对盐胁迫的主要反应之一。过量的ROS会破坏生物大分子,对细胞产生毒性作用。植物中的几种抗氧化酶,如抗氧化歧化酶、过氧化物酶和过氧化氢酶,在清除ROS的过程中起着关键作用[gydF4y2Ba38gydF4y2Ba].有报道称,ROS也可以作为信号分子介导植物对不同胁迫的反应[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].细胞中的一些蛋白激酶可以感知外源ROS的刺激或ROS的产生,并通过一系列磷酸化和去磷酸化信号对应激做出反应。例如,NADPH氧化酶能迅速提高细胞内ROS水平,刺激信号从细胞质膜迅速进入细胞核[gydF4y2Ba41gydF4y2Ba].Szymańska, P. Katarzyna等人发现拟南芥中两种snf1相关蛋白激酶2 (SnRK2), SnRK2.4和SnRK2.10可以调节ROS稳态并响应盐度[gydF4y2Ba42gydF4y2Ba].在我们的调查中,过度表达gydF4y2BaPpSnRK1αgydF4y2Ba抗氧化酶基因在盐胁迫下的表达量显著增加,清除ROS能力增强,细胞膜损伤程度较低,抗氧化酶基因的表达量显著增加,这可能部分解释了转基因植物耐盐性提高的机制,提示了转基因植物抗盐性提高的作用gydF4y2BaPpSnRK1αgydF4y2Ba在调节抗氧化酶基因的表达(fig .。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba).一般认为,脯氨酸是小麦抗盐胁迫的渗透调节剂之一,脯氨酸的积累有助于维持细胞液泡膜的完整性和功能,从而增强其抗盐损伤的能力[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].很明显gydF4y2BaPpSnRK1αgydF4y2Ba有助于维持细胞膜的完整性和功能,从而增强植物抵抗盐害的能力(图。gydF4y2Ba2gydF4y2Ba).因此,我们认为这些可能对观察到的耐盐性起到了至少部分的作用。gydF4y2Ba
的gydF4y2BaSnRKsgydF4y2Ba代表一个大家庭,可以进一步分为gydF4y2BaSnRK1gydF4y2Ba,gydF4y2BaSnRK2,gydF4y2Ba和gydF4y2BaSnRK3gydF4y2Ba亚科。许多成员gydF4y2BaSnRKsgydF4y2Ba家庭在非生物应激反应中起着关键作用。营养生长中渗透胁迫下ABA信号通路中,AREB1/ABF2, AREB2/ABF4和ABF3可被SnRK2.2, 2.6和2.3激活[gydF4y2Ba45gydF4y2Ba].已知SnRK2.2和密切相关的SnRK2.3在ABA抑制拟南芥种子萌发中发挥作用[gydF4y2Ba46gydF4y2Ba].此外,SnRK2.6可以与ABAR/CHLH相互作用,并在保卫细胞信号转导中响应脱落酸[gydF4y2Ba23gydF4y2Ba结果表明,在盐胁迫下,植物的过表达gydF4y2BaPpSnRK1αgydF4y2Ba显著影响7个细胞的表达水平gydF4y2BaSnRK2gydF4y2Ba番茄家族基因(图。gydF4y2Ba4gydF4y2Ba).此外,关于斯内克斯家族的研究表明,家庭中也存在不同基因之间的相互作用。例如,在拟南芥中,SNRK3.15可以与SNRK1.1和SNRK1.2相互作用,调节它们的活动并参与糖代谢[gydF4y2Ba47gydF4y2Ba].因此,植物SnRKs不同亚科成员之间的直接或间接相互作用增强了植物对胁迫的响应能力。gydF4y2Ba
脱落酸是调控植物非生物胁迫反应的关键分子。之前的一项研究证明了两者之间的相互作用gydF4y2BaSnRK1.1gydF4y2Ba和ABA信号的交叉gydF4y2BaSnRK1.1gydF4y2Ba过表达拟南芥系gydF4y2Baaba2gydF4y2Ba突变体,其ABA信号转导和糖信号通路均受损,导致葡萄糖低敏感[gydF4y2Ba48gydF4y2Ba].此外,缺陷核33 (defective kernel 33, DEK33)参与了ABA的合成过程,并与SnRK1相互作用,提示它们的相互作用可能调节DEK33的稳定性,从而调节ABA信号[gydF4y2Ba49gydF4y2Ba].据报道,抑制gydF4y2BaSnRK1gydF4y2Ba豌豆中SnRK1的表达导致了与ABA不敏感突变体相似的多性成熟缺陷,小麦根系中SnRK1可以响应ABA处理,其水平急剧下降,但磷酸化(活性)SnRK1的数量保持不变[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].在我们的研究中,我们发现gydF4y2BaSlPP2C37gydF4y2Ba(PP2C家族成员)[gydF4y2Ba26gydF4y2Ba],gydF4y2BaSlPYL4gydF4y2Ba,gydF4y2BaSlPYL8gydF4y2Ba(ABA信号传导中的ABA受体)和gydF4y2BaSnRK2gydF4y2Ba家族基因受到显著调控gydF4y2BaPpSnRK1αgydF4y2BaRNA-seq数据显示,在正常生长条件下过表达(图3)。gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba和gydF4y2Ba7gydF4y2Ba)MAPK(丝裂原活化蛋白激酶)级联也被证明与ABA信号和非生物胁迫有关[gydF4y2Ba32gydF4y2Ba].RNA-seq结果显示MAPK通路在gydF4y2BaPpSnRK1αgydF4y2Ba超表达行(无花果。gydF4y2Ba5gydF4y2Ba额外的文件gydF4y2Ba4gydF4y2Ba).这些基因已经被证明参与了ABA信号通路[gydF4y2Ba5gydF4y2Ba].根据这些结果,我们假设gydF4y2BaSnRK1αgydF4y2Ba可能参与ABA信号转导途径。需要进一步的验证来说明其调控机制gydF4y2BaSnRK1αgydF4y2Ba盐胁迫下。gydF4y2Ba
通过RNA-seq对基因进行IGV (integrated Genomics Viewer)可视化,并对相关基因进行RT-qPCR分析gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba和gydF4y2Ba我gydF4y2Ba图像的IGV可视化gydF4y2BaSlPP2C37gydF4y2Ba(一),gydF4y2BaSlPYL4gydF4y2Ba(c),gydF4y2BaSlPYL8gydF4y2Ba(e),gydF4y2BaSlNAC022gydF4y2Ba(g)和gydF4y2BaSlNAC042gydF4y2Ba(我)gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba和gydF4y2BajgydF4y2BaRT-qPCR分析结果gydF4y2BaSlPP2C37gydF4y2Ba(b),gydF4y2BaSlPYL4gydF4y2Ba(d),gydF4y2BaSlPYL8gydF4y2Ba(f),gydF4y2BaSlNAC022gydF4y2Ba(h)和gydF4y2BaSlNAC042gydF4y2Ba(j)。注意:在B,D,F,H和J中,错误栏表示SES(gydF4y2BangydF4y2Ba= 3,3个生物复制)。WT和的所有值gydF4y2BaPpSnRK1αgydF4y2Ba过度表达的植物在统计学上有显著差异(学生的t检验;gydF4y2BapgydF4y2Ba值< 0.05)gydF4y2Ba
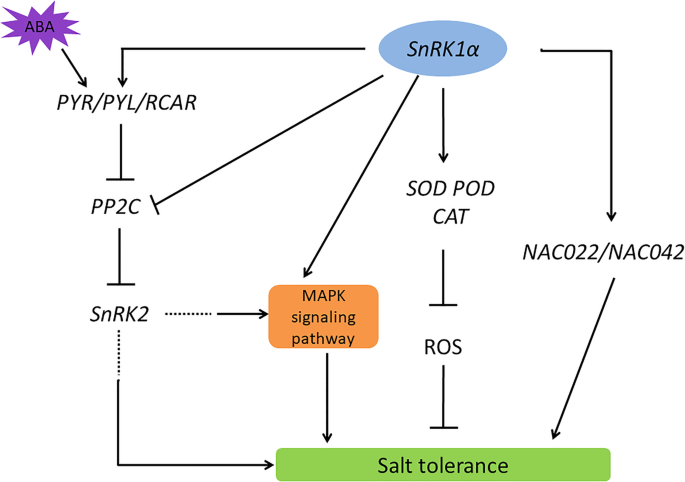
的工作模式gydF4y2BaPpSnRK1αgydF4y2Ba通过ABA信号转导途径和ROS机制调控耐盐性。在当前的工作模型中,gydF4y2BaPpSnRK1αgydF4y2Ba-过度表达可提高细胞的转录水平gydF4y2Ba草皮gydF4y2Ba,gydF4y2Ba仓,gydF4y2Ba和gydF4y2BaCAT1gydF4y2Ba以及SOD、POD和CAT活性,降低了植物细胞中ROS的产生。gydF4y2BaPpSnRK1αgydF4y2Ba通过改变ABA受体的转录水平参与ABA信号通路(gydF4y2BaSlPYL4gydF4y2Ba,gydF4y2BaSlPYL8gydF4y2Ba), PP2C (gydF4y2BaSlPP2C37gydF4y2Ba),gydF4y2BaSlSnRK2sgydF4y2Ba,从而导致番茄中盐胁迫的耐受性增加。此外,gydF4y2BaPpSnRK1αgydF4y2Ba-overexpression增加的表达gydF4y2BaSlNAC022gydF4y2Ba,已被证实参与ABA信号转导转录gydF4y2Ba
NAC蛋白作为植物特有的最大转录因子家族之一,在植物对环境胁迫的响应中具有不同的作用[gydF4y2Ba52gydF4y2Ba].据报道gydF4y2BaANAC036gydF4y2Ba(拟南芥NAC转录因子家族成员)参与拟南芥花序和叶片形态发生[gydF4y2Ba53gydF4y2Ba].Hong Y等人发现了这一点gydF4y2BaONAC22gydF4y2Ba(水稻NAC转录因子家族成员)通过调节aba介导的通路在耐干旱和盐胁迫中发挥积极作用[gydF4y2Ba54gydF4y2Ba].我们的调查显示gydF4y2BaSlNAC022gydF4y2Ba,具有高度的同源性gydF4y2BaANAC036gydF4y2Ba和gydF4y2BaONAC22gydF4y2Ba,明显受到调控gydF4y2BaPpSnRK1αgydF4y2Baoverexpressing植物(图。gydF4y2Ba6gydF4y2Ba).JUNGBRUNNEN1 (gydF4y2Bajub1.gydF4y2Ba)可以强烈地延迟衰老和增强对拟南芥中的各种非生物胁迫的耐受性[gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].有趣的是gydF4y2BaSlNAC42gydF4y2Ba,具有高度的同源性gydF4y2Bajub1.gydF4y2Ba,也明显高于野生型(图。gydF4y2Ba6gydF4y2Ba).这里我们假设gydF4y2BaSlNAC022gydF4y2Ba和gydF4y2BaSlNAC42gydF4y2Ba在里面gydF4y2BaPpSnRK1αgydF4y2Ba过表达叶片对ABA信号的响应增强了植物的耐盐性。进一步确定SnRK1和NAC022/ NAC42是否直接相互作用以提高耐盐性还需要更多的工作。gydF4y2Ba
在这里,我们表明过度表达gydF4y2BaPpSnRK1αgydF4y2Ba改善了植物的耐盐性。这些观察结果表明,应力阻力可能受到调节的影响gydF4y2BaPpSnRK1αgydF4y2Ba基因。进一步的分子和遗传分析将增加我们对其功能的理解gydF4y2BaPpSnRK1αgydF4y2Ba为植物抗逆性研究提供了理论依据,为转基因作物的选育提供了策略。gydF4y2Ba
结论gydF4y2Ba
综上所述,本研究结果表明SnRK1是应激反应的关键激酶gydF4y2BaPpSnRK1αgydF4y2Ba过表达可以通过调节ROS代谢或可能的ABA介导的途径显着改善耐盐性。更重要的是,SNRK1可以直接或间接与SNRK2系列交互。SNRK1响应盐胁迫的机制是复杂的,并对SNRK1是否直接调节gydF4y2BaNAC022gydF4y2Ba和gydF4y2BaNAC042gydF4y2Ba表达或通过结合中间受体间接控制其转录需要进一步研究。生成gydF4y2Basnrk1gydF4y2Ba功能缺失突变体可能是进一步了解其功能的分子机制所必需的gydF4y2BaSnRK1gydF4y2Ba在盐应激反应和耐受性。gydF4y2Ba
方法gydF4y2Ba
载体构建与番茄转化gydF4y2Ba
在本研究中,WT番茄(gydF4y2Ba茄属植物lycopersicumgydF4y2Ba轧机。简历。中书6)由清卫孟[gydF4y2Ba57gydF4y2Ba].然后我们得到了过表达gydF4y2BaPpSnRK1αgydF4y2Ba通过载体构建和番茄转化,选择了三个品系(OE-1、OE-4和OE-7)进行进一步研究。gydF4y2Ba
基于的编码序列gydF4y2BaPpSnRK1αgydF4y2Ba(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/XM_007215174.2gydF4y2Ba),设计了两条引物(正向引物:5 ' - GCTCTAGAATGGATGGATCGGTTG-3 ';反向引物:5 ' - GCGTCGACTTAAAGGACCCG−3 ')。然后,gydF4y2BaPpSnRK1αgydF4y2Ba将编码序列按意义方向插入到花椰菜花叶病毒35S启动子下游的二进制载体pBI121中(35S:gydF4y2BaPpSnRK1αgydF4y2Ba).这种结构被引入gydF4y2Ba农杆菌肿瘤术gydF4y2Ba菌株LBA4404 (gydF4y2Ba茄属植物lycopersicumgydF4y2Ba轧机。简历。用叶盘法进行中书变换[gydF4y2Ba58gydF4y2Ba].gydF4y2Ba
T2转基因植株过表达gydF4y2BaPpSnRK1αgydF4y2BaT5直接PCR试剂盒(TSINGKE, TSE011),引物gydF4y2BaPpSnRK1αgydF4y2Badf(5“-GTGTGGAGTTGCGGAGTCAT-3”)gydF4y2BaPpSnRK1αgydF4y2Ba是(5“-ACGAGGAAGATGAGCCTGGA-3”)。将pcr阳性的番茄植株移栽到有土壤的盆栽中,在自然条件下生长。接下来,我们选择了3个转基因番茄株系(OE-1、OE-4和OE-7)进行进一步研究。gydF4y2Ba
植物材料及处理gydF4y2Ba
WT和转基因番茄种子在温室中25±3℃,16 h光照/8 h暗循环培养4周。1个月后,将WT和转基因品系OE1、OE4、OE7分别用水处理(对照处理)或100 mmol·L处理gydF4y2Ba−1gydF4y2Ba食盐(氯化钠)。每个处理包含三个组,每组10棵幼苗。盐胁迫条件下,每3天用1000 mL 100 mmol·L-1 NaCl溶液浇灌植株至饱和。分别在处理后0、3、6、9和12 d采集叶片样品。第1天,在NaCl处理后2 h和24 h测定SnRK1酶活性。gydF4y2Ba
rt - pcrgydF4y2Ba
用超纯RNA试剂盒(CWBIO, China, CW0581M)从番茄叶片中提取总RNA,用PrimeScript™II 1st Strand cDNA Synthesis Kit (Takara, 6210A)反转录成cDNA。调整每个cDNA池的体积,使其具有相同的PCR信号强度gydF4y2BaEF1αgydF4y2Ba后32个周期。选择PpSnRK1和SlSnRK1同源片段,设计特异性引物(gydF4y2BaPpSlSnRK1αgydF4y2Ba- f和gydF4y2BaPpSlSnRK1αgydF4y2Ba-R)用于PCR鉴定(附加文件gydF4y2Ba9gydF4y2Ba).采用Premix Taq (Takara, R004A)进行PCR。gydF4y2Ba
SnRK1活动的决心gydF4y2Ba
一克每个新鲜植物样本收获两个盐治疗后24小时,在1毫升的冷提取缓冲区包含100毫米Tricine-NaOH (pH值8.0),25毫米氟化钠,5毫米二硫苏糖醇,焦磷酸四钠2毫米,0.5毫米的乙二胺四乙酸,0.5毫米乙二醇四乙酸、苯甲脒1毫米,1 mM苯甲基磺酰氟,1 mM蛋白酶抑制剂鸡尾酒(Sigma P9599),磷酸酶抑制剂(PhosStop;和不溶性聚乙烯吡咯烷酮至最终浓度为2% (w/v)的溶液中。匀浆转移到两根冷微离心管中,12000 ×离心gydF4y2BaggydF4y2Ba4°C保存5分钟。上清液(750 uL)在2.5 mL离心柱上脱盐(Sephadex G-25培养基柱;通用电气医疗保健公司(GE Healthcare)的估值达到了预平衡。SnRKl活性由通用激酶活性试剂盒(R&D Systems, Minneapolis, MN, United States, EA004)以AMARA多肽为底物测定[gydF4y2Ba59gydF4y2Ba].gydF4y2Ba
抗氧化能力和脯氨酸含量的测定gydF4y2Ba
采用酸性茚三酮法测定脯氨酸含量[gydF4y2Ba60gydF4y2Ba].OgydF4y2Ba2−gydF4y2Ba采用羟胺氧化法测定含量[gydF4y2Ba61gydF4y2Ba]3,3′-二氨基联苯胺(DAB)染色和硝基蓝四氮唑(NBT)染色检测HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2−gydF4y2Ba番茄叶片中的含量。首先将番茄叶片浸泡在0.5 mg/mL DAB染色液(pH = 3.8)或0.5 mg/mL NBT染色液中,然后置于黑暗、高湿的塑料盒中浸泡约24 h。将染色液倒出,将叶片样品与乙醇/乳酸/甘油溶液(3:1:1,v:v:v)在沸水浴中孵育5分钟[gydF4y2Ba62gydF4y2Ba].采用硝基蓝四唑光化学还原法测定SOD活性[gydF4y2Ba63gydF4y2Ba].用紫外吸收法测定CAT活性,将240 nm (OD240)光密度在1 min内0.1的变化定义为酶活性的一个单位[gydF4y2Ba64gydF4y2Ba]POD活性在OD470时通过愈创木酚法测定,一单位酶活性定义为OD470每分钟0.1次死亡[gydF4y2Ba65gydF4y2Ba].SOD、POD、CAT活性以U·min表示gydF4y2Ba−1gydF4y2Ba·ggydF4y2Ba−1gydF4y2Ba(FW)。gydF4y2Ba
通过测定番茄叶片的相对电导率来测定细胞的损伤程度。将取自WT或转基因株系的10个叶盘(直径0.8 cm)浸泡在20 mL蒸馏水中,抽真空30 min,室温摇匀3 h,测量初始电导率(S1)。随后,将叶片样品煮沸30分钟,冷却至室温,测量最终的电导率(S2)。以纯蒸馏水的电导率为空白(S0)。计算相对电子电导(REC)为gydF4y2Ba\(\mathrm{REC}=\frac{\mathrm{S}1-\mathrm{S}0}{\mathrm{S}2-\mathrm{S}0}\ast 100\)gydF4y2Ba.采用硫代巴比妥酸法测定丙二醛含量[gydF4y2Ba66gydF4y2Ba].用伊文思蓝染色液对番茄叶片进行染色,观察细胞活力[gydF4y2Ba67gydF4y2Ba].gydF4y2Ba
RNA-seqgydF4y2Ba
叶片WT和3gydF4y2BaPpSnRK1αgydF4y2Ba采集正常生长2个月的番茄过表达品系。RNA分离、质量控制、文库构建、Illumina Hiseq测序由武汉迈特华生物技术有限公司完成。gydF4y2Ba
生物信息分析gydF4y2Ba
质量控制gydF4y2Ba
原始读取从原始数据中删除低质量的读取和包含适配器和poly-N的读取,然后过滤和检查测序错误率和GC内容。由此产生的干净、高质量的读取用于后续分析。gydF4y2Ba
定位和差异表达基因(DEG)鉴定gydF4y2Ba
利用HISAT2将序列定位到番茄基因组。利用特征计数计算FPKM和计数值。DESeq2用于分析不同样本和治疗组之间的差异[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].然后采用Benjamin-Hochberg方法在显著性水平上进行多重假设检验修正gydF4y2BaPgydF4y2Ba < 0.05; |log 2 fold change| ≥ 1 was used to identify differentially expressed genes (DEGs) between the two libraries (PpSnRK1αgydF4y2Baoe和WT)。采用基于超几何分布的R方法对基因本体(GO)和京都基因与基因组百科全书(KEGG)进行富集分析。gydF4y2Ba
中存在gydF4y2Ba
采用UltraSYBR混合液(CWBIO, China, CW2601M)进行实时荧光定量PCR (qRT-PCR)。25 μL反应混合物中含有0.5 μL正向引物(10 μM)、0.5 μL反向引物(10 μM)、5 ng cDNA模板、12.5 μL 2× UltraSYBR混合物和9.5 μL水。qRT-PCR的条件为:95℃10 min, 95℃10 s, 60℃30 s, 72℃32 s,共40个循环。qRT-PCR的计算方法为2gydF4y2Ba——ΔΔCtgydF4y2Ba与gydF4y2BaEF-1αgydF4y2Ba基因作为内源控制。每个样本有三个独立的生物学重复。请参阅附加文件gydF4y2Ba8gydF4y2BaRT-PCR引物见表S6。gydF4y2Ba
统计分析gydF4y2Ba
统计分析使用Microsoft Office Excel 2010,图像处理使用Microsoft PowerPoint 2010。均数比较采用SPSS 20.0软件邓肯多量程检验。P < 0.05为显著差异。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的数据集包含在本文及其附加文件中。的编码序列gydF4y2BaPpSnRK1αgydF4y2Ba序列可在NCBI获得(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/XM_007215174.2gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
- PpSnRK1α:gydF4y2Ba
-
snf相关激酶1α亚基(gydF4y2Ba碧桃gydF4y2Ba)gydF4y2Ba
- PpSnRK1αgydF4y2Baoe:gydF4y2Ba
-
PpSnRK1αgydF4y2Ba-overexpressing西红柿行gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- qRT PCR:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 矩形:gydF4y2Ba
-
相对电子电导gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- FPKM:gydF4y2Ba
-
每千碱基外显子的片段,每百万片段的图谱gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论财团gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- MAPK:gydF4y2Ba
-
丝裂原活化蛋白激酶gydF4y2Ba
- CIPK:gydF4y2Ba
-
钙调磷酸酶b样相互作用蛋白激酶gydF4y2Ba
- ABI1:gydF4y2Ba
-
ABA-insensitive 1gydF4y2Ba
- PP2CA:gydF4y2Ba
-
蛋白磷酸酶2C A组gydF4y2Ba
- TFs:gydF4y2Ba
-
转录因子gydF4y2Ba
- 平:gydF4y2Ba
-
生长调节因素gydF4y2Ba
- HSF:gydF4y2Ba
-
热休克转录因子gydF4y2Ba
- 所有供试/ PYR:gydF4y2Ba
-
Pyrabactin耐药(PYR)样/ Pyrabactin耐药gydF4y2Ba
- 南京:gydF4y2Ba
-
NAM, ATAF1,2, CUC2gydF4y2Ba
- SOS:gydF4y2Ba
-
盐过度敏感gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
杨勇,郭勇。植物盐胁迫响应的分子机制研究。新植醇。2018;217(2):523 - 39。gydF4y2Ba
- 2.gydF4y2Ba
朱镕基j - k。植物的非生物胁迫信号与响应。细胞。2016;167(2):313 - 24。gydF4y2Ba
- 3.gydF4y2Ba
基因与耐盐性:将它们结合在一起。新植醇。2005;167(3):645 - 63。gydF4y2Ba
- 4.gydF4y2Ba
MAPK和ABA在非生物胁迫信号转导中的作用。植物学报,2016;21(8):677-85。gydF4y2Ba
- 5.gydF4y2Ba
朱镕基j - k。植物的盐和干旱胁迫信号转导。植物学报2002;53:247-73。gydF4y2Ba
- 6.gydF4y2Ba
朱建康。通过蛋白激酶的渗透胁迫信号。中国生物医学工程学报。2012;32(4):457 - 461。gydF4y2Ba
- 7.gydF4y2Ba
石胜,毛军,董磊,苏勇,王强,刘华。钙离子传感器CBL-CIPK参与植物对非生物胁迫的响应。Int J Genomics. 2015;2015:493191。gydF4y2Ba
- 8.gydF4y2Ba
WRKY蛋白在非生物胁迫反应中的表达与信号转导。TheScientificWorldJournal。2015; 2015:807560。gydF4y2Ba
- 9.gydF4y2Ba
AP2/ERF家族转录因子在植物非生物胁迫反应中的作用。生物物理学报。2012;1819(2):86-96。gydF4y2Ba
- 10.gydF4y2Ba
NAC蛋白在胁迫耐受中的调控作用。植物科学进展,2012;17(6):369-81。gydF4y2Ba
- 11.gydF4y2Ba
Rushton DL, Tripathi P, Rabara RC, Lin J, Ringler P, Boken AK, Langum TJ, Smidt L, Boomsma DD, Emme NJ等。WRKY转录因子:脱落酸信号转导的关键成分。生物技术学报;2012;10(1):2-11。gydF4y2Ba
- 12.gydF4y2Ba
Ariel FD,Manavella PA,Dezar CA,Chan RL.高清拉链系列的真实故事.趋势植物科学杂志2007;12(9):419-26。gydF4y2Ba
- 13.gydF4y2Ba
Emanuelle S, hosain MI, Moller IE, Pedersen HL, van de Meene AML, Doblin MS, Koay A, Oakhill JS, Scott JW, Willats WGT等。拟南芥的SnRK1是一种非典型AMPK。植物j . 2015; 82(2): 183 - 92。gydF4y2Ba
- 14.gydF4y2Ba
Crozet P,Jammes F,Valot B,Ambard Bretteville F,Nessler S,Hodges M,Vidal J,Thomas M.拟南芥蔗糖非发酵1相关蛋白激酶1(AtSnRK1)与其激活激酶(AtSnAK)之间的交叉磷酸化决定了它们的催化活性。《生物化学杂志》2010;285(16):12071-7。gydF4y2Ba
- 15.gydF4y2Ba
Snf1激酶的调控:激活需要一个上游激酶介导的苏氨酸210的磷酸化以及一个由Snf4亚基介导的明显步骤。生物化学学报。2001;276(39):36460-6。gydF4y2Ba
- 16.gydF4y2Ba
拟南芥蛋白激酶GRIK1和GRIK2通过磷酸化SnRK1的激活环而特异性激活SnRK1。植物杂志。2009;150:996 - 1005。gydF4y2Ba
- 17.gydF4y2Ba
通过磷酸化调控amp激活的蛋白激酶。j . 2000, 345(3): 437。gydF4y2Ba
- 18.gydF4y2Ba
Baena-González E,辛J.汇聚能量和压力信号。植物学报,2008;13(9):474-82。gydF4y2Ba
- 19.gydF4y2Ba
Hong S-P,Carlson M.Snf1蛋白激酶对环境胁迫的调节。生物化学杂志。2007;282(23):16838–45.gydF4y2Ba
- 20.gydF4y2Ba
赵Y-H,洪J-W, Kim E-C, Yoo S-D。SnRK1在逆境响应基因表达和植物生长发育中的调控作用。植物杂志。2012;158(4):1955。gydF4y2Ba
- 21.gydF4y2Ba
索托-布尔戈斯,巴沙姆特区。在拟南芥中,SnRK1通过TOR信号通路激活自噬。《公共科学图书馆•综合》。2017;12 (8):e0182591。gydF4y2Ba
- 22.gydF4y2Ba
Coello P,嘿SJ, Halford NG。蔗糖非发酵相关蛋白激酶(SnRK)家族:通过调控提高耐受性和产量的潜力。中国生物医学工程学报。2010;32(3):883-93。gydF4y2Ba
- 23.gydF4y2Ba
梁松,卢凯,吴忠,姜绍春,余永涛,毕超,辛强,王小芳,张德平。拟南芥中镁螯合酶H亚基与蔗糖非发酵1 (SNF1)相关蛋白激酶SnRK2.6/OST1之间的联系J Exp Bot. 2015;66(20): 6355-69。gydF4y2Ba
- 24。gydF4y2Ba
陈玲,任芳,周玲,王庆庆,钟辉,李晓波。甘蓝型油菜钙调磷酸酶b样1/ cbl相互作用蛋白激酶6 (CBL1/CIPK6)参与植物对非生物胁迫的响应和ABA信号转导。中国生物医学工程学报。2012;63(17):6211-22。gydF4y2Ba
- 25。gydF4y2Ba
郭勇,朱建坤。蛋白激酶SOS2的一个新结构域介导了与蛋白磷酸酶2C ABI2的相互作用。中国科学院院刊。2003;100(20):11771。gydF4y2Ba
- 26。gydF4y2Ba
Rodrigues A, Adamo M, Crozet P, Margalha L, Confraria A, Martinho C, Elias A, Rabissi A, Lumbreras V, González-Guzmán M,等。ab1和PP2CA磷酸酶是拟南芥snf1相关蛋白激酶1信号转导的负调控因子。植物细胞。2013;25(10):3871。gydF4y2Ba
- 27。gydF4y2Ba
于勇,傅军,徐勇,张军,任飞,田胜,郭伟,涂旭,赵军,等。基因组重测序揭示了桃果可食性的进化史。Nat Commun。2018;9(1):5404。gydF4y2Ba
- 28。gydF4y2Ba
甜菜碱和脯氨酸在植物抗非生物胁迫中的作用。环境实验机器人。2007;59(2):206-16。gydF4y2Ba
- 29.gydF4y2Ba
杨勇,唐宁,宪志,李志明。两个SnRK2蛋白激酶基因在番茄渗透胁迫反应中的负调控作用。植物学报。2015;122(2):421-34。gydF4y2Ba
- 30gydF4y2Ba
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。gydF4y2Ba
- 31gydF4y2Ba
Varet H, Brillet-Guéguen L, Coppée J-Y, Dillies M-A。SARTools:一个基于DESeq2和edger的R管道,用于RNA-Seq数据的综合差异分析。《公共科学图书馆•综合》。2016;11 (6):e0157022。gydF4y2Ba
- 32.gydF4y2Ba
acta opecologica sinica, 2010, 31 (4): 454 - 454 . acta opecologica sinica, 2010, 31(4): 454 - 454。Biotechnol放置2014;32(1):40-52。gydF4y2Ba
- 33.gydF4y2Ba
王鹏,薛林,Batelli G,李胜,侯永杰,Van Oosten MJ,张浩,陶华,朱建坤。定量磷蛋白组学鉴定了SnRK2蛋白激酶底物,揭示了脱落酸作用的效应物。中国科学院院刊。2013;110(27):11205。gydF4y2Ba
- 34.gydF4y2Ba
李锐,张建军,魏军,王华,王勇,马锐。CBL-CIPK信号系统在植物非生物胁迫响应中的作用及机制。科学通报。2009;19(6):667-76。gydF4y2Ba
- 35.gydF4y2Ba
Im JH, Cho Y-H, Kim G-D, Kang G-H, Hong J-W, Yoo S-D。能量传感器snf1相关蛋白激酶1对拟南芥缺氧适应和盐胁迫耐受性的反向调节植物学报。2014;37(10):2303-12。gydF4y2Ba
- 36.gydF4y2Ba
黄华华,王春华,黄华伟,江春平,池世芳,黄福昌,严贺。McSnRK1 (snf1相关蛋白激酶1)在转基因盐生植物晶体间胚芽细胞和根中调节Na/K稳态的功能分析植物学报2019;38(8):915-26。gydF4y2Ba
- 37.gydF4y2Ba
SNF1/AMPK/SnRK1激酶,能量控制核心的全球调节因子?植物科学进展。2007;12(1):20-8。gydF4y2Ba
- 38.gydF4y2Ba
陈志强,陈志强。活性氧在植物非生物胁迫反应中的调控作用。植物学报。2015;6:1092。gydF4y2Ba
- 39.gydF4y2Ba
Miller GAD, Suzuki N, Ciftci-Yilmaz S, Mittler RON。干旱和盐度胁迫下活性氧的稳态和信号传递。植物学报。2010;33(4):453-67。gydF4y2Ba
- 40.gydF4y2Ba
李志刚,李志刚,李志刚。植物活性氧基因网络的研究进展。植物科学进展。2004;9(10):490-8。gydF4y2Ba
- 41.gydF4y2Ba
Bedard K, Krause K- h。ros生成NADPH氧化酶的NOX家族:生理学和病理生理学。杂志启;2007 87(1):245 - 313。gydF4y2Ba
- 42.gydF4y2Ba
Szymańskapk,波尔卡尔卡 - Kowalczyk L,Lichocka M,Maszkowska J,Dobrowolska G.SnF1相关蛋白激酶SNRK2.4和SNRK2.10调节植物宿主对盐胁迫的植物反应。int j mol sci。2019; 20(1):143。gydF4y2Ba
- 43.gydF4y2Ba
赵国峰,秦鹏。外源多胺对大麦幼苗根系液泡膜功能的保护作用。植物生长规律。2004;42(2):97-103。gydF4y2Ba
- 44.gydF4y2Ba
刘家,朱杰克。α盐 - 过敏突变体中的脯氨酸积聚和盐应激诱导的基因表达。植物理性。1997年; 114(2):591。gydF4y2Ba
- 45.gydF4y2Ba
Yoshida T, Fujita Y, Maruyama K, Mogami J, Todaka D, Shinozaki K, Yamaguchi-Shinozaki K.四种拟南芥AREB/ABF转录因子主要作用于SnRK2激酶下游的基因表达,以响应渗透胁迫。植物学报。2015;38(1):35-49。gydF4y2Ba
- 46.gydF4y2Ba
王鹏,朱建坤,郎铮。一氧化氮通过SnRK2蛋白的s -亚硝基化抑制脱落酸对种子萌发的抑制作用。植物信号学报。2015;10(6):e1031939。gydF4y2Ba
- 47.gydF4y2Ba
闫舒,董欣。水杨酸对植物免疫信号的感知。植物学报。2014;20:64-8。gydF4y2Ba
- 48.gydF4y2Ba
SnRK1 (SnRK1 -related kinase 1)在拟南芥(Arabidopsis thaliana)的糖和ABA信号转导中起着重要作用。植物j . 2009; 59(2): 316 - 28。gydF4y2Ba
- 49。gydF4y2Ba
戴东,童华,程丽丽,彭飞,张涛,齐伟,宋锐。玉米Dek33基因在核黄素合成中的表达及其对籽粒油体形成和ABA合成的影响。acta botanica sinica(云南植物研究),2019;70(19):5173-87。gydF4y2Ba
- 50gydF4y2Ba
抑制蔗糖非发酵-1相关蛋白激酶基因在豌豆胚中的表达会导致类似于脱落酸不敏感表型的成熟多性缺陷。植物杂志。2006;140(1):263 - 78。gydF4y2Ba
- 51gydF4y2Ba
Coello P, Hirano E, Hey SJ, Muttucumaru N, Martinez-Barajas E, Parry MA, Halford NG。有证据表明脱落酸促进小麦snf1相关蛋白激酶(SnRK) 1的降解和假定的钙依赖SnRK2的激活。中国生物医学工程学报。2012;63(2):913-24。gydF4y2Ba
- 52gydF4y2Ba
NAC转录因子:结构上不同,功能上不同。植物科学进展,2005;10(2):79-87。gydF4y2Ba
- 53gydF4y2Ba
NAC转录因子家族基因ANAC036的过度表达导致拟南芥矮化表型。植物生理学杂志。2010;167(7):571-7。gydF4y2Ba
- 54gydF4y2Ba
关键词:水稻,NAC转录因子,ONAC022,抗旱性,耐盐性植物学报2016;7:4。gydF4y2Ba
- 55gydF4y2Ba
Wu A、Allu AD、Garapati P、Siddiqui H、Dortay H、Zanor M-I、Asensi Fabado MA、Munné-Bosch S、Antonio C、Tohge T等。活性氧物种响应NAC转录因子JUNGBRUNNEN1调节拟南芥的寿命。植物细胞。2012;24(2):482。gydF4y2Ba
- 56.gydF4y2Ba
易卜拉欣·莫特拉赫S、核糖PA、蒂鲁马莱库马尔VP、阿卢阿德、陈RL、穆勒·罗贝尔B、巴拉扎德·S.荣布伦南1赋予HD Zip I转录因子AtHB13下游的耐旱性。前沿植物科学。2017;8:2118。gydF4y2Ba
- 57.gydF4y2Ba
孟X,王j-r,王g-d,梁x-q,李x-d,孟q-w。R2R3-MYB基因,LEX2,正常调节转基因番茄中的热耐受性。J植物理性。2015; 175:1-8。gydF4y2Ba
- 58.gydF4y2Ba
JEF RBH, Hoffmann NL, Wallroth M, Eichholtz D, Rogers SG, Fraley RT.一种简单而通用的基因转移方法。科学。1985;227(4691):1229。gydF4y2Ba
- 59.gydF4y2Ba
张勇,Primavesi LF, Jhurreea D, Andralojc PJ, Mitchell RA, Powers SJ, Schluepmann H, Delatte T, Wingler A, Paul MJ。通过海藻糖-6-磷酸盐抑制snf1相关蛋白激酶1活性和调节代谢途径。植物杂志。2009;149(4):1860 - 71。gydF4y2Ba
- 60.gydF4y2Ba
Bates LS, Waldren RP, Teare ID。水分胁迫研究中游离脯氨酸的快速测定。土壤植物。1973;39(1):205 - 7。gydF4y2Ba
- 61.gydF4y2Ba
马楠楠,左永强,梁晓青,尹波,王国栋,孟Q-W。多重逆境响应转录因子SlNAC1提高了番茄的耐冷性。杂志。2013;(4)149:474 - 86。gydF4y2Ba
- 62.gydF4y2Ba
胡德刚,马庆军,孙春华,孙明辉,尤春霞,郝永杰。CIPK蛋白激酶MdSOS2L1的过表达增加了抗氧化代谢产物,增强了苹果和番茄的耐盐性。杂志。2016;156(2):201 - 14所示。gydF4y2Ba
- 63.gydF4y2Ba
王永春,曲国珍,李海英,吴永军,王超,刘发发,杨长平。转锰超氧化物歧化酶杨树抗盐性的研究。acta photonica sinica; 2009;37(2):1119。gydF4y2Ba
- 64.gydF4y2Ba
Aebi h .过氧化氢酶。见:伯格梅尔·胡,编辑。《酶学分析方法》第二版。纽约:学术出版社;1974.p . 673 - 84。gydF4y2Ba
- 65.gydF4y2Ba
Pütter J.过氧化物酶。新闻:胡伯格迈尔,编辑。酶分析方法。第二版,纽约:学术出版社;1974P685–90.gydF4y2Ba
- 66.gydF4y2Ba
王毅,姜杰,赵X,刘庚,杨聪,詹丽。柽柳LEA基因在转基因烟草中的抗旱性研究。植物科学。2006;171(6):655–62.gydF4y2Ba
- 67.gydF4y2Ba
Jacyn Baker C, Mock NM。用伊文思蓝测定细胞悬液和叶盘中细胞死亡的改进方法。植物细胞组织器官培养。1994;39(1):7-12。gydF4y2Ba
致谢gydF4y2Ba
感谢国家自然科学基金、国家现代农业技术研究体系基金和山东省“双一流”计划基金的支持。gydF4y2Ba
资金gydF4y2Ba
国家现代农业产业技术研究体系基金项目(No. cars -30-2-02);国家自然科学基金项目(No. 31672099, No. 31801812);山东省“双顶”计划项目(No. SYL2017YSTD10)。关键词:黄土,边坡,边坡稳定性,边坡稳定性,边坡稳定性资助方在本研究的实验设计、结果分析和稿件撰写中均未发挥作用,但对稿件提供了资金支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
FP和YX构思和设计了实验。WRW和JHL进行了实验。GFW、mx和YSX提供了试剂、材料和分析工具。WRW和YSX撰写了这篇文章。所有作者阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商说明gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
相对表达水平gydF4y2BaSnRK1αgydF4y2Ba(原汁原味的未经修剪的凝胶)。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
映射RNA-SEQ读取的统计信息。gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
重复或基因型之间FPKM值的散点图。gydF4y2Ba
附加文件4:表S2。gydF4y2Ba
DEG列表及其在WT和中的表达水平gydF4y2BaPpSnRK1αgydF4y2Ba超表达。gydF4y2Ba
附加文件5:表S3。gydF4y2Ba
KEGG富集分析。gydF4y2Ba
附加文件6:表S4。gydF4y2Ba
富集分析。gydF4y2Ba
附加文件7:图S3。gydF4y2Ba
37个家庭的101个助教gydF4y2BaPpSnRK1α。gydF4y2Ba
附加文件8:表S5。gydF4y2Ba
TFs及其在WT和gydF4y2BaPpSnRK1αgydF4y2Ba超表达。gydF4y2Ba
附加文件9:表S6。gydF4y2Ba
本研究使用的引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
王,或者说是。,Liang, JH., Wang, GF.et al。gydF4y2Ba过度表达gydF4y2BaPpSnRK1αgydF4y2Ba通过调控ABA信号通路和活性氧代谢增强番茄耐盐性。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba128 (2020). https://doi.org/10.1186/s12870-020-02342-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
出版gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02342-2gydF4y2Ba
关键字gydF4y2Ba
- PpSnRK1αgydF4y2Ba
- 活性氧代谢gydF4y2Ba
- ABA信号gydF4y2Ba
- 盐耐受性gydF4y2Ba