摘要
背景
与亚砷酸盐在水稻植株中的吸收和转运相关的基因(例如,OsLsi1那OsLsi2那OsLsi3那OsLsi6和OsABCC1)已被确定为迄今为止。然而,在砷酸盐胁迫条件下,在水稻的整个生长期内随着时间的推移表达仍然很差。在该研究中,研究了与水稻不同器官的砷酸盐运输和砷浓度相关的基因表达的动态,以确定在整个生长期内基因表达调节的砷酸盐吸收和易位的关键时期。
结果
的相对表达OsLsi2和OsLsi1根系中表达量上调,达到最大值(2-ΔΔct= 4.04和1.19),其中根系砷含量最高,为144 mg/kg。苗期至抽穗期(3 ~ 16周)根系砷累积量为45.1 ~ 61.2%,主要与根系砷的高表达有关OsABCC1(1.50-7.68),导致砷位于根的液泡中。随着抽穗至乳熟(16 ~ 20周)时间的延长,根向茎部的砷转运因子逐渐增加,其中74.3%的砷在乳期的茎部积累。笋中砷积累的这种增加可能与以下发现有关:(1)OsABCC1在18-20周内,根系表达被抑制至0.14-0.75;(2)OsLsi3和OsABCC116-20周,I、II、III节表达分别上调至4.01-25.8和1.59-2.36;和(3)OsLsi6和OsABCC1叶子和壳中的表达在18周内显着上调至2.03-5.26。
结论
连接阶段是在根中表达砷酸盐转运基因的关键时期,并且前往乳状成熟阶段是表达芽中砷酸盐转运基因的关键时期,这两者都应考虑在安全期间进行调节砷污染水稻土壤生产。
图形概要

背景
砷(AS)土壤和水中的污染已成为一个严重的环境问题,特别是在南部和东南亚1那2].采矿和工业活动是砷污染环境的主要来源[3.那4.那5.].在中国、印度和韩国的污染地点生产的稻米中砷含量可高达0.77-0.85毫克/公斤[6.那7.].在水稻土中,亚砷酸盐(As(III), H3.aso.3.)是大米占据的主要种类[8.那9.那10.].了解水稻砷(III)吸收和转运的规律和关键时期,对于制定砷污染土壤中水稻安全生产的控制策略具有重要意义。
迄今为止,已经确定的与水稻中As(III)的吸收和运输相关的基因与硅(Si)的吸收和运输相关的基因是相同的,因为亚砷酸盐是硅酸的化学类似物。在水稻根中,As(III)在不经意间被硅酸转运体OsLsi1和OsLsi2摄取并运输[8.那11.那12.].OSLSI1优先分布在尸体带的远侧,被动地将(III)传送到根细胞中;Oslsi2,在堆垛近侧的近侧,在根细胞到Apoplast朝向Xylem积极运输为(iii)[8.那13.那14.].As(III)一旦被运输到根细胞中,要么与植物螯合素(PCs)复合,然后被隔离在液泡中解毒[15.那16.]或通过蒸腾气流通过水稻木质部导管输送到茎和叶[17.].OsABCC1是位于液泡内的c型ABC (atp结合盒)转运体,负责As液泡区隔化[16.].OsABCC1可以在水稻的根、茎、叶和壳中表达,在液泡中隔离As对于减少As向水稻籽粒的分配非常重要[16.].
禾秆植物的节控制矿质元素在枝条不同组织中的分布,包括必需元素和有毒元素[18.那19.].在水稻节点中,三种转运体(即OsLsi6、OsLsi2和OsLsi3)参与了As(III)从节点到穗的维管间运输[20.那21.那22.].OSLSI6,血浆膜局部化Si / As(III)通道主要在血管束的综合症转移细胞(EVB)中表达[23.].OsLsi2和OsLsi3分别定位于evb的束鞘远端和evb与弥漫维管束(dvb)之间的薄壁细胞[22.].作为(iii)在EVBS的XYLEM中,可以通过OSLSI6选择性地卸载,然后通过OSLSI2和OSLSI3重新加载到DVB的木耳,从而优先于通过木质血管分布到圆锥花序[22.那23.].此外,在叶片和节中存在OsLsi6,负责As(III)从木质部运输到叶片和节的组织中[8.].
一些研究探讨了As(III)在水稻植株中的吸收和运输[19.那22.那24.[大多数主要集中在水稻生长的幼苗或成熟阶段[25.那26.那27].例如,在幼苗阶段进行了在幼苗期间进行以鉴定水稻(例如,OSLSI1和OSLSI2)中的许多实验[25.那26.那27].籽粒灌浆期砷主要进入颖果[28],这被认为是采取措施减少稻米摄取的关键阶段[29].然而,As(III)在水稻整个生育期都可以被水稻吸收,As(III)在水稻不同器官和/或组织中的运输是由各种转运体介导的,如上所述。这些转运体的基因表达对调节谷粒中As的积累非常重要。然而,我们对整个生长期As(III)摄取和运输的基因表达动态仍有认识上的差距。因此,本研究旨在研究As(III)相关转运体基因在水稻全生育期的表达动态以及As(III)在水稻不同器官的吸收积累特征。研究结果可为进一步了解砷在水稻不同部位基因表达调控的砷吸收和转运提供依据,为砷污染水稻土壤中砷的缓解策略提供指导。
结果
研究了水稻全生育期砷的分布规律
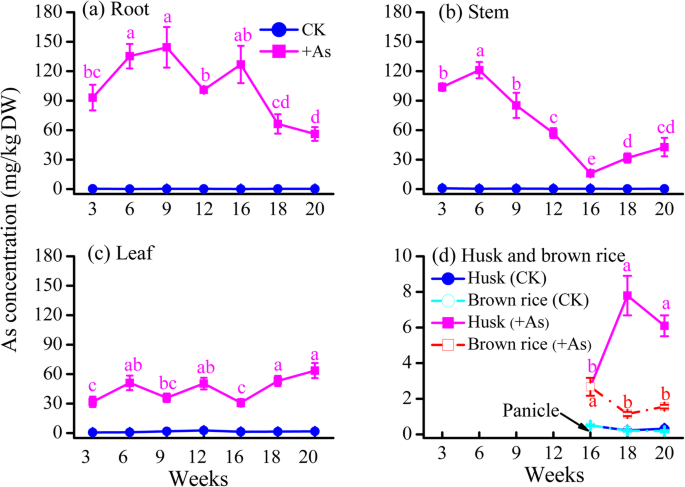
在+As处理下,水稻各器官中总As浓度依次为:根>茎≥叶>壳>(图2)。1).根系As浓度从幼苗到拔节期(3-9周)随时间增加,拔节期(9周)根系As浓度最高,为144 mg/kg。1a).抽穗至乳期(16-20周),根As浓度由126 mg/kg降低至56.1 mg/kg,茎和叶As浓度分别由16.1 mg/kg增加至42.7 mg/kg和30.9 mg/kg增加至63.6 mg/kg(图4)。1a-1c)。同时,抽穗期至乳期谷壳中As浓度高于糙米(图2)。1d).图S的结果1结果表明,+As处理的根、茎、叶和籽粒的大部分生物量与CK处理相似,但在第12周时根和叶生物量有所下降(P.< 0.05), 20周时产量下降(P. < 0.05).
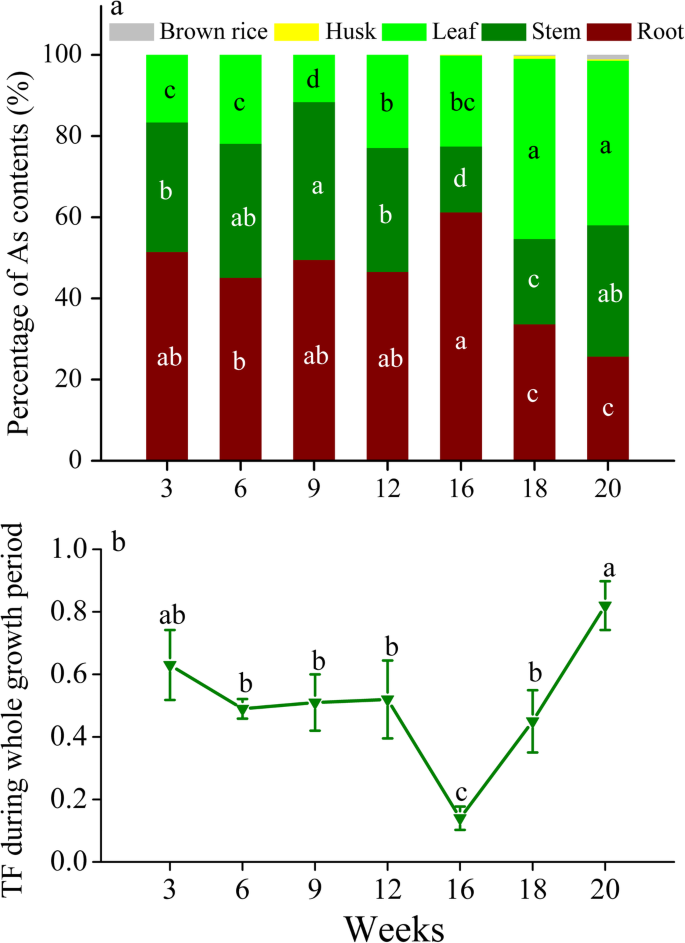
+As处理中,抽穗期(16周)根系总As含量最高,为938 μg,乳期茎叶总As含量最高,分别为889 μg和1116 μg(图S)2一种)。在幼苗到前期阶段(3-16周),米在根中累积的米累积的45.1-61.2%,而在开花到牛奶中患有66.4-74.3%的枝条(特别是叶子中的40.6-44.4%)阶段(图。2),易位因子(TF)保持稳定在一个范围0.49 - -0.63在孕穗期前(12周),然后下降到最小值为0.14的抽穗期(16周),然后随时间线性增加到最大值为0.82在乳熟期(20周)(图。2b).上述结果表明,在水稻整个生育期,苗期至抽穗期是根系吸收和积累砷的时期,抽穗至乳期是根系向地上部运输砷的时期。
亚砷酸盐相关基因在根中的表达
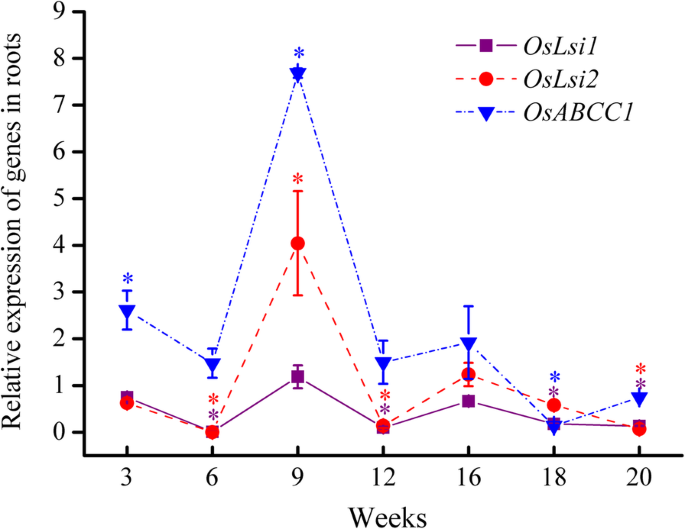
图2中的结果。3.表明,OsLsi1和OsLsi2在+作为治疗的整个生长期期间,基因组成型在根系中,这与先前报道的结果一致[14.那26.].在这项研究中,它们的相对表达随时间而变化。而相对的表达OsLsi1和OsLsi2基因在6周和12周显著抑制至< 0.13 (P.< 0.05),它们的表达在9周时被解除抑制或提升至1.19和4.04,在16周时分别为0.67和1.23,随后在16周后逐渐下降。
的相对表达OsABCC1根系中的基因显然促进(幼苗期间≥1.48阶段,在标题阶段后抑制在0.75以下的最大值7.68。这些结果表明,这些结果表明,作为追消在亚砷酸盐吸收和积聚的植物(幼苗到航线)期间,根部的液泡是活跃的。此外,相对表达OsABCC1与的值线性正相关OsLsi1和OsLsi2(图S3.),说明根系吸收As(III)越多,根系液泡中积累的As(III)越多。
砷酸盐相关基因在枝条中的表达
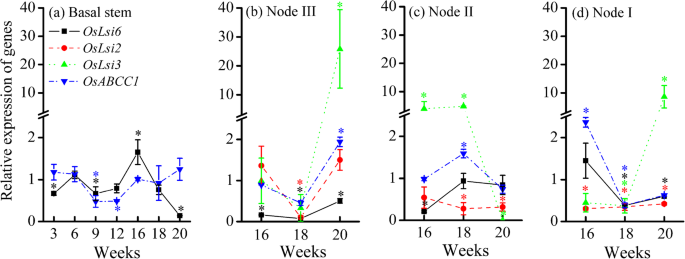
在基部茎中,的相对表达OsABCC1在整个生长期均保持在0.48-1.25范围内,而OsLsi6从苗期的0.66增加到抽穗期的最高值1.65,然后显著降低至0.14 (P. < 0.05) at the milk stage (Fig.4.基因表达的这种抑制OsLsi6在基底茎20周内可能导致更累积在未经元茎中的累积,并且更多地运输到底部叶子,通过木质血管连接到基底杆中的未胶结节点。
在节点III、II、I中,相对表达OsLsi3和OsABCC116-20周分别上调至4.01-25.8和1.59-2.36,而OsLsi6相对表达量< 1.0OsLsi2仅在淋巴结III提升至1.36-1.50(图3)。4.罪犯)。另一方面,表达水平OsABCC1那OsLsi6那OsLsi3,OsLsi2有时也抑制(<1.0),特别是在18周的节点III和I(图。4.b、d).抑制基因表达OsLsi6那OsLsi3,OsLsi2在节点I 18周时,可以保留更多的As积累在节点I或将其运输到第一叶顶部,而在节点中促进其基因表达可能导致更多As运输到籽粒。
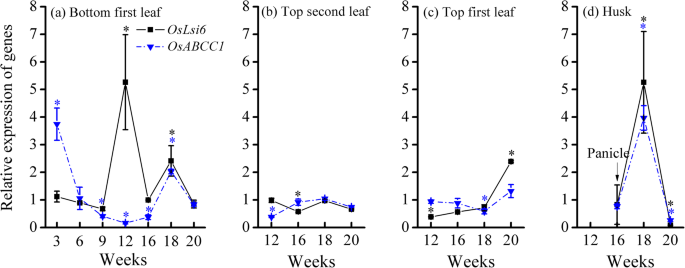
对于底部第一片叶子,基因表达显著上调(P.< 0.05)OsLsi612周和18周的基因OsABCC1第3周和第18周的基因(图。5.一种)。对于顶部叶子,相对表达OsLsi6和OsABCC1仅观察到20周的顶部第一叶中的上调,而剩余部分保持在0.38-1.0的范围内12-20周(图。5.b和c).在壳中,的相对表达OsLsi6和OsABCC1分别在18周时显著提高至5.26和3.97 (P.< 0.05),然后在20周时抑制至< 0.54(图。5.d).因此,基因表达OsLsi6和OsABCC1从孕穗期到乳期,旗叶(即上部的第一叶和第二叶)主要上调,而旗叶(即上部的第一叶和第二叶)不上调。
因为亚砷酸盐在被隔离在液泡中解毒之前通常与pc结合在一起[16.],而PCs的生物合成则由植物螯合酶(如PCS1)催化[30.,表示OSPCS1.并对水稻不同器官的基因进行了定量分析。如图S所示4.-6., 这OSPCS1.和OsABCC1基因体组成型在根,节点和+作为治疗中的壳体中表达,这证实了真空封存的真空封存与PCS的络合强烈相关。
讨论
一般来说,水稻的整个生育期包括育苗、分蘖期、拔节期、孕穗期、抽穗期、开花期和乳期七个生育期,这些生育期又可分为营养生长期和生殖生长期[29].难以识别从营养生长转变为生殖生长阶段的时间(即,穗分化的引发),并且通常认为营养生长和生殖生长阶段都被认为在接合到标题阶段期间同时进行[29那31].但本研究考虑的营养生长期为秧苗至拔节期(3-9周),生殖生长期为孕穗期至乳期(12-20周)。
营养生长阶段关键基因的表达
营养生长阶段是形成水稻根系的重要时期[29],是第一个吸收亚砷酸盐并对稻米中积累的亚砷酸盐的毒性作用作出反应的器官[32].在本研究营养生长阶段,很明显,根中的As浓度高于茎和叶中的As浓度(图。1),大多数人在根中累积,总作为内容占45.1-51.4%(图。2a).在这个阶段,我们观察到的基因表达的抑制OsLsi1和OsLsi2在分蘖期的根中(图。3.),这与现场实验的先前结果一致[26.那33].这种抑制可能是由于水稻对有毒As [34],这可能是该阶段根系中As含量百分比下降的原因之一(图。2一种)。随后,违反OsLsi1和促进OsLsi2拔节期在根中的表达(图。3.)归因于水稻生长对硅的需求和/或因为转运体OsLsi1和OsLsi2被降解,需要回收[26.那33].这样的推广OsLsi1和OsLsi2表达可导致根对亚砷酸盐的吸收增加(图。1和S2一种)。
一旦砷酸盐由根溶出,就像转运蛋白一样的真空封存奥巴西比卡可以限制砷酸盐的迁移率并控制砷酸盐转移到植物中的其他器官[16.那35].OsABCC1在幼苗阶段,底部第一叶中的表达最高(图。5.a),这可能导致如底叶的泡沫中的优先积累。在联合阶段,特别是,OsABCC1在根中表达量最高(图2)。3.),虽然在基底茎和底部第一叶中抑制了这种表达(图。4.和5.一种)。这样的差异OsABCC1根与茎之间的表达不仅导致了根中As浓度的增加,也导致了茎中As浓度的降低(图2)。1).从幼苗到分蘖/连接阶段的TF值的降低(图。2b)证实虽然根、茎、叶中总As含量随着生物量的增加而逐渐增加(图S)1和S2),营养生长阶段从根向枝转移的As较少。结果,晋级了OsABCC1在营养生长阶段,根的表达是维持根内高砷积累和抑制根向地上部转移的关键调控因素。
在营养阶段,植物的表达模式OsLsi1那OsLsi2和OsABCC1在本研究中的根系中与以前的研究中的研究不同[16.那26.那33],这可能是由于本研究的营养液中不含硅,而田间试验的水稻土中含有硅。虽然在本研究中这些转运体主要负责As(III)的吸收,但Si的存在可能优于As(III),因为Si和As(III)在水稻吸收中使用的转运体与之前的研究相同。地上部高Si积累可通过下调表达降低As的吸收和积累OsLsi1和OsLsi2在根[36].硅肥已被证明会阻碍OsLsi1和OsLsi2根中的表达[26.那33],适用于拔节期砷污染水稻土中的水稻植株。
繁殖生长阶段的关键基因表达
在生殖生长阶段,大部分在稻米中累积在靴子和标题阶段的根部,而从根部运输到射击前往牛奶阶段的射击更多(图。2).水稻植株中As积累的这种易位可能是根和茎中不同基因表达的联合调控的结果。
在词根中,的相对表达OsABCC1在孕穗期和抽穗期仍在1.0以上,抑制OsLsi1和OsLsi2孕穗期的表达量在抽穗期释放(图1)。3.),均有利于根中砷的积累,抽穗期根中砷积累总量的61.2%(图2)。2a).同时,表达OsLsi6在基础茎中在标题阶段促进(图。4.a),促进As易位到通过转运维管束(TVB)连接到节点的上部节点和叶片。表达OsLsi1那OsLsi2和OsABCC1抽穗期后,根系中叶绿素含量开始受到抑制,并随着时间的推移逐渐减少。3.).根吸收或在根液泡中积累的As较少,转移到枝条的As较多。从抽穗期到泌乳期,TF值显著增加,证实了这一结果。2b)。
当砷转移到上茎时,节点对控制水稻植株中砷的分布至关重要[18.那19.那23.].在节点III中,表达OsABCC1显著高于节II和节I,特别是在乳期(图2)。4.b-d),这可能导致As在节点III优先积累。节点III的As浓度高于节点II和节点I (P.> 0.05)(图S7.).另外,表达了OsABCC1在花期和抽穗期,节点II和I中的As含量分别增加,说明在节点的液泡中积累了更多的As。我们的结果证实,节点中的As浓度远高于茎中的浓度(图S)7.和无花果。1b)。
在节点I中,EVB和DVB分别连接到顶部第一叶片和穗;因此,EVB和DVB之间的元件传递决定了顶部第一叶和晶粒之间的相对分布。表达OsLsi6那OsLsi2和OsLsi3在花期同时受到抑制,这可能是由于As毒性对节i组织的自我保护所致。由于As通过木质部途径分配到穗需要这三个转运体的合作[22.那23.],同时抑制节点I,会减少从节点I向穗部转移的As量,增加开花期向顶部第一叶转移的As量。
与其他器官相比,水稻叶片在开花期和乳期砷含量和含量百分比最高(图2)。1和2a).这一结果表明,As通过木质部导管的蒸腾流向叶片的运输在As在叶片中的积累中仍然起重要作用。另一方面,叶片中的OsLsi6负责将底物(包括亚砷酸盐)从木质部卸载到叶片组织中[8.那21.].刺激的表达OsLsi6和OsABCC1在第一片叶子的底部和顶部的基因表明,叶片在组织和液泡中具有较高的积累As的能力(图。5.a和c)。
在壳中,的相对表达OsLsi6和OsABCC1在开花期同时被促进(图。5.).瞬态增强OsLsi6在谷壳中的表达可能增加亚砷酸盐通过木质部途径进入谷壳的运输。同时,推广OsABCC1表达增加了谷壳中As的液泡分离。因此,upregulationOsLsi6和OsABCC1开花期的表达会导致谷壳中As的积累增加,糙米中As的分配减少。综上所述,生殖生长阶段根、节、叶、壳中不同基因的表达表明,水稻植株已经发展出多种途径来调节As在植株中的运输和积累,最终降低As在糙米中的分布。
在生殖阶段,水稻不同器官的基因表达调控较为复杂。一方面,节点和叶片上调了表达OsLsi6和OsABCC1并积累了水稻吸收的大部分As。这可能是水稻对砷胁迫的自我调节。乳汁期是As在穗部分布的关键时期。的差别,因此对这些OsLsi6那OsLsi2和OsLsi3节点中的基因表达及上调OsLsi6和OsABCC1壳体中的基因表达是必要的,以减少从节点到圆锥片的运输,并随着壳体中的积累而增加。
结论
结果表明,在亚砷酸盐胁迫下,拔节期是根中亚砷酸盐转运基因表达的关键时期,抽穗至乳熟期是枝条中亚砷酸盐转运基因表达的关键时期。拔节期根系砷的高积累主要与根系砷的高表达有关OsLsi2那OsLsi1和OsABCC1基因。抽穗至乳期枝条中砷积累量的显著增加与叶片中砷的表达上调有关OsLsi3/OsLsi6和OsABCC1在节/叶和壳中表达以及抑制OsABCC1表达的根源。这些发现为在砷污染水稻土安全生产过程中采取调控措施控制砷在水稻植株中的吸收和运输提供了有用的信息。值得注意的是,本研究中一个水稻基因型的研究结果可能不适用于其他水稻基因型;因此,还需要进一步研究以确定亚砷酸盐吸收和转运基因在水稻生产中广泛应用的其他水稻品种中的表达模式。
方法
植物材料及生长实验
大米(简历。栽培稻品种优优128个,一三线籼稻杂交水稻品种,可积累高的水稻颗粒,[37那38].米种子购自广东农业学院蔬菜研究院。在75%乙醇中灭菌和30%H后2O.2,用去离子水彻底冲洗4小时,然后放在一张潮湿的滤纸上,置于25°C的黑暗中。秧苗发芽后,移栽到一个2 L的塑料罐中,其中含有一半强度的Kimura B溶液作为营养液,并设置为整个生长期的开始(0周)。1周后,NaAsO2在+As处理的营养液中添加最终浓度为5 μM的As,以不含As(III)的CK处理作为对照。每个处理设置3个独立的生物重复,其中6株生长在同一塑料盆内的水稻作为一个重复。幼苗在22-28℃,相对湿度70%的人工温室中生长,光周期为10:14 h(光/暗)。在孕穗期和抽穗期(12-16周),温度逐渐升高至32℃,光周期逐渐变为12:12 h。
营养液的组成为:0.18 mM (NH4.)2所以4.,0.27 mm mgso4., 0.09 mM KNO3., 0.09 mM KH2宝4., 0.18 mM Ca3.)2, 0.045 mM K2所以4., 20 μM NaFe-EDTA, 6.7 μM MnSO4., 0.15 μM ZnSO4., 0.16 μM CuSO4., 9.4 μm h3.博3.,0.10μmna2MoO4.和0.10 μM CoSO4.。用1.0M KOH或1M HCl将水培营养液的pH调节至5.6,在整个生长期期间每3d营养溶液每3℃重新调整营养溶液。营养溶液是无Si浓度低于0.013mm的Si浓度的Si浓度,以最大限度地减少硅酸对砷酸的竞争吸收影响通过根部[8.那33].本研究采用水培法是因为水培法更适合监测植物的生理功能(如植物对营养物质的吸收和转运),而盆栽或田间试验对环境更敏感[39那40].
样品采集和制备
收集的水稻在整个生长期间七个阶段:(i)苗期(移植后3周,3周),(2)分蘖期(6周),(3)拔节期(9周)(iv)孕穗期(12周),(v)抽穗期(16周),(vi)开花阶段(18周)和(七)牛奶阶段(20周)。在每个阶段,收获的植株用蒸馏水洗涤,分成根和芽,芽又分为茎(包括叶鞘)、叶、圆锥和谷粒(即稻壳和糙米)。根、茎、叶、穗、壳、糙米在60℃烘干72 h,磨粉后进行As分析。对于基因表达的分析,包括根、基部茎、节(即节III、节II和节I)、叶(即下第一叶、上第二叶和上第一叶)、圆锥花序和壳(图S)8.)被冷冻并研磨成液氮粉末,然后在RNA提取之前储存在-80℃。
总as和转运因子的测定
大约0.2 g的干燥样品用10ml HNO预消化3.和HClO4.混合物(87:13,v:v)在室温下消化8小时,然后在石墨消化仪上消化(proD48,长沙Zerom仪器仪表有限公司,湖南,中国)[41].然后,用1%HNO稀释消化的溶液3.至50ml后,用0.45 μm滤纸过滤。总As浓度用氢发生原子荧光光谱仪(AFS-933, Titan Instruments Co., Ltd, Beijing, China)测定。采用标准物质(GBW10020,柑桔叶粉样品)和空白进行质量控制。柑桔叶粉中As的回收率为111.8±1.9% (N= 18)。
从根到茎的转位用TF表示,计算公式如下:
其中C拍摄和C根为As在水稻植株上的浓度(mg/kg)和根中的浓度(mg/kg)。
RNA提取与逆转录聚合酶链反应(RT-PCR)
使用Trizol试剂(Invitrogen Corp., CA, USA)从植物样本中提取总RNA。然后,用PrimeScript™RT试剂试剂盒和gDNA擦除器(Takara Bio)去除基因组DNA后,使用oligo dT(18)引物从1 μg总RNA中合成第一链cDNA。Inc .、神奈川、日本)。基因相对转录水平OsLsi1那OsLsi2那OsLsi3那OsLsi6和OsABCC1在不同的地方,大米和肌动蛋白测量(内部控制)(表S1).使用CFX384,在含有2.5μl1:5稀释的cDNA的10μl反应体积,500nm的稀释cDNA,500nm的稀释cDNA,500nM的反应体积中进行实时定量RT-PCR,使用CFX384实时系统(CFX384 Touch,Bio-Rad Laboratories Inc.,CA,USA)。使用以下方案进行实时定量PCR:(94°C / 2分钟)×1;(94°C / 30 s)/(58°C / 30 s)/(72°C / 30 s)×45;(72°C / 5分钟)×1.基因的特异性引物序列OsLsi1那OsLsi2那OsLsi3那OsLsi6那OsABCC1和肌动蛋白如表S2。靶基因表达是基于的标准化肌动蛋白在CK治疗中由2-ΔΔct方法如下[42]:
C(t,靶基因)和C(t,内控基因)目标基因和阈值周期是多少肌动蛋白分别放大。ΔC(t +,)和Δc(t, CK)分别等于+As和CK处理中靶基因和内控基因阈值周期的差异。
统计分析
所有统计分析均采用SPSS 19.0软件(SPSS Inc., IL, USA)。用单因素方差分析各生长阶段间差异的显著性。一个一个示例T.-检验用于检测显著性差异。图表由Origin 8.0 (OriginLab, Mass, USA)创建。
可用性数据和材料
本研究期间产生或分析的所有数据均包含在本发表的文章及其补充信息文件中,或可根据要求从通信作者处获得。
缩写
- 作为(iii):
-
亚砷酸盐
- evbs:
-
扩大维管束
- dvb:
-
弥漫血管束
- 电脑:
-
Phytochelatins.
- rt - pcr:
-
逆转录聚合酶链反应
- TF:
-
易位因子
- TVB:
-
运维管束
参考文献
- 1。
Shakoor MB,Riaz M,Niazi NK,Ali S,Rizwan M,ARIF MS,ARIF M.砷中砷的最新进展。在:Hasanuzzaman M,Fujita M,Nahar K,Biswas J,编辑。非生物胁迫耐受性水稻研究进展。木头出版;2019年。https://doi.org/10.1016/B978-0-12-814332-2.00018-6。
- 2。
周勇,牛玲,刘凯,尹胜,刘伟。中国农业土壤砷的分布格局、累积趋势、影响因素及风险评价。Sci Total Environ. 2018。https://doi.org/10.1016/j.scitotenv.2017.10.232。
- 3.
陈辉,唐智,王鹏,赵福军。中国水稻镉、砷含量及砷形态的地理变异环境Pollut》2018。https://doi.org/10.1016/j.envpol.2018.03.048。
- 4.
何建平,李建军。我国饮用水中砷的研究进展。二聚水分子。2013。https://doi.org/10.1016/j.jhydrol.2013.04.007。
- 5.
施捷,陈某,吴股,朱yg。中国大陆砷的人为循环:1990 - 2010年。环境科技。2017年。https://doi.org/10.1021/cs.est.6b01669。
- 6.
Kwon JC, Nejad ZD, Jung MC.韩国采矿活动污染的水稻土和精米中的砷和重金属。系列2017。https://doi.org/10.1016/j.catena.2016.01.005。
- 7.
Norton GJ, Duan G, Dasgupta T, Islam MR, Lei M, Zhu YG, Deacon CM, Moran AC, Islam S, Zhao FJ, Stroud JL, Mcgrath SP, Feldmann J, Price AH, Meharg AA。水稻中砷积累和形态形成的环境和遗传控制:比较在孟加拉国、中国和印度污染地点种植的一系列常见品种。环境科学技术。2009。https://doi.org/10.1021/es901844q。
- 8.
马建峰,山二宁,Mitani N,徐学勇,苏永华,Mcgrath SP,赵福军。亚砷酸盐在水稻中的转运体及其在水稻籽粒砷积累中的作用。美国国立科学学院学报2008。https://doi.org/10.1073/pnas.0802361105。
- 9.
Sun W, Sierra-Alvarez R, Milner L, Oremland R, Field JA。亚砷酸盐和亚铁氧化与化能化养反硝化作用在缺氧环境中固定砷。环境科学技术。2009。https://doi.org/10.1021/es900978h。
- 10。
吴Z,任h,麦格拉特SP,吴P,赵FJ。研究磷酸盐转运途径对水稻砷积累的贡献。植物理性。2011年。https://doi.org/10.1104/pp.111.178921。
- 11.
Carey Am,Norton Gj,Deacon C,Scheckel Kg,Lombi E,Punshon T,Guerinot Ml,Lanzirotti A,Newville M,Choi Ys,Price Ah,Meharg AA。旗叶对籽粒灌浆紫杉种的韧皮植物。新植物。2011年。https://doi.org/10.1111/j.1469-8137.2011.03789.x.。
- 12.
Schroeder JI, Delhaize E, Frommer W, Guerinot ML, Harrison MJ, Herrera-Estrella L, Horie T, Kochian L, Munns R, Nishizawa NK, Tsay YF, Sanders d。自然》2013。https://doi.org/10.1038/nature11909。
- 13.
马建福,田井,山二,三谷,小西,胜原,石黑浩,村田,矢野。水稻中硅转运体的研究进展。自然》2006。https://doi.org/10.1038/nature04590。
- 14.
马建峰,山二N, Mitani N, Tamai K, Konishi S, Fujiwara T, Katsuhara M, Yano M.水稻中硅的外排转运体。自然》2007。https://doi.org/10.1038/nature05964。
- 15.
Dhankher OP, Rosen BP, McKinney EC, Meagher RB。砷酸还原酶(ACR2)抑制拟南芥幼苗中砷的超积累。美国国家科学学院学报2006。https://doi.org/10.1073/pnas.0509770102。
- 16.
宋文耀,山木T,山木N, Ko D, Jung KH, Fujii-Kashino M, An G, Martinoia E, Lee Y, Ma JF.宋文耀,山木T,山木N, Ko D, Jung KH, Fujii-Kashino M, An G, Martinoia E, Lee Y, Ma JF.水稻ABC转运体OsABCC1可以减少砷在籽粒中的积累。美国国立科学院科学研究所2014。https://doi.org/10.1073/pnas.1414968111。
- 17.
mitani n,ma jf,iwashita t.鉴定米饭中米米的硅形式(栽培稻l .)。植物细胞生理。2005年。https://doi.org/10.1093/pcp/pci018。
- 18.
Chen Y,Moore KL,Miller Aj,McGrath SP,MA JF,Zhao FJ。节点在米砷储存和分布中的作用。J Exp Bot。2015年。https://doi.org/10.1093/jxb/erv164。
- 19.
马建峰,马建峰。节点,禾本科植物中矿物质营养分布的枢纽。趋势植物SCI。2014年。https://doi.org/10.1016/j.tplants.014.05.007。
- 20.
马建峰,马建峰。水稻节上负责硅在血管间转移的转运体。植物细胞》2009。https://doi.org/10.1105/tpc.109.069831。
- 21。
Yamaji N, Mitatni N, Ma JF。调节水稻芽中硅分布的一种转运体。植物细胞》2008。https://doi.org/10.1105/tpc.108.059311。
- 22。
山二N,樱井G,三谷上野N,马剑锋。水稻中三种转运体和不同的维管结构在节间转移中的协调。美国国立科学院科学研究所2015。https://doi.org/10.1073/nas.1508987112。
- 23。
马建峰,马建峰。禾本科植物中矿物元素的节点控制分配。植物学报。2017。https://doi.org/10.1016/j.pbi.2017.05.002。
- 24。
李恩,王继,歌词。植物中的砷吸收和易位。植物细胞生理。2016年。https://doi.org/10.1093/pcp/pcv143.。
- 25.
Mitani N, Yamaji N, Ma JF。水稻硅转运体Lsi1底物特异性的表征。Pflugers Arch - Eur J Physiol. 2008。https://doi.org/10.1007/S00424-007-0408-Y.。
- 26.
马建峰,马建峰。水稻硅外排转运体Lsi2的进一步特性。土壤学报。2011。https://doi.org/10.1080/00380768.2011.565480。
- 27.
赵福杰,Ago Y, Mitani N, Li RY, Su YH, Yamaji N, McGrath SP, Ma JF。水稻水通道蛋白Lsi1在根中亚砷酸盐外流中的作用。2010年新植醇。。https://doi.org/10.1111/j.1469-8137.2010.03192.x。
- 28.
郑美国,蔡思,胡y,太阳gx,威廉姆斯pn,崔hj,赵fj,zhu yg。水稻中浓度砷和时间变异的空间分布。新植物。2011年。https://doi.org/10.1111/j.1469-8137.2010.03456.x。
- 29.
于海英,王旭,李飞,李斌,刘超,王强,雷军。不同生育期铁复合剂对水稻土砷迁移率和生物有效性的影响。环境Pollut》2017。https://doi.org/10.1016/j.envpol.017.01.072。
- 30.
Yamazaki S, Ueda Y, Mukai A, Ochiai K, Matoh T. Rice phytochelatin synthases OsPCS1和OsPCS2对镉和砷的耐受性有不同的贡献。工厂直接。2018。https://doi.org/10.1002/pld3.34。
- 31.
水稻单穗粒数、株高和抽穗期多效性主要数量性状位点Ghd7.1的验证与鉴定栽培稻l .)。植物生态学报。2013。https://doi.org/10.1111/jipb.12070。
- 32.
张飞精,王烨,娄泽,东杰德。重金属应力对两种红树林幼苗叶片和根脂质过氧化的影响(Kandelia candel和工业gymnorrhiza).臭氧层。2007。https://doi.org/10.1016/j.chemosphere.2006.10.007。
- 33。
马建峰,马建峰。水稻硅转运体Lsi1的时空分布与变化。植物杂志。2007。https://doi.org/10.1104/pp.106.093005。
- 34。
Srivastava S, Srivastava AK, Suprasanna P, Souza SF。亚砷酸盐胁迫下芥菜水通道蛋白亚型的实时定量表达及生长响应。2013年Mol Biol众议员。https://doi.org/10.1007/s11033-012-2303-7。
- 35。
郭军,徐伟,马明。巯基螯合金属组装和液泡区隔化增强了转基因植物对镉和砷的耐受性和积累拟南芥thaliana. J危害物质。2012。https://doi.org/10.1016/j.jhazmat.2011.11.008。
- 36。
mitaniueno n,yamaji n,ma jf。芽中的高硅积累是为了降低水稻中Si转运蛋白基因的表达所必需的。植物细胞生理。2016年。https://doi.org/10.1093/pcp/pcw163。
- 37.
水稻对砷的吸收、转运和抗性机制。农业生态系统环境。2018。https://doi.org/10.1016/j.agee.2017.10.017。
- 38.
周辉,曾敏,周旭,廖波辉,彭鹏,胡敏,朱伟,吴永军,邹志军。32个杂交水稻铁斑和植株组织中重金属转运和积累的研究(栽培稻l .)品种。土壤植物。2015。https://doi.org/10.1007/S11104-014-2268-5。
- 39.
黄兰,李米,云S,Sun T,Li C,MA F.铵摄取率响应于PEG诱导的鼠丘氏抗旱胁迫reshd。Environ Exp Bot。2018年。https://doi.org/10.1016/j.envexpbot.2018.04.007。
- 40.
3种水培作物对全氟烷基酸的根系吸收和转运。中国农业科学。2014。https://doi.org/10.1021/jf500674j。
- 41.
王旭,易志,杨华,王强,刘胜。胶州湾菲律宾蛤沉积物中重金属含量的调查。中国环境监测评估。2010。https://doi.org/10.1007/S10661-009-1262-5。
- 42.
Livak KJ,Schmittgen TD。使用实时定量PCR分析相对基因表达数据。方法。2001年。https://doi.org/10.1006/meth.2001.1262。
致谢
不适用。
资金
本作在中国天然科学基金(41877043),广东重点研发项目(2019B110207002),广东自然科学基金(2017A030306010),中国国家重点研发项目(2016YFD08007010)那Guangdong Academy of Sciences’ Projects (2017GDASCX-0404), Local Innovative and Research Teams Project of Guangdong Pearl River Talents Program (2017BT01Z176), and Guangdong Special Support Plan for High-Level Talents (2017TQ04Z511).
作者信息
从属关系
贡献
DP进行了所有实验工程,数据收集,分析,解释和起草手稿和修订。WW和TT进行植物生长,RNA提取和浓度实验的测定。JY,FL,XL和CL促成了实验,数据分析,数据解释,写作和修改手稿的概念和设计。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1
水稻植株不同部位在整个生育期的生物量。图S2。水稻植株不同部位总砷含量在整个生育期的变化。图S3。相关性之间的相对表达OsLsi1和OsABCC1(一)与之间的相对表达OsLsi2和OsABCC1在水稻植物的整个生长期间(b)。图S4。相关的表达OSPCS1.在整个生长期的+中的根部中的基因。图S5。相关的表达OSPCS1.(a)基因茎,(b)节点III,(c)节点II,(c)节点II,(d)+在整个生长期间的含量的节点I。图S6。相关的表达OSPCS1.全生育期+As处理在(a)下第一叶、(b)上第二叶、(c)上第一叶和(d)果皮中表达。图S7。+As处理在乳期的总As浓度。图S8。收获的水稻样品示意图。表S1。实验测定了不同组织中的靶基因。表S2。实验中基因的特异性引物序列。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
潘,D.,yi,J.,Li,F。等等。全年生长期内水稻砷吸收和输送基因表达的动态。BMC植物杂志20.133(2020)。https://doi.org/10.1186/s12870-020-02343-1
收到了:
公认:
发表:
关键字
- 亚砷酸盐
- 吸收和运输
- 基因表达
- 大米
- 整个增长期