抽象的
背景
磷酸盐是实现作物最大产量所必需的一种植物常量养分。根能够从直接的根区域吸收土壤磷素,从而形成养分耗竭区。通过与丛枝菌根真菌(AMF)的共生关系,许多植物能够从这一根营养消耗带以外的地方开采磷酸盐。在此,我们研究了草莓根系构型、AMF关联与低磷耐受性之间的关系。通过168个后代的定位群体,研究了草莓亲本品种‘Redgauntlet’和‘Hapil’根系构型的差异。对每个基因型的低磷酸盐耐受性和AMF关联进行量化,以便评估性状之间的表型和基因型关系。
结果
一种“清除磷酸盐”的根表型,即个体表现出高比例的表面侧根,与跨基因型根系大小的减少有关。通过表征5个根系大小性状的多效QTL网络,发现根系大小性状之间存在遗传相关性。相比之下,平均根直径和根的分布在遗传控制的两种离散方法下。共有18个QTL与植株性状相关,其中4个与坚固性相关,可解释46%的观测变异。对AMF关联与根构型关系的研究发现,较高的根密度与较高的AMF定殖有关。然而,在最佳营养条件下,低磷耐受性与AMF关联倾向之间并无表型或基因型关联。
结论
了解磷酸盐捕获的遗传关系可以通过更好的营养利用效率为草莓品种的繁殖。固体根系与较大的AMF定植相关。然而,与草莓植物中的根系结构性质没有表型或基因批次不型或基因批次。此外,在根系统尺寸和根系结构类型之间观察到权衡,突出了与“磷化扫处理”根系结构相关的能量成本。
背景
磷酸盐是农业中最狭窄的植物Macronurient,估计磷酸盐差的耕地的30-40%受限制[1].增强庄稼的产物,以利用预先存在和补充磷酸盐是一种可用于降低肥料要求的一种策略。通过育种作物,可以通过具有优化的根系结构的作物和增加形成菌根关联的倾向来实现更大的磷酸盐使用效率(扁平)[2].这两种特性都通过提高磷素的吸收来提高外部PUE,从而促进植株产量的提高,而不是通过改善现有磷储备的保存和重新动员来提高内部PUE [3.].
众所周知,根系结构在获取磷素方面发挥着重要作用,因为细根吸收养分的能力更强[4.].更大的侧根分枝和更高的根毛密度与更大的磷酸盐吸收有关[5.那6.那7.].根系分泌有机酸,该有机酸在直接根区域中动力磷酸盐,从而允许磷酸盐摄取并产生营养耗尽区[8.].然而,与丛枝菌根真菌(Arbuscular mycorrhiz真菌,AMF)的共生关系可以使植物通过利用广阔的AMF外根菌丝网络从根营养耗散区以外获取磷酸盐[9.].植物能够使用菌根,在磷酸盐摄取中的植物根毛的作用替代植物根部毛发[10].这种共生关联在营养限制条件下是非常有利的;实际上,大多数较高的陆地植物形成了菌根协会[11].
对草莓品种‘Hapil’的磷素吸收的研究表明,花朵在繁殖发育阶段对磷素的需求较大,而这种需求并不能通过对现有磷素的重新分配来满足。实际上,这种额外的磷酸盐从环境中获得的速度超过了根系的能力[12]导致草莓生产中AMF协会的必要性建议。已发现AMF殖民化在益官中增加了阶级草莓果生产的产量[13].此外,在土壤盆栽试验中,磷酸盐溶解细菌(PSB)已被证明可以提高植物吸收生物有效磷的水平,并导致草莓产量的增加[14].事实上,AMF已被发现在高磷酸盐存在时与PSB协同作用,在低磷酸盐条件下则具有竞争性[15,表明微生物群落对获得最佳磷酸盐的重要性。
已显示AMF共生协会在缺陷条件下伴随着增强的磷酸盐摄取以及在缺陷条件下的多种草莓特征16].AMF已被发现能恢复甚至提高草莓植物在干旱胁迫下的生物量[17,增加营养繁殖[18那19,增加果实产量和数量[20.],提高草莓果实中花青素和酚类物质的产量[21那22].此外,AMF定植诱导草莓根系构型的变化(通过根分枝的增加),这与草莓更强的抗性有关疫霉fragariae[23].草莓品种特异性AMF互作已被报道,这些互作表明控制宿主-菌根联合的遗传成分可能通过育种策略加以利用[23那24那25].
根系结构开始受到更高的关注作为提高作物产量和质量的机制[26].实际上,已经建议生产高营养有效的根系系统成为第二绿色革命的关键[7.].根部可表现出对土壤异质性的模块化塑料反应,其能够增殖和增强仅在营养丰富的区域中的离子吸收[27].相比之下,整个根系可能会随着平均养分水平的变化而变化,从而导致植物间的变异。研究发现,均质低磷降低了主根生长,增加了侧根密度和根长[28].此外,在常见的豆中已经观察到不同的基因型特异性根系策略,其中与与低磷酸盐耐受相关的干旱耐受性和横向浅根相关的深根表型之间进行权衡[29].
通过生理根可塑性增加离子吸收是一种有效的吸收移动离子如硝酸根的有效策略。然而,形态塑性更昂贵,必须用于增强不动离子的摄取,例如磷酸盐[27].实施形态可塑性的成本很高,因此它只能被认为是一种理想的营养采集策略,其中营养贴片的时间和空间部件是丰富和可预测的。据报道,植物以响应低磷酸盐环境而增加横向根生长[28那30.研究发现,根系结构的这种变化增加了从异质性局部斑块和同质富磷表层土壤的磷素吸收[31].很明显,根的形态与植物的磷酸盐捕获潜力直接相关,特别是对于非菌根植物;例如,Arabidopsis Thaliana ARX4.侧根产量较低的突变体捕获磷酸盐离子的竞争能力降低[32].
在本研究中,我们旨在量化控制草莓根系构型、AMF关联和低磷耐性的基因型组成,并建立性状之间的关系。从根本上说,这项工作将为八倍体草莓的磷酸盐获取提供更多的育种资源。
结果
亲代和子代根结构的描述
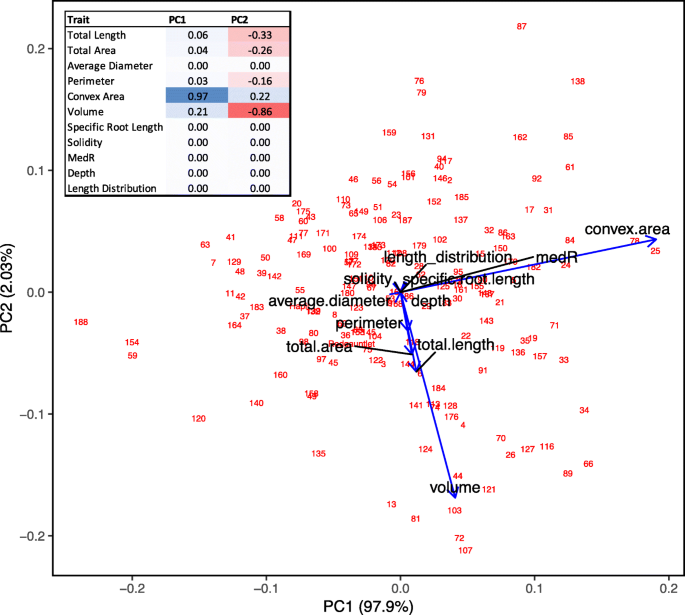
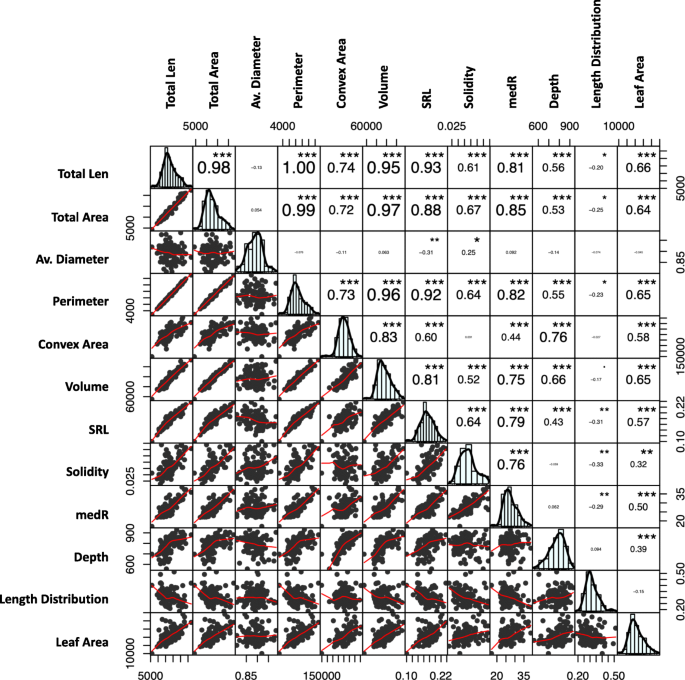
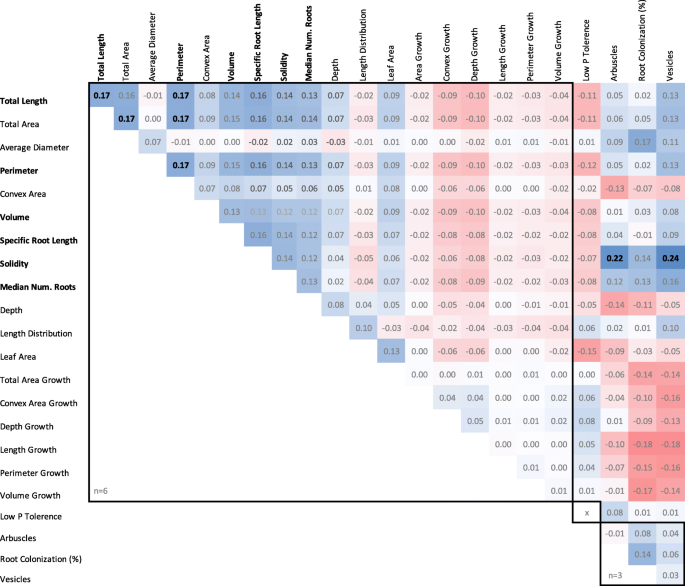
两个祖父草莓品种“Redgauntlet”和'Hapil'在传播时展示了对比的根系结构,当迷人的提示时;'Redgauntlet'根的平均直径小,同时'Hapil'根的平均根直径相对较大(桌子1).此外,如果流道植物固定在rhizotrons中并保持附着在母体植物上,'Redgauntlet'和'Hapil'根在根系结构中表现出更大的对比。'Redgauntlet'具有稀疏和深的根系,而'Hapil'具有密集和浅根系。实际上,所有研究的性状除外,父母根系系统(图)之间具有中位数(MEDR)和长度分布的性状明显不同(图。1, 桌子1).相比之下,映射种群内根结构的变化主要可以由根网络所探索的空间(凸区;无花果。2:PC1和凸区R.= 0.97)。代表植物大小度量的特征是高度肯定的相关性(体积,根区域,叶面积,长度和周长;图。3.).弱阴性,但显着,在多个植物大小度量和长度分布之间观察到相关性(R.−0.20 ~−0.33),表明植物整体大小与更大比例的资源分配到表层根之间存在权衡。
植物QTL架构
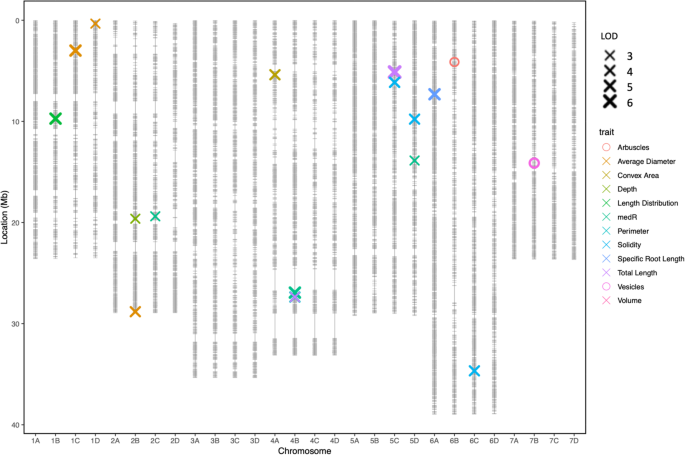
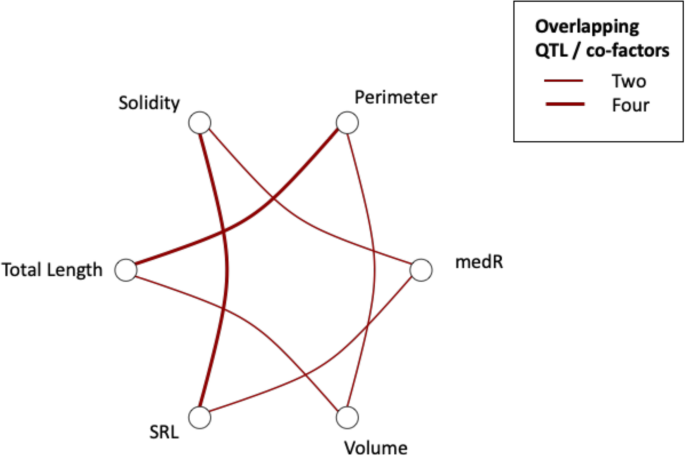
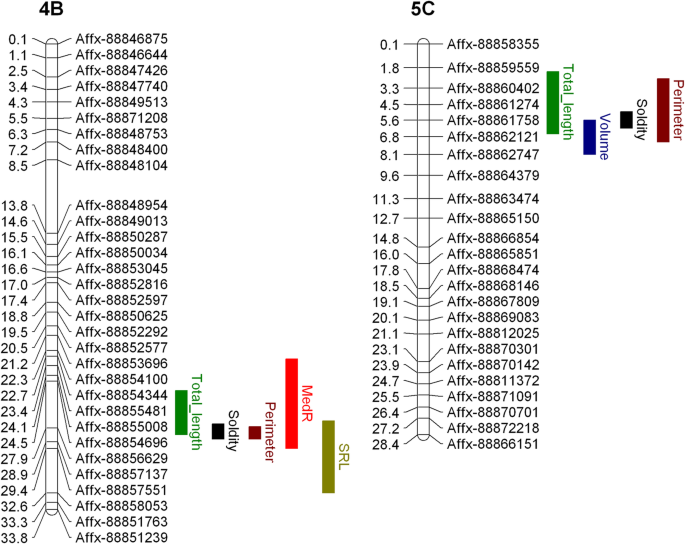
共发现16个QTL与10个植株构型性状相关,见表2和无花果。4..在检测到的QTL中,有4个与一个以上的根性状相关。5.).4个QTL与稳定性有关,当结合在一起时,可以解释46%的观测变异(表)2).染色体4B的同一区域增加了5个根性状;比根长(SRL)、根周长、总根长6.;桌子2).虽然染色体5C上的相同遗传区域,但染色体2C上的MEDR相关的焦平SNP位于10kb的10kb内f . vesca基因模型FVH4_2G24150.1用植物素结合结构域编码蛋白质(IPR000526)。与染色体5D上的MEDR相关的焦XP与通常携带通常与细胞伸长率相关的小型植物引入RNA结构域的相邻基因簇相关(IPR003676)。此外,这是f . vesca基因模型FVH4_1G17760.1染色体1B含有小GTP酶超家族,ARF / SAR型(IPR006689)域。根生长速度的遗传组分小,动力学根部特征显示出非常低的遗传性评分(范围为0至5.59%)。此外,没有发现该特性的实验之间的基因型相关性,并且没有鉴定出相关的QT1。
低磷酸盐耐受QTL
观察到磷酸水平与基因型之间的显着相互作用(X(137)2= 246.2.那P.< 0.0001)表明' Redgauntlet ' x ' Hapil '群体对低磷的耐受性存在变异。低磷耐性是由在最佳低磷条件下生长的基因型的相对生物量决定的.在两次分析中观察到具有低磷酸盐耐受性的稳健QTL。
丛枝菌根真菌关联QTL
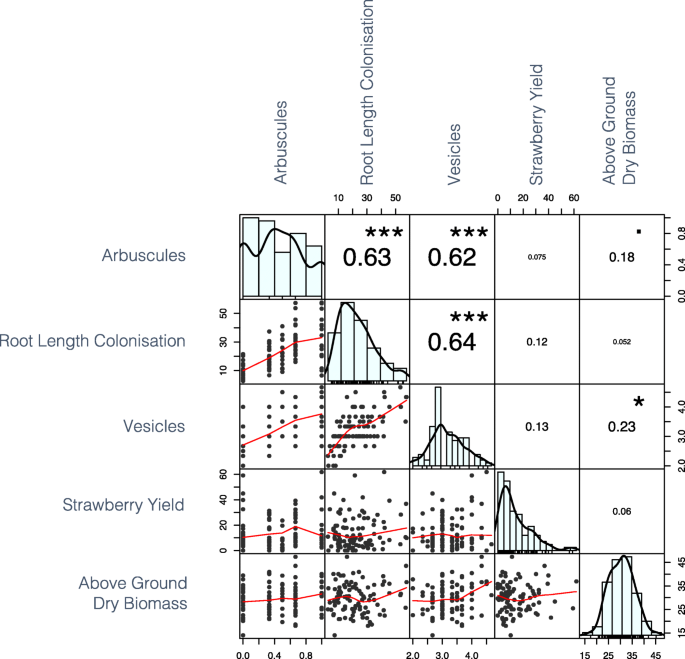
在AMF性状之间观察到强的正表型相关性(图。7.).发现两个强大的QTL与AMF结构相关联。发现单个基因座在染色体6b上控制菌根枝形成,而染色体7b上的轨迹被发现控制菌根囊泡形成。
表型和遗传相关性
几个代表根系大小指标的根系性状可以被分组,因为它们都是表型的(图。3.)和遗传相关(图。8.).这些性状包括总根长、总根面积、周长、体积、固结度、根长和根粗比,表明这些性状可能是由相同的遗传成分控制的。这一结果得到了以下事实的支持:这些性状(除总面积外)都有重叠的QTL(图2)。5.).相反,未发现平均根直径和长度分布与根尺寸的性状有表型或基因分布。在低磷酸盐耐受性和根系结构之间没有发现相关性,也不存在低磷酸盐耐受性和AMF关联(图。8.).有趣的是,根系的坚固性与丛枝和泡囊的形成具有显著的遗传相关性。
讨论
根系大小与长度分布的关系
我们首次表明,在草莓中可以将其描述为“磷酸盐清除”根表型和根系大小之间的权衡。“磷酸盐清除”表型可以通过高根长度分布来定义,从而在豆类中看到的土壤表面上看到了更大比例的水平根部[29].事实上,比较不同植物种类的根系结构趋势的研究发现,来自营养丰富地区的植物幼苗的根系更大[33].同样,已经观察到权衡Senento寻常魅力大根系开采效率高但开采效率低的根系[34].实际上,玉米根系系统可以被称为小巧且紧凑或大且探讨,探索和职业之间的权衡,这是由表型权衡而不是生物量限制而产生的探索和职业之间的权衡[35].由于根直径和根长分布与根系大小性状之间未观察到表型或基因型相关,我们假设这些性状受独特的遗传控制。
根系统和AMF协会
鉴于根系结构和菌根协会之间存在通用链路的荟萃分析研究发现了混合结果。在菌根依赖(AMF的正面影响)和不同植物物种中的总长度之间观察到了负面关系[36].此外,研究AMF改变主机根系系统的程度在植物中发现了具有最高的菌根依赖性的植物的更大的根修改潜力[37].相比之下,跨多种物种的另一项研究发现较粗糙的根系结构不会导致更大的菌根殖民化也不从关联中获得增长效益[38].这里,较高的稳定性与更大的仲裁频率和囊泡AMF结构的频率遗传相关。高稳定性可以通过“浓密的根部生长在一起,彻底探索根网络区域”[39].水稻的类似研究发现根系(固体)的彻底性与根系(凸面区域)的彻底性之间存在负面关系[39],可以说致密的根系系统探索较小的土壤区域,从而使得更多地受益于利用AMF外积网络。然而,在这里不能在这里绘制这样的结论,因为我们在我们的基因型中看到了透明度与凸面区域之间的关系。
AMF殖民化的好处
在低磷酸盐条件下,用菌根定植的草莓植株对干物质和磷酸盐的吸收更大[16].此外,发现AMF对草莓品种'ELSANTA'的应用导致股东司生产的产量大大提高[13].在这里,我们看到了在基因型之间,地上干生物量和AMF泡囊形成之间的正相关(图。7.).可以推测具有较大光合区域的植物具有更大的共生碳的可用性,这可能导致增加的AMF碳储存结构的数量 - 囊泡。这种关系可能表明AMF的益处,而不是植物的益处。不幸的是,在Terra-Green®中生长的“Redgauntlet”X'APIL'基因型中没有观察到草莓产量和AMF协会之间没有积极关系(图。7.表示AMF草莓相互作用复杂,并且任何相关的益处都可以是底物和基因型特异性。使用煅烧的半胱氨酸粘土生长介质Terra-Green®导致磷酸不稳定的吸附,并提高菌根关联的必要性,以获得土壤磷酸盐[40].因此,在当前实验中观察到的AMF关联可能高于其他商业相关的生长介质。
亲本根结构及繁殖方法
当通过“钉扎”小植物而不是雾化的尖端传播,我们发现了更大的分辨率来区分两种父母品种中的差异根系结构。在附着在母植物上,钉在植物中能够建立根系,从而可以获得父母营养素。众所周知,可以响应土壤养分状态改变根系结构[28那41].因此,雾尖繁殖方法可能会由于缺乏亲本营养而导致根系结构的改变。然而,体内低磷酸盐状态并没有触发在低磷酸盐外部环境中观察到的缺磷酸盐形态变化[42].利用不同繁殖策略培育的植物的性能和养分利用效率的研究可能对最佳苗圃繁殖实践具有下游影响。与上述发现相反,在两个实验中,亲本平均根直径的变化是一致的,我们还观察到平均根直径似乎是独立于代表大小的根性状控制的(图。8.).
根系结构的荷尔蒙控制
乙烯和生长素途径已被确定为根分枝、根毛伸长和低磷酸盐检测的关键调控因子[43那44那45].其中两个与medR相关的QTL与植物生长素途径的核心基因共定位f . vesca二倍体草莓。有趣地,染色体1B上的长度分布QT1与含有小GTP酶超家族,ARF / SAR型结构域的基因相关,功能研究Arabipdosis已经显示了这个域名在根发尖初发挥作用[46].
性状的遗传力和遗传相关性
所有调查的性状的遗传性分数低(5-14.5%;桌子2),表明控制评估性状的大环境组分控制变化。仲裁遗传性为0%。低仲裁遗传性是跨越100个横切的低仲裁的人工制品,每个根系统中发现0,1或2个arbuscules。ArbUscules的平均值为QTL评估提供了更大的定量分数。尽管遗传性评分低,但每次解释的18种QTL控制性状的鉴定方法是观察到的表型变异的5.9%和13.4%。根部性状之间的低遗传相关性可以通过根的高度塑性性来解释,这些根源的高度塑性性能可以响应于多重非生物因子而改变,包括营养浓度,水可用性,氧含量,土壤密度和pH [3.].
QTL共同定位
我们观察了一种控制在草莓中的多根尺寸特征的普利生术QTL网络,表明基因组的若干区域对于根系结构很重要。类似的研究已经确定了与稻米和玉米中多种根系结构相关的基因组的区域[35那39].
耐磷性和根系构型
在本研究中观察到低磷酸盐耐受性和长度分布之间的关联。实际上,在最佳磷酸盐条件下观察到的根系结构性质和低耐受性之间没有观察到基因型相关性。然而,已被证明响应于低磷酸盐环境表现出表型可塑性,从而磷酸盐饥饿的植物显示出初级根生长减少,由于磷酸盐代谢和横向分支增加而降低生长速率[30.那47].本实验测定了最佳生长条件下的根构型。因此,在最佳磷酸盐条件下生长时,基因型的根结构很可能既不是介导的,也不是代表的,对低磷酸盐耐受性的任何改善。进一步的研究应该确定Redgauntlet和Hapil的根构型是否在低磷条件下改变,以及特定的低磷根性状是否与增强的耐磷性有关。此外,我们可以确定是否根系可塑性本身与草莓低磷耐受性的增加有关。
结论
理解根系结构的遗传控制可以指导培育策略朝向开发最佳根系系统。在这里,我们描述了一种用于草莓的高吞吐量根表型平台,其允许量化植物变异的“隐藏”下组成部分。我们展示了根系结构的不同组件:根系系统尺寸,长度分布和根直径都是不同的遗传控制机制。在最佳营养条件下生长时,未发现在草莓植物中的根系结构特征存在于批量或基因分型。未来的工作必须表征是否在低磷酸盐条件下的根可塑性与草莓中的磷酸盐采集加剧相关。
方法
根结构量化
植物材料
草莓 (草莓属x ananassa)“Redgauntlet”X'Hapil的映射人口用于研究根系结构,AMF协会和低磷酸盐耐受性。在NIAB EMR产生植物材料,最初是为了研究的F1十字架黄萎病dahliae反抗 [48].为了初步评价亲本根系构型,我们将10株‘Redgauntlet’和‘Hapil’的流道植株固定成根状体。在根系发育过程中,所有植株都附着在母株上。由于评估群体根系结构需要大规模的实验,168个基因型和亲本植物作为喷雾尖端繁殖。从基因型上剪下雾尖,插入含1l泥炭土壤的根孢子中,筛分至5 mm。在每个根管中,每个基因型生长一株。在湿度为80%的条件下饲养1周后,将根孢子随机转移到16:8 h的温室条件下;22:16°C白天:夜晚,60 RH%。每根管2支4 L/h滴管,以16 ml / d(+/−2%)灌洗30 s,每天4次,添加草莓营养饲料;可溶性SF-C (N:P:K, 8:12:35 + 4MgO)。 The experimental layout was a randomised block design with blocks from South to North. The experiment was repeated three times with two replicates per time point.
根除棉建筑
根除杆容器由两张透明的丙烯酸片(24×20×0.4cm;Ploxiglas®),丙烯酸垫片(0.5厘米;丙烯酸在线,英国船体)制成,并将5厘米折叠夹子保持在一起。不透明的乙烯基封面防止光线进入rhizotrons。改性板条箱(50×30×25cm)支撑了挖掘的角度为25°,以促进沿着根钻前片的根生长。
根成像
构建成像钻机(80×70×133cm),以允许同时根和拍摄成像。摄像机从根茎表面固定1米,植物冠层上方65厘米。用1800万像素全架数字单镜头反光相机(佳能; EOS 1200D)拍摄了一台18-55毫米镜头(佳能EFS)。通过具有恒定照明的LED面板提供照明。通过一台笔记本电脑使用带EOS实用软件(佳能,USA Inc.,Lake Studer,NY)来远程控制两台摄像机,以触发同步图像捕获。24位RGB图像的最小可检测尺寸为约0.1mm像素−1.图像的分辨率(每像素230μm)可以区分精细规模的草莓根。植物建立后7至21天的6到21天之间同时进行根和射击图像。
图像分析
图像分析软件是在C ++中开发的,用于QR解码,图像预处理和根架构特征的量化,可以从https://github.com/eastmallingresearch/Image-processing/tree/master/C%2B%2B/root_architecture.
图像预处理
地下图像被转换为灰度。自适应阈值法使用每个图像的平均邻域作为阈值来校正不均匀的光照和根管表面反射。采用任意的轮廓尺寸阈值去除二值图像中的噪声。预处理去除了大部分背景像素;但是由于一些根像素与主根结构断开,因此小于去选阈值,需要人工去噪。将地面图像转换为HSV颜色空间,并对色调通道进行全局阈值处理,从背景中提取冠层。通过量化植物叶片对应的像素数来计算冠层面积。
根结构的量化
根系构型性状以像素值计算,包括总根长、平均直径、根面积、根周长、凸面积、固定性(网络面积除以凸面积)、深度、中位数根数(MedR)、比根长(SRL)和长度分布。总面积是使用二值图像计算的像素根数。总根长按照Kimura等人的方法计算[49],这样在计算时考虑了骨架图像中正交连通对和对角连通对的个数,最大限度地减小了样本方向和根重叠的混杂影响。将该方法推广,通过计算根系上三分之二和下三分之二的根长之比来量化根长分布[50。对二值根管图像进行距离变换,像素的灰度强度表示到最近边界的最小距离。经过距离变换后,通过提取根骨架对应的每个像素的强度得到根半径,并以此计算体积、平均直径和SRL [50。基于Lyer-Pascuzzi的二进制图像计算根周边,稳定性,深度,凸面区域,深度和MEDR [50。根生长速率计算为指数拟合在时间点2到5的衰减速率。用总根长、总根面积、凸面积、周长和体积测量生长速率。
低磷耐耐受性
在' Redgauntlet ' x ' Hapil '作图群体中测定了低磷酸盐耐受性。固定,冷藏(−2°C)草莓植株移植到2 L的方形花盆中,其中含有椰糠(Botanicoir, England)。采用完全随机区组设计,每173个基因型设置4个重复植株。通过滴管自动提供最佳磷肥(N:P:K 176:36:255 ppm)或低磷肥(N:P:K 176:10:255 ppm),每公斤1−1(速度:每45分钟10秒)。初步磷酸剂剂量实验用于确定基于植物生物质生产的降低的缺陷灌溉速率。通过4 L / H滴管,每天六次速度提供施用。在从冷储存后146天后,收获的地上和根植物材料,在80℃下干燥7天的烘箱,量化干生物质。通过在最佳和低磷酸盐条件下生长的每个基因型的植物之间的相对差异来计算低磷酸盐耐受性。将混合模型进行比较,以试验使用Chi-Square似然比测试进行基因型和磷酸盐水平之间的相互作用。
AMF协会
在“Redgauntlet”X''Hapil的映射群体中量化了基因型形成菌根关联的倾向。随机块实验设计每147个基因型含有三种复制植物。Glasshouse条件为16:8 H日:夜晚,20:14°C。将冷储存( - 2°C)植物移植到含有Terra-Green®的2 L罐中。在移植根部以1-2厘米进行修剪前。将下列amf接种物加入到种植孔中,每株植物:15克菌髓种类的颗粒状商品组合(Claroideoglomus Claroideum,Glomus Microagregatum,Rhizophagus Irregularis,Funneliformis Mosseae和F. Geosporus,“rootgrow”传播混合2;PlantWorks Ltd., Kent, UK)。人工灌溉1个月后,用牡荆维塔饲料(N:P:K, 1:0:2, 18:0:36)按1 kg l施肥−1(速度:每45分钟10秒)。从冷藏后的52 d开始,每周两次评估果实大小和市场产量。95天后,对植株进行破坏性采收,定量测定地上干生物量,并采集根系样品进行分析。10% KOH清除根,台盼蓝染色。根长定植(RLC%)使用解剖显微镜定量,其中菌丝、丛枝和囊泡的存在在1厘米网格的100个水平和垂直相交处进行标记[13那51].
联系地图生成
使用植物QIAGEN DNAEASY植物迷你提取试剂盒从叶片材料中提取DNA。使用含有138K探针组的istraw90亚胺芯片进行基因分型进行基因分型。SNP数据可以在supp中找到。文件1.使用CrossLink程序创建“Redgauntlet”X'HAPIL的链接地图[52]专为Octploid Ligkage地图开发而设计。组合来自五个双重父母草莓种群的分离标记,以使共识图详述[52].
定量特质基因座(QTL)分析
使用R版本3.5.1进行遗传分析[53].通过对平均基因型特征值的Kruskal-Wallis分析进行表型性状的QTL映射,以鉴定焦平单核苷酸多态性(SNP)。为每个QTL选择最重要的标记,然后使用逐步回归函数通过逐步线性回归模型进行选择[54].在MAPQTL®中进行间隔映射和MQM映射[55].通过两步过程确定潜在的共同因子:第一个显着的QTL被视为鉴定推定的相互作用基因座的共同因子,然后将往复分析预先成形,将这些新鉴定的基因座作为共同因子,如果它们改进,则保留辅因子初始QTL的LOD评分。两种分析中鉴定的QTL被认为是稳健的,因此在此报告。根据Cockerton等人的规定计算遗传性和比例减少。,2019年[48].主要成分分析用于确定组件占基因型中最大比例的变异比例。通过内部脚本计算遗传相关性,通过在每次互易恢复之间的平均Pearson的相关系数通过内部脚本来计算。通过Pearson的相关性计算实验遗传相关性。使用R包量化表型相关性[56].创建网络图以描绘使用R包“网络”的重叠QTL和共源区的数量[57]和“Visnetwork”[58].BedTools的交叉功能用于识别10 KB内的QTL位置Fragaria Vesca.基因组V.4基因模型[59].函数的注释f . vesca使用Transocan V.4生成的基因模型。
数据和材料的可用性
分析为本研究的一部分的SNP数据集可以在补充文件1中找到。当前研究期间的剩余数据集可从合理的请求上获得相应的作者。
缩写
- AMF:
-
丛枝菌根真菌
- i35k:
-
Istraw35 Affymetrix芯片
- I90K:
-
Istraw90 Affymetrix芯片
- MedR:
-
根的中位数
- PCA:
-
主要成分分析
- p
-
磷使用效率
- QTL:
-
数量性状位点
- QR:
-
快速反应
- RH%:
-
百分比相对湿度
- RLC %:
-
根长度殖民
- RGB:
-
红色绿色蓝色
- RSA:
-
根系统架构
- RxHa:
-
'redgauntlet'x'hapil'映射人口
- SNP:
-
单核苷酸多态性
- SRL:
-
特定的根长度
参考
- 1.
Runge-Metzger A.关闭周期:高效P管理改善全球粮食安全的障碍。磷气球。1995年; 54:27-42。
- 2.
Van de Wiel CCM,Van der Linden CG,Spolten Oe。农业磷利用效率提高:繁殖机会。Euphytica。2016; 207(1):1-22。
- 3.
Vance CP, Uhde-Stone C, Allan DL。磷的获取和利用:植物保护不可再生资源的关键适应。新植醇。2003;157(3):423 - 47岁。
- 4.
Bates Tr,Lynch JP。根毛在低磷的可用性下赋予竞争优势。植物土壤。2001; 236(2):243-50。
- 5.
德鲁MC。鉴定磷酸盐,硝酸铵,铵和钾对新型根系生长的效应的比较,笋芽。新植物。1975; 75(3):479-90。
- 6.
王磊,廖华,闫欣,庄斌,董玉英。大豆根毛性状与磷态相关的遗传变异。土壤植物。2004;261(1/2):77 - 84。
- 7.
林奇JP。第二次绿色革命的根源。植物学报。2007;55(5):493。
- 8.
根际土壤无机磷的生物有效性研究。土壤植物。2001;237(2):173 - 95。
- 9.
史密斯SE,读DJ。菌根共生。books.google.com;2010年。
- 10。
朱永刚,陈波。用无根无毛大麦突变体对菌根真菌和根毛获取磷酸盐进行对比。植物学报。2005;28(7):928-38。
- 11.
王b,邱yl。陆地植物中菌根的系统发育分布及演化。mycorrhiza。2006; 16(5):299-363。
- 12.
Dunne MJ, Fitter AH。田间生长的草莓(草莓属x ananassa简历。哈普尔)作物:腐烂贡献的证据。ANN施用BIOL。1989; 114(1):185-93。
- 13.
罗宾逊博伊尔L,Feng W,Gulbis N,Hajdu K,Harrison RJ,Jeffries P等人。使用丛枝菌根真菌改善益发生料底物的草莓生产。前植物SCI。2016; 7:1237。
- 14.
Güneş A, Ataoğlu N, Turan M, Eşitken A, Ketterings QM。溶磷微生物对草莓产量和养分浓度的影响。[j] .地球科学进展,2009,29(3):341 - 346。
- 15.
张L,徐米,刘y,张F,Hodge A,Feng G.碳和磷交换可以在丛枝菌根真菌和磷酸盐溶解细菌之间进行合作。新植物。2016; 210(3):1022-32。
- 16.
霍维斯CD。甜腹菌疹对草莓土壤磷吸收的影响(Fragaria.Sp,纱线。剑桥大学最喜欢的)。中国林业科学。1996;41(1):57-64。
- 17.
Boyer LR,Brain P,Xu X-M,Jeffries P.接种干旱的草莓与两种丛枝菌根真菌的混合接种:对根系中真菌物种种群动态的影响,以及对水缺乏的后果植物耐受性。mycorrhiza。2015; 25(3):215-27。
- 18.
Williams Sck,Vestberg M,Uosukainen M,Dodd Jc,Jeffries P.肥料和丛枝菌根真菌对微扑达草莓后体外生长的影响。农艺知。1992年; 12(10):851-7。
- 19.
Niemi M,Vestberg M.与VA菌根真菌的人商业种植的草莓接种。植物土壤。1992年; 144(1):133-42。
- 20。
Bona E,Lingua G,Manassero P,Cantamessa S,Marsano F,Todeschini v等。AM Fungi和PGP假单胞菌在低氮和磷水平上增加了草莓中的开花,水果生产和维生素含量。mycorrhiza。2015; 25(3):181-93。
- 21。
Castellanos-Morales V,Villegas J,Wendelin S,Vierheilig H,埃德尔·雷德,纳尔登斯 - Navarro R.枝条菌根真菌的根殖民化血管球intraradices改变了草莓的质量(草莓属x ananassa不同的氮水平。中国农业科学。2010;90(11):1774-82。
- 22。
Lingua G,Bona E,Manassero P,Marsano F,Todeschini V,Cantamessa S等人。丛枝菌根真菌和植物生长促进假单胞菌增加草莓水果中的花青素浓度(草莓属x ananassavar。SELVA)在减少施肥的条件下。int j mol sci。2013; 14(8):16207-25。
- 23。
Norman JR, Atkinson D, Hooker JE。丛枝菌根真菌对草莓根系构型的影响及诱导对根际病原菌的抗性疫霉fragariae.土壤植物。1996;185(2):191 - 8。
- 24.
李国华,李国华,李国华,等。高磷条件下草莓接种丛枝菌根真菌的响应。菌根。2005;15(8):612 - 9。
- 25.
王志强,王志强,王志强,等。盐胁迫下丛枝菌根真菌对草莓幼苗生长的影响。农业科学。2014;23(2):146-58。
- 26.
黄杰 - ,Plett JM。根改造:如何改善对基本根本生物学的理解可以为精英作物的发展提供推动促进可持续土壤健康的精英作物。Funct植物Biol。2019; 46(7):597-612。
- 27.
塑料植物:根对不同营养供应的响应。新植醇。2004;162(1):9-24。
- 28.
Williamson LC,Ribrioux SP,Fitter Ah,Leyser HM。磷酸盐可用性调节根系结构拟南芥.植物理性。2001; 126(2):875-82。
- 29.
何md, Rosas JC, Brown KM, Lynch JP。根建筑对水和磷获取的权衡。植物生态学报。2005;32(8):737。
- 30.
NIU YF,柴RS,JIN GL,王H,唐CX,张YS。根系结构发展对低磷可用性的回应:综述。Ann Bot。2013; 112(2):391-408。
- 31。
Linkohr BI, Williamson LC, Fitter AH, Leyser HMO。硝酸盐和磷酸盐的有效性和分配对根系构型有不同的影响拟南芥.植物j . 2002; 29(6): 751 - 60。
- 32。
根系统结构决定了适合度拟南芥在竞争固定的磷酸盐离子而不是硝酸盐离子的突变体。中国生物医学工程学报。2002;269(1504):2017-22。
- 33。
Šmilauerovám,ŠmilauerP.年轻人对成年人说什么:幼苗根反映成年植物的克隆特征。J. ECOL。2007; 95(3):406-13。
- 34。
伯恩顿通用汽车。建模根系结构:资源收购效率与潜力之间是否存在权衡?新植物。1994年; 127(3):483-93。
- 35。
Zurek PR, Topp CN, Benfey PN。数量性状位点定位揭示了控制玉米根系结构的基因组区域。植物杂志。2015;167(4):1487 - 96。
- 36.
不同植物种类和品种对丛枝菌根的依赖性。土壤与植物营养学报。2003;49(5):655-68。
- 37.
Hetrick坏。菌根和根结构。Experientia。1991;(4):355 - 62。
- 38.
Maherali H.根系结构与菌根生长反应之间是否存在关联?新植物。2014; 204(1):192-200。
- 39.
利用3D表型和数量性状位点定位技术,鉴定了水稻基因组中控制根构型的核心区域。美国国家科学院学报。2013; 110 (18): e1695 - 704。
- 40。
Ogutu Ra,Williams Ka,Pierzynski Gm。磷酸盐吸附用于煅烧材料,用作实验室研究中的无土媒体组分。Hortscience。2009; 44(2):431-7。
- 41。
链接本文:López-Bucio J, Cruz-Ramírez A, herrae - estrella L.养分利用率对根系构型的调节作用。植物学报。2003;6(3):280-7。
- 42。
Thibaud M-C,Arrighi J-F,Bayle V,Chiarenza S,Creff A,Bustos R等人。对磷酸盐饥饿的局部和全身转录反应的解剖拟南芥.工厂J.2010; 64(5):775-89。
- 43。
nei S, Ivanchenko MG, Muday GK。乙烯调控植物侧根的形成和生长素的转运拟南芥蒂利亚纳.工厂J. 2008; 55(2):175-87。
- 44。
生长素和乙烯促进根毛伸长拟南芥.工厂J. 1998; 16(5):553-60。
- 45。
López-Arredondo DL, Leyva-González MA, González-Morales SI, López-Bucio J,植物学报。2014;65:95-123。
- 46。
拟南芥adp -核糖基化因子1在表皮细胞极性中的作用。植物细胞,2005,17(2):525 - 36。
- 47。
Péret B, Desnos T, Jost R, Kanno S, Berkowitz O, Nussaume L.根建筑的响应:寻找磷酸盐。植物杂志。2014;166(4):1713 - 23所示。
- 48.
Cockerton HM,Li B,Vickerstay RJ,Eyre Ca,Sargent DJ,Armitage Ad等。识别黄萎病dahliae通过疾病筛选多种群体的抗性和基于图像的表型化的抗性。前植物SCI。2019; 10:924。
- 49.
Kimura K,Kikuchi S,Yamasaki S.通过图像分析进行准确的根长测量。植物土壤。1999年; 216(1):117-27。
- 50。
刘志强,刘志强,刘志强,等。植物根系自动表型和性状排序的成像和分析平台。植物杂志。2010;152(3):1148 - 57。
- 51。
McGONIGLE TP, Miller MH, Evans DG, Fairchild GL, Swan JA。提出了一种客观测定泡丛菌根真菌定殖的新方法。新植醇。1990;115(3):495 - 501。
- 52。
Vickerstaf Rj,哈里森RJ。CrossLink:一种用于突出物种的快速脚本的遗传映射器。生物XIV。2017; 8:135277。
- 53。
团队RC。R:统计计算的语言和环境;2015.维也纳:统计计算基础;2018.
- 54。
陈志强,陈志强,陈志强,等。草莓抗白粉病QTL鉴定(草莓属×ananassa.).Al Appl Genet。2018; 131(9):1995-2007。
- 55。
Van Ooijen JW, Kyazma BV。MapQTL 6。用于绘制二倍体物种实验居群数量性状位点的软件。瓦赫宁根:Kyazma BV;2009.
- 56。
Peterson BG,Carl P. Performanceanalytics:用于性能和风险分析的计量计量工具。性能anyaltics:用于性能和风险分析的计量计量工具;2018.
- 57。
Butts C.网络:关系数据的课程。Statnet项目;2015.
- 58。
Almende BV,Thieurmel B,Titouan R.Visnetwork:使用“VIS.JS”库的网络可视化。r;2019年。
- 59。
edger pp,vanburen r,colle m,poorten tj,wai cm,niederhuth ce,等。单分子测序和光学映射产生了林地草莓的改进基因组(Fragaria Vesca.),且与染色体尺度相邻。Gigascience。2018;7(2):1 - 7。
确认
作者感谢Louisa Boyer博士和Plantworks有限公司提供的关于菌根的建议。作者感谢Robert Vickerstaff作为其他项目的一部分生成了八倍体共识图谱,以及Beatrice Denoyes博士(INRA)和Amparo Monfort博士(CRAG)授权使用他们的信息标记来生成草莓共识图谱。
资金
该研究由生物技术和生物科学研究理事会(BBSRC) BB/M01200X/2和Innovate英国项目101914资助,以共同资助“开发资源利用效率草莓用于基质生产项目”。这里详细介绍的所有实验都是作为这个项目的一部分进行的。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中都没有发挥作用。
作者信息
隶属关系
贡献
RJH ES AJ HMC构思和设计实验。BL -分析成像数据。HMC -进行数量遗传学分析。AMC AJ AK LGA NBP MCM进行实验NH, NBP研制成像设备。AA -基因注释。由HMC, ES, BL和RJH撰写,所有作者投稿。所有作者均已阅读并批准本稿件
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
Louisa Boyer博士在这份手稿中为菌痢的应用提供了指导。路易莎受雇于工厂有限公司。所有作者声明,该研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:补充表1。
两种父母品种和F1基因型的根系建筑特征的特征手段。CV是变异系数。与ANOVA测试相关的意义值。除非另有说明,否则单位是像素号。SRL - 特定的根长度,MEDR-中等根号。p值用星星表示:*** <0.001,** <0.01,* <0.05。在像素数或相对统计中提供值。在没有父母的情况下计算F1基因型之间的差异。
附加文件2:补充表2。
H2是与每种表型事件相关的广泛感受到。SRL - 特定的根长度,MEDR-中等根号。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Cockerton,H.,Li,B.,Stavridou,E。et al。根系结构中的遗传和表型关联,丛枝菌根真菌殖民和草莓中磷耐耐受性低(Fragaria.×ananassa.).BMC植物杂志20,154(2020)。https://doi.org/10.1186/s12870-020-02347-020-02347-020-02347-0
已收到:
公认:
发表:
迪伊:https://doi.org/10.1186/s12870-020-02347-020-02347-020-02347-0
关键字
- QTL
- macronuriver
- symbiont
- 网络
- 权衡
- 可靠性
- Rhizotron
- 长度分布
- amf.
- 图像分析